生物蛋白质分子设计共46页
理学蛋白质分子设计

• 先讲理论 • 后面举几个例子
蛋白质分子设计策略
• 理性设计策略
– 前提:充分了解结构与功能的关系
• 随机突变+功能筛选
– 前提:不了解结构与功能的关系
• 理性设计+随机突变+功能筛选
– 前提:不完全了解结构与功能的关系
分子设计的种类
小改:少数残基的替换,突变或修饰 中改:分子拼接,肽段或结构域的替换 大改:从头设计,全新蛋白质的设计
具体方法:
利用R55受体的结构 模建R75受体的结构
根据淋巴毒素与R55 的作用情况,模拟肿 瘤坏死因子与R55受 体的相互作用情况。
根据肿瘤坏死因子与 R55受体的相互作用 情况,模拟肿瘤坏死 因子与R75受体的相 互作用情况。
Gln67与R55作用不明显,但与R75的Asp有静电作用, 将它突变为结构相似但带电相反的Glu会降低TNF与 R75的作用,但不会改变与R55的作用。
0 0.02 0.2 2 20 200
Protein (ng)
mTSA BSA SEA
融合蛋白与A431细胞结合的剂量曲线
mTSA与A431细胞结合的特异性试验 A.Positive control EGF; B. pmTSA ; C. mTSA binding blocked by EGF; D. Blank control :PBS
基于结构的药物设计
确定靶蛋白的结合口袋,以结合口袋的结构环境设 计药物; 未知受体结构时,根据具有相同或相似生物学活性 的已知化合物的结构叠合,反推受体结合口袋的可能 结构环境,根据推测的受体结合口袋进行新型药物设 计。
蛋白质分子的模拟肽设计
骨架残基设计,肽库筛选 以结构为模板的分子设计。
【精编】蛋白质的分子结构模板PPT课件

二. 蛋白质的二级结构
O
C—N 0.132 nm
C
C
C
N
0.132nm
N
C
H
❖ 虽是单键却有部分双键性质 ❖ 周边六个原子在同一平面上
肽键平面
★多肽链可以看成由Cα串联起来的无数个 平面组成
(三)二级结构单元的种类
1. -螺旋(-helix)
二. 蛋白质的二级结构
鲍林(Linus pauling)
• 肽链内形成氢键,氢键的取 向几乎与轴平行,第一个酰 胺基团的-CO基与第四个酰 胺基团的-NH基形成氢键。
• 右手-螺旋。
蛋白质分子中氢键的形成
(三)二级结构单元的种类
二. 蛋白质的二级结构
2、-折叠(-pleated sheet)
一种比较伸展、锯齿状的肽链结构。
维持β-折叠结构稳定性的力 —— 氢键由 一条链上的羰基和另一条链上的氨基之间 形成,即氢键是在链与链之间形成的。
一级结构是由遗传信息决定的。 一级结构是蛋白质空间结构和特异生物学功能的基础。
H
O
H
O
H—N—CH2—C—OH + H—N—CH2—C—OH
H
OH
O
H—N—CH2—C——N—CH2—C—OH
肽键
性质:分子间脱水反应
蛋白质分子中的共价键与次级键
化学键
共价键
肽键 二硫键
一级结构
氢键
二、三、四级结构
疏水键 非共价键键 盐键
∑BOM物料× 单价 + 作业数量×作业价格 = 制造成本
67
SAP成本计算说明_BOM的材料成本核算
Bill of Materials :产品A
蛋白质生物信息学(共45张PPT)

利用生物信息学软件DNAman将VH-L-L的核苷酸序列翻译
为氨基酸序列
利用NCBI提供的ORF Finder预测VH-L-L的 ORF,从预测结果看出VH-L-L是一段连续 的较长的ORF,它可能是一个完整的编码 序列
利用ProtParam对VH-L-L的氨基酸序列及基本 理化性质进行了分析。
析,更加深入地理解DNA序列,结构,演化及其 与生物功能之间的关系。
研究课题涉及到分子生物学,分子演化及结构生 物学,统计学及计算机科学等许多领域。
研究过程
以数据(库)为核心 1 数据库的建立 2 生物学数据的检索 3 生物学数据的处理 4 生物学数据的利用:计算生物学
研究展望
由于生物信息学是基于分子生物学与多种学科交叉而成的 新学科,现有的形势仍表现为各种学科的简单堆砌,相互之 间的联系并不是特别的紧密。在处理大规模数据方面,没 有行之有效的一般性方法;而对于大规模数据内在的生成 机制也没有完全明了,这使得生物信息学的研究短期内很 难有突破性的结果。
第一节生物信息学与蛋白质工程 一、生物信息学概述
生物信息学是利用应用数学、信息学、统计 学和计算机科学的方法研究生物学的问题。
1987年,林华安首创Bioinformation 一词,被誉为”世界生物信息之父”。
概述
生物信息学分子生物学与信息技术(尤其是互联网 技术)的结合体。
研究材料和结果就是各种各样的生物学数据 研究工具是计算机
由于DNA自动测序技术的快速发展,
DNA数据库中的核酸序列公共数据量 以每天106bp速度增长,生物信息迅速 地膨胀成数据的海洋。毫无疑问,我们 正从一个积累数据向解释数据的时代转 变,数据量的巨大积累往往蕴含着潜 在突破性发现的可能。 “生物信息学” 正是从这一前提产生的交叉学科。
第二章蛋白质工程蛋白质设计ppt课件

篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
三、蛋白质分子设计原则
❖1.活性设计: 是蛋白质分子设计的第一步,主要是考虑被研
究的蛋白质功能,涉及选择化学基团和化学 基团的空间取向。在这类设计中应采用天然 存在的氨基酸来提供所需的基团,尽管原则 上并不限制引入其他外来基团。同时还应该 考虑辅因子的使用。
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
第二章 蛋白质分子设计
❖第一节:蛋白质分子设计原理
❖第二节:基于蛋白质天然结构的分子 设计
❖第三节:全新蛋白质分子设计
LOGO
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
LOGO
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
三、蛋白质分子设计原则
❖4.疏水基团与亲水基团需合理分布 这种分布并不仅仅是简单地使暴露在外面的残 基具有亲水性,埋藏在内部的残基具有疏水 性而是还应安排少量的疏水残基在表面,少 量亲水残基在内部。在蛋白质分子设计过程 中要在原子水平上区分侧链的疏水部分与亲 水部分。
LOGO
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
三、蛋白质分子设计原则
❖ 3.框架设计: 是指对蛋白质分子的立体设计。天然蛋白质是框架 化的。也就是说,催化部位和底物结合部位要适当 地安装在大分子载体之中,给予各个基团以适当的 空间排布,才能具有催化活性功能。因此要设计的 蛋白质活性分子,也必须框架化。 但是对复杂的多肽链而言,需要预测三级结构,需 要大量的计算筛选所需的一级结构,其结果很难预 测。
蛋白质分子的结构解析PPT课件

蛋白质的四级结构涉及亚基的组成、 形状、大小以及亚基之间的相互关系 。四级结构的变化会影响蛋白质的整 体功能。
结构域
总结词
蛋白质的结构域是指在较大的蛋白质分子中,可以独立折叠为较为稳定的三级 结构的区域。
详细描述
结构域通常由200-400个氨基酸残基组成,具有特定的空间构象和功能。不同 的结构域可以组成不同的蛋白质,也可以存在于同一蛋白质的不同部位。
疾病诊断与治疗
疾病标志物发现
通过蛋白质结构解析,可以发现 与疾病相关的标志物,用于疾病
的早期诊断。
个性化治疗
基于蛋白质结构的差异,可以为患 者提供更加个性化的治疗方案,提 高治疗效果。
药物疗效评估
通过比较治疗前后蛋白质结构的变 化,可以评估药物治疗的效果。
生物工程与农业应用
酶工程
蛋白质结构解析有助于设计和优 化酶的活性位点,提高酶的催化
核磁共振技术
总结词
核磁共振技术是一种利用核自旋磁矩进行研究的方法,可以对蛋白质的溶液构象进行解 析。
详细描述
核磁共振技术利用核自旋磁矩的相互作用,通过外部磁场对核自旋进行操控,检测其共 振信号。对于蛋白质分子,可以利用该技术检测其氢原子、碳原子等核自旋的共振信号, 从而推断出蛋白质在溶液中的构象和动态行为。该方法具有高分辨率和高灵敏度,能够
05 蛋白质的结构解析方法
X射线晶体学
总结词
X射线晶体学是一种通过X射线分析晶体 结构的方法,广泛应用于蛋白质结构解 析。
VS
详细描述
X射线晶体学利用X射线在晶体中的衍射 效应,通过分析衍射图像,可以确定晶体 的原子排列和分子结构。对于蛋白质分子 ,可以通过结晶将其固定成晶体,然后利 用X射线分析其结构。该方法能够提供高 分辨率的结构信息,是解析大型蛋白质结 构和复杂蛋白质复合物结构的主要手段之 一。
蛋白质结构和功能

环肽:
(4) 多肽(>10肽)、寡肽(<10肽)、
29 29
现在是29页\一共有108页\编辑于星期五
R1 NH2 CH
COOH
R2 H2N CH COOH
氨基端
R1
NH2 CH
N-(H)
肽
O
CN
肽
键H
现在是30页\一共有108页\编辑于星期五
* 两性电离性质和氨基酸分离(离子交换): pH < pI 氨基酸 (+) pH > pI 氨基酸 (-)
19 19
现在是19页\一共有108页\编辑于星期五
2. 紫外吸收 芳香族aa(Tyr、Phe、Trp) -- 共轭双键 吸收峰:波长260-280nm 应用:蛋白质定性、定量
2200
现在是20页\一共有108页\编辑于星期五
C
4455
现在是45页\一共有108页\编辑于星期五
N
氢键
氢键
C
46 46
现在是46页\一共有108页\编辑于星期五
d. 氢键 -- 与螺旋纵轴平行(3个/相邻螺旋)
(α螺旋的主要稳定因素)
e. 侧链基团(R)位置 -- 螺旋外 (不参与螺旋组成,但影响螺旋形成与稳定)
(ppt12)
f. α螺旋 -- 稳定的蛋白质空间构象 (也是最稳定的二级结构)
g. 在不同蛋白质中所占比例不同(角蛋白,小分子)
47 47
现在是47页\一共有108页\编辑于星期五
4.β-折叠或β-片层(pleated sheet structure)
比较伸展的肽链空间结构
基本特征:
蛋白质分子设计精选全文

可编辑修改精选全文完整版蛋白质分子设计[引言]蛋白质是一类非常有用的物质,在生物体的进化过程中起着非常重要的作用。
与其它化学试剂比拟:〔1〕分子量非常大;〔2〕在机体内稳定;〔3〕专一性的优劣。
分子生物学的开展弥补了上述缺点,如定位突变、PCR使蛋白质可能工程化生产。
蛋白质设计〔蛋白质的构造、功能预测〕涉及多学科的穿插领域,包括材料学、化学、生物学、物理及计算机学科。
其应用范围涵盖了药物、食品工业中的酶、污水处理、疫苗、化学传感器等,设计的蛋白质也不仅仅限于20种天然氨基酸,也包括非天然氨基酸、有机/无机模块。
蛋白质设计的目的:〔1〕为蛋白质工程提供指导性信息;〔2〕探索蛋白质的折叠机理。
蛋白质设计分类:〔1〕基于天然蛋白质构造的分子设计;〔2〕蛋白质从头设计。
存在问题:与天然蛋白质比拟:〔1〕缺乏构造独特性;〔2〕缺乏明显的功能优越性。
第一节基于天然蛋白质构造的分子设计一、概述蛋白质构造与功能的认识对蛋白质设计至关重要,需要多学科的配合。
蛋白质设计循环如下:1.对要求的活性进展筛选。
2.对蛋白质进展表征,如测定序列、三维构造、稳定性及催化活性。
3.专一型突变产物。
4.计算机模拟。
5.蛋白质的三维构造。
在PDB中搜索,无纪录即进展X射线、NMR方法或预测并构建三维构造模型。
6.蛋白质构造与功能的关系。
蛋白质突变体设计的三个主要步骤:1.突变位点和替换氨基酸确实定。
(1)确定对蛋白质折叠敏感的区域。
(2)功能上的重要位置。
(3)其它位置对蛋白质突变体的影响。
(4)替换或加减残基对构造特征的影响。
2.能量优化和蛋白质动力学方法预测修饰后蛋白质的构造。
3.预测构造与原始蛋白质构造比拟,预测新蛋白质性质。
上述设计工作完成后,再进展蛋白质合成或突变实验,别离、纯化并对新蛋白质定性。
二、蛋白质设计原理1.内核假设。
假设蛋白质独特的折叠形式主要由蛋白质内核中的残基相互作用决定。
所谓内核指蛋白质在进化过程中的保守区域,由氢键连接的二级构造单元组成。
细胞生物学蛋白分选
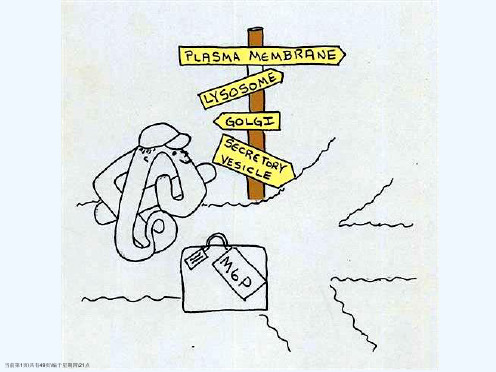
当前第8页\共有49页\编于星期四\21点
Signal peptide required for import into ER
当前第9页\共有49页\编于星期四\21点
Günter Blobel,
born in 1936,
works at the Laboratory of Cell Biology,
The Rockefeller University, New York
当前第7页\共有49页\编于星期四\21点
Signal hypothesis
How do newly synthesized proteins find their correct destinations within a cell?
➢ 输入线粒体 +H3N-Met-Leu-Ser-Leu-Arg-Gln-Ser-Ile-Arg-Phe-Phe-Lys-Pro-Ala-
Thr-Arg-Thr-Leu-Cys-Ser-Ser-Arg-Tyr-Leu-Leu-
➢ 输入质体 +H3N-Met-Val-Ala-Met-Ala-Met-Ala-Ser-Leu-Gln-Ser-Ser-Met-Ser-
细胞质基质中的蛋白质转运
三、膜泡运输 vesicular transport
43
5
6
当前第37页\共有49页\编于星期四\21点
7 2
1
vesicular transport
当前第38页\共有49页\编于星期四\21点
三、vesicular transport
第十三讲蛋白质分子设计讲课文档

第三页,共31页。
(1)鼠单克隆抗体恒定区的人源化 – 将小鼠McAb恒定区用人抗体恒定区代替而拼接成嵌合抗体,既具有抗原结
合特异性,又极大地降低了鼠单克隆抗体的异源性。 改造策略和程序:
① 克隆鼠McAb可变区基因——从鼠杂交因;
➢ 缺点是成本高,操作相对烦琐。
第十页,共31页。
二、蛋白质关键残基嫁接
• 蛋白质之间相互作用,往往只有几个非常关键的aa残基对结合起到主要作用,并不 是全部蛋白分子参与。思考——如何证明这一命题?
• 基于这种情况,我国科学家来鲁华教授课题组发展了一种“蛋白质关键残基嫁接”的方法。
• 成功地将EPO的关键残基“嫁接”到一个结构完全不同的PH蛋白结构域上, ERPH1蛋白具有了和EPOR结合的功能。
第六页,共31页。
移植设计的原则
① 将CDR序列和紧邻两侧的骨架序列一起移植; ② 对骨架区中影响抗原结合部位的aa残基改为鼠源McAb的残基;
③ 人McAb可变区序列的选择:抗体可变区序列数据库分析,选择与鼠单克隆抗 体同源性高的人源序列;
④ 保留可变区N末端aa序列,尤其是轻链可变区N末端序列。 ⑤ 将人改型可变区基因与人lg恒定区基因连接,构成完整的人改型基因进行表达。
• 抗体剪裁的医学价值
与人McAb相比,小鼠McAb容易制备,
抗原性强,但易导致人体过敏反应。
将鼠McAb抗原结合部位转移到人抗体上, 达到与人McAb同样的效果。
第二页,共31页。
抗体剪裁
1、 抗体的人源化
• 新的挑战:
改造鼠源McAb基因,综合人—鼠嵌合McAb的优点;
获得特异性高、异源性小的,具有临床应用价值的抗体。
研究方向与兴趣
• 1987年开始从事化学与生物学的交叉研究,
1、(三) 蛋白质分子设计概述

定位突变或化学修饰来实现。
※ 中改(或分子拼头设计):从头设计全新的蛋白质。
2、根据设计层次的不同可分为两类:
※ 蛋白质结构的分子设计。 目标是设计出具有特定结构的蛋白质。 ※ 蛋白质功能的分子设计。 目标是获得具备特定功能的蛋白质。
结构设计是功能设计的基础和前提,功能设计是结 构设计的升华。结构设计主要是基于对蛋白质折叠和稳 定机理认识进行,功能设计还要考虑结构-功能的联系, 所以功能设计会更难、更具挑战性。
意义: ※ 获得具有特定功能、能满足人类需要的蛋白质。 ※ 用于研究蛋白质结构-功能的关系。 作用: ※ 检验蛋白质折叠机理及蛋白质结构-功能关系的
知识和信息的正确性。
※ 获得和积累关于蛋白质折叠和结构-功能关系的
信息。
三、蛋白质分子设计的分类
1、按照改造部位的多寡可分为三类: ※ 小改(或点突变):少数残基的替换。可通过
一、蛋白质分子设计的概念
蛋白质分子设计:为了获得具有特定功能 的蛋白质,在分子水平上对蛋白质的结构进行 改造,甚至构建具有特定结构的蛋白质。 蛋白质的分子设计包括:对已有蛋白质的 分子改造,亦称蛋白质的理性设计(或改造); 设计尚未在自然界中发现的、具有全新结构和
功能的蛋白质,亦称蛋白质的从头设计。
• 蛋白质分子设计是一门实验性科学, 是理论设计过程与实验过程相互结 合的产物,在设计过程中,计算机 模拟技术和基因工程操作技术是两 个必不可少的工具。
设计目标
• 就目前的水平而言,所选择的目标 均是一些残基不多(60-80个AA残 基)、结构简单并且具有对称性的多 肽结构。
二、蛋白质分子设计的意义与作用
• 1984年获得全国高中数学联赛一等奖(河南省第一名),保送清华大学 生物科学与技术系; • 1989年,提前一年毕业并获得数学系学位; • 1995年获得美国约翰霍普金斯大学医学院分子生物物理博士学位,随后 在美国纪念斯隆-凯特琳癌症中心进行博士后研究; • 1998年—2008年,历任美国普林斯顿大学分子生物学系助理教授、副教 授、终身教授 ; • 2008年,全职回到清华大学工作,任清华大学生命科学学院院长,教授、 博导。 • 2013年4月25日当选为美国艺术与科学学院院士;4月30日 当选美国国家 科学院外籍院士; • 2013年12月19日当选中国科学院院士; • 2013年9月13日,瑞典皇家科学院宣布授予清华大学施一公教授2014年 度爱明诺夫奖 ; • 主要运用结构生物学和生物化学的手段研究肿瘤发生和细胞凋亡的分子 机制,集中于肿瘤抑制因子和细胞凋亡调节蛋白的结构和功能研究; • 迄今为止,他在国际权威学术杂志发表学术论文百余篇,其中作为通讯 作者在《Cell》发表11篇、《Nature》发表7篇、《Science》发表3篇 。
