克莱森重排反应
克莱森重排反应
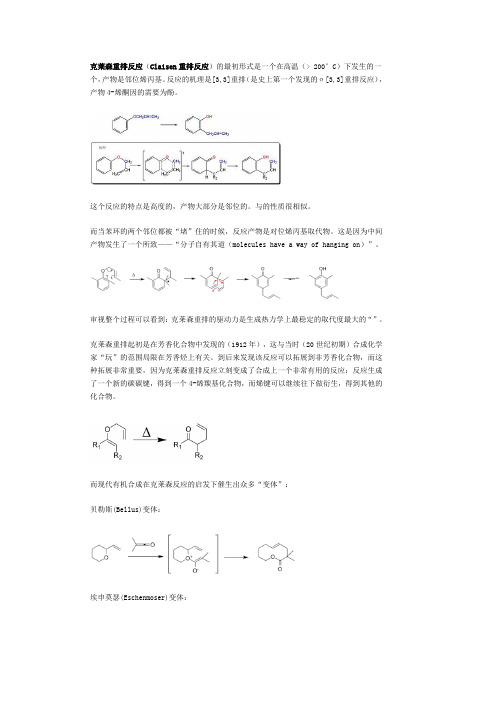
克莱森重排反应(Claisen重排反应)的最初形式是一个在高温(> 200°C)下发生的一个,产物是邻位烯丙基。
反应的机理是[3,3]重排(是史上第一个发现的σ[3,3]重排反应),产物4-烯酮因的需要为酚。
这个反应的特点是高度的,产物大部分是邻位的。
与的性质很相似。
而当苯环的两个邻位都被“堵”住的时候,反应产物是对位烯丙基取代物。
这是因为中间产物发生了一个所致——“分子自有其道(molecules have a way of hanging on)”。
审视整个过程可以看到:克莱森重排的驱动力是生成热力学上最稳定的取代度最大的“”。
克莱森重排起初是在芳香化合物中发现的(1912年),这与当时(20世纪初期)合成化学家“玩”的范围局限在芳香烃上有关。
到后来发现该反应可以拓展到非芳香化合物,而这种拓展非常重要,因为克莱森重排反应立刻变成了合成上一个非常有用的反应:反应生成了一个新的碳碳键,得到一个4-烯羰基化合物,而烯键可以继续往下做衍生,得到其他的化合物。
而现代有机合成在克莱森反应的启发下催生出众多“变体”:贝勒斯(Bellus)变体:埃申莫瑟(Eschenmoser)变体::强生(Johnson)变体:[]天然界的存在在植物代谢的中从到的转换步骤就是一个克莱森重排;该反应受的催化。
预苯酸是一个重要的前体化合物,生物体内含苯环的天然化合物有一大半是由预苯酸转换过来的。
嚬哪醇重排(:pinacol rearrangement)是一个在酸催化下脱水并发生取代基生成羰基化合物的反应。
这一类反应由于(2,3-二甲基-2,3-丁二醇)转换为(3,3-二甲基-2-丁酮)的反应最具代表性,因而得名。
反应的关键步骤是一个的1,2-。
[]反应机理1.两个其中之一接受一个之后脱去一分子水,形成;2.发生1,2-重排,一个基团从未脱去羟基的碳上向有正电荷的碳上转移;3.羟基上脱去一个质子,其氧原子与碳成双键,反应结束。
有机化学重排反应 总结
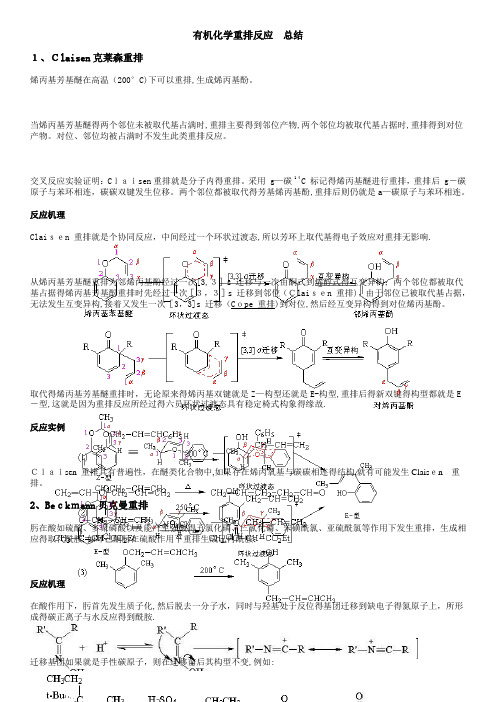
有机化学重排反应总结1、Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚得两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排就是分子内得重排。
采用 g—碳 14C 标记得烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代得芳基烯丙基酚,重排后则仍就是a—碳原子与苯环相连。
反应机理Claisen 重排就是个协同反应,中间经过一个环状过渡态,所以芳环上取代基得电子效应对重排无影响.从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移与一次由酮式到烯醇式得互变异构;两个邻位都被取代基占据得烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代得烯丙基芳基醚重排时,无论原来得烯丙基双键就是Z—构型还就是E-构型,重排后得新双键得构型都就是E -型,这就是因为重排反应所经过得六员环状过渡态具有稳定椅式构象得缘故.反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连得结构,就有可能发生Claisen重排。
2、Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸得五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应得取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位得基团迁移到缺电子得氮原子上,所形成得碳正离子与水反应得到酰胺.迁移基团如果就是手性碳原子,则在迁移前后其构型不变,例如:反应实例3、Bamberger,E、重排苯基羟胺(N-羟基苯胺)与稀硫酸一起加热发生重排成对—氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其她芳基羟胺,它得环上得o—p位上未被取代者会起类似得重排.例如,对-氯苯基羟胺重排成2—氨基—5—氯苯酚:反应机理反应实例4、Cope库伯重排1,5-二烯类化合物受热时发生类似于O—烯丙基重排为C—烯丙基得重排反应(Claisen重排)反应称为Cope重排。
有机化学重排反应 的总结
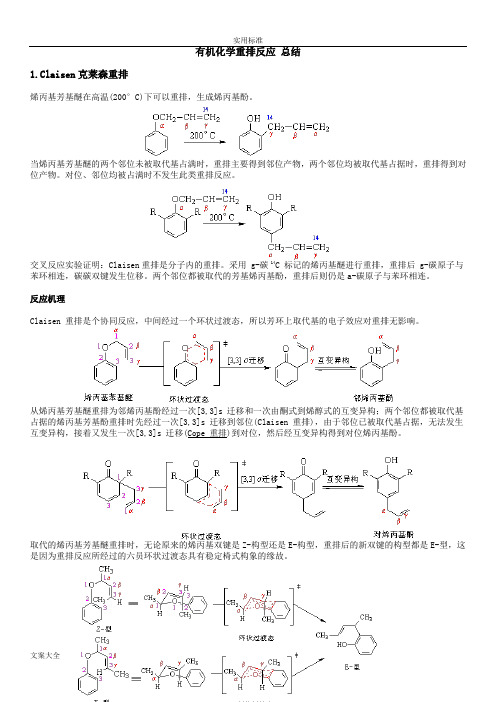
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
有机化学重排反应-总结
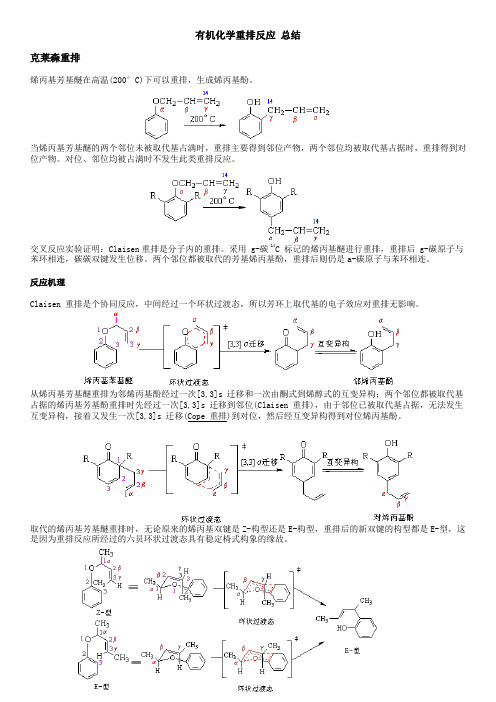
有机化学重排反应总结克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3.Bamberger,E.重排苯基羟胺〔N-羟基苯胺〕和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基〔或甲氧基〕苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
有机重排反应
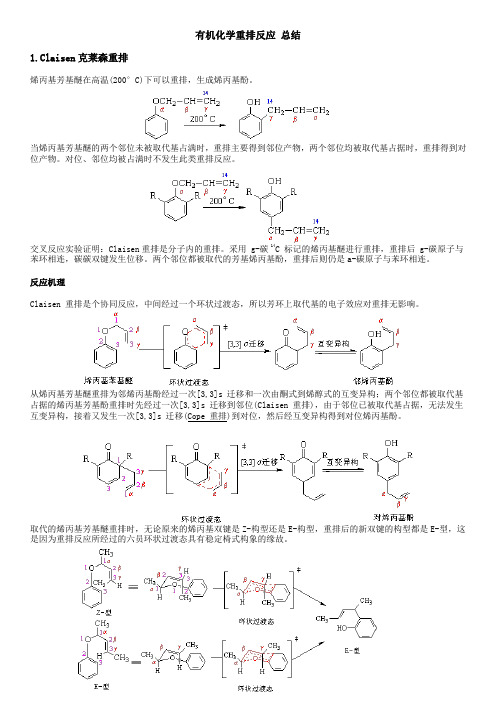
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
claisen重排应用实例

claisen重排应用实例
克莱森重排(Claisen rearrangement)是一种重要的有机化学反应,它可以将一个醇或酚转化为相应的酯。
这个反应在有机合成
中具有广泛的应用,下面给出一个典型的克莱森重排应用实例:
实例:合成乙酰乙酸异丙酯
步骤1:合成乙酰乙酸乙酯
首先,将乙醇和乙酸酐(酸酐是酸的酯化合物)加入反应瓶中,并加入一定量的碱催化剂,如氢氧化钠(NaOH)。
反应瓶通常使用
玻璃瓶,配有反应器和冷凝器。
乙醇 + 乙酸酐→ 乙酸乙酯 + 乙酸
此反应是一个酯化反应,通过酸催化生成酯。
反应进行时,反
应瓶中的温度应保持在适宜的范围内,通常在60-80摄氏度之间。
步骤2:克莱森重排反应
将合成的乙酸乙酯加入反应瓶中,并加入一定量的碱催化剂,
如氢氧化钠(NaOH)。
反应瓶中的温度应保持在适宜的范围内,通
常在100-150摄氏度之间。
乙酸乙酯→ 乙酸异丙酯
此反应是克莱森重排反应,通过碱催化使酯分子内部的酯基迁移,生成相应的酯。
步骤3:提取产物
反应结束后,将反应瓶中的产物进行提取。
通常使用有机溶剂,如乙醚或氯仿,将产物从反应混合物中分离出来。
步骤4:纯化产物
提取得到的产物可能还含有杂质,需要进行纯化。
可以使用色
谱层析等技术将产物纯化。
通过以上步骤,可以成功合成乙酰乙酸异丙酯。
这个反应实例
展示了克莱森重排的应用,通过酯化和重排反应,可以将乙醇和乙
酸酐转化为乙酰乙酸异丙酯。
克莱森重排反应机理

克莱森重排反应是有机化学中一种重要的反应类型,常用于合成芳香化合物。
本文将从反应机理的角度对克莱森重排反应进行详细介绍。
克莱森重排反应是指通过醛或酮与二酮或二醇在碱性条件下反应,生成α,β-不饱和酮的反应。
该反应通常在碱性条件下进行,碱的作用是使醛或酮发生亲核加成,生成一个稳定的醇醚中间体。
这个中间体经过质子转移和脱水反应,形成α,β-不饱和酮产物。
克莱森重排反应的机理可以分为三步。
首先,醛或酮与碱反应生成醇醚中间体。
这个中间体是通过醛或酮的羰基碳上的亲核加成形成的。
其次,醇醚中间体发生质子转移反应,质子从羰基碳上转移到相邻的碳上,形成一个稳定的碳阳离子中间体。
最后,碳阳离子中间体通过脱水反应,失去一个水分子,生成α,β-不饱和酮产物。
克莱森重排反应的机理中,质子转移是一个关键步骤。
质子转移的位置取决于碱的性质以及反应条件。
通常情况下,质子转移到离羰基碳最近的一个碳上,形成稳定的碳阳离子。
然而,在特殊情况下,质子转移也可能发生到离羰基碳更远的位置上。
克莱森重排反应的应用非常广泛。
它可以用于合成芳香化合物,尤其是那些具有α,β-不饱和酮结构的化合物。
这类化合物在药物合成和天然产物合成中具有重要的地位。
此外,克莱森重排反应还可以用于合成含有杂环结构的化合物,如吡咯、噻吩等。
总之,克莱森重排反应是一种重要的有机化学反应,通过醛或酮与二酮或二醇在碱性条件下反应,生成α,β-不饱和酮。
该反应的机理包括醛或酮的亲核加成、质子转移和脱水反应等步骤。
克莱森重排反应在有机合成中有广泛的应用,特别是在合成芳香化合物和含有杂环结构的化合物方面。
克莱森重排机理

克莱森重排机理克莱森重排是指在存在乙酰丙酮(或酮类)和硫脲(或脲类)等分子间的反应中,分子间发生重排反应,生成异构体的化学过程。
该反应在有机化学合成中有广泛的应用,具有一定的机理特点。
一、反应机理克莱森重排的反应机理包括以下几个步骤:1.硫脲与酮类分子发生亲核加成,形成价态复杂的中间体;2.中间体负离子发生轴向异构,形成中间体B。
此时,碳负离子在α位置得到了稳定化;3.负离子中间体B发生质子转移,并发生环型闭合,生成异构体。
此时,杂原子硫原子转化为环内原子性质,生成六元环的化合物;4.反应的最终产物是异构体的混合物,难以区分哪个成分是主要的产物。
二、反应条件克莱森重排作为一种常用的有机化学反应,其反应条件具有一定的特点,通常需要满足以下条件:1.反应物要求有一定的亲电性和亲核性,包括酮类和硫脲(或脲类)化合物;2.反应需要在适量的碱性条件下进行,以促进负离子中间体的形成;3.反应需要在适宜的温度下进行,不宜过高或过低,一般在室温至70℃之间;4.溶剂选择要合适,一般选择乙醇、二甲基甲酰胺等极性溶剂;5.该反应具有缩合反应的性质,易于生成大分子化合物。
三、应用克莱森重排在有机化学领域中具有广泛的应用,常用于:1.生产有机化合物的制备,例如生产杀菌剂、农药、抗生素等产品;2.新药研发领域中的化学反应研究;3.有机合成化学研究领域中,用于生成环状或多环状的复杂化合物,为后续有机合成研究提供组成部分;4.生物化学领域,用于设计合成有机化合物,以研究其生物活性等性质。
总之,克莱森重排反应是一种常用的有机反应过程,具有一定的机理特征和应用价值。
在化学研究领域,在其反应条件和应用范围等方面进行深入了解和研究,对于有机化学领域的发展和推动具有重要意义。
有机化学重排反应 总结

--有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用g-碳14C 标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
Claisen重排

他的成就包括羰基化合物的酰化,烯丙基重排 (Claisen重排)),肉桂酸(PhCH=CHCOOH) 的制备,吡唑(邻二氮杂茂)的合成,异哑唑衍生 物的合成和乙酰乙酸乙酯的制备。
Claisen反应的发展
1912年Claisen在给烯醇类烯丙基醚加热后.得到不饱 和醛或酮,以后又发现芳香族的烯丙基醚也能发生同 类型的重排反应
最初的定义:烯醇类或酚类的烯丙基醚,在加热下 发生分子内重排而生成γ, δ-不饱和醛(酮)或者邻 (对)位烯丙基酚的反应统称为Claisen重排。
Claisen反应的发展
脂肪族Claisen反应机理
Mechanism of the Claisen Rearrangement
The aliphatic Claisen Rearrangement is a [3,3]-sigmatropic rearrangement in which an allyl vinyl ether is converted thermally to an unsaturated carbonyl compound
芳香族Claisen重排
当苯环的两个邻位都被“堵”住的时候,反应产 物是对位烯丙基取代物。这是因为中间产物发生 了一个科普重排反应所致
审视整个过程可以看到:克莱森重排的驱动力是生 成热力学上最稳定的取代度最大的“烯烃”。
芳香族过渡到脂肪族
该反应可以拓展到非芳香化合物: 反应生成了一个新的碳碳键,得到一个4-烯羰基化合物, 而烯键可以继续往下做衍生,得到其他的化合物。
微反应器中的克莱森重排反应

微反应器中的克莱森重排反应单丽娟,山东豪迈化工技术有限公司摘 要:微反应器内,流体在通道内以微米级的单元相互接触,这种特殊的结构,有着传统反应器无法比拟的优越性。
引言以微结构反应器为基础的微化工技术,是一门名副其实的多学科交叉技术。
已涉及到研究的各种领域,包括数学、化学、物理、材料、生物、药物、化工及机械加工等。
该技术的核心是将现有的技术手段,利用微系统技术进行优化。
由于其具备较大的比表面积、微小的反应体积和其特有的层流传质,使其在传热、传质和混合性能方面具有常规反应器无法比拟的优势。
随着微反应器的推广,化工工程师们争相报道了各种有机反应在微反应器中应用的文章,例如硝化反应[1]、氟化反应、格氏反应、迈克尔加成反应、磺化反应[2]等。
微反应器中进行克莱森重排反应[3]的文献报道不是很多。
1微反应器中的克莱森重排反应克莱森重排反应最经典的反应是烯丙基苯基醚高温下的重排反应,得到邻烯丙基苯酚。
它是一种有机化合物,是一种新型农用杀菌剂,对苹果腐烂、苹果干腐病、苹果轮纹病、玉米小叶斑病等具有明显的防治作用。
克莱森重排是严格的分子内反应,是构建C-C键的有力工具。
传统反应器中,对位取代的克莱森重排反应一般需要较高的反应温度(﹥200℃)和较长的反应时间。
高温下的长时间反应容易生成多种副产物,使产率降低,增加各种后处理费用。
我们尝试在微反应器中进行克莱森重排反应,同时选用最经典的反应类型,产物是邻烯丙基苯酚。
1.1实验仪器与试剂仪器:输液泵(0.01-100ml/min)微反应器(自制)玻璃烧瓶(若干)、油浴锅试剂:对位取代的烯丙基苯基醚(自制)1.2微反应器中的克莱森重排反应液体反应物在无溶剂的条件下通过恒流泵直接打入微反应器的通道内,通过微反应器装置加热片的加热作用,发生重排反应,最后产物冷却流入收集装置。
该反应的停留时间主要通过调节反应液的流速来控制,流速主要通过泵的设定和调节来控制。
收集来的反应液直接进行HPLC检测,确定反应物的转化率,为了确定产物的结构,反应产物则采用柱色谱分离后进行1HNMR、IR表征。
+++有机化学重排反应-总结
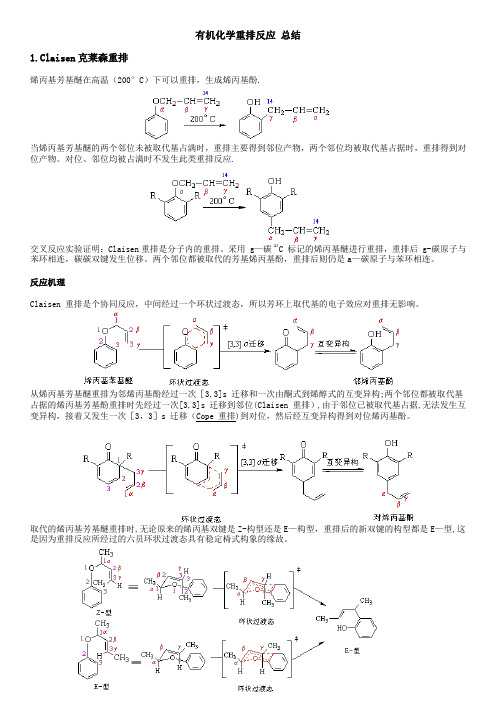
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚.当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应.交叉反应实验证明:Claisen重排是分子内的重排。
采用 g—碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a—碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E—构型,重排后的新双键的构型都是E—型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2。
Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3。
Bamberger,E。
重排苯基羟胺(N—羟基苯胺)和稀硫酸一起加热发生重排成对—氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
有机化学重排反应讲解
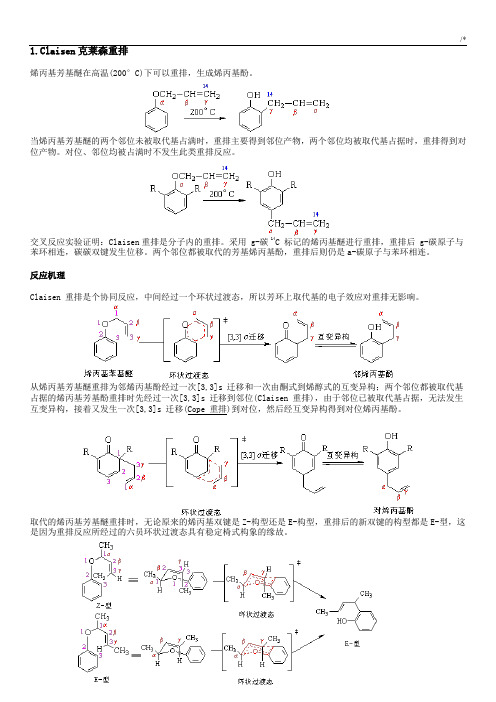
1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
最新有机化学重排反应总结

有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
克莱森重排

4.5水相中的克莱森重排反应 水相中的克莱森重排反应 使用水溶剂可以加速克莱森重排反应,并且能够在温和的条件下进行
O PhMe,100C,95h 12% (CH2)5CO2R (CH2)5 CO2R CHO
4.6高压克莱森重排反应 高压克莱森重排反应 烯丙基醚(对甲基苯基醚)在不同的温度和溶剂中发生克莱森重排的速率常数都会随 压力的增大而增大。间甲氧基醚和烯丙基乙烯基醚也有类似的现象。
OH OH heat + + Ph
O O
Ph
O
O
Ph heat
OH
OH
Ph
+ NH2
+ NH2
自1950年以来,化学家们通过标记技术,立体化学探针,动力学分析,分子间和分 子内的交叉实验等方法探究该反应的机理。对于烯丙基苯基醚型的克莱森重排,还 检测和直接研究了反应中间体环己二烯酮。通常克莱森重排机理有两种表示方法: 用双箭头表示电子转移反应式或者用单箭头表示单电子转移反应式
CH3 O heat H C H 2 =C H CH3 (E ,Z )o r(Z ,E) (Z ,Z )or (E ,E) 3% 9 7 .8% 97% 2 .2% CHO + H H H CH3 CHO CH=CH2 CH3
(E,E)-丙烯基巴豆基醚在椅式过渡态中,两个甲基都处于椅式的平伏键上。由于 这种构象能量最低而最容易发生重排,所以生成主要产物。而在船式六元环状过渡态 中,两个甲基则都处于准平伏键上。由于船底的两组碳原子为重叠式构象,能量相对 较高而较难发生重排,因此生成次要产物。
由于克莱森重排反应可以方便的通过椅式构象过渡态控制产 物的立体化学。因此克莱森重排反应已经广泛应用于天然产 物的全合成中。在含有季碳的萜类天然产物中,都是使用脂 肪克莱森重排反应作为关键步骤实现的。
有机化学重排反应 总结

--有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用g-碳14C 标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
克莱森重排反应

克莱森重排反应(Claisen重排反应)的最初形式是一个烯丙基苯基醚在高温(> 200°C)下发生的一个重排反应,产物是邻位烯丙基苯酚。
反应的机理是σ[3,3]重排(是史上第一个发现的σ[3,3]重排反应),产物4-烯酮因芳香性的需要互变异构为酚。
这个反应的特点是高度的区域选择性,产物大部分是邻位的。
与弗里斯重排的性质很相似。
而当苯环的两个邻位都被“堵”住的时候,反应产物是对位烯丙基取代物。
这是因为中间产物发生了一个科普重排反应所致——“分子自有其道(molecules have a way of hanging on)”。
审视整个过程可以看到:克莱森重排的驱动力是生成热力学上最稳定的取代度最大的“烯烃”。
克莱森重排起初是在芳香化合物中发现的(1912年),这与当时(20世纪初期)合成化学家“玩”的范围局限在芳香烃上有关。
到后来发现该反应可以拓展到非芳香化合物,而这种拓展非常重要,因为克莱森重排反应立刻变成了合成上一个非常有用的反应:反应生成了一个新的碳碳键,得到一个4-烯羰基化合物,而烯键可以继续往下做衍生,得到其他的化合物。
而现代有机合成在克莱森反应的启发下催生出众多“变体”:贝勒斯(Bellus)变体:埃申莫瑟(Eschenmoser)变体:艾兰德(Ireland)变体:强生(Johnson)变体:[编辑]天然界的存在在植物代谢的莽草酸途径中从分支酸到预苯酸的转换步骤就是一个克莱森重排;该反应受分支酸歧化酶的催化。
预苯酸是一个重要的前体化合物,生物体内含苯环的天然化合物有一大半是由预苯酸转换过来的。
嚬哪醇重排(英:pinacol rearrangement)是一个邻二醇在酸催化下脱水并发生取代基重排生成羰基化合物的反应。
[1][2]。
这一类反应由于嚬哪醇(2,3-二甲基-2,3-丁二醇)转换为嚬哪酮(3,3-二甲基-2-丁酮)的反应最具代表性,因而得名。
反应的关键步骤是一个碳正离子的1,2-重排。
克莱森重排

O OH
R2AlCl,rt 93%
4.4水加速的克莱森重排反应 水加速的克莱森重排反应 对于某些有机和金属有机反应,加入适量的水可以对反应速率,产率,反应的区域选 择性,非对映选择性和对映选择性产生增大作用
O Me3Al(4eq),CH2Cl2 -20C,1h Additive:none,trace H2O(1eq),94% OH
4.5水相中的克莱森重排反应 水相中的克莱森重排反应 使用水溶剂可以加速克莱森重排反应,并且能够在温和的条件下进行
O PhMe,100C,95h 12% (CH2)5CO2R (CH2)5 CO2R CHO
4.6高压克莱森重排反应 高压克莱森重排反应 烯丙基醚(对甲基苯基醚)在不同的温度和溶剂中发生克莱森重排的速率常数都会随 压力的增大而增大。间甲氧基醚和烯丙基乙烯基醚也有类似的现象。
有时候重排反应会发生在烯丙基的β-碳原子上,并形成非正常的克莱森重排反应产物。 机理研究表明,非正常的重排产物是通过正常的邻位重排产物生成的。如下图所示: 正常的邻位重排产物中的酚羟基上的氢原子首先转移到烯丙基的末端碳原子上,然后 形成由环丙烷和环己二烯酮形成的螺环中间体。当环己二烯酮的氧原子从环丙烷上取代 基的碳原子上夺取一个氢原子后,环丙烷开环重排到烯丙基β-碳原子上。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
克莱森重排反应(Claisen重排反应)的最初形式是一个烯丙基苯基醚在高温(> 200°C)下发生的一个重排反应,产物是邻位烯丙基苯酚。
反应的机理是σ[3,3]重排(是史上第一个发现的σ[3,3]重排反应),产物4-烯酮因芳香性的需要互变异构为酚。
这个反应的特点是高度的区域选择性,产物大部分是邻位的。
与弗里斯重排的性质很相似。
而当苯环的两个邻位都被“堵”住的时候,反应产物是对位烯丙基取代物。
这是因为中间产物发生了一个科普重排反应所致——“分子自有其道(molecules have a way of hanging on)”。
审视整个过程可以看到:克莱森重排的驱动力是生成热力学上最稳定的取代度最大的“烯烃”。
克莱森重排起初是在芳香化合物中发现的(1912年),这与当时(20世纪初期)合成化学家“玩”的范围局限在芳香烃上有关。
到后来发现该反应可以拓展到非芳香化合物,而这种拓展非常重要,因为克莱森重排反应立刻变成了合成上一个非常有用的反应:反应生成了一个新的碳碳键,得到一个4-烯羰基化合物,而烯键可以继续往下做衍生,得到其他的化合物。
而现代有机合成在克莱森反应的启发下催生出众多“变体”:
贝勒斯(Bellus)变体:
埃申莫瑟(Eschenmoser)变体:
艾兰德(Ireland)变体:
强生(Johnson)变体:
[编辑]天然界的存在
在植物代谢的莽草酸途径中从分支酸到预苯酸的转换步骤就是一个克莱森重排;该反应受分支酸歧化酶的催化。
预苯酸是一个重要的前体化合物,生物体内含苯环的天然化合物有一大半是由预苯酸转换过来的。
嚬哪醇重排
(英:pinacol rearrangement)是一个邻二醇在酸催化下脱水并发生取代基重排生成羰基化合物的反应。
[1][2]。
这一类反应由于嚬哪醇(2,3-二甲基-2,3-丁二醇)转换为嚬哪酮(3,3-二甲基-2-丁酮)的反应最具代表性,因而得名。
反应的关键步骤是一个碳正离子的1,2-重排。
[编辑]反应机理
1.两个羟基其中之一接受一个质子之后脱去一分子水,形成碳正离子;
2.发生1,2-重排,一个基团从未脱去羟基的碳上向有正电荷的碳上转移;
3.羟基上脱去一个质子,其氧原子与碳成双键,反应结束。
第1步中,倾向生成稳定的碳正离子,级数较高的碳上的羟基容易脱去。
第2步中,倾向转移给电子性大的基团,芳基比烷基易于转移,烷基易于氢。
傅里德-克拉夫茨反应
,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
[1]该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应
[编辑]傅-克烷基化反应
傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:
傅-克烷基化机理
这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔
丁基化反应。
1,4-二甲氧基苯的叔丁基化
烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:[6]
1-氯-2-甲基-2-苯基丙烷的合成
曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
[7]
通过烯烃的傅-克烷基化
在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
[编辑]傅-克去烷基化反应
傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
例如,在用溴乙烷对苯的多重取代当中,由于烷基是一个活化基团,原来期待能够得到邻对位取代的产物。
然而真正的反应产物是1,3,5-三甲基苯,即所有烷基取代都是间位取代。
[8]热力学反应控制使得该反应产生了热力学上更稳定的间位产物。
通过化学平衡,间位产物比起邻对位产物降低了空间位阻。
因此反应最终的产物是一系列烷基化与去烷基化共同作用的结果。
2,4,6-三乙基苯的合成
傅-克酰基化反应
主条目:傅-克酰基化反应
傅-克酰基化反应是在强路易斯酸做催化剂条件下,让酰氯与苯环进行酰化的反应。
此反应还可以使用羧酸酐作为酰化试剂,反应条件类似于烷基化反应的条件。
酰化反应比起烷基化反应来说具有一定的优势:由于羰基的吸电子效应的影响(钝化基团),反应产物(酮)通常不会像烷基化产物一样继续多重酰化。
而且该反应不存在碳正离子重排,这是由于酰基正离子可以共振到氧原子上从而稳定碳离子(不同于烷基化形成的烷基碳正离子,正电荷非常容易重排到取代基较多的碳原子上)。
生成的酰基可以用克莱门森还原反应、沃尔夫-凯惜纳-黄鸣龙还原反应或者催化氢化等反应转化为烷基。
条件:氯化铝为催化剂,回流,无水
傅-克酰化的成功与否取决于酰氯试剂的稳定性。
比如甲酰氯就由于不稳定而不能进行,因此合成苯甲醛就需要其他的方法,如Gattermann-Koch反应:在氯化铝和氯化亚铜的催化下,通过苯、一氧化碳与氯化氢在高压当中合成。
[编辑]反应机理
第一步是在路易斯酸的条件下,氯的解离形成酰基碳正离子:
第二步是接下来的芳环亲电试剂进攻酰基正离子:
最后一步,电荷转移至氯原子形成HCL,而AlCl3催化剂重新形成:
如果需要的话产生的芳香酮可以接着被还原形成相应的芳环烷基侧链,见:沃尔夫-凯惜纳-黄鸣龙还原反应或者Clemmensen还原,两者的区别在于溶剂的酸碱性。
[编辑]傅-克羟基烷基化
芳环和一定的醛酮形成相应的羟基取代的烷基化产物:[9]。
