试表18-石灰有效钙镁含量试验报告
石灰土有效钙镁含量衰减规律的试验分析

石灰土有效钙镁含量衰减规律的试验分析摘要: 本文通过试验对比的方法,分别对石灰土在常见的洒水与露天条件下,灰剂量的衰减情况和干密度变化规律。
然后进一步分析了石灰土有效钙镁合量和石灰土强度之间的关系, 并论述了石灰土路基与干密度的联系。
最后为确保石灰土施工质量, 提出了一些建议措施。
关键词: 石灰土;干密度;对策;质量石灰土可以简单的理解为用石灰和细粒土相混合得到的混合料。
它较一般的原料有着明显的优点,如具有板体性,强度比砂石路面要高;有一定的水稳性和抗冻性;而且其强度随龄期而增长。
一直以来,尤其是近年随着我国交通运输事业的加速发展,石灰稳定土结构的应用更为广泛。
本文从形成石灰土强度的内因和外因条件论述对石灰土质量构成重要影响的原因,并提出了对策。
1 影响石灰土质量的因素及对策其实影响石灰土质量的因素不外乎两个,即土质与石灰的质量。
1.1 土质我们说土质其实一般包括三方面:(1)土的塑性指数(2)土的颗粒大小(3)土中杂质含量。
根据规定,只要是塑性指数在15~20之间的粘性土,或者是含有一定数量的粘性土的中粒土和粗粒土,均可以满足配置石灰土的需要。
当然施工中的土粒应尽可能细,量化来说土块最大尺寸不应大于15mm,因为灰土强度与土的粒径有着直接的关系。
土中杂质的要求一般为:硫酸盐含量小于0.8%,更不得有明显的杂草或植物根茎等异物。
因为有机质本身的水稳性较差,和水结合后会剧烈膨胀,导致石灰土的强度降低。
1.2石灰质量建筑用石灰土应符合《公路路面基层施工技术规范》的技术指标。
在此基础上石灰的存放时间要尽量的短,因为随着石灰存放时间的延长,特别是在没有良好的保护措施的情况下,石灰中的有效钙和氧化镁的含量会大幅度下降,导致活性降低。
而活性低的石灰会直接导致石灰强度的降低。
其次石灰务必要得到充分消解,未充分消解的石灰如果在工程结束后遇水就会继续消解,引起局部爆裂崩解,严重影响土层的强度和平整度。
1.3混合比例不同的石灰剂量会使得石灰起到不同的作用。
灰剂量及钙镁含量
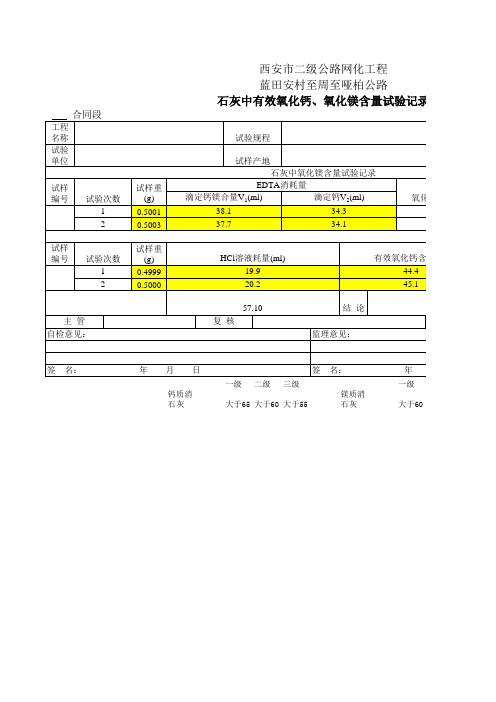
试验次数 1 2
氧化镁含量(%) 12.6 12.1
试样 编号
试验次数 1 2
HCl溶液耗量(ml) 19.9 20.2 57.10 结 论 监理意见:
有效氧化钙含量(%) 44.4 45.1
主 管 自检意见:
复 核
签
名:
年
月
日பைடு நூலகம்
一级 二级 三级 大于65 大于60 大于55
签 名:
镁质消石灰
年
一级 大于60
西安市二级公路网化工程 蓝田安村至周至哑柏公路 石灰中有效氧化钙、氧化镁含量试验记录
合同段
工程 名称 试验 单位 试样 编号 试样重 (g) 0.5001 0.5003 试样重 (g) 0.4999 0.5000 试验规程 试样产地 石灰中氧化镁含量试验记录 EDTA消耗量 滴定钙镁合量V1(ml) 滴定钙V2(ml) 38.1 37.7 34.3 34.1
月
日
钙质消石灰
程 路 量试验记录
试验编号 试验日期
氧化镁含量(%) 12.6 12.1
平均值 12.35
备 注 1.674
12.7 12 12.35
有效氧化钙含量(%) 44.4 45.1
平均值 44.75
备 注 0.3988
试 验
年
月
日
二级 三级 大于55 大于50
高锰酸钾法测定石灰石中钙的含量(实验报告)

高锰酸钾法测定石灰石中钙的含量(实验报告)高锰酸钾法测定石灰石中钙的含量米海丰摘要本实验以高锰酸钾法测定了石灰石中钙的含量,最终得到试样中钙的含量为41.57%±0.43%,测定结果的相对标准误差(RSD)为0.85% 。
关键词高锰酸钾法石灰石钙引言天然石灰石是工业生产中重要的原材料之一,它的主要成分是CaCO3,此外还含有SiO2、Fe2O3、Al2O3及MgO 等杂质。
石灰石中Ca2+含量的测定主要采用配位滴定法和高锰酸钾法。
前者比较简单但干扰也较多,后者干扰少、准确度高、但较费时。
用高锰酸钾法测定石灰石中的钙含量,首先将石灰石用盐酸溶解制成试液,然后将Ca2+转化为CaC2O4沉淀,将沉淀过滤、洗净,用稀H2SO4溶解,用KMnO4标准溶液间接滴定与Ca2+相当的C2O42-,根据KMnO4溶液的用量和浓度计算出试样中钙的含量。
主要反应有:CaCO3+2HCl = CaCl2+H2O+CO2↑Ca2++ C2O42- = CaC2O4 ↓CaC2O4+2H+ = Ca2++ H2C2O42MnO4-+5 H2C2O4+6H+= 2Mn2++10 CO2↑+8H2O1实验部分1.1实验试剂与仪器KMnO4(固)、Na2C2O4(A.R.或基准试剂于105℃干燥2h,贮存于干燥器中)、3mol·L-1 H2SO4、6 mol·L-1HCl、3 mol·L-1NH3·H2O、0.25 mol·L-1(NH4)2C2O4、0.1%甲基橙指示剂、10%柠檬酸铵、0.1%(NH4)2C2O4、0.5 mol·L-1CaCl2、石灰石样试样50mL酸式滴定管、10mL量筒、250mL锥形瓶、250mL烧杯、滴管、玻璃棒、玻璃砂芯漏斗(或玻璃纤维)、棕色细口试剂瓶、台秤、分析天平、酒精灯、表面皿、漏斗、定性滤纸1.2实验方法[1]1.2.10.02 mol·L-1KMnO4溶液的配制台秤上称取1.6 g KMnO4[(KMnO4)=158.04]溶于500 mL水中,盖上表面皿,加热煮沸20~30 min(随时加水以补充因蒸发而损失的水)。
石灰石中钙镁含量的测定实验报告

石灰石中钙镁含量的测定实验报告一、实验目的:本实验旨在通过化学分析方法测定石灰石中钙镁含量。
二、实验原理:石灰石主要由碳酸钙(CaCO3)和少量的碳酸镁(MgCO3)组成。
钙和镁都是碱土金属元素,因此可以采用EDTA配合物滴定法来测定石灰石中钙镁含量。
三、实验步骤:1.取一定量的石灰石样品,粉碎并筛选出粒度在60目以下的颗粒。
2.将粉末样品称取0.2g,加入100ml锥形瓶中,加入10ml0.1mol/L盐酸,加热至完全溶解。
3.在溶液中加入几滴甲基红指示剂,然后用0.1mol/L氢氧化钠溶液滴定至颜色由红变黄。
4.加入10ml NH4Cl/NH4OH缓冲液和10ml 0.01mol/L EDTA溶液,用0.01mol/L MgCl2标准溶液滴定至颜色变化,记录所需的EDTA溶液用量V1。
5.再加入10ml NH4Cl/NH4OH缓冲液和10ml 0.01mol/L EDTA溶液,用0.01mol/L CaCl2标准溶液滴定至颜色变化,记录所需的EDTA 溶液用量V2。
四、实验结果:根据EDTA配合物滴定法的原理,钙和镁的摩尔比为1:1,因此可以计算出石灰石中钙和镁的含量。
计算公式如下:钙含量(%)=(V2-V1)×0.01×40.08×1000/m镁含量(%)=V1×0.01×24.31×1000/m其中,V1为EDTA溶液用量(mL),V2为EDTA溶液用量(mL),m为样品质量(g),40.08和24.31分别为钙和镁的摩尔质量。
五、实验结论:通过本实验,成功测定了石灰石中钙镁含量。
实验结果表明,该石灰石样品中钙含量为XX%,镁含量为XX%。
市政工程—石灰有效钙和镁含量试验报告
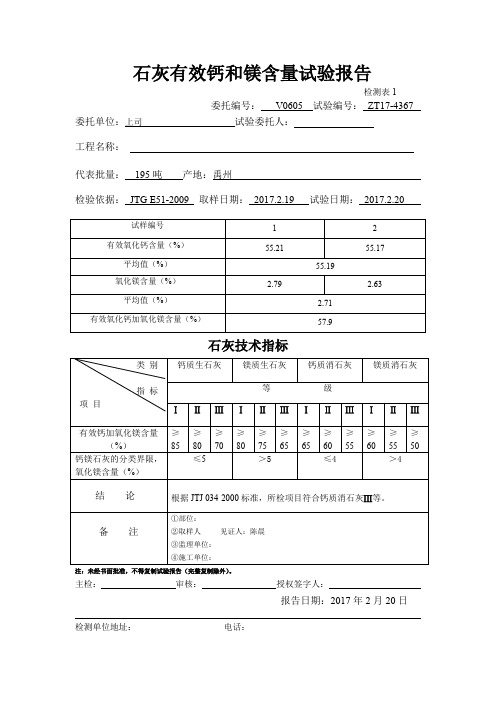
2.63
平均值(%)
2.71
有效氧化钙加氧化镁含量(%)
57.9
石灰技术指标
类别
指标
项目
钙质生石灰
镁质生石灰
钙质消石灰
镁质消石灰
等级
Ⅰ
Ⅱ
Ⅲ
Ⅰ
Ⅱ
Ⅲ
Ⅰ
Ⅱ
Ⅲ
Ⅰ
Ⅱ
Ⅲ
有效钙加氧化镁含量(%)
≥85
≥80
≥70
≥80
≥75
≥65
≥65
≥60
≥55
≥60
≥55
≥50
钙镁石灰的分类界限,氧化镁含量(%)
≤5
>5
≤4
>4
结论
根据JTJ 034-2000标准,所检项目符合钙质消石灰Ⅲ等。
备注
①部位:②取Biblioteka 人 见证人:陈晨③监理单位:
④施工单位:
注:未经书面批准,不得复制试验报告(完整复制除外)。
主检:审核:授权签字人:
报告日期:2017年2月20日
检测单位地址:电话:
石灰有效钙和镁含量试验报告
检测表1
委托编号:V0605试验编号:ZT17-4367
委托单位:上司试验委托人:
工程名称:
代表批量:195吨产地:禹州
检验依据:JTG E51-2009取样日期:2017.2.19试验日期:2017.2.20
试样编号
1
2
有效氧化钙含量(%)
55.21
55.17
55.19
氧化镁含量(%)
04石灰钙镁含量试验记录表

04石灰钙镁含量试验记录表
但不要出现任何公司,设备名称等对应的特定参数
样品名称:
试验日期:
制备人:
测量情况:
试验方法:
1.石灰钙镁分析:采用标准酸溶法。
2.采用的试剂:
a.稀硫酸:H2SO4
b.稀盐酸:HCl
c.高氯酸:HClO4
3.调整pH仪:采用电极IDM准确调节液体pH
4.pH测量:采用pH仪和pH电极测量。
5.分析试管:采用25毫升的玻璃分析试管。
6.分析瓶:使用玻璃分析瓶进行分析。
样品/标样准备:
1.采集:根据有关要求采集样品/标准品。
2.程序:将样品/标准品放入分析瓶中,根据指定程序进行分析。
3.权重:根据实验要求,确定样品/标准品的权重。
4.样品前处理:使用不锈钢搅拌器对样品进行调搅,将样品中的固体物质完全溶解,并将溶液过滤后进行试验。
结果表:
试验编号样品/标准品石灰钙含量mmol/L 镁含量mmol/L
1样品3.250.25
2样品4.230.21
3样品4.120.22
4标准品5.210.19
参考值:
石灰钙含量:3.9-6.0mmol/L
镁含量:0.1-0.4mmol/L
试验总结:。
试表18-石灰有效钙镁含量试验报告

试表18-石灰有效钙镁含量试验报告试验报告:石灰有效钙镁含量试验一、实验目的本试验的目的是探究石灰的有效钙镁含量,并通过试验结果分析石灰的适用性和优劣,为农田土壤改良提供参考依据。
二、实验原理有效钙镁含量是指土壤中可溶解于水中的钙镁离子的含量。
石灰是一种常用的土壤改良剂,其中含有丰富的钙镁元素,可提高土壤的酸碱性及结构,促进植物生长。
三、实验材料2.土壤样品:采集自农田中的不同类型土壤样品。
3.蒸馏水:用于溶解石灰样品。
4.离心机:用于离心石灰水溶液。
5.试剂:含有钙镁离子的指示剂。
6.显微镜:用于观察试验结果。
四、实验步骤1.准备石灰水溶液:将石灰样品沉淀,取上部悬浮液与等量的蒸馏水混合,静置一段时间得到石灰水溶液。
2.过滤石灰水溶液:将石灰水溶液过滤,去除悬浮的杂质。
3.离心石灰水溶液:将石灰水溶液离心,分离出溶液中的固体颗粒。
4.取一部分过滤后的石灰水溶液,加入含有钙镁离子的指示剂,观察颜色的变化。
5.将试剂与石灰溶液混合均匀,观察变红的程度,通过颜色深浅判断石灰溶液中钙镁离子的含量。
五、实验结果与分析六、实验注意事项1.实验过程中要注意安全,避免直接接触试剂和石灰样品。
2.实验前要对实验室用具进行清洗和消毒,保证实验环境的卫生和无污染。
3.实验前要对石灰样品进行充分的掺混,保证取样的均匀性。
4.实验结果可能受到实验条件和仪器设备的影响,要重复实验以验证结果。
七、实验结论与展望通过本次试验,我们成功地测试了石灰样品的有效钙镁含量。
实验结果可以为农田土壤改良提供参考依据,并帮助农民选择合适的石灰样品。
此外,还可以通过进一步的实验研究,去测定石灰样品对不同类型土壤的适应性和改良效果,为农田改良提供更加准确和科学的指导。
总结:本试验通过测试石灰样品的有效钙镁含量,为农田土壤改良提供了参考依据。
通过实验结果,可以帮助农民选择适合的石灰样品,提高土壤的肥力和产量。
接下来,还可以通过进一步的研究,去探究石灰样品对不同类型土壤的适应性和改良效果,为农田改良提供更全面、准确和科学的指导。
市政工程—石灰有效钙和镁含量试验报告

市政工程—石灰有效钙和镁含量试验报告一、试验目的本次试验的目的是测定市政工程中所使用的石灰中的有效钙和镁含量,为市政工程的施工质量提供参考数据。
二、试验方法和原理1.试验方法本次试验采用自制反应液法。
首先将一定质量的石灰样品与浓度已知的盐酸反应,形成反应产物。
然后,以乙腈为溶剂稀释反应产物溶液,并使用酸铝石(Alizarin S)和硝酸钡溶液作为指示剂和沉淀剂。
最后,通过滴定法测定剩余的酸量,由此计算出石灰中有效钙和镁含量。
2.试验原理石灰的主要成分是钙和镁的氧化物或碳酸盐。
试验原理基于石灰与盐酸反应生成的产物,其中钙和镁与盐酸反应主要是生成氯化物。
通过对剩余酸的滴定,可以得到钙和镁含量。
酸铝石反应溶液的颜色变化可以作为滴定终点的指示剂,硝酸钡溶液用于沉淀剩余的钙和镁。
三、试验操作步骤1.将待测石灰样品称取0.1g,并加入250ml锥形瓶中。
2.向锥形瓶中加入30ml浓盐酸,盖上瓶盖并摇匀,同时注意安全。
3.待反应停止后,再向锥形瓶中加入150ml乙腈,并摇匀,使反应产物溶解。
4.待溶液彻底混合后,过滤溶液,收集滤液。
5.将滤液用试管移至试验架上,使用滴定管滴加酸铝石溶液,持续滴加直至溶液出现红色。
6.观察滴定过程中溶液颜色变化,当滴加酸铝石溶液使溶液颜色变为红色,即为滴定结束。
7.记录滴加酸铝石溶液的体积,计算滴定所需的盐酸体积。
8.使用滴定管滴加硝酸钡溶液,直至产生沉淀。
9.持续滴加硝酸钡溶液直至沉淀消失,记录滴加的体积。
10.根据滴定数据,计算出石灰样品中有效钙和镁的含量。
四、试验结果和数据分析本次试验共进行了3次独立重复实验,结果如下所示:试验1:滴定所需盐酸体积:25.0ml,滴加硝酸钡溶液体积:12.0ml试验2:滴定所需盐酸体积:24.5ml试验3:滴定所需盐酸体积:25.2ml,滴加硝酸钡溶液体积:11.9ml根据上述数据,每次实验所消耗的盐酸体积和硝酸钡溶液体积的平均值分别为24.9ml和11.9ml。
