化学竞赛无机化学绝密课件 硼族元素共266页
【高中化学奥赛课件】硼族元素

B11以上:十一 ……, 例如: B16H20 十六硼烷
若原子数目相同,而H原子数目不同:
3. 结构
以B2H6的结构为例
B5H9 戊硼烷-9 B5H11 戊硼烷-11
14个价轨道 2个B原子:2×4 = 8个价轨道 6个H原子:6×1 = 6个价轨道
12个价电子数
2个B原子: 2 ×3=6个价电子 6个H原子: 6 ×1=6个价电子
B2O3
e.与碱反应:
2NaOH + 4H3BO3 = Na2B4O7 + 7H2O
过量NaOH使Na2B4O7变成NaBO2
Na2B4O7 + 2NaOH = 4NaBO2 + H2O
f. 偏硼酸HBO2
片状结构、锯齿链状或环状、三维网格结构
3 硼酸盐
(1) 硼酸盐基本
结构单元
BΦ3 平面三角形 BΦ 4 四面体(Φ = O, OH)
§16-5 惰性电子对效应和周期表中的斜线关系
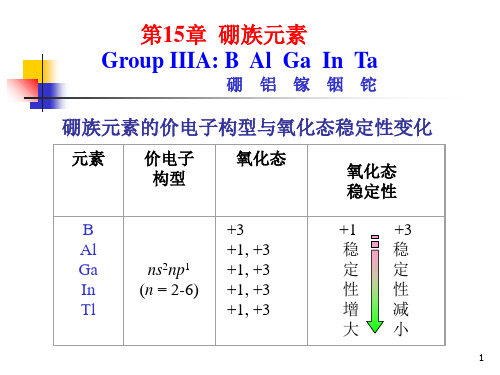
§16-1 硼族元素的通性
1.硼族元素的基本性质
性质
元素
元素符号
原子序数
相对原子质量
价层电子构型
主要氧化数
共价半径/pm 离子半径(M +)/pm 离子半径(M3+)/pm 电离能I1/kJ.mol-1 电离能I2/kJ.mol-1 电离能I3/kJ.mol-1 电子亲合能E1/kJ.mol-1 电负性(Pauling)
实验测定
3c-2e bond (3 center-2 electron bond) B2H6分子 逆磁性(电子均已成对)
1H NMR → 2种H,比例4:2(4个H和2个H)
2个B与4个H共平面
在其他较高级硼烷中, 其结构还可能涉及另外三种成键要素: (2C-2e)的B-B键, 闭式(3C-2e)硼键, 开式(3C-2e)硼桥键。
化学竞赛无机化学绝密课件-硼族元素

H B8
B10 H
H H B1
H
H B9 H
B2
B3
H
B6 H
H
两
B4 H
图
H
中
H B5
B7 H
序
号
是
对
应
的
硼骨架相当 于缺少 2个顶点 的正 20 面体。
H
H
H BH
H
B
B
H
H BH
H
H
如图是丁硼烷-10(B4H10) 的键联关系
H
H
H BH
H
B
B
H
H BH
H
H
B-H 键 6 个 B-B 键 1 个 氢桥键 4个
12. 1 硼单质
无定形硼为黄棕色粉末。 晶体硼黑灰色,高硬度, 高熔点。
12. 1. 1 晶体硼的结构 晶体硼单质的基本结构单元为 正二十面体,十二个硼原子占据多 面体的顶点。
正二十面体共 20 个面,每个面 都是正三角形; 每个面角都是五面角;共 12 个顶点。
我们称这种基本结构单元为 B12
B2H6 和 LiH 两者在乙醚介质 中发生如下反应生成 LiBH4
乙醚
B2H6 + 2 LiH ———— 2 LiBH4
乙醚
B2H6 + 2 LiH ———— 2 LiBH4 该反应的关键环节是
H H B + HLi ———
H HBH
-
Li +
H
H
LiBH4 是白色固体,火箭推进剂。
B2H6 和 NH3 以 1:2 混合,高 温下可制得硼氮六环 B3N3H6 :
四个端基 H 和两个 B 形成 分子平面。
中山大学无机化学精品课程第15章硼族元素PPT课件
══════
800~1100 ℃
B12(C) + 18 I2(g)
Na2B4O7·10H2O + 2HCl = 4H3BO3 + 2NaCl + 5H2O 2H3BO3 = B2O3 +3 H2O (800 K) B2O3 + Mg = 3MgO + 2B (800 K)
4
2. -菱形硼结构(重点)
邻的另外6个B12共形成6个3c-2e键 (B-B 203 pm),共用去:
形成6个正常B-B 2c-2e键 (B-B 171 nm),共 用去:
6 × 2/3 e = 4 e
6 × 2/2 e = 6 e
➢ 每个B12与外部B12 成键共用去4 e + 6 e = 10 e
6
(2) B12 单元内部成键 : 由“多面体顶角规则”确定:
(B亲F)
7
973 K 4B(s) + 3O2(g) = 2B2O3(s)
△rH298 = - 2887 kJ·mol-1 △rG298 = - 2368 kJ·mol-1 ∴B在炼钢中作脱氧剂。
B-O Si-O C-O 键能/kJ·mol-1 560-690 > 452 > 358
(B亲O) 2x B(s) + xN2(g) = 2(BN)x (s) 氮化硼:石墨结构,B-N键极性,为绝缘体 2B(s) + 3X2(g) = 2BX3 (X = Cl、Br、I)
4. B是亲F、亲O元素: 键能/kJ·mol-1 B-O 561~690;Si-O 452;
B-F 613; Si-F 565
3
二、硼单质
无 定 形 硼 ( 棕 色 粉 末 ) 单 质 硼 晶 体 硼 : 最 重 要 -菱 形 硼 ( 黑 灰 色 )
第十六章-硼族元素PPT课件

-0.34
Tl3+ 1.25 Tl+ -0.336 Tl 1.36 TlCl -0.557
Tl(OH)3 -0.05 TlOH -0.344 Tl
Tl3+的化合物具有强氧化性
Tl+.的化合物特别稳定
8
§16-2 硼及其化合物
2-1 硼在自然界的存在
——以硼酸盐的形式存在
主要矿有:
硼砂—— Na2B4O7·10H2O
27
B2H6的结构由美国化学家—— 利普斯科姆(Lipscomb,W.N.)提出:
1949年后,利普斯科姆开始对硼烷、碳硼烷及其一系列 衍生物进行系统研究。关于硼烷的结构,早在半个世纪前
曾有人做过研究,但都未能真正解释明白硼烷及其衍生物 组分的多样化结构的复杂性。
利普斯科姆利用低温X 射线衍射方法等测定了多种硼烷 结构。根据他测定的结果,硼烷分子具有代表性的结构是
BF3 + F- BF4-
B(OH)3 + OH- [B(OH)4]单质硼和B化合物中还能形成多中心键
3c-2e 键 、 sp2杂化的硼化合物中的大键。
.
11
③ 多面体习性
——晶态B和许多硼的化合物为多面体或多面体的碎片, 形似笼状或巢状等结构。 这种多面体的习性同它能形成多种类型的键有关。
巢图状16硼-3 烷-结菱形构硼的结构
中除外向B—H键以外的其它类型的化学键。
键型
所用轨道数 所用电子数 键数
B—B
2
2
y
B—H—B
3
2
s
开口B—B—B
3
2
闭合B—B—B
3
t 2
B—H
2
2
硼族元素 PPT教程 【优秀课件】元素化学 大学化学化工专业资料

元 素 符
价电子 层结构
主要 氧化
值
号
共 价 半 径
/pm
硬度 (金刚
石
=10)
熔点 ℃
沸点 /℃
第一 电离
能
/kJ·m ol-1
第一电 子亲合
能
/kJ·mol-
1
电 负 性
晶体类型
B 2s22p1 +3
88 9.5 2180 3650 801
23 2.0 原子晶体
Al 3s23p1 +3 125 2.9 660 2467 578
2H3BO3
B2 O3 + 3H2O
性质:水蒸气中形成偏硼酸,在水中形成硼酸 B2O3(s) + H2O(g) = 2HBO2(g) B2O3(s) + 3H2O(1) = 2H3BO3(aq)
熔融状态的B2O3可溶解许多金属氧化物,制得有色硼玻璃。
3 硼的化合物
◇硼酸 H3BO3
H3BO3 ,或写为B(OH)3,是白色片状晶体。
3 硼的化合物
②与多羟基化合物加合
硼酸是典型的路易斯(Lewis)酸,在其溶液中加入甘油和甘露醇等
R
R
R-
H C OH H3BO3 2 H C OH
HCO OCH
H
C
B OO
C
H H 3H2O
R'
R'
R
R' R
H C O H HO
OH H O C H
B
H C O H HO
HOCH
③ 受热易分解
铝粉和铁的氧化物混合可制成铝热剂。 8Al + 3Fe3O4 = 4A12O3 + 9Fe ∆rHmΘ= -3329 kJ/mol 若这个反应在小容器中进行,可达很高温度(约3500℃)
2024年化学竞赛无机化学绝密课件硼族元素-(含多场合)

化学竞赛无机化学绝密课件硼族元素-(含多场合)化学竞赛无机化学绝密课件硼族元素摘要:本文主要介绍了化学竞赛中无机化学部分的重要知识点——硼族元素。
通过对硼族元素的概述、性质、化合物以及应用等方面的详细讲解,旨在帮助参赛者更好地掌握这一部分内容,提高化学竞赛成绩。
一、硼族元素概述硼族元素位于元素周期表的第二族,包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铍(Tl)等元素。
硼族元素在自然界中分布广泛,其中硼和铝是地壳中含量较多的元素。
硼族元素在化学性质上具有一定的相似性,但在物理性质和应用方面存在较大差异。
二、硼族元素的性质1.电子结构:硼族元素的原子结构中,最外层电子数为3个,因此它们在化学反应中容易失去3个电子,形成+3价离子。
2.金属性和非金属性:从上到下,硼族元素的金属性逐渐增强,非金属性逐渐减弱。
硼和铝具有较强的非金属性,而铟和铍的金属性较强。
3.离子半径:硼族元素的离子半径随着原子序数的增加而增大,这是因为原子核对最外层电子的吸引力逐渐减弱。
4.电负性:硼族元素的电负性随着原子序数的增加而减小,这是因为原子核对最外层电子的吸引力逐渐减弱。
三、硼族元素的化合物1.氧化物:硼族元素与氧元素形成的氧化物具有多种类型,如硼酸、氧化铝、氧化镓等。
这些氧化物在工业、医药等领域具有广泛的应用。
2.硼化物:硼族元素与金属元素形成的硼化物具有高熔点、高硬度和良好的导电性等特点,如碳化硼、氮化硼等。
3.氢化物:硼族元素与氢元素形成的氢化物在有机合成中具有重要应用,如硼氢化钠、硼氢化铝等。
4.硼酸盐:硼酸盐是一类重要的无机化合物,如硼砂、硼酸铝等。
它们在玻璃、陶瓷、洗涤剂等领域具有广泛应用。
四、硼族元素的应用1.金属铝:铝是硼族元素中应用最广泛的元素,广泛应用于建筑、交通、包装、电力等领域。
铝具有良好的导电性、导热性和轻质等特点,是国民经济的重要支柱产业。
2.硼化合物:硼化合物在农业、医药、化工等领域具有重要应用。
第四章-硼族元素PPT课件

天然宝石: 透明氧化铝晶体含不同杂质而呈现鲜明颜色
红宝石(Cr3+)
蓝宝石(Fe3+)
18
绿宝石(Cu2+)
氢氧化铝
A l3 + + 3 H 2 O O H H + - A l( O H ) 3 O H H + - [ A l( O H ) 4 ] 两性 A l(O H )3 3 H A l3 + + 3 H 2 O
9
镓铟铊
均为银白色, 质软, 轻而有延展性的金属, 有毒 Ga: 熔点(303 K) ~ 沸点(2523 K)
液态范围在金属中最大,用在高温温度计
10
11.2.2 硼族元素的氢化物
一系列硼的氢化物, 20多种-----硼烷
◆ 组成 BnHn+4 类(稳定) BnHn+6 类
例: B2H6
最简单的硼
2B+ F2 ══室═温2BF3 2 B + 3 X 2 Δ 2 B X 3 ( X C l,B r ,I )
平面三角 形分子
6
③ 无定型B在赤热下同水蒸汽作用 2B + 6H2O ═══ 2H3BO3 + 3H2
④ 无定型B被热的浓H2SO4或浓HNO3氧化 2B + 3H2SO4(浓) ══ 2H3BO3 + 3SO2↑ B + 3HNO3(浓) ══ H3BO3 + 3NO2↑
(II) 与金属氧化物共熔
B2O3(s)+
M2O M2O3
共熔
硼酸盐(特征颜色) 硼玻璃
13
硼酸 H3BO3
H O B H
OO H
层状结构,似石墨,滑腻,有解离性
无机化学教学13章硼族元素PPT课件

镓的氧化物包括Ga₂O₃和GaO,它们具有高熔点和稳定性,可用于制备其他镓的化合物。镓的氧化物可以 由金属镓与氧气反应得到。
镓的硫化物和硒化物
镓的硫化物
镓的硫化物包括Ga₂S₃和GaS,它们具有较高的硬度、熔点和导电性。镓的硫化物可以 由金属镓与硫反应得到。
镓的硒化物
镓的硒化物包括Ga₂Se₃和GaSe,它们具有与硫化物类似的性质,如高熔点和导电性。 镓的硒化物可以由金属镓与硒反应得到。
有机镓化合物
有机镓酸酯
有机镓酸酯是一类重要的有机化合物, 它们可以通过酯交换反应制备。有机镓 酸酯在聚合反应中用作催化剂和添加剂 。
VS
其他有机镓化合物
除了有机镓酸酯外,还有许多其他有机镓 化合物,如有机镓醇、有机镓酸盐等。这 些化合物在医药、材料科学和催化等领域 有广泛的应用。
06 铟的化合物
铟的卤化物和氧化物
铟的卤化物
铟与卤素(如氟、氯、溴、碘)反应,生成 相应的卤化物。这些卤化物具有较高的熔点 和沸点,在常温下多为固态。
铟的氧化物
铟与氧气反应,可以生成多种氧化物,如 In2O3和In2O。这些氧化物具有不同的性 质和应用,例如In2O3是一种半导体材料, 可用于制备透明导电膜。
铟的硫化物和硒化物
无机化学的重要性
无机化学在化学学科中占据重要地位 ,是学习其他化学课程的基础。
无机化学在工业生产和科学研究中具 有广泛的应用,如制药、农业、能源 等领域。
02 硼族元素概述
硼族元素的定义
硼族元素
指周期表中第13族(ⅢA族)的元 素,包括硼(B)、铝(Al)、镓 (Ga)、铟(In)、铊(Tl)等元 素。
硼氢化合物和有机硼化合物
硼氢化合物
化学竞赛无机化学绝密课件 硼族元素资料

这种新类型的化学键,是由于 B
的缺电子结构造成的。 下面以 B10H14,癸硼烷 - 14 为
例说明硼氢化合物中的常见键型。
B10H14,癸硼烷-14 的键联关系
H B
H H B B H HB BH B H H
H B
B H
H
HB
H
B H
硼氢化合物中有 5 种常见键型
H B B H HB H H B
结。见图中虚线。
虚线三角形角顶位置的 3 个 B 原子之间共用 2 个电子成键。 即所谓 “三中心二电子键”。
三中心二电子键所用的 B 原子,
为 B12 单元中层的 B 原子。
关于三中心二电子键这类新的化 学键后面将要详细介绍。
前后片层之间,通过 B-B 键结合。
这些 B 原子是 B12 结构单元中,前
晶体硼黑灰色,高硬度,
高熔点。
12. 1. 1 晶体硼的结构
晶体硼单质的基本结构单元为
正二十面体,十二个硼原子占据多
面体的顶点。
正二十面体共 20 个面,每个面
都是正三角形; 每个面角都是五面角;共 12 个顶点。
我们称这种基本结构单元为 B12
B12 单元中,前面 3 个硼原子
构成的三角形,其所在的平面与后
这个硼原子在形成硼桥键时提供
一个原子轨道及其中的一个电子。
H B
B H
H H B
H HB B H
HB
BH
H H B
B H
H B H
闭合式硼键
B B B
4个
闭合式硼键中成键的 3 个硼原 子彼此等价
没有哪一个属于桥上的原子。
这 3 个硼一共提供 2 个电子。
硼族元素课件课件

Na2B4O7 10 H2O + 2 NH4Cl
= 2NaCl +B2O3(g) + 4H2O+ 2BN
第29页,幻灯片共48页
● 立方氮化硼与金刚石之间具有类似的替代关系,
类似的结构导致了类似的性质。它硬度接近金刚
石,也是一种有效的磨料,特别是用于不适宜 用金刚石磨料的场合。
B2O3(s)+ M2O
M2O3
共熔
硼酸盐(玻璃状)(特征颜色)
用于鉴别Mn+
第20页,幻灯片共48页
Question 3
1、H3BO3 为什么是一元酸?
2、H3BO3 为什么在冷水中溶解度小,
在热水中却是易溶的?
第21页,幻灯片共48页
二、硼酸
• (一)B(OH)3晶体结构
层状结构:层内:B sp2杂化 有氢键 层间:范德华力 ∴似石墨,有解离性
H BB
B
BB
B
5.封闭式
BB
2c-2e bond; 2c-2e bond; 3c-2e bond; 3c-2e bond;
3c-2e bond。
第16页,幻灯片共48页
例1
癸硼烷-14(B10H14)分子结构
(1) 价轨道数:410+ 114 = 54 10个B 14H
(2)价电 子 数 3×10 + 1×14 = 44 10B 14H
(四)四硼酸
H2B4O7
H3BO3
Ka =1.5×10-7 > Ka =5.8×10-10
∵非羟基氧数目↑(Pauling XOm (OH)n模型) 任何硼酸盐 + H+ → H3BO3 (水溶解度最小)
高中化学竞赛 无机化学第2章硼族元素(共26页PPT)(共26张PPT)
2. 硼酸
B:sp2杂化;存在分子间氢键; 层与层之间的分子作用力结合。
点击观看动画
H3BO3是路易斯酸,是一元酸
酸性很弱,Ka=5.8×10-10加入多羟基
化合物可增加酸性。
2
双烷氧基硼阴离子
H2SO4
H3BO3+3CH3OH== B(OCH3)3+3H2O
•燃烧绿色火焰 •鉴别硼酸及盐
3. 硼砂 (Na2B4O7·10H2O)
[B4O5(OH)4]2B: sp2杂化 sp3杂化
Na2B4O5(OH)4·8H2O
硼砂珠实验
冷却后为 蓝宝石色
硼砂珠实验:
△
Na2B4O7 ==B2O3+2NaBO2 +) CoO +B2O3 ==Co (BO2)2
Na2B4O7+CoO=2NaBO2·Co(BO2)
α-菱形硼
2 B + 3F2 == 2 BF3 4 B + 3O2 == 2 B2O3 2 B + N2 == 2 BN 2 B + 3 Cl2 == 2 BCl3 2 B + 3 S == B2S3 2 B + 6 H2O(g) == 2 B(OH)3 + 3 H2↑ B + 3 HNO3(浓) == B(OH)3 + 3 NO2↑ 2 B + 3 H2SO4 (浓) == 2 B(OH)3 + 3SO2↑
由于他的理论和实验研究的成功,利普斯科姆于1976年获 诺贝尔化学奖,并在后来的二十年期间给硼化学的发展带来了 重大的影响,从而开创了硼化学这一新领域。
2. AlCl3的成键特征 AlCl3中铝为sp3杂化
(GaCl3)2 (InCl3)2 (AlBr3)2 (AlI3)2 (GaBr3)2 除B的卤化物及ⅢA的氟化物以外,均为二聚形式。
无机化学课件硼族元素

oxidation number
ⅢA —— ns2np1
0、+1、+3
其中铝是地壳中蕴藏最丰富的金属元素主要以铝矾 土矿(Al2O3·xH2O)存在铝是银白色、有光泽的轻金属 具有良好的导电性和延展性广泛用来作导线、结构材料 和器皿铝合金质轻又硬,用于飞机制造。
所以硼族元素有时称为土族元素,其中Al2O3为黏 土的主要成分,既难溶又难熔
第十三章 p区元素(一)
一. 硼族元素
二. 碳族元素
§13.1 硼族元素
(The Boron Family Elements)
本节要求:
1. 了解硼族元素的通性、硼单质的性质; 2. 掌握缺电子原子及其化合物的结构特点和性质; 3. 熟悉硼的典型化合物(硼酸、硼砂)的性质和硼砂 珠试验; 4. 熟悉铝的化合物的性质特点。
B2O3 + 3Mg
2B + 3MgO
KBF4 + 3Na
3NaF + KF + B
(2)工业上:从硼镁矿 → 单质硼 → 精制硼
Mg2B2O5·5H2O + 2NaOH
2NaBO2 + 2Mg(OH)2 + 4H2O
4NaBO2 + CO2 + 10H2O
Na2B4O7·10H2O + Na2CO3
硼的主要化合物有硼酸、硼砂、卤化硼
(一)、硼酸H3BO3 —— 分子结构如下:
B:sp2杂化;存在分子间氢键形成接近六角形的对称层 状结构;层与层之间的分子作用力结合——与石墨相似
能溶于水,为典型的Lewis一元弱酸,由sp2 →sp3:
B(OH)3 + H2O
[B(OH)4] - + H +
16-硼族元素概述PPT课件

BF3+HF===HBF4
BF3+H2O===H3BO3+HF
HF+BF3===HBF4
BF3+H2O===H3BO3+HBF4
HBF4是氟硼酸,是一种强酸,与H2SiF6相近。
第16章 硼族元素
硼铝的成键特征
硼铝的结构与性质
硼
烷
硼铝含氧化合物
卤化物和氟硼酸
对角关系
.
1
硼的成键特征
硼及其化合物结构上的复杂性和键型上的多样性,丰富 和扩展了现有的共价键理论,因此,硼及其化合物的研究在近 年来获得了迅速发展。
无定形硼为棕色粉末,它比晶态硼活泼。几乎所有制备硅 的方法都适用于制硼。例如用H2还原硼的卤化物可以制得纯的 晶态硼,晶态硼不光有灰黑色,且有黄色、亮红色的同素异形 体,其颜色随结构含杂质不同而异。
电子构型nS2nP1 (缺电子性) 主要氧化数:+3 键能见表16-2 B-O键561Kj/mol最大
.
4
16-2硼族元素的单质和化合物
2-1 单质硼 晶态硼有多种变体,它们都以B12正二十
面体为基本结构单元,属于原子晶体。因此,硼的硬度大, 熔点、沸点高,化学性质也不活泼。
无定形和粉末状硼的性质 (1)它易在氧中燃烧:
B2H6与LiH反应,将得到一种比B2H6的还原性更 强的还原剂硼氢化理LiBH4。让过量的NaH与BF3反 应,可得到硼氢化钠NaBH4。
2LiH+B2H6=2LiBH4
4NaH+BF3==NaBH4+3NaF NaBH4、LiBH4都是白色盐型化合物晶体,能溶 于水或乙醇,无毒,化学性质稳定。由于其分子中有
2024版化学竞赛无机化学绝密课件

根据题目所给信息和所学知识,建立 数学模型或化学方程式。
检查计算过程和结果是否合理和准确, 注意单位换算和有效数字的处理。
05
历年真题回顾与模拟训练
历年真题分析及考点总结
分析历年真题的出题 规律和难度变化趋势, 为学生提供备考方向。
针对历年真题中的易 错点和难点进行深入 剖析,提高学生的解 题能力。
性质、制备方法和应用,如硝酸盐、硫酸盐 等。
非金属及其化合物
非金属的通性
重要的非金属盐
包括氧化性、还原性、与金属反应生 成离子化合物等。
性质、制备方法和应用,如铵盐、磷 酸盐等。
非金属的氧化物和含氧酸
性质、制备方法和应用,如硫酸、硝 酸等。
酸碱反应与沉淀溶解平衡
酸碱反应的定义和分类 包括中和反应、水解反应等。
酸碱指示剂和pH值
酸碱指示剂的变色原理和选择,pH 值的测定方法。
沉淀溶解平衡
溶度积常数和溶解度关系,沉淀的生 成、溶解和转化。
缓冲溶液
缓冲溶液的组成和性质,缓冲作用原 理和缓冲溶液的应用。
03
无机化学实验技能与操作
实验室安全知识与操作规范
实验室安全守则
01
遵守实验室规章制度,正确使用实验器材,注意个人及他人安
元素周期表
周期表的排列规律,各族 元素的性质及变化规律, 如s区、p区、d区、f区元 素的性质特点。
元素性质
金属元素与非金属元素的 性质差异,以及元素性质 与原子结构的关系。
化学键与分子结构
化学键
离子键、共价键(σ键和π 键)、金属键等基本概念 及特点。
分子结构
分子的空间构型、键长、 键角等参数,以及分子的 极性和非极性。
【高中化学奥赛课件】第2章 硼族元素

除氧化物 定性分析 陶瓷、玻璃上釉 制 == 4H3BO3+2NaOH H3BO3+OH- == B(OH)4-
PH=9.24
缓冲溶液 洗衣粉填料
3.4 Ga、In、Tl 简介
GaCl2 InCl2 反磁
Ga+[Ga+3Cl4] ||
4S2 4S04P0
Tl+类似于K+与Ag+
3.3.1. 硼酸
B:SP2杂化;存在分子间氢键; 层与层之间的分子作用力结合。
H3BO3是Lewis酸,是一元酸。
其酸性很弱,Ka=5.8×10-10加入多羟 基化合物可增加酸性。
2
H2SO4
H3BO3+3CH3OH== B(OCH3)3+3H2O
•燃烧绿色火焰 •鉴别硼酸及盐
3.3.2. 硼砂 (Na2B4O7·10H2O)
2.2.2 AlCl3的成键特征 AlCl3中铝为SP3杂化
(GaCl3)2 (InCl3)2 (AlBr3)2 (AlI3)2 (GaBr3)2 除B的卤化物及ⅢA的氟化物以外,均为二聚形式。
2.2.3 BX3的成键特征及路易斯酸性
熔点(K)
BF3 (g) 146
沸点(K)
172
键长(pm)(实测) 131
ⅢA B Al Ga In Tl
ns2np1
第二章 硼族元素
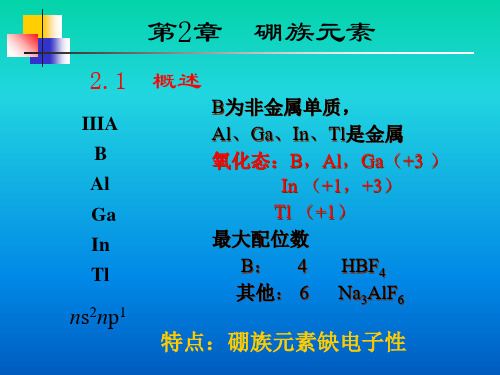
2.1 概述
α-菱形硼
B为非金属单质, Al、Ga、In、Tl是金属 氧化态:B,Al,Ga(+3 )
In (+1,+3) Tl (+1) 最大配位数:
B: 4 例:HBF4 其他 6 例:Na3AlF6
2.2 硼族元素的缺电子性
