高中化学平衡移动的超全知识点总结
选修4 化学平衡的移动 知识点梳理
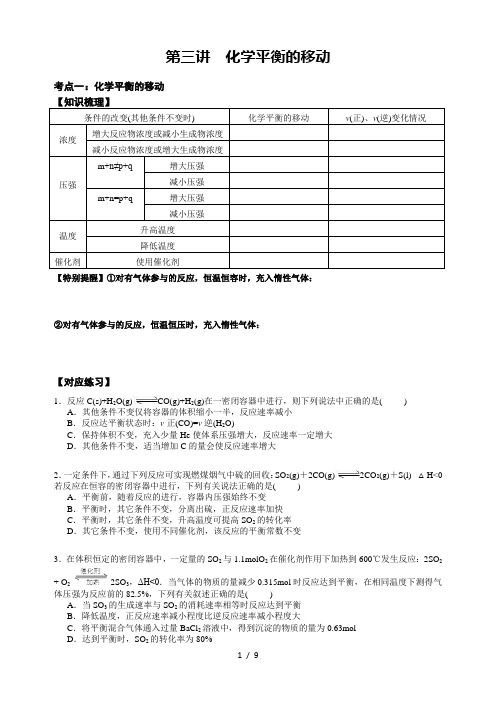
第三讲化学平衡的移动考点一:化学平衡的移动【知识梳理】条件的改变(其他条件不变时) 化学平衡的移动v(正)、v(逆)变化情况浓度增大反应物浓度或减小生成物浓度减小反应物浓度或增大生成物浓度压强m+n≠p+q增大压强减小压强m+n=p+q 增大压强减小压强温度升高温度降低温度催化剂使用催化剂【特别提醒】①对有气体参与的反应,恒温恒容时,充入惰性气体:②对有气体参与的反应,恒温恒压时,充入惰性气体:【对应练习】1.反应C(s)+H2O(g)CO(g)+H2(g)在一密闭容器中进行,则下列说法中正确的是( ) A.其他条件不变仅将容器的体积缩小一半,反应速率减小B.反应达平衡状态时:v正(CO)=v逆(H2O)C.保持体积不变,充入少量He使体系压强增大,反应速率一定增大D.其他条件不变,适当增加C的量会使反应速率增大2.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)2CO2(g)+S(l) △H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )A.平衡前,随着反应的进行,容器内压强始终不变B.平衡时,其它条件不变,分离出硫,正反应速率加快C.平衡时,其它条件不变,升高温度可提高SO2的转化率D.其它条件不变,使用不同催化剂,该反应的平衡常数不变3.在体积恒定的密闭容器中,一定量的SO2与1.1molO2在催化剂作用下加热到600℃发生反应:2SO2+ O2 2SO3,ΔH<0.当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%,下列有关叙述正确的是( )A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡B.降低温度,正反应速率减小程度比逆反应速率减小程度大C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的物质的量为0.63mol4.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g)nY(g) △H = Q kJ/mol。
高中化学选修4 化学平衡的移动

V正 V正=V逆 V逆
V正 = V逆
平衡1 平衡2
时间
m+n=p+q
减小体系的压强,平衡不移动,但正逆反应速 率都减小!
增大压强
速率
V正
V正=V逆
V正 = V逆
V逆
平衡1 平衡2
时间
注意:
m+n=p+q
△
增大体系的压强,平衡不移动,
1.例: I2 + H2
2HI 但浓度增大,颜色加深,正逆
反应速率都加快!
降低温度
v
v
V(正)
V(正)
原平衡
原平衡
V(逆)
V’(逆) V’(正)
新平衡
V(逆)
V’(正) V’(逆)
新平衡
0 正反应 △H ﹥ 0
t 0 正反应△H ﹤ 0
t
平衡往放热方向移动
4 、催化剂对化学平衡的影响
使用催化剂
V正、V逆都增大,且增大的幅度相等
平衡不移动(但到达平衡时间缩短)
速率
V正
V正=V逆
向气体分子数减少的方向移动 向气体分子数增多的方向移动
温度 升高温度 降低温度
催化剂
向吸热反应方向移动 向放热反应方向移动
加入催化剂,平衡不移动
三、化学平衡移动原理(勒夏特列原理)
改变影响平衡的一个条件(如浓度、压强、温度) 平衡就向能够减弱这种改变的方向移动。这就是勒夏 特列原理。
概念的理解: ①影响平衡的因素只有浓度、压强、温度三种;
V(逆)
V’ (逆)
V’ (正)= V’ (逆)
V’ (正)
0
t0
t
减小生成物的浓度
高中化学平衡知识点总结

高中化学平衡知识点总结一、化学平衡的基本概念1. 化学平衡是指在封闭的容器内,反应物与生成物浓度不再发生明显变化的状态。
在平衡状态下,反应物和生成物的浓度保持不变,但是反应仍然在进行。
2. 平衡状态下,正向反应的速率等于反向反应的速率,正向反应和反向反应达到动态平衡。
3. 平衡常数(K)描述了反应在特定温度下达到平衡时,正向反应和反向反应中各个组分的浓度之间的比例关系。
二、平衡常数1. 平衡常数K是在反应达到平衡时,反应物和生成物的浓度之比的一个指标。
2. 平衡常数可以通过平衡反应的速率常数得到,对于一般的平衡反应aA + bB ⇌ cC + dD,其平衡常数表达式为K = [C]^c [D]^d / [A]^a [B]^b。
3. 平衡常数K与反应进行的速率无关,只与反应物和生成物的数量有关。
4. 平衡常数K只与温度有关,与反应物和生成物的浓度、压强、催化剂等无关。
5. 平衡常数的大小可以达到10^12数量级,也可以非常小,接近零。
三、影响化学平衡的因素1. 温度温度对反应平衡常数K值的影响是显著的,通常而言,反应温度越高,平衡常数越大;反之,反应温度越低,平衡常数越小。
化学反应的平衡常数与与温度的关系通过Gibbs自由能与温度的关系来解释。
2. 浓度改变反应物的浓度,可以导致平衡移动到反向或正向。
通常来说,增加反应物的浓度会导致反应向正向移动以达到新的平衡状态。
反之,减少反应物的浓度会导致反应向反向移动以达到新的平衡状态。
3. 压力对于气相反应,改变反应物分子的压力会影响平衡的位置。
通常来说,增加压力会导致反应向物质分子数量较少的方向移动;减小压力则会导致反应向物质分子总数较多的方向移动。
4. 添加催化剂催化剂可以加速反应达到平衡状态,但催化剂对平衡常数K无影响。
四、化学平衡的应用1. 工业生产在工业反应中,通过控制反应条件,可以合理利用化学平衡来提高产品的产率。
2. 环境化学通过对环境中各种物质的化学平衡研究,可以更好地了解环境中的化学反应过程。
高中化学平衡移动知识点总结

高中化学平衡移动知识点总结:
1. 平衡常数(Kc)和平衡表达式:
-平衡常数是表示在平衡时各物质浓度的关系,通常用Kc表示。
-平衡表达式根据反应物和生成物的摩尔比例关系写出,每个物质的浓度用方括号表示。
2. 影响平衡的因素:
-反应物浓度:增加反应物浓度会驱使反应向生成物方向移动,减少反应物浓度则会导致反应向反应物方向移动。
-生成物浓度:增加生成物浓度会导致反应向反应物方向移动,减少生成物浓度则会促使反应向生成物方向移动。
-温度:温度升高通常会使反应向吸热方向移动,降低温度则使反应向放热方向移动。
-压力(对于气体反应):增加压力会使反应向分子数较少的方向移动,减小压力则会促使反应向分子数较多的方向移动。
3. Le Chatelier原理:
-当系统处于平衡状态下,当外界对系统进行扰动时,系统会通过移动平衡来减小扰动。
- Le Chatelier原理指出,当系统受到温度、浓度或压力等因素
的改变时,系统会通过移动平衡来抵消这种改变。
4. 平衡移动的影响:
-加热反应体系:增加温度会使平衡向吸热方向移动,即吸热反应向前进。
-压缩气体反应体系:增加压强会使平衡向分子数较少的方向移动,减小压强则促使平衡向分子数较多的方向移动。
-改变浓度:增加某个物质的浓度会使平衡向相应生成物的方向移动,减小浓度则导致平衡向反应物的方向移动。
5. 平衡移动的时间:
-平衡移动并不是瞬间发生的,它需要一定的时间。
具体时间取决于反应速率和反应机制。
理解平衡移动知识点对于理解化学反应的平衡态及其变化非常重要,帮助我们预测和解释实验结果,并在实际应用中优化反应条件。
化学平衡移动规律总结

化学平衡移动规律总结化学反应是物质转化的过程,而化学平衡则是在反应物和生成物浓度达到一定比例时的状态。
化学平衡的移动规律是指在一定条件下,平衡位置如何随着外界条件的改变而发生变化的规律。
下面将从温度、压力、浓度和催化剂四个方面来总结化学平衡的移动规律。
一、温度影响在化学反应中,温度的改变会影响反应物和生成物的速率以及平衡位置。
根据Le Chatelier定律,当温度升高时,反应速率会增加。
对于吸热反应,升高温度会使平衡位置向右移动,生成物浓度增加;而对于放热反应,升高温度会使平衡位置向左移动,生成物浓度减少。
二、压力影响在气相反应中,压力的改变对平衡位置有一定影响。
根据Le Chatelier定律,当压力增加时,平衡位置会向反应物浓度较小的一侧移动,以减少压力。
对于反应物和生成物摩尔数相等的反应,压力的改变不会影响平衡位置。
而对于摩尔数不相等的反应,压力的增加会使平衡位置向摩尔数较小的一侧移动。
三、浓度影响在溶液中的反应中,溶液浓度的改变会导致平衡位置的移动。
根据Le Chatelier定律,当浓度增加时,平衡位置会向生成物浓度较小的一侧移动,以减少浓度差。
而当浓度减少时,平衡位置会向生成物浓度较大的一侧移动,以增加浓度差。
四、催化剂影响催化剂可以加速化学反应的速率,但不参与反应。
催化剂的加入不会改变平衡位置,因为它同样影响反应物和生成物的速率。
催化剂提供了一个更低的活化能路径,使反应更容易进行,但并不改变反应的平衡位置。
化学平衡的移动规律可以通过调节温度、压力和浓度来实现。
根据Le Chatelier定律,当这些条件发生改变时,平衡位置会向着减少影响的一侧移动,以达到新的平衡状态。
催化剂的加入可以提高反应速率,但不会改变平衡位置。
这些规律的理解和应用对于理解和控制化学反应过程具有重要意义。
知识点总结3 化学平衡的移动

一、化学平衡状态1. 定义:在 下的可逆反应,正反应速率和逆反应速率 ,各物质的浓度保持 的状态。
2. 特征:“动”—— “等”—— “逆”——“定”—— “变”——3. 化学平衡状态的判断二、化学平衡的移动1. 化学平衡移动的概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。
2. 化学平衡移动的本质:正、逆反应速率发生不同程度的改变。
3. 化学平衡移动的标志:(1)反应速率从V 正 = V 逆 → V ’正 ≠ V ’逆→V ’’正 = V ’’逆;(2)各组分的浓度、质量分数、体积分数等由保持一定 → 发生改变 → 再次保持一定。
4. 化学平衡移动的方向:(1)若改变外界条件,引起V 正 > V 逆,则化学平衡向 反应方向移动; (2)若改变外界条件,引起V 正 < V 逆,则化学平衡向 反应方向移动;(3)若改变外界条件,引起V 正和V 逆 都同等程度发生变化,则化学平衡向 移动。
三、影响化学平衡移动的因素(一)浓度变化对化学平衡的影响速率变化V逆瞬间不变,后增大V逆瞬间不变,后减小V正瞬间不变,后增大V正瞬间不变,后减小v-t图像规律总结在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆反应方向移动。
(二)压强变化对化学平衡的影响1. 压强变化对化学平衡的影响规律化学平衡aA(g) + bB(g) ⇌ cC(g) + dD(g)a +b >c+daA(g) + bB(g) ⇌ cC(g) + dD(g)a +b <c+daA(g) + bB(g) ⇌ cC(g) + dD(g)a +b = c+d体系压强变化增大压强减小压强增大压强减小压强增大压强减小压强反应速率变化V正、V逆同时增大;且V’正>V’逆V正、V逆同时减小;且V’正<V’逆V正、V逆同时增大;且V’正<V’逆V正、V逆同时减小;且V’正>V’逆V正、V逆同时增大;且V’正=V’逆V正、V逆同时减小;且V’正=V’逆平衡移动方向正反应方向移动逆反应方向移动逆反应方向移动正反应方向移动不移动不移动v-t 图像规律总结对于有气体参加或生成的化学反应,在其他条件不变的情况下,增大压强,化学平衡向着气体分子数目减小的方向移动;减小压强,化学平衡向着气体分子数目增大的方向移动。
化学平衡移动的总结

化学平衡移动的总结化学平衡是化学反应过程中,反应物与生成物浓度达到一定比例时的一种状态。
在这种状态下,反应物与生成物的浓度之间的比值保持不变,称为平衡常数。
化学平衡的移动是指改变化学平衡条件,使得反应物与生成物的浓度发生变化。
本文将对化学平衡移动进行总结,包括影响化学平衡移动的因素以及如何通过改变这些因素来移动平衡。
一、影响化学平衡移动的因素1. 温度:温度是影响化学平衡移动的重要因素之一。
根据Le Chatelier原理,当反应放热时,提高温度会使平衡向反应物一侧移动,反之则向生成物一侧移动。
这是因为提高温度会增加反应物的动能,促使反应向吸热方向进行,从而使平衡移动。
2. 压力(或浓度):对于气体反应,压力的改变会影响化学平衡的移动方向。
当压力增加时,平衡会向压力较小的一侧移动,以减小压力。
而对于溶液反应,则可以通过改变浓度来移动平衡。
增加反应物浓度会使平衡向生成物一侧移动,反之亦然。
3. 物质的添加或去除:向平衡体系中添加或去除某种物质,会导致平衡移动。
当某种物质被添加到平衡体系中时,平衡会向减少该物质的一侧移动,以恢复平衡。
而当某种物质被去除时,平衡会向补充该物质的一侧移动。
二、移动化学平衡的方法1. 温度控制:通过改变温度,可以移动化学平衡。
例如,对于放热反应,可以通过提高温度来向生成物一侧移动平衡;对于吸热反应,则可以通过降低温度来移动平衡。
2. 压力(或浓度)控制:对于气体反应,可以通过改变压力来移动平衡。
增加压力会使平衡向压力较小的一侧移动,减小压力则相反。
对于溶液反应,可以通过改变浓度来移动平衡。
增加反应物浓度会使平衡向生成物一侧移动,减小反应物浓度则相反。
3. 物质的添加或去除:通过向平衡体系中添加或去除物质,可以移动平衡。
添加某种物质会使平衡向减少该物质的一侧移动,去除某种物质则相反。
三、案例分析1. 铵氨水的制备:铵氨水(氨水和铵盐的混合物)可以通过以下反应制备:NH3(g) + H2O(l) ⇌ NH4OH(aq)在该反应中,平衡向生成物一侧移动。
高一上册期中化学平衡的移动必考知识点总结

高一上册期中化学平衡的移动必考知识点
总结
高一上册期中化学平衡的移动必考知识点总结
1、概念
可逆反应中旧化学平衡的破坏、新化学平衡的建立,由原平衡状态向新化学平衡状态的转化过程,称为化学平衡的移动。
2、化学平衡移动与化学反应速率的关系
(1)v正gt;v逆:平衡向正反应方向移动。
(2)v正=v逆:反应达到平衡状态,不发生平衡移动。
(3)v正lt;v逆:平衡向逆反应方向移动。
lt; p=gt;
3、影响化学平衡的因素
4、“惰性气体”对化学平衡的影响
①恒温、恒容条件
原平衡体系体系总压强增大―→体系中各组分的浓
度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系容器容积增大,各反应气体的分压减
小―→体系中各组分的浓度同倍数减小
5、勒夏特列原理
定义:如果改变影响平衡的一个条件(如C、P或T等),平衡就向能够减弱这种改变的方向移动。
原理适用的范围:已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:外界条件
改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:外界因素对平衡体系的影响占主要方面。
最后,希望精品小编整理的高一上册期中化学平衡的移动必考知识点对您有所帮助,祝同学们学习进步。
官方公众平台--精品高中生正式上线啦,大家可扫描下方的二维码关注,也可搜索微信号“gk51edu”或者直接输入“精品高中生”进行关注!!我们每天会为大家推送最新的内容哦~。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学平衡移动的超全知识点总结
一、化学平衡的移动
1.化学平衡的移动
(1)定义
达到平衡状态的反应体系,条件改变,引起平衡状态被破坏的过程。
(2)化学平衡移动的过程
2.影响化学平衡移动的因素
(1)温度:在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
(2)浓度:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。
(3)压强:对于反应前后总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动。
(4)催化剂:由于催化剂能同时同等程度地增大或减小正反应速率和逆反应速率,故其对化学平衡的移动无影响。
3.勒夏特列原理
在密闭体系中,如果改变影响化学平衡的一个条件(如温度、压强或浓度等),平衡就向能够减弱这种改变的方向移动。
对于反应mA(g)+nB(g)pC(g)+qD(g),分析如下:
2.浓度、压强和温度对平衡移动影响的几种特殊情况
(1)改变固体或纯液体的量,对平衡无影响。
(2)当反应混合物中不存在气态物质时,压强的改变对平衡无影响。
(3)对于反应前后气体体积无变化的反应,如H2(g)+I2(g)2HI(g),压强的改变对平衡无影响。
但增大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。
(4)恒容时,同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响,增大(减小)浓度相当于增大(减小)压强。
(5)在恒容容器中,当改变其中一种气态物质的浓度时,必然会引起压强的改变,在判断平衡移动的方向和物质的转化率、体积分数变化时,应灵活分析浓度和压强对化学平衡的影响。
若用α表示物质的转化率,φ表示气体的体积分数,则:
①对于A(g)+B(g)C(g)类反应,达到平衡后,保持温度、容积不变,加入一定量的A,则平衡向正反应方向移动,α(B)增大而α(A)减小,φ(B)减小而φ(A)增大。
②对于aA(g)bB(g)或aA(g)bB(g)+cC(g)类反应,达到平衡后,保持温度、容积不变,加入一定量的A,平衡移动的方向、A的转化率变化,可分以下三种情况进行分析:
三、化学平衡图象题的解题方法
(曲线a用催化剂,b不用催化剂或化学计量数a+b=c时曲线a的压强大
(3)速率−时间图象
以合成氨反应为例:N2(g)+3H2(g)2NH3(g) ΔH<0。
2.化学平衡图象解答原则
(2)解题步骤
以可逆反应aA(g)+bB(g)cC(g)为例:
(1)“定一议二”原则
这类图象的分析方法是“定一议二”,当有多条曲线及两个以上条件时,
图A表示T2>T1,正反应是放热反应。
(2)对于同一可逆反应,在一定条件(恒温恒容或恒温恒压)下,无论是从正反应(反应物)、逆反应(生成物)或从中间状态(既有反应物、也有生成物)开始,只要建立平衡后,平衡混合物中各组分的比例相同,或各组分在混合物中的百分含量相等,这样的化学平衡互称为等效平衡。
(3)注意只是组分的百分含量相同,包括体积百分含量、物质的量百分含量或质量百分含量,而各组分的浓度不一定相等。
2.审题方法
(1)注意反应特点:反应前后气体的物质的量是否发生变化。
(2)分清平衡建立的条件:是恒温恒压还是恒温恒容。
3.理解等效平衡的意义
(1)对于反应前后气体物质的量有变化的反应,如2SO2(g)+O2(g)
2SO3(g)等温等压、等温等容下建立平衡如下图:
容易得出A与C等效,A与D不等效。
因为C→D是对反应前后气体体积有变化的反应加压,平衡发生了移动。
结论:对于反应前后气体物质的量有变化的反应,恒温恒压时只要起始加入的物质按方程式化学计量数转化到方程式一侧,比例相同就可建立等效平衡;而恒温恒容时,则需起始加入的物质按方程式化学计量数转化到方程式一侧,完全相同才能建立等效平衡,因为反应物物质的量的变化会引起平衡的移动。
(2)对于反应前后气体物质的量没有变化的反应,如:H2(g)+I2(g)
2HI(g)等温等压、等温等容下建立平衡如下图:
容易得出A与C等效,A与D等效。
因为C→D平衡不发生移动。
对反应前后气体体积不变的反应加压,平衡不移动。
结论:对于反应前后气体物质的量不变的反应,无论是恒温恒压还是恒温恒容,只要加入的物质按方程式化学计量数转化到方程式一侧,比例相同就可建立等效平衡。
五、解答化学平衡移动题目的思维模型
六、构建“虚拟的第三平衡”法解决平衡间的联系
在解题时若遇到比较条件改变后的新、旧平衡间某量的关系有困难时,可以考虑构建一个与旧平衡等效的“虚拟的第三平衡”,然后通过压缩或扩大体积等手段,再与新平衡沟通,以形成有利于问题解决的新模式,促使条件向结论转化,例如:
(1)构建等温等容平衡思维模式:新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(2)构建等温等压平衡思维模式(以气体物质的量增加的反应为例(见图示):新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。
