溶出曲线相似性因子f2-差异因子f1自动计算表格
溶出指导原则

附件1普通口服固体制剂溶出度试验技术指导原那么一、前言本指导原那么适用于普通口服固体制剂,包括以下内容:〔1〕溶出度试验的一般要求;〔2〕根据生物药剂学特性建立溶出度标准的方法;〔3〕溶出曲线比拟的统计学方法;〔4〕体内生物等效性试验豁免〔即采用体外溶出度试验代替体内生物等效性试验〕的一般考虑。
本指导原那么还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂〔如片剂和胶囊〕体外溶出度试验方法,有以下作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后〔如处方、生产工艺、生产场所变更和生产工艺放大〕,确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的根底上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统〔BCS〕〔Amidon 1995〕:1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原那么可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性〔IVIVC〕。
溶出度指导原则

附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。
溶出度指导原则

附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验得一般要求;(2)根据生物药剂学特性建立溶出度标准得方法;(3)溶出曲线比较得统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)得一般考虑。
本指导原则还针对药品得处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量与疗效得一致性提出了建议。
附录对溶出度试验得方法学、仪器与操作条件进行了概述、二、背景固体制剂口服给药后,药物得吸收取决于药物从制剂中得溶出或释放、药物在生理条件下得溶解以及在胃肠道得渗透。
由于药物得溶出与溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂与胶囊)体外溶出度试验方法,有下列作用:1、评价药品批间质量得一致性;2.指导新制剂得研发;3。
在药品发生某些变更后(如处方、生产工艺、生产场所变更与生产工艺放大),确认药品质量与疗效得一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物得溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量得一致性、变更以及工艺放大前后药品质量得一致性。
对于新药申请,应提供关键临床试验与/或生物利用度试验用样品以及其她人体试验用样品得体外溶出度数据、对于仿制药申请,应在溶出曲线研究得基础上制定溶出度标准。
无论就是新药还就是仿制药申请,均应根据可接受得临床试验用样品、生物利用度与/或生物等效性试验用样品得溶出度结果,制定溶出度标准、三、生物药剂学分类系统根据药物得溶解性与渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准得依据,也可用于预测能否建立良好得体内-体外相关性(IVIVC)。
溶出曲线f2

溶出曲线f2
溶出曲线F2是一个在药物制剂研究领域中常用的概念,用于描述药物在溶液中的释放行为。
溶出曲线是通过测定药物在不同时间点从制剂中释放到溶液中的量,从而绘制出的曲线。
F2因子是用于评估溶出曲线相似性的一个指标,其值介于0到100之间。
F2因子的计算方法是将溶出曲线的相似因子(f1)和重现性因子(f2)结合在一起,以获得一个综合的相似性评价。
F2因子的计算公式为:
F2 = 50 - (10× |ln(R) - ln(S)|)
其中,R是参比制剂的累计释放率,S是试验制剂的累计释放率。
F2因子的值越高,表示两种制剂的溶出行为越相似。
通常认为,当F2因子大于50时,两种制剂的溶出行为被认为是相似的。
溶出曲线F2的测定通常采用旋转法或桨法进行。
在旋转法中,将药物制剂置于旋转搅拌的溶液中,通过定时取样并测定药物释放量,绘制溶出曲线。
而在桨法中,将药物制剂置于固定搅拌的溶液中,同样通过定时取样并测定药物释放量,绘制溶出曲线。
需要注意的是,溶出曲线F2的测定结果受到多种因素的影响,如制剂的组成、粒径、表面性质、溶解度等。
因此,在药物制剂研发过程中,需要综合考虑这些因素,以获得具有良好溶出性能的药物制剂。
溶出曲线相似性f2因子法评价自动计算表

时间点 n 输入
n=7
时间点Rt(参比制剂平均累积释放度)
Tt(受试制剂平均累积释放度)
517.5822.931043.8442.361568.4067.662085.9385.113097.50100.5045106.19105.4360
105.77
106.48
87.2776968289.89294377
f2=79
相似性判断:相似
方法说明:
溶出曲线的相似性f2因子法评价
Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。
其中如果两条溶出曲线完全一致,则:f2=50×lg(100)=100;如果一批样品释药完全,而另一批尚未开始释药,则有:
因此,f2的值的范围在0~100,而且f2越大,两条曲线的相似性越高。
事实上即使是相同处方的产品,其批次不同,在溶出曲线上也会有一定的差异。
如果受试与参比制剂溶出曲线的差异不大于参比制剂间溶出曲线的差异,那么就可以认为受试与参比制剂溶出曲线具有相似性。
通常认为,同一处方不同批次的样品,在任一取样点释放度的平均差异不超过10%,是可以接受的。
将10%代入式中计算:
因此,FDA与EMEA规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。
0.00
20.00 40.00 60.00 80.00 100.00 120.00 5
10 15 20 30
45
60
平均累积释放度(%)时间点溶出曲线相似性f2因子评价
Rt(参比制剂平均
累积释放度)Tt(受试制剂平均累积释放度)。
溶出实验指导原则

附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。
(完整版)溶出相似性F2因子评价法计算程序20161012

使用说明:pH4.0时间点个数n6n 参比制剂溶出度%Rt自制制剂溶出度%Tt114.2020.50241.4040.00354.7054.30470.6071.20576.0077.10686.9088.30f2因子水时间点个数n6n 参比制剂溶出度%Rt自制制剂溶出度%Tt116.0014.00257.0052.00378.0077.00492.0090.00f2因子pH1.2时间点个数n3n 参比制剂溶出度%Rt自制制剂溶出度%Tt116.0011.00283.0036.00394.0065.00f2因子计算公式只允许修改黄色部分数据若时间点数超过5个,请在黄色部分3、4行之间插入行若时间点数少于5个,请在黄色部分3、4行之间删除行f2因子时间点个数n6 n参比制剂溶出度%Rt自制制剂溶出度%Tt 116.0014.00581.0052.00691.0077.00f2因子(Rt-Tt)*(Rt-39.691.960.160.361.211.9645.348.55666666734.1859531476.69238465(Rt-Tt)*(Rt-Tt)42514346.66666666738.7298334679.40228148(Rt-Tt)*(Rt-Tt)2522098413075#DIV/0!插入行删除行0.0020.0040.0060.0080.00100.00释放度%#DIV/0! #DIV/0!(Rt-Tt)*(Rt-Tt)48411961041174.57.570111641 43.955114220.00%20.00%40.00%60.00%80.00%00.00%012345时间min原研与自制样品溶出曲线拟合(水)原研自制。
f2值计算溶出相似要求

F2值计算溶出相似要求概述在药物开发和质量控制中,溶出测试是评价药物释放性能和质量一致性的关键步骤之一。
为了确保药物的有效性和稳定性,药物溶出曲线需要满足一定的相似性要求。
本文将介绍如何计算F2值来评估药物溶出曲线之间的相似性。
溶出曲线相似性衡量药物溶出曲线相似性的指标主要有Q值和F2值。
其中,Q值是基于相似因子(SF)计算的,而F2值是基于相对预测误差(RPE)计算的。
相似因子(S F)相似因子(S F)是衡量两个溶出曲线相似性的常用指标。
S F的计算公式如下所示:```S F=50*lo g[(1+(1/n)*Σ(t1-t2)^2)^(-0.5)*100]```其中,n为取样时间点数,t1和t2为各时间点的溶出百分比。
相对预测误差(R P E)相对预测误差(R PE)是评价溶出曲线相似性的另一种方法。
RP E的计算公式如下:```R P E=[(Σ(t1-t2)^2)/(Σt1^2)]*100```其中,t1和t2为各时间点的溶出百分比。
F2值的计算F2值是基于相对预测误差(RP E)计算的,其计算公式如下:```F2=50*lo g[(1+(RPE)^0.5*100)^(-1)]```F2值的解释F2值的范围通常在0到100之间,数值越高表示溶出曲线相似性越好。
根据美国药典(U SP)的要求,F2值在50到100之间被认为是合格的,表示溶出曲线具有良好的相似性。
F2值的应用F2值的计算可以帮助药物研发人员和质量控制人员评估药物溶出性能和质量一致性。
通过比较不同批次、不同具体剂型、不同工艺条件或不同包装材料的溶出曲线的F2值,可以及时发现潜在的问题并采取相应的措施。
结论F2值作为衡量溶出曲线相似性的重要指标,在药物开发和质量控制领域发挥着重要作用。
通过对溶出曲线进行F2值的计算和比较,可以有效评估药物溶出性能和质量一致性,为药物研发和质量控制提供科学的依据。
---以上就是关于F2值计算溶出相似要求的文档内容,希望对您有所帮助。
溶出度指导原则

附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。
f2因子法计算电子表格
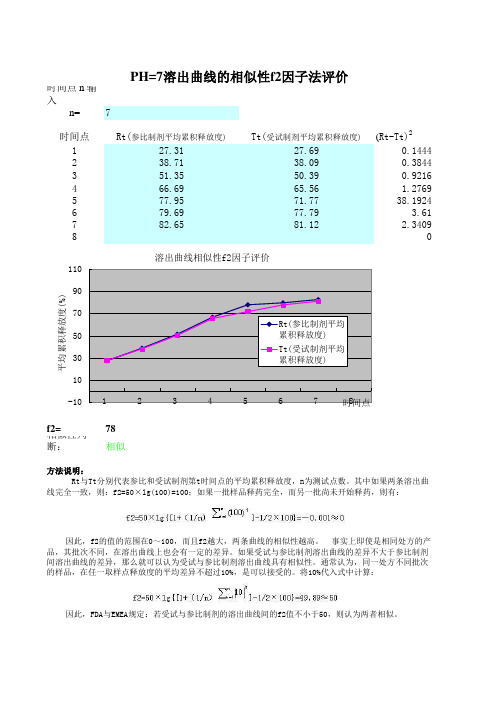
时间点 n 输入n=7时间点Rt(参比制剂平均累积释放度)Tt(受试制剂平均累积释放度)(Rt-Tt)2127.3127.690.1444238.7138.090.3844351.3550.390.9216466.6965.56 1.2769577.9571.7738.1924679.6977.79 3.61782.6581.122.34098f2=78相似性判断:相似方法说明:PH=7溶出曲线的相似性f2因子法评价Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。
其中如果两条溶出曲线完全一致,则:f2=50×lg(100)=100;如果一批样品释药完全,而另一批尚未开始释药,则有:因此,f2的值的范围在0~100,而且f2越大,两条曲线的相似性越高。
事实上即使是相同处方的产品,其批次不同,在溶出曲线上也会有一定的差异。
如果受试与参比制剂溶出曲线的差异不大于参比制剂间溶出曲线的差异,那么就可以认为受试与参比制剂溶出曲线具有相似性。
通常认为,同一处方不同批次的样品,在任一取样点释放度的平均差异不超过10%,是可以接受的。
将10%代入式中计算:因此,FDA与EMEA规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。
-101030507090110 123456 78平均累积释放度(%)时间点溶出曲线相似性f2因子评价Rt(参比制剂平均累积释放度)Tt(受试制剂平均累积释放度)f2因子的应用条件及注意事项:1.在进行参比与受试制剂的溶出曲线比较的过程中,时间点间隔无需相等,但两者所取各时间点必须一致,一般除0时外,选择3点以上,即n≥3。
2.f2计算公式只适用于受试与参比制剂的平均累积释放度差值<100时的溶出曲线比较(如果二者的差值>100,就会得到一个负值),普通口服制剂要保证药物溶出90%以上,缓释制剂、肠溶制剂药物释放需达到80%以上,或达到释放平台。
溶出相似性F2因子评价法计算程序20161012

溶出相似性F2因子评价法计算程序20161012使用说明:pH4.0时间点个数n6n 参比制剂溶出度%Rt自制制剂溶出度%Tt114.2020.50241.4040.00354.7054.30470.6071.20576.0077.1 0686.9088.30f2因子水时间点个数n6n 参比制剂溶出度%Rt自制制剂溶出度%Tt116.0014.00257.0052.00378.0077.00492.0090.00f2因子pH1.2时间点个数n3n 参比制剂溶出度%Rt自制制剂溶出度%Tt116.0011.00283.0036.00394.0065.00f2因子计算公式只允许修改黄色部分数据若时间点数超过5个,请在黄色部分3、4行之间插入行若时间点数少于5个,请在黄色部分3、4行之间删除行f2因子时间点个数n6 n参比制剂溶出度%Rt自制制剂溶出度%Tt 116.0014.00581.0052.00691.0077.00f2因子pH4.0(Rt-Tt)*(Rt-Tt)时间原研自制39.6930min 14.2%20.5%1.9660min 41.4%40.0%0.1690min 54.7%54.3%0.36180min 70.6%71.2%1.21240min 76.0%77.1%1.96480min86.9%88.3%45.348.55666666734.1859531476.69238465(Rt-Tt)*(Rt-Tt)水4时间原研自制2530min 14.90%20.5%160min 41.40%40.2%4240min 75.50%74.0%34480min85.9%85.1%6.66666666738.7298334679.40228148(Rt-Tt)*(Rt-Tt)pH1.225时间原研自制220960min 38.6%39.6%84190min 50.3%51.9%3075120min55.7%57.0%#DIV/0!插入行删除行0.020.040.060.080.0100.0释放度%0.020.040.060.080.0100.0释放度%#DIV/0!(Rt-Tt)*(Rt-Tt)48411961041174.57.57011164143.955114220.0%20.0%40.0%60.0%80.0%100.0%01234567时间min原研与自制样品溶出曲线拟合(pH4.0)原研自制0.00%20.00%40.00%60.00%80.00%100.00%012345时间min原研与自制样品溶出曲线拟合(水)原研自制。
溶出度指导原则之欧阳道创编

附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。
溶出度指导原则

附件 1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。
2015普通口服固体制剂-溶出度试验-技术指导原则

附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。
溶出指导原则

附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。
本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。
附录对溶出度试验的方法学、仪器和操作条件进行了概述。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。
由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用:1.评价药品批间质量的一致性;2.指导新制剂的研发;3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。
对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。
对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。
无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。
溶出指导原则

附件1普通口服固体制剂溶出度试验技术指导原则一、前言本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验得一般要求;(2)根据生物药剂学特性建立溶出度标准得方法;(3)溶出曲线比较得统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)得一般考虑。
本指导原则还针对药品得处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量与疗效得一致性提出了建议。
附录对溶出度试验得方法学、仪器与操作条件进行了概述。
二、背景固体制剂口服给药后,药物得吸收取决于药物从制剂中得溶出或释放、药物在生理条件下得溶解以及在胃肠道得渗透。
由于药物得溶出与溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。
基于上述考虑,建立普通口服固体制剂(如片剂与胶囊)体外溶出度试验方法,有下列作用:1。
评价药品批间质量得一致性;2。
指导新制剂得研发;3、在药品发生某些变更后(如处方、生产工艺、生产场所变更与生产工艺放大),确认药品质量与疗效得一致性。
在药品批准过程中确定溶出度标准时,应考虑到药物得溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量得一致性、变更以及工艺放大前后药品质量得一致性。
对于新药申请,应提供关键临床试验与/或生物利用度试验用样品以及其她人体试验用样品得体外溶出度数据。
对于仿制药申请,应在溶出曲线研究得基础上制定溶出度标准。
无论就是新药还就是仿制药申请,均应根据可接受得临床试验用样品、生物利用度与/或生物等效性试验用样品得溶出度结果,制定溶出度标准。
三、生物药剂学分类系统根据药物得溶解性与渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon1995):1类:高溶解性–高渗透性药物2类:低溶解性–高渗透性药物3类:高溶解性–低渗透性药物4类:低溶解性–低渗透性药物上述分类原则可作为制定体外溶出度质量标准得依据,也可用于预测能否建立良好得体内—体外相关性(IVIVC)。
溶出曲线F2计算模版补液

溶出度自动计算表—提示:请在以下空白单元格中输入数据!
110.0 100.0 90.0
80.0
样1
样2 样3 样4
样5
70.0
样6 样7 样8
样9
溶出率(%)
60.0 50.0 40.0
30.0
样10 样11 20.0 10.0
0.0
样12
平均值
0
10
20
30
40
50
60
70
参比制剂
时间(分)
2/2
溶出度自动计算表—提示:请在以下空白单元格中输入数据! 1、样品信息 样品名称 样品规格(mg/片) 2、对照品信息 对照品名称 对照品纯度(%) 3、实验条件 溶出介质 仪器装置 转速(rpm) 检测仪器 数据存储路径 4、对照品溶液峰ห้องสมุดไป่ตู้积/吸光度 对照品编号 称样量(mg) 稀释倍数 对照1 样品批号 样品来源 对照品批号 对照品来源 介质体积(mL) 取样体积(mL) 溶出液取样后稀释倍数 溶出设备
对照2
浓度(mg/mL) 峰面积/吸光度 校正因子f N/A N/A N/A N/A N/A N/A N/A N/A
f平均值
RSD(%)
N/A
N/A
5、供试品溶液峰面积/吸光度 5分钟 10分钟 15分钟 20分钟 30分钟 45分钟 60分钟 样1 样2 样3 样4 样5 样6 样7 样8 样9 样10 样11 样12 基本公式:C对:A对=C供:A供 又C对=W对/R对,C供=C溶原/R供,代入基本公式,则有:(W对/R对):A对=(C溶原/R供):A供 整理后,C溶原=[(W对/A对)/R对]平均*R供*A供,又[(W对/A对)/R对]平均=f平均值,则有:C溶原=f平均值*R供*A C溶原-规定取样时刻溶出液浓度;C对-对照品溶液浓度;W对-对照品称样量;A对-对照品溶液峰面积/吸光度; A供-供试品溶液峰面积/吸光度;R对-对照品的稀释倍数;R供-规定取样时刻取出的溶出原液的稀释倍数 6、各取样时刻溶出液的浓度(C溶原,mg/mL) 5分钟 10分钟 15分钟 20分钟 30分钟 45分钟 60分钟 样1 N/A N/A N/A N/A N/A N/A N/A 样2 N/A N/A N/A N/A N/A N/A N/A 样3 N/A N/A N/A N/A N/A N/A N/A 样4 N/A N/A N/A N/A N/A N/A N/A 样5 N/A N/A N/A N/A N/A N/A N/A 样6 N/A N/A N/A N/A N/A N/A N/A 样7 N/A N/A N/A N/A N/A N/A N/A 样8 N/A N/A N/A N/A N/A N/A N/A 样9 N/A N/A N/A N/A N/A N/A N/A 样10 N/A N/A N/A N/A N/A N/A N/A 样11 N/A N/A N/A N/A N/A N/A N/A 样12 N/A N/A N/A N/A N/A N/A N/A 7、样品累积溶出度结果(Q%) Q% t=[Ct*介质体积+(C1+C2+…+Ct-1)*取样体积]/样品规格*100% 5 10 15 20 30 45 60 样1 N/A N/A N/A N/A N/A N/A N/A 样2 N/A N/A N/A N/A N/A N/A N/A 样3 N/A N/A N/A N/A N/A N/A N/A
溶出曲线f2计算公式(二)

溶出曲线f2计算公式(二)溶出曲线f2计算公式1. 引言溶出曲线(dissolution profile)是用于评估药物在体外释放行为的一种重要手段。
通过分析溶出曲线,可以了解药物在给定时间内的溶出速率和程度,从而评估药物的溶出特性和释放机制。
其中,溶出曲线f2计算公式是一种常用的方法,能够衡量两个溶出曲线之间的相似度。
2. 溶出曲线f2计算公式溶出曲线f2计算公式是根据United States Pharmacopeia (USP)所提出的方法,用于比较两个溶出曲线之间的相似程度。
其计算公式如下:f2 = 50 * log [1 + (1/n) * Σ (Rt - Tt)^2]^其中,f2表示两个溶出曲线的相似度,n表示样品点的数量,Rt 和Tt分别表示参考品和试验品在每个时间点上的累积溶出量。
3. 参考例子为了更好地理解溶出曲线f2计算公式的应用,我们来看一个具体的例子:假设有一种药物A的溶出曲线如下表所示:时间(小时) | 累积溶出量(%) |||| | 1 | | | 2 | | | 3 | | | 4 | | | 5 | | | 6 | |现在我们要比较这个溶出曲线与参考品的溶出曲线B是否相似。
参考品的溶出曲线B如下表所示:时间(小时) | 累积溶出量(%) |||| | 1 | | | 2 | | | 3 | | | 4 | | | 5 | | | 6 | |根据上述数据,我们可以利用溶出曲线f2计算公式计算相似度f2的数值:1.首先,计算样品点的数量n,这里n=6。
2.然后,计算每个时间点上的差值(Rt - Tt),并计算差值的平方。
3.将所有差值的平方相加,并除以n。
4.代入公式计算f2的数值。
根据以上步骤,我们可以计算出样品A与参考品B之间的相似度f2的数值。
4. 结论通过以上的例子,我们可以看到溶出曲线f2计算公式的应用。
该计算公式能够客观地评估两个溶出曲线之间的相似度,从而判断药物的溶出特性和释放机制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
该自动计算表格用于非模型依赖法或模型依赖方法进行溶出曲线的比较,同时计算差异因子(f1)和相似因子(f2)。
受试样品和参比样品各12片或6片均可,直接用溶出度的数据代替表格中的数据即可自动计算出f1和f2。
(一)非模型依赖法
非模型依赖的相似因子法
1、采用差异因子(f1)或相似因子(f2)来比较溶出曲线是一种简单的非模型依赖方法。
差异因子(f1)法是计算两条溶出曲线在每一时间点的差异(%),是衡量两条曲线相对偏差的参数。
2、相似因子(f2)是衡量两条溶出曲线相似度的参数。
差异因子和相似因子的具体测定步骤如下:
(1)分别取受试(变更后)和参比样品(变更前)各12片(粒),测定其溶出曲线。
(2)取两条曲线上各时间点的平均溶出度值,根据上述公式计算差异因子(f1)或相似因子(f2)。
(3)f1值越接近0,f2值越接近100,则认为两条曲线相似。
一般情况下,f1值小于15或f2值高于50,可认为两条曲线具有相似性,受试(变更后)与参比产品(变更前)具有等效性。
