溶出曲线的相似性f2因子法评价
溶出曲线指导原则

普通口服固体制剂溶出曲线测定与比较指导原则本指导原则适用于仿制药质量一致性评价中普通口服固体制剂溶出曲线测定方法的建立和溶出曲线相似性的比较。
一、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透等,因此,药物的体内溶出和溶解对吸收具有重要影响。
体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。
普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。
溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临床疗效差异的风险。
二、溶出试验方法的建立溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。
可参考有关文献,了解药物的溶解性、渗透性、pKa常数等理化性质,考察溶出装置、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。
(一)溶出仪溶出仪需满足相关的技术要求,应能够通过机械验证及性能验证试验。
必要时,可对溶出仪进行适当改装,但需充分评价其必要性和可行性。
溶出试验推荐使用桨法、篮法,一般桨法选择50—75转/分钟,篮法选择50—100转/分钟。
在溶出试验方法建立的过程中,转速的选择推荐由低到高。
若转速超出上述规定应提供充分说明。
(二)溶出介质溶出介质的研究应根据药物的性质,充分考虑药物在体内的环境,选择多种溶出介质进行,必要时可考虑加入适量表面活性剂、酶等添加物。
1.介质的选择应考察药物在不同pH值溶出介质中的溶解度,推荐绘制药物的pH-溶解度曲线。
在确定药物主成分稳定性满足测定方法要求的前提下,推荐选择不少于3种pH值的溶出介质进行溶出曲线考察,如选择pH值1.2、4.5和6.8的溶出介质。
对于溶解度受pH值影响大的药物,可能需在更多种pH值的溶出介质中进行考察。
推荐使用的各种pH值溶出介质的制备方法见附件。
当采用pH7.5以上溶出介质进行试验时,应提供充分的依据。
溶出曲线f2

溶出曲线f2
溶出曲线F2是一个在药物制剂研究领域中常用的概念,用于描述药物在溶液中的释放行为。
溶出曲线是通过测定药物在不同时间点从制剂中释放到溶液中的量,从而绘制出的曲线。
F2因子是用于评估溶出曲线相似性的一个指标,其值介于0到100之间。
F2因子的计算方法是将溶出曲线的相似因子(f1)和重现性因子(f2)结合在一起,以获得一个综合的相似性评价。
F2因子的计算公式为:
F2 = 50 - (10× |ln(R) - ln(S)|)
其中,R是参比制剂的累计释放率,S是试验制剂的累计释放率。
F2因子的值越高,表示两种制剂的溶出行为越相似。
通常认为,当F2因子大于50时,两种制剂的溶出行为被认为是相似的。
溶出曲线F2的测定通常采用旋转法或桨法进行。
在旋转法中,将药物制剂置于旋转搅拌的溶液中,通过定时取样并测定药物释放量,绘制溶出曲线。
而在桨法中,将药物制剂置于固定搅拌的溶液中,同样通过定时取样并测定药物释放量,绘制溶出曲线。
需要注意的是,溶出曲线F2的测定结果受到多种因素的影响,如制剂的组成、粒径、表面性质、溶解度等。
因此,在药物制剂研发过程中,需要综合考虑这些因素,以获得具有良好溶出性能的药物制剂。
普通口服固体制剂溶出曲线测定与比较指导原则

附件2 【2 】通俗口服固体系体例剂溶出曲线测定与比较指点原则本指点原则实用于仿造药质量一致性评价中通俗口服固体系体例剂溶出曲线测定办法的树立和溶出曲线类似性的比较.一.背景固体系体例剂口服给药后,药物的接收取决于药物从制剂中的溶出或释放.药物在心理前提下的消融以及在胃肠道的渗入渗出等,是以,药物的体内溶出和消融对接收具有主要影响.体外溶出实验常用于指点药物制剂的研发.评价制剂批内批间质量的一致性.评价药品处方工艺变更前后质量和疗效的一致性等.通俗口服固体系体例剂,可采用比较仿造制剂与参比制剂体外多条溶出曲线类似性的办法,评价仿造制剂的质量.溶出曲线的类似并不意味着两者必定具有生物等效,但该法可下降两者消失临床疗效差异的风险.二.溶出实验办法的树立溶出实验办法应能客不雅反应制剂特色.具有恰当的敏锐度和区分力.可参考有关文献,懂得药物的消融性.渗入渗出性.pKa 常数等理化性质,考核溶出装配.介质.搅拌速度和取样距离期等实验前提,肯定合适的实验办法.(一)溶出仪溶出仪需知足相干的技巧请求,应可以或许经由过程机械验证及机能验证实验.必要时,可对溶出仪进行恰当改装,但需充分评价其必要性和可行性.溶出实验推举应用桨法.篮法,一般桨法选择50—75转/分钟,篮法选择50—100转/分钟.在溶出实验办法树立的进程中,转速的选择推举由低到高.若转速超出上述划定应供给充分辩明.(二)溶出介质溶出介质的研讨应根据药物的性质,充分斟酌药物在体内的情形,选择多种溶出介质进行,必要时可斟酌参加适量表面活性剂.酶等添加物.1.介质的选择应考核药物在不同pH值溶出介质中的消融度,推举绘制药物的pH-消融度曲线.在肯定药物主成分稳固性知足测定办法请求的前提下,推举选择不少于3种pH值的溶出介质进行溶出曲线考核,如选择pH值1.2.4.5和6.8的溶出介质.对于消融度受pH值影响大的药物,可能需在更多种pH值的溶出介质中进行考核.推举应用的各类pH值溶出介质的制备办法见附件.当采用pH7.5以上溶出介质进行实验时,应供给充分的根据.水可作为溶出介质,但应用时应考核其pH值和表面张力等身分对药物及辅料的影响.2.介质体积推举选择500ml.900ml或1000ml.(三)溶出曲线的测定1.溶出曲线测准时光点的选择取样时光点可为5和/或10.15和/或20.30.45.60.90.120分钟,此后每隔1小时进行测定.2.溶出曲线考核截止时光点的选择以下任何一个前提均可作为考核截止时光点选择的根据.(1)持续两点溶出量均达85%以上,且差值在5%以内.一般在酸性溶出介质(pH1.0—3.0)中考核时光不超过2小时.(2)在其他各pH值溶出介质中考核时光不超过6小时.(四)溶出前提的优化在截止时光内,药物在所有溶出介质中平均溶出量均达不到85%时,可优化溶出前提,直至消失一种溶出介质达到85%以上.优化次序为进步转速,参加适量的表面活性剂.酶等添加物.表面活性剂浓度推举在0.01%—1.0%(W/V)规模内依次递增,特别品种可适度增长浓度.某些特别药品的溶出介质可应用人工胃液和人工肠液.(五)溶出办法的验证办法树立后应进行必要的验证,如:精确度.周详度.专属性.线性.规模和耐用性等.三.溶出曲线类似性的比较溶出曲线类似性的比较,多采用非模子依附法中的类似因子(f2)法.该法溶出曲线类似性的比较是将受试样品的平均溶出量与参比样品的平均溶出量进行比较.平均溶出量应为12片(粒)的均值.盘算公式:}100])()/1(1{[505.0122•-+•=-=∑nt t t T R n f lgR t 为t 时光参比样品平均溶出量; T t 为t 时光受试样品平均溶出量; n 为取样时光点的个数.(一)采用类似因子(f 2)法比较溶出曲线类似性的请求 类似因子(f 2)法最合适采用3—4个或更多取样点且应知足下列前提:1.应在完整雷同的前提下对受试样品和参比样品的溶出曲线进行测定.2.两条溶出曲线的取样点应雷同.时光点的拔取应尽可能以溶出量等分为原则,并统筹整数时光点,且溶出量超过85%的时光点不超过1个.3.第1个时光点溶出成果的相对标准误差不得过20%,自第2个时光点至最后时光点溶出成果的相对标准误差不得过10%.(二)溶出曲线类似性剖断标准1.采用类似因子(f2)法比较溶出曲线类似性时,一般情形下,当两条溶出曲线类似因子(f2)数值不小于50时,可以为溶出曲线类似.2.当受试样品和参比样品在15分钟的平均溶出量均不低于85%时,可以为溶出曲线类似.四.其他(一)溶出曲线类似性的比较应采用同剂型.同规格的制剂.(二)当溶出曲线不能采用类似因子(f2)法比较时,可采用其他合适的比较法,但在应用时应赐与充分论证.附:溶出介质制备办法附溶出介质制备办法一.盐酸溶液取表1中划定量的盐酸,用水稀释至1000ml,摇匀,即得.表1 盐酸溶液的配制二.醋酸盐缓冲液取表2中划定物资的取样量,用水消融并稀释至1000ml,摇匀,即得.表2 醋酸盐缓冲溶液的配制2mol/L醋酸溶液:取冰醋酸120.0g(114ml)用水稀释至1000ml,摇匀,即得.三.磷酸盐缓冲液取0.2mol/L磷酸二氢钾溶液250ml与表3中划定量的0.2mol/L氢氧化钠溶液混杂,用水稀释至1000ml,摇匀,即得.表3 磷酸盐缓冲液0.2mol/L磷酸二氢钾溶液:取磷酸二氢钾27.22g,加水消融并稀释至1000ml.0.2mol/L氢氧化钠溶液:取氢氧化钠8.00g,加水消融并稀释至1000ml.以上为推举采用的溶出介质配制办法,若有必要,研讨者也可根据具体情形采用其他的溶出介质以及响应的配制办法.。
采用f2因子法评价溶出曲线的相似性需注意的问题

发布日20070806期栏目化药药物评价标题采用f2因子法评价溶出曲线的相似性需注意的问题正文审评四部审评八室马玉楠在制剂的开发研究中,通过对比不同处方之间的溶出曲线,可以较准确地反映药物处方、工艺、生产场地及规模等因素变化对药物体外释放行为的影响。
近年来,国外针对溶出曲线的相似性评价方法报道很多,其中f2因子方法因为计算简单、判定结果可靠,作为评价体外溶出曲线相似性的方法,已经被美国FDA的CDER和欧盟EMEA收载并推荐使用。
F2因子的计算公式为:Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。
其中如果两条溶出曲线完全一致,则:f2=50×lg(100)=100;如果一批样品释药完全,而另一批尚未开始释药,则有:。
因此,f2的值的范围在0~100,而且f2越大,两条曲线的相似性越高。
事实上即使是相同处方的产品,其批次不同,在溶出曲线上也会有一定的差异。
如果受试与参比制剂溶出曲线的差异不大于参比制剂间溶出曲线的差异,那么就可以认为受试与参比制剂溶出曲线具有相似性。
通常认为,同一处方不同批次的样品,在任一取样点释放度的平均差异不超过10%,是可以接受的。
将10%代入式中计算:。
因此,FDA与EMEA规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。
在某些情况下,如果对于任一取样点释放度的平均差异的限定不是10%,则可通过计算得出相应的f2值(临界值)。
表1提供了一些释放度平均差异与相应的f2临界值。
表1 释放度平均差异与f2临界值表Table 1 Average difference of drug release percent and f2Limit平均偏差(Average difference) 2% 5% 10% 15% 20%F2临界值(f2 Limit) 83 65 50 41 36f2因子的应用条件及注意事项:1.在进行参比与受试制剂的溶出曲线比较的过程中,时间点间隔无需相等,但两者所取各时间点必须一致,一般除0时外,选择3点以上,即n≥3。
f2因子法评价头孢克肟颗粒溶出曲线相似性

’ 通讯作者 ,E malvpce g i z tm.d . - i i. n y@g hc euc : h n
60 9
f因子 法 评 价 头 孢 克 肟 颗 粒 溶 出 曲线 相 似 性 1
陈 伟 鸿 等
8 .% , 中检 所 提 供 ,批 号 :3 5 32 0 0 ) 52 1 0 0 —0 8 3 ;头 孢
克 肟 颗 粒 ( 试 制 剂 ,A) 试 产 品 三批 ,批 号分 别 受 -中
为 l 0 2 、 1 0 2 、 1 0 2 ,批 规 模 : 1 万 袋 ) 0 15 0 16 0 17 0 ;
p .磷 酸 盐 缓 冲 液 ( BS 72 :A= .5 9 . H72 P .) 00 6 C
Ch n W e — o g S n — a g Ch n , i io L u Gu — o g a d Zh n - i g e i n , u Ya g y n , e g Yi Hu Ru - a , i o h n n a g Ke q n h b
( olg f hn s t i dc , u n z o nv ri f hn s eiieGun z o 10 6 C l e iee e a e oC Ma r Me i G ag h uU iesyo iee dc , a gh u5 0 ) a t C M n 0
抗 生 素 ,特 别 是 对 革 兰 阳 性 菌 中 的链 球 菌 属 、肺 炎
可 以有效避 免难 溶性 药物 沉淀 杯底 而漏服 药物 。头 孢 克肟 在体 内溶 出度是 影 响生物 吸 收性能 的重要 参数 ,
球菌、革兰阴性菌中的淋 球菌 等显示 比其它 口头孢
服 更 强 的 抗 菌 作 用 ,其 作 用 为 杀菌 。该 药 是 迄 今 为
溶出曲线F2的使用
药物溶出曲线一致性评价的气息让不少公司不少战友憋足了气,接下来会怎样发展我不想做任何预测或评论。
但对于固体仿制药,如需做体外溶出曲线考察评价,则首推采用F2因子,这点已经无疑。
近来与同事讨论F2相关方法,各有秉持,虽不是什么大分歧,终归还是不利于工作的开展。
因此笔者有意翻阅谢沐风老师撰写的溶出系列,读后虽觉已多方考虑,但难免无法涵盖工作中遇到的所有情况,故又查找相关的国外文献进行解疑。
自己稍稍总结之后又将谢老师几十页的溶出贴从头学习一遍,且做为“实战”丰富经验。
在此将我的一点心得贴出,希望能为大家的工作稍作一些补充(不仅限于一致性评价,对于3类6类药的开发也适用)。
同时也恳请大家分享一些相关的心得经验。
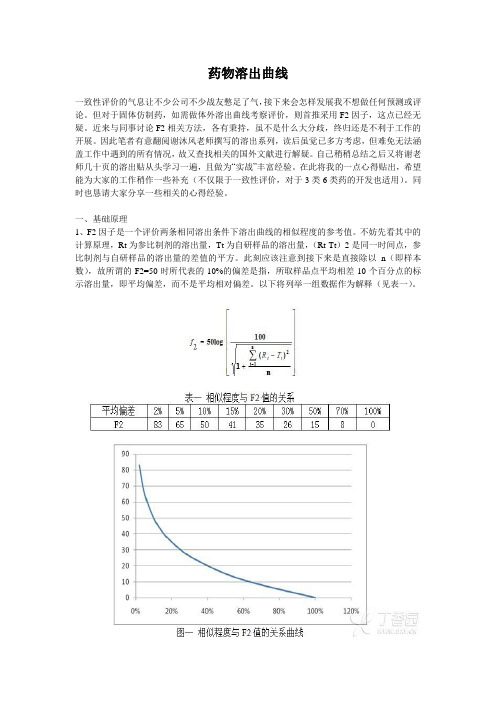
一、基础原理1、F2因子是一个评价两条相同溶出条件下溶出曲线的相似程度的参考值。
不妨先看其中的计算原理,Rt为参比制剂的溶出量,Tt为自研样品的溶出量,(Rt-Tt)2是同一时间点,参比制剂与自研样品的溶出量的差值的平方。
此刻应该注意到接下来是直接除以n(即样本数),故所谓的F2=50时所代表的10%的偏差是指,所取样品点平均相差10个百分点的标示溶出量,即平均偏差,而不是平均相对偏差。
以下将列举一组数据作为解释(见表一)。
常见的问题是如何取点。
谢沐风老师的溶出系列里面已经分列多种情况,但我思考的是究竟不同选点意味着什么?请见表二。
表二4个自研样品与参比制剂的F2值此处不用在意选点是否符合要求,列举这些并计算旨在揭示选点的奥妙。
参比制剂在第四个时间点溶出85%,计算时随着超过85%的点的增加,F2值有增加的趋势。
样品2的F2之所以减少,是因为74与72两者之间代表的偏差极小,而且样品2的曲线与参比制剂的曲线近似平行,可视为正常波动。
而48到52、32与36那却是个质的不一样。
也因此才有超过85%只取一个点。
表三中,样品1与参比制剂各点差值均不超过8%,F2计得60.03;样品2在第1个点有15%的差异,其他点均少于8%,F2计得51.09;样品3在第3个点有超过12%的差异,其他点均少于10%,F2计得51.20;样品4在第1个点有超过19%的差异,其他点完全一致,F2计得50.06;样品5在第2个点有超过17%的差异,其他点均少于10%,F2计得48.05。
(完整版)溶出相似性F2因子评价法计算程序20161012

使用说明:pH4.0时间点个数n6n 参比制剂溶出度%Rt自制制剂溶出度%Tt114.2020.50241.4040.00354.7054.30470.6071.20576.0077.10686.9088.30f2因子水时间点个数n6n 参比制剂溶出度%Rt自制制剂溶出度%Tt116.0014.00257.0052.00378.0077.00492.0090.00f2因子pH1.2时间点个数n3n 参比制剂溶出度%Rt自制制剂溶出度%Tt116.0011.00283.0036.00394.0065.00f2因子计算公式只允许修改黄色部分数据若时间点数超过5个,请在黄色部分3、4行之间插入行若时间点数少于5个,请在黄色部分3、4行之间删除行f2因子时间点个数n6 n参比制剂溶出度%Rt自制制剂溶出度%Tt 116.0014.00581.0052.00691.0077.00f2因子(Rt-Tt)*(Rt-39.691.960.160.361.211.9645.348.55666666734.1859531476.69238465(Rt-Tt)*(Rt-Tt)42514346.66666666738.7298334679.40228148(Rt-Tt)*(Rt-Tt)2522098413075#DIV/0!插入行删除行0.0020.0040.0060.0080.00100.00释放度%#DIV/0! #DIV/0!(Rt-Tt)*(Rt-Tt)48411961041174.57.570111641 43.955114220.00%20.00%40.00%60.00%80.00%00.00%012345时间min原研与自制样品溶出曲线拟合(水)原研自制。
溶出度指导原则精选版

溶出度指导原则Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】普通口服固体制剂溶出曲线?测定与比较指导原则(2015-11-09 16:15:30)分类:普通口服固体制剂溶出曲线测定与比较指导原则一、概述为进一步推进仿制药与原研药品质量和疗效一致性评价工作的开展,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)要求,制定本指导原则。
本指导原则适用于仿制药质量一致性评价中普通口服固体制剂溶出曲线测定方法的建立和溶出曲线相似性的比较。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透等,因此,药物的体内溶出和溶解对吸收具有重要影响。
体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。
普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。
溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临床疗效差异的风险。
三、溶出试验方法的建立溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。
可参考有关文献,了解药物的溶解性、渗透性、pKa常数等理化性质,考察溶出装置、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。
(一)溶出仪溶出仪需满足相关的技术要求,应能够通过机械验证及性能验证试验。
必要时,可对溶出仪进行适当改装,但需充分评价其必要性和可行性。
溶出试验推荐使用桨法、篮法,一般桨法选择50~75转/分钟,篮法选择50~100转/分钟。
在溶出试验方法建立的过程中,转速的选择推荐由低到高。
若转速超出上述规定应提供充分说明。
(二)溶出介质溶出介质的研究应根据药物的性质,充分考虑药物在体内的环境,选择多种溶出介质进行,必要时可考虑加入适量表面活性剂、酶等添加物。
f2值计算溶出相似要求

F2值计算溶出相似要求概述在药物开发和质量控制中,溶出测试是评价药物释放性能和质量一致性的关键步骤之一。
为了确保药物的有效性和稳定性,药物溶出曲线需要满足一定的相似性要求。
本文将介绍如何计算F2值来评估药物溶出曲线之间的相似性。
溶出曲线相似性衡量药物溶出曲线相似性的指标主要有Q值和F2值。
其中,Q值是基于相似因子(SF)计算的,而F2值是基于相对预测误差(RPE)计算的。
相似因子(S F)相似因子(S F)是衡量两个溶出曲线相似性的常用指标。
S F的计算公式如下所示:```S F=50*lo g[(1+(1/n)*Σ(t1-t2)^2)^(-0.5)*100]```其中,n为取样时间点数,t1和t2为各时间点的溶出百分比。
相对预测误差(R P E)相对预测误差(R PE)是评价溶出曲线相似性的另一种方法。
RP E的计算公式如下:```R P E=[(Σ(t1-t2)^2)/(Σt1^2)]*100```其中,t1和t2为各时间点的溶出百分比。
F2值的计算F2值是基于相对预测误差(RP E)计算的,其计算公式如下:```F2=50*lo g[(1+(RPE)^0.5*100)^(-1)]```F2值的解释F2值的范围通常在0到100之间,数值越高表示溶出曲线相似性越好。
根据美国药典(U SP)的要求,F2值在50到100之间被认为是合格的,表示溶出曲线具有良好的相似性。
F2值的应用F2值的计算可以帮助药物研发人员和质量控制人员评估药物溶出性能和质量一致性。
通过比较不同批次、不同具体剂型、不同工艺条件或不同包装材料的溶出曲线的F2值,可以及时发现潜在的问题并采取相应的措施。
结论F2值作为衡量溶出曲线相似性的重要指标,在药物开发和质量控制领域发挥着重要作用。
通过对溶出曲线进行F2值的计算和比较,可以有效评估药物溶出性能和质量一致性,为药物研发和质量控制提供科学的依据。
---以上就是关于F2值计算溶出相似要求的文档内容,希望对您有所帮助。
美国和日本溶出曲线相似性判定方法介绍

美国和日本溶出曲线相似性判定方法介绍来源:中国食品药品检定研究院固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出以及在胃肠道的渗透。
由于药物的溶出对吸收具有重要影响,因此药物体外溶出度试验可能会与体内行为具有一定关联。
对于仿制药而言,与原研制剂体外溶出曲线具有相似性,虽然不能完全证明与原研制剂具有相同的生物等效性,但却可以大大提高生物等效性试验( BE 试验) 的成功率,而体外溶出曲线不相似,BE 试验的失败率将大大提高。
目前国外已有相关指导原则用于溶出曲线试验的指导。
本文主要对美、日有关仿制药指导原则中溶出曲线相似性方法内容进行介绍,希望通过对两者的解读,能为我国仿制药质量一致性评价固体口服制剂体外评价方法提供借鉴。
1、美国溶出曲线相似性判定方法FDA 在1997 年发布的普通口服固体制剂溶出度试验技术指导原则中,采用非模型依赖法和模型依赖法进行溶出曲线的比较。
1.1非模型依赖法( Model Independent Approaches)差异因子( f1) 和相似因子( f2) 是一种简单的模型非依赖方法用于溶出曲线的比较{ A simple model independent approach uses a difference factor ( f1) and asimilarity factor( f2) to compare dissolution profiles}。
差异因子( f1) 法是计算两条溶出曲线在每一时间点差异,是衡量两条曲线相对偏差的参数,计算公式如下:其中n 为取样时间点个数,Rt为参比制剂( 或变更前产品) 在t 时刻的溶出度值,Tt为试验批次( 变更后样品) 在t 时刻的溶出度值。
相似因子( f2) 是衡量两条溶出曲线相似度的参数,计算公式如下:其中n 为取样时间点个数,Rt为参比制剂( 或变更前产品,后面统称为参比制剂) 在t 时刻的溶出度值,Tt为试验批次( 变更后样品) 在t 时刻的溶出度值。
f2因子法计算电子表格
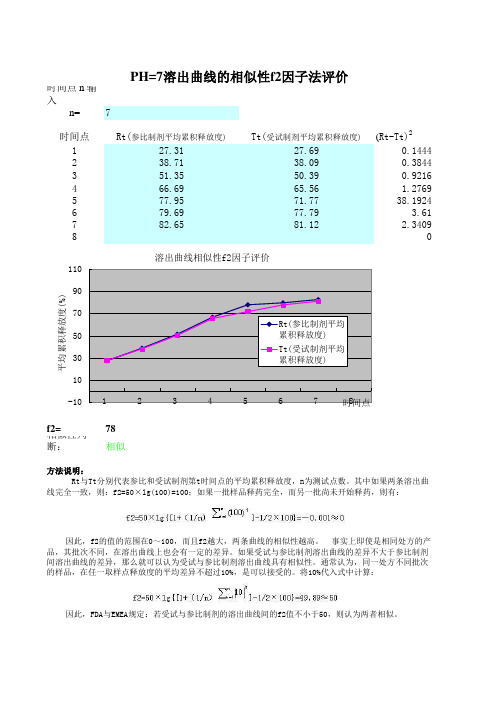
时间点 n 输入n=7时间点Rt(参比制剂平均累积释放度)Tt(受试制剂平均累积释放度)(Rt-Tt)2127.3127.690.1444238.7138.090.3844351.3550.390.9216466.6965.56 1.2769577.9571.7738.1924679.6977.79 3.61782.6581.122.34098f2=78相似性判断:相似方法说明:PH=7溶出曲线的相似性f2因子法评价Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。
其中如果两条溶出曲线完全一致,则:f2=50×lg(100)=100;如果一批样品释药完全,而另一批尚未开始释药,则有:因此,f2的值的范围在0~100,而且f2越大,两条曲线的相似性越高。
事实上即使是相同处方的产品,其批次不同,在溶出曲线上也会有一定的差异。
如果受试与参比制剂溶出曲线的差异不大于参比制剂间溶出曲线的差异,那么就可以认为受试与参比制剂溶出曲线具有相似性。
通常认为,同一处方不同批次的样品,在任一取样点释放度的平均差异不超过10%,是可以接受的。
将10%代入式中计算:因此,FDA与EMEA规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。
-101030507090110 123456 78平均累积释放度(%)时间点溶出曲线相似性f2因子评价Rt(参比制剂平均累积释放度)Tt(受试制剂平均累积释放度)f2因子的应用条件及注意事项:1.在进行参比与受试制剂的溶出曲线比较的过程中,时间点间隔无需相等,但两者所取各时间点必须一致,一般除0时外,选择3点以上,即n≥3。
2.f2计算公式只适用于受试与参比制剂的平均累积释放度差值<100时的溶出曲线比较(如果二者的差值>100,就会得到一个负值),普通口服制剂要保证药物溶出90%以上,缓释制剂、肠溶制剂药物释放需达到80%以上,或达到释放平台。
f2因子法评价头孢克肟颗粒溶出曲线相似性

f2因子法评价头孢克肟颗粒溶出曲线相似性陈伟鸿;宿央央;程怡;胡瑞标;刘国洪;张可擎【期刊名称】《中国抗生素杂志》【年(卷),期】2011(036)009【摘要】Objective To observe the similarity of dissolution profiles of cefixime granules between two different kinds of manufactures. Methods To determine the dissolution percentage by authorized methods from ChP 2010, the methods were authenticated in different mediums introduced, and the similary of dissolution curve was evaluated by f2 factor. Results To compare with cefixime granules of reference product, the similarity factors of the dissolution curve from manufacturers were 56.66, 69.24, 69.46 and 77.64 in mediums of aid, water, PBS 6.8 and PBS 7.2, respectively. Conclusion The dissolution of characteristics of manufactures from pharmcy factory a was similar to the reference product.%目的评价待上市产品与市售产品体外溶出行为的相似性.方法桨法测定溶出度,紫外分光光度法检测,用威布尔分布模型提取溶出参数t50、td、m,并采用f2相似因子法评价受试制剂和市售参比制剂溶出曲线的相似度.结果在4种溶出介质0.1 mol/L盐酸、纯水、pH 6.8与pH 7.2磷酸盐缓冲液下,受试制剂与参比制剂的相似因子分别为56.66、69.24、69.46和77.64.结论受试制剂与参比制剂在4种不同介质下溶出曲线相似,提示该试验药品处方合理,生产工艺稳定可靠.【总页数】4页(P689-692)【作者】陈伟鸿;宿央央;程怡;胡瑞标;刘国洪;张可擎【作者单位】广州中医药大学中药学院,广州,510006;广州中医药大学中药学院,广州,510006;广州中医药大学中药学院,广州,510006;广州中医药大学中药学院,广州,510006;广州中医药大学中药学院,广州,510006;广州中医药大学中药学院,广州,510006【正文语种】中文【中图分类】R978.0+1【相关文献】1.采用f2因子法评价不同规格援生力维溶出曲线的相似性 [J], 李君霞;胡泽开;付爱萍;胡静2.f2因子法评价头孢呋辛酯片溶出曲线相似性 [J], 赵昕;王平;马滔3.相似因子法评价雷美替胺片自研制剂与原研制剂溶出曲线的相似性 [J], 张琳;刘葵葵;李欣;邢雪敏;王伶4.光纤药物溶出实时测定仪结合f2法评价阿折地平片自制制剂与原研制剂溶出曲线的相似性 [J], 张晖;张伟;郭庆明;萧伟5.萘普生片溶出曲线相似性评价及体内外相关性研究 [J], 唐婉;尹菁;张圆;石蓓佳;李攀;陆益红;樊夏雷因版权原因,仅展示原文概要,查看原文内容请购买。
普通口服固体制剂溶出曲线测定与比较指导原则

附件2普通口服固体制剂溶出曲线测定与比较指导原则本指导原则适用于仿制药质量一致性评价中普通口服固体制剂溶出曲线测定方法的建立和溶出曲线相似性的比较。
一、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透等,因此,药物的体内溶出和溶解对吸收具有重要影响。
体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。
普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。
溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临床疗效差异的风险。
二、溶出试验方法的建立溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。
可参考有关文献,了解药物的溶解性、渗透性、pKa常数等理化性质,考察溶出装臵、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。
(一)溶出仪溶出仪需满足相关的技术要求,应能够通过机械验证及性能验证试验。
必要时,可对溶出仪进行适当改装,但需充分评价其必要性和可行性。
溶出试验推荐使用桨法、篮法,一般桨法选择50—75转/分钟,篮法选择50—100转/分钟。
在溶出试验方法建立的过程中,转速的选择推荐由低到高。
若转速超出上述规定应提供充分说明。
(二)溶出介质溶出介质的研究应根据药物的性质,充分考虑药物在体内的环境,选择多种溶出介质进行,必要时可考虑加入适量表面活性剂、酶等添加物。
1.介质的选择应考察药物在不同pH值溶出介质中的溶解度,推荐绘制药物的pH-溶解度曲线。
在确定药物主成分稳定性满足测定方法要求的前提下,推荐选择不少于3种pH值的溶出介质进行溶出曲线考察,如选择pH 值1.2、4.5和6.8的溶出介质。
对于溶解度受pH值影响大的药物,可能需在更多种pH值的溶出介质中进行考察。
推荐使用的各种pH值溶出介质的制备方法见附件。
溶出曲线相似性f2因子法评价
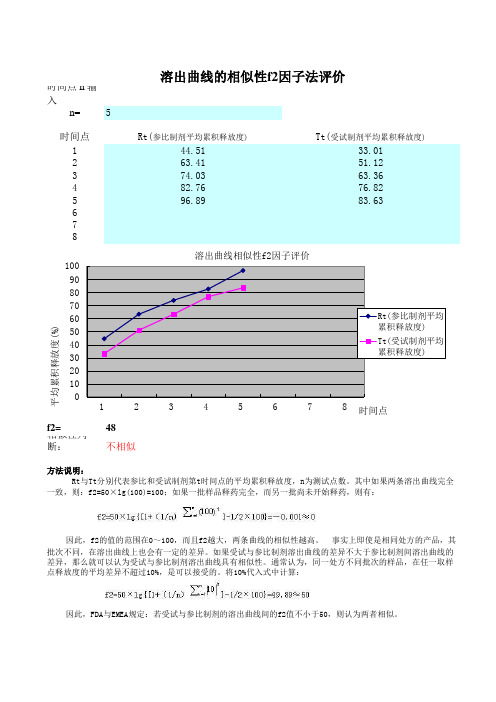
时间点 n 输入n=544.5133.0163.4151.1274.0363.3682.7676.8296.8983.63f2=48相似性判断:不相似方法说明:溶出曲线的相似性f2因子法评价Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。
其中如果两条溶出曲线完全一致,则:f2=50×lg(100)=100;如果一批样品释药完全,而另一批尚未开始释药,则有:因此,f2的值的范围在0~100,而且f2越大,两条曲线的相似性越高。
事实上即使是相同处方的产品,其批次不同,在溶出曲线上也会有一定的差异。
如果受试与参比制剂溶出曲线的差异不大于参比制剂间溶出曲线的差异,那么就可以认为受试与参比制剂溶出曲线具有相似性。
通常认为,同一处方不同批次的样品,在任一取样点释放度的平均差异不超过10%,是可以接受的。
将10%代入式中计算:因此,FDA与EMEA规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。
20 40 60 801001 2 3 4 5 6 7 8 平均累积释放度(%) 时间点 溶出曲线相似性f2因子评价Rt(参比制剂平均累积释放度) Tt(受试制剂平均累积释放度)f2因子的应用条件及注意事项:1.在进行参比与受试制剂的溶出曲线比较的过程中,时间点间隔无需相等,但两者所取各时间点必须一致,一般除0时外,选择3点以上,即n≥3。
2.f2计算公式只适用于受试与参比制剂的平均累积释放度差值<100时的溶出曲线比较(如果二者的差值>100,就会得到一个负值),普通口服制剂要保证药物溶出90%以上,缓释制剂、肠溶制剂药物释放需达到80%以上,或达到释放平台。
3.受试与参比制剂释放曲线上各时间点的平均累积释放度差异,在平台区达到最小(如果外推到释放100%,差值将为0),在该区域上取样点的增加会直接导致f2值偏大。
因此,受试或参比制剂的药物累积释放度在85%以上的取样点应不多于一个,否则,将会给判定结果带来误差。
采用f2因子法评价溶出曲线的相似性需注意的问题20070806

栏目 化药药物评价>>化药质量控制
作者 马玉楠
部门 审评四部审评八室
正文 内容
在制剂的开发研究中,通过对比不同处方之间的溶出曲
线,可以较准确地反映药物处方、工艺、生产场地及规模等
因素变化对药物体外释放行为的影响。近年来,国外针对溶
出曲线的相似性评价方法报道很多,其中f2因子方法因为计
可以接受的。将10%代入式中计算:。因此,FDA与EMEA
规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则
认为两者相似。
在某些情况下,如果对于任一取样点释放度的平均差异的
限定不是10%,则可通过计算得出相应的f2值(临界值)。表1
提供了一些释放度平均差异与相应的f2临界值。
表1 释放度平均差异与f2临界值表
总之,f2因子法作为定量描述制剂体外溶出曲线相似性的 非模型依赖方法,简单易行、结果可靠。当药品处方、生产 工艺、生产地点和生产规模等发生变更后,溶出度检查是比 较变更前后制剂产品相似性或差异程度的重要工具和研究工 作的重要内容,同时该方法也为口服固体制剂的处方筛选, 产品质量控制、生物等效性评价等提供了有力的判定依据。 在进行f2因子比较试验时要特别注意样本量、样本批间差 异、溶出取样点等是否满足条件,以保证数据的可靠性。
未开始释药,则有:。因此,f2的值的范围在0~100,而且
f2越大,两条曲线的相似性越高。
事实上即使是相同处方的产品,其批次不同,在溶出曲线
上也会有一定的差异。如果受试与参比制剂溶出曲线的差异
不大于参比制剂间溶出曲线的差异,那么就可以认为受试与
参比制剂溶出曲线具有相似性。通常认为,同一处方不同批0%,是
普通口服固体制剂溶出曲线测定和比较指导原则

附件2普通口服固体制剂溶出曲线测定与比较指导原则本指导原则适用于仿制药质量一致性评价中普通口服固体制剂溶出曲线测定方法的建立和溶出曲线相似性的比较。
一、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透等,因此,药物的体内溶出和溶解对吸收具有重要影响。
体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。
普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。
溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临床疗效差异的风险。
二、溶出试验方法的建立溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。
可参考有关文献,了解药物的溶解性、渗透性、pKa常数等理化性质,考察溶出装置、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。
(一)溶出仪溶出仪需满足相关的技术要求,应能够通过机械验证及性能验证试验。
必要时,可对溶出仪进行适当改装,但需充分评价其必要性和可行性。
溶出试验推荐使用桨法、篮法,一般桨法选择50—75转/分钟,篮法选择50—100转/分钟。
在溶出试验方法建立的过程中,转速的选择推荐由低到高。
若转速超出上述规定应提供充分说明。
(二)溶出介质溶出介质的研究应根据药物的性质,充分考虑药物在体内的环境,选择多种溶出介质进行,必要时可考虑加入适量表面活性剂、酶等添加物。
1.介质的选择应考察药物在不同pH值溶出介质中的溶解度,推荐绘制药物的pH-溶解度曲线。
在确定药物主成分稳定性满足测定方法要求的前提下,推荐选择不少于3种pH值的溶出介质进行溶出曲线考察,如选择pH 值1.2、4.5和6.8的溶出介质。
对于溶解度受pH值影响大的药物,可能需在更多种pH值的溶出介质中进行考察。
推荐使用的各种pH值溶出介质的制备方法见附件。
溶出度指导原则完整版

溶出度指导原则HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】普通口服固体制剂溶出曲线?测定与比较指导原则(2015-11-09 16:15:30)分类:普通口服固体制剂溶出曲线测定与比较指导原则一、概述为进一步推进仿制药与原研药品质量和疗效一致性评价工作的开展,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)要求,制定本指导原则。
本指导原则适用于仿制药质量一致性评价中普通口服固体制剂溶出曲线测定方法的建立和溶出曲线相似性的比较。
二、背景固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透等,因此,药物的体内溶出和溶解对吸收具有重要影响。
体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。
普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。
溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临床疗效差异的风险。
三、溶出试验方法的建立溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。
可参考有关文献,了解药物的溶解性、渗透性、pKa 常数等理化性质,考察溶出装置、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。
(一)溶出仪溶出仪需满足相关的技术要求,应能够通过机械验证及性能验证试验。
必要时,可对溶出仪进行适当改装,但需充分评价其必要性和可行性。
溶出试验推荐使用桨法、篮法,一般桨法选择50~75转/分钟,篮法选择50~100转/分钟。
在溶出试验方法建立的过程中,转速的选择推荐由低到高。
若转速超出上述规定应提供充分说明。
(二)溶出介质溶出介质的研究应根据药物的性质,充分考虑药物在体内的环境,选择多种溶出介质进行,必要时可考虑加入适量表面活性剂、酶等添加物。
溶出曲线f2计算公式(二)

溶出曲线f2计算公式(二)溶出曲线f2计算公式1. 引言溶出曲线(dissolution profile)是用于评估药物在体外释放行为的一种重要手段。
通过分析溶出曲线,可以了解药物在给定时间内的溶出速率和程度,从而评估药物的溶出特性和释放机制。
其中,溶出曲线f2计算公式是一种常用的方法,能够衡量两个溶出曲线之间的相似度。
2. 溶出曲线f2计算公式溶出曲线f2计算公式是根据United States Pharmacopeia (USP)所提出的方法,用于比较两个溶出曲线之间的相似程度。
其计算公式如下:f2 = 50 * log [1 + (1/n) * Σ (Rt - Tt)^2]^其中,f2表示两个溶出曲线的相似度,n表示样品点的数量,Rt 和Tt分别表示参考品和试验品在每个时间点上的累积溶出量。
3. 参考例子为了更好地理解溶出曲线f2计算公式的应用,我们来看一个具体的例子:假设有一种药物A的溶出曲线如下表所示:时间(小时) | 累积溶出量(%) |||| | 1 | | | 2 | | | 3 | | | 4 | | | 5 | | | 6 | |现在我们要比较这个溶出曲线与参考品的溶出曲线B是否相似。
参考品的溶出曲线B如下表所示:时间(小时) | 累积溶出量(%) |||| | 1 | | | 2 | | | 3 | | | 4 | | | 5 | | | 6 | |根据上述数据,我们可以利用溶出曲线f2计算公式计算相似度f2的数值:1.首先,计算样品点的数量n,这里n=6。
2.然后,计算每个时间点上的差值(Rt - Tt),并计算差值的平方。
3.将所有差值的平方相加,并除以n。
4.代入公式计算f2的数值。
根据以上步骤,我们可以计算出样品A与参考品B之间的相似度f2的数值。
4. 结论通过以上的例子,我们可以看到溶出曲线f2计算公式的应用。
该计算公式能够客观地评估两个溶出曲线之间的相似度,从而判断药物的溶出特性和释放机制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
时间点 n 输入
n=8
时间点Rt(参比制剂平均累积释放度)
Tt(受试制剂平均累积释放度)
11292171232615437285503866652773618
84
73
f2=49
相似性判断:不相似
方法说明:
溶出曲线的相似性f2因子法评价
Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。
其中如果两条溶出曲线完全一致,则:f 如果一批样品释药完全,而另一批尚未开始释药,则有:
因此,f2的值的范围在0~100,而且f2越大,两条曲线的相似性越高。
事实上即使是相同处方的产品,其批次不同,一定的差异。
如果受试与参比制剂溶出曲线的差异不大于参比制剂间溶出曲线的差异,那么就可以认为受试与参比制剂溶出常认为,同一处方不同批次的样品,在任一取样点释放度的平均差异不超过10%,是可以接受的。
将10%代入式中计算:
因此,FDA与EMEA规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。
20406080100 1
2
3
4
5
6
7
8 平均累积释放度(%)
时间点
溶出曲线相似性f2因子评价
Rt(参比制剂平均累积释放度)
Tt(受试制剂平均累积释放度)
f2因子的应用条件及注意事项:
1.在进行参比与受试制剂的溶出曲线比较的过程中,时间点间隔无需相等,但两者所取各时间点必须一致,一般。
2.f2计算公式只适用于受试与参比制剂的平均累积释放度差值<100时的溶出曲线比较(如果二者的差值>100,就
剂要保证药物溶出90%以上,缓释制剂、肠溶制剂药物释放需达到80%以上,或达到释放平台。
3.受试与参比制剂释放曲线上各时间点的平均累积释放度差异,在平台区达到最小(如果外推到释放100%,差值
增加会直接导致f2值偏大。
因此,受试或参比制剂的药物累积释放度在85%以上的取样点应不多于一个,否则,将会给判定4.f2因子比较一般选择每个处方的12个剂量单位的测定均值来进行处理。
因为不考虑参比和受试制剂批内样本间
内样本间差异较大时,用f2因子来评价两者溶出曲线的相似性时需要谨慎,从第2个时间点至最后1个时间点溶出结果的变异5.f2值与平均偏差之间成非线性关系,它只适用于描述参比与受试制剂溶出曲线的相似性,而不能用于评价受试
价
Rt-Tt(Rt-Tt)2
3912%9%
52517%12%
1112126%15%
98137%28%
1214450%38%
1419666%52%
1214473%61%
1112184%73%
溶出曲线完全一致,则:f2=50×lg(100)=100;
处方的产品,其批次不同,在溶出曲线上也会有
以认为受试与参比制剂溶出曲线具有相似性。
通。
将10%代入式中计算:。
,一般除0时外,选择3点以上,即n≥3
0,就会得到一个负值),普通口服制
,差值将为0),在该区域上取样点的于一个,否则,将会给判定结果带来误差。
样本间差异,所以若参比或受试制剂批后1个时间点溶出结果的变异系数应小于10%。
价受试制剂样本间差异。
