常见的市售酸碱的浓度
常见的无机酸性清洗剂介绍

常见的无机酸性清洗剂介绍酸是处理金属表面污垢最常用的药剂。
酸是一种电解质,它在水中电离时产生的阳离子都是氢离子。
但各种酸在水中电离出的氢离子浓度不同。
常用溶液的pH值来表示溶液的酸碱性。
在相同浓度下,酸溶液的pH值越小,它的酸性越强。
1、硫酸硫酸是三氧化硫的水合物,是一种无色黏稠的液体,含量可达100%。
把三氧化硫溶于100%的硫酸中可得到棕色油状液体,叫发烟硫酸。
通常在清洗中应用的是98%及以下含量的硫酸溶液。
稀硫酸容易与钢铁反应并产生氢气,常温下,60%及以上的硫酸会在钢铁表面形成钝化膜而使钢铁对它有耐蚀性;93%以上时,即使加热到煮沸条件也几乎不腐蚀钢铁。
而铅与钢铁正相反,可溶于浓硫酸中,但对稀硫酸有良好耐蚀性。
其他金属与硫酸的反应情况如下。
铝:易溶于10%的硫酸中,但对80%以上的硫酸有耐蚀性。
锌、镁:易溶于各种浓度的硫酸中。
锡:对稀硫酸才有耐蚀性。
镍:常温下对80%以下的硫酸有耐蚀性。
铬:可被浓硫酸氧化生成钝化膜,所以它不被浓硫酸腐蚀。
含铬的18-8铬镍钢,常温下与硫酸接触也会生成耐蚀的氧化膜而钝化,但在加热情况下会被腐蚀。
铜:由于金属活动性差,不能从酸中置换出氢离子,所以一般情况下不会被硫酸溶解,只有在浓硫酸加热条件下,铜被氧化才能被硫酸溶解厂。
2、盐酸盐酸是氯化氢气体的水溶液,15℃时氯化氢在水中溶解度最大,可生成42.7%的盐酸。
市场上出售的浓盐酸为37.2%。
盐酸与硫酸一样,是一种价格便宜的强酸,在清洗金属中应用很广泛。
它与硫酸的不同是具有易挥发性,在40℃以上使用时,氯化氢气体会从盐酸溶液中挥发出来,使用时产生困难。
盐酸与金属反应生成的氯化物水溶性大都很好,但盐酸与卤化物对金属都有腐蚀作用,在使用时要注意。
盐酸对各种金属的腐蚀作用如下。
镁、锌、铬、铁:易被盐酸腐蚀。
铅:对20%以下浓度的盐酸有一定的耐腐蚀性。
锡、镍:在常温下对稀盐酸有一定耐腐蚀性,在氧化气氛中会慢慢被腐蚀。
18-8铬镍不锈钢:对许多化学药品有良好的耐腐蚀性,但会被盐酸腐蚀。
常见酸碱的性质及使用中应注意的事项

吸收空气中的水份,而使浓度降低。
• 3.浓硫酸具有脱水性,能将有机物中的H和O以2:1的形式脱去,从而使有机物 炭化。
• 4.浓硫酸具有强烈的腐蚀性,如果皮肤沾到浓硫酸会使皮肤严重灼伤。若皮
肤不慎沾上浓硫酸时,应立即用大量的水冲洗。 保存:密闭、干燥的玻璃容器中。
3.氧化性:浓硝酸和稀硝酸都有强氧化性
• 它能与几乎所有的金属(金、铂)除外和非金属发生氧化 还原反应。 • 应当注意:铁和铝能溶于稀硝酸,但遇冷浓硝酸发生钝化 现象,所以可以用铁或铝制容器盛装浓硝酸。 • 浓硝酸 :浓盐酸 = 1 : 3 (体积比)叫做王水。其 氧化能力比硝酸强,能溶解金、铂等贵重金属。 • 三、使用时注意事项 • 1.稀、浓硝酸都有腐蚀性,若不慎沾到皮肤上,立即用大 时的水冲洗。
盐 酸
HCL
• 一、物理性质: • 工业三大强酸之一, 纯的盐酸是无色有刺激气味的 液体,通常市售浓盐酸的密度为1.19g/cm3,质量分数为 0.37。工业用的盐酸由于含有FeCL3 略带黄色。 • 盐酸是一种低沸点、易挥发的酸。 • 化学性质: • 二、化学性质 • 1.具有酸的通性,能使指示剂变色。 • 2.能和多数属反应。 • 三、保存 • 密闭容器中(挥发性)。
2.三大特性: 具有强酸性,氧化性和吸水性。:
•
•ቤተ መጻሕፍቲ ባይዱ
常温时,浓硫酸能使铁、铝表面产生致密的氧化物薄膜,阻止
内部金属继续与硫酸反应。受热后,浓硫酸可与铁、铝等大多数金属反 应。所以,冷的浓硫酸可用铁或铝制容器储存或运输。
• 三、使用时应注意事项
• 1.配制溶液时要将硫酸沿玻璃棒注入水中,切不可将水注入硫酸中,且不断
试剂的配制和取用
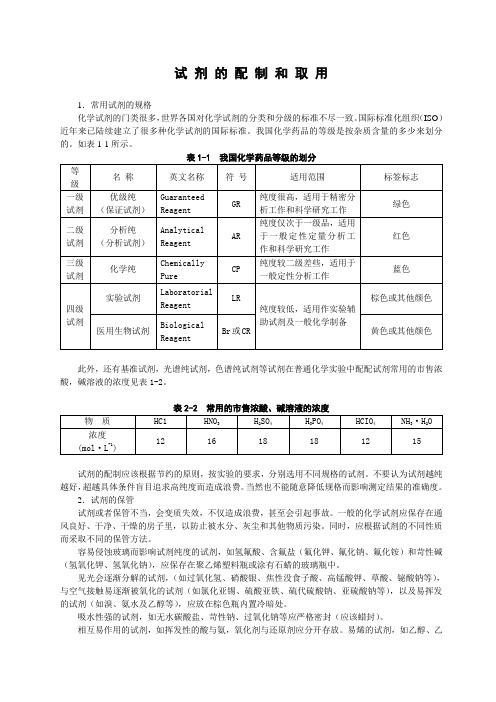
试剂的配制和取用1.常用试剂的规格化学试剂的门类很多,世界各国对化学试剂的分类和分级的标准不尽一致。
国际标准化组织(ISO)近年来已陆续建立了很多种化学试剂的国际标准。
我国化学药品的等级是按杂质含量的多少来划分的。
如表1-1所示。
此外,还有基准试剂,光谱纯试剂,色谱纯试剂等试剂在普通化学实验中配配试剂常用的市售浓酸,碱溶液的浓度见表1-2。
试剂的配制应该根据节约的原则,按实验的要求,分别选用不同规格的试剂。
不要认为试剂越纯越好,超越具体条件盲目追求高纯度而造成浪费。
当然也不能随意降低规格而影响测定结果的准确度。
2.试剂的保管试剂或者保管不当,会变质失效,不仅造成浪费,甚至会引起事故。
一般的化学试剂应保存在通风良好、干净、干燥的房子里,以防止被水分、灰尘和其他物质污染。
同时,应根据试剂的不同性质而采取不同的保管方法。
容易侵蚀玻璃而影响试剂纯度的试剂,如氢氟酸、含氟盐(氟化钾、氟化钠、氟化铵)和苛性碱(氢氧化钾、氢氧化钠),应保存在聚乙烯塑料瓶或涂有石蜡的玻璃瓶中。
见光会逐渐分解的试剂,(如过氧化氢、硝酸银、焦性没食子酸、高锰酸钾、草酸、铋酸钠等),与空气接触易逐渐被氧化的试剂(如氯化亚锡、硫酸亚铁、硫代硫酸钠、亚硫酸钠等),以及易挥发的试剂(如溴、氨水及乙醇等),应放在棕色瓶内置冷暗处。
吸水性强的试剂,如无水碳酸盐、苛性钠、过氧化钠等应严格密封(应该蜡封)。
相互易作用的试剂,如挥发性的酸与氨,氧化剂与还原剂应分开存放。
易烯的试剂,如乙醇、乙醚、苯、丙酮与易爆炸的试剂,如高氯酸、过氧化氢、硝基化合物,应分开贮存在阴凉通风、不受阳光直射的地方。
剧毒试剂,如氰化钾、氰化钠、氢氟酸、二氯化汞、三氧化二砷(砒霜)等,应特别注意由专人妥善保管,严格做好记录,经一定手续取用,以免发生事故。
极易挥发并有毒的试剂可放在通风橱内,当室内温度较高时,可放在冷藏室内保存。
3.试剂滴液的配制配制试剂溶液时,首先根据所配制试剂纯度的要求,选用不同等级试剂,再根据配制溶液的浓度和数量,计算出试剂的用量。
实验室安全操作规程

实验室安全操作规程一、实验室安全守则(一)分析人员必须认真学习分析规程和有关的安全技术规程,了解设备性能及操作中可能发生事故原因,掌握预防和处理事故的方法。
(二)玻璃管与胶管、胶塞等拆装时,应先用水润湿,手上垫棉布,以免玻璃管折断扎伤. (三)稀释浓硫酸的容器要放在塑料盆中,只能将浓硫酸慢慢到入水中,不能相反!必要时用水冷却。
(四)蒸馏和提纯时不能离人,以防温度过高或冷却水突然中断。
(五)化验室每瓶试剂必须贴有明显的与内容物相符的标签。
严禁将用完的原装试剂空瓶不更换标签而装入别种试剂。
发现试剂瓶上标签掉落或将要模糊时应立即贴好标签.(六)不准使用绝缘损坏或老化的线路及电器设备。
保持电器及电线的干燥.(七)正确操作闸刀开关,应使闸刀处于安全合上或完全拉断的位置,不能若即若离,以防接触不良打火花.(八)使用酒精灯时,注意酒精切勿装满,应不超过容量的2/3,灯内酒精不足1/4容量时,应灭火后添加酒精。
燃着的灯焰应用灯冒盖灭,不可用嘴吹灭,以防引起灯内酒精起燃。
酒精灯应用火柴点燃,不应用另一正燃的酒精灯来点,以防失火。
(九)若局部起火,应立即切断电源,用湿抹布或石棉布覆盖熄灭。
若火势较猛,应立即与有关部门联系,请求救援.(十)打开浓盐酸、浓硝酸、浓氨水试剂瓶塞时应戴防护用具。
(十一)打开高温烘箱前,须确认箱内温度小于100℃后方可打开。
(十二)若遇酸碱液灼烧时,速用大量自来水冲洗患处。
属酸液烧伤,用2%碳酸氢钠冲洗;属碱液烧伤,用2%硼酸冲洗,再用清水冲洗。
二、化学试剂的分类和规格(一)化学试剂按其用途分为一般试剂、基准试剂、无机离子分析用有机试剂、色谱试剂与制剂、指示剂与试纸等。
(二)实验室最常见试剂的规格1.基准试剂是一类用于标定滴定分析标准溶液的标准参考物质,可作为滴定分析中的基准物用,也可精确称量后直接配制标准溶液.主成分含量一般在99.95%—100.05%,杂质含量略低于优级纯或与优级纯相当.标签颜色为浅蓝色.2.优级纯试剂,也称为保证试剂,其成分高,杂质含量低,主要用于精密的科学研究和测定工作,简称GR级。
化学清洗剂中无机酸的种类及原理详解

化学清洗剂中无机酸的种类及原理详解酸是处理金属表面污垢最常用的化学药剂。
清洗中常用的酸包括无机酸和有机酸两类。
无机酸是无机化合物中酸类的总称,也称为矿酸,如硫酸、盐酸、硝酸、磷酸等。
无机酸通常是由氢和非金属元素组成的。
酸是一种电解质,它在水中电离时产生的阳离子都是氢离子。
但是各种酸在水中电离出的氢离子浓度不同。
常用溶液的pH值来表示溶液的酸碱性。
pH 值是溶液中氢离子浓度负对数,pH=-lgcH+。
中性水溶液在常温下,氢离子浓度为10-7mol/L,所以水的pH=-lg10-7=7。
在酸的水溶液中氢离子浓度大于10-7mol/L,所以酸的pH<7。
在相同浓度情况,酸溶解的pH值越小说明此酸电离出的氢离子越多,它的酸性越强。
酸对各种金属的溶解能力与金属的活泼性有关,越活泼的金属越易与酸电离出的氢离子反应而转变成金属离子。
金属变成金属离子的难易顺序为:Li>K>N9>Ca>Mg>Zn>Cr>Fe2>Cd>Co>Ni>Pb>Sn>Fe3>[H]>Cu>Ag>Hg>Au 这种顺序又称为金属活动顺序,其中氢以前的金属易于在酸中转变成金属离子,它们在酸中与氢离子反应时被溶解,同时有氢气发生。
在上面的顺序中Fe出现两次,Fe2表示铁转变成二价铁离子(Fe2+),Fe3表示转变成三价铁离子(Fe3+),在前一转变过程中金属铁更为活泼。
已知,假如在金属表面由于发生了氧化作用产生了耐腐蚀的氧化覆盖膜时,酸对金属时的溶解作用会明显地受到抑制,这种现象叫金属的钝化。
在用各种酸清除污垢的过程中,H+离子起着主要作用,但酸根离子对污垢的溶解也有一定作用,有时还是很重要的,比如F-离子可使水垢中的SiO2发生化学反应而溶解,而别的酸根(阴离子)是不行的。
因此在用酸作化学清洗剂时不仅要考虑到酸的强度,也要考虑不同酸的特性。
4食品分析的基础知识和数据处理

滴定度: 滴定度:指1ml的标准溶液相当于被测物的 的标准溶液相当于被测物的 表示, 代表标准 质量,可用符号“ 质量,可用符号“ TS/X ”表示,S代表标准 表示 溶液(滴定剂)的化学式。 溶液(滴定剂)的化学式。
如: THCl/Na2CO3=0.05316g/mL,表示 ,表示1mL盐酸标准 盐酸标准 溶液相当于0.05316gNa2CO3。 溶液相当于
d = xi − x
平均绝对偏差 d
d = ( d1 + d2 + d3 +... + dn ) / n
相对偏差——绝对偏差占测定平均值的 (2)相对偏差 绝对偏差占测定平均值的 百分比。 百分比。 ①相对算术平均偏差= d / x×100% 相对算术平均偏差= ②标准偏差 S 2 2 2 d1 + d2 +... + dn S= = n −1 相对标准偏差——变异系数 ③ 相对标准偏差 变异系数
2 4
c(1/2H SO ) = 2mol/L
2 4
c(2H SO ) = 0.5mol/L
2 4
比例浓度:指溶液中各组分的体积比, 比例浓度:指溶液中各组分的体积比, 记为A+B+C。 记为 。
正丁醇-氨水 无水乙醇( 氨水-无水乙醇 如:①正丁醇 氨水 无水乙醇(7+1+2),表示正 ) 表示正 丁醇、氨水和无水乙醇按体积比7:1:2混合 丁醇、氨水和无水乙醇按体积比 混合; 混合 有时试剂名称后注明( ②有时试剂名称后注明(3+4)等,但未指 ) 明与何种试剂混合时, 明与何种试剂混合时,则第一个数字表示试剂 的体积, 个数字表示水的体积。 的体积,第2个数字表示水的体积。 个数字表示水的体积
4食品分析的基础知识和数据处理

Q 值表(狄克逊检验法临界值) n 3 4 5 6 7 8 9 显著性水平 α 0.05 0.01 0.970 0.994 0.829 0.926 0.710 0.821 0.628 0.740 0.569 0.680 0.608 0.717 0.564 0.672 n 10 11 12 13 14 15 … 显著性水平 α 0.05 0.01 0.530 0.635 0.502 0.605 0.479 0.579 0.611 0.697 0.586 0.670 0.565 0.647
2 4
c(2H SO ) = 0.5mol/L
2 4
比例浓度:指溶液中各组分的体积比, 记为A+B+C。
如:①正丁醇-氨水-无水乙醇(7+1+2),表示正 丁醇、氨水和无水乙醇按体积比7:1:2混合; ②有时试剂名称后注明(3+4)等,但未指 明与何种试剂混合时,则第一个数字表示试剂 的体积,第2个数字表示水的体积。
食品分析
龙岩学院生命科学学院
主讲教师:
陈雪梅
食品分析的基础知识 和数据处理
一、分析方法的选择
(一)选择分析方法应考虑的因素 1.分析要求的准确度和精密度 2.分析方法的繁简和速度 3.样品的特性 4.现有条件
(二)分析方法的评价
1、精密度
精密度——指多次平行测定结果相互接 近的程度。 反应测定方法的稳定性和重现性。
按Grubbs法,先求全组数据的平均值和标准 偏差:
4
x
1 . 25 1 . 27 1 . 31 1 . 40 4
1 . 31 , S
i 1
(x x) n 1
2
0 066
分析化学实验讲义╱附录

附录附录1洗涤液的配制及使用1. 铬酸洗液主要用于去除少量油污,是无机及分析化学实验室中最常用的洗涤液。
使用时应先将待洗仪器用自来水冲洗一遍,尽量将附着在仪器上的水控净,然后用适量的洗液浸泡。
配制方法:称取25g化学纯K2Cr2O7置于烧杯中,加50 mL水溶解,然后一边搅拌一边慢慢沿着烧杯壁加入450 mL工业浓H2SO4,冷却后转移到有玻璃塞的细口瓶中保存。
2. 酸性洗液工业盐酸(1:1),用于去除碱性物质和无机物残渣,使用方法与铬酸洗液相同。
3. 碱性洗液1%的NaOH水溶液,可用于去除油污,加热时效果较好,但长时间加热会腐蚀玻璃。
使用方法与铬酸洗液相同。
4. 草酸洗液用于除去Mn,Fe等氧化物。
加热时洗涤效果更好。
配制方法:5~10g草酸溶于100 mL水中,再加入少量浓盐酸。
5. 盐酸-乙醇洗液用于洗涤被染色的比色皿、比色管和吸量管等。
配制方法:将化学纯的盐酸与乙醇以1:2的体积比混合。
6. 酒精与浓硝酸的混合液此溶液适合于洗涤滴定管。
使用时,先在滴定管中加入3 mL酒精,沿壁再加入4 mL 浓HNO3,盖上滴定管管口,利用反应所产生的氧化氮洗涤滴定管。
7. 含KMnO4的NaOH水溶液将10 g KMnO4溶于少量水中,向该溶液中注入100 mL 10% NaOH溶液即成。
该溶液适用于洗涤油污及有机物,洗后在玻璃器皿上留下的MnO2沉淀,可用浓HCl或Na2SO3溶液将其洗掉。
附录2市售酸碱试剂的浓度及比重附录3常用指示剂(1)酸碱指示剂(2)混合指示剂(3)配位滴定指示剂附录4不同温度下,稀溶液体积对温度的补正值附录5化学试剂纯度分级表①以20%乙醇为溶剂,配成0.1%(W / V)溶液。
除此之外,还有高纯试剂,色谱纯试剂,光谱纯试剂,生化试剂等。
高纯试剂(EP):包括超纯、特纯、高纯、光谱纯,配制标准溶液。
此类试剂质量注重的是:在特定方法分析过程中可能引起分析结果偏差,对成分分析或含量分析干扰的杂质含量,但对主含量不做很高要求。
指示剂配置方法

指示剂配置方法所需药品:酚酞用途:酸碱指示剂配制方法:称取1g酚酞,用100ml无水乙醇溶解0.1%甲基红所需药品:甲基红用途:酿制甲基白-溴甲酚绿混合指示剂配制方法:称取1g甲基红,用1000ml无水乙醇溶解0.1%溴甲酚绿所需药品:溴甲酚绿用途:酿制甲基白-溴甲酚绿混合指示剂配制方法:称取1g溴甲酚绿,用1000ml无水乙醇溶解用途:测蛋白质用指示剂酿制方法:临用时按0.1%甲基白:0.1%溴甲酚绿=1:5体积比混合而变成1%淀粉指示剂所须要药品:可溶性淀粉用途:活性氯测量指示剂配制方法:称取1.0g可溶性淀粉,加少量ro水搅匀,随后一面搅拌一面加入热水约60ml再将此溶液煮沸2-3min,静置冷却,加nacl20g,溶解后再加ro水至100ml(可冷藏备用)3%硼酸溶液所需药品:硼酸用途:测定蛋白质酿制方法:称取3.0g硼酸,用ro水熔化并定溶至100ml40%naoh溶液所须要药品:naoh用途:测量蛋白质配制方法:称取416.7gnaoh,溶解于583.3gro水中邻联甲苯胺溶液所须要药品:分析氢铵hcl、邻联甲苯胺用途:检测水中余氯配制方法:量取150ml浓盐酸用ro水稀释至500ml。
称取1.00g邻联甲苯胺(或1.35g邻联甲苯胺盐酸盐),并吸取5ml配制好的盐酸一同放入玻璃研钵器中研成糊状。
然后置入1000ml的容器中加150ml蒸馏水稀释,同时加入495ml稀盐酸并用玻璃棒充分搅拌,最后用蒸馏水稀释至1000ml。
0.1mol/lnaoh标准溶液配制:称取4.17gnaoh(纯度96%),提蒸馏水熔化,并吸收至1000ml。
标定:精确称取0.2g在105-110℃烘至恒重的基准邻苯二甲酸氢钾,溶于50ml新煮沸过的冷水中,加2滴酚酞指标剂,用配制好的naoh溶液滴定至溶液呈粉红色。
同时作空白试验。
结果则表示c(naoh)=式中:c(naoh):氢氧化钠标准溶液之物质的量浓度,mol/lm:邻苯二甲酸氢钾之质量,gv1:氢氧化钠溶液之用量,mlv2:空白试验氢氧化钠溶液之用量,ml0.2042:与1.00mlnaoh标准溶液[c(naoh)=1.000mol/l]相当的基准邻苯二甲酸氢钾的质量(g)0.1mol/lhcl标准溶液配制量挑9mlhcl,提拌匀并吸收至1000ml。
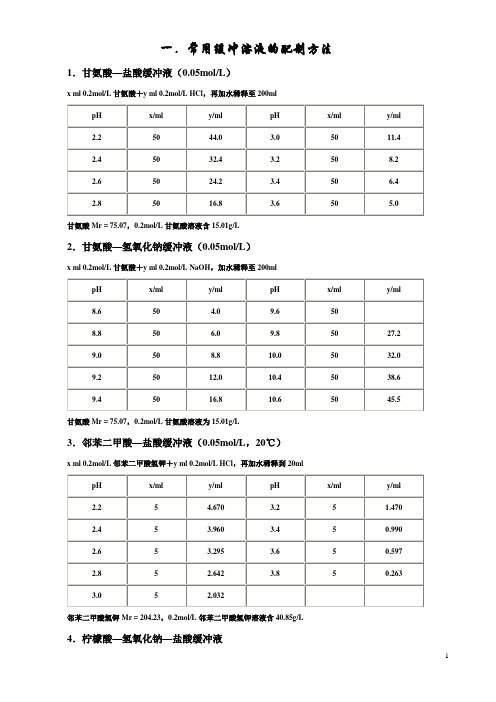
缓冲液配制方法
5.91
1.00
9.00
7.73
9.00
1.00
6.24
2.00
8.00
8.04
9.50
0.50
6.47
3.00
7.00
8.34
9.75
0.25
6.64
4.00
6.00
8.67
9.90
0.10
6.81
5.00
5.00
8.18
10.00
0
6.98
6.00
4.00
Na2HPO4·2H2O,Mr = 178.05,1/15mol/L溶液为11.876g/L
7.0
8.00
29.2
9.00
5.7
注:三羟甲基氨基甲烷(Tris)
Mr = 121.14,0.1mol/L溶液为12.114g/L。Tris溶液可从空气中吸收二氧化碳,保存时注意密封。
15.硼酸—硼砂缓冲液(0.2mol/L硼酸根)
pH
0.05mol/L
硼砂/ml
0.2mol/L
硼酸/ml
pH
0.05mol/L
6.柠檬酸—柠檬酸钠缓冲液(0.1mol/L)
pH
0.1mol/L
柠檬酸/ml
0.1mol/L
柠檬酸钠/ml
pH
0.1mol/L
柠檬酸/ml
0.1mol/L
柠檬酸钠/ml
3.0
18.6
1.4
5.0
8.2
11.8
3.2
17.2
2.8
5.2
7.3
12.7
3.4
16.0
4.0
5.4
6.4
化学药品管理规定

1 目的实验室的化学药品及试剂溶液品种很多,化学药品大多具有一定的毒性及危险性,对其加强管理不仅是保证分析数据质量的需要,也是确保安全的需要。
2 适用范围2.1 常规化学药品(非危险化学药品)2.2 危险化学药品2.2.1 易爆和不稳定物质:如浓过氧化氢、有机过氧化物等。
2.2.2 氧化性物质:如氧化性酸,过氧化氢也属此类。
2.2.3 可燃性物质:除易燃的气体、液体、固体外,还包括在潮气中会产生可燃物的物质,如碱金属的氢化物、碳化钙及接触空气自燃的物质如白磷等。
2.2.4 有毒物质。
2.2.5 腐蚀性物质:如酸、碱等。
2.2.6 放射性物质。
3 职责3.1 实验室质量负责人依照该程序对实验室整个化学药品管理过程进行监控。
3.2 各部门负责本部门领用的化学药品的在用管理。
3.3 仓库管理员负责化学药品的验收、存储和发放管理。
4 要求4.1 要遵循既有利于使用,又要保证安全的原则,管好用好化学药品,加强安全教育。
4.2 化学药品必须根据化学性质分类存放,易燃、易爆、剧毒、强腐蚀品不得混放。
化学药品要存放在专用柜内,有存放专用柜的储藏室;有阴凉、通风、防潮、避光等条件;有防火防盗安全设施。
4.3 所有药品必须有明显的标志。
对字迹不清的标签要及时更换,对过期失效和没有标签的药品不准使用,并要进行妥善处理。
4.4 试验药剂容器都要有标签,对分装的药品在容器标签上要注明名称、规格、浓度;无标签或标签无法辩认的试剂都要当成危险物品重新鉴别后小心处理。
4.5 化学药品盛装容器应封闭,防止漏气、潮解。
见光容易起变化的化学药品应装在深色的玻璃容器或避光的容器里,对化学药品包装和药品质量要定期检查。
4.6 要加强对火源的管理。
化学药品储藏室周围及内部严禁火源;实验室的火源要远离易燃、易爆物品,有火源时,不能离人。
4.7 储存的易燃易爆物品应避光、防火和防电等,实验室存放的易燃易爆物品,要确定合理的储存量,不许过量且包装容器应密封性好。
食品标准分类和数

分子式
H2SO4 HCl HNO3 H3PO4 CH3COOH CH3COOH NH3·H2O
常用市售酸碱试剂规格
相对分子 质量
密度/g/ml
质量分数 /%
98.8
1.8496-9836.源自61.1936-38
63.01
1.42
65-68
98.00
1.69
85
60.05
1.05
99
60.05
1.04
1、试剂规定
* 所用试剂,无特别标注,均为分析纯(AR)。 * 所用水,未注明其他要求,均为蒸馏水或去离子
水;水浴除外。 * 所用乙醇,除特别注明外,均指95%乙醇。 * 溶液未指明用何种试剂配制时,均指水溶液。 * 盐酸、硫酸、硝酸、氨水等,未指明具体浓度时,
均指市售试剂规格浓度。
试剂
硫酸 盐酸 硝酸 磷酸 冰醋酸 乙酸 氨水
– 计算规则
• 计算过程:可暂时多保留一位 • 计算结果:按有效数字运算规则保留。
加减法:结果保留位数与各数中小数点后位 数最少的数相同;
乘除法:结果保留位数与其中有效数字位数 最少的数相同。 • 例如:6.162÷5.2=1.185,取两位有效数字,即1.2
3.142+3.1516+2.96=9.2536,取小数点后两位,即9.25
如: THCl/Na2CO3=0.05316g/mL,表示1mL盐酸标准 溶液相当于0.05316gNa2CO3。
四、食品分析的实验误差
1、误差的表达 • 绝对误差——测定值与真实值之差; • 相对误差——测定值占真实值的百分率。 • 误差的大小表示准确度的高低。
2、引起误差的原因
• 系统误差:由固定原因造成的误差。 – 一般具有单向性,按一定的规律重复出现。 – 可分为:仪器误差、方法误差、试剂误差和操 作误差等。
戊二醛在水草除藻及补充碳源中的应用

戊二醛简介戊二醛是一种高效消毒剂,具有杀菌谱广、杀细菌芽孢效果可靠、杀菌作用受有机物影响较小、对金属腐蚀性小等特点,适用于不耐热的医疗器械和精密仪器的消毒与灭菌,尤其是内窥镜的消毒灭菌。
物理化学性质戊二醛是一种饱和五碳二醛,分子式为C5H8O2,纯品为无色或浅黄色油状液体,有微弱的醛气味,易溶于水和醇,戊二醛水溶液呈酸性。
戊二醛在酸性条件下稳定,可长期贮存,商业出售的戊二醛通常是质量分数为2%、25%、50%的酸性溶液。
消毒用的戊二醛通常为2%的碱性溶液,酸性溶液在使用之前需活化(碱性化)。
碱性条件下戊二醛不稳定,易聚合成多聚体,pH≥8的溶液通常在4周内失去活性,活化的碱性戊二醛使用时间不应超过两周。
对微生物的杀灭作用戊二醛杀灭微生物的机理还不清楚,可能是自由醛基与细胞壁中的氨基酸结合,使得微生物无法摄取养分与排出废物,从而引起微生物的死亡。
戊二醛与蛋白质和酶的反应速率取决于溶液的酸碱度,在pH4~9范围内,随着pH值的增加,反应速率增加。
影响戊二醛杀菌效果的因素主要有以下:(1)浓度和作用时间:随着浓度的增加和作用时间的延长,杀菌作用增强。
但质量分数低于2%的戊二醛溶液,无论怎样延长杀菌时间,也不能取得可靠的杀细菌芽孢效果。
因此,杀灭细菌芽孢需用质量分数大于2%的戊二醛溶液。
(2)溶液酸碱度:酸性戊二醛的杀菌作用明显低于碱性戊二醛,但随温度升高差异逐渐减小。
在pH4.0~9.0范围内,随着pH值的增加杀菌作用增强;pH7.5~8.5时杀菌作用最强;pH>9时,戊二醛迅速聚合,杀菌作用迅速丧失。
(3)温度:在较低温度下也有杀菌作用。
随温度升高,戊二醛杀菌作用增强。
(4)有机物:有机物使杀菌作用减弱,但有机物对戊二醛杀菌作用的影响比其他消毒剂小,20%小牛血清和1%全血对2%戊二醛的杀菌效果基本无影响。
(5)非离子表面活性剂及其他理化因子的增效作用:聚氧乙烯脂肪醇醚为非离子表面活性剂,在戊二醛溶液中加入0.25%聚氧乙烯脂肪醇醚配制成的强化酸碱性戊二醛,稳定性和杀菌效果都明显提高。
市售液碱浓度

市售液碱浓度?
答:市售液碱的浓度通常在1mol/L至50mol/L之间,具体浓度取决于使用场景。
例如,低浓度液碱(浓度在1mol/L 至5mol/L之间)通常用于清洗和去污,如清洗玻璃、陶瓷、不锈钢等表面的油渍和脏污,以及调节pH值,如在食品加工和制药过程中。
而中高浓度液碱(浓度在5mol/L至50mol/L 之间)则常用于有机合成、清洗金属表面、生产合成树脂、酯类和聚酰亚胺等高分子材料。
另外,由于生产工艺的不同,氯碱工厂生产的液碱浓度通常为30-32%或40-42%。
这些液碱为无色透明液体,但工业品多含有杂质,主要为氯化钠及碳酸钠等,有时还有少量氧化铁。
当溶解成浓液碱后,大部分杂质会上浮到液面并可以分离除去。
GB/T5009.1理化检验总则1_2005

GB:8.8 样品保存
检验后的样品保存
一般样品,
在检验结束后,应保留一个月,以备需要时复检;
易变质食品
不予保留;
保存时,应加封,并尽量保持原状; 取样部位
检验取样,一般皆系指“取可食部分”,以所检验的 样品计算;
GB:8 样品的采集和保存
外埠食品
应结合索取卫生许可证、生产许可证及检验合格证或化验单,了 解发货日期、来源地点、数量、品质及包装情况。
硫酸标准溶液 c( ½ H2SO4)=0.1 mol/L(0.1 N)
GB:5 溶液浓度的表示方法
5.5.2 标准溶液,主要用于测定杂质含量, 应符合GB/T 602的要求。
GB:5 溶液浓度的表示方法
5.5.2 混合比例表示
几种“固体试剂的混合质量分数” 几种“液体试剂的混合体积分数”
2、2004-03,环资学院一实验室,干燥箱失控,爆炸,惊动市消防车。
3、2003-03,环资学院,研究生在毒气柜中融化石蜡,人离开时间过长, 烧毁了整个毒气柜,惊动市消防车。
4、冰箱存放有机溶液:未加盖、加盖不严,导致爆炸,也发生过多次;
几种液体试剂的混合体积份数
可表示为(1+1)、(4+2+1)等。
如:盐酸+水=1+1,
盐酸+水=1:1 ?
5.5.3 溶液浓度的表示 ?
GB/T 5009.1-2001
是以质量比(体积比)为基础给出,
则可表示为百分数:% (m/m) 或 % (V/V)
GB:5 溶液浓度的表示方法
GB:3 空白试验
3.6 空白试验 系指:
除不加样品外,采用完全相同的分析步骤、试剂和 用量(滴定法中标准滴定液的用量除外),
蛋白质的测定

2、消化准备 将试样移入洗净、烘干、编号的
100 mL或500 mL的凯氏烧瓶内 ,加入0.2 g硫酸
铜,6 g硫酸钾及20 mL硫酸,加入2粒~3粒玻璃 珠,稍摇匀后于瓶口放一小漏斗,将瓶以45°角
斜支于有小孔的石棉网上。
消化
3、消化 将准备好的凯氏烧瓶以45°斜放于温控电炉上(先垫上石
棉网),开始用微火小心加热,(小心瓶内泡沫冲出而影响结果!),
④ 步骤
凯 氏 定 氮 法
消化
滴定 吸收
蒸馏
样品消化
总反应式: 2NH2(CH2)2COOH + 13H2SO4
(NH4)2SO4 + 6CO2 + 12SO2 + 16H2O
(一定要用浓硫酸-98%)
<1> 加硫酸钾 作为增温剂,提高溶液沸点,纯硫酸沸点 340℃,加入硫酸钾之后可以提高至400℃以上。也可加入 硫酸钠,氯化钾等提高沸点,但效果不如硫酸钾。
g) 混合指示液:1份甲基红乙醇溶液 (1g/L) 与5份溴甲酚绿乙醇 溶液 (1g/L) ,临用时混合。 ( 也可用 2 份甲基红乙醇溶液 (1g/L) 与1份次甲基蓝乙醇溶液(1g/L)临用时混合)。
盐酸标准滴定溶液配制与标定 [c(HCl)=0.0500 mol/L]
(GB/T 601-2002 化学试剂 标准滴定溶液的制备 1、配制 按下表的规定量取盐酸,注入1000 mL水中,摇匀。
2NH4Cl + 4H3BO3
<2> 用过量的 H2SO4 或 HCl标准溶液吸收,再用 NaOH 标 准溶液滴定过剩的酸液,用甲基红指示剂。
凯氏定氮法分析步骤再次说明
GB/T 5009.5-2010《食品中蛋白质的测定》第一法) (一)试样处理
常用凝胶参数

凝胶浓度(%)
溴酚蓝
二甲苯青FF
3.5
100bp
460bp
5.0
65bp
260bp
8.0
45bp
160bp
12.0
20bp
70bp
15.0
15bp
50bp
20.0
12bp
45bp
七、氨基酸の特性
八、遗传密码
密码子の第二位
密码子の第一位(5’端)
U
C
A
G
密码子の第三位(3端’)
40~120
~1500
1500
2.5~3.5
1.5±3.5
3
1
SephadexG-25
粗级
100~300
(≈5~100目)
中级
50~150
(≈100~200目)
1,000~
5,000
100~
5,000
4~6
1.5±0.2
6
2
细级
20~800(≈200~400目)
超细
10~40
Sephadex G-50
1445
85
1.700
55.2
硫酸
H2P‘O4
98.10
18.00
1776
96
1.840
55.6
氢氧化铵
NH4OH
35.00
14.80
251
28
0.898
67.6
氢氧化钾
KOH
56.10
13.50
757
50
1.520
74.1
1.94
109
10
标准溶液的浓度
测定条件
酸性铬蓝K
0.1%乙醇溶液
Ca
Mg
红~蓝
红~蓝
pH = 12
pH = 10 (氨性缓冲溶液)
钙指示剂
与NaCl配成1:100的固体混合物
Ca
酒红~蓝
pH > 12 (KOH或NaOH)
铬天青S
0.4%水溶液
Al
Cu
Fe(II)
Mg
紫~黄橙
蓝紫~黄
蓝~橙
红~黄
pH = 4 (醋酸缓冲溶液),热
黄~紫
黄~紫红
pH > 10 (NaOH),25%乙醇
pH = 8~10 (氨性缓冲溶液)
pH = 7~8 (氨性缓冲溶液)
pH = 8.5~11.5 (氨性缓冲溶液)
PAN
0.1%乙醇〔或甲醇〕溶液
Cd
Co
Cu
Zn
红~黄
黄~红
紫~黄
红~黄
粉红~黄
pH = 6 (醋酸缓冲溶液)
醋酸缓冲溶液,70~80℃。以Cu2+离子回滴
标定NaOH溶液
含NaCl和蔗糖饱和液枯燥器
二水合草酸
标定NaOH溶液
室温空气枯燥
氯化钾
500~600℃枯燥至恒重
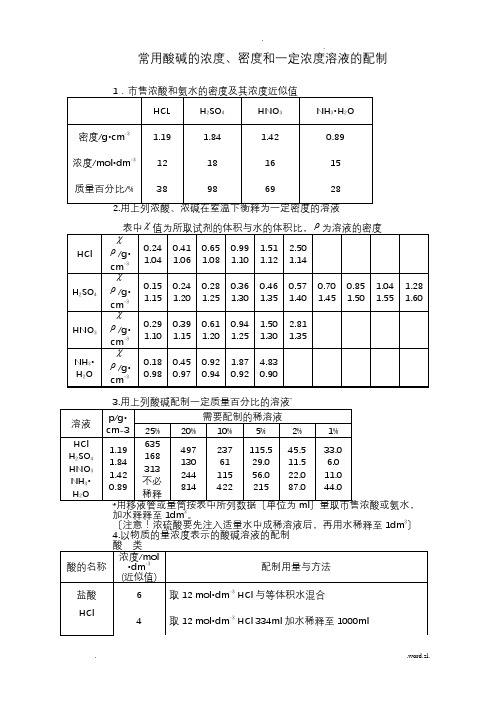
附录2 市售酸碱试剂的浓度及比重
试剂
比重
量浓度〔mol/L〕
重量百分浓度〔%〕
冰醋酸
氨水
苯胺
盐酸
氢氟酸
硝酸
高氯酸
磷酸
硫酸
三乙醇胺
浓氢氧化钠
饱和氢氧化钠
1.05
0.90
1.022
1.19
1.14
HNO3
/g•cm-3
