常用酸碱试剂的浓度与相对密度(20℃)
常用化学品安全操作说明书(硫酸碱液盐酸三氯化铁次氯酸钠焦亚硫酸钠片碱硫酸铝)

常用化学品安全操作说明书1、硫酸2、碱液3、盐酸4、三氯化铁5、次氯酸钠6、焦亚硫酸钠7、聚丙烯酰胺(PAM)8、片碱9、硫酸铝10、氩气一、浓硫酸分类与特性概述:外观及性状:纯品为无色油状液体,工业品因含杂呈黄色或棕色,无味。
中文名浓硫酸分子式H2SO4相对分子质量98.07CAS号7664-93-9危险性类别:8.1 类强酸性腐蚀品侵入途径:吸入、食入、皮肤接触。
最高容许浓度:车间空气中有害物质的最高容许浓度2mg/m3健康危害:刺激鼻、喉,引起打喷嚏、肺水肿、支气管粘膜发火、气阻、胸痛、呼吸短促、鼻和牙床出血,严重时灼伤鼻、口,引起肺水肿、慢性肺炎、皮炎,并灼痛眼睛,引起角膜损伤,甚至失明;过量食入导致流涎,极度口渴、吞咽困难、休克、牙龈损害、口腔、咽喉、胃及食管烧伤、恶心、呕吐物有咖啡粒状物、胃肠穿孔,肾损害;长期暴露症状相同甚至更严重。
危险特性 与碱发生中和反应并放热。
具有强烈的吸水性能和氧化性,对水猛烈结合放出大 量热。
对棉麻织物、木材、纸张等碳水化合物因脱水而炭化。
二、浓硫酸储存条件及方式:存在密闭容器中,置于凉爽、干燥、通风处,避免接触氯酸盐、铬酸盐、碳化物、雷酸盐、硝酸盐,金属粉未;防水,避免光照;储存区地面应为耐酸、耐腐蚀的坚固水泥地面,严禁烟火;储存处应使用防爆电器设备;禁用金属容器储存 三、使用时的注意事项:操作人员必须经过上岗培训,严格遵守操作规程和操作卡。
严禁烟火;戴防护镜,穿防护服;选用适当呼吸器。
避免与碱性物质和水接触。
搬运时要轻装轻卸,防止包装及容器损坏。
配备泄漏应急处理设备。
倒空的容器可能残留有害物。
稀释或制备溶液时,应严格遵守在搅拌下将硫酸缓慢加入水中,以免沸腾和飞溅。
工程控制 密闭操作。
提供安全淋浴和洗眼设备。
呼吸系统防护 可能接触其粉尘时,必须佩戴头罩型电机动送风过滤式 呼吸器。
必要时,佩戴空气呼吸器。
眼睛防护:戴化学安全防护面罩。
身体防护 穿耐酸碱橡胶皮靴,穿工作服(防腐材料制作)。
常用试液及配制方法

常用试液及配制方法硫代乙酰胺试液取硫代乙酰胺4g,加水使溶解成100ml,置冰箱中保存。
临用前取混合液[由1mol/l氢氧化钠溶液15ml、水5.0ml及甘油20ml组成]5.0ml,加上述硫代乙酰胺溶液1.0ml,置水浴上加热20秒钟,冷却,立即使用。
硫代硫酸钠滴定液(0.1mol/l)可用作硫代硫酸钠试液。
硫氰酸汞铵试液取硫氰酸铵5g与二氯化汞4.5g,加水使溶解成100ml,即得。
硫氰酸铵试液:取硫氰酸铵8g,加水溶解成100ml。
硫酸汞试液取黄氧化汞5g,加水40ml后,缓缓加硫酸20ml,随加随搅拌,再加水40ml,搅拌使溶解,即得。
硫氰酸铬铵试液:取0.5g硫氰酸铬铵,加水20ml,摇匀1小时,过滤。
这种液体应该暂时配制。
不适用于准备后48小时。
硫酸亚铁试液取硫酸亚铁结晶8g,加新沸过的冷水100ml使溶解,即得。
本液应临用新制。
硫酸苯肼试液取盐酸苯肼60mg,加硫酸溶液(1→2)100ml使溶解,即得。
硫酸钙试液该溶液为饱和硫酸钙水溶液。
加入100ml硫酸溶解二氧化钛,即100ml硫酸。
硫酸钾试液取硫酸钾1g,加水使溶解成100ml,即得。
硫酸铜试液:取硫酸铜12.5g,加水溶解成100ml。
硫酸铜铵试液取硫酸铜试液适量,缓缓滴加氨试液,至初生的沉淀将近完全溶解,静置,倾取上层的清液,即得。
本液应临用新制。
硫酸镁试液:取未干燥的硫酸镁晶体12g,加水溶解成100ml。
稀硫酸镁试液取硫酸镁2.3g,加水使溶解成100ml,即得。
氰化钾试液:取氰化钾10g,加水溶解成100ml。
氯试液本液为氯的饱和水溶液。
本液应临用新制。
氯化三苯基四氮唑试液:取1g氯化三苯基四氮唑,用无水乙醇溶解于200ml。
氯化亚锡试液取氯化亚锡1.5g,加水10ml与少量的盐酸使溶解,即得。
本液应临用新制。
取1g氯化金,用35ml水溶解,得到氯化金试液。
氯化钙试液取氯化钙7.5g,加水使溶解成100ml,即得。
氯化钡试液:取氯化钡细粉5g,加水溶解成100ml。
SDS溶液(20%,pH7.2)
北京雷根生物技术有限公司
SDS 溶液(20%,pH7.2)
简介:
SDS 即Sodium dodecyl sulfate ,中文名为十二烷基磺酸钠,也称十二烷基硫酸钠。
SDS solution(20%,pH7.2)是生化试剂,用途广泛,可以用于SDS-PAGE 、细菌碱裂解等。
组成:
操作步骤(仅供参考):
1、根据具体实验要求操作。
注意事项:
1、 如遇环境温度较低,溶液易产生沉淀,可以温浴加热促溶。
2、 Leagene SDS 溶液对人体有一定刺激性,请注意防护。
3、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 12个月有效。
相关:
编号 名称 R00171 Storage SDS solution(20%,pH7.2) 100ml RT 使用说明书 1份
编号 名称 CC0005 磷酸缓冲盐溶液(1×PBS,无钙镁) DC0032 Masson 三色染色液 IH0143
PBS 磷酸盐缓冲液(0.1mol/L,pH7.2-7.4) PE0080
Tris-HCl 缓冲液(1mol/L,pH6.8) PT0013
考马斯亮蓝快速染色液 PW0040
Western blot 一抗稀释液 TO1013 丙二醛(MDA)检测试剂盒(TBA 比色法)。
常用酸碱浓度表

盐酸 HCl 质量 百分数 1 2 4 6 8 10 12 14 16 18 20
20 密度 d 4 / g.cm-3
100mL 水溶 液中含 HCl/g
HCl 质量 百分数 22 24 26 28 30 32 34 36 38 40
20 密度 d 4 / g.cm-3
100mL 水溶液 中含 HCl/g
1.004 2.018 3.044 4.080 5.128 10.54 16.26 22.30 28.67 35.40 42.49 49.85 57.52 65.50 73.66 82.00
1.3931 1.4134 1.4337 1.4521 1.4686 1.4826 1.4850 1.4873 1.4892 1.4912 1.4932 1.4952 1.4974 1.5008 1.5056 1.5129
氢氧化钠
NaOH 质 量百分数 1 2 4 6 8 10 12 14 16 18 20 22 24
20 密度 d 4 / g.cm-3
100mL 水溶液 中含 NaOH/g
NaOH 质 量百分数 26 28 30 32 34 36 38 40 42 44 46 48 50 碳酸钠
20 密度 d 4 / g.cm-3
100mL 中 游离 SO3/g
1.860 1.865 1.870 1.875 1.880 1.885 1.890 1.895
2.8 5.0 8.0 10.2 12.1 13.7 15.4 17.7
1.900 1.905 1.910 1.915 1.920 1.925 1.930 1.935
19.1 20.1 21.8 25.5 30.6 35.9 41.2 49.6
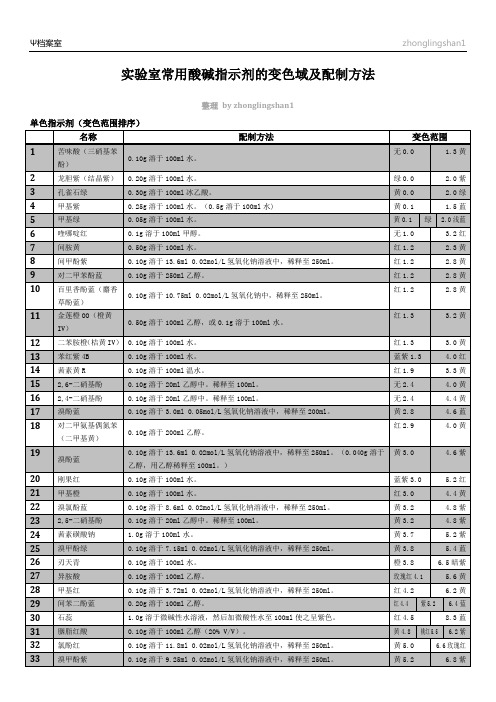
实验室常用酸碱指示剂的变色域及配制方法
无5.6
7.4黄
37
松色素
1.0g溶于乙醇。
无5.8
7.8红紫
38
溴百里香酚蓝(溴麝香草酚蓝)
0.10g溶于8.0ml 0.02mol/L氢氧化钠溶液中,稀释至250ml。
黄6.0
7.6蓝
39
儿茶酚紫
0.10g溶于100ml水。
黄6.0
7.0紫
40
姜黄
饱和水溶液。
黄6.0
13
苯红紫4B
0.10g溶于100ml水。
蓝紫1.3
4.0红
14
茜素黄R
0.10g溶于100ml温水。
红1.9
3.3黄
15
2,6-二硝基酚
0.10g溶于20ml乙醇中。稀释至100ml。
无2.4
4.0黄
16
2,4-二硝基酚
0.10g溶于20ml乙醇中。稀释至100ml。
无2.4
4.4黄
17
溴酚蓝
0.10g溶于3.0ml 0.05mol/L氢氧化钠溶液中,稀释至200ml。
黄2.8
4.6蓝
18
对二甲氨基偶氮苯(二甲基黄)
0.10g溶于200ml乙醇。
红2.9
4.0黄
19
溴酚蓝
0.10g溶于13.6ml 0.02mol/L氢氧化钠溶液中,稀释至250ml。(0.040g溶于乙醇,用乙醇稀释至100ml。)
黄3.0
4.6紫
20
刚果红
0.10g溶于100ml水。
蓝紫3.0
5.2红
1
13*
2g/L甲基红乙醇溶液
1
红紫
不明显蓝色
常见化学指示剂

酚酞试液化学式:C20H14O4酚酞为白色或微带黄色的细小晶体。
熔点258-262℃,相对密度1.27。
溶于乙醇(难溶于水而易溶于酒精。
因此通常把酚酞配制成酒精溶液使用),溶于稀碱溶液呈深红色,溶于酸性溶液颜色不发生变化,微溶于醚,不溶于水,无臭,无味。
由邻苯二甲酸酐和苯酚在加入脱水剂的条件下加热至115-120℃进行缩合制得。
化学用途酚酞溶液是一种酸碱指示剂。
酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式结构,当8.2醌式结构。
酚酞的变色范围是 8.2 ~ 10.0,所以酚酞只能检验碱而不能检验酸。
(浅红色)(红色)酚酞作为一种常用指示剂,广泛使用于酸碱滴定过程中。
通常情况下酚酞遇酸溶液不变色,遇中性溶液也不变色,遇碱溶液变红色。
然而,酚酞在强碱中由红色迅速退为无色,而在浓酸中也会变色,在稀酸溶液中酚酞滴加过量造成沉淀,使溶液变成白色浑浊。
(这是由于酒精易溶于水,使试剂中难溶于水的酚酞析出的缘故。
)酚酞的醌式或醌式酸盐,在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐式;遇到较浓的碱液,会立即转变成无色的羧酸盐式。
所以,酚酞试剂滴入浓碱液时,酚酞开始变红,很快红色退去变成无色。
酚酞遇浓硫酸变橙色。
酚酞指示剂的配制中华人民共和国国家标准:酚酞指示剂(0.5%酚酞乙醇溶液):取0.5g酚酞,用95%乙醇溶解,并稀释至 100mL,无需加水。
其实个人觉得用无水乙醇也是可以的,因为不能用水配置的原因是因为在水中溶解度小,况且,在用酚酞的时候是要往水溶液中滴加的,自然就会遇水,因此用无水乙醇,肯定不会有其他的什么坏处的,用95%的乙醇我想是考虑到成本原因吧,因此没必要用无水乙醇。
甲基红性状描述有光泽的紫色结晶或红棕色粉末,溶于乙醇和乙酸,几乎不溶于水;乙醇溶液经长时间保存后,可因羧基起酯化作用而使灵敏度显著降低;最大吸收波长410nm用途说明原生动物活体染色;酸碱指示剂,pH变色范围4.4(红)~6.2(黄);滴定氨、弱有机碱和生物碱,但不适用于除草酸和苦味酸以外的有机酸;可与溴甲酚绿和亚甲基蓝组成混合指示剂以缩短变色域和提高变色的敏锐性;沉淀滴定的吸附指示剂,如用硝酸钍滴定氟离子;检定游离氯、亚氯酸盐等氧化剂;甲基红是常用的酸碱指示剂之一,常浓度为0.1%乙醇溶液,pH4.4(红)-6.2(黄)。
酸碱指示剂的酸碱度范围选择和溶液浓度

酸碱指示剂的酸碱度范围选择和溶液浓度酸碱指示剂是一种常用于酸碱滴定反应中的物质,它可以通过改变颜色来指示溶液的酸碱性质。
在进行滴定实验时,选择合适的酸碱指示剂是十分重要的,因为它能够准确地反映溶液的酸碱度范围和浓度。
本文将探讨酸碱指示剂的酸碱度范围选择和溶液浓度对实验结果的影响。
酸碱指示剂的酸碱度范围选择是根据其酸碱性质和PH范围来确定的。
常见的酸碱指示剂有苏丹红、溴酚蓝、甲基橙等,它们分别对应着酸性、中性和碱性溶液。
首先是苏丹红,它是一种酸性指示剂,可以将酸性溶液的颜色变为红色。
苏丹红的酸碱度范围为PH 0-3,因此适用于酸性溶液的滴定实验。
对于酸碱中性或碱性溶液,苏丹红的指示效果较差。
其次是溴酚蓝,它是一种中性指示剂,会使中性溶液的颜色变为蓝色。
溴酚蓝的酸碱度范围为PH 6.0-7.6,因此适用于中性溶液的滴定实验。
对于酸性或碱性溶液,溴酚蓝的指示效果较差。
最后是甲基橙,它是一种碱性指示剂,可以将碱性溶液的颜色变为橙色。
甲基橙的酸碱度范围为PH 3.1-4.4,因此适用于碱性溶液的滴定实验。
对于酸性或中性溶液,甲基橙的指示效果较差。
除了酸碱度范围的选择,溶液浓度也对酸碱指示剂的使用产生影响。
一般来说,指示剂在浓度较低的溶液中呈现出较明显的颜色变化,而在浓度较高的溶液中颜色变化较为模糊。
例如,在进行酸碱滴定实验时,如果溶液浓度过高,就会导致指示剂颜色变化不明显,难以准确判断等价点。
因此,在实验中应当尽可能使用相对较低浓度的溶液,以确保可观察到明显的颜色变化。
此外,酸碱指示剂的选择还应考虑其化学稳定性和溶解性。
指示剂应具有良好的稳定性,不易受到光、热或其他因素的影响而发生变化。
溶解性也是一个重要的考虑因素,以确保指示剂能够充分溶解在溶液中,不会出现沉淀现象。
综上所述,选择合适的酸碱指示剂对于酸碱滴定实验的准确性和可靠性至关重要。
在选择酸碱指示剂时,应根据需求确定所需的酸碱度范围,并考虑溶液的浓度、化学稳定性和溶解性等因素。
常用酸碱指示剂配制

常用酸碱指示剂配制注:下列70余种指示剂按pH变色域由小到大顺序排列。
圆括号中列出的是其pH变色域。
左边系酸型色,右边系碱型色。
变色pH域可因观察者对颜色敏感程度不同而存在差异,它还受离子强度、温度、溶剂等因素影响,因而列出的数据为近似值。
配制下列指示剂凡是用0.02 mol/L及0.05 mol/L氢氧化钠溶液或乙醇溶解的,应将指示剂全部溶解后,然后稀释至—定的体积。
所用乙醇均指95%(体积分数)乙醇,应呈中性。
苦昧酸(三硝基苯酚)(无色0.0—1.3黄) 0.10 g溶于100 mL水。
结晶紫(龙胆紫)(绿0.0—2.0紫) 0.20 g溶于100 mL水。
孔雀绿(黄0.0—2.0绿) 0.3 g溶于100 mL冰乙酸。
《说明》孔雀绿的第二变色域是:绿11.0~13.5无色。
亮绿(黄0.0—2.6绿) 0.5 g溶于100 mL冰乙酸。
甲基紫(黄0.1—1.5蓝) 0.25 g溶于l00 mL水。
《说明》甲基紫的第二pH变色域是:蓝1.5~3.2紫。
每100 mL滴定液加3~5滴。
邻甲酚红(红0.2—1.8黄) 0.05~0.1 g溶于l00 mL 20%乙醇。
《说明》邻甲酚红第二pH变色域是:黄7.2—8.8红紫。
间胺黄(红1.2—2.3黄) 0.5 g溶于100 mL水。
《说明》每l00 mL滴定液加3~5 mL。
间甲酚紫(红1.2—2.8黄) 0.1 g溶于13.6 mL0.02 mol/L氢氧化钠中,用水稀释至250 mL。
对二甲苯酚蓝(红1.2—2.8黄) 0.10 g溶于250 mL乙醇。
百里(香)酚蓝(麝香草酚蓝)(红1.2— 2.8黄) ①0.10g溶于10.75 mL0.02 mol /L氢氧化钠中,用水稀释至250 mL。
②0.1 g溶于4.3 mL 0.05 mol/L氢氧化钠中,用水稀释至200 mL。
《说明》百里酚蓝第二变色域:黄8.0—9.6紫蓝。
《说明》每l00 mL滴定液加1~3滴。
常用酸碱试剂的浓度与相对密度(20℃)

常用酸碱试剂的浓度与相对密度(20℃)
在化学实验中,常用的酸碱试剂有很多种。
了解这些试剂的浓度和相对密度可以帮助我们更加准确地进行实验,得到更加可靠的结果。
下面是一些常用酸碱试剂的浓度和相对密度:
酸类试剂
盐酸
•浓度:37%
•相对密度:1.19
硝酸
•浓度:65%
•相对密度:1.42
硫酸
•浓度:98%
•相对密度:1.84
醋酸
•浓度:99.8%
•相对密度:1.05
磷酸
•浓度:85%
•相对密度:1.69
碱类试剂
氢氧化钠
•浓度:40%
•相对密度:1.53
氢氧化钾
•浓度:45%
•相对密度:2.12
碳酸氢钠
•浓度:10%
•相对密度:2.16
碳酸钠
•浓度:10%
•相对密度:2.53
氨水
•浓度:25%
•相对密度:0.90
需要注意的是,不同浓度的试剂在实验中可能会产生不同的效果,因此在使用之前最好先仔细阅读实验流程,并按照要求使用合适的浓度的试剂。
此外,对于那些相对密度较大的试剂,在使用时应该格外小心,避免发生意外事故。
以上是常用酸碱试剂的浓度与相对密度的一些基本信息,希望对你进行化学实验时有所帮助。
实验室常用试剂缓冲液配制方法一览表

实验常用试剂、缓冲液的配制方法1、1M Tris-HCl□组份浓度1 M Tris-HCl(pH7.4,7.6,8.0)□配制量1L□配置方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH 值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5 M Tris-HCl□组份浓度1.5 M Tris-HCl(pH8.8)□配制量1L□配置方法1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer□组份浓度100 mM Tris-HCl,10 mM EDTA (pH 7.4,7.6,8.0)□配制量1L□配置方法1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M 醋酸钠□组份浓度3 M 醋酸钠(pH5.2)□配制量100mL□配置方法1. 称取40.8gNaOAc•3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2. 加入冰乙酸调节pH值至5.2。
3. 加入去离子水将溶液定容至100mL。
亚硫酸氢钠安全技术说明书

亚硫酸氢钠安全技术说明书第一部分:化学品名称化学品中文名称:亚硫酸氢钠化学品俗名:酸式亚硫酸钠化学品英文名称:hydrogen sulfite sodium第二部分:成分/组成信息有害物成分含量亚硫酸氢钠≥40%第三部分:危险性概述侵入途径:吸入、食入、经皮吸收。
健康危害:对皮肤、眼、呼吸道有刺激性,可引起过敏反应。
可引起角膜损害,导致失明。
可引起哮喘;大量口服引起恶心、腹痛、腹泻、循环衰竭、中枢神经抑制。
环境危害:对环境有危害,对水体可造成污染。
燃爆危险:本品不燃,具腐蚀性,可致人体灼伤。
第四部分:急救措施皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:饮足量温水,催吐。
就医。
第五部分:消防措施危险特性:具有强还原性。
接触酸或酸气能产生有毒气体。
受高热分解放出有毒的气体。
具有腐蚀性。
有害燃烧产物:氧化硫、氧化钠。
灭火方法:尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直到灭火结束。
第六部分:泄漏应急处理应急处理:隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘口罩,穿防酸服。
不要直接接触泄漏物。
小量泄漏:避免扬尘,小心扫起,收集于干燥、洁净、有盖的容器中。
大量泄漏:收集回收或运至废物处理场所处置。
第七部分:操作处置与储存操作注意事项:密闭操作,局部排风。
防止粉尘释放到车间空气中。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿橡胶耐酸碱服,戴橡胶耐酸碱手套。
避免产生粉尘。
避免与氧化剂、酸类、碱类接触。
配备泄漏应急处理设备。
倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、通风的库房。
远离火种、热源。
防止阳光直射。
包装密封。
应与氧化剂、酸类、碱类分开存放,切忌混储。
生化试剂溶解方式及溶液状态
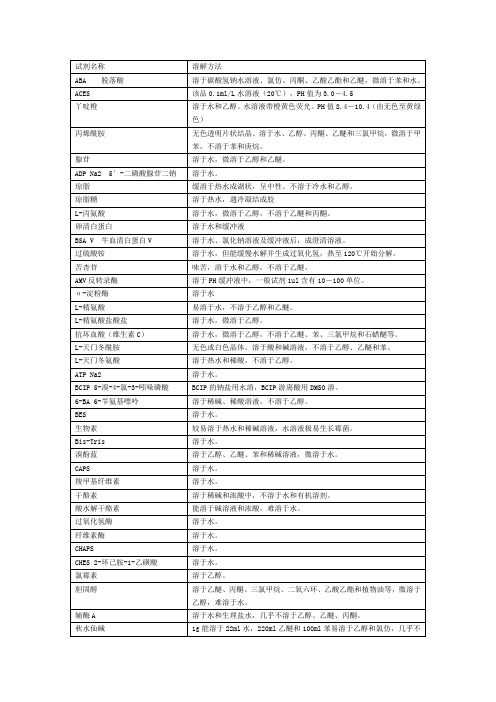
D-山梨醇
易溶于水,微溶于冷乙醇,不溶于乙醚。
亚精胺
能溶于水、乙醇和乙醚。
可溶性淀粉
溶于沸水,不溶于冷水、乙醇和乙醚。
蔗糖
易溶于水,微溶于乙醇。
TEMED四甲基乙二胺
能与水、乙醇和其他有机溶剂相混溶。
盐酸噻胺(维生素B1)
易溶于水和甲醇,溶于甘油,不溶于乙醇和苯。
MES 2-(N-吗啡啉)乙磺酸
溶于水。
L-甲硫氨酸
溶于水和稀乙醇,不溶于无水乙醇,乙醚和苯。
甲叉双丙烯酰胺
溶于水、乙醇和含水丙酮。
次甲基兰
难溶于冷水和乙醇,加热易溶乙醇,不溶于乙醚。
MOPS 3-(N-吗啡啉)丙磺酸
溶于水。
NAD98%辅酶I
溶于水,不溶于丙酮等有机溶剂。
NADH还原型辅酶I
溶于水。
噻唑兰(MTT)
能溶于水和甲醇,不溶于氯仿。
凝血酶
易溶于生理盐水,溶液呈淡黄色混浊溶液。
Tricine三(羟甲基)甲基甘氨酸
能溶于水。
Tris三羟甲基氨基甲烷
溶液水,不溶于乙醚。
Triton X-100曲拉通X-100
能溶于水、甲苯、二甲苯和乙醇,不溶于石油醚。
台盼兰
溶于水,溶液呈深蓝色,不溶于醇。
试剂名称
溶解方法
ABA脱落酸
溶于碳酸氢钠水溶液、氯仿、丙酮、乙酸乙酯和乙醚,微溶于苯和水。
ACES
该品0.1ml/L水溶液(20℃),PH值为3.0-4.5
丫啶橙
溶于水和乙醇。水溶液带橙黄色荧光。PH值8.4-10.4(由无色至黄绿色)
丙烯酰胺
无色透明片状结晶。溶于水、乙醇、丙酮、乙醚和三氯甲烷,微溶于甲苯,不溶于苯和庚烷。
化学试剂管理

氢氧化钠性状: 俗称烧碱、火碱、苛性钠, 常温下是一种白色晶体, 具有强腐蚀性。
易溶于水, 其水溶液呈强碱性, 能使酚酞变红。
保存条件: 密封干燥保存。
硫酸性状: 无色无味澄清粘稠油状液体。
对皮肤、粘膜等组织有强烈的刺激和腐蚀作用。
使用时应非常小心并穿戴保护手套和衣物。
浓硫酸溶解时放出大量的热, 因此浓硫酸稀释时应该“酸入水, 沿器壁, 慢慢倒, 不断搅”。
保存条件: 通风阴凉、密封保存。
盐酸性状: 学名氢氯酸, 是氯化氢的水溶液, 浓盐酸具有极强的挥发性, 挥发后与空气中的水蒸气结合产生的盐酸小液滴。
盐酸的密度=1+盐酸质量分数/2, 根据公式ω1ρ1V1=ω2ρ2V2 计算要加如的水即可。
稀释时必须是将水往浓盐酸里加。
保存条件: 通风阴凉、密封保存。
无水硫酸钠性状: 单斜晶系, 晶体短柱状, 集合体呈致密块状或皮壳状等, 无色透明, 有时带浅黄或绿色, 易溶于水。
白色、无臭、有苦味的结晶或粉末, 有吸湿性。
外形为无色、透明、大的结晶或颗粒性小结晶。
保存条件:储存于阴凉、通风的库房。
远离火种、热源。
应与酸类等分开存放, 切忌混储。
储区应备有合适的材料收容泄漏物。
乙二胺四乙酸性状: 白色无臭无味、无色结晶性粉末, 熔点240℃(分解)。
不溶于醇与一般有机溶剂, 能够溶于冷水(冷水速度较慢), 热水, 溶于氢氧化钠, 碳酸钠与氨的溶液中, 能溶于160份100℃沸水。
其碱金属盐能溶于水。
保存条件:贮于通风、干燥处, 注意防潮、防晒, 不宜与碱性化学物品混贮。
无水乙酸钠性状: 白色粉末。
有吸湿性。
易溶于水,溶于乙醇。
保存条件: 密封干燥保存变色硅胶性状: 蓝色硅胶猫砂分为蓝胶指示剂、变色硅胶猫砂和蓝胶, 外观为蓝色或浅蓝色玻璃状颗粒, 根据颗粒形状可分为球形和块状两种, 具有吸湿后自身颜色由蓝色变红色的特性。
本品为球形或不规则形状的颗粒, 根据外观的不同分为紫色、桔红色或黄色三种型号, 其主要成分为二氧化硅, 颜色随湿度不同而变化。
锰的化合物有哪些

锰的化合物有哪些锰的化合物主要有氧化物、氢氧化物、锰盐等三大类。
一、锰的氧化物锰的氧化物主要有一氧化锰(MnO)、二氧化锰(MnO2)、三氧化二锰(Mn203)、四氧化三锰(Mn3O4)、亚锰酸酐(Mn2O5)、锰酸酐(Mn03)和高锰酐(Mn2O7).Mn2O5和MnO3不能以游离状态存在,只能以亚锰基和锰酸基形式存在。
自然界中最常见的锰的氧化物有软锰矿(MnO2)、硬锰矿(mMnO·MnO2·nH20)、偏锰酸矿(MnO2·nH2O)、水锰矿[MnO2·Mn(OH)2]、褐锰矿(Mn203)、黑锰矿等。
含锰天然氧化物见表1。
表1 含锰天然氧化物MnO,Mn203,Mn304,MnO2等不溶于水,锰的各种氧化态,随氧化价的升高,碱性减弱,酸性增强,低价的MnO,Mn2O3属碱性;4价的MnO2属中性;高价的MnO3,Mn207为酸性。
(一)一氧化锰一氧化锰又称为氧化亚锰(MnO),分子量70.94,呈草绿色或灰绿色粉末,为碱性氧化物,在空气中易氧化,在大气中加热至不同温度时可以生成Mn304,Mn203,MnO2.常温下不溶于水,易溶于酸而生成玫瑰色的二价锰盐。
结晶水合物和Mn2+盐溶液的玫瑰色是因为存在[Mn(H20)6]2+离子的缘故。
MnO密度为5.43~5.46g/cm3,硬度为5~6,熔点1784℃.Mn0主要用于生产硫酸锰,因为生产硫酸锰的主要原料是软锰矿(Mn02),MnO2不溶于稀酸,必须预先还原成MnO。
纯度较高和重金属离子含量低的MnO可直接用于作肥料和饲料添加剂。
工业上生产MnO的方法主要是在回转窑或反射炉加碳还原软锰矿粉制得,也有报导可在多层移动炉、沸腾炉生产。
除采用软锰矿外还可用Mn(OH)2和MnCO3在隔绝空气条件下加热制得。
(二)四氧化三锰(Mn304)Mn304矿物学中又称之为黑锰矿,分子量228.82,理论含锰量72.03%,离子结构为Mn2+[Mn23+]O4,复合分子式为MnO·Mn203,属四方(斜方)晶系,是普通尖晶石结构。
盐酸试剂密度

盐酸试剂密度盐酸试剂是一种常用的化学试剂,在实验室以及工业生产中都有广泛的应用。
其密度是指单位体积的盐酸试剂的质量,通常用于计算溶液的浓度以及稀释比例。
盐酸,化学式HCl,是一种无色透明的液体,具有强烈的刺激性气味。
它是一种非常重要的酸性试剂,可以与金属氧化物、碱、碳酸盐等物质反应,产生相应的盐和水。
由于其强酸性和广泛的反应性,盐酸被广泛用于实验室和工业生产中的化学反应。
盐酸试剂的密度是一个重要的物理性质,它可以通过实验测定或者计算得到。
一般来说,盐酸的密度与其浓度相关。
在常温下,浓盐酸的密度约为1.18-1.20 g/mL,而稀盐酸的密度会略低一些。
测定盐酸试剂的密度可以使用密度计或者比重瓶等仪器。
在实验室中,通常会使用比重瓶来测量盐酸试剂的密度。
比重瓶是一种特殊的玻璃瓶,其底部有一个较小的开口,可以通过称重的方式测量其中液体的质量,从而计算出密度。
测定盐酸试剂密度的方法如下:1.首先,清洗比重瓶,确保其内壁干净无杂质。
2.用干净的滴管将一定量的盐酸试剂滴入比重瓶中,滴加量要适量,避免溢出。
3.用天平称量比重瓶的质量,记作m1。
4.将盐酸试剂充分摇匀,确保其中的气泡消除。
5.再次用天平称量比重瓶的质量,记作m2。
6.根据盐酸试剂的质量和比重瓶的容积,计算出盐酸的密度。
通过测定盐酸试剂的密度,可以得到其浓度的近似值。
盐酸与水的混合物,其密度与浓度之间有一定的关系,可以通过密度与浓度的对应关系表来进行估算。
根据这个对应关系,可以根据测得的盐酸密度,推算出其浓度。
盐酸试剂密度的测定对于实验室的化学分析和工业生产中的配方调整都非常重要。
通过准确测定盐酸试剂的密度,可以保证实验结果的准确性,以及生产过程中产品质量的稳定性。
因此,在实验和生产中,对盐酸试剂的密度进行准确的测定和控制是非常必要的。
盐酸试剂的密度是一个重要的物理性质,可以通过实验测定或者计算得到。
盐酸试剂密度的测定对于实验室和工业生产中的化学反应和产品质量的控制非常重要。
