物理化学第十章 复合反应动力学
物理化学第十章 复合反应动力学

链引发——链传递——链终止。
二、直链反应
H2+Br2=HBr气相反应是典型的直链反应,经实验 测定,其速率方程为: 0 .5
d c ( HBr ) dt kc ( H 2 ) c ( Br 2 ) 1 k ' [ c ( HBr ) / c ( Br 2 )]
三、支链反应和爆炸限
在链传递过程中,若自由基以几何级数增加,则构 成支链反应。支链反应若不加以控制,易发生爆炸。 现以典型的支链反应 2H2+O2==H2O 为例。 将H2和O2以2:1摩尔比充入容器,加热使其反应, 实验发现,在一定的温度和压力范围内将发生爆炸, 但在另外的温度和压力范围内则不发生爆炸。在低压 时,是否爆炸还与容器大小有关。
一、平衡态近似法
若反应物和中间产物可很快建立平衡,而中间产 物变为产物很慢,则可应用平衡态近似法处理。 设复合反应A+B=C的机理为:
b )A+B A
k2
k1 k -1
B+ C D(快)
c(D )
D C(慢) 近似平衡时: K c
d c (C) dt
k1 k 1 c (A) c (B)
1
1
2k2 1
k 1 / k 5 c ( H 2 ) c 2 ( Br 2 ) k4 k3 c ( HBr ) / c ( Br 2 )
kc ( H 2 ) c 2 ( Br 2 ) 1 k ' c ( HBr ) / c ( Br 2 )
此速率公式已被实验结果证实,机理假设合理。 (不一定唯一,更不一定正确)
物理化学6.4-1 典型复合反应

(2)平行竞争反应的产物
k1 Y A k2 Z
dcY dt
k1cA
dcZ dt
k
2cA
两式相比,且当 t=0 时 cY,0 =0、cZ,0 =0 ,积分,得
cY k1 cZ k2
(6-39)
特征: 由反应分子数相同的两元反应(或级数相同 的非元反应)组合,若初始只有反应物,则两平行 产物的数量之比等于其微观速率系数之比 。
k
k0
exp
Ea RT
如甲苯的氯化
FeCl3 (30-50℃) →苯环上取代 光激发 (120-130℃) →侧链取代
练习:
例:下列平行反应,主、副反应都是一级反应:
k1 A
k2
Y(主反应) Z(副反应)
已知
lg(k1
/
s
1
)
2000 T/K
4.00
lg(k 2
/
s 1
(1)对行正、逆元反应速率系数与可逆反应平衡常数的关系
A k1 Y k -1
k1, k-1—分别为正、逆反应的 微观速率系数(对元反应而言)。
正向反应,A的消耗速率
逆向反应,A的增长速率
dcA dt
k1cA
dcA dt
k1cY
则A的净消耗速率
dcA dt
k1cA
k 1cY
所以 cY = 0.0606 mol·dm-3,cZ = 0.00606 mol·dm -3
(2)
400
K时,cY
/
cZ
k1(400 K) k2 (400K)
《物理化学》(南大第五版)知识点总结

W=ΔU= CV dT ;ΔH= Cp dT
不可逆绝热过程:Q=0 ; 利用 CV(T2-T1)=-pe(V2-V1)求出 T2, W=ΔU= CV dT ;ΔH= Cp dT 2、相变化 可逆相变化:ΔH=Q=nΔ_H; W=-p(V2-V1)=-pVg=-nRT ; ΔU=Q+W
B (T , p, sln ) b , B (T ) RT ln a b , B ; ab,B=γb,B bB;
标准态为:同温下 bB=1 且符合
亨利定律的溶质(假想状态) 。
B (T , p, sln ) %, (T ) RT ln a%, B ; a%,B=γ%,B[%B]; B
标准态为:同温下[B%]=1 且
符合亨利定律的溶质(一般为假想状态) 。 三、各种平衡规律 1、液态混合物的气液平衡
* pA=p * A ax,A ; pA=p A ax,A ; p=pA+pB
2、溶液的气液平衡
pA=p * A ax,A;pB=kx,Bax,B=kb,Bab,B=k%,Ba%,B;p=pA+pB
r Gm (T ) RT ln K
[ p( H 2 ) / p ][c( ZnCl 2 )] c2 (H C l )
三、 范特荷夫等温方程
r Gm (T ) r Gm (T ) RT ln J RT ln J / K
四、平衡常数与温度的关系
B f Gm ( B,298)
(4)ΔG 与温度的关系 ΔG=ΔH-TΔS ,设 ΔH、ΔS 不遂温度变化。 五、化学势 1、化学式的定义和物理意义
B (
G ) T , p ,nc ( c B ) ;在 T、p 及其他物质的量保持不变的情况下,增加 1molB 物质引 n B
(完整版)物理化学课程教学大纲

物理化学课程教学大纲一、课程说明(一)课程名称、所属专业、课程性质、学分;课程名称: 物理化学(PhysicalChemistry)所属专业:材料化学课程类别:专业课课程性质:专业课(必选)学分: 3学分(54学时)(二)课程简介、目标与任务、先修课与后续相关课程;课程简介:物理化学又称理论化学,是从研究化学现象和物理现象之间的相互联系入手,从而找出化学运动中最具普遍性的基本规律的一门学科。
共包括4部分内容:第1部分,热力学。
内容包括:热力学第一定律、热力学第二定律、化学势、化学平衡、相平衡。
第2部分,电化学。
内容包括:电解质溶液、可逆电池电动势、不可逆电池过程。
第3部分,表面现象与分散系统。
内容包括:表面现象、分散系统。
第4部分,化学动力学。
内容包括:化学动力学基本原理、复合反应动力学。
目标与任务:使学生掌握物理化学基本概念及计算方法,同时还应得到一般科学方法的训练和逻辑思维能力的培养。
这种训练和培养应贯穿在课堂教学的整个过程中,使学生体会和掌握怎样由实验结果出发进行归纳和演绎,或由假设和模型上升为理论,并结合具体条件用理论解决实际问题的方法。
先修课与后续相关课程:先修课:高等数学(微分、积分)、大学普通物理、无机化学、有机化学、分析化学后续相关课程:无。
(三)教材与主要参考书。
教材:物理化学简明教程,第四版,印永嘉等编,高等教育出版社出版.2007参考书目:[1] 付献彩主编,《物理化学》上、下册. 第五版.高等教育出版社出版.2006[2] 胡英主编,《物理化学》上、中、下册. 第一版,北京:高等教育出版社出版.2001[3] 宋世谟主编,《物理化学》上、下册,第四版.北京:高等教育出版社出版.2001[4] 物理化学简明教程例题与习题,第二版,印永嘉等编,高等教育出版社出版二、课程内容与安排绪论讲授,1学时。
第一章热力学第一定律1.1 热力学的研究对象1.2 几个基本概念1.3 能量守恒1.4 体积功1.5 定容及定压下的热1.6 理想气体的热力学能和焓1.7 热容1.8 理想气体的绝热过程1.9 实际气体的节流膨胀1.10 化学反应的热效应1.11生成焓及燃烧焓1.12反应焓与温度的关系(一)教学方法与学时分配讲授,8学时。
第10章 复合反应动力学

对行反应的行反应的特点:
1.净速率等于正、逆反应速率之差值 2.达到平衡时,反应净速率等于零 3.在c~t图上,达到平衡后,反应物和产物 的浓度不再随时间而改变
11
10.1-1.对行反应
对行反应的特点:
4.正、逆速率系数之比等于平衡常数 与 k = k1 + k-1 联立,即可求得 k1 和 k-1 。 5. 速率方程可写为:
物中cB/cD之值。假设B是所需要的主产物,为
了获得更多的主产物,该平行反应在哪个温度
下进行更有利?
26
10.1-2.平行反应
解:根据阿伦尼乌斯公式 k = k0e-Ea/RT
k 0,1 E a , 2 E a ,1 c B k1 k 0,1e exp( ) Ea , 2 / RT c D k 2 k 0, 2 e k 0, 2 RT
k1c A ,0 (k1 k 1 )c A k 1c A ,0
(k1 k 1 )t
当对行反应达平衡时有υ+ =υ-,又因为cB,e = cA,0 – cA,e ,有: k1cA,e = k-1 cB,e = k -1(cA,0 - cA,e ) 代入上式得 k-1cA,0 =(k1 + k-1)cA,e cA,0 = ( k1 + k-1) cA,e / k-1 k1cA,0 = ( k1 + k-1) k1cA,e / k-1 (因k1cA,e = k-1 cB,e)
8
10.1-1.对行反应
另解如下:因 k-1cA,0 =(k1 + k-1)cA,e
dcA (k1 k 1 )cA k 1cA,0 dt (k1 k 1 )cA (k1 k 1 )cA,e
物理化学简明教程第四版课件07-10

( k1 k2 ) t
y
k1a k1 k 2
1 e
( k1 k 2 ) t
§10.1 典型复合反应动力学
3)平行反应的特征
y k1 ①特征: 即产物之比等于速率常数之比 z k2
平行反应的特征
§10.1 典型复合反应动力学
②改变k1/k2的方法: 欲使k1>k2
dC I、 A k (a x) 1 dt
dc B II、 K1 ( a x ) K 2 ( x y ) dt
dCC III、 k 2 (x y) dt
§10.1 典型复合反应动力学
②A、B、C浓度随时间变化规律
I、C A a x ae
k1t
ak1 k1t k 2 t II、C B x y (e e ) k 2 k1 k2 k1 k1t k 2 t III、C C y a 1 e e k 2 k1 k 2 k1
活性质点,同时产生两个或两个以上的新活性质点,
使反应像树枝状支链的形式迅速传递下去。 因而反应速度急剧加快,引起支链爆炸。如果 产生的活性质点过多,也可能自己相碰而失去活性,
使反应终止。
氢与氧气生成水汽的反应 2H2(g)+O2(g)→2H2O(g) (总反应)
这个反应看似简单,但反应机理很复杂,至今 尚不十分清楚。但知道反应中有以下几个主要步骤 和存在H、O、OH和HO2等活性物质。
为防止催化剂中毒,反应物必须预先净化
催化作用分类 1)均相催化 催化剂与反应系统处在同一个相的称为均相催化。
如用硫酸作催化剂使乙醇和乙酸生成乙酸乙 酯的反应是液相均相反应。 2)复相催化 催化剂与反应系统处在不同相的称为多相催化。 如用固体超强酸作催化剂使乙醇和乙酸生成 乙酸乙酯的反应是多相催化反应。石油裂解、直 链烷烃芳构化等反应也是多相催化反应。 3)生物催化(酶催化) 如馒头的发酵、制酒过程中的发酵。
2023年大学_物理化学简明教程(邵谦著)课后答案下载

2023年物理化学简明教程(邵谦著)课后答案下载2023年物理化学简明教程(邵谦著)课后答案下载绪论0.1 物理化学的研究对象及其重要意义0.2 物理化学的研究方法0.3 学习物理化学的方法第一章热力学第一定律(一)热力学概论1.1 热力学的研究对象1.2 几个基本概念(二)热力学第一定律1.3 能量守恒--热力学第一定律1.4 体积功1.5 定容及定压下的热1.6 理想气体的热力学能和焓1.7 热容1.8 理想气体的绝热过程1.9 实际气体的节流膨胀(三)热化学1.10 化学反应的热效应1.11 生成焓及燃烧焓1.12 反应焓与温度的关系--基尔霍夫方程思考题第二章热力学第二定律2.1 自发过程的共同特征2.2 热力学第二定律的经典表述2.3 卡诺循环与卡诺定理2.4 熵的概念2.5 熵变的计算及其应用2.6 熵的物理意义及规定熵的计算2.7 亥姆霍兹函数与吉布斯函数2.8 热力学函数的?些重要关系式2.9 厶C的计算__2.10 非平衡态热力学简介思考题第三章化学势3.1 偏摩尔量3.2 化学势3.3 气体物质的化学势3.4 理想液态混合物中物质的化学势 3.5 理想稀溶液中物质的化学势3.6 不挥发性溶质理想稀溶液的依数性 3.7 非理想多组分系统中物质的化学势思考题第四章化学平衡4.1 化学反应的方向和限度4.2 反应的标准吉布斯函数变化4.3 平衡常数的各种表示法4.4 平衡常数的实验测定4.5 温度对平衡常数的影响4.6 其他因素对化学平衡的影响思考题第五章多相平衡5.1 相律(一)单组分系统5.2 克劳修斯一克拉佩龙方程5.3 水的相图(二)二组分系统5.4 完全互溶的双液系统__5.5 部分互溶的双液系统__5.6 完全不互溶的双液系统5.7 简单低共熔混合物的固一液系统 5.8 有化合物生成的固一液系统__5.9 有固溶体生成的固一液系统(三)三组分系统5.10 三角坐标图组成表示法__5.11 二盐一水系统__5.12 部分互溶的三组分系统思考题第六章统计热力学初步6.1 引言6.2 玻耳兹曼分布6.3 分子配分函数6.4 分子配分函数的求算及应用第七章电化学(一)电解质溶液7.1 离子的迁移7.2 电解质溶液的电导7.3 电导测定的应用示例7.4 强电解质的活度和活度系数__7.5 强电解质溶液理论简介(二)可逆电池电动势7.6 可逆电池7.7 可逆电池热力学7.8 电极电势7.9 由电极电势计算电池电动势7.10 电极电势及电池电动势的应用(三)不可逆电极过程7.11 电极的.极化7.12 电解时的电极反应7.13 金属的腐蚀与防护__7.14 化学?源简介第八章表面现象与分散系统(一)表面现象8.1 表面吉布斯函数与表面张力 8.2 纯液体的表面现象8.3 气体在固体表面上的吸附 8.4 溶液的表面吸附8.5 表面活性剂及其作用(二)分散系统8.6 分散系统的分类8.7 溶胶的光学及力学性质8.8 溶胶的电性质8.9 溶胶的聚沉和絮凝8.10 溶胶的制备与净化__8.11 高分子溶液思考题第九章化学动力学基本原理9.1 引言9.2 反应速率和速率方程9.3 简单级数反应的动力学规律9.4 反应级数的测定9.5 温度对反应速率的影响9.6 双分子反应的简单碰撞理论9.7 基元反应的过渡态理论大意__9.8 单分子反应理论简介思考题第十章复合反应动力学10.1 典型复合反应动力学10.2 复合反应近似处理方法10.3 链反应__10.4 反应机理的探索和确定示例10.5 催化反应10.6 光化学概要__10.7 快速反应与分子反应动力学研究方法简介思考题附录Ⅰ.某些单质、化合物的摩尔热容、标准摩尔生成焓、标准摩尔生成吉布斯函数及标准摩尔熵Ⅱ.某些有机化合物的标准摩尔燃烧焓(298K)Ⅲ.不同能量单位的换算关系Ⅳ.元素的相对原子质量表Ⅴ.常用数学公式Ⅵ.常见物理和化学常数物理化学简明教程(邵谦著):内容简介本教材自8月出版以来,受到了广大读者,特别是相关高校师生的厚爱,并被许多高校选作教材。
第十章 复合反应动力学

第十章 复合反应动力学第一次课:课程名称:物理化学本课内容:§10.1典型复合反应授课时间: 90 分钟一、教学目的通过本次教学,使学生了解复合反应的类型,掌握各类复合反应的特点及反应速率方程。
二、教学意义通过本次授课,使学生进一步认识复合反应的类型及动力学特征,了解不同反应的速率方程。
三、教学重点典型复合反应类型:对峙反应、平行反应及连续反应四、教学难点典型复合反应的速率方程的特点五、教学方式以电子课件为主,辅以少量板书的课堂讲授六、讲授内容§10.1 典型复合反应动力学1.对峙反应2.平行反应3.连串反应七、讲授方法§10.1 典型复合反应动力学通过课间演示,举例说明依次向学生展现三种典型的复合反应:1.对峙反应先介绍对峙反应的概念,进而指出对峙反应的动力学特征,即反应物A的浓度随反应时间的增长不可能降低到零,而产物的浓度亦不能增加到A的起始浓度。
再通过实例讲述温度对对峙反应速率的影响。
2.平行反应先通过课间介绍平行反应的概念,即由相同的反应物同时进行不同的反应得到不同的产物,这种类型的反应称为“平行反应”,也称为“竞争反应”。
选取2个一级基元反应构成的最简单的平行反应,进行详尽讲述。
从而进一步介绍平行反应的动力学特征,即产物数量之比等于其速率常数之比,亦即在反应过程中各产物数量之比保持恒定,这是平行反应的特征。
3.连串反应首先讲解连串反应的概念,即如果一反应要经几个连续的基元反应方能到达最后产物,而前一基元反应的产物为后一基元反应的反应物,则这种类型的反应称为“连串反应”,也称“连续反应”。
之后通过举例分析,指出连串反应的动力学特征,即物质A的浓度随时间增长而降低,物质C的浓度随时间增长而增大,而物质B的浓度先增大,经过一极大点后,又随时间增长而降低。
八.时间分配:本次课全部用时90分钟,分配如下:对峙反应30分钟,平行反应30分钟,连续反应30分钟九.讨论、思考与作业:讨论与思考:1.一个具有复合机理的反应,其正逆向反应的速率控制步骤是否一定相同?2.若某反应实际是由A一步生成B,是否可能使B经中间物C逆向回到A?作业:习题3,4,6,8,9。
物理化学第三版第十章_复合反应动力学及反应速率理论资料

A
B
(k1)
C
(k2)
如果这两个反应都是一级反应,则
dcB/dt =k1cA dcC/dt =k2cA
若反应开始时只有A,则按计量关系可知
cA+cB+cC =cA,0
dcA dcB dcC 0 dt dt dt
- dcA dt
= dcB dt
dcC dt
=(k1+k2 )cA
cA dcA
第十章 复合反应动力学及反应速率理论
§10.1 平行反应(parallel reaction)
相同反应物同时进行若干个不同的反应称 为平行反应。
这种情况在有机反应中较多,通常将生成期 望产物的一个反应称为主反应,其余为副反应。
总的反应速率等于所有平行反应速率之和。 平行反应的级数可以相同,也可以不同, 前者数学处理较为简单。
逆向反应速率应近似视为相等:
k1cAcB k1cC
dcD dt
k2cC
令
k k1k2 / k1
cC c A cB
KC
dcD dt
KCk2cAcB
k1k2 k1
cAcB
所以
dcD dt
kcAcB
支链反应——H2和O2反应的历程
支链反应也有链引发过程,所产生的活性质点一 部分按直链方式传递下去,还有一部分每消耗一个 活性质点,同时产生两个或两个以上的新活性质点, 使反应像树枝状支链的形式迅速传递下去。
(1)k1>>k2,第二步为速控步
dcC dt
dcA dt
k2cA
cC = cA,0(1- e-k2t)
(2)k2>>k1,第一步为速控步
dcC dt
物理化学知识点总结[物理化学知识点归纳]
![物理化学知识点总结[物理化学知识点归纳]](https://img.taocdn.com/s3/m/ea35e0ce227916888586d7c1.png)
物理化学知识点总结[物理化学知识点归纳]热力学第一定律...............................................................................(1)第二章热力学第二定律. (3)第三章化学势 (7)第四章化学平衡 (10)第五章多相平衡 (12)第六章统计热力学基础 (14)第七章电化学 (16)第八章表面现象与分散系统 (20)第九章化学动力学基本原理 (24)第十章复合反应动力学 (27)物理化学知识点归纳根据印永嘉物理化学简明教程第四版编写,红色的公式要求重点掌握,蓝色的公式掌握。
第一章热力学第一定律本章讨论能量的转换和守恒,其目的主要解决变化过程的热量,求功的目的也是为了求热。
1. 热力学第一定律热力学第一定律的本质是能量守恒定律,对于封闭系统,其数学表达式为∆U =Q +W 微小过程变化:d U =δQ +δW只作体积功:d U =δQ −p e d V 理想气体的内能只是温度的函数。
2. 体积功的计算:δW V =−p 外d VW V =−∫p 外d VV 1V 2外压为0(向真空膨胀,向真空蒸发):W V =0;恒容过程:W V =0恒外压过程:W V =−p 外(V 2−V 1) 恒压过程:W V =−p (V 2−V 1) 可逆过程:W V =−∫V 2V 1p d V (主要计算理想气体等温可逆、绝热可逆过程的功)3. 焓和热容由于大多数化学反应是在等压下进行的,为了方便,定义一个新的函数焓:H =U +pV焓是状态函数,是广度性质,具有能量,本身没有物理意义,在等压下没有非体积功的热效应等于焓的改变量。
等容热容:C V = δQ V⎛∂U ⎛=⎛⎛ d T ⎛∂T ⎛V等压热容:C p =δQ p⎛∂H ⎛=⎛⎛ d T ⎛∂T ⎛p对于理想气体:C p −C V =nR4. 理想气体各基本过程中W 、Q 、∆U 、∆H 的计算5. 焦耳-汤姆逊系数µ=⎛⎛∂T ⎛1⎛∂H ⎛=−⎛⎛⎛,用于判断气体节流膨胀时的温度变化。
物理化学第九章第十章

第九章 《化学动力学基本原理》第十章 《复合反应动力学》一、选择题1.在TK时,对于某一简单级数反应的半衰期与反应物起始浓度的关系,正确的是( )。
A. 对一级反应为反比;B. 对二级反应为正比;C. 对零级反应为正比;D. 无明确关系。
2.某反应的反应物消耗3/4所需时间是消耗1/2所需时间的二倍,则反应级数为( )。
A. 零级;B. 一级;C. 二级;D. 三级。
3.基元反应的反应级数( )反应分子数。
A. 总大于;B. 总小于;C. 总等于;D. 等于或小于。
4.某放射性同位素的半衰期为5天,则经15天后所剩的同位素的物质的量是原来同位素的物质的量的( )。
A. 1/3;B. 1/4;C. 1/8;D. 1/16。
5.某反应的速率常数k = 2×10-2 dm3· mol-1 · s-1,当反应物初始浓度为1.0 mol · dm-3时,反应的半衰期为( )。
A. 50 s ;B. 15 s ;C. 30 s ;D. 21.65 s 。
6.反应速率常数随温度变化的阿仑尼乌斯经验式适用于( )。
A. 基元反应; B. 基元反应和大部分非基元反应;C. 非基元反应;D. 所有化学反应。
7.反应物A进行由两个一级反应组成的平行反应: 步骤⑴的速率常数为k1,步骤⑵的速率常数为k2。
已知k1> k2,若两步骤的指前因子相近且与温度无关, 则( )。
A. 升温对⑴和⑵的影响相同;B. 升温对⑴有利;C. 升温对⑵有利;D. 降温对⑵有利。
8.某物质A与水反应,在水溶液中,若A起始浓度为1mol/kg,1h后,浓度为0.5 mol/kg,2h后, 浓度为0.25mol/kg, 则对A来说,此反应的级数为( )。
A. 零级;B. 一级;C. 二级;D. 三级。
9.在Tk时,某一反应的速率常数为0.0693min-1,反应物起始浓度0.1mol/L, 则半衰期为()。
考研《物理化学》考点精讲教程(第10讲 化学动力学基础)

k (cA,0
y)(cB,0
y)
t 0:
t=t:
A + BD + …
≠ cA ,0
cB ,0
cA
cB
= =
cA,0 - y cB,0 - y
1
ln cB,0 (cA,0 y) kt
(cA,0 cB,0 ) cA,0 (cB,0 y)
Ø k 的量纲: (浓度) - 1 (时间) - 1
k
1
ln cB,0 cA
3. 半衰期法
t1/ 2
2n1 1
(n
1)k
cn1 A,0
令B 2n1 1 , (n 1)k
则:t1/2 BcA1,0n
lg tˊ1/ 2 = (1 - n) lgˊcA,0 + lg B
lg t1〞/ 2 = (1 - n) lg cA〞,0 + lg B
lg
t1/ 2 t1/ 2
k 1 ln pA,0 t pA
Ø半衰期: cA=cA,0 /2 所需的时间
t1/ 2
1 k
ln
cA,0 cA,0 /2
t1/ 2
ln 2 k
0.693 k
kp kc
《物理化学》考点精讲教程
n级反应
A + ······ P
微分式:
A
dpA dt
kpAn
dpA pAn
kdt
积分式:
pA dpA
1 n
lg
cA ,0 cA,0
n
1
lg(t1 / 2 lg (cA,0
t1/ 2 ) cA ,0 )
《物理化学》考点精讲教程
10.3 温度对反应速率的影响
物理化学课件-第10章 复合反应动力学
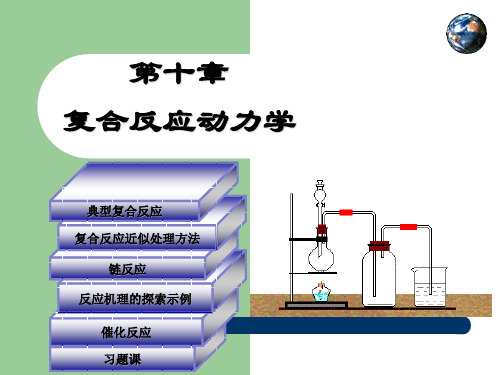
积分 a ln (k1 k2 )t ax
a x ae
( k1 k2 ) t
12
典型复合反应 近似处理
链反应
机理探索
催化反应
习题课
dy ( k1 k 2 ) t k1ae dt
积分
y
0
dy k1a e
0
t
( k1 k2 ) t
2 1
1/T (1) E1>E2 A1>A2 高温:第二步控制; 低温:第一步控制 lnk~1/T出现斜率改变,说明r.d.s改变 (2) E1>E2 A1<A2 在某温度范围内总反应速率始终由第一步控制
23
典型复合反应 近似处理 链反应 机理探索 催化反应 习题课
例 某气相1-2级对峙反应:
A(g)
dt
k1 a ( k1 k 2 ) t y [1 e ] k1 k 2
同理
k2a ( k1 k 2 ) t z [1 e ] k1 k 2
13
典型复合反应 近似处理
链反应
机理探索
催化反应
习题课
平行反应特征分析:
(1) 浓度特征 c y/z=k1/k2 (k1/k2 代表了反应的选择性) 改变方法: B
xe xe k ln at xe x
a t k t xe
a xe xe k ln at xe x
6
典型复合反应 近似处理
链反应
机理探索
催化反应
习题课
对峙反应特征分析 1、浓度与t的关系
c a xe
A B
k
[ A] a x ae 0 [ B] x a ae kt a
物理化学:第十章 电化学反应的热力学与动力学

该式叫离子独立运动定律。
⑶弱电解质的m∞ :
可直接查表: m∞ =λ+∞ +λ-∞
可通过测强电解质的m∞求得:
例如:Λ( m HAc)=Λ( H+)+Λ( Ac-)
=[Λ( H+)Λ( Cl-)]+[Λ( Ac-)Λ( Na+)] -[Λ( Cl-)Λ( Na+)]
在两相或数相间存在电势差的系统叫电化学系统。
电化学系统研究
电化学系统的热力学; 电化学系统的动力学。
①电化学系统的热力学
主要研究电化学系统中没有电流通过时系统的性质,亦 即有关电化学反应平衡的规律。
②电化学系统的动力学 主要研究电化学系统中有电流通过时系统的性质,亦即有 关电化学反应速率的规律。
二. 电化学系统的研究方法
Λ
m
HCl
Λ
m
C
2
H
5
COONa
Λ
m
NaCl
=(42.616+8.592-12.665)103S·m2·mol1 =38.543103S·m2·mol1
10.5 离子的平均活度、平均活度因子
一.电解质和离子的化学势
电解质溶液中,
溶质(
即电解质)
的化学势
B
def
G nB
T
,
p,
nA
根据电解质电离度大小分类:
电解质分为
强电解质 弱电解质
在溶剂中全部电离; 在溶剂中部分电离。
强弱电解质的划分除与电解质本身性质有关外,还取决于
溶剂性质。例如,CH3COOH在水中部分电离属弱电解质,而 在液氨中则全部电离,属强电解质。
根据电解质的结合键类型分类:
电解质分为 真正电解质 潜在电解质
物理化学复件 动力学2

dCM =0 dt
例1:气相反应 : 反应历程
H 2 + Cl 2 → 2 HCl Cl 2 k1 2Cl → H2 + Cl HCl + H →
k2 k3
hν
Cl2 + H HCl + Cl → 2Cl → Cl 2
k4
用稳定态近似法证明
dC HCl 12 = kC H 2 C Cl 2 dt
dC M =0 dt
ln(k1 / k2) 处的时间。 处的时间。 tMm = k − k ax 1 2
四. 链反应
反应经引发后,能相继发生一系列有自由基 定义------ 反应经引发后,能相继发生一系列有自由基 定义 或自由原子参加的连串反应 或自由原子参加的连串反应, 使反应自动进 参加的连串反应 行下去. 行下去 自由基(自由原子 ----- 一种具有未成对电子的原子基团 自由基 自由原子) 自由原子 (或原子 它具有很高的化学活泼性 不稳定 或原子), 它具有很高的化学活泼性 不稳定, 很高的化学活泼性, 或原子 很容易重新结合成正常分子. 很容易重新结合成正常分子 如自由原子: 如自由原子 H 、Cl、I、Br 等; 、、 自由基: 甲基自由基) 乙酰基自由基) 自由基:CH3(甲基自由基) 、CH3CO(乙酰基自由基) 甲基自由基 等。
由实验确定的速率方程为
r = kCH + CHNO2 CBr−
反应历程
H + HNO2
+
k1 k −1
+ H 2 NO2
快速平衡 慢 快
+ H 2 NO2 + Br − k 2 ONBr + H 2O →
+ ONBr + C6 H 5 NH2 k3 C6 H 5 N2 + H 2O + Br →
复合反应动力学方程、及处理方法1
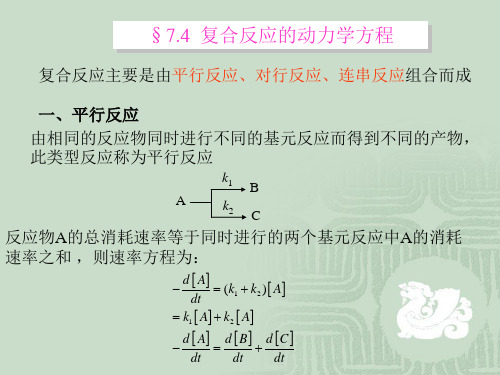
链传递
k3 OH H 2 H 2 O H 直链 k4 H O2 OH O
O H 2 OH H
k5
支链
链终止
k6 H H H 2 k7 H OH H 2 O k8 H O2 M HO2 M
m 1 2 1 2
代入(5)式可得中间物能达到的最大浓度
B m A (k1
k2 )
k2 k2 k1
§7.5 复合反应动力学处理中的近似方法
解复合反应速率方程时常采用的近似方法有:选取控制步骤法、 稳态近似法和平衡态近似法 一、选取控制步骤法 动力学处理中引用总反应速率近似等于控制步骤反应速率的方 法称为选取控制步骤法 对于一级连串反应
三、连串反应
由几个连续的基元反应所组成的反应称为连串反应或连续反应
k1 k2 A B C
其速率方程为
d A
dt d B dt d C dt
k1 A
(1) (2) (3)
k1 A k2 B k2 B
(1)式移项积分得反应物A的解,将其带入(2)式,可得 关于B的一线性微分方程
k exp(k1t ) k1 exp(k2t ) C A 1 2 (6) k2 k1
中间物达到的最大浓度时所需的反应时间 称为生成中间物的最佳时间, 以 tm 表示 (5)式对 时间t 求导并令其导数为0,即 可求出tm t 1 (k k ) ln(k k )
2
d ln k Ea dT RT 2
活化能的定义 (阿累尼乌斯活化能 )
复合反应总反应的活化能称为总活化能或表观活化能,与组成 复合反应的各基元反应的活化能有关 是何关系?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
k 2c (B )c (D )
k1k 2 k 1
c ( A ) c ( B ) kc ( A ) c ( B )
二、稳态近似法
若中间产物非常活泼(如自由基),一旦生成 将立即变为反应物或产物,其浓度保持极低的稳 定值,可以用稳态近似法处理。 设反应为 A+B
(1)A+B
k1
1
c ( Br )
k1 k5
1
c 2 ( Br 2 )
c ( H )
k2
k 1 / k 5 c ( H 2 ) c 2 ( Br 2 )
k 3 c ( Br 2 ) k 4 c ( HBr )
二、直链反应
d c ( HBr ) dt 2 3 4
=k2c(Br· 2)+k3c(H· )c(H )c(Br2)-k4c(H· )c(HBr)
( k1 k 2 ) t
0
d y k1a e
0
t
( k1 k 2 ) t
dt
c(B ) y
k1a k1 k 2
k2a k1 k 2
[1 e
( k1 k 2 ) t
]
同理 c ( C ) z
[1 e
( k1 k 2 ) t
]
10-1 平行反应
4 k 4 c (H ) c ( HBr)
③ H Br 2 3 HBr Br
k
④ H HBr 4 H 2 Br
k
二、直链反应
⑤ 2 Br M 5 Br 2 M
k
5 k 5 c ( Br )
2
该机理是否正确,可用稳态法导出其速率公式。
实例:乙醇 乙醚 模型: k1 A k2 C B 两反应皆为一级
设A的起始浓度为a,t时刻反应掉x,生成的c(B)和 c(C)分别为y和z ,即 c(A)=a-x, c(B)=y, c(C)=z
10-1 平行反应
1、速率方程
dc(A ) dt dc(B ) dt d c (C ) dt dx dt
)
根据c(C)=c0(A)-c(A)-c(B),带入前面结果,得:
k2 k1 k 1t k t c (C ) c 0 ( A ) 1 e e 2 k 2 k1 k 2 k1
10-3 连串反应
3、浓度变化 A单调下降
c0(A)
A C
C单调增加
B有极大值: c(B)max
k1k 2 c A c B k 1 k 2 kc A c B
k 2cD
例题:某复合反应的反应机理为
A k+ kC , B +C k2 P
二、稳态近似法
其中C是非常活泼的中间产物,试用稳态法导出其总反 应速率公式。 解:
dcC dt k cA k cC k 2cBcC 0
k 1 ( a x ) k 2 ( a x ) ( k 1 k 2 )( a x )
2、积分式
ln
a a x
( k1 k 2 )t
( k1 k 2 ) t
c ( A ) a x ae
10-1 平行反应
dy dt
y
k 1 ( a x ) k 1 ae
cC k cA k k 2cB
dcP dt
k 2cBcC
k 2k cA cB k k 2cB
当k-<<k2cB 时,表现为一级;反之,表现为二级
三、复合反应的表观活化能
k k1k 2 k 1
Ea RT
2
基元反应的活化能具有明确的物理意义。而复合 反应的活化能则意义不明。如平衡态近似法中:
1919年,Christiansen提出如下反应机理:
① Br 2 1 2 Br
k
1 k 1 c ( Br 2 )
② Br H 2 2 HBr H
k
2 k 2 c ( Br ) c ( H 2 )
3 k 3 c ( H ) c ( Br 2 )
E2
( k1 E1 k 2 E 2 ) RT
2
Ea
k1 E1 k 2 E 2 k1 k 2
10-5 链反应
一、链反应的特点 二、直链反应 三、支链反应和爆炸限
一、链反应的特点
1、定义
一旦引发,就可以发生一系列的连串反应,则该反 应称为连锁反应,简称链反应。 如高分子化合物的合成、燃料燃烧等皆为链反应。 2、自由基
1
1
2k2 1
k 1 / k 5 c ( H 2 ) c 2 ( Br 2 ) k4 k3 c ( HBr ) / c ( Br 2 )
kc ( H 2 ) c 2 ( Br 2 ) 1 k ' c ( HBr ) / c ( Br 2 )
此速率公式已被实验结果证实,机理假设合理。 (不一定唯一,更不一定正确)
第十章
复合反应动力学
由两个或两个以上基元步骤组成的反应称为复合反 应。典型复合反应有三种基本类型: 平行反应、对行反应和连串反应
目 录
10-1 平行反应 10-2 对行反应 10-3 连串反应 10-4 复合反应近似处理方法 10-5 链反应 10-6 催化作用
10-1 平行反应
概念:相同的反应物生成不同的产物。 乙烯
三、支链反应和爆炸限
在链传递过程中,若自由基以几何级数增加,则构 成支链反应。支链反应若不加以控制,易发生爆炸。 现以典型的支链反应 2H2+O2==H2O 为例。 将H2和O2以2:1摩尔比充入容器,加热使其反应, 实验发现,在一定的温度和压力范围内将发生爆炸, 但在另外的温度和压力范围内则不发生爆炸。在低压 时,是否爆炸还与容器大小有关。
dc(Br· )/dt=υ1-υ2+υ3+υ4-υ5=k1c(Br2)-k2c(Br· 2) )c(H +k3c(H· )c(Br2) +k4c(H· )c(HBr)-k5c2(Br· )=0 dc(H· )/dt=υ2-υ3-υ4 =k2c(Br· 2)-k3c(H· )c(H )c(Br2)-k4c(H· )c(HBr)=0 联立解得:
T宜
T
10-3 连串反应
概念:第一步反应的产物是第二步反应的反应物。
模型:
A B C
k1 k2
两步反应皆为一级
速率控制步骤: 若k1>>k2 , k1<<k2 ,
2
d c (C) dt
d c (A) dt
k 2c(B )
1
k1c ( A )
三、支链反应和爆炸限
1、在压力较低时,分子之间的碰 撞不剧烈,自由基向器壁扩散速 度快并在器壁销毁。不爆炸。容 器越小越不爆炸。 2、在压力较高时,分子碰撞加剧, 自由基在气相销毁的速率增加, 也不爆炸。压力越高越不爆炸。 3、只有在压力适中时,销毁速度 低于生成速度才发生爆炸。 4、第二爆炸限随温度的升高而增 加,是因为温度越高自由基生成 速度越快,为增加销毁速度应2 k 1 k 2 k1
tmax
B
10-4 复合反应近似处理方法
假设的反应机理是否正确,其首要条件是根 据机理推导的速率方程是否与实验相符。若相 符则机理可能正确,否则机理肯定不正确。对 于A+B C ,一般机理有两种,可分别用平衡
态近似法和稳态近似法进行处理,另外本节还 将对复合反应的表观活化能进行分析。
实例:丙烯 模型:
A k+ k-
环丙烷
B
正逆反应皆为一级
k k
改写为
设 t=0 a t =t a - x t= a - xe
0 x xe
xe a xe
Kc
ak xe
k k
10-2 对行反应
1、速率方程
dx dt k (a x) k x
2、积分式
二、直链反应思考题
HCl气相合成反应是典型的直链反应:
① Cl
2
1 Cl Cl
k
k2
1 k 1 [ Cl 2 ]
2 k 2 [ Cl ][H 2 ]
② Cl H 2 HCl H
③ H Cl
2
3 HCl Cl
k 2c(D )
k1k 2 k 1
c ( A ) c ( B ) kc ( A ) c ( B )
一、平衡态近似法
例题:某复合反应A+B=C的机理为:
b) A A
k1 k -1
k2
B+ C D(快)
B+D C(慢)
试推导其速率方程。 解:近似平衡时:
d c (C) dt
Kc k1 k 1 c(D ) c (A)
一、平衡态近似法
若反应物和中间产物可很快建立平衡,而中间产 物变为产物很慢,则可应用平衡态近似法处理。 设复合反应A+B=C的机理为:
b )A+B A
k2
k1 k -1
B+ C D(快)
c(D )
D C(慢) 近似平衡时: K c
d c (C) dt
k1 k 1 c (A) c (B)
显然,任一时刻,两产物的浓度之比为 k1/k2
3、温度控制 根据
ln k 1 ln A1 E1 RT ln k 2 ln A 2 E2 RT
若两反应的Ea不同,控制温度可改变两产物的k, 从而改变两产物的比例。
