最新中北大学化学工程与工艺专业实验讲义
化学反应工程与工艺专业实验讲义-2014年版本(全部)

化学工程与工艺专业实验讲义化工学院2014年改编实验一双驱动搅拌器测定气液传质系数气液传质系数是设计计算吸收塔的重要数据。
工业上应用气液传质设备的场合非常多,而且处理物系又各不相同,加上传质系数很难完全用理论方法计算得到,因此最可靠的方法就是借用实验手段得到。
测定气液传质系数的实验设备多种多样,而且都具有各自的优缺点。
本实验所采用的双驱动搅拌吸收器不但可以测定传质系数,而且可以研究气液传质机理。
本实验的目的是通过了解双驱动搅拌吸收器的特点,明暸该设备的使用场合以及测定气液传质系数的方法,进而对气液传质过程有进一步的了解。
一、实验目的:1. 了解和掌握气液传质过程的一般原理和流程;2.了解和掌握双驱动搅拌器测定气液传质系数设备的操作方法二、实验原理:气液传质过程中由于物系不同,其传质机理可能也不相同,被吸收组分从气相传递到液相的整个过程决定于发生在气液界面两侧的扩散过程以及在液相中的化学反应过程,化学反应又影响组分在液相中的传递。
化学反应的条件、结果各不相同,影响组分在液相中传递的程度也不同,通常化学反应是促进了被吸收组分在液相中的传递。
或者将这个过程的传质阻力分成气膜阻力与液膜阻力,就需要了解整个传质过程中哪一个是传质的主要阻力,进而采取一定的措施,或者提高某一相的运动速度,或者采用更有效的吸收剂,从而提高传质的速率。
气膜阻力为主的系统、液膜阻力为主的系统或者气膜阻力与液膜阻力相近的系统在实际操作中都会存在,在开发吸收过程中要了解某系统的吸收传质机理必须在实验设备上进行研究。
双驱动搅拌吸收器的主要特点是气相与液相搅拌是分别控制的,搅拌速度可以分别调节,所以适应面较宽。
可以分别改变气、液相转速测定吸收速率来判断其传质机理,也可以通过改变液相或气相的浓度来测定气膜一侧的传质速率或液膜一侧的传质速率。
测定某条件下的气液传质系数必需采取切实可行的方法测出单位时间单位面积的传质量,并通过操作条件及气液平衡关系求出传质推动力,由此来求得气液传质系数。
中北大学化学工程与工艺专业实验讲义2013

化学工程与工艺专业专业实验讲义中北大学化工与环境学院2013/12/9实验1聚醋酸乙烯酯及其衍生物的制备实验1-1聚醋酸乙烯酯的制备一、实验目的通过醋酸乙烯酯溶液聚合,增强对溶液聚合的感性认识,进一步掌握溶液聚合的反应特点;二、实验基本原理及特点溶液聚合是单体、引发剂在适当的溶剂中进行的聚合反应。
根据聚合物在溶剂中溶解与否,溶液聚合又分为均相溶液聚合和非均相溶液聚合(沉淀聚合)。
自由基聚合、离子聚合和缩聚反应均可采用溶液聚合。
溶液聚合的一个突出特点就是在聚合过程中存在链转移问题。
高分子链自由基向溶剂分子的链转移可在不同程度上使产物的分子量降低。
聚合温度也很重要,随着温度的升高,反应速度要加快,相对分子质量要降低。
当其他条件固定时,随着温度升高,链转移反应速度也要增加,所以选择合适的温度,对保证聚合物的质量是很有意义的。
实验后的附表中列出了甲醇在醋酸乙烯酯自由基聚合时,在不同反应温度下的链转移常数值。
单体转化率对相对分子质量及相对分子质量分布也有一定影响,因为随着转化率的不同,影响相对分子质量的因素,如引发剂、单体、溶剂及生成的大分子等的浓度均发生了变化,所以在不同时期里,生成的高聚物相对分子质量也不同。
转化率越高,相对分子质量分布也就越宽。
在溶剂浓度较小的醋酸乙烯酯聚合反应中,一般随转化率增加,反应速度逐渐增加。
这说明有自动加速现象存在。
当转化率达50%左右时,反应速度开始急剧下降。
在这种条件下,要达到高转化率,聚合时间就要加长。
因此,在工业生产中,转化率一般控制在50%左右。
三、实验仪器及试剂三口瓶1个回流冷凝管1个电动搅拌器1套恒温水浴1套量筒(10mL)1个烧杯(50mL、250mL)各1个温度计(0~100℃)1支醋酸乙烯酯30ml偶氮二异丁腈若干甲醇30ml四、实验步骤1.在装有搅拌器的、回流冷凝管、温度计的干燥洁净的250ml三口瓶中依次加入新精制过的醋酸乙烯20 ml(V AC密度为0.9342),0.04 g偶氮二异丁腈和10 ml甲醇(密度为0.7928),在搅拌下水浴加热(为了便于观察用1000ml大烧杯做水浴),使其回流(水浴温度控制在70 ℃),反应温度控制在65 ℃。
《化学工程与工艺专业实验》教学大纲

《化学工程与工艺专业实验》教学大纲课程名称:《化学工程与工艺专业实验》课程总学时:48课程总学分:2实验学时:48课程属性:专业限选适用专业:化学工程与工艺专业开设学期:第7学期本大纲执笔人:GH 审稿人:JHGJH 审定人:JGHJH一、课程简介、教学目的与要求(一)课程简介《化学工程与工艺专业实验》为化学工程与工艺专业的核心课程。
其主要任务是通过本课程的学习,一方面巩固所学的理论知识和进一步加深基础理论的认识。
另一方面培养学生对实验现象进行分析、归纳和总结的能力,为今后从事有关的科研工作打下良好的基础。
本课程面对化学工程与工艺及相关专业四年级学生,总学时为48学时,2学分。
(二)、教学目的与要求本课程内容与理论教学结合比较密切,要求学生在实验过程中结合所学的理论知识,善于观察实验过程中所出现的各种现象,培养学生理论联系实际的能力。
实验过程中,严格要求学生认真操作,认真观察现象,认真做好实验记录,培养学生严谨的科学态度。
通过实验中观察到的现象和测定的实验数据,联系所学的理论知识,认真进行数据处理,写实验报告过程中要求正确得出实验结论,正确解释实验中出现的现象(尤其是哪些与书本中所学知识不相同的现象),从而,培养学生的科学思维和逻辑思维能力。
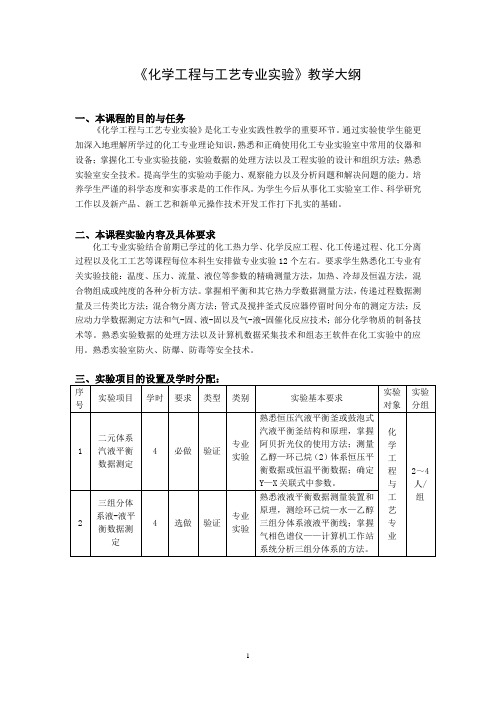
二、实验项目内容与学时分配序号实验项目名称计划学时实验类型开出要求实验目的与基本要求1二元气液平衡实验4验证必开1、了解和掌握用双循环气液平衡器测定二元系统气液平衡数据的方法。
2、了解缔合系统气液平衡数据的关联方法,从实验测得的T-p-x-y数据计算各组分的活度系数。
3、通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。
4、掌握二元系统气液平衡相图的绘制。
2三元水-盐体系平衡数据测定实验4验证必开1、熟悉液液平衡数据测量装置和原理,测绘环己烷—水—乙醇三组分体系液液平衡线;掌握气相色谱仪——2、计算机工作站系统分析三组分体系的方法。
重点:用液—液平衡釜测量恒温液—液平衡数据。
化学工程与工艺技术实验

化学工程与工艺技术实验化学工程与工艺技术实验化学工程与工艺技术实验是化学工程与工艺专业的重要课程之一,通过实验可以锻炼学生的动手能力和实际操作能力,培养学生的工程思维和解决问题的能力。
在一次化学工程与工艺技术实验中,我们的实验课题是气固两相制粒。
我们需要通过实验研究成品粉末的物理性质和制粒过程的各个因素对制粒效果的影响。
首先,我们需要准备实验所需的物质和仪器设备。
实验所需物质有:氧化钛(TiO2)、流化床材料、去离子水等。
仪器设备有:微粒分析仪、粘度计、流化床等。
然后,我们开始实验。
首先,我们需要制备气固两相制粒的实验样品。
将适量的氧化钛和流化床材料放入流化床中进行混合,然后加入适量的去离子水,控制温度和湿度,使混合物成为湿团,最后使用喷雾干燥技术进行干燥,得到所需的粉末制品。
接下来,我们使用微粒分析仪和粘度计对实验样品进行测试。
微粒分析仪可以测量样品的粒径分布和粒径平均值,粘度计可以测量样品的粘度。
通过这些测试结果,我们可以了解到不同因素对制粒效果的影响。
最后,我们对实验结果进行分析和总结。
通过分析粒径分布和粘度的变化趋势,我们可以得出结论:在一定温度和湿度条件下,氧化钛和流化床材料的比例对粒径分布和粘度有一定影响;湿团的干燥时间对制粒效果也有一定影响。
通过这次实验,我深刻体会到了化学工程与工艺技术的重要性。
在实验过程中,我不仅学会了使用各种仪器设备和操作技巧,更重要的是学会了思考和解决问题的能力。
化学工程与工艺技术实验不仅能够培养学生的动手能力和实际操作能力,更能够培养学生的工程思维和解决实际问题的能力。
通过这次实验,我深刻认识到了化学工程与工艺技术的重要性。
化学工程与工艺技术是将化学原理与工程实践相结合的学科,不仅要求学生具备扎实的化学基础,还需要学生具备工程思维和解决问题的能力。
通过实验的实际操作,我更加深入地了解了化学工程与工艺技术的实践应用,并对将来从事相关工作有了更清晰的认识和规划。
化工《化学工程与工艺专业实验》教学大纲

《化学工程与工艺专业实验》实验教学大纲课程所在学院:材料科学与工程;所在实验室:化学工程与工艺一、课程基本信息二、实验目的与基本要求化学工程与工艺专业实验是在完成化学工程与工艺专业学科基础课程、专业理论课程学习的基础上,根据我校学科特色,专门开设的一门实践教学课程。
主要由基础验证性实验、综合设计性实验、研究开放性实验等部分组成。
课程的目的是使学生能够了解本专业实验研究的基本方法,观察实验过程所出现的各种现象,掌握专业实验仪器和设备的使用方法。
通过对基本物性参数的测定实验,掌握化工产品质量控制的分析检测方法;通过天然产物的提取、分离、纯化综合设计性实验,掌握天然产物的深加工方法及应用;通过结合科研课题,让学生查阅资料、提出实验方案、设计实验路线,进行研究开发性实验。
培养了学生分析问题和解决问题的能力,提高了学生的动手能力和研究兴趣。
Chemical Engineering and Technology Experiment is a practical hands-on course designed and implemented to reflect the unique characteristics of both university and the major of Chemical Engineering and Technology. It is a course that requires the completion of all basic courses and the study of all subject theories of the major of Chemical Engineering and Technology. It primarily comprises of fundamental confirmatory experiment, integrated design experiment and research open experiment. This course helps students understand basic experiment methods in major-related research, observe various outcomes during experiment processes and eventually learn how to test and analyze results during the process of chemical product quality control. This course also introduces the methods and application of deep processing of natural products by allowing students to conduct integrated design experiments about extraction, separation and purification of natural products. Additionally, the course involves various research topics that allow students to search and read literature, design experiment plans and procedures, and perform research open experiments. Eventually this course will improve the students' skills, both theoretic and hands-on, in analyzing and solving problems, while helping develop students' interest in research topics.注:实验类型分:1)演示型(验证型);2)综合型(设计型);3)研究型(创新型)。
化学工程与工艺专业实验

双驱动搅拌器测定气液传质系数1、本实验中,气体稳压管可稳压的范围是多少? CA、任何气体都可稳压;B、压强在正负0.2MP范围内;C、压强在略高于大气压附近2、如何判断稳压管处于正常稳压状态?ABA、鼓泡要均匀;B、只要有鼓泡就可以;C、不鼓泡也能稳压3、本实验用酸解法测定溶液中的CO2量时,要测取哪些数据? CA、量气管内气体体积(酸解前后差值)和大气压值;B、量气管内气体体积(酸解前后差值)和吸收液体积;C、量气管内气体体积(酸解前后差值)、大气压值、酸解时的温度和吸收液的体积;4、本实验中液相的搅拌速度过大时,通常对测得的气液传质数据有何影响?CA、对K值无影响;B、使K值比实际的偏大;C、使K值比实际的偏小5、本实验若取实验开始时和终了时的液相样品来测定溶液中CO2量的变化,则须注意:ABA、实验中不能取出液相量;B、测得的气液传质系数是整个实验过程的平均值;C、测得的气液传质系数在应用到工业实际时,对吸收气体的浓度须作相应的修正6、实验结束后,要将稳压管与水饱和器之间的气体管略放空,其理由是:AA、防止水饱和器中水蒸气冷凝形成的负压使稳压管中的水倒吸;B、为了使每次实验有一个完整的全过程;C、为了实验室的安全固体小球实验原理及要求1、热量传递的方式是:ABCA、传导;B、对流;C、辐射2、影响热量传递的因素有哪些?ABCA、物性因素;B、设备因素;C、操作因素3、本实验中,小球的加热温度应控制在什么范围内?BA、300—400℃B、400—500℃C、500—600℃D、600—700℃4、每次实验所需时间的判别依据是:AA、过余温度的98.2%B、过余温度的99.2%C、过余温度的90.2%D、过余温度的88.2%5、比较自然对流、强制对流和流化床,它们的对流传质系数的大小依次为:AA、自然对流<强制对流<流化床;B、自然对流<强制对流>流化床;C、自然对流>强制对流<流化床;D、自然对流>强制对流>流化床6、本实验中需要测定哪些数据?ABCDEA、床层压降B、气体流量C、室温D、小球降温时间E、小球温度7、本实验中,非定态导热过程简化处理的判据是:AA、Bi<0.1B、Bi>0.1C、Bi<1D、Bi>18、在工业中,下列哪些设备的传热问题可以用集总参数法来处理?ABA、热电偶;B、全混釜C、大型储气罐连续流动反应器中的返混测定1、返混和停留时间分布不是一一对应的,因为:ADA、不同的停留时间分布可以有相同的返混情况;B、不同的停留时间分布可以有相同的返混程度;C、相同的停留时间分布可以有不同的返混程度;D、相同的停留时间分布可以有不同的返混情况2、本实验测定停留时间分布的方法是:BA、脉冲失踪法,示踪剂是饱和NaCl溶液;B、阶跃示踪法,示踪剂是饱和KCl溶液;C、脉冲失踪法,示踪剂是饱和KCl溶液;D、周期输入法,示踪剂是饱和NaCl溶液;3、返混的起因是:BCA、不均匀的速度分布;B、间歇反应器中的混和;C、物料的停留时间分布;D、空间上的反向流动4、脉冲示踪法可以直接得到:ADA、停留时间分布函数;B、轴向扩散系数;C、停留时间分布密度函数;D、多釜串联模型参数5、本实验要求确定的模型参数是:ADA、有因次方差;B、平均停留时间;C、无因次方差;D、釜数n6、多釜串联模型可以描述以下哪些反应系统的返混程度?AA、循环管式反应器;B、连续流动搅拌釜式反应器;C、间歇搅拌反应器;D、三釜串联反应器乙苯脱氢制苯乙烯1、乙苯脱氢反应实验采用的是哪种反应器?BA、绝热列管式反应器;B、等温列管式反应器;C、流化床反应器;D、搅拌釜式反应器;E、鼓泡床反应器2、本实验的目的是什么?BA、筛选乙苯脱氢反应催化剂;B、考察反应温度的影响;C、考察反应压力的影响;D、考察乙苯空速对反应的影响;E、考察乙苯与水的配比对反应的影响3、本实验采用的反应器有几个测温点? CA、一个测温点,测定预热的温度;B、二个测温点,除了A题以外,还测定反应器加热夹套的温度;C、三个测温点,除了A、B题以外,还测定催化剂床层的温度;D、四个测温点,除了A、B、C题以外,还测定气液分离器的温度;E、五个测温点,除了A、B、C、D题以外,还测定放空尾气的温度4、根据以下哪些实验参数可以判断反应系统已处于稳定状态?DEA、乙苯的流量已稳定不变;B、水的流量已稳定不变;C、温度已经稳定不变;D、分析液相烃的组成,确认已不随时间而变;E、分析放空尾气的组成,确认已不随时间而变;5、如何简单地判断催化剂的活性?AA、根据乙苯的转化率;B、根据生成苯乙烯的选择性;C、根据苯乙烯的收率;D、根据进出反应器的物质是否平衡;E、根据放空尾气中的CO2浓度;6、随着反应温度的提高,将产生以下影响:AEA、乙苯的转化率升高;B、生成苯乙烯的选择性升高;C、生成苯乙烯的选择性将出现极大值;D、苯乙烯的收率增加;E、反应副产物将增加;催化反应精馏法制备甲缩醛1、采用反应精馏工艺制备甲缩醛具有哪些优点?ABDA、可提高反应的平衡转化率;B、可有效利用反应热;C、可提高反应温度,加快反应速度;D、可降低反应过程对原料浓度的要求2、如果组分P为主产物,S为副产物,A为反应物,下列哪些反应不宜采用反应精馏? DA、反应AP+S,吸热反应,相对挥发度:P>S>A;B、反应AP+S,放热反应,相对挥发度:P>A>S;C、反应A→P→S,放热反应,相对挥发度:P>A>S;D、反应A→P→S,放热反应,相对挥发度:S>A>P;3、根据物系的挥发特性,合成甲缩醛的反应精馏塔应采用何种结构? AA、三段结构:精馏段—反应段—提馏段;B、两段结构:精馏段—反应段;C、两段结构:反应段—提馏段;D、一段结构:精馏段—塔釜反应;4、如果采用三段结构,则全塔的温度分布应呈何种趋势? BA、温度由塔釜至塔顶逐步降低;B、温度在反应段出现峰值;C、温度由塔釜至塔顶逐步升高;D、温度在反应段出现最低值5、如果采用三段结构,则两股原料应以何种方式加入? DA、甲醇由塔顶加入,甲醛由塔釜加入;B、甲醇由反应段的上端加入,甲醛由反应段的下端加入;C、甲醛由塔顶加入,甲醇由塔釜加入;D、甲醛由反应段的上端加入,甲醇由反应段的下端加入;6、本实验用浓硫酸作为均相催化剂,催化剂应如何加入精馏塔? CA、一次性由塔釜加入;B、单独由塔顶连续加入;C、随原料甲醛一同加入;D、随原料甲醇一同加入;7、本实验中,为考察回流比的影响,应采用何种方式调节回流比? AA、固定进料和塔顶采出速率,改变塔釜加热量;B、固定塔釜加热量和塔顶采出比(D/F),改变进料速率;C、固定进料速率和塔釜加热量,改变塔顶采出量;8、本实验中,为考察塔顶采出比的影响应采用何种方式调节塔顶采出量?BA、固定塔釜加热量的回流比,改变进料速率;B、固定进料速率和回流比,改变塔釜加热量;C、固定进料速率和塔釜加热量,改变塔顶采出量;9、为求得产品甲缩醛的收率,实验中必须采集哪些数据?ABA、进料甲醛的质量流率和浓度;B、塔顶产品的质量流率和甲缩醛浓度;C、塔釜产品流率和甲醛浓度;氨-水系统气液相平衡数据的测定1、氨——水相平衡数据测定系统的自由度为2,实验中控制哪二个条件?BA、温度、压力;B、温度,液相组成;C、压力、液相装成;D、气相和液相组成;2、高压釜气密性检查方法是:ABCA、加压,观察压力表读数;B、抽真空,观察压力表读数;C、加压后放在水中观察有无气泡出现3、实验中,高压釜抽真空的方法是: BA、从液相管抽真空;B、从气相管抽真空;C、从气相管或液相管抽真空都行;4、为什么加氨时将小钢瓶倒放,并从液相管加入?ABCA、加入的是液氨;B、液氨和水直接混合吸收;C、加氢速度快;5、实验中怎样判断系统已达到平衡?BCA、温度稳定一段时间;B、压力不变一段时间;C、温度、压力不变一段时间;6、实验中取样分析时,在取样瓶中预放一定量的液体是:AA、硫酸溶液;B、氢氧化钠溶液;C、去离子水碳分子筛变压吸附提纯氮气1、碳分子筛吸附法从空气中分离提纯氮气的原理是: BA、利用N2与O2在空气中的浓度差,优先吸附N2 气;B、利用N2与O2在碳分子筛中吸附速率的差异,优先吸附O2 气;C、利用碳分子筛中的微孔尺寸的选择性,优先吸附O2 气;D、利用N2与O2在碳分子筛中吸附速率的差异,优先吸附N2 气;2、一个连续变压吸附分离装置至少需要几个吸附柱,包括哪些操作步骤?BA、2个,操作包括系统充压、加压吸附、减压脱附、柱间气液切换;B、3个,操作包括系统充压、加压吸附、减压脱附、柱间气液切换;C、1个,操作包括系统充压、加压吸附、减压脱附;D、3个,操作包括加压吸附、减压脱附、柱间气液切换;3、本实验采用什么工程手段来实现吸附和脱附操作? CA、加压吸附、常压脱附;B、加压吸附、升温脱附;C、加压吸附、真空脱附;D、低温吸附、高温脱附;4、当吸附剂用量一定时,影响本实验变压吸附效果的主要因素有哪些?BA、吸附压力、温度、气体流量、脱附压力;B、吸附压力、气体流量、脱附压力、吸附时间;C、吸附压力、气体流量、吸附时间;D、温度、气体流量、脱附压力、吸附时间;5、穿透曲线是吸附柱出口液体中被吸附物质的浓度AA、随时间的变化曲线;B、随气体流量的变化曲线;C、随吸附压力的变化曲线;D、随进口浓度的变化曲线;6、测定吸附穿透曲线的目的是什么?ADA、测定出口气体的穿透点,并据此确定吸附柱的最佳操作时间和吸附剂的动态吸附容量;B、测定出口气体的穿透点,并据此确定吸附柱的最佳操作时间;C、测定出口气体的穿透点,并据此确定吸附柱的动态吸附容量;D、测定出口气体的穿透点和饱和点,并据此判断吸附柱中传制质区的长度;7、为了确定吸附剂的动态吸附容量,实验中必须测定哪些参数? BA、气体流量、穿透时间、气体进口浓度、穿透点气体浓度;B、操作压力、温度、气体流量、穿透时间、气体进口浓度、穿透点气体浓度;C、操作压力、温度、气体流量、气体进口浓度、穿透点气体浓度;D、操作压力、温度、气体流量、穿透时间、气体进口和出口浓度;8、本实验中为什么不考虑吸附过程的热效应? DA、因为设备小、散热快;B、因为是变压吸附,温度恒定;C、因为是真空脱附,能及时移走吸附热;D、因为是物理吸附,吸附热不显著;填料塔分离效率的测定原理及要求1、影响填料塔分离效率的因素有哪些?ABCA、物性因素;B、设备因素C、操作因素;2、甲酸——水系统的轻组分可能是什么?ABA、甲酸B、水C、共沸物3、甲酸——水系统的重组分可能是什么? CA、甲酸B、水C、共沸物4、实验时,塔体保温温度控制在什么范围? AA、96℃——100℃;B、100℃——104℃;C、104℃——108℃;5、正系统塔内表面张力自下而上的分布是如何变化的? AA、增大;B、不变;C、减小;6、负系统塔内表面张力自上而下的分布是如何变化的? CA、增大;B、不变;C、减小;7、塔内传质过程应控制在什么状态? CA、分子扩散;B、层流对流;C、湍流对流;组合膜分离乳清废水1、超滤、纳滤、反渗透膜分离的推动力是: BA、浓度差;B、压力差;C、电位差;D、温度差2、反映膜分离性能的指标有:ABCA、膜渗透通量;B、截留率;C、通量衰减系数;D、流量3、影响待处理料液膜分离效率的操作因素有:ABA、料液温度;B、操作压强;C、料液浓度;D、处理量;4、常用的膜组件形式有:ABCDA、管式;B、卷式;C、板框式;D、中空纤维和毛细管式;5、膜组件若长期不用,应采取以下措施: CA、用清水清洗,晾干保存;B、直接加入1%的甲醛保护液;C、用清水清洗并排空,再加入保护液密封;D、直接加入清水并密封。
化学反应工程与工艺专业实验讲义

实验一反应精馏合成乙酸乙酯一实验目的1 了解反应精馏过程原理及适用场合.2 掌握反应精馏装置的操作方法和反应精馏研究方法。
3 了解反应精馏与常规精馏的区别。
4 学会用色谱-热导检测器分析塔内物料浓度组成。
二实验原理反应精馏法是将化学反应过程与精馏分离过程同时进行生产产品的操作。
由于物理过程与化学过程同时存在,使过程更加复杂。
(1)对可逆平行反应,通过精馏将反应产物中的高沸物或低沸物连续的从系统中排出,可使总转化率超过平衡转化率,大大提高生产效率。
(2)对于异构体混合物分离比较困难时,若其中的某组分能发生化学反应并生成沸点不同的物质,就可以加以分离。
本实验用乙酸、乙醇为原料,加入少量浓硫酸为催化剂通过反应精馏合成乙酸乙酯。
边反应边将乙酸乙酯分离出来,提高乙酸的转化率。
操作方式:间歇过程;塔釜连续进料过程;塔身某处连续进料过程。
产物分析方法:采用色谱-热导检测分析,色谱工作站处理。
GDX分离柱(φ3mm,L 2m) , 柱温110度,汽化温度130度,检测温度120度;载气压力0.04Mpa;桥流100mA.出峰的先后顺序为:H2O , CH3CH2OH , CH3COOH ,CH3COOC2H5.它们的摩尔校正因子分别为:3.03, 2.09, 1.39, 0.91。
三实验装置与试剂反应精馏装置一套,直径20mm, 内装填料,可自动加热、保温、回流控制。
操作过程见说明书。
无水乙醇200mL ;含浓硫酸0.3%(wt)的冰乙酸200mL.四实验步骤1 配置1:1.3(mol)酸醇混合液250mL,加入到塔釜中。
并用色谱准确测其组成。
2 开启色谱-热导检测分析仪及色谱工作站,按分析方法操作。
3 通冷却水,接通电源。
按操作说明书对反应精馏装置加热升温,并开启保温电流。
待塔顶有液体出现时,全回流30分钟。
以微量注射器在塔身不同高度取样口取样分析,作出塔内各组分的浓度分布曲线。
4 开启回流比3:1 ,塔顶开始出产品。
化学工程与工艺专业分析化学实验讲义

化学工程与工艺专业分析化学实验讲义化学工程与工艺专业是一门应用型科学,主要研究化学反应工程原理、化工过程及相关技术的综合性学科。
作为该专业的学生,实验课程是非常重要的一部分,通过实验可以帮助学生更好地理解理论知识、掌握实际操作技能,提高实践能力。
本文将介绍一份分析化学实验讲义,主要包括分析化学实验的目的、原理、实验步骤和结果分析等方面。
一、实验目的本次实验的目的是学习和掌握分析化学中的常用分析技术,并运用这些技术进行物质的定性与定量分析。
通过本次实验,学生应能够了解和掌握气相色谱分析的原理和操作方法,能够正确使用气相色谱仪进行样品分析。
二、实验原理气相色谱是一种常用的分离和分析技术,它基于物质在气相中的分配行为实现物质的分离和定性/定量分析。
其主要原理是通过溶剂和样品之间的分配和移动过程来实现样品中各种组分的分离。
在气相色谱仪中,样品首先被蒸发成气体,然后通过色谱柱中的固定相进行分离,最后通过检测器检测各组分的峰信号,并对其进行定性和定量分析。
三、实验步骤1.样品制备:取适量的待分析物样品,按照一定比例配制成溶液或气体样品。
2.样品进样:将制备好的样品以一定速度进样到气相色谱仪的进样口。
3.色谱柱选择:根据待分析物的性质选择合适的色谱柱。
4.色谱柱调试:根据待分析物的特性进行色谱柱的调试优化,如优化气相流速、柱温等条件。
5.实验测定:开启气相色谱仪,运行待分析物样品,记录峰面积、峰高等数据。
6.数据处理:根据测得的数据进行定性和定量分析,生成实验报告。
四、实验结果与分析通过实验测定,可以得到样品中各组分的峰面积或峰高数据。
通过对比样品和标准品的测定数据,可以进行定性和定量分析。
定性分析主要通过对比待分析物样品的色谱图与标准品的色谱图,判断样品中是否存在目标成分。
定量分析主要通过计算待分析物样品的峰面积或峰高与标准品之间的比例关系,从而推算出待分析物样品中目标成分的含量。
五、实验注意事项1.实验操作要严谨,遵循实验安全规范。
化学工程与工艺专业实验

' yCO,d =0.062 低变出口CO组分:yCO ,d
=0.023
α1 =
0.120 − 0.062 = 0.455 0.120 × (1 + 0.062)
低变反应变换率:y'0
CO,d
= yCO,d = 0.062
α2 =
0.062 − 0.023 = 0.615 0.062 × (1 + 0.023)
0 y1CO = yCO (1 − α1 )
0 0 y1 C O 2 = y C O 2 + y C O α 1
0 0 y1H 2 = yH 2 + yCOα1
f i ( Pi ) = P
P总 =
0.5 总
yCO y
− 0.5 CO2
(1 −
yCO2 y H 2 K P1 yCO y H 2 O
)
760 + 150 × 1 0 1 .3 = 1 2 1 .3 K p a 760
化学工程与工艺专业实验 — 一氧化碳中温—低温串联变换反应
一、实验项目的来源与技术背景
来源与背景
1、实验项目的来源 变换反应(Shift Reaction)是CO和水蒸汽反应生成H2和CO2。借 助变换反应可实现粗合成气中CO/H2比例的调节,广泛应用于合成氨、 制甲醇合成气、制氢和IGCC发电等项目。 (1) 在合成氨中的应用 一氧化碳与水发生变换反应生成氢和二氧化碳是合成氨生产中的 重要过程。合成氨主要用于制造氮肥和复合肥料,农业对化肥的需求 是合成氨工业发展的持久推动力。经过近百年的发展,合成氨技术趋 于成熟,形成了一大批各有特色的工艺流程,但都是由三个基本部分
一、实验项目的来源与技术背景
来源与背景
化工专业实验教学大纲(新)
《化学工程与工艺专业实验》教学大纲一、本课程的目的与任务《化学工程与工艺专业实验》是化工专业实践性教学的重要环节。
通过实验使学生能更加深入地理解所学过的化工专业理论知识,熟悉和正确使用化工专业实验室中常用的仪器和设备;掌握化工专业实验技能,实验数据的处理方法以及工程实验的设计和组织方法;熟悉实验室安全技术。
提高学生的实验动手能力、观察能力以及分析问题和解决问题的能力。
培养学生严谨的科学态度和实事求是的工作作风。
为学生今后从事化工实验室工作、科学研究工作以及新产品、新工艺和新单元操作技术开发工作打下扎实的基础。
二、本课程实验内容及具体要求化工专业实验结合前期已学过的化工热力学、化学反应工程、化工传递过程、化工分离过程以及化工工艺等课程每位本科生安排做专业实验12个左右。
要求学生熟悉化工专业有关实验技能:温度、压力、流量、液位等参数的精确测量方法,加热、冷却及恒温方法,混合物组成或纯度的各种分析方法。
掌握相平衡和其它热力学数据测量方法,传递过程数据测量及三传类比方法;混合物分离方法;管式及搅拌釜式反应器停留时间分布的测定方法;反应动力学数据测定方法和气-固、液-固以及气-液-固催化反应技术;部分化学物质的制备技术等。
熟悉实验数据的处理方法以及计算机数据采集技术和组态王软件在化工实验中的应用。
熟悉实验室防火、防爆、防毒等安全技术。
四、授课计划与学时安排本实验课程48学时,每位学生在16个专业实验中选做其中12个实验。
五、实验考核及评分办法1、学生进实验室前要求预习实验教材或实验指导书;2、实验过程中对每一学生的实验操作技能和解决问题的能力进行考核,并进行提问;3、对学生实验的实验报告进行批改和评分(平时操作分计入实验报告得分);4、对学生的实验进行闭卷的笔试,经教师批改后评出笔试得分;5、“化工专业实验”课成绩由:实验报告成绩(含平时操作得分),笔试成绩这两者综合而得。
(这两项成绩各占50%)执笔人:丁健。
化学工程与工艺实验讲义

实验三、二氧化碳临界状态观测及P—V—T关系测定一、实验目的1、了解CO2临界状态的观测方法,增加对临界状态概念的感性认识。
2、加深对理论课所讲的工质的热力学状态:凝结、汽化、饱和状态等基本概念的理解。
3、掌握CO2的P—V—T关系的测定方法,学会用实验测定实际气体状态变化规律的方法和技巧。
4、学会活塞式压力计,恒温器等部分热工仪器的正确使用方法。
二、实验原理对于真空气体,因分子间引力的作用,若把实验温度降到一定程度后,将会出现液化现象,如果对真空气体的PVT行为作一完整的测定。
就能进一步反应出真空气体的液化过程及另一重要的物理性质——临界点。
如图1所示,以CO2为例所测的P—Vm标准曲线图,分析真实气体的性质。
对理想气体P—V m图上的恒温线应为“PV m = RT = 常数”的曲线,不同温度只是对应的常数不同而已。
然而,对于真空气体,恒温线一般分为三种类型:即t > t c、t = t c、t < t c(t c为临界温度)。
对CO2来说,分类的的温度界线是31.1℃。
对简单可压缩系统,当工质处于平衡状态时,其状态分布函数P、Vm之间有:0),,(=TVpFm ,或),(mVpTT=,),(TpVVm=。
本实验就是根据上式,采用等温方法来测定CO2的P、V之间的关系从而找出CO2的P—V—T的关系。
三、实验设备及说明1、整个实验装置由压力台、恒温器和试验台本体及其防护罩三大部分组成,如图2所示。
实验台本体结构如图3所示,我们使用的装置仅有一个温度计。
2、实验中由压力台送来的压力油进入高压容器的玻璃杯上部,有水银进入予先装带CO2气体的承压玻璃管CO2被压缩。
其中容积是通过压力台上的活塞杆的进退来调节,温度由恒温器供水夹套里的水温来调节。
3、实验工质二氧化碳的压力由装在压力台上的压力表读出,温度由插在恒温水套中的温度计读出。
四、实验的内容及步骤1、使用恒温器调定温度,让温度恒定在实验温度条件下。
化工专业实验讲义

化学工程与工艺专业实验讲义化学工程与工艺专业教研室实验一二元汽—液平衡数据的测定 (1)实验二二氧化碳临界状态观测及P-V-T关系测定 (5)实验三三元液—液平衡数据的测定 (12)实验四乙苯脱氢制苯乙烯 (18)实验五煤油裂解制烯烃 (23)实验六填料塔液相轴向混合特性的测定 (26)实验七沸石催化剂的制备 (34)实验八反应精馏法制乙酸乙酯 (39)实验九恒沸精馏 (43)实验十填料塔分离效率的测定 (50)实验十一液膜分离法脱除废水中的污染物 (52)实验十二碳酸二甲酯生产工艺过程开发 (56)实验一二元汽—液平衡数据的测定汽液相平衡关系是精馏、吸收等单元操作的基础数据。
随着化工生产的不断发展,现有汽液平衡数据不能满足需要。
许多物系的平衡数据很难由理论直接计算得到,必须由实验测定。
平衡实验数据测定方法有两类,即直接法和间接法。
直接法中又有静态法、流动法和循环法等。
其中循环法应用最为广泛。
若要测得准确的汽液平衡数据,平衡釜是关键。
现已采用的平衡釜形式有多种,且各有特点,应根据待测物系的特征,选择适当的釜型。
用常规的平衡釜测定实验数据,需样品量多且测定时间长。
本实验用的小型平衡釜主要特点是釜外有真空夹套保温,可观察釜内的实验现象且样品用量少,达到平衡速度快,因而实验时间短。
一、实验目的1.测定常压下乙醇(1)-水(2)二元汽液平衡数据2.通过实验了解汽液平衡釜的构造,掌握二元汽液平衡数据的测定方法和技能。
3.应用计算机将lewis和colburn二人对乙醇(1)——水(2)在常压下测定的数据用Wilson方程回归得的能量参数,对于自己所得的数据的准确性进行校验。
二、实验原理和计算关联公式以水循环法测定气液平衡数据的平衡釜类型有多种多样,但基本原理都一样,如图1-1所示,当体系达到平衡时,A容器的温度不变,此时A和B中的组成不随时间变化,此时从A和B容器中取样分析,可以得到汽液平衡数据。
根据汽液平衡原理,当汽液两相达到平衡时,除了两相的温度,压力相等之外,任一组在两相中的逸度必须相等。
化学工程与工艺专业分析化学实验讲义
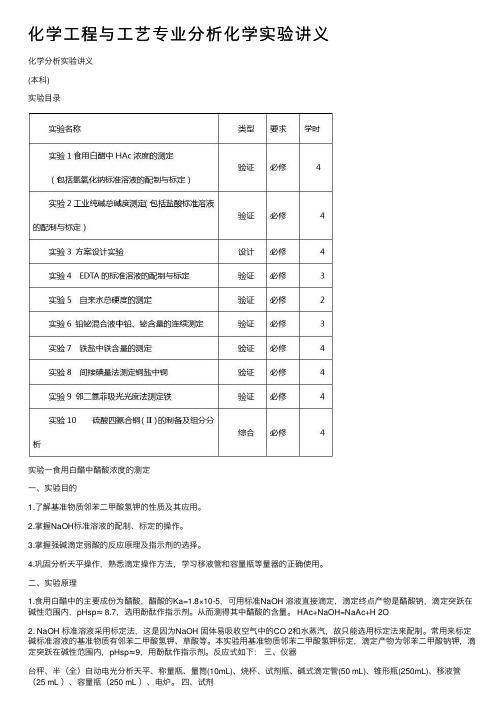
化学⼯程与⼯艺专业分析化学实验讲义化学分析实验讲义(本科)实验⽬录实验⼀⾷⽤⽩醋中醋酸浓度的测定⼀、实验⽬的1.了解基准物质邻苯⼆甲酸氢钾的性质及其应⽤。
2.掌握NaOH标准溶液的配制、标定的操作。
3.掌握强碱滴定弱酸的反应原理及指⽰剂的选择。
4.巩固分析天平操作,熟悉滴定操作⽅法,学习移液管和容量瓶等量器的正确使⽤。
⼆、实验原理1.⾷⽤⽩醋中的主要成份为醋酸,醋酸的Ka=1.8×10-5,可⽤标准NaOH 溶液直接滴定,滴定终点产物是醋酸钠,滴定突跃在碱性范围内,pHsp≈ 8.7,选⽤酚酞作指⽰剂。
从⽽测得其中醋酸的含量。
HAc+NaOH=NaAc+H 2O2. NaOH 标准溶液采⽤标定法,这是因为NaOH 固体易吸收空⽓中的CO 2和⽔蒸汽,故只能选⽤标定法来配制。
常⽤来标定碱标准溶液的基准物质有邻苯⼆甲酸氢钾、草酸等。
本实验⽤基准物质邻苯⼆甲酸氢钾标定,滴定产物为邻苯⼆甲酸钠钾,滴定突跃在碱性范围内,pHsp≈9,⽤酚酞作指⽰剂。
反应式如下:三、仪器台秤、半(全)⾃动电光分析天平、称量瓶、量筒(10mL)、烧杯、试剂瓶、碱式滴定管(50 mL)、锥形瓶(250mL)、移液管(25 mL )、容量瓶(250 mL )、电炉。
四、试剂NaOH(s)(A.R.)、酚酞指⽰剂(0.2%⼄醇溶液)、⾷⽤⽩醋(市售)。
邻苯⼆甲酸氢钾(KHC 8H 4O 4)基准物质(烘⼲温度100-1250C )。
五、实验步骤1.0.1mol/LNaOH 标准溶液的配制⽤台秤称取4.0g NaOH 固体于1000mL 烧杯中,加去离⼦⽔溶解,然后转移⾄试剂瓶 (聚⼄烯)中,⽤去离⼦⽔稀释⾄1000mL ,充分摇匀,贴上标签(溶液名称,姓名,配制⽇期),备⽤。
2.0.1mol/L NaOH 溶液的标定准确称取邻苯⼆甲酸氢钾0.4~0.8g 三份,分别置于250mL 锥形瓶中,各加⼊约40mL 热⽔溶解,冷却后,加⼊3滴酚酞指⽰剂,⽤NaOH 溶液滴定⾄溶液刚好由⽆⾊变为微红⾊且30s 内不褪,停⽌滴定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中北大学化学工程与工艺专业实验讲义2013化学工程与工艺专业专业实验讲义中北大学化工与环境学院2013/12/9实验1聚醋酸乙烯酯及其衍生物的制备实验1-1聚醋酸乙烯酯的制备一、实验目的通过醋酸乙烯酯溶液聚合,增强对溶液聚合的感性认识,进一步掌握溶液聚合的反应特点;二、实验基本原理及特点溶液聚合是单体、引发剂在适当的溶剂中进行的聚合反应。
根据聚合物在溶剂中溶解与否,溶液聚合又分为均相溶液聚合和非均相溶液聚合(沉淀聚合)。
自由基聚合、离子聚合和缩聚反应均可采用溶液聚合。
溶液聚合的一个突出特点就是在聚合过程中存在链转移问题。
高分子链自由基向溶剂分子的链转移可在不同程度上使产物的分子量降低。
聚合温度也很重要,随着温度的升高,反应速度要加快,相对分子质量要降低。
当其他条件固定时,随着温度升高,链转移反应速度也要增加,所以选择合适的温度,对保证聚合物的质量是很有意义的。
实验后的附表中列出了甲醇在醋酸乙烯酯自由基聚合时,在不同反应温度下的链转移常数值。
单体转化率对相对分子质量及相对分子质量分布也有一定影响,因为随着转化率的不同,影响相对分子质量的因素,如引发剂、单体、溶剂及生成的大分子等的浓度均发生了变化,所以在不同时期里,生成的高聚物相对分子质量也不同。
转化率越高,相对分子质量分布也就越宽。
在溶剂浓度较小的醋酸乙烯酯聚合反应中,一般随转化率增加,反应速度逐渐增加。
这说明有自动加速现象存在。
当转化率达50%左右时,反应速度开始急剧下降。
在这种条件下,要达到高转化率,聚合时间就要加长。
因此,在工业生产中,转化率一般控制在50%左右。
三、实验仪器及试剂三口瓶 1个回流冷凝管 1个电动搅拌器 1套恒温水浴 1套量筒(10mL)1个烧杯(50mL、250mL)各1个温度计(0~100℃) 1支醋酸乙烯酯 30ml偶氮二异丁腈若干甲醇 30ml四、实验步骤1.在装有搅拌器的、回流冷凝管、温度计的干燥洁净的250ml三口瓶中依次加入新精制过的醋酸乙烯20 ml(VAC密度为0.9342),0.04 g偶氮二异丁腈和10 ml甲醇(密度为0.7928),在搅拌下水浴加热(为了便于观察用1000ml大烧杯做水浴),使其回流(水浴温度控制在70 ℃),反应温度控制在65 ℃。
2.当反应物变粘稠时加入20 ml甲醇,使反应瓶中反应物稀释,冷却到室温。
五、思考题1.试以醋酸乙烯溶液聚合为例,说明溶液聚合的特点,并分析影响溶液聚合反应的因素。
2.写出合成聚醋酸乙烯酯的化学反应式。
实验1-2 聚醋酸乙烯酯的醇解一、实验目的掌握聚乙烯醇制备的一般方法和高分子反应的基本原理。
二、实验基本原理由于“乙烯醇”极不稳定,极易异构化而生成乙醛或环氧乙烷,所以聚乙烯醇(PVA)不能由“乙烯醇”来聚合,通常都是讲聚醋酸乙烯酯醇解后得到聚乙烯醇。
聚乙烯醇的醇解可以在酸性或碱性条件下进行。
酸性春节时,残留的酸可加速PVA的脱水作用,使产物变黄或不溶于水。
目前,工业上都采用碱性醇解法。
本实验用甲醇为醇解剂,NaOH为催化剂。
一般,NaOH/PVA的摩尔比为0.12.。
由于PVAc可溶于甲醇而PVA不溶于甲醇,因此在反应过程中会发生形变。
在实验室中醇解进行的好坏的关键在于体系中刚出现胶冻时,必须用强烈搅拌将其打碎,才能保证醇解较完全地进行。
三、实验仪器及试剂三口瓶 1个回流冷凝管 1个电动搅拌器 1套恒温水浴 1套量筒(10mL)1个烧杯(50mL、250mL)各1个温度计(0~100℃) 1支聚醋酸乙烯酯若干甲醇若干NaOH 若干四、实验步骤1.将聚醋酸乙烯溶液升温至30℃,加入2ml 5%的NaOH-甲醇溶液,控制反应温度在45℃。
当醇解度大60%左右时,大分子从溶解状态变为不溶状态,出现胶团。
此时立即强烈打碎。
2.出现胶团后在继续发硬0.5h ,打碎胶冻,在加入2ml NaOH-甲醇溶液,仍控制反应温度在45℃,反应0.5h。
升温至65℃,反应1h。
3.冷却,将反应液倒出,抽滤。
用甲醇仔细的洗涤,烘干。
五、思考题1.写出醇解反应式。
2.为什么会出现胶冻现象?对实验结果有何影响?实验1-3 聚乙烯醇缩甲醛(胶水)的制备一、实验目的了解聚乙烯醇缩甲醛化学反应的原理,并制备胶水。
二、实验原理聚乙烯醇缩甲醛是利用聚乙烯醇与甲醛在盐酸催化作用下而制得的。
聚乙烯醇是水溶性的高聚物,如果用甲醛将它进行部分缩醛化,随着缩醛度的增加,水溶液愈差,作为维尼纶纤维用的聚乙烯醇缩甲醛其缩醛度控制在35%左右,它不溶于水,是性能优良的合成纤维。
本实验是合成水溶性的聚乙烯醇缩甲醛。
反应过程中需要控制较低的缩醛度以保持产物的水溶性,若反应过于剧烈,则会造成局部缩醛度过高,导致不溶于水的物质存在,影响胶水质量。
因此在反应过程中,特别注意要严格控制催化剂用量、反应温度、反应时间及反应物比例等因素。
聚乙烯醇缩甲醛随缩醛化程度的不同,其性质和用途各有所不同,它能溶于甲酸、乙酸、二氧六环、氯化烃(二氯乙烷、氯仿、二氯甲烷)、乙醇-甲苯混合物(30:70)、乙醇-甲苯混合物(40:60)以及60%的含水乙醇中。
缩醛度为75%~85%的聚乙烯醇缩甲醛其主要用途是制造绝缘漆和粘合剂。
三、实验仪器及试剂三口瓶 1个电动搅拌器 1套温度计 1支恒温水浴 1套聚乙烯醇若干甲醛(37%~40%) 4~6ml盐酸若干氢氧化钠若干去离子水(或蒸馏水) 若干四、操作步骤1. 在250 ml三颈瓶中加入90 ml去离子水(或蒸馏水)、7 g聚乙烯醇,在搅拌下升温溶解;2. 聚乙烯醇完全溶解后,于90℃左右加入4.5 ml甲醛(40%工业纯),搅拌15 min,再加入1:4盐酸,使溶液pH值为1~3。
保持反应温度90 ℃左右;3. 反应体系逐渐变稠,当体系中出现气泡或有絮状物产生时,立即迅速加入1.5 ml 8%的NaOH溶液,同时加入35 ml去离子水(或蒸馏水)。
调节体系的pH值为8~9。
然后冷却降温出料,获得无色透明粘稠液体(即市售胶水)。
五、思考题1. 写出缩醛化反应的化学反应式。
2. 为什么缩醛度增加,水溶性下降,当达到一定的缩醛度以后,产物完全不溶于水?参考文献1. 赵德仁著.高聚物合成工艺学.北京:化学工业出版社,19812. 清华大学工化系高分子教研室.高分子化学实验,19793. 王久芬编.高分子化学实验.北京:兵器工业出版社,19984. 潘祖仁编.高分子化学.北京:化学工业出版社,20035 .张兴英编.高分子科学实验,化学工业出版社,2004实验2 苯丙共聚乳液的制备及性能测试一、实验目的1.掌握以苯乙烯、丙烯酸酯类为单体,针对目标产物进行聚合实验设计的基本原理。
2.进行不同聚合机理、聚合方法的选择及确定二、实验原理两种或两种以上的单体参加的聚合反应称为共聚。
共聚是增加聚合物品种,改善聚合物性能的主要手段之一。
两单体共聚时,由于两单体竞聚率乘积的不同聚合反应可分为理想共聚、交替共聚、非理想共聚合和“嵌段”共聚。
不同的共聚反应类型,共聚物组成的控制各有不同。
对有恒比共聚点的体系,在恒比共聚点投料,控制转化率可合成出组成恒定的共聚乳液。
根据要合成的共聚乳液的组成选择补加单体的投料方法也可合成出组成恒定的共聚乳液。
苯乙烯和丙烯酸丁酯共聚60℃时r1=0.698,r2=0.164 。
苯乙烯、丙烯酸丁酯都是按照连锁聚合中的自由基聚合机理进行聚合的。
聚合方法可根据需要采用本体聚合、溶液聚合、悬浮聚合和乳液聚合。
三、主要试剂及主要仪器苯乙烯,已精制;丙烯酸丁酯,已精制;OP-10;十二烷基苯磺酸钠;去离子水250 ml三口瓶;冷凝管;量筒;烧杯;玻璃片;试管;恒温水浴;搅拌器;精密电子天平;烘箱;离心机。
四、共聚乳液制备实验设计目标产物:组成基本恒定的苯丙共聚乳液提示:1.聚合机理及聚合方法自由基共聚乳液聚合2.聚合配方水单比 2:1,引发剂为单体质量的0.2%~0.3%乳化剂为单体质量的2%~3%3.聚合工艺反应温度:75~80℃反应时间:3h实验前完成:1. 示意写出共聚物结构。
2.确定聚合机理及聚合方法,写出聚合反应的基元反应。
3.确定聚合反应类型,计算出具体配方。
(去离子水用量为30mL)4.确定聚合装置及主要仪器,画出聚合装置简图。
5.确定加料方式。
6. 确定工艺流程,并写出实验步骤。
五、性能测试以下性能测试项目1、2为必做,3、4项选做一项,5、6、7项选做一项即可。
测试标准 GB/T11175-2002《合成树脂乳液试验方法》。
1.乳液外观将3mL乳液置于试管中,目测乳液颜色、均一性、透明度,有无分层、有无沉淀;将乳液涂在玻璃板上,目测检查有无粒子和异物。
(试管中的乳液可直接用于稀释稳定性测定)2. 稀释稳定性在试管中加入3mL乳液,边搅拌边加入10mL去离子水,放置24h后,观察是否分层或破乳。
3. 离心稳定性在离心试管中加入半试管乳液,离心60min,观察乳液是否分层。
4. 钙离子稳定性在试管中加入3mL乳液,滴加0.5%的CaCl2溶液,直至破乳,记录CaCl2溶液用量。
或在3mL乳液中加1mL0.5%的CaCl2溶液静置24h~48h若不分层为合格。
5. 乳液固含量测定将洁净干燥的培养皿在115℃~120恒重后,降至室温,准确称重。
加入2g左右的乳液(准确至0.0001g),加热2h恒重后,降至室温,准确称重。
计算乳液的固含量。
固含量计算公式为:(自己写出)符号表示:G——固含量,%;m1——空培养皿质量,g;m2——干燥前培养皿和乳液的总质量,g;m3——干燥后培养皿和乳液的总质量,g;6.乳液成膜性和胶膜吸水率测定将洁净干燥的载玻片在80℃恒重后,用玻璃棒将乳液涂覆在载玻片上,室温下成膜,观察是成膜性。
在烘箱中烘干后降至室温后称重,再将附有涂膜的载玻片置于水中浸泡24h,取出后用滤纸吸干表面的水分后称量。
涂抹吸水率计算公式为:(自己写出)符号表示:S ——涂膜的吸水率,%;m0——载玻片的质量,g;m1——干燥后的涂膜和载玻片的总质量,g;m2——吸水后的涂膜和载玻片的总质量,g。
7. 胶膜耐水性测定在洁净干燥的载玻片上均匀涂一层乳液,放到烘箱中烘干。
在已干透的胶膜上滴1滴去离子水,观察胶膜滴水后白浊化的时间。
乳液性能表参考文献1. 赵德仁著.高聚物合成工艺学.北京:化学工业出版社,19812. 王久芬编.高分子化学实验.北京:兵器工业出版社,19983. 潘祖仁编.高分子化学.北京:化学工业出版社,20034. 张兴英编.高分子科学实验,化学工业出版社,20045. GB/T11175-2002合成树脂乳液试验方法实验3 环氧树脂的制备及性能测试一、实验目的1. 通过双酚A型环氧树脂的制备,掌握一般缩聚反应的机理。
