2019年秋九年级科学上册 第1章 物质及其变化 第6节 几种重要的盐 第4课时 实验:碱和盐的性质
九上第一章酸碱盐知识点完整整理
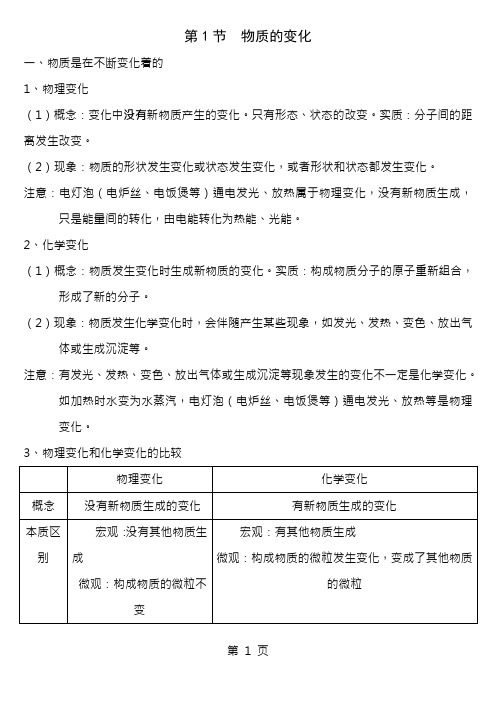
第1节物质的变化一、物质是在不断变化着的1、物理变化(1)概念:变化中没有新物质产生的变化。
只有形态、状态的改变。
实质:分子间的距离发生改变。
(2)现象:物质的形状发生变化或状态发生变化,或者形状和状态都发生变化。
注意:电灯泡(电炉丝、电饭煲等)通电发光、放热属于物理变化,没有新物质生成,只是能量间的转化,由电能转化为热能、光能。
2、化学变化(1)概念:物质发生变化时生成新物质的变化。
实质:构成物质分子的原子重新组合,形成了新的分子。
(2)现象:物质发生化学变化时,会伴随产生某些现象,如发光、发热、变色、放出气体或生成沉淀等。
注意:有发光、发热、变色、放出气体或生成沉淀等现象发生的变化不一定是化学变化。
如加热时水变为水蒸汽,电灯泡(电炉丝、电饭煲等)通电发光、放热等是物理变化。
3、物理变化和化学变化的比较二、探究物质变化的方法1、观察化学反应通常要注意:(1)反应前的现象(2)反应中的现象(3)反应后的现象(1)通过观察和实验等来寻找物质变化的证据。
物质变化的证据:生成沉淀、颜色改变、气体产生、温度变化、性质变化、发光发热、PH变化、状态变化等。
(2)演示实验:硫酸铜晶体的变化①取1块硫酸铜晶体,观察形状、颜色。
蓝色固体②向盛有硫酸铜晶体的试管中加水,观察晶体能否溶解,水溶液颜色有什么变化。
能溶解,形成蓝色溶液。
③在硫酸铜溶液中滴加氢氧化钠溶液,观察溶液有什么变化。
(写出化学方程式)形成蓝色絮状沉淀2NaOH+CuSO4=Na2SO4 +Cu(OH)2↓④另取1块硫酸铜晶体,将它放在大试管中加热,观察硫酸铜晶体有什么变化。
(写出化学方程式)蓝色固体逐渐变白CuSO4·5H2O = CuSO4 + 5H2O⑤实验完成后,熄灭酒精灯,冷却大试管,再在冷却后的硫酸铜白色粉末中逐滴加水,观察有什么现象产生(写出化学方程式)白色固体逐渐变蓝CuSO4 + 5H2O === CuSO4·5H2O根据现象,进行分析:有颜色变化的实验是2、3、4 、5,原因是发生物理变化和化学变化有沉淀产生的实验是3, 原因是发生化学变化;有状态变化的实验是2、3、4、5, 原因是发生物理变化或化学变化;并总结出硫酸铜晶体的性质(包括物理性质和化学性质):蓝色晶体、易溶于水、受热易分解、能与氢氧化钠反应生成蓝色絮状沉淀【小结】根据物质变化中所获得的信息对物质的性质进行分析推测的方法,是认识物质、探索物质变化规律的基本方法。
九年级科学上册第1章物质及其变化复习知识点归纳(新版)浙教版

第1章物质及其变化第1节物质的变化知识点1 物质是在不断变化着的1.物理变化和化学变化:产生新物质的变化属于化学变化,不产生新物质的变化属于物理变化。
2.化学变化的基本特征是生成新物质。
化学变化一定伴随发生物理变化,但物理变化中不一定发化学变化。
知识点2 探索物质变化的方法1.化学变化中常伴随发光、放热、放出气体、产生沉等现象,但有这些现象的变化不一定是化学变化。
判断化学变化的依据是生成了新物质。
2.探索物质的变化和变化规律时,可以通过观察、实验等方法,从物质的状态、颜色、温度(吸热或放热)、有无沉淀或气体生成等方面寻找证据。
第2节物质的酸碱性知识点1 酸性物质和碱性物质1.电离:物质溶解于水或受热熔化而形成自由移动离子的过程,叫做电离。
2.酸是由氢离子和酸根离子组成的化合物,碱是由金属离子和氢氧根离子组成的化合物。
3.酸在水中电离时,生成的阳离子都是氢离子;碱在水中电离时,生成的阴离子都是氢氧根离子。
知识点2 酸碱指示剂1.在酸性或碱性溶液里能显示不同颜色的物质,叫做酸碱指示剂,通常简称指示剂。
2.紫色的石蕊试液在酸性溶液中显示红色,在碱性溶液中显示蓝色;无色的酚酞试液在酸性溶液中不变色,在碱性溶液中显示红色;蓝色石蕊试纸在酸性溶液中显示红色,在碱性溶液中显示蓝色;红色石蕊试纸在酸性溶液中显示红色,在碱性溶液中显示蓝色。
3.酸性溶液或碱性溶液使指示剂变色,不能说成指示剂使酸性溶液或碱性溶液变色。
因为变色的物质是指示剂,不是酸性或碱性溶液。
4.花瓣中含有一些植物色素,这些色素在酸性或碱性溶液中呈现不同的颜色,用花的汁液可以制成酸碱指示剂。
知识点3 溶液酸碱性的强弱程度1.溶液的酸碱性强弱程度简称酸碱度。
2.化学上通常用pH表示溶液的酸碱度。
pH的范围通常在0~14之间。
3.pH=7,溶液呈中性;pH<7,溶液呈酸性,pH越小,物质酸性越强;pH>7,溶液呈碱性,pH越大,物质碱性越强。
浙教版九年级科学上册《几种重要的盐》PPT精品课件

咸肉
咸菜
为什么可以用食盐水清洗伤口?
因为浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,具有杀菌作用。
④. 清洗伤口杀菌作用
1.了解碳酸钙、氯化钠的性质 2.了解复分解反应发生的条件
例1:下列对氯化钠的描述中,正确的是( C )
A、氯化钠固体极易溶于水,溶解时放出大量的热 B、其水溶液有涩味和滑腻感所以呈碱性 C、其水溶液有一定的杀菌消毒作用 D、其水溶液能使紫色石蕊试液变蓝色
2. 碳酸钙的化学性质
(1). 与酸反应
CaCO3 + 2 HCl = CaCl2 + H2O + CO2 (实验室制取CO2原理)
(2). 加热分解 CaCO3 高=温 CaO + CO2 生石灰 (工业上制取CO2原理)
3. 碳酸钙形成的岩石的用途: 洁白纯净的碳酸钙岩石叫汉白石。 含杂质而有美丽花纹的碳酸钙叫大理石。 质地致密的碳酸钙岩石叫石灰石。
思考:化肥有助于植物生长,长期使用化肥好吗? 虽然化肥有助于植物生长,但长期使用化肥往往会使土壤板结,破坏土壤结构。
4、 农家肥料(有机肥)
农家肥料中含有大量有机物和多种营养元素 (如微量元素硼、锌、铜、锰、钼等)
主要作用有: 有利于改良土壤结构,提高土壤肥力。使作物吸收多种营养元素。
1.了解几种重要的盐的溶解性 2.知道化肥的作用
4、碳酸盐:大多难溶。(除钾盐、钠盐、 铵盐可溶外);
1. 可溶性盐 K+、Na+、NH4+等离
盐
子与酸根离子组成的盐。
2. 不溶性盐 AgCl BaSO4 BaCO3
部分酸碱盐的溶解性表(20℃)
应用:粗盐中可溶性杂质的去除 溶液(含杂质Na2SO4、CaCl2、MgCl2) 加入试剂的顺序及操作(可供选择的试剂有:NaOH、Na2CO3、BaCl2、HCl)
(2019)新浙教版九年级上册科学第一章《物质及其变化》知识点归纳

【九上】第一章物质及其变化(1-3节)知识点归纳【知识衔接】:八年级下册化学基础知识1、化学变化的实质:分子分裂成原子,原子重新组合成新的分子。
化学反应中,一定发生改变的是分子种类(物质种类),一定不发生改变的是原子的种类和数目,可能发生改变的是分子的数目。
2、分子构成的物质:大多数的非金属单质,常见的一些气体、液体,还有碘和溴。
3、原子直接构成的物质:金属和固态非金属(硫、碳、磷、硅)及稀有气体4、离子构成的物质:酸、碱、盐5、1-18号元素:6、常用元素:钾K、钙Ca、锰Mn铁Fe、铜Cu、锌Zn银Ag、钡Ba、汞Hg7、常见的原子团:8、常见化合价:(背诵)钾钠银氢+1价,钙镁钡锌为+2价,氟氯溴碘负一价,通常氧是—2价,三铝四硅五价磷,一二铜二三铁,单质元素为零价。
9、根据元素化合价写出化合物的化学式,原则:在化合物中所有元素化合价的代数和为零。
化合物化学式书写口诀:正前负后、上方标价、交叉填数、约简检验。
10.化学方程式的书写方法:书写化学方程式可以归结为五步:①写:反应物的化学式写在“=”的左边,生成物的化学式写在“=”的右边,多种反应物或生成物之间用“+”相连。
②配:在反应物、生成物的化学式前配上适当的化学计量数,使式子两边每一种元素的原子总数相等。
通常用最小公倍数法配平。
③注:注明反应条件,通常写在“=”的上方或下方。
“加热”常用“△”表示。
④标:如果反应物中没有气体,而生成物中有气体产生,那么在气体的化学式右边用“↑”号表示;如果是溶液中发生的反应,反应物中无固体,而生成物中有固体的,那么在固体的化学式右边用“↓”号表示。
⑤查:检查化学式是否正确,化学方程式是否配平,条件和物质状态是否标注,标注是否恰当。
11.根据化学方程式计算的基本步骤(1)设未知量x(此时x不带单位,如“设某物质的质量为x克”是错误的);(2)正确书写有关的化学方程式(别忘了配平);(3)计算出有关物质的相对分子质量(要乘上配平的系数),写在相应化学式的正下方(包括x);(4)在有关物质的相对分子质量下面写出已知质量(纯净物质量)和未知量x;(5)将有关的四个量列成比例式,求出未知量x(此时x要带单位,如x=1克);(6)简明地写出答案。
九年级上第1章第4节几种重要的盐

有机肥 (农家肥) 5.肥料
N肥: 能使农作物茎叶茂盛 P 肥: 促进根、花、果实的生长 化肥:
K肥: 能使茎秆粗壮,不易倒伏 复合肥:
版权所有
6.铵盐:
① NH3的水溶液显碱性
NH3· H2O
版权所有
版权所有
③我国化学家侯德榜发明“侯氏制碱法” ④主要用途:制糕点、做玻璃等
版权所有
3.常见的盐:
CaCO3
石灰石 、汉白玉 的主要成分。 ①是 大理石 、
版权所有
分析: CaCO3 + 2 HCl =
Na2CO3 + 2 HCl = Na2CO3 + H2SO4 = CaCl2 + H2O + CO2 H2O + CO2
加热
版权所有
3.常见的盐: Na2CO3 (俗名:苏打、纯碱 ) ①晶体Na2CO3· 10H2O易分化 (化学变化)
Na2CO3· 10H2O (属于纯净物) Na2CO3 + 10H2O
②Na2CO3溶液显碱性 (弱酸强碱盐)
(碱的溶液显碱性;显碱性的不一定是碱的溶液)
第4节 几种重要的盐 1.盐: 电离时,生成金属阳离子(或铵根阴离子)
和酸根阴离子的化合物。
2.盐的分类:
①盐:钠盐、钾盐、硫酸盐、碳酸盐…… ②盐
可溶性盐:
钾钠铵盐均可溶 硝酸盐遇水影无踪 氯物不溶银亚贡 硫酸不溶银和钡
难溶性盐:
版权所有
3.常见的盐:
Na2CO3
6.铵盐:
① NH3的水溶液显碱性
NH3· H2O
(所以NH3不能用浓H2SO4干燥)
②铵盐能与碱反应放NH3
版权所有
浙教版九年级科学上册1.6.1几种重要的盐课件

重铬酸钾晶体 K2Cr2O7
硫酸亚铁晶体 FeSO4·7H2O
思考与讨论
你还见过其他盐的晶体吗?
碳酸钠晶体 (Na2CO3·10H2O)
硫酸铝钾晶体 [KAl(SO4)2·12H2O]
硫酸钙晶体 (CaSO4·2H2O)
氟化钙晶体 (CaF2)
知识点 2 几种盐的性质
CaCO3+2HCl=CaCl2+H2O+CO2↑
形形色色的碳酸钙
(4)用途
建筑原料
补钙剂
炼钢
制生石灰 汉白玉华表
思考与讨论
怎样证明一块岩石是碳酸盐?
取少量岩石样品于试管内,滴加适 量盐酸,若有气泡产生,将产生的 气体通入澄清石灰水中,若澄清石 灰水变浑浊,说明有CO2生成,从 而推知岩石的成分中含有碳酸盐。
பைடு நூலகம்
中和胃酸
食品添加剂
饮料原料
灭火剂原料
2.碳酸钙(CaCO3) 是一种难溶的盐
Ca(OH)2+H2CO3=CaCO3↓+2H2O 碳酸(H2CO3)和氢氧化钙发生中和反应的产物 (1)存在
大理石、石灰石、 汉白玉、鸡蛋壳等
(2)物理性质 白色固体,难溶于水
(3)化学性质 ①高温能分解
CaCO3 高温 CaO+CO2↑ ②能与酸反应
Na2CO3+2HCl=2NaCl+H2O+CO2↑ H2CO3=H2O+CO2↑
碳酸钠也可与硫酸反应, 写出化学方程式
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 盐+酸→新盐+新酸
③能和某些碱反应 碳酸钠与氢氧化钙反应
浙教版九年级上册科学《第6节 几种重要的盐》课件

0 1 2 3 4 5 6
8 9 10 11 12 13 14
中性
碱 性 增 强
酸 性 增 强
0 - 14
(二) pH与溶液酸碱性的关系:
(三)测定pH值的方法:
1、最简便的方法是:使用pH试纸。(准确整数)
测定方法:在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测试液的pH
调查学校花园的土壤的酸碱性
操作步骤:
1、取土壤少许于烧杯中,加入适量蒸馏水,搅拌
2、静止一段时间
3、用胶头滴管取上层清液测定pH
在不同pH溶液中浸泡过后
pH=1
pH=7
pH=13
观察各束头发的光泽
分别取一根头发拉断
溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
现在商场上的洗发水各种各样,你在选择洗发水时,有什么尺度和标准吗?
pH<7
pH<7
pH<7
pH<7
pH>7
pH>7
pH>7
pH=7
pH=7
测定生活中一些物质的pH值 ,说明他们的酸碱性
pH
酸碱性
pH
酸碱性
橘子
汽水
糖水
自来水
牛奶
唾液
番茄汁
草木灰
肥皂水
洗洁精
酱油
醋
(四)了解溶液的酸碱度的重要意义
1、化工生产中
2、测定人体中的pH值,了解人体健康
(二)碳酸钠(纯碱或苏打Na2CO3)
1、是重要的碳酸盐Na2CO3•10H2O(洗涤碱)易风化。
风化:结晶水合物在空气里失去结晶水的过程。 结晶水:晶体从溶液中析出时结合的水分子。结晶水合物:含结晶水的化合物。
科学九上第一二章知识要点

九(上)第一章基础知识分析第1节物质的变化1、物理变化与化学变化:区别:变化后有无新物质生成。
联系:物质发生化学变化的同时一定伴随着物理变化,但发生物理变化时一定不发生化学变化。
2、探究物质变化的基本方法:观察和实验。
3、物质变化的证据:颜色、气味或味道的改变、状态的改变、沉淀生成、气体产生等。
4、硫酸铜晶体:蓝色晶体。
加热时失去结晶水而变成白色粉末,该粉末遇水又变成兰色晶体。
CuSO4·5H2O====== CuSO4+5H2O ; CuSO4+5H2O===== CuSO4·5H2O5、物质变化规律的应用:(1)硫酸铜溶液检验蛋白质的存在,使其产生沉淀;(2)白色硫酸铜粉末检验水分的存在,遇水变蓝色。
第2节酸1、电离:一些物质在水溶液或融化状态下电离成自由移动离子的过程。
2、酸:一些物质电离时,其阳离子全部是氢离子的化合物。
HCI ==== H+ + CI — H2SO4====2 H++ SO42— HNO3===== H++ NO3—3、常见的酸:盐酸 HCI 硫酸H2SO4硝酸HNO3碳酸H2CO3磷酸H3PO4醋酸CH3COOH4、检验物质酸碱性和测定溶液的酸碱度:(1)检验物质酸碱性:酸碱指示剂(2)测定溶液的酸碱度:PH试纸。
(一)酸的通性1、酸使指示剂变色;2、酸 + 碱 ===== 盐 + 水3HCl+ Al(OH)3 ==== AlCl3+3H2O (用胃舒平治疗胃酸过多)H 2SO4+2 NaOH==== Na2SO4+ H2O3、酸 + 某些盐 ===== 新盐 + 新酸2HCl + CaCO3====CaCl2+ H2O + CO2↑(实验室制取CO2)HCl + AgNO3 ==== AgCl ↓ + HNO3(用AgNO3溶液和稀硝酸检验盐酸)H 2SO4+ BaCl2==== BaSO4↓ + 2HCl (用BaCI2溶液和稀硝酸检验硫酸)4、酸 + 金属氧化物 ==== 盐 + 水6HCl+ Fe2O3====2 FeCl3+3 H2O (用稀盐酸清除铁锈,铁锈溶解,形成黄色溶液)H 2SO4+ CuO ==== CuSO4+ H2O (氧化铜黑色粉末溶解,形成蓝色溶液)5、酸 + 某些金属 ==== 盐 + 氢气Fe + 2HCl ==== FeCl2 + H2↑Zn + H2SO4==== ZnSO4+ H2↑(实验室用于制H2)(二)酸的个性1、盐酸HCl:盐酸是HCl气体的水溶液,具有挥发性,挥发出的HCl气体在瓶口遇水蒸汽形成盐酸的小液滴而出现白雾。
九年级科学上册第1章物质及其变化1.6几种重要的盐课件浙教版(付,130)

酸钠晶体的化学式是 ,其中所含的水叫 其相对分
子质量是(写计算过程)
.Байду номын сангаас
5.下列物质可使无色酚酞试液变红的是( ) (A)食盐水 (B)稀硫酸 (C)碳酸钠溶液 (D)盐酸
这节课你学会了哪些内容?
1、盐是一类物质 2、几种盐的性质 (1)碳酸钠
•俗称:苏打、纯碱 •晶体易风化 •用途 •溶液呈碱性
(2)碳酸钙
2NaOH+H2SO4=Na2SO4+2H2O BaCl2+H2SO4=BaSO4+2HCl 2NaOH+CuSO4=Cu(OH)2+Na2SO4
结论:很多酸、碱、盐间发生的反应属于 复分解反应
参照酸和碱的性质的推断方法,请你推断出 盐有哪些性质
某些盐之间可以反应生成新的盐
Na2CO3+CaCl2 = CaCO3↓+ 2NaCl 某些盐与酸反应生成新盐和新酸
氯化钠(NaCl) 俗称:食盐 食盐
1.你知道我们平时用的食盐是从哪里制取的吗? 2.食盐除了可以做食物佐料外,还有什么用途?
重要化工原料,制生理盐水 ( 0.9%的氯化钠溶液),用食盐水清洗伤口,防腐等。
思考:(1)你知到什么情况下,人需要及时
注射生理盐水或补充盐开水?
(2)为什么盐水可以清洗伤口呢? (3)人每天摄取的食盐都是一定的,多余的 盐可以通过哪些途径排出体外?经常吃太咸 的食品,对身体有利吗?
这些盐被称为化学肥料,简称为化 肥。
盐与化肥
• 你知道农民伯伯常用的化肥有哪些吗?
化肥分类
化肥的来源
1.氮肥(铵盐)的制取:
常用酸与氨气反应制取 NH3+H2O+CO2=NH4HCO3(碳铵) 2NH3+H2SO4=(NH4)2SO4(硫铵)
九年级上科学第一章知识点提纲

第一章基础知识复习第1节物质的变化1.物理变化与化学变化的区别:有没有新物质生成.有新物质生成的就是化学变化.2.化学变化与化学性质的区别:变化指的是生成了新物质,性质指的是可以生成新物质.3.CuSo4·5H2O=== CuSo4+5H2O CuSo4+5H2O=== CuSo4·5H2OCuSo4+2NaOH===Cu(OH)2↓+Na2SO4CuSo4溶液为蓝色用途(1)可以用CuSo4来检验水的存在,如果有水,则会变蓝色;(2)可以用硫酸铜检验蛋白质的存在,如果加入硫酸铜溶液有沉淀产生,则有.第2节探索酸的性质1.酸的性质:(1)酸能与酸碱指示剂反应:酸能使紫色石蕊试液变红色,使无色酚酞不变色.(2)酸+碱=盐+水3HCl+Al(OH)3=AlCl3+3H2O 2HCl+MG(OH)2=MgCl2+2H2OHCl+NaOH=NaCl+H2O(3)酸+盐=新酸+新盐实验:鸡蛋壳(主要万分是CaCO3)与稀盐酸的反应现象:鸡蛋壳表面有气泡产生,伸入试管的燃着的火柴熄灭化学方程式:2HCl+CaCO3=CaCl2+H2O+CO2↑用途:可以用来检验CO2 2的存在,也可以用于实验室制CO2气体(4)酸+金属氧化物=盐+水实验一: 除铁锈(主要成分是Fe2O3)实验现象: 溶液变成黄色,时间稍长有气泡产生化学方程式Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑实验二: 氧化铜(黑色)与盐酸的反应现象: 黑色氧化铜溶解,溶液变成蓝色化学方程式CuO+2HCl=CuCl2+H2O5.酸的个性:(1)盐酸(HCl)A.浓盐酸是无色液体,具有挥发性,打开瓶盖会有白零产生,具有刺激性气味B.工业盐酸因含有杂质而显黄色C.实验:稀盐酸与硝酸银溶液的反应现象:有不溶于稀硝酸的白色沉淀产生化学方程式: HCl+AgNo3=AgCl↓+HNO3用途:可以用来检验氯离子的存在(2)硫酸(H2SO4) △蓝色白色白色蓝色A.浓硫酸有很强的腐蚀性,如果不慎溅到皮肤上,要先用干布拭去,然后用大量的水冲洗;B .稀释浓硫酸时,要把浓硫酸沿玻璃棒慢慢倒入水中,并不断搅拌,用手触摸烧杯外壁时,可发现很热.C.浓硫酸有脱水性,当滴在纸上时,会使纸变黑(化学性质)D.浓硫酸有吸水性,可以用它来用干燥剂(物理性质)E .检验稀硫酸(或-24SO )——取少量待检液体取于洁净的试管中,各滴入几滴2BaCl 溶液和稀3HNO ,有白色沉淀产生(3)鉴别稀盐酸和稀硫酸——分别取待检液体于两支洁净的试管中,各滴入几滴2BaCl 有白色沉淀产生的原溶液是稀硫酸,无现象产生的原溶液是稀盐酸.(4)硝酸(3HNO ) A .挥发性; B .腐蚀性; C.不稳定性(见光易分解,贮存在棕色瓶中)第3节 探索碱的性质1.碱的概念:电离时生成的阴离子全部是氢氧离子(-OH )化合物叫做碱.2.碱的性质:(1)碱能与酸碱指示剂反应:碱使无色酚酞变红,使紫色作用生成盐和水的反应.用途:A.治胃病; B.用熟石灰[]2)(OH Ca 改良酸性土壤.(2)碱+酸盐+水 中和反应——酸和碱作用生成盐和水的反应.O H NaCl HCl NaOH 2+=+ O H SO Na SO H NaOH 2424222+=+用途:A.治胃病; B.用熟石灰[]2)(OH Ca 改良酸性土壤.(3)碱+非金属氧化物=盐+水实验:澄清石灰水中通入2CO 现象:澄清石灰水变浑浊 化学方程式:22)(CO OH Ca +(4)碱+盐=新碱+新盐实验一:氯化铜溶液(蓝色)氢化钠溶液反应. 现象:生成蓝色沉淀化学方程式:NaCl OH Cu NaOH CuCl 2)(222+↓==+实验二:氯化铁溶液(黄色)与氢氧化钠溶液反应 现象:生成红褐色沉淀化学方程式:NaCl OH Fe NaOH FeCl 3)(333+↓=+3. 碱的个性(1)氢氧化钠(NaOH )A 、俗名:火碱、烧碱、苛性钠B 、氢氧化钠是一种白色固体,在空气中易潮解,同时能和空气中的二氧化碳反应,需密封保存.C 、氢氧化钠极易溶于水,溶解时放出大量的热D 、氢氧化钠具有很强的腐蚀性E 、检验氢氧化钠是否变质的方法有以下几种:a.加盐酸,有气体产生说明已变质:↑++==+223222CO O H NaCl HCl CO Nab.加入氯化钙溶液,有沉淀产生说明已变质:NaCl CaCO CaCl CO Na 23232+↓==+c.加入氢氧化钙溶液,有沉淀产生说明已变质:NaOH CaCO OH Ca CO Na 2)(3232+↓==+ F 、氢氧化钠变质后除杂方法:)(32CO Na NaOH加入适量氢氧化钙溶液 NaOH CaCO OH Ca CO Na 2)(3232+↓==+G 、氢氧化钠可以用来做干燥剂,可以干燥氢气和氧气,不能干燥2CO 和2SO(2)氢氧化钙[]2)(OH CaA 、俗名:熟石灰、消石灰;B 、氢氧化钙溶液俗称石灰水;C 、O H CaCl HCl OH Ca 22222)(+==+ O H CaSO SO H OH Ca 244222)(+==+(3)鉴别2)(OH Ca 和NaOH 溶液—分别取少量待检液体于两支洁净的试管中,分别通入2CO 气体(或各滴入32CO Na 溶液),有白色沉淀产生的原溶液是2)(OH Ca ,无现象产生的原溶液是NaOH .第4节 几种重要的盐一、盐的概念—金属阳离子或铵根离子与酸根离子组合的化合物.1、几种常见的盐:(1)俗名:纯碱或苏打 (2)结晶水合物:O H CO Na 23210⋅(3)碳酸钠晶体在空气中易风化 (4)碳酸钠溶液能使无色酚酞变红,显碱性2.碳酸钙(3CaCO )(1)是大理石、石灰石、贝壳和鸡蛋壳的主要成分; (2)3CaCO 是一种难溶的盐;(3)O H CaCO CO H OH Ca 233222)(+↓==+(4)碳酸盐的检验:加稀盐酸能产生使澄清石灰水变浑浊的气体.3.食盐(NaCl )(1)生理盐水——0.9%的氯化钠溶液 (2)33NaNO AgCl AgNO NaCl +↓==+三、盐水性质(1)盐+酸==新盐+新酸(2)盐+碱==新盐+新碱 (3)盐+盐==新盐+新盐 (某些盐加热易分解↑++==22334CO O H NH HCO NH四、盐的制取1.酸、碱、盐的溶解性:-OH 只有+K 、+Na 、+4NH 、+2Ca 、+2Ba 溶. -3NO :全溶 :-Cl 只有AgCl 不溶 -24SO :只有4BaSO 不溶 -32CO :只有+K 、+Na 、+4NH 溶 2.复分解反应——两种化合手互相交换成份生成两种新化合物的反应.3.复分解反应发生条件:(1)反应物中没有酸时,反应物必须都能溶于水;(2)生成物中必须有气体、沉淀或水中的一种。
新浙教版九年级上册初中科学 第6节 几种重要的盐 教学课件

2.食盐在自然界中的分布情况如何?
3.氯化钠有什么用途?
4.氯化钠的电离方程式如何写?其中含有哪些离子?氯离子 如何检验?
第十二页,共四十二页。
新课讲解
3.氯化钠 (1)俗称食盐,白色固体、易溶于水。
第十三页,共四十二页。
新课讲解
(2)分布
海盐
湿润的红色石蕊试纸变蓝;产生氨气,氨气溶于水是碱性的。
第三十三页,共四十二页。
新课讲解
检验NH4+的方法: 加NaOH等碱溶液。 如果产生使湿润的红色石蕊试纸变蓝的气体,则含有NH4+。
第三十四页,共四十二页。
新课讲解
思考
在农村,人们常取少量白色粉末状的化肥和消石灰一 起放在手掌心搓,通过闻气味来检验是否是氮肥,这是根 据什么原理?
第八页,共四十二页。
新课讲解
2.碳酸钙 (CaCO3)
(1) 碳酸钙难溶于水,是建筑材料,可用于制造水泥。
汉白玉、大理石、石灰石
第九页,共四十二页。
新课讲解
(2) 碳酸钙与酸反应(实验室制取CO2) CaCO3+2HCl=CaCl2+H2O+CO2↑
(3) 碳酸钙高温分解(工业制取CO2)
CaCO3
第二十页,共四十二页。
新课讲解
2.复分解反应 活动: 在盛有Na2CO3溶液的试管里加入CaCl2溶液,可发现?
白色沉淀
Na2CO3+CaCl2=CaCO3↓+2NaCl
第二十一页,共四十二页。
新课讲解
你能找出这个反应类型有什么特点? Na2CO3+CaCl2 = CaCO3↓+ 2NaCl
九年级科学上册第1章物质及其变化第6节《几种重要的盐》4

第十三页,共十七页。
根据溶解性口诀,判断下列
物质的溶解性。 (xiàliè)
1.Zn(OH)2:__不__溶__ 2.AgCl:_____不__溶_ 3.NaNO3:____溶____ 4.K2CO3:_____溶___
5.BaSO4:___不__溶___ 6.BaCl2:___溶_____
镁盐: MgCl2 MgSO4 MgNO3 等 硝酸盐: KNO3 NaNO3 MgNO3 等 碳酸盐: K2CO3 Na2CO3 MgCO3 等
……….
第十一页,共十七页。
大多(dàduō)酸溶水中间
钾钠铵盐均易溶
溶
硝
碱 钾 钠 钡 钙
酸 盐 遇 踪水 影
氯 化 物 不 溶 氯
硫硫 酸酸 盐盐 不微 溶溶 硫是
碳 酸 盐 只 溶 钾
(shuǐ yǐnɡ)
铵
化
酸银
钠
无
银
钡钙
铵
第十二页,共十七页。
记忆 规律: (jìyì)
可溶性盐:钾盐(含K+)、钠盐(含Na+)
铵盐(含NH4+)、硝酸盐(含NO3-)
不可溶性盐: 硫酸钡BaSO4、 氯化银AgCI 大部分碳酸盐如CaCO3、BaCO3、MgCO3等
可溶性碱: KOH 、NaOH 、Ba(OH)2 Ca(OH)2 、NH3.H2O
(2)反应进行(jìnxíng)的环境:大多数在水(溶液
行
第十五页,共十七页。
)中进
下列物质(wùzhì)能发生化学反 应吗?为什么?
1.CuO+Ba(OH)2= Cu(OH)2 ↓ +BaO 2.SO2+HNO3=NO2 + H2SO3 3.2Fe(OH)3+3MgCl2=2FeCl3+3Mg (OH)2 ↓ 4.Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl
九年级科学上册 第1章 物质及其变化 第6节 几种重要的盐 第4课时 实验:碱和盐的性质课件

操作示意图
现象
(续表)
结论
澄清石灰水变 __浑_浊_(_hú_nz_hu_ó)
氢氧化钙能与某 些非金属氧化物反 应生成_盐_______和
___水_____
2021/12/12
澄清石灰水变 __浑_浊__(h_ún_zhu_ó)
氢氧化钙能与某 些盐反应生成 _新__盐___和_新__碱_____
第五页,共二十二页。
再滴加稀硝酸后的现象
沉淀不消失 ____沉_沉淀_淀不__消消_失失_____ ______________
2021/12/12
第十三页,共二十二页。
第4课时 实验:碱和盐的性质
互动(hùdònɡ)探究
探究(tànjiū)点二 盐的性质
[情景(qíngjǐng)展示]
1.取3支试管,分别倒入稀硫酸、硫酸铜溶液、碳酸钠溶液。在这3支
支试管中分别滴加几滴硝酸银溶液。再往这3支试管中各滴入几滴稀硝酸,振 荡(zhèndàng)后观察现象。
溶液
稀盐酸 氯化钠溶液 碳酸钠溶液
滴加几滴硝酸银溶液 后的现象
产生___白淀_白色_色_(b沉_áis_淀è)_沉_____ 产生____白_色__沉_淀______ 产生______________
第1章 物质及其变化
第6节 几种重要的盐 第4课时 实验:碱和盐的性质
2021/12/12
第一页,共二十二页。
第1章 物质(wùzhì)及其变化
第4课时 实验 :碱和盐的性质 (shíyàn)
新知学习
2021/12/12
互动探究 课堂小结
第二页,共二十二页。
第4课时 实验(shíyàn):碱和盐的性质
2.含Cl-的化合物的检验方法:加入_____硝_酸__银_溶__液__和____________ ,若稀产硝生酸____________,证明白色是沉含淀Cl-的化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
h
16
第4课时 实验:碱和盐的性质
[问题探究] 这两组实验体现出了盐的哪些性质?
[思考交流]
_____________________________________________________ _____________________________________________________
2碳.取酸3支钠试溶管液,分别倒入稀盐酸、氯化钠溶液、碳酸钠溶液,在
这3支试管中分别滴加少量硝酸银溶液,记录观察到的现象。再往
这3支试管中各滴入几滴稀硝酸,振荡后观察现象并记录实验现象。
h
15
第4课时 实验:碱和盐的性质
溶液 稀盐酸
滴加少量硝酸银溶液的现 再滴加稀硝酸后的现
象
象
பைடு நூலகம்
氯化钠溶液
碳酸钠溶液
探究点二 盐的性质
[情景展示]
1.取3支试管,分别倒入稀硫酸、硫酸铜溶液、碳酸钠溶液。
在这3支试管中分别滴加少量氯化钡溶液,记录观察到的现象。
再往这3支试管中各滴入几滴稀硝酸,振荡后观察现象并记录
实验现象。
h
14
第4课时 实验:碱和盐的性质
溶液
滴加少量氯化钡溶液的 再滴加稀硝酸后的
现象
现象
稀硫酸
硫酸铜溶液
互动探究
探究点一 碱的性质
[情景展示]
小明在某食品包装袋内发现了一包生石灰干燥剂,并对它现在的成 分产生了兴趣,并猜想干燥剂中可能有氢氧化钙或碳酸钙,小红说 可以利用氢氧化钙的化学性质对干燥剂的成分进行检验。
h
6
第4课时 实验:碱和盐的性质
[问题探究]
氢氧化钙有哪些性质?请利用我们已学过的一些碱的共性知识,设计 探究氢氧化钙化学性质的实验方案(用操作示意图表示),进行实验后 ,填写实验报告。
向盛有澄清石灰水的两支试 管中滴加无色酚酞试液和紫
色石蕊试液
1号试管溶液变成红色号试 氢氧化钙溶液能使无色
管溶液变成红色,2号试管 酚酞试液变红,紫色石
溶液变成蓝色
蕊试液变蓝
向盛有澄清石灰水的试管中 滴加1滴酚酞试液1滴酚酞试
h
8
溶液先变红后红色褪去 氢氧化钙能与酸反应
第4课时 实验:碱和盐的性质
和___水_____ 4
第4课时 实验:碱和盐的性质
操作示意图
现象
(续表)
结论
澄清石灰水变 __浑_浊_____
氢氧化钙能与某 些非金属氧化物反 应生成__盐______和
___水_____
澄清石灰水变 __浑_浊_____
氢氧化钙能与某
些盐反应生成 __新_盐___和_新__碱_____
h
5
第4课时 实验:碱和盐的性质
沉淀不消失
硫酸铜溶液 产生____白__色_沉__淀_h______
___沉__淀_不__消__失____ 12
第4课时 实验:碱和盐的性质
(2)取3支试管,分别倒入稀盐酸、氯化钠溶液、碳酸钠溶液,在 这3支试管中分别滴加几滴硝酸银溶液。再往这3支试管中各滴入几 滴稀硝酸,振荡后观察现象。
溶液
稀盐酸 氯化钠溶液 碳酸钠溶液
新知学习
新知一 探究氢氧化钙的化学性质
操作示意图
现象
结论
1号试管溶液变为 氢氧化钙能使无
__红___色,
色酚酞试液变
2号试管溶液变为 __红____,使紫色石
_蓝____色
蕊试液变__蓝______
溶液先变为 ____红____色,后 ___红_____色褪去
h
氢氧化钙能与酸 反应生成_盐_______
[归纳总结]
向盛有澄清石 灰水的试管中 通入二氧化碳
澄清石灰水变 浑浊
氢氧化钙能与 某些非金属氧
化物反应
向盛有澄清石 灰水的试管中 滴加碳酸钠溶
液
澄清石灰水变 氢氧化钙能与
浑浊
某些盐反应
h
9
第4课时 实验:碱和盐的性质
[继续探究] 怎样证明干燥剂中是否含有氢氧化钙?哪种方法最简单?
[思考交流] __________________________________________
h
10
第4课时 实验:碱和盐的性质
[归纳总结]
取样后加适量水溶解,倒出上层清液,可以利用加酸碱指示剂、 通入二氧化碳气体等方法检验,用加指示剂的方法检验最简单。
[课堂速记] _____________________________________________________
_____________________________________________________
第1章 物质及其变化
第6节 几种重要的盐 第4课时 实验:碱和盐的性质
h
1
第1章 物质及其变化
第4课时 实验:碱和盐的性质
新知学习
互动探究
课堂小结
h
2
第4课时 实验:碱和盐的性质
重要提示: 无论是检验Cl-还是SO42-,都不要忘记加稀硝酸,以排除可能存在 的CO32-的干扰。
h
3
第4课时 实验:碱和盐的性质
h
11
第4课时 实验:碱和盐的性质
新知学习
新知二 盐的某些性质
实验:(1)取3支试管,分别倒入稀硫酸、硫酸铜溶液、碳酸钠溶液。
在这3支试管中分别滴加少量氯化钡溶液。再往这3支试管中各滴入几
滴稀硝酸,振荡后观察现象。
溶液
滴加少量氯化钡溶液后 的现象
再滴加稀硝酸后的现象
稀硫酸
产生____白__色__沉__淀_______
第4课时 实验:碱和盐的性质
[归纳总结]
取样后先滴加少量氯化钡溶液,若产生白色沉淀,再滴加稀硝酸,若
沉淀不消失,则证明含有硫酸根离子。滴加少量硝酸银溶液,若产生
滴加几滴硝酸银溶液 后的现象
产生___白_白_色色_沉_沉_淀淀______ 产生____白_色__沉_淀______ 产生______________
再滴加稀硝酸后的现象 沉淀不消失
____沉_沉淀__淀不_消消__失失____ ______________
h
13
第4课时 实验:碱和盐的性质
互动探究
[思考交流] _____________________________________________________ ______________________________h_______________________ 7
第4课时 实验:碱和盐的性质
[归纳总结]
操作步骤
操作示意图
现象
结论
h
17
第4课时 实验:碱和盐的性质
[归纳总结]
盐能与某些酸生成新盐和新酸,盐能与某些盐反应生成另 两种盐。 [继续探究] 从实验中你能归纳出检验硫酸根离子和氯离子的方法吗?滴加稀 硝酸的目的是什么?? [思考交流] __________________h________________________ 18
