沪教版化学方程式全书
沪教版初中化学上册全册化学方程式总结(打印版)

1沪教版初中化学上册全册化学方程式总结一、几种物质在空气或氧气中燃烧: 1、★铁丝燃烧: 3Fe + 2O 2 ==== Fe 3O 4 (化合) 2、▲镁条燃烧: 2Mg + O 2 ==== 2MgO (化合) 3、▲红磷燃烧: 4P + 5O 2 === 2P 2O 5(化合) 4、木炭燃烧: C + O 2 === CO 2(完全燃烧)(化合) 2C + O 2 ==== 2CO (不完全燃烧) 5、▲氢气燃烧: 2H 2 + O 2 === 2H 2O (化合反应)6、硫燃烧: S + O 2 === SO 2(化合反应)7、铜丝加热及生锈: 2Cu + O 2 === 2CuO ;(化合反应)8、▲铝丝加热或形成氧化膜:4Al + 3O 2 === 2Al 2O 3(化合反应)9、二氧化碳被碳还原: C + CO 2 === 2CO (化合反应) 10、▲ 一氧化碳燃烧 2CO + O 2 ==== 2 CO 2(化合反应)二、制氧气的3个反应:1、★加热高锰酸钾制氧气:高锰酸钾−−→−加热锰酸钾 +二氧化锰+氧气 2KMnO 4===K 2MnO 4 +MnO 2 +O 2 ↑(分解) 2、★双氧水在二氧化锰作催化剂的条件下制氧气:过氧化氢−−−→−二氧化锰水 + 氧气 2H 2O 2 2H 2O + O 2↑(分解反应) 3、氯酸钾和二氧化锰加热制氧气:二氧化锰 氯酸钾 ————→ 氯化钾 + 氧气 2KClO 3 2KCl +3 O 2 ↑ (分解反应) 加热三、有关二氧化碳的反应:1、★二氧化碳的实验室制法:碳酸钙+盐酸→氯化钙+二氧化碳+水 CaCO 3 + 2HCl= CaCl 2 + CO 2 ↑+ H 2O2、★二氧化碳和水反应:二氧化碳 + 水 —→ 碳酸 CO 2 + H 2O == H 2CO 3(化合反应)3、加热碳酸的反应:碳酸−−→−加热二氧化碳 + 水 H 2CO 3 === CO 2 ↑ + H 2O (分解反应)4、★二氧化碳和澄清石灰水反应; 即二氧化碳气体的检验:二氧化碳 + 氢氧化钙 → 碳酸钙 + 水 CO 2 + Ca(OH)2 == CaCO 3 ↓+ H 2O5、 ★二氧化碳和氢氧化钠溶液反应; 即氢氧化钠变质的原因 点燃 高温点燃 点燃 点燃 点燃 点燃 点燃 点燃△MnO 2 === MnO 2 === △ △ △2CO 2 +2NaOH == Na 2CO 3 + H 2O四、置换反应:1.镁与盐酸、硫酸反应制氢气:Mg + 2HCl == MgCl 2 + H 2↑;Mg + H 2SO 4 == MgSO 4 + H 2↑2.★铁与盐酸、硫酸反应制氢气:Fe + 2HCl == FeCl 2 + H 2↑Fe + H 2SO 4 == FeSO 4 + H 2↑3.锌与盐酸、硫酸反应制氢气:Zn + 2HCl == ZnCl 2 + H 2↑;★实验室制取氢气 Zn + H 2SO 4 == ZnSO 4 + H 2↑4.铝与盐酸、硫酸反应制氢气:2Al + 6HCl == 2AlCl 3 + 3H 2↑;2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑5.★湿法炼铜法,铁与硫酸铜溶液反应:Fe + CuSO 4 == FeSO 4 + Cu五、复分解反应:1.酸碱中和反应:HCl + NaOH == NaCl + H 2O ;2.金属氧化物与酸溶液反应:Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O ; Fe 2O 3 + 3H 2SO 4 ==Fe 2(SO 4)3 + 3H 2O3.碳酸盐与酸溶液反应:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O Na 2CO 3 + 2HCl == 2NaCl+ CO 2↑+ H 2O4.盐溶液与碱溶液反应:Na 2CO 3 + Ca(OH)2 == CaCO 3↓+ 2NaOH ; CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 4 CuSO 4 + Ca(OH)2 == CaSO 4+ Cu(OH)2↓5.纯碱与氯化钙溶液反应:Na 2CO 3 + CaCl 2 == CaCO 3↓+ 2NaCl6.铵盐与碱反应产生氨气:NH 4NO 3 + NaOH NaNO 3 + NH 3↑+ H 2O (NH 4)2SO 4 + Ca(OH)2 CaSO 4 + 2NH 3↑+ 2H 2O六、其他反应类型:1、 水−−→−通电氢气+氧气 2H 2O 2H 2↑+ O 2↑(分解反应)2、★一氧化碳还原氧化铁: Fe 2O 3 + 3CO 2Fe + 3CO 2 ;一氧化碳还原四氧化三铁 Fe 3O 4 + 4CO 3Fe + 4CO 2; 一氧化碳还原氧化铜: CuO + CO Cu + CO 2 3、碳酸钙高温煅烧分解:CaCO 3 CaO + CO 2↑(分解反应)4、生石灰溶于水:CaO + H 2O == Ca(OH)2(化合反应)5、金属镁与二氧化碳反应:2Mg + CO 2 ==== 2MgO + C (置换反应)6、甲烷燃烧 CH 4 +2 O 2 ==== CO 2 +2H 2O7.绿色植物光合作用:6CO 2 + 6H 2O C 6H 12O 6 + 6O 2 高温 === △== 叶绿素△ == 酶 == 高温 === 点燃 点燃 高温 ===光照 === 通电 === 高温 ===8. 呼吸作用:C6H12O6 + 6O26CO2 + 6H2O3。
沪教版九年级化学第一二章化学方程式整理

初三年化学一二章化学方程式整理永春一中林扬奇反应项目反应化学方程式现象1碳酸氢铵加热分解为氨气、水、二氧化碳。
NH4HCO3NH3↑ +H2O + CO2↑白色粉末消失,产生刺激性气味气体,试管壁有水珠生成,澄清石灰水变浑浊。
2碱式碳酸铜加热分解为氧化铜、水、二氧化碳Cu2(OH)2CO32CuO+H2O+CO2↑绿色粉末变成黑色,试管口处有水珠生成,澄清石灰水变浑浊。
3碱式碳酸铜与盐酸反应生成氯化铜、水、二氧化碳Cu2(OH)2CO3 +4HCl =2CuCl2+3H2O+CO2 ↑绿色粉末溶解产生大量气泡,溶液变成蓝绿色。
4镁带在空气中燃烧生成氧化镁2Mg+O22MgO镁带燃烧发出耀眼的白光,放出热量,生成白色粉末状固体。
5铜丝在火焰上灼烧2Cu +O22CuO铜丝表面变黑6镁带与盐酸反应Mg+2HCl=MgCl2+H2↑镁带表面产生大量气泡,并不断溶解。
7红磷在空气中燃烧生成五氧化二磷4P+5O22P2O5红磷燃烧发出黄光,放出热量,产生大量白烟。
8木炭在氧气中燃烧生成二氧化碳C+O2CO2木炭燃烧发出白光,放出热量,澄清石灰水变浑浊。
9铁丝在氧气中燃烧生成四氧化三铁3Fe+2O2Fe3O4剧烈燃烧,火星四射,放出热量,生成黑色固体。
10加热高锰酸钾分解制氧气2KMnO4K2MnO4+MnO2+O2↑11双氧水分解制氧气2H2O22H2O + O2↑溶液产生大量气泡12氯酸钾与二氧化锰加热制取氧气2KClO32KCl +3O2↑13二氧化碳通入紫色石蕊试液生成碳酸CO2+H2O = H2CO3紫色石蕊试液变红(注:是碳酸使紫色石蕊变红,不是CO2)14加热含石蕊试液的二氧化碳水溶液H2CO3 = H2O+CO2↑石蕊试液又变成紫色15二氧化碳通入澄清石灰水Ca(OH)2+CO2 = CaCO3↓+H2O澄清石灰水变浑浊16实验室用石灰石与稀盐酸制二氧化碳CaCO3+2HCl = CaCl2+H2O+CO2↑石灰石表面产生大量气泡并不断溶解17电解水得到氢气和氧气2H2O 2H2↑+O2↑电源两极产生大量气泡,负极产生的气体是正极的二倍。
沪教版九年级上册1-4章化学方程式

1—4章化学方程式一.化合反应1.镁带燃烧: 2Mg + O 2 ==== 2MgO2.铁丝燃烧: 3Fe + 2O 2 ==== Fe 3O 43.氢气燃烧: 2H 2 + O 2 === 2H 2O4.碳的燃烧:2C + O 2 ==== 2CO (不完全燃烧);C + O 2 === CO 2(完全燃烧)5.硫的燃烧:S + O 2 === SO 26.磷的燃烧:4P + 5O 2 === 2P 2O 57.浓盐酸与浓氨水相靠近:NH 3 + HCl == NH 4Cl8、二氧化碳与水反应: CO 2+ H 2O == H 2CO 39、一氧化碳的燃烧:2CO + O 2 == 2CO 2二.分解反应10.碳酸氢铵(碳铵)受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O 11.加热高锰酸钾制氧气: 2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 12.二氧化锰催化双氧水制氧气:2H 2O 2 2H 2O + O 2↑ 13.电解水:2H 2O 2H 2↑+ O 2↑14.碳酸分解:H 2CO 3 == CO 2↑+ H 2O15、加热氯酸钾制取氧气:2KClO 32KCl + 3O 2↑ 三.其它反应16、硫酸铜溶液与氢氧化钠溶液反应:CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 417、二氧化碳与澄清石灰水反应:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O ;18、实验室制取二氧化碳:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O ; 点燃 点燃点燃 点燃 点燃 点燃 △ ===△ === 通电 === 点燃 MnO 2=== MnO 2 === △ 点燃。
沪教版初中化学方程式上册

1-5章化学方程式整理小结一.化合反应 1.镁带燃烧: 2Mg + O 2 ==== 2MgO (耀眼白光,照明弹) 2.铁燃烧及生锈:3Fe + 2O 2 ==== Fe 3O 4(火星四射,得黑色固体);*4Fe + 3O 2 ===== 2Fe 2O 3(缓慢氧化)3.铜丝加热: 2Cu + O 2 === 2CuO ;4.铝丝常温形成致密氧化膜:4Al + 3O 2 === 2Al 2O 3 5.氢气燃烧或爆炸: 2H 2 + O 2 === 2H 2O 6.碳的燃烧:2C + O 2==== 2CO (不完全燃烧);C + O 2 === CO 2(完全燃烧) 7.硫的燃烧:S + O 2 === SO 2 (空气中微弱的淡蓝色火焰,氧气中明亮的蓝紫色火焰) 8.磷的燃烧:4P + 5O 2 === 2P 2O 5 (浓厚白烟,烟幕弹)9.二氧化碳被碳还原:C + CO 2 === 2CO (吸热反应,高炉炼铁中制还原剂CO )10.二氧化碳溶于水:CO 2 + H 2O == H 2CO 3 (制碳酸饮料) 11.CO 燃烧:2CO+O 2=== 2CO 2 (CO 是煤气的主要成分,有毒)二.分解反应 1.碳酸氢铵(碳铵)受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O (特点:固体受热后消失)2.碱式碳酸铜(铜绿受热分解):Cu 2(OH)2CO 3 2CuO + H 2O + CO 2↑(特点:分解得3种氧化物)3.加热高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 4.二氧化锰催化双氧水制氧气:2H 2O 2 2H 2O + O 2↑ (实验室制氧气) 5.氯酸钾制氧气:2KClO 3 2KCl+3O 2↑ 6.电解水:2H 2O 2H 2↑+ O 2↑ 7.碳酸分解:H 2CO 3 CO 2↑+ H 2O 三.置换反应*1.氢气还原金属氧化物: CuO + H 2 Cu + H 2O*2.碳粉还原金属氧化物: 2CuO + C 2Cu + CO 2↑3.铝与盐酸、硫酸反应制氢气:2Al + 6HCl == 2AlCl 3 + 3H 2↑;2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑4.镁与盐酸、硫酸反应制氢气:Mg + 2HCl == MgCl 2 + H 2↑;Mg + H 2SO 4 == MgSO 4 + H 2↑5.铁与盐酸、硫酸反应制氢气:Fe + 2HCl == FeCl 2 + H 2↑;Fe + H 2SO 4 == FeSO 4 + H 2↑6.锌与盐酸、硫酸反应制氢气:Zn + 2HCl == ZnCl 2 + H 2↑;Zn + H 2SO 4 == ZnSO 4 + H 2↑(实验室制氢气)7.湿法炼铜法,铁与硫酸铜溶液反应:Fe + CuSO 4 == FeSO 4 + Cu*8.铜与硝酸银溶液反应:Cu + 2AgNO 3 == Cu(NO 3)2 + 2Ag四.复分解反应:*1.金属氧化物与酸溶液反应:Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O(除锈);Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O (除锈)CuO + H 2SO 4 == CuSO 4 + H 2O2.实验室制CO 2:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O (原理:碳酸盐与酸都能反应生成CO 2)3.硫酸铜溶液和氢氧化钠溶液混合生成蓝色沉淀:CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 4五.其他反应类型: 1.一氧化碳还原金属氧化物:Fe 2O 3 + 3CO 2Fe + 3CO 2(赤铁矿炼铁) Fe 3O 4 + 4CO 3Fe + 4CO 2;(磁铁矿炼铁) * CuO + CO Cu + CO 2 潮湿空气 △点燃 点燃 点燃 点燃 点燃点燃 点燃 高温 △ === △ ===△ === MnO 2 === 通电 ===高温 === 高温 === 高温 === 高温 === 高温 ===MnO 2 === △△ === 点燃2.二氧化碳通入澄清石灰水:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O (验CO 2); *3.天然气燃烧:CH 4 + 2O 2 CO 2 + 2H 2O4..铜绿和盐酸反应:Cu 2(OH)2CO 3 + 4 HCl = 2CuCl 2 + 3H 2O + CO 2↑打*的为拓展内容 点燃 ===。
上海高中化学方程式[全]
![上海高中化学方程式[全]](https://img.taocdn.com/s3/m/5caab8b28e9951e79a892798.png)
上海高中化学方程式[全]work Information Technology Company.2020YEAR高考总复习之高中化学方程式总结 化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓)13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆ 22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆ 47、FeS S Fe −→−+∆48、S H H S 22−→−+∆ 49、2CS C S −−→−+高温50、22SO O S −−→−+点燃51、O H 3SO K S K 2KOH 6S 32422++−→−+∆ 第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合)63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3O V 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3O V 22SO 2O SO 252∆−−→←+ 79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+86、NaCl 2BaSO SO Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓)95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓)96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SO H 11221142+−−−→−浓第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆ 113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))(116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
九年级化学全册4.3化学方程式课件2(新)沪教

A+B+C=D
25g
15g
15g 6g 9g 30g
12. 在一个密闭的钢筒内有A、B、C、D四种物质, 通过电火花引燃后,充分发生反应。经测定,钢筒内 反应前后各物质的质量如下:
物质
A
B
C
D
反应前质量(g)
4
10
1
25
反应后质量(g)
(未测)
21
10
9
若A的相对分子质量为n,D的相对分子质量为2n,则该 反应的化学方程式中A与D的化学计量数之比为( )
48 ------
=
3--g----
80 X
(4)列比例式
80×3g
(5)计算结果
48 =5g
(6) 简答
答:3g镁在氧气中充分燃烧可生成氧化镁 5 g
(三)练习题
1.铁可在纯氧中燃烧生成四氧化三铁,现要制取2.32 克四氧化三铁,则需要多少克铁? Fe- 56,O-16
解:设需要铁的质量为X
点燃 3Fe + 2O 2 ====== Fe3 O4
反应时间/分
0 2 4 6 8 10
烧杯及所盛物质质量/克 80.0 79.0 78.3 77.9 77.8 77.8
⑴反应生成CO2的总质量为克。
⑵该石灰石样品中碳酸钙的质量分数是多少?
CaCO3 +2HCl = CaCl2 + H2O + CO2 ↑
100
44
X
2.2g
14.某学校研究性学习小组为了测定当地矿山石灰石中碳酸钙 的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均 分成4份,进行实验,结果如下:
A. 9.6g B. 14பைடு நூலகம்4g C. 4.8g D. 6.4g
沪教版初三总复习化学反应方程全

常见气体的性质(1)氧气O2(通常状况下) 化学性质及用途(O2)无色无味的气体,不易溶于水,密度比空气略大①C + O2==CO2(发出白光,放出热量)a. 供呼吸;b. 炼钢;c. 气焊。
(注:O2具有助燃性,但不具有可燃性,不能燃烧。
)②S + O2 ==SO2(空气中—淡蓝色火焰;氧气中—紫蓝色火焰)③4P + 5O2 == 2P2O5(产生白烟,生成白色固体P2O5)④3Fe + 2O2 == Fe3O4(剧烈燃烧,火星四射,放出大量的热,生成黑色固体)⑤蜡烛在氧气中燃烧,发出白光,放出热量(2)氢气(H2)无色无味的气体,难溶于水,密度比空气小,是最轻的气体。
①可燃性:2H2 + O2 ==== 2H2OH2 + Cl2 ==== 2HCla.填充气、飞舰(密度比空气小)b.合成氨、制盐酸c.气焊、气割(可燃性)4.提炼金属(还原性)②还原性:H2 + CuO === Cu + H2O3H2 + WO3 === W + 3H2O3H2 + Fe2O3 == 2Fe + 3H2O(3)二氧化碳(CO2)无色无味的气体,密度大于空气,能溶于水,固体的CO2叫“干冰”。
①CO2 + H2O ==H2CO3(酸性)(H2CO3 === H2O + CO2↑)(不稳定)a.用于灭火(应用其不可燃烧,也不支持燃烧的性质)b.制饮料、化肥和纯碱CO2 + Ca(OH)2 ==CaCO3↓+H2O(鉴别CO2)CO2 +2NaOH==Na2CO3 + H2O②氧化性:CO2 + C == 2COCaCO3 == CaO + CO2↑(工业制CO2)(4)一氧化碳(CO)无色无味气体,密度比空气略小,难溶于水,有毒气体。
①可燃性:2CO + O2 == 2CO2(火焰呈蓝色,放出大量的热,可作气体燃料)a. 作燃料b. 冶炼金属②还原性:CO + CuO === Cu + CO23CO + WO3 === W + 3CO23CO + Fe2O3 == 2Fe + 3CO2(跟血液中血红蛋白结合,破坏血液输氧的能力)基本化学反应(一)化合反应1.定义:多变一(2)基本形式:A+B=AB2C+O2===2CO2CO+O2===2CO2CO2+C===2CO CO2+H2O==H2CO311.二氧化碳通过灼热碳层:C + CO高温2CO(是吸热的反应)分解反应1.定义:一变多基本形式:AB=A+B2HgO===2Hg+O21.定义:一换一基本形式:A+BC=AC+B酸与金属反应:Zn+H2SO4==ZnSO4+H2↑Fe+H2SO4 ==FeSO4+H2↑Mg+2HCl==MgCl2+H2↑盐与金属反应:2Al+3CuSO4==Al2(SO4)3+3Cu CuSO4+Zn==ZnSO4+Cu2.金属单质+ 酸——盐+ 氢气(置换反应)(1)锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑(2)镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑(3)铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑(4)锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑(5)镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑(6)铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑(1)-(6)的现象:有气泡产生。
化学九年级全册沪教版4.3化学方程式课件2

48 ------
=
3--g----
80 X
(4)列比例式
X = -8-0--×---3-g---48
=5g
(5)计算结果 (6) 简答
答:3g镁在氧气中充分燃烧可生成氧化镁 5 g
(三)练习题
1.铁可在纯氧中燃烧生成四氧化三铁,现要制取2.32 克四氧化三铁,则需要多少克铁? Fe- 56,O-16
C. 3(a+b)克
D. c克
5. a克A与 b克B 充分反应生成C,则生成C的质量与 (a+b)的关系是( )
A. =
B. ≤
C. ≥
D. 无法确定
6.在化学反应3X = 2Y的反应中,9.6g X最多能生 成Y的质量为 ( )
A. 9.6g B. 14.4g C. 4.8g D. 6.4g
7.在反应A+3B=2C+2D中,A和B的相对分子质 量之比为7:8。已知2.8gA与一定量B完全反应, 生成3.6gD。则在反应中,B和C的质量比为 ( )
A.3:3 B.3:4 C.12:11 D.11:12
A + 3B = 2C + 2D
7 24 2.8g 9.6g 8.8g 3.6g
8.氢气和氧气的混合物10克,点燃后生成水,并 剩余1克气体,则原混合物气体中,氢气和氧气 的质量分别为( )
A 、 2克氢气和8克氧气 B 、 1克氢气和9克氧气 C 、 5克氢气和5克氧气 D 、 4克氢气和6克氧气
A+B+C=D
25g
15g
15g 6g 9g 30g
12. 在一个密闭的钢筒内有A、B、C、D四种物质, 通过电火花引燃后,充分发生反应。经测定,钢筒内 反应前后各物质的质量如下:
沪教版初中常见化学方程式

一、化合反应1.镁带在空气中燃烧: 2Mg + O 2 ==== 2MgO (耀眼白光、放热、白烟,白色固体)2.铁丝在氧气中燃烧: 3Fe + 2O 2 ==== Fe 3O 4 (火星四射、放热、黑色固体)3.铜丝加热及生锈: 2Cu + O 2 === 2CuO (红变黑);2Cu + O 2 + H 2O + CO 2 == Cu 2(OH)2CO 34.铝在空气中缓慢氧化:4Al + 3O 2 === 2Al 2O 35.氢气燃烧或爆炸: 2H 2 + O 2 === 2H 2O (淡蓝色火焰)6.碳的燃烧:2C + O 2 ==== 2CO (不完全燃烧);C + O 2 === CO 2(完全燃烧)7.一氧化碳燃烧:2CO + O 2 === 2CO 2(蓝色火焰)7.硫的燃烧:S + O 2 === SO 2 (刺激性气味;空气中淡蓝色火焰;氧气中蓝紫色火焰)8.磷的燃烧:4P + 5O 2 === 2P 2O 5 (白烟,白色固体)9.二氧化碳被碳还原:C + CO 2 === 2CO (高炉炼铁,产生还原剂CO )10.人工固氮(合成氨):N 2 + 3H 2 ======= 2NH 3 11.生石灰溶于水:CaO + H 2O == Ca(OH)2 (放热)12.二氧化碳溶于水:CO 2 + H 2O == H 2CO 313.二氧化硫溶于水:SO 2 + H 2O == H 2SO 314.二氧化硫在空气中转化为三氧化硫:2SO 2 + O 2 ==== 2SO 315.三氧化硫溶于水:SO 3 + H 2O == H 2SO 416.亚硫酸氧化成硫酸:2H 2SO 3+ O 2 == 2H 2SO 417.工业上制盐酸(氢气在氯气中燃烧):H 2 + Cl 2 === 2HCl 18.金属钠在氯气中燃烧:2Na + Cl 2 2NaCl19.浓盐酸与浓氨水相靠近:NH 3 + HCl == NH 4Cl (白烟)二、分解反应1.碳酸氢铵(碳铵)受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O2.碱式碳酸铜(铜绿受热分解):Cu 2(OH)2CO 3 2CuO + H 2O + CO 2↑ (绿变黑)3.加热高锰酸钾制氧气:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 4.二氧化锰催化双氧水制氧气:2H 2O 2 2H 2O + O 2↑5. 氯酸钾与二氧化锰制氧气:2KClO 3 2KCl + 3O 2↑6.电解水:2H 2O 2H 2↑+ O 2↑ (正氧负氢,氧一氢二)7.碳酸分解:H 2CO 3 CO 2↑+ H 2O8.碳酸钙高温煅烧分解:CaCO 3 CaO + CO 2↑9.电解熔融状态的氧化铝制取金属铝:2Al 2O 3 4Al + 3O 2↑10.小苏打(碳酸氢钠)加热分解:2NaHCO 3 Na 2CO 3 +H 2O+CO 2 ↑三、置换反应1.氢气还原金属氧化物:Fe 2O 3 + 3H 2 2Fe + 3H 2O ;Fe 3O 4 + 4H 2 3Fe + 4H 2O ; CuO + H 2 Cu + H 2O △ 点燃 点燃 点燃 点燃 点燃 点燃 高温 高温、高压 催化剂 粉尘 点燃 点燃 === △ === △ === △ ===MnO 2 === 通电 === 高温 === 通电 === 高温 === 高温 === 高温 === △ === △ === 点燃MnO 2=== △ 点燃2.碳粉还原金属氧化物:2Fe 2O 3 + 3C 4Fe + 3CO 2↑;Fe 3O 4 + 2C 3Fe + 2CO 2↑; 2CuO + C 2Cu + CO 2↑3.铝与盐酸、硫酸反应:2Al+6HCl = 2AlCl 3 + 3H 2↑;2Al + 3H 2SO 4 == Al 2(SO 4)3 + 3H 2↑4.镁与盐酸、硫酸反应:Mg + 2HCl == MgCl 2 + H 2↑;Mg + H 2SO 4 == MgSO 4 + H 2↑5.铁与稀酸反应:Fe + 2HCl == FeCl 2 + H 2↑;Fe + H 2SO 4 == FeSO 4 + H 2↑(溶液变为浅绿色)6.实验室制取氢气:Zn + 2HCl == ZnCl 2 + H 2↑;Zn + H 2SO 4 == ZnSO 4 + H 2↑7. 锌与硫酸铜溶液反应:Zn + CuSO 4 = Cu + ZnSO 48.湿法炼铜法:Fe + CuSO 4 == FeSO 4 + Cu (溶液由蓝色变浅绿色;铁表面析出红色固体)9.铜与硝酸银溶液反应:Cu + 2AgNO 3 == Cu(NO 3)2 + 2Ag (溶液变蓝;铜片表面变黑)10.金属镁与二氧化碳反应:2Mg + CO 2 2MgO + C四、复分解反应1.中和反应:HCl + NaOH == NaCl + H 2O ; Cu(OH)2 + H 2SO 4 == CuSO 4 + 2H 2O H 2SO 4 + Ba(OH)2 == BaSO 4↓+ 2H 2O ;Ca(OH)2 + 2HCl == CaCl 2 +2H 2OHCl + NH 3·H 2O = NH 4Cl + H 2O ; H 2SO 4 + 2NH 3·H 2O = (NH 4)2SO 4 + 2H 2O2.金属氧化物与酸反应:CuO + H 2SO 4 == CuSO 4 + H 2O (黑色固体溶解,溶液变为蓝色); Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O ;Fe 2O 3 +3H 2SO 4 == Fe 2(SO 4)3 + 3H 2O (除锈,溶液变为黄色);3.碳酸盐与酸溶液反应:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O (实验室制备CO 2);Na 2CO 3 + 2HCl == 2NaCl+ CO 2↑+ H 2O ; 2HNO 3 + CaCO 3 = Ca(NO 3)2 + H 2O + CO 2↑ C u 2(O H )2C O 3+4HCl == 2CuCl 2 + 3H 2O+CO 2↑ (溶液由无色变为蓝绿色)4.盐溶液与碱溶液反应:Na 2CO 3 + Ca(OH)2 == CaCO 3↓+ 2NaOH (纯碱制烧碱);CuSO 4 + Ca(OH)2== Cu(OH)2↓+CaSO 4 (配制波尔多液);CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 4 ; CuSO 4 + Ba(OH)2 == BaSO 4↓+ Cu(OH)2↓5.Ag +与Cl -反应:HCl + AgNO 3 == AgCl↓+ HNO 3;NaCl + AgNO 3 == AgCl↓+ NaNO 36.Ba 2+与SO 42-反应:BaCl 2 + CuSO 4 == BaSO 4↓+ CuCl 2;H 2SO 4 + BaCl 2 == BaSO 4↓+ 2HCl7.纯碱与氯化钙溶液反应:Na 2CO 3 + CaCl 2 == CaCO 3↓+ 2NaCl8.铵盐与碱反应产生氨气: NH 4NO 3 + NaOH NaNO 3 + NH 3↑+ H 2O (湿润的红色石蕊试纸变蓝) (NH 4)2SO 4 + Ca(OH)2 CaSO 4 + 2NH 3↑+ 2H 2O ;(NH 4)2SO 4 + 2NaOH Na 2SO 4 + 2NH 3↑+ 2H 2O五、其他反应1.一氧化碳还原金属氧化物:Fe 2O 3 + 3CO 2Fe + 3CO 2(红变黑); Fe 3O 4 + 4CO 3Fe + 4CO 2;CuO + CO Cu + CO 2(黑变红)2.非金属氧化物与碱溶液反应:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O ;(检验CO 2) (吸收CO 2或SO 2) CO 2 +2NaOH == Na 2CO 3 + H 2O ; SO 2 +2NaOH == Na 2SO 3 + H 2O3.有机物燃烧:CH 4 + 2O 2 CO 2+ 2H 2O (蓝色火焰); C 2H 6O + 3O 2 2CO 2 + 3H 2O 4.呼吸作用 C 6H 12O 6 + 6O 2 6CO 2 + 6H 2O5.绿色植物光合作用:6CO 2 + 6H 2O C 6H 12O 6 + 6O 2 高温 === 高温 === 高温 === 点燃 === 点燃 === === 叶绿素 点燃 === 光照 === △ ===△ === △ === 高温 ===高温 === 高温===。
沪教版九年级(初三)化学上册:化学方程式_课件1

(2)配。
在反应物和生成物的前面配上适当的化学计量数,使反应前后各
种元素的原子个数相等。配平后把短线改成等号。 如3Fe+2O2====Fe3O4 (3)注。
条件 ,如点燃、 用文字或符号在“等号”上面注明反应发生的_____
状态 ,如反 加热(常用“△”表示)、催化剂等。标出生成物的_____ 应中有气体放出或在溶液中有沉淀生成,就在生成的气体或沉 淀物的化学式右边分别用“↑”或“↓”标明。
第2课时 依据化学方程式的计算
一、化学方程式的意义
生成物 ,而且还揭示了反应 反应物 和_______ 不仅表示化学变化中的_______
相对质量关系 。 前后各物质之间的_____________ 以氢气在氧气中燃烧的化学方程式为例 化学方程式: 2H2 +
点燃 O2 ==== 2H2O
物质的质量比:(2×2)∶32∶(2×18)
根据化学方程式进行计算时所设未知数不能带单位但最后求出的未知数的数值要带单位已知量在整个计算过程中要带单位相关的化学方程式一定要书写正确特别注意要配平相关物质的化学计量数与相对分子质量的乘积要计算准确最后要简明地写出答案
化学方程式
化学反应的表示方法
1.化学方程式的概念及书写原则
化学反应 的式子。 化学式 表示__________ (1)概念:用_______
点燃
“↓”。
5.判断化学方程式是否配平的依据是看等号两边各种元素的原 子总数是否相等。( √ )
提示:配平化学方程式是为了遵循质量守恒定律,使反应前后
原子的种类与数目都相等。
【探究点】化学方程式的书写
结合下述化学方程式探究相关问题:
①S+O2 ==== SO2
沪教版化学-九年级上册-4.5 化学方程式(7课时)

4.5 化学方程式教学目标1.理解质量守恒定律的涵义及关键词语。
2.初步培养学生应用实验方法来定量研究问题和分析问题的能力。
3.用化学变化实质及原子、分子的知识解释质量守恒定律。
4.理解化学方程式的意义及书写化学方程式应遵循的原则。
5.初步学会配平化学方程式的方法。
6.了解化学方程式计算的意义,掌握计算方法及解题格式。
教学重点1.质量守恒定律的涵义。
2.正确书写化学方程式。
3.有一种反应物(或生成物)的质量求生成物(或反应物)的质量。
教学难点1.运用质量守恒定律解释一些现象。
2.化学方程式的配平。
3.化学方程式计算的解题思路和解题格式。
教学课时七课时教学用具托盘天平、砝码、锥形瓶、小试管、橡皮塞。
硫酸铜溶液、氢氧化钠溶液。
教学过程第一课时教学目标1.理解质量守恒定律的涵义及关键词语。
2.初步培养学生应用实验方法来定量研究问题和分析问题的能力。
3.用化学变化实质及原子、分子的知识解释质量守恒定律。
教学重点质量守恒定律的涵义。
教学难点运用质量守恒定律解释一些现象。
教学用具托盘天平、砝码、锥形瓶、小试管、橡皮塞。
硫酸铜溶液、氢氧化钠溶液。
教学过程写出下列化学变化的反应表达式1.在空气中点燃磷2.蜡烛在氧气中燃烧3.镁在空气中燃烧4.加热碱式碳酸铜这些反应表达式反映出反应物在一定条件下发生化学反应生成新的物质。
从这些反应式里我们可以看出参加反应的是什么物质,生成的是什么物质,表示出这些反应中质的变化。
但是,随着反应的进行,物质的量是否也发生变化呢?反应物的质量与生成物的质量有什么关系?反应后物质的质量是增加、减少还是不变?下面我们通过试验来探讨这些问题。
观察和问题一张纸片燃烧后,只剩下少量灰烬,其余物质是消失了吗?物质发生化学反应前后,质量总和会变化吗?假设和推测物质发生化学反应前后,质量总和不会变化。
设计实验方案将燃烧前的纸片和燃烧后的生成物称量比较质量。
选做实验1. 4224()CuSO NaOH Cu OH Na SO +→+2. 2233BaCl Na CO BaCO NaCl +→+解释和结论一.质量守恒定律1.定律内容:在化学反应中,参加反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这就是质量守恒定律。
(沪教版)初中化学方程式全收录

初中化学方程式一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O2加热2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃2P2O57. 硫粉在空气中燃烧:S + O2点燃SO28. 碳在氧气中充分燃烧:C + O2点燃CO29. 碳在氧气中不充分燃烧:2C + O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2 ↑14.加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O2点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O442. 铜在空气中受热:2Cu + O2加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸--------盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)-------新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ Fe2O3高温2Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属--------盐+ 氢气(见上)(2)酸+ 金属氧化物--------盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱--------盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐--------另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱+ 非金属氧化物--------盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱+ 酸--------盐+ 水(中和反应,方程式见上)(3)碱+ 盐--------另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)+ 金属单质-------另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸--------另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ (3)盐+ 碱--------另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐+ 盐-----两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
沪教版初三化学化学方程式

化学方程式一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧: 2Mg + O2点燃 2MgO2.铁在氧气中燃烧: 3Fe + 2O2点燃 Fe3O43.铝在空气中燃烧: 4Al + 3O2点燃 2Al2O34.铜在空气中受热: 2Cu + O2△ 2CuO5.氢气中空气中燃烧: 2H2+ O2点燃 2H2O6.红磷在空气中燃烧: 4P + 5O2点燃 2P2O57.硫粉在空气中燃烧: S + O2点燃 SO28.碳在氧气中充分燃烧: C + O2点燃 CO29.碳在氧气中不充分燃烧: 2C + O2点燃 2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧2CO + O2点燃 2CO2 11.甲烷在空气中燃烧:CH4+ 2O2点燃 CO2+ 2H2O 12.二氧化硫与氧气反应: 2SO2 + O2 尘埃2SO3二.几个分解反应:13.水在直流电的作用下分解: 2H2O 通电 2H2↑+ O2 ↑14.加热碳酸氢铵: NH4HCO3△ NH3↑ + H2O + CO2 ↑15.加热高锰酸钾: 2KMnO4△K2MnO4 + MnO2 + O2↑16.双氧水和二氧化锰制氧气: 2H2O2MnO2 2H2O + O2↑17.碳酸不稳定而分解: H2CO3 === H2O + CO2↑18.高温煅烧石灰石: CaCO3高温CaO + CO2↑“铜绿”受热的变化Cu2(OH)2CO3△2CuO + CO2↑+ H2O加热氯酸钾2KClO3 = 2KCl +3O2↑三.呼吸、光合作用:19.呼吸作用: C6H12O6 + 6O2 === 6CO2 + 6H2O20.光合作用: 6CO2 + 6H2O 光照叶绿素 C6H12O6 + 6O2四.氧化还原反应21.一氧化碳还原氧化铁: 3CO+ Fe2O3△ 2Fe + 3CO2五.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸(不包括浓、稀硝酸和浓硫酸) --盐 + 氢气(置换反应)(注意:产生一克氢气所需要金属的质量等于 )22.锌和稀硫酸反应: Zn + H2SO4 === ZnSO4 + H2↑23.铁和稀硫酸反应: Fe + H2SO4 === FeSO4 + H2↑24.镁和稀硫酸反应: Mg + H2SO4 === MgSO4 + H2↑25.铝和稀硫酸反应: 2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑26.锌和稀盐酸反应: Zn + 2HCl=== ZnCl2 + H2↑27.铁和稀盐酸反应: Fe + 2HCl=== FeCl2 + H2↑28.镁和稀盐酸反应: Mg+ 2HCl=== MgCl2 + H2↑29.铝和稀盐酸反应: 2Al + 6HCl === 2AlCl3 + 3H2↑(及此类的具有相同规律的、常见物质参加的反应。
九年级化学全册化学反应方程式教案沪教版

九年级化学全册化学反应方程式教案沪教版教学目标(一)、知识与技能1..能正确书写简单的化学反应方程式,并据此进行简单的计算。
(二)、过程与方法1.进一步理解科学探究的过程;2.认识书写化学方程式的依据,理解内容和形式的辨证关系。
(三)、情感态度与价值观认识定量研究对化学科学发展的意义。
教学重点、难点1、重点:质量守恒定律的理解、应用和成立原因;化学反应方程式的书写及配平;有关化学方程式的计算2、难点:化学方程式的配平,化学方程式的计算通过实验探究燃烧的条件教学资源准备演示、分组实验器材、药品教学过程教学过程一、导入新课设置情景问题:酒精灯内的液体燃烧后会逐渐减少,生锈的铁钉质量比原先质量增加,铁与硫酸铜溶液反应后总质量却没有变;那么化学反应前后物质的总质量会发生什么变化?增加,减少还是不变?二、师生互动(一)、化学变化的表示方法1.化学方程式的原则(1)严格遵循质量守恒定律,即需要化学方程式配平(2)严格尊重实验事实,不可主观臆造2.化学方程式的意义:以P为例 4P +5O22P2O54×31 5×32 2×142(1)磷和氧气在点燃的情况下,完全燃烧,生成了五氧化二磷(2)每4个磷原子在点燃条件下能与5个氧分子完全反应,生成2个五氧化二磷分子(3)每124份质量的磷在点燃的情况下,能与160份质量氧气完全反应,生成284份质量五氧化二磷3.化学方程式的配平书写化学方程式必须遵守质量守恒定律。
因此,在化学方程式两边的化学式前面要配适当的化学计量数,使化学方程式左、右两边每一种元素的原子总数相等。
化学方程式配平后,短线改成等号。
配平化学方程式的方法有多种,这里介绍几种简单的方法:(1)最小公倍数法:例如配平化学方程式:NH3+Cl2—N2+NH4Cl观察上式:左边有3H,右边有4H,氢原子的最小公倍数是12。
因此,在NH3前配上化学计量数4,在NH4Cl前配上化学计量数3,即:4NH3+Cl2—N2+3NH4Cl原子个数相等);Cl”(使3/2前配“2Cl,所以在左边的3Cl上式中:右边有原子数相N”(使1/2前应配“2N,所以在3N中有Cl43NH,右边的4N左边有Cl4+3NH2N—2Cl+34NH等),即:上式两边分别乘以2,使各项化学计量数变成最小整数比,即:Cl46NH +2==N 2+3Cl 38NH (2)观察法先找出化学方程式中原子数目多的化学式,令该化学式的化学计量数为1O2NO+H —2+O 3NH 例如:配平化学方程式 ;依据“等号”两边各种原子的1的原子数目比较多,令其化学计量数为3NH 数目相等确定其他各项的化学计量数。
九年级初三化学方程式汇总沪教版
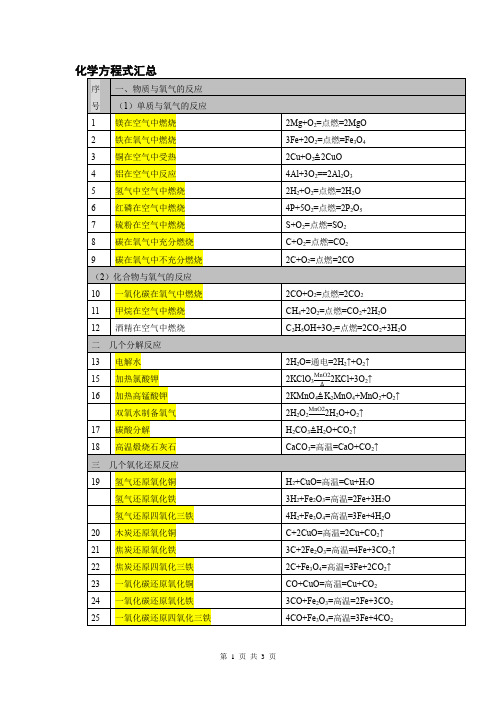
序号
一、物质与氧气的反应
(1)单质与氧气的反应
1
镁在空气中燃烧
2Mg+O2=点燃=2MgO
2
铁在氧气中燃烧
3Fe+2O2=点燃=Fe3O4
3
铜在空气中受热
2Cu+O2 2CuO
4
铝在空气中反应
4Al+3O2==2Al2O3
5
氢气中空气中燃烧
2H2+O2=点燃=2H2O
6
红磷在空气中燃烧
58
硝酸和烧碱反应
HNO3+NaOH====NaNO3+H2O
(6)酸/碱/盐+盐----另一种酸/碱/盐+另一种盐
59
大理石与稀盐酸反应
CaCO3+2HCl====CaCl2+H2O+CO2↑
60
碳酸钠与稀盐酸反应
Na2CO3+2HCl====2NaCl+H2O+CO2↑
61
碳酸镁与稀盐酸反应
MgCO3+2HCl====MgCl2+H2O+CO2↑
66
氢氧化钠与氯化铁
3NaOH+FeCl3====Fe(OH)3↓+3NaCl
67
氢氧化钠与氯化镁
2NaOH+MgCl2====Mg(OH)2↓+2NaCl
68
氢氧化钾与氯化铜
2KOH+CuCl2====Cu(OH)2↓+2KCl
69
氢氧化钙与碳酸钠
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
CaCO3=高温=CaO+CO2↑
沪教版初三化学方程式

初三化学方程式按元素归类总结与氧有关的化学方程式:2Mg+O 2−−−→点燃2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光 S+O 2−−−→点燃 SO 2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰; 同时生成有刺激性气味的气体。
C+O 2−−−→点燃CO 2 现象:生成能够让澄清石灰水浑浊的气体 2C+O 2−−−→点燃2CO 现象:燃烧 4P+5O 2−−−→点燃2P 2O 5 现象::生成白烟 3Fe+2O 2−−−→点燃Fe 3O 4 现象:剧烈燃烧、火星四射、生成黑色的固体 2H 2+O 2−−−→点燃2H 2O 现象:淡蓝色的火焰 2H 2O 22MnO −−−→2H 2O+O 2↑ 现象:溶液里冒出大量的气泡 2KClO 32MnO −−−→2KCl+3O 2↑ 现象:生成能让带火星的木条复燃的气体 2KMnO 4−→−∆K 2MnO 4+MnO 2+O 2↑ 现象:同上与氢有关的化学方程式: 2H 2+O 2−−−→点燃2H 2O 现象:淡蓝色的火焰 Zn+H 2SO 4→ZnSO 4+H 2↑ 现象:有可燃烧的气体生成Mg+H 2SO 4→MgSO 4+H 2↑ 现象:同上Fe+H 2SO 4 →FeSO 4+H 2↑ 现象:变成浅绿色的溶液,同时放出气体 2Al+3H 2SO 4 →Al 2(SO 4)3+3H 2↑ 现象:有气体生成Zn+2HCl →ZnCl 2+H 2↑ 现象:同上Mg+2HCl →MgCl 2+H 2↑ 现象:同上Fe+2HCl →FeCl 2+H 2↑ `现象:溶液变成浅绿色,同时放出气体 2Al+6HCl →2AlCl 3+3H 2↑ 现象:有气体生成H 2+CuO −→−∆Cu+H 2O 现象:由黑色的固体变成红色的,同时有水珠生成 2Fe 2O 3+3H 2 −−→−高温2Fe+3H 2O 现象:有水珠生成,固体颜色由红色变成银白色跟碳有关的化学方程式:C+CO 2−−→−高温O 2(氧气充足的情况下) 现象:生成能让纯净的石灰水变浑浊的气体 2C+O 2−−→−高温2CO(氧气不充足的情况下) 现象:不明显C+2CuO −−→−高温2Cu+CO 2↑ 现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑浊的气体生成 3C+2Fe 2O 3−−→−高温4Fe+3CO 2↑ 现象:固体由红色逐渐变成银白色,同时黑色的固体减少,有能使纯净的石灰水变浑浊的气体生成 CO 2+C −−→−高温2CO 现象:黑色固体逐渐减少3C+2H 2O −−→−高温CH 4+2CO 现象:生成的混和气体叫水煤气,都是可以燃烧的气体 跟二氧化碳有关的化学方程式:C+O 2−−−→点燃CO 2 现象:生成能使纯净的石灰水变浑浊的气体 Ca(OH)2+CO 2→CaCO 3↓+H 2O 现象:生成白色的沉淀,用于检验二氧化碳 CaCO 3+CO 2+H 2O →Ca(HCO 3)2 现象:白色固体逐渐溶解 Ca(HCO 3) −→−∆CaCO 3↓+CO 2↑+H 2O 现象:生成白色的沉淀,同时有能使纯净的石灰水变浑浊的气体生成 Cu 2(OH)2CO 3−→−∆2CuO+H 2O+CO 2↑ 现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水变浑浊的气体生成2NaOH+CO 2→Na 2CO 3+H 2O (也可为KOH ) 现象:不明显CaCO 3−−→−高温CaO+CO 2↑ 现象:有能使纯净石灰水变浑浊的气体生成跟一氧化碳有关的,但同时也跟二氧化碳有关:Fe 2O 3+3CO −−→−高温2Fe+3CO 2 现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成 CuO+CO −→−∆Cu+CO 2 现象:固体由黑色变成红色,同时有能使纯净石灰水变浑浊的气体生成跟盐酸有关的化学方程式:NaOH(也可为KOH)+HCl →NaCl+H 2O 现象:不明显HCl+AgNO 3→AgCl ↓+HNO 3 现象:有白色沉淀生成,这个反应用于检验氯离子 CaCO 3+2HCl →CaCl 2+H 2O+CO 2↑ 现象:百色固体溶解,生成能使纯净石灰水变浑浊的气体 Na 2CO 3+2HCl →2NaCl+H 2O+CO 2↑ 现象:生成能使纯净石灰水变浑浊的气体 NaHCO 3+HCl →NaCl+H 2O+CO 2↑ 现象:生成能使纯净石灰水变浑浊的气体 Fe 2O 3+6HCl →2FeCl 3+3H 2O 现象:红色固体逐渐溶解,形成黄色的溶液 Fe(OH)3+3HCl →FeCl 3+3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液 Cu(OH)2+2HCl →CuCl 2+2H 2O 现象:蓝色沉淀溶解,形成黄绿色的溶液 CuO+2HCl →CuCl 2+H 2O 现象:黑色固体溶解,生成黄绿色的溶液 Zn+2HCl →ZnCl 2+H 2↑ 现象:同上Mg+2HCl →MgCl 2+H 2↑ 现象:同上Fe+2HCl →FeCl 2+H 2↑ 现象:溶液变成浅绿色,同时放出气体 2Al+6HCl →2AlCl 3+3H 2↑ 现象:有气体生成以上四个反应,盐酸、硫酸都相似,硝酸一般具有氧化性,所以产物一般不为H 2跟硫酸有关的化学方程式:Fe 2O 3+3H 2SO 4→Fe 2(SO 4)3+3H 2O 现象:红色固体溶解,生成黄色溶液 CuO+H 2SO 4→CuSO 4+H 2O 现象:黑色固体溶解,生成蓝色溶液Cu(OH)2+H 2SO 4→CuSO 4+2H 2O 现象:蓝色沉淀溶解,生成蓝色溶液 H 2SO 4+BaCl 2→BaSO 4↓+2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子 CaCO 3+H 2SO 4→CaSO 4+H 2O+CO 2↑Na 2CO 3+H 2SO 4→Na 2SO 4+H 2O+CO 2↑2NaHCO 3+H 2SO 4→Na 2SO 4+2H 2O+2CO 2↑现象:这三个反应现象同与盐酸反应现象一致跟钙盐有关的化学方程式:CaCl2+Na2CO3→CaCO3↓+2NaCl 现象:生成白色沉淀CaCO3+CO2+H2O→Ca(HCO3)2 现象:固体逐渐溶解Ca(HCO3)2+Ca(OH)2→2CaCO3↓+2H2O 现象:生成白色沉淀跟几种金属及其盐有关的化学方程式:铜:−∆Cu+CO2 现象:固体由黑色逐渐变成红色,同时有能使纯净的石灰CuO+CO−→水变浑浊的气体生成−∆Cu+H2O 现象:固体由黑色逐渐变成红色,同时有水珠生成H2+CuO−→Cu+2AgNO3→Cu (NO3)2+2Ag 现象:铜表面慢慢生成了银白色金属CuCl2+2NaOH→Cu (OH) 2↓+2NaCl 现象:生成了蓝色絮状沉淀CuO+H2SO4→CuSO4+H2O 现象:黑色固体溶解,生成蓝色溶液Cu (OH) 2+H2SO4→CuSO4+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液Fe(Zn)+CuSO4→FeSO4+Cu 现象:有红色金属生成−∆2CuO+H2O+CO2↑现象:固体由绿色逐渐变成黑色,同时有能使纯净石灰水Cu2(OH)2CO3−→变浑浊的气体生成铁:Fe+2HCl→FeCl2+H2 现象:铁粉慢慢减少,同时有气体生成,溶液呈浅绿色FeCl2+2NaOH→Fe(OH)2↓+NaCl 现象:有白色絮状沉淀生成4Fe(OH)2+O2+2H2O→4Fe(OH)3现象:氢氧化铁在空气中放置一段时间后,会变成红棕色Fe (OH) 3+3HCl→FeCl3+3H2O 现象:红棕色絮状沉淀溶解,溶液呈黄色Fe (OH) 2+2HCl→FeCl2+2H2O 现象:白色絮状沉淀溶解,溶液呈浅绿色Fe+CuSO4→FeSO4+Cu 现象:铁溶解生成红色金属Fe+AgNO3→Fe(NO3)2+Ag 现象:铁溶解生成银白色的金属Fe2O3+6HCl→2FeCl3+3H2O 现象:红色固体溶解,生成黄色的溶液Zn+FeCl2→ZnCl2+Fe 现象:锌粉慢慢溶解,生成铁银:AgNO3+HCl→AgCl↓+HNO3 现象:有白色沉淀生成,且不溶于强酸AgNO3+NaCl→AgCl↓+NaNO3现象:有白色沉淀生成,且不溶于强酸Cu+2AgNO3→Cu(NO3)2+2Ag 现象:红色的铜逐渐溶解,同时有银白色的金属生成2AgNO3+Na2SO4→Ag2SO4↓+2NaNO3 现象:有白色沉淀生成。
沪教版九年级化学上册《化学方程式》【创新课件】2

Ⅱ.奇数配偶法(以氯酸钾分解反应为例)
KClO3
MnO2 △
KCl
+
O2↑
2KClO3
MnO2 △
KCl
+
O2↑
2KClO3
M==nO=2
△
2KCl
+
3O2↑
上一页 下一页
2.反应发生的条件 点燃、加热(△)、高温、通电、催化剂等。 反应条件要写在等号的上方。
3.生成物状态 “↑”表示生成气体; “↓”表示生成沉淀。
上一页 下一页
课堂小结
上一页 下一页
上一页 下一页
例:碳酸钙与盐酸反应生成二氧化碳,若需制备二氧
化碳8.8g,至少需要碳酸钙多少克?
解:设需碳酸钙的质量为x。
设
CaCO3+2HCl==CaCl2+H2O+CO2↑
写
100
44
找
x
8.8g
100:44 = x:8.8g x=20g
列
答:至少需要碳酸钙的质量为20g。
答
上一页
下一页
计算时应注意的问题: (1)设未知量时要注意单位统一,多个未知量要用 不同的字母表示; (2)化学方程式书写要正确且必须要配平; (3)相对分子质量一定要计算准确,且要乘化学式 前面的系数; (4)一定要带入纯物质的质量(体积换算为质量); (5)解题步骤规范,过程完整;
化 学 方
质的方面
表示反应物、生 成物和反应条件
程
式 的
微观上表明反应物和生
意
成物之间的微粒个数比
义
量的方面
宏观上表明反应物和
生成物之间的质量比
上一页
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一. 化合反应: 由两种或两种以上物质生成另一种物质的反应。
1.碳在空气中燃烧:C + O 2 点 燃 CO 2 2.碳的不完全燃烧:2C + O 2 点 燃 2CO (O 2 不足)
3.镁带燃烧: 2Mg + O 2 点 燃 2MgO
4.硫在空气中燃烧:S + O 2 点 燃 SO 2
5.磷在空气中燃烧:4P + 5O 2 点 燃 2P 2O 5
6.氢气在空气中燃烧:2H 2 + O 2 点 燃 2H 2O
7.铁丝在氧气中燃烧:3Fe + 2O 2 点 燃 Fe 3O 4
8.铝片在空气中表面氧化:4Al + 3O 2 ==2Al 2O 3
9、铜丝在火上灼烧:2Cu + O 2 △ 2CuO
10、二氧化碳使紫色石蕊试液变红: CO 2 + H 2O == H 2CO 3
11、生石灰投入水里:CaO + H 2O == Ca(OH)2
13、点燃一氧化碳(煤气点燃):2CO + O 2点 燃 2CO 2
14、高温下碳与二氧化碳反应:CO 2 + C 高 温 2CO
15、酸雨的形成:
(1)S + O 2 点 燃 SO 2 2SO 2+ O 2
2SO 3 SO 3 + H 2O == H 2SO 4
(2) S + O 2 点 燃 SO 2 SO 2+ H 2O == H 2SO 3 2H 2SO 3+ O 2== 2H 2SO 4
16、二氧化硫在空气中,在尘埃的作用下与氧气和水反应生成硫酸 2SO 2+2 H 2O+ O 2
2H 2SO 4 二. 分解反应:由一种物质反应生成两种或两种以上物质的反应。
1.高锰酸钾受热分解: 2KMnO 4 △ K 2MnO 4 + MnO 2 + O 2↑
2.双氧水加入二氧化锰: 2H 2O 2 MnO 2 2H 2O + O 2↑
3.氯酸钾和二氧化锰混合制氧气:
2KClO 3 2KCl +3O 2↑
4.电解水: 2H 2O 通 电 2H 2↑ + O 2↑
5.高温煅烧石灰石: CaCO 3高 温 CaO + CO 2↑
6.碳酸不稳定(易分解): H 2CO 3 △ H 2O + CO 2↑
7.加热碳酸氢铵: NH 4HCO 3 △ NH 3↑ + H 2O + CO 2↑
8.加热碱式碳酸铜:Cu 2(OH)2CO 3 △ 2CuO + H 2O +CO 2↑
9.小苏打加热 2NaHCO 3 △Na 2CO 3+H 2O+CO 2↑
三、置换反应:由一种单质和一种化合物反应生成另一种单质和另一
种化合物的反应。
1.
湿法炼铜(曾青得铁化为铜): Fe + CuSO 4 == FeSO 4 + Cu 2.
锌与硫酸铜溶液反应Zn + CuSO 4 == ZnSO 4 + Cu 3.
铜与硝酸银溶液反应Cu+ 2AgNO 3 == 2Ag + Cu(NO 3)2 4.
实验室制取氢气: Zn + H 2SO 4 == ZnSO 4 + H 2↑ 5. 铁与稀硫酸反应: Fe + H 2SO 4 == FeSO 4 + H 2↑
尘埃 尘埃
6.
铝与稀硫酸反应: 2Al + 3H 2SO 4 == Al ..2.(SO ...4.).
3. +3H 2↑ 7. 镁与稀硫酸反应: Mg + H 2SO 4 == MgSO 4 + H 2↑
8. 铁与稀盐酸反应: Fe + 2HCl == FeCl 2 + H 2↑
9. 铝与稀盐酸反应:2Al + 6HCl == 2AlCl 3 + 3H 2↑
10. 锌与稀盐酸反应: Zn+ 2HCl == ZnCl 2 + H 2↑
11.
镁与稀盐酸反应: Mg+ 2HCl == MgCl 2 + H 2↑ 12. 氢气还原氧化铜:CuO + H 2 高温Cu + H 2O
13 碳还原氧化铁: Fe 2O 3 + 3C 高温 2Fe + 3CO 2↑
四.复分解反应:两种化合物相互交换成分生成两种新的化合物的反应。
1、稀盐酸除铁锈:Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O
2、稀硫酸除铁锈:Fe 2O 3 + 3H 2SO 4 == Fe ..2.(SO ...4.).
3. + 3H 2O 3、稀盐酸与氧化铜反应:Fe 2O 3 + 6HCl == 2FeCl 3 + 3H 2O
4、实验室制取二氧化碳:CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑
5、碳酸钠和稀盐酸:Na 2CO 3+ 2HCl = 2NaCl +H 2O+CO 2↑
6、草木灰与稀盐酸反应:K 2CO 3+2HCl =2KCl +H 2O+CO 2↑
7、碳酸氢钠和稀盐酸: NaHCO 3+ HCl = NaCl +H 2O+CO 2↑
8、氢氧化钠与稀盐酸反应:NaOH + HCl == NaCl + H 2O
9、氢氧化钠与稀盐酸反应:2NaOH + H 2SO 4 == Na 2SO 4+2H 2O 8—12为中和 10、氢氧化铝中和胃酸:Al (OH)3 +3HCl == AlCl 3 +3H 2O
11、熟石灰和盐酸反应:Ca(OH )2+ 2HCl == CaCl 2 +2H 2O
12、氨水中和硫酸废水:2NH 3·H 2O + H 2SO 4 = (NH 4)2SO 4+2H 2O
13、配制农药波尔多液:Ca(OH )2+ CuSO 4 == Cu(OH)2↓+ CaSO 4
14、氢氧化钠和氯化铁反应:3NaOH + FeCl 3 == Fe (OH)3↓+3NaCl
14、工业上用纯碱制烧碱:Ca(OH)2 + Na 2CO 3 == CaCO 3↓+ 2NaOH
15、硫酸铵和火碱溶液反应:2NaOH+ (NH 4)2SO 4= Na 2SO 4+2H 2O+2NH 3↑
16、硝酸铵与氢氧化钠加热产生氨气:NaOH + NH 4NO 3 △ NH 3↑+ H 2O + NaNO 3
17、氯化铵与熟石灰加热产生氨气:Ca(OH )2+ 2NH 4Cl △ 2NH 3↑+ 2H 2O + CaCl 2
18、氯化钙和纯碱溶液反应:CaCl 2 + Na 2CO 3 == CaCO 3↓+ 2NaCl
19、氯化钡和纯碱溶液反应:BaCl 2 + Na 2CO 3 == BaCO 3↓+ 2NaCl
五.其他反应
1.
炼铁(赤铁矿)反应:Fe 2O 3 + 3CO 高温 2Fe + 3CO 2 2.
炼铁(赤磁铁矿)反应:Fe 3O 4 + 4CO 高温 3Fe + 4CO 2 3.
一氧化碳还原氧化铜:CuO + CO 高温Cu + CO 2 4.
天然气燃烧:CH 4 + 2O 点燃 CO 2 + 2H 2O 5.
酒精燃烧:C 2H 6O + 3O 点燃 2CO 2 + 3H 2O 6.
将二氧化碳通入石灰水里:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O 7.
用氢氧化钠溶液吸收CO 2: CO 2 + 2NaOH == Na 2CO 3+ H 2O 8.
工业上用石灰浆吸收二氧化硫:SO 2 + Ca(OH)2 == CaSO 3↓+ H 2O 9. 工业上用氢氧化钠溶液吸收SO 2: SO 2 + 2NaOH == Na 2SO 3+ H 2O
10. 绿色植物的光合作用: 6CO 2+6H 2O −−−→光照叶绿素
C 6H 12O 6+6O 2 11. 呼吸作用:C 6H 12O 6+6O 2−−
→酶6CO 2+6H 2O。
