人教版高二化学选修四第四章检测题
新课标人教版高中化学选修4第四章测试题
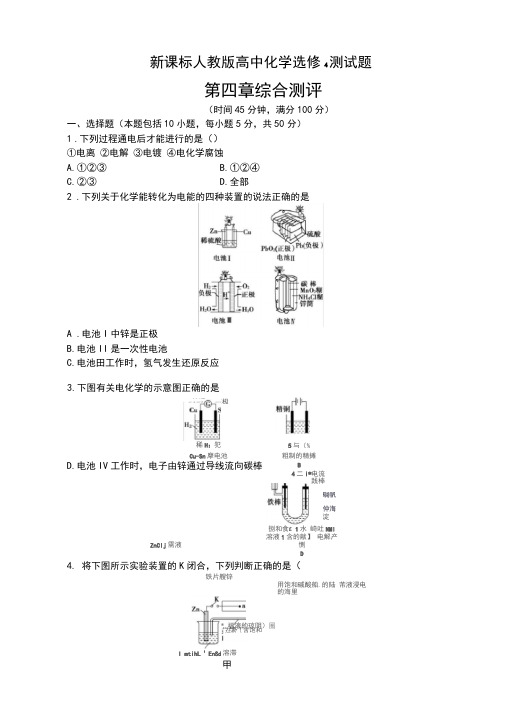
新课标人教版高中化学选修4测试题第四章综合测评(时间45分钟,满分100分)一、选择题(本题包括10小题,每小题5分,共50分)1 .下列过程通电后才能进行的是()①电离 ②电解 ③电镀 ④电化学腐蚀A.①②③B.①②④C.②③D.全部2 .下列关于化学能转化为电能的四种装置的说法正确的是A .电池I 中锌是正极B.电池II 是一次性电池C.电池田工作时,氢气发生还原反应D.电池IV 工作时,电子由锌通过导线流向碳棒ZnClj 需液铁片艘锌用饱和碱酸船.的陆 芾液浸电的海里I mtihL 1 EnSd 溶滞®福液的琼阴)圈 拄新{含饱和3.下图有关电化学的示意图正确的是蛇援 正极4. 将下图所示实验装置的K 闭合,下列判断正确的是(稀H :犯Cu-Sn 摩电池 5与(% 碉帆仲海淀粗制的精摊B捌和食£1水 崎吐NMI溶液1含的献】 电解产恻D 4二i*电流 践棒A . Cu电极上发生还原反应B.电子沿Zn一a一b一Cu路径流动C.片刻后甲池中c(so4一)增大D.片刻后可观察到滤纸b点变红色5.铁锲蓄电池放电时的总反应式为Fe+ Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2,下列有关该电池的说法正确的是()A.电池的负极为Ni2O3,正极为FeB.电池的电解液可能是碱性溶液,也可能是酸性溶液C.电池放电时,正极反应式为Ni2O3+3H2O + 2e ===2Ni(OH)2+2OHD.电池充电时,阳极附近溶液的pH升高6.X、Y、Z、W四块金属板分别用导线两两相连浸入稀硫酸中构成原电池。
X、Y相连时,X 为负极;Z、W相连时,外电路电流方向是W-Z; X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。
据此判断四种金属的活动性顺序是()A. X>Z>W>YB. Z>X>Y>WC. X>Y>Z>WD. Y>W>Z>X7.下列与金属腐蚀有关的说法,正确的是()舞触化的3%WCI溶淞图1 图2 图3A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重8.图2中,发生吸氧腐蚀C.图3中,燃烧灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁相当于原电池的正极8.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。
人教版高中化学选修四单元测试题及答案全套.doc

最新人教版高中化学选修四单元测试题及答案全套第一章过关检测(时间:45分钟满分:100分)一、选择题(本题共8小题,每小题7分,共56分。
每小题只有一个选项符合题意)1•能源是当今社会发展的三大支柱Z—,有专家指出:如果对燃料燃烧产物如CO?、H20. N2等利用太阳能让它们重新组合,使之能够实现下图所示循环,那么不仅可以消除燃烧产物对大气的汚染,还可以节约燃料,缓解能源危机。
在此构想的物质循坏中太阳能最终转化为()CH4、NH)、CHjOH 兄0、CO2、N2太阳能A.化学能B.热能C.生物质能D.电能解析:从题图中可看岀:太阳能一>化学能一>热能。
答案:B2.下列与化学反应中能量变化相关的叙述正确的是()A.生成物总能量一定低于反应物总能量B.放热反应的反应速率总是大于吸热反应的反应速率C.根据盖斯定律,可计算某些难以直接测量的反应焰变D.同温同压下,H2(g)+Cl2(g)^2HCl(g)在光照和点燃条件的不同解析:生成物的总能量低于反应物的总能量的反应,是放热反应,若相反则是吸热反应,故A项错;反应速率与反应是吸热还是放热没有必然的联系,故B项错;C项是盖斯定律的重要应用,正确;根据△//=生成物的恰■反应物的焙,可知,焙变与反应条件无关,故D项错。
答案:C3.下列关于反应能量的说法正确的是()A.Zn(s)+CuSO4(aq)==ZnSO4(aq)+Cu(s) A//=-216 kJ-mof1,则反应物总能量〉生成物总能量B.相同条件下,如果1 mol氢原子所具有的能量为&,1 mol氢分子所具有的能量为则2£,=£2C」01 kPa 时,2H2(g)+O2(g) ----- 2H2O(1) A//=-571.6 kJ-mof1,则H2的燃烧热为571.6 kJ mol"D.氧化还原反应一定是放热反应解析:A项正确,因为该反应为放热反应;B项错误,因为分子变成原子要破坏化学键,吸收能量,2&>E2;C项错高温误,出的燃烧热是1 mol氢气充分燃烧,生成液态水时放出的热量;D项错误,如C+CO2==2CO,此反应是氧化还原反应,但是属于吸热反应。
高二化学选修4第四章 单元测试试题及答案

高二化学选修4第四章单元测试试题及答案第四章单元测试姓名班别学号成绩一、选择题(共18小题,每小题3分,共54分,每小题只有一个选项符合题意)1. 下列各变化中属于原电池反应的是( )A(在空气中金属铝表面迅速氧化形成保护层B(镀锌铁表面有划损时,也能阻止铁被氧化C(红热的铁丝与冷水接触,表面形成蓝黑色保护层D(浓硝酸比稀硝酸更能氧化金属铜-12. 铁棒与石墨棒用导线连接后浸入0.01mol•L的食盐溶液中,可能出现的现象是( )-A. 铁棒附近产生OH B. 铁棒逐渐被腐蚀C. 石墨棒上放出ClD. 石墨棒上放出O 223. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( ) ((- -A(电解饱和食盐水时,阳极的电极反应式为:2Cl,2e==Cl ? 2- -B(氢氧燃料电池的负极反应式:O+ 2HO+ 4e== 4OH 2 2C(粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu- 2+,2e== Cu- 2+D(钢铁发生电化学腐蚀的正极反应式:Fe,2e== Fe4. 用惰性电极电解100mL饱和食盐水,一段时间后,在阴极得到112mL H(标准状况),此时电解质溶液(体积变化忽略不计)的21pH为 ( )A. 13B. 12C. 8D.15. 用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH+2KOH+2O==KCO+3HO,下列说法错误的是( ) 42232A. 通甲烷的一极为负极,通氧气的一极为正极B. 放电时通入氧气的一极附近溶液的pH升高C. 放电一段时间后,KOH的物质的量不发生变化--2-D. 通甲烷的电极反应式是:CH+10OH,8e==CO+7HO 2436. 用两支惰性电极插入500mL AgNO溶液中,通电电解。
当电解3液的pH从6.0变为3.0时(电解时阴极没有氢气放出,且电解液在前后体积变化可以忽略),电极上析出的质量大约是( )A. 27mgB. 54 mgC. 108 mgD. 216mg7. 下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( ) (((A(该能量转化系统中的水也是可能循环的B(燃料电池系统产生的能量实际上来自于水-- C(水电解系统中的阳极反应:4OH2HO+O?+4e 222- -D(燃料电池放电时的负极反应:H+2OH2HO+2e 228. 对外加电流的保护中,下列叙述正确的是( )A. 被保护的金属与电源的正极相连B. 被保护的金属与电源的负极相连C. 在被保护的金属表面上发生氧化反应D. 被保护的金属表面上不发生氧化反应,也不发生还原反应9. 如下图所示,下列叙述正确的是( )A. Y为阴极,发生还原反应B. X为正极,发生氧化反应C. Y与滤纸接触处有氧气生成D. X为滤纸接触处变红10. 下面有关电化学的图示,完全正确的是( )11. 将等物质的量的KSO、NaCl、Ba(NO)、AgNO混合均匀后,24323置于指定容器中,加入足量的水,搅拌、静置、过滤。
人教版选修四第四章、电化学基础 期末基础知识复习及训练(含答案)

人教版高二化学必修四第四章、电化学基础期末基础知识复习及训练(含答案)基础知识点整理一、原电池基本概念理解。
1、原电池的概念:把化学能直接转化为电能的装置叫做原电池。
2、化学电池的分类:常见的原电池可以分为三类:(1)一次电池:常见一次电池:碱性锌锰电池、锌银电池、锂电池等;(2)二次电池:放电后可以再充电使活性物质获得再生,可以多次重复使用,又叫充电电池或蓄电池;(3)燃料电池:是使燃料与氧化剂反应直接产生电流的一种原电池。
3、原电池的电极反应:以锌铜原电池为例:负极:氧化反应:Zn-2e=Zn2+(较活泼金属)正极:还原反应:2H++2e=H2↑(较不活泼金属)总反应式:Zn+2H+=Zn2++H2↑4、常见原电池的电极反应总结。
⑴干电池(属于一次电池)①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+正极:2NH4++2e-=2NH3+H2NH3和H2被Zn2+、MnO2吸收:MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。
②A.放电反应负极: Pb-2e-+ SO42- = PbSO4正极: PbO2 +2e-+4H+ + SO42- = PbSO4 + 2H2OB.充电反应:阴极:PbSO4 +2e-= Pb+ SO42-阳极:PbSO4 -2e- + 2H2O = PbO2 +4H+ + SO42-===总反应式:Pb + PbO 2 + 2H2SO4放电充电2PbSO4 + 2H2O5、典型例题分析。
例题1、原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。
下列说法中正确的是( )A.(1)(2)中Mg作负极,(3)(4)中Fe作负极B.(2)中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.(3)中Fe作负极,电极反应式为Fe-2e-===Fe2+D.(4)中Cu作正极,电极反应式为2H++2e-===H2↑答案:B解析:(1)中Mg作负极;(2)中Al作负极;(3)中铜作负极;(4)是铁的吸氧腐蚀,Fe作负极。
2015-2016学年高二人教版化学选修四练习:4章测评A、B Word版含答案

第四章测评A(基础过关卷)(时间:45分钟满分:100分)第Ⅰ卷(选择题共48分)一、选择题(本题包括12小题,每小题4分,共48分。
每小题只有一个选项符合题意)1.下列事实不能用电化学原理解释的是()A.铝片不用特殊方法保护B.轮船水线下的船体上装一定数量的锌块C.纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大D.镀锌铁比较耐用解析:铝能与空气中的O2化合生成致密的氧化膜,保护铝不受腐蚀;B项是牺牲阳极的阴极保护法;C项锌与置换出的铜构成原电池,加快反应速率;镀锌铁一旦破损,锌比铁活泼,仍能起保护作用,比较耐用。
答案:A2.下列叙述正确的是()A.电解饱和食盐水制烧碱时,Fe作阳极,石墨作阴极B.电解氯化铜溶液时,阳极上产生的气体质量和阴极上析出的铜的质量相等C.钢铁在空气中发生电化学腐蚀时,铁作负极D.原电池工作时,阳离子移向电池的负极解析:电解饱和食盐水制烧碱时,阳极必须是惰性电极,A错误;电解氯化铜时,实质是电解氯化铜本身,阳极上产生的气体质量和阴极上析出的铜的质量不相等,B错误;钢铁在空气中发生电化学腐蚀,不论是析氢腐蚀还是吸氧腐蚀,均是铁作负极,C正确;原电池工作时,阳离子移向电池的正极,D错误。
答案:C3.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-Li2S+Fe,有关该电池的下列说法中,正确的是()A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价B.该电池的电池反应式为2Li+FeS Li2S+FeC.负极的电极反应式为Al-3e-Al3+D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-2Li++FeS解析:在该电池中Li是负极材料,材料中Li为0价,负极反应式为2Li-2e-2Li+,结合题给正极反应式可得出电池反应为2Li+FeS Li2S+Fe,选项A、C不正确,选项B正确;充电时阴极发生得电子的还原反应,选项D不正确。
人教版选修四化学单元测试题(四)及答案.doc

高二化学单元测试题(四)姓名:班级:座号:成绩:本试卷分第一部分(选择题)和第二部分(非选择题),满分100 分,考试时间45 分钟。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cu 64 Cl 35.5第一部分选择题(共42 分)一、选择题(每小题只有 1 个选项符合题意,每小题 4 分,共 24 分。
)....1.下列关于强弱电解质的叙述错误的是( )A .弱电解质在溶液中部分电离,存在电离平衡B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同D.纯净的强电解质在液态时,有的导电,有的不导电2.下列叙述正确的是( )A .无论是纯水,还是酸性、碱性或中性的稀溶液,在常温下,其+) ·c(OH-- 14 c(H )= 1× 10+- 7mol/L 的溶液一定是中性溶液B.c(H )等于 1× 10+3COOH溶液中的c(H +C.0.2 mol/L CH 3COOH 溶液中的 c(H )是 0.1 mol/L CH )的 2倍D.任何浓度的溶液都可以用pH 来表示其酸性的强弱3.水的电离过程为H2 ++OH-,在不同温度下其平衡常数为K W (25℃ )=1.0×-14 , K(35℃ )=2.1×10 - 14( )10 。
下列叙述正确的是+A . c(H )随着温度的升高而降低+-)B.35℃时纯水中 c(H )> c(OHC.向水中加入 NaHSO4溶液会抑制水的电离D.向水中加入 NaHCO 3溶液会抑制水的电离4.用标准的 KOH 溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( ) A .配制标准溶液的固体KOH 中混有 NaOH 杂质B.滴定终点读数时,仰视滴定管的刻度,其他操作正确C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液5.下列离子方程式属于盐的水解,且书写正确的是( )A . NaHCO 3溶液: HCO 3-+H2O CO32-+ H3O+B.NaHS 溶液: HS-+ H 2O H 2S+OH-C.Na 2CO3溶液: CO3 2-+ 2H2O-H 2CO3+ 2OHD. NH 4Cl 溶于 D2O 中: NH 4++ D2O+NH 3·D 2O+H6.牙齿表面由一层硬的成分为Ca5(PO4)3OH 的物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3OH(s)2+ 4 3- -Ca5 (PO4)3 F(s)的溶解度比5Ca (aq)+ 3PO (aq)+ OH (aq) ,已知Ca5(PO4)3OH 更小,为了保护牙齿,世界各地均采用了不同的措施。
人教版高中化学选修4练习:第四章检测题 pdf版含答案

Cu--2e-===Cu2+ D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+ 答案:B 3.关于下图所示的原电池,下列说法正确的是( )
A.电子从锌电极通过电流表流向铜电极 B.盐桥中的阴离子向 CuSO4 溶液中迁移 C.锌电极发生还原反应,铜电极发生氧化反应 D.铜电极上发生的电极反应是 2H++e-===H2↑ 答案:A 4.如图实验为研究金属腐蚀的实验,下列相关说法正确的是( )
第四章检测题
(时间:90 分钟 满分:100 分) 一、选择题(本题包括 15 个小题,每小题 3 分,共 45 分。每小 题仅有一个选项符合题意) 1.下列关于化学能转化为电能的四种装置的说法正确的是( )
A.电池Ⅰ中锌是正极 B.电池Ⅱ是一次性电池 C.电池Ⅲ工作时,氢气发生还原反应 D.电池Ⅳ工作时,电子由锌通过导线流向碳棒 答案:D 2.化学用语是学习化学的重要工具,下列用来表示物质变化的 化学用语中,正确的是( ) A.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH- B.电解饱和食盐水时,阳极的电极反应式为: 2Cl--2e-===Cl2↑ C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:
A.食盐水中有气泡逸出 B.铁表面的反应为 Fe-3e-===Fe3+ C.红色首先在食盐水滴的中心出现 D.该实验研究的是金属的吸氧腐蚀 答案:D 5.如图所示,a、b、c、d 均为石墨电极,通电进行电解。下 列说法正确的是( )
A.乙池中 d 的电极反应为:2Cl--2e-===Cl2↑
B.a、c 两极产生气体的物质的量相等
C.甲、乙两池中溶液的 pH 均保持不变
D.乙池中发生的反应为:
电解
=====
2NaCl+2H2O
高二化学选修4化学反应原理第四章电化学练习题

第四章电化学基础练习题1.Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,电解总反应:2Cu+H2O==Cu2O+H2O↑。
下列说法正确的是:()A.石墨电极上产生氢气B.铜电极发生还原反应C.铜电极接直流电源的负极D.当有0.1mol电子转移时,有0.1molCu2O生成。
2.下列叙述不正确的是()A.铁表面镀锌,铁作阳极B.船底镶嵌锌块,锌作负极,以防船体被腐蚀C.钢铁吸氧腐蚀的正极反应:O2 +2H2O+4e-=4OH—D.工业上电解饱和食盐水的阳极反应:2Cl一一2e一=C12↑3.限制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如右图所示的原电池。
下列推断不正确...的是()A.反应起先时,乙中石墨电极上发生氧化反应B.反应起先时,甲中石墨电极上Fe3+被还原C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极4.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为点解液,铝合金为负极,空气电极为正极。
下列说法正确的是()A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变D.电池工作时,电子通过外电路从正极流向负极5.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是()A.反应①、②中电子转移数目相等B.反应①中氧化剂是氧气和水C.与铜质水龙头连接处的钢质水管不易发生腐蚀D.钢铁在潮湿的空气中不能发生电化学腐蚀()6.化学在生产和日常生活中有着重要的应用。
人教版高中化学选修四单元测试题全套带答案解析1.doc

最新人教版高中化学选修四单元测试题全套带答案解析1第一章测评B(高考体验卷)(吋间:45分钟满分:100分)一、选择题(每小题5分,共60分)1.(XXXX海南化学)标准状态下,气态分子断开1 mol化学键的熔变称为键焰。
己知11一1【、11-0和0=0键的键焙分别为436 kj・mol \ 463 kJ ・nio「和495 kJ • mol ^下列热化学方程式正确的是( )A.出0 (g) =H2 (g) +O2 (g) A 洋—485 kJ ・ mo f1B.H.2O (g):=H>(g) +02 (g) A 川+485 kJ ・ mol-1C.2氏(g) +02 (g);=211,0 (g) A /A+485 kJ ・D.2Ib (g) +O2 (g) =2IL0 (g) △ /A-485 kJ ・ mol-1解析:化学反应的焙变等于反应物总键焰与生成物总键焙的差,市此可确定D项正确。
答案:D2.(XXXX 重庆理综)已知:C (s) +比0 (g):= 0 (g) +出(g) △洋白kJ ・ mol'12C (s) +O2 (g) =2C0 (g) A /A-220 kJ ・ mol-'II—H、0=0和0TI键的键能分别为436、496和462 kJ・mo「,则日为( )A.-332B.-118 0. +350 D.+130解析:C(s)+H20(g)=CO(g)+H2(g) △辰kJ- moK'd)2C (s) +O2 (g) =2C0 (g) A /A-220 kJ ・ mol-1 (2)(1)X2- (2)得2H20 (g) =O2 (g) +2出(g)A 洋+ (2卅220) kJ・moL由键能数值计算得2H2O(g) =02(g)+2H2(g)中A 洋4X462 kJ • mo I-1-(496 kJ • mo「+2X436 kJ ・ mol_1) =+480 kJ ・ mol-1,即:2^+220=480,解得沪+130。
人教版高二化学-选修四--第四章章节练习--含答案解析

高二化学 第四章1.下列有关判断正确的是A .由Fe 、Cu 、FeCl 3溶液组成原电池,其负极反应式为:Cu -2e -=Cu 2+B .由Mg 、Al 、NaOH 溶液组成原电池,其负极反应式为:Al -3e -+3OH -=Al(OH)3C .由Al 、Cu 、浓硝酸组成原电池,其负极反应式为:Cu -2e -=Cu 2+D .用原电池和电解池装置都能实现2HCl + Cu CuCl 2 + H 2↑ 反应2.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )A .a 为正极,b 为负极B .生产过程中H +向a 电极区域运动 C .电子从b 极向a 极移动 D .负极反应式为:2224224H O SO e SO H --++-=+3.如图所示装置中,观察到电流计指针偏转;M 棒变粗;N 棒变细,由此判断表中所列M ,N ,P 物质,其中可以成立的是4.下列图示的有关说法正确的是A.装置①中负极反应式为H2+2e一=2H+B.装置①工作时,外电路电子由a电极流向b电极C.若采用装置②精炼铜,则d为粗铜,c为纯铜D.若装置②用惰性电极电解稀H2SO4溶液,则溶液pH升高5.人造地球卫星用到的一种高能电池-银锌电池,它在放电时的电极反应为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。
据此判断,氧化银是:A.负极,被氧化 B.负极,被还原C.正极,被还原D.正极,被氧化7.把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如平面图所示),经过一段时间后,首先观察到溶液变红的区域是A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近8.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,该燃料电池是以甲醇为燃料,氧气为氧化剂,电解质可以是质子交换膜(可传导氢离子),也可以是固体氧化物(可传导氧离子),甲醇和氧气分别在多孔金属电极上发生反应,从而将化学能直接转化为电能。
人教版高中化学选修四单元测试题全套及答案.doc

最新人教版高中化学选修四单元测试题全套及答案§1化学反应与能量单元检测一.选择题:A. 化学反应除了生成新的物质外,还伴随着能量的变化B. 据能暈守恒定律,反应物的总能暈一定等于生成物的总能暈C. 放热的化学反应不需要加热就能发生D. 吸热反应不加热就不会发牛4. 化学反应可视为旧键断裂和新键形成的过程。
共价键的键能是两种原子间形成lmol 共 价键(或其逆过程)时释放(或吸收)的能暈。
已知H-H 键的键能为436kJ/mob CI-CI 键的键能为 243kJ/mol,H-CI 键的键能为431kJ/moL 则 H 2(g)+CI 2(g)=2HCI(g)的反应热(A H )等于5. 下列各项与反应热的大小无关的是C.反应物的性质下列说法错误的是A- 热化学方程式各物质前的化学计量数不表示分子个数只代表物质的量B. 热化学方程式未注明温度和压强时,AH 表示标准状况下的数据C. 同一化学反应化学计量数不同,AH 不同;化学计量数相同而状态不同,AH 不相同D. 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比3. 已知 25°C 、lOlkPa 条件下:4AI(S )+3O 2 (g) == 2AI 2O 3 (s) A H = -2834.9 kJ-moK 1 4AI ⑸+2O 3(g)== 2AI 2O 3(S ) AH = -3119.91 kJ mol 1 由此得出的结论正确的是A. 等质量的02比6能暈低, 由。
2变。
3为吸热反应B. 等质量的。
2比能量低, 由。
2变O3为放热反应C. 。
3比稳定,由。
2变。
3 为吸热反应D. 。
2比。
3稳定,由。
2变。
3为放热反应 A. -183 kJ/mol B. 183 kJ/molC.・862 kJ/molD. 862 kJ/molA.反应物和生成物的状态B.反应物暈的多少D.反应的快慢 1. 下列说法正确的是2.6.已知lOlkPa时的辛烷的燃烧热为5518kJ/mol,强酸与强碱在稀溶液中发牛反应时的中和热为57.3kJ/mol,则下列热化学方程式书写正确的是(1)C8H18 (I) + 25/202 (g) = 8CO2 (g) +9H2O (I);A H = +5518kJ/mol(2)C8H I8 (I) + 25/202 (g) = 8CO2 (g) +9H2O (I);AH =・5518kJ/mol③J (aq) +0H' (aq) = H20 (I); A H = -57.3kJ/mol(4)l/2H2SO4(aq) + NaOH(aq) =l/2Na2SO4(aq) + H2O(I); A H = +57.3kJ/molA.①③B.②③C.②④D.②7.据人民网2002年9月4日报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变- 亠TiO.成激光用于分解海水制氢,其反应可表示为:2H2O^=2H2 ?+O2 T O有下列儿种说法:①水分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。
高中化学:选修4 人教版 第四章测试(100分) word答案版
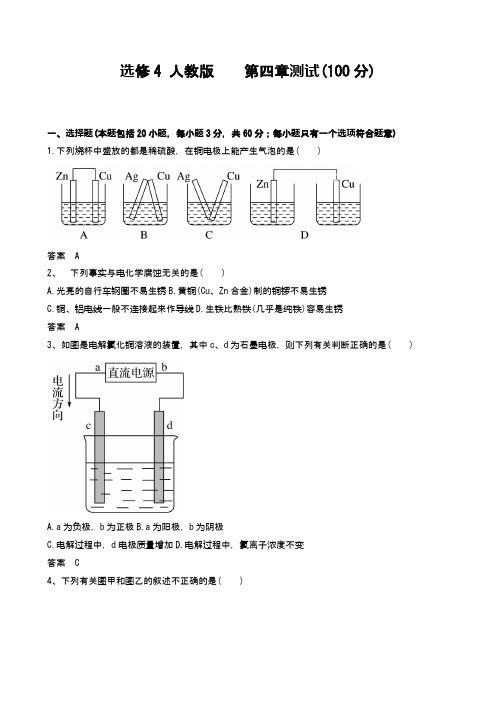
选修4 人教版第四章测试(100分)一、选择题(本题包括20小题,每小题3分,共60分;每小题只有一个选项符合题意)1.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生气泡的是( )答案 A2、下列事实与电化学腐蚀无关的是( )A.光亮的自行车钢圈不易生锈B.黄铜(Cu、Zn合金)制的铜锣不易生锈C.铜、铝电线一般不连接起来作导线D.生铁比熟铁(几乎是纯铁)容易生锈答案 A3、如图是电解氯化铜溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变答案 C4、下列有关图甲和图乙的叙述不正确的是( )A.均发生了化学能转化为电能的过程B.Zn和Cu既是电极材料又是反应物C.工作过程中,电子均由Zn经导线流向CuD.相同条件下,图乙比图甲的能量利用效率高答案 B5、将镁条和铝条平行插入一定浓度的氢氧化钠溶液中,用导线连接形成原电池。
下列有关该装置的叙述正确的是( )A.因镁比铝活泼,故镁是原电池的负极,铝为正极B.铝条表面虽有氧化膜,但可不必处理C.该电池的内、外电路中,电流均由电子定向移动形成D.铝是电池的负极,工作时溶液中会立即有白色沉淀生成答案 B6如图,下列说法不正确的是( )A.在①装置中锌棒逐渐变细,铜棒无变化B.在②装置中锌棒逐渐变细,铜棒逐渐变粗C.在②装置中部分化学能转化成了电能D.在①②装置中锌棒均被氧化答案 B7如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示。
关于该装置的下列说法正确的是( )A.外电路的电流方向X→外电路→YB.若两电极分别为铁和碳棒,则X为碳棒,Y为铁C.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性顺序为X>Y答案 D8、如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。
(完整)化学选修4_第四章测试题

(完整)化学选修4_第四章测试题编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)化学选修4_第四章测试题)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)化学选修4_第四章测试题的全部内容。
化学4第四章测试题一、选择题1.下列关于铜电极的叙述不正确的是( )A.铜锌原电池中铜是正极B.用电解法精炼粗铜时粗铜作阳极C。
在镀件上电镀铜时,用金属铜作阳极 D。
电解稀硫酸制H2、O2时铜作阳极2.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()A.两烧杯中铜片表面均无气泡产生B.甲中铜片是正极,乙中铜片是负极C.两烧杯中溶液的pH均增大 D.产生气泡的速度甲比乙慢3。
碱性电池有容量大、放电电流大的特点,因而应用广泛。
锌锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3。
下列说法错误的是()A.电池工作时,锌失去电子 B。
电池工作时,电子由正极通过外电路流向负极C.电池正极的电极反应式为:2MnO2+H2O+2e-=Mn2O3+2OH—D.外电路中每通过O.2mol电子,锌的质量理论上减小6。
5g4。
关于如图所示装置的叙述,正确的是()A.铜是阳极,铜片上有气泡产生B.铜片质量逐渐减少C.电流从锌片经导线流向铜片D.铜离子在铜片表面被还原5。
把a,b,c,d四块金属片浸入稀硫酸中,用导线两两相连成原电池.若a,b相连时,a为负极;c,d相连时,电流由d到c;a,c相连时,c极上产生大量气泡;b,d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱为:( )A。
高二化学选修4:第4章综合能力测试

第四章综合能力测试(时间90分钟满分100分)试卷说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,请将第Ⅰ卷正确选项填涂在答题卡上,第Ⅱ卷正确答案答在该试题相应答题位置上。
可能用到的相对原子质量:H—1C—12N—14O—16 F—19Na—23Mg—24S—32Cl—35.5K—39Ca—40 Zn—65Ba—137第Ⅰ卷(选择题,共48分)一、选择题(本题包括18小题,每小题只有一个选项符合题意,每小题3分,共48分)1.(2011·湘潭模拟)下列过程需要通电才能进行的是()①电离②电解③电镀④电泳⑤电化学腐蚀A.①②③B.②④⑤C.②③④D.全部【解析】电离是指电解质离解成自由移动的离子的过程,自发进行;电化学腐蚀是指金属因构成原电池而加快失去电子;而电解、电镀、电泳均是在通电条件下进行的。
【答案】 C2.(2011年兖州高二期末)下列各装置中铜电极上能产生气泡的是()【解析】A项,乙醇为非电解质,不构成原电池。
B项,两电极均为铜电极,不构成原电池。
C项为原电池,Cu为正极,2H++2e-===H2↑。
D项,没有自发的氧化还原反应,构不成原电池。
【答案】 C3.将等质量的A、B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A的试管中加入少量CuSO4溶液。
如图表示产生氢气的体积V与时间t的关系,其中正确的是()【解析】向A中滴加CuSO4溶液:Zn+CuSO4===Cu+ZnSO4,置换出的Cu附着在Zn上构成原电池,加快产生H2的速率。
A中的Zn有少量的与CuSO4反应,产生的H2体积较少。
【答案】 D4.如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流表中有电流通过,则下列说法正确的是()A.锌片是负极B.两个铜片上都发生氧化反应C.石墨是阴极D.两个番茄都形成原电池【解析】由于番茄汁显酸性,Zn和Cu的活泼性不同,且Zn能与H+反应,因此左侧为原电池,右侧为电解池。
2020-2021学年高中化学人教版选修4第四单元电化学基础测试卷 (二) 学生版

2020-2021学年高二上学期第四单元测试卷化学(二)注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Cu 64 Ba 137一、选择题(每小题2分,共20分。
每小题只有一个选项符合题意。
)1.铁锅用水清洗放置后出现红褐色的锈斑,在此变化过程中不发生的反应是A.Fe-3e-=Fe3+B.O2+2H2O+4e-=4OH-C.4Fe(OH)2+O2+2H2O=4Fe(OH)3D.2Fe+O2+2H2O=2Fe(OH)22.关于下列装置说法正确的是A.装置②中滴入酚酞,a极附近变红B.装置①中,一段时间后SO2−4浓度增大C.用装置③精炼铜时,c极为粗铜D.装置④中发生吸氧腐蚀3.如图是保护埋在土壤中的铁管的常用方法,下列说法正确的是A.铁管表面的电子通过导线传递到锌块上B.锌块改变了铁管的组成和结构C.锌块作正极,随着电子沿导线的流出而逐渐消耗D.若土壤呈酸性,则H+向铁管移动4.用铂作电极电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是A.CuSO4B.H2SO4C.CuCl2D.NaCl5.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下实验装置部分实验现象a极质量减小,b极质量增大b极有气体产生,c极无变化d极溶解,c极有气体产生电流从a极流向d极由此可判断这四种金属的活动性顺序是A.a>b>d>c B.b>c>d>a C.d>a>b>c D.a>b>c>d6.液体燃料电池相比于气体燃料电池具有体积小等优点。
高二化学选修四第四章《金属的电化学腐蚀与防护》(含答案解析)

合金、金属的腐蚀与防护一、选择题(每题有1-2个选项符合题意)1.下列说法中不正确的是( )A.合金属于纯净物B.合金的硬度大于各成分金属C.合金的熔点低于各成分金属D.目前世界上用途最广的合金是钢2.下列关于镁铝合金的说法正确的是( )A.熔点比镁、铝都高B.熔点比镁、铝都低C.硬度比镁、铝都小D.硬度比镁、铝都大3.下列有关合金性质的说法正确的是( )A.合金与各成分金属相比,具有许多优良的物理、化学或机械的性能B.相同金属元素形成的合金,元素的含量有可能不同,但其性能是相同的C.镁铝合金在盐酸中能完全溶解D.合金具有各成分金属性质之和4.所谓合金必须是( )①通过熔合而成②由两种或两种以上金属或金属与非金属组成③耐腐蚀④耐高温⑤具有金属的特性⑥铸造性能良好A.①②④B.①②③C.①②⑤D.①②⑥5.钢笔的笔头是合金钢,钢笔笔头尖端是用机器轧出的便于使用的圆珠体。
铱金笔的笔头是用不锈钢制成的,为了改变笔头的耐磨性能,故在笔头尖端点上铱金粒,为区别钢笔而叫铱金笔。
金笔的笔头是黄金的合金。
下列说法错误的是( )A.钢笔的笔头不易被氧化,抗腐蚀性能好B.铱金笔的耐磨性能比钢笔要好C.金笔的笔头和笔尖都是用纯金制成的D.金笔经久耐磨,书写时弹性特别好,是一种很理想的硬笔6.用于飞机制造业的重要材料是( )A.Mg—Al合金B.Cu—Sn合金C.Cu—Zn合金D.不锈钢7.钛合金被认为是21世纪的重要材料,有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”,根据它的主要性能,下列用途不切合实际的是( )A.用来做保险丝B.用于制造航天飞机C.用来制造人造骨D.用于制造船舶8.属于新型合金的是( )A.18K金B.不锈钢合金C.储氢合金D.硬铝合金9.以下现象与电化学腐蚀无关的是( )A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比软铁芯(几乎是纯铁)容易生锈C.铁质器件附有铜质配件,在接触处易生铁锈D.银质奖牌久置后表面变暗10.钢铁的锈蚀过程中,下列五种变化可能发生的是( )①Fe由+2价转化为+3价②O2被还原③H+被还原④有Fe2O3·H2O生成⑤杂质碳被氧化除去A.①②B.③④C.①②③④D.①②③④⑤11.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章综合能力检测1.暖宝宝是市场上常见的热敷、止痛、消肿贴剂。
它由原料层、明胶层、无纺布袋层三部分组成,其中原料是由铁、石墨、活性炭、无机盐等合成的聚合物,构成了原电池,其中铁作( ) A.正极B.负极C.阴极D.阳极2.对外加电流的金属保护中,下列叙述正确的是( )A.被保护的金属与电源的正极相连B.被保护的金属与电源的负极相连C.在被保护的金属表面上发生氧化反应D.被保护的金属为阴极,其表面上发生氧化反应3.已知蓄电池在充电时作电解池,放电时作原电池。
铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。
关于标有“+”的接线柱,下列说法中正确的是( ) A.充电时作阳极,放电时作正极B.充电时作阳极,放电时作负极C.充电时作阴极,放电时作负极D.充电时作阴极,放电时作正极4.在电解质溶液中插入M、N电极,并连接直流电源进行电解,可以看到两极上均有气泡产生,电解后测定电解质溶液,其H+浓度无变化。
符合这些条件的是( )A.两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH 溶液B.两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液C.两个电极均为石墨,M是阳极,电解质溶液是0.4%的KOH溶液D.m是铁片,作阴极,N是石墨,电解质溶液是0.4%的KNO3溶液5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )A.电解饱和食盐水,阳极的电极反应式为:2Cl--2e-===Cl2↑B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-C.粗铜精炼时,与电池正极相连的是纯铜,电极反应式为:Cu-2e -===Cu2+D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+6.将a、b、c、d 4种金属两两连接浸入电解质溶液中,组成4个原电池(如图):①中a 极发生氧化反应 ②中电流由b 到c ③中c 极质量增加 ④中a 极有大量气泡,则4种金属的活泼性由强到弱的顺序为( )A .d >a >c >bB .d >c >a >bC .b >d >c >aD .a >d >b >c7.我国第五套人民币的一元硬币材质为铜芯镀银,依据掌握的电镀原理,你认为硬币制作时,铜芯应做( )A .阴极B .阳极C .正极D .负极8.有如下两个反应:①2HCl =====高温H 2+Cl 2 ②2HCl =====电解H 2↑+Cl 2↑关于这两个反应的叙述中错误的是( )A .①②两反应都是氧化还原反应B .①②两反应中的能量转换方式都是热能转变为化学能C .②反应是电能转变为化学能D .①反应是热能转变为化学能9.在钢铁腐蚀过程中,下列五种变化可能发生的是( )①Fe 2+转化为Fe 3+ ②O 2被还原 ③产生 H 2④Fe(OH)3失水形成Fe 2O 3·H 2O ⑤杂质碳被氧化A .①②B .②③④C .①②③④D .①②③④⑤10.有人设计以Pt 和Zn 为电极材料,埋入人体内作为某种心脏病人的心脏起搏的能源。
它依靠人体内含有一定浓度的溶解氧进行工作,下列叙述中错误的是( )A .Pt 是正极B .负极反应:Zn -2e -===Zn 2+C .正极反应:2H ++2e -===H 2↑D .正极反应:2H 2O +O 2+4e-===4OH -11.如下图所示,将两烧杯中电极用导线相连,四个电极分别为Mg 、Al 、Pt 、C 。
当闭合开关S 后,以下表述正确的是( )A.电流表指针不发生偏转B.Al、Pt两极有H2产生C.甲池pH增大,乙池pH减小D.Mg、C两极生成的气体在一定条件下可以恰好完全反应12.用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是( )A.相同状况下两电极上产生的气体体积之比为2:1B.两电极产生的气体质量之比为8:1C.相同状况下两电极上产生的气体体积之比为4:1D.若两电极上产生的气体质量为16:3,则D2O与H2O的物质的量之比为2:113.某学生为完成2HCl+2Ag===2AgCl+H2↑反应设计了如图所示的四个实验,你认为可行的实验的是( )14.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )A.NaOH B.H2SO4C.AgNO3D.Na2SO415.用石墨作电极电解3mol·L-1KCl和0.5mol·L-1Al2(SO4)3的1 L混合溶液时,下图电解变化曲线合理的是( )16.(12分)某校化学兴趣小组同学,利用下列装置探究pH试纸上的微型电解。
(1)如图,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6 V电池连接好电路。
当两根鳄鱼夹夹住回形针后,试纸上立刻出现以下现象:阳极回形针处很快出现大片红棕色;阴极附近迅速呈现大片蓝紫色,对照比色卡发现其pH约为13。
①如图,右端回形针为__________极(填“阴”或“阳”);阴极试纸上出现大片蓝紫色的原因是(用反应式结合文字表示):________________________________________________。
②推测阳极回形针处出现的红棕色物质可能是__________(写化学式)。
(2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现__________色圆点,而在阴极与试纸接触处呈现__________色圆点,说明了电解硫酸钠饱和溶液的实质是:____________________________________________(用方程式表示)。
17.(10分)用铂电极电解氢氧化钠溶液,测定两极逸出气体的1 2 3 4 5 6 7 8时间/min气体体积/mL阴极生成的气体 6 12 20 29 39 49 59阳极生成的气体 2 4 7 11 16 21 26 31(1)完成有关的电极反应式:阴极_________________________ _,阳极______________________。
(2)完成电解池总反应方程式__________________________。
(3)开始电解阶段两极产生气体的体积比不符合理论比值的原因是__________________________。
(4)自第______________分钟起阴极与阳极产生气体的体积比符合理论的比值。
18.(6分)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如图所示:(1)在0→t1时间内,两个电极上的电极反应式为阳极:_________________________________________________ ___________________;阴极:____________________________________________。
(2)用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因:____________________________________________________。
19.(14分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式__________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应________________________,负极反应_______________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:__________________________________________________________ ________________________________________________________。
氢氧化物开始沉淀时的pH 氢氧化物沉淀完全时的pHFe3+ 1.9 3.2Fe2+7.0 9.0Cu2+ 4.7 6.7提供的药品:Cl2浓H2SO4NaOH溶液CuO Cu(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。
请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式________________________、___________ 。
劣质不锈钢腐蚀的实验现象_____________________________。
20.(10分)某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
按照实验步骤依次回答下列问题:(1)导线中电子流向为__________(用a、b表示);(2)写出装置中镀锌电极上的电极反应式:_________________ ___________;(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为__________;(不许用“N A”表示);(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向向表述正确的是__________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右烧杯移动B.盐桥中的K+向右侧烧杯移动、Cl-向左烧杯移动C.盐桥中的K+、Cl-都向左侧烧杯移动D.盐桥中的K+、Cl-几乎不移动(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀,还可能导致电流在较短时间内衰减。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
A.NaOH B.Zn C.Fe D.H2SO4。
