聚酯反应动力学方程
聚酯合成工艺

1聚酯合成工艺聚对苯二甲酸乙二醇酯(PET)是由单体对苯二甲酸乙二酯(BHET)经逐步增长的缩聚反应而成的。
BHET的合成有两种方法对苯二甲酸二甲酯(DMT)和乙二醇(EG)的酯交换法(DMT法),反应式为DMT+EG=BHET+2CH30H对苯二甲酸(TPA)和乙二醇(EG)的直接酯化法(TPA法),反应式为TPA+2EG=BHET+2H20我们研究第二种TPA和EG直接酯化反应,形成含有BHET和少量短链低聚物的预聚体,而副产物水可以经分馏系统排出酯化温度250----265反应压力1.2~1.8x105停留时间180~360MIN聚合度4~6在酯化阶段主要的设备一般是两个酯化反应器。
在PET合成中,要获得足够高的反应速度就必须用到催化剂,但是一些催化剂也会加速副反应的进行。
酯化反应,还有酯基转移反应可以分别用质子或羧基官能团催化。
在酯化反应中,羧基的浓度是足够高的,而不需要再额外添加催化剂。
然而,在一些工业化生产中,其金属催化剂和稳定剂却都是在这一反应阶段加入的。
在缩聚过程中,羧基的浓度因太低而不足以有效地催化反应,因此要加入合适的催化剂是不可避免的,锑系化合物是目前最常用的缩聚催化剂。
酯化和缩聚过程都是可逆平衡反应,通常是在催化剂存在下进行。
因此优选催化剂、有效控制最佳工艺条件、促进平衡向产品方向移动,是工艺过程的关键问题。
从体系状态看,固体TPA在反应条件下只能部分溶于EG,因此反应过程前期为固一液非均相体系。
在酯化过程中,TPA首先通过扩散作用溶解于EG,然后溶解于液相中的TPA与EG进行均相酯化反应。
TPA在EG—BHET中溶解速度随着低聚物的增加而增大,当全部溶解即出现清晰点,这时开始均相反应,一般酯化率在85%左右达到清晰点【6】。
TPA和EG酯化过程中不断脱出水,且TPA溶于预聚体,体系逐渐由非均相向均相转化,由混浊趋向透明,达到清晰点。
在过程由酯化向缩聚过渡中EG和TPA完成酯化反应时其反应所需的摩尔比为2:1,即两个EG分子与一个TPA分子发生酯化反应生成1个分子的BHET。
聚酯合成的酯化与缩聚

➢ 直接酯化为吸热反应,但热效应较小,为4.18KJ/mol,升温反应 速度略有增加。
酯化反应
直接酯化法
酯化反应
酯交换法
3. DMT制备对苯二甲酸双羟乙酯(BHET) ➢(2)酯交换反应配位机理:首先金属催化剂与乙二醇 反应生成醇化物(英文缩写为MOR):
M(OCOCH3)2 + 2HOCH2CH2OH MO(CH2CH2OH)2 + 2CH3COOH
酯化反应
酯交换法
➢(2)然后MOR上的金属提供空轨道和DMT中的羰基氧 的 孤对电子配位结合。反应可按下面两种情况进行:
缩聚反应
缩聚动力学
➢BHET缩聚过程中的化学反应非常复杂,在研究动力学方程时,除 考虑链增长的可逆平衡外,还要同时考虑存在大分子链的热降解反 应和链端降解反应。
➢链增长反应
➢热降解反应
缩聚反应
缩聚动力学
缩聚反应
➢设:
缩聚动力学
则n对时间(t)的依赖关系分为链增长和热降解两部分,而链增长 反应为二级反应,热降解反应为一级反应,总的动力学方程式表达 为:
缩聚过程的副反应
➢ (1)大分子链端基裂解生成乙醛
缩聚反应
缩聚过程的副反应
➢ (2)生成环状低聚物
缩聚反应
缩聚过程的副反应
➢ (3)酯键裂解并产生酯交换作用
缩聚反应
缩聚过程的副反应
➢ (4)生成乙二醇醚
缩聚反应
缩聚工艺对比
连续法
间歇法
聚酯合成工艺

1聚酯合成工艺聚对苯二甲酸乙二醇酯(PET)是由单体对苯二甲酸乙二酯(BHET)经逐步增加缩聚反应而成。
BHET合成有两种方法对苯二甲酸二甲酯(DMT)和乙二醇(EG)酯交换法(DMT法),反应式为DMT+EG=BHET+2CH30H对苯二甲酸(TPA)和乙二醇(EG)直接酯化法(TPA法),反应式为TPA+2EG=BHET+2H20我们研究第二种TPA和EG直接酯化反应, 形成含有BHET和少许短链低聚物预聚体, 而副产物水能够经分馏系统排出酯化温度250----265反应压力1.2~1.8x105停留时间180~360MIN聚合度4~6在酯化阶段关键设备通常是两个酯化反应器。
在PET合成中, 要取得足够高反应速度就必需用到催化剂, 不过部分催化剂也会加速副反应进行。
酯化反应, 还有酯基转移反应能够分别用质子或羧基官能团催化。
在酯化反应中, 羧基浓度是足够高, 而不需要再额外添加催化剂。
然而, 在部分工业化生产中, 其金属催化剂和稳定剂却都是在这一反应阶段加入。
在缩聚过程中, 羧基浓度因太低而不足以有效地催化反应, 所以要加入适宜催化剂是不可避免, 锑系化合物是现在最常见缩聚催化剂。
酯化和缩聚过程都是可逆平衡反应, 通常是在催化剂存在下进行。
所以优选催化剂、有效控制最好工艺条件、促进平衡向产品方向移动, 是工艺过程关键问题。
从体系状态看, 固体TPA在反应条件下只能部分溶于EG, 所以反应过程前期为固一液非均相体系。
在酯化过程中, TPA 首先经过扩散作用溶解于EG, 然后溶解于液相中TPA与EG进行均相酯化反应。
TPA在EG —BHET中溶解速度伴随低聚物增加而增大, 当全部溶解即出现清楚点, 这时开始均相反应, 通常酯化率在85%左右达成清楚点【6】。
TPA和EG酯化过程中不停脱出水, 且TPA溶于预聚体, 体系逐步由非均相向均相转化, 由混浊趋向透明, 达成清楚点。
在过程由酯化向缩EG和TPA完成酯化反应时其反应所需摩尔比为2: 1, 即两个EG分子与一个TPA分子发生酯化反应生成1个分子BHET。
第一讲 聚合方法(3逐步聚合反应)

← ←
三级反应 二级反应
3.1 自催化体系
通式 R=
羧基既是反应官能团 ,又是催化剂 设开始时 C=[COOH]=[OH]
记C0为t=0的羧基或羟基浓度 (C为 t时刻的) 忽略移去水使体积减少:
积分
C=C0(1-P)
讨 论:
1. 数据处理:
a. 以
1 (1 P ) 2 ~t,
X ~t,亦即
kc: 该化学反应速度常数 则:生成物的形成速率:
ka kc d [ P] [ A][ B] dt kb kc
① 扩散速率远大于反应速率,kb
>>
kc
d [ p] k a k c [ A][ B] dt kb
②反应速率远大于扩散速率,kc
>>
kb
d [ p] ka [ A][ B] dt
COOH参加反应的几率 则1-P就是此时刻一个给定的COOH还没参加
反应的几率
聚酰胺化反应的过程
分子式
O
存在的结构 反应了的 单元数 COOH数 1 2 3 4 x 0 1 2 3 x-1
若端基从-NH2 开始,则有(x-1)个反应了的 COOH基和一个未反应的COOH基作尾端基
则: 1 个COOH反应掉的几率: P x-1个COOH连续反应掉的几率: Px-1 1 个COOH未反应掉的几率: 1-P
3. P≥0.80时,积分动力学表达式与实验值符合得很好
3.2 外加酸催化体系
通式
外加强酸催化剂
kcat[H+]>>k3[COOH],k3[COOH]可忽略
[H+]不变, 令k2=kcat [H+] 二级反应,将其积分可得
讨 论:
☆ 聚氨酯改性不饱和聚酯树脂的反应动力学_叶蓓

功 能 高 分 子 学 报Journal of Functional PolymersVol.22No.12009年3月收稿日期:2008210207作者简介:叶蓓(19842),女,安徽安庆人,硕士生,研究方向:聚氨酯改性树脂。
E 2mail :yeye224@ 通讯联系人:倪礼忠,E 2mail :nilizhong @聚氨酯改性不饱和聚酯树脂的反应动力学叶 蓓, 周 权, 宋 宁, 倪礼忠(华东理工大学材料科学与工程学院,上海200237)摘 要: 通过差示扫描量热法(DSC )和傅里叶红外光谱(F T 2IR )分析,探讨了聚氨酯改性不饱和聚酯树脂(U PR )体系反应特征及固化反应动力学。
结果表明:体系中聚氨酯网络的形成远快于U PR 网络的形成。
U PR 和聚氨酯改性U PR 体系的表观活化能分别为58.0kJ /mol 和64.8kJ /mol ,改性后体系的活化能并无较大变化;反应的级数分别为0.90和0.91。
关键词: 聚氨酯;不饱和聚酯;固化反应机理;动力学中图分类号: O63 文献标志码: A 文章编号: 100829357(2009)0120060204Kinetics of the Curing of Polyurethane Modif ied U nsaturatedPolyester R esinYE Bei , ZHOU Quan , SON G Ning , N I Li 2zhong(School of Materials Science and Engineering ,East China U niversity of Science and Technology ,Shanghai 200237,China )Abstract : The curing characteristic and kinetics analysis of polyuret hane modified unsat ura 2ted polyester are st udied by DSC and F T 2IR.The network of polyuret hane is formed much faster t han t hat of unsat ura 2ted polyester.The apparent activation energy of U PR is 58.0kJ /mol ,while t hat of polyuret hane modified U PR is 64.8kJ /mol.There is no significant difference between t he two systems.The reaction order of U PR is 0.90,while t hat of polyuret hane modified U PR is 0.91.K ey w ords : polyuret hane ;unsat urated polyester ;curing reaction mechanism ;kinetics 不饱和聚酯树脂(U PR )具有优良的综合性能,用途十分广泛,是近年来热固性树脂中发展较快的品种之一[1]。
不饱和聚酯树脂的DSC测试与动力学分析
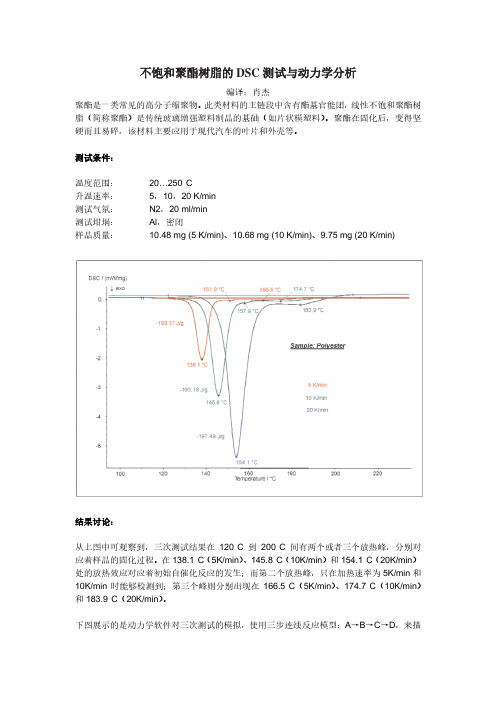
不饱和聚酯树脂的DSC测试与动力学分析
编译:肖杰
聚酯是一类常见的高分子缩聚物。
此类材料的主链段中含有酯基官能团,线性不饱和聚酯树脂(简称聚酯)是传统玻璃增强塑料制品的基础(如片状模塑料)。
聚酯在固化后,变得坚硬而且易碎,该材料主要应用于现代汽车的叶片和外壳等。
测试条件:
温度范围:20…250°C
升温速率:5,10,20 K/min
测试气氛:N2,20 ml/min
测试坩埚:Al,密闭
样品质量: 10.48 mg (5 K/min)、10.68 mg (10 K/min)、9.75 mg (20 K/min)
结果讨论:
从上图中可观察到,三次测试结果在120°C 到200°C间有两个或者三个放热峰,分别对应着样品的固化过程。
在138.1°C(5K/min)、145.8°C(10K/min)和154.1°C(20K/min)处的放热效应对应着初始自催化反应的发生;而第二个放热峰,只在加热速率为5K/min和10K/min时能够检测到;第三个峰则分别出现在166.5°C(5K/min)、174.7°C(10K/min)和183.9°C(20K/min)。
下图展示的是动力学软件对三次测试的模拟,使用三步连续反应模型:A→B→C→D,来描
述固化反应过程。
在对动力学参数进行优化后,动力学软件可以模拟并预测得到在任一温度程序下的固化反应过程。
聚酯酯化反应计算公式

聚酯酯化反应计算公式聚酯酯化反应是一种常见的化学反应,用于合成聚酯材料。
在这篇文章中,我将向您介绍聚酯酯化反应的计算公式及其相关内容。
本文从基础概念出发,并逐渐深入,帮助您更全面、深刻地理解聚酯酯化反应的计算过程。
一、聚酯酯化反应的基本定义聚合物是由单体通过化学键连接而成。
聚酯是一类具有酯键连接的聚合物,其合成过程主要包括酯化反应和缩聚反应。
其中,酯化反应是指通过酯键合并酸和醇单体,生成酯基团的过程。
聚酯酯化反应的计算公式将帮助我们理解反应的过程和计算反应物的用量。
对于酯化反应来说,一般的计算公式为:n1/M1 + n2/M2 = n3/M3其中,n1和n2分别表示酸和醇的物质的量(单位为mol),M1和M2分别表示酸和醇的摩尔质量,n3表示酯的物质的量,M3表示酯的摩尔质量。
二、深入理解聚酯酯化反应计算公式聚酯酯化反应计算公式是根据化学的摩尔比例来推导的。
在反应过程中,酸和醇按照一定的比例进行反应,生成相应的酯。
这个计算公式中的摩尔比例可以帮助我们确定反应过程中的物质的量关系。
其中,n1和M1表示酸的物质的量和摩尔质量,n2和M2表示醇的物质的量和摩尔质量,而n3和M3分别表示生成的酯的物质的量和摩尔质量。
通过这个公式,我们可以计算出所需的反应物的摩尔量。
在具体的实验中,我们可以通过确定某一物质的摩尔量,再通过相应的比例关系计算其他物质的摩尔量。
这样,我们就能够合理地设计实验,确保反应的顺利进行。
三、聚酯酯化反应的应用聚酯材料具有广泛的应用领域,包括纺织、塑料、包装等。
在聚酯的合成过程中,酯化反应是关键的步骤之一。
通过聚酯酯化反应计算公式,我们可以精确地控制反应的条件,确保所需聚酯的产量和质量。
这对于工业生产和研究开发至关重要。
通过计算反应物的摩尔量,我们还可以合理地配置反应物的用量,避免浪费和成本过高。
四、我的观点和理解聚酯酯化反应计算公式是聚酯合成过程中的重要工具,具有指导意义和实用价值。
线型缩聚反应机理与动力学方程

6.4 线型缩聚
⒈ 工业上涤纶树脂的合成 涤纶是聚酯的重要代表,它是重要的合成纤维和工程塑料。 合成涤纶的原料是乙二醇和对苯二甲酸。 当原料纯度很高时,可以用直缩法制备涤纶树脂。 在原料纯度不很高的情况下,很难控制官能团物质的量,需用 酯交换法制备涤纶树脂。 工业上生产涤纶比较成熟的方法是酯交换法。 即先将对-苯二甲酸与甲醇反应生成对-苯二甲酸二甲酯—— 甲酯化 然后将对-苯二甲酸二甲酯与乙二醇反应生成对-苯二甲酸 二乙二醇酯——酯交换 再以对-苯二甲酸二乙二醇酯为单体进行均缩聚,制备聚对苯二甲酸二乙二醇酯(PET)——涤纶树脂。
=
k1 k3 c(COOH)c(OH)c(HA) k2c(A )
(6.32)
- dc(COOH) = k1.k3c(COOH)c(OH)c(H⊕)
dt
k2 .KHA
(6.33a)
式 (6.33a)为强酸(HA)催化的聚酯化反应聚合速率方程。 根据外加酸作催化剂和没有外加酸两种情况 讨论聚酯化反应聚合速率方程式
1 (1- P)2
=
2no2kt +1
(6.36)
X
2 n
=
2n02kt +1
(6.37)
式(6.37)为自催化聚酯化反应平均聚合度方程。 它表明自催化酯化反应聚合物的Xn2与聚合时间t 成正比,表 达了缩聚反应逐步性的特点: 缩聚物平均聚合度随聚合反应的时间的延长而缓慢地增加。 要获得高相对分子质量的产物,需要较长的时间。 自催化聚酯反应动力学一般认为是三级反应。
6.4 线型缩聚
① 自催化聚酯化反应速率方程 没有外加酸而以原料中的羧酸做催化剂
- dc(COOH) = k1.k3c(COOH)c(OH)c(H⊕)
聚酯的热分析与热分解动力学的研究

℃升至 600 ℃,静态空气气氛 。陶瓷坩埚 :70μl 。
3 结果与分析 3. 1 DSC 分析
的物理性质与温度关系的一种技术 。常用的热分析 技术 , 包括热重 ( T G) 、差示扫描量热法 (DSC) 、差 热分析 (D TA) 和热机械分析 ( TMA) , 在热分析中 应用广泛的有 T G 和 DSC , 前者是在程序控制温度 下 , 测量物质的质量与温度关系的一种技术 , 后者 则是在程序控制温度下测量输入到试样和参比物 的能量差与温度 (或时间) 关系的一种技术 。热分析 动力学是用热分析技术研究物质的物理变化和化 学反应 , 借助一定的数学处理方法 , 获得相应的反 应动力学参数和反应机理函数 [1 - 3 ]。通过这种方法 可以为物质的热降解 、热老化等热性能提供有用的 参考数据 , 广泛应用在高分子材料的热稳定性研究 和寿命评估 , 具有理论和工程应用价值 。聚对苯二 甲酸乙二醇酯 (聚酯 , P E T) , 它在较宽的温度范围 内可以保持良好的物理性能 、吸湿性能小 、电绝缘 性能好等优点 ,在生活和工程中应用十分广泛 [4 ]。但 是在高温环境中容易发生降解反应 , 导致材料本身 的绝缘性能下降 。陈玉君等 [5 ]利用热重 - 红外光谱 联用的分析方法研究了 P E T 的高温稳定性 ,王巍 [6 ] 用 DSC 方法研究了 P E T 的热性能 ,B Saha 等 [7 ]在 非等温和等温分解动力学研究中利用非模型动力 学分析 P E T 的动力学参数 , 但对 P E T 比较系统的 热分析和热动力学研究目前比较少 。本文通过对两 种不同厚度的 P E T 试样的 T G 曲线和 DSC 曲线的 研究分析 , 得出两种试样的失重 、热解特性和各个 热转变温度 , 并且通过 Freeman - Carroll 法得到试 样的活化能 , 对于今后的材料制作和工程应用方面 具有参考价值 。
高分子化学第二章

3.3
聚合度与平衡常数的关系
O
COOH
+
HO
C
O
+ H2O
设t=0时 平衡时
N。 N
N。 N
0 (N。—N)
0 Nw
N —— 平衡时未反应的羧基或羟基数 N0–N —— 也是已反应的羟基或羧基的mol数即是平 衡时生成的酯基数; Nw —— 体系中H2O的mol数
K=
_ _ [ OCO ][H2O] _ _ [ COOH][ OH]
_ _ H [ORCO]n OH
该反应事实上包括 n-1 个反应,当然就存在 n-1个平 衡常数。
aRb+aRb aRRb+ab aRRb+ aRb aRRRa+ab aRRRb+ aRb bRRRRb+ab 单体+单体 单体+二聚体 单体+三聚体 二聚体+三聚体 反应速率R1 R2 R3 R4 Rn-1 平衡常数K1 K2 K3 K4 Kn-1
第二章
逐步聚合反应
(stepwise polymerization)
第一节
引言
逐步聚合: 是具有两个或两个以上官能团的低分之化合物 相互反应而逐步生成高分子化合物的反应。
研究意义:
1、大多数杂链聚合物都是靠这类聚合合成的。 如:聚碳酸酯 (聚2,2双[4,4′羟基苯基] 丙烷碳酸酯):
_ n HO CH3 _C _ CH3 O _ _ _ n Cl C Cl OH +
_
_
-H2O
+己二酸
HO [OC(CH2)4CONH(CH2)6NH] H
_
_
_ _ -H2O HO [OC(CH2)4CONH(CH2)6NH] OC(CH2)4COOH
高分子化学习题答案2

教材P634、⑴由外加酸催化聚酯化动力学公式:1/(1+p)=k'c0t +1可得t= p/((1-p)*k'c0)当p=0.98时:t1=0.98/((1-0.98)k'c0)=49/k'c0当p=0.99时:t1=0.99/((1-0.99)k'c0)=99/k'c0所以t2近似等于2t1,所以在p=0--0.98和p=0.98--0.99时间段的时间近似相等。
⑵①、自催化作用下分两种情况:a、羧酸不电离:由-d c/d t=kc3得出1/c2-1/c02 =2kt又因为c=c0(1-p)所以1/(1-p)2=2ktc02+1因为X n1=1/(1-p) 所以X n1=2ktc02+1由1/c2-1/c02 =2kt 得出c2/c02=1/(2ktc02+1)得出[c]/[c0]=1/(2ktc02+1)1/2b、羧酸部分电离:-d c/d t=kc5/2 得出1/c3/2-1/c03/2=2/3kt又因为c=c0(1-p) 所以1/(1-p)3/2=2/3ktc03/2+1因为X n2=1/(1-p) 所以X n2=2/3ktc03/2+1同理:[c]/[c0]= 1/(2/3ktc03/2+1)2/3②、外加酸的情况下:由-d c/d t=k'c2得出1/c-1/c0 =k't又因为c=c0(1-p)所以1/(1-p)=k'tc0+1因为X n=1/(1-p) 所以X n=k'tc0+1得出[c]/[c0]=1/k'tc0+117、由题:f=[(2.5x2)+1x2+1x3]/(2.5+1+1)=2.22⑴按carothers法:Pc=2/f=2/2.22=0.9,反应到产生凝胶时羧基的剩余量为n COOH=2.5x2(1-0.9)=0.5,酸值为中和1g试验所需要的KOH的mg量-COOH KOH1 1N-COOH= n KOH所以酸值=(n KOH xM KOH)/m总=(0.5x56)/(2.5x148+1x62+1x92)=53.4mgKOH/g试样⑵按flory法:(2,2,3体系)f=3,ρ=(1x3)/(1x2+1x3)=0.6Pc=1/[1+ρ(f-2)]1/2=1/[1+0.6x(3-2)]1/2=0.7906, 反应后剩余的-COOH的摩尔质量:n COOH=2.5x2x(1-0.7906)=1.047酸值=(n KOH xM KOH)/m总=(1.047x56)/(2.5x148+1x62+1x92) =111.89mgKOH/g试样。
聚酯合成反应原理相关知识精选全文

可编辑修改精选全文完整版聚酯合成反应原理相关知识 第一节 聚酯合成的主反应一、直接酯化段反应机理目前,PTA 酯化反应一般不需要加催化剂,因为PTA 分子中的羧酸本身就可起催化作用,这种催化实际上为氢离子催化,因为,在没有催化剂存下的直接酯化反应被认为是一个酸催化过程。
(一)外加酸催化反应。
在反应体系中,适当地加入少量的强酸做催化剂,可缩短反应时间,在较短的时间内获得较高的转化率。
1、 强酸离解产生氢离子。
HAH++A-2、 PTA 分子质子化。
CO OHCOO H ++H+CO OHCOOH3、质子化的PTA 分子与EG 作用生成一个不稳定的中间体。
OH C OH CO OH ++H OC H 2C H 2OHOH O H C O +COOH C H 2C H 2OH H[]4、中间体很不稳定,马上进行分子内的重新排列生成酯化物。
OH O H C O +COOH C H 2C H 2OH H[]C OO C H 2C H 2OHCOO H OH 2+H++PTA 中的另一个羧基同样发生上述反应,最后得到BHET,由于反应过程为平衡可逆过程,所以,为了顺利的进行酯化反应,必须不断的把小分子副产物从反应区域内移走。
(二)PTA 自催化反应PTA 在加热,加压和有水存在时,可以离解为酸根和氢离子:HOOC --COOH2OOHHOOC -COOHδ-从而使羧酸基碳原子正电性加强,形成类似的质子化PTA 分子,并与EG 发生如下反应:δCOHCOOHC O OHCOOH2CH 2δ+-OH -HO HCOOHC OH O +OHCH 2CH 2C OO-+HOOC -(中间体)不稳定的中间体重排后可得酯化产品。
因此,这种两分子PTA 与一分子EG 的酯化反应,实质上是一分子PTA 与一分子的EG 的酯化反应;另一分子PTA 是在起催化剂的作用。
二、缩聚反应机理与酯化反应,BHET 进行缩聚反应时一般需要催化剂。
FT-IR研究聚酯-TDI型聚氨酯固化反应动力学

1.1 原 料及 仪器 1,4-丁二醇 、2,4一甲苯二异氰酸酯 (TDI)、己二
酸、二丁基二月桂酸锡 ,AR级 ,阿拉丁试剂有 限公 司 ;季 戊 四醇 ,CP级 ,中国上 海试 剂一 厂 ;[(6一氧代 一
6H一二苯 并 [e,e][1,2]氧 磷 杂 己 环一6.基 )甲基 ]丁 二酸 (DDP),CP级 ,浙 江省 化工 研究 院有 限公 司 。
· 18 ·
聚 氨 酯 工 业
POLYURETHANE INDUSTRY
2016年 第 31卷 第 1期
2016.Vo1.31 No.1
FT-IR研 究 聚 酯 -TDI型聚 氨酯 固化 反 应 动 力 学
李欣 恰 管 习文 张 倩 张金枝 邹 其超 柴仕 淦 (湖北 大学化 学化 工 学院 有机 功能 高分子 的合 成和 应 用教 育部 重 点 实验 室
过 的长 度 即样 品厚 度 ,cm)。在 反 应 过 程 中~ NC0 合 DDP端羟基 聚酯 的结构 。
不 断 被 消 耗 ,一 NCO 的 吸 收 峰 峰 强 度 逐 渐 减 小 。 2.2 含 DDP聚 氨酯 的红 外表 征
Spectrum One型 傅 里 叶 变 换 红 外 光谱 分 析仪 , 美 国 PerkinElmer公 司 。 1.2 实验 路线 1.2.1 合成
(1)在 250 mL的四颈烧 瓶 上 安装 好 冷 凝 管 ,温 度计 ,电动搅拌器 ,然后将 DDP、己二酸 、季戊四醇 和 1,4.丁二 醇按 一定 比例 加入 到 四颈 烧 瓶 中 ,并 通 人氮 气 。在搅拌 的作 用 下对 其 进 行 加 热 ,当温 度 升 至 140℃ 时 ,按单 体 总 质量 的 0.05% ̄i人 催 化 剂 二 丁基 二月 桂酸 锡 。继 续 升 温 至 180℃ ,反 应 4 h冷 却出料 ,得到一种端羟基含磷聚酯多元醇产物 。
tgic 固化羚基聚酯粉末涂料的固化反应方程式

TGIC 固化羚基聚酯粉末涂料是一种广泛应用于金属家具、汽车零部件、家电等行业的高性能涂料,具有优异的耐候性、耐化学品性和机械性能。
其固化反应方程式是非常重要的,对于理解该涂料的固化机理、优化工艺条件、改进产品性能都具有重要意义。
TGIC 固化羚基聚酯粉末涂料是通过与环氧树脂或酚醛树脂等进行交联反应来实现固化的。
固化反应方程式如下:1. 反应物的表示TGIC 固化羚基聚酯粉末涂料中的主要反应物包括固化剂(Tetraglycidyl methylene dianiline,TGIC)、羚基聚酯树脂、辅助固化剂和各类添加剂。
2. 主要固化反应TGIC 固化羚基聚酯粉末涂料的主要固化反应是 TGIC 与羚基聚酯树脂的环氧基团发生开环反应,形成交联结构。
其反应方程式如下所示:TGIC + 羚基聚酯树脂→ 交联产物3. 反应机理TGIC 在固化过程中,其环氧基团与羚基聚酯树脂中的羟基发生开环反应,形成碳-氧-碳(C-O-C)键,从而实现与羚基聚酯树脂的交联固化。
在此过程中,固化剂与树脂之间的反应速率、反应活性、交联密度等参数将对固化过程和固化产物的性能产生显著影响。
4. 影响固化反应的因素TGIC 固化羚基聚酯粉末涂料的固化反应受到多种因素的影响,包括固化剂与树脂的配比、固化剂的种类和活性、固化温度、固化时间、助剂的添加等。
其中,固化剂与树脂的配比是影响固化反应速率和交联密度的关键因素之一,固化温度和固化时间影响固化反应的程度和速率,助剂的添加则可以调控固化反应的速率和产物的性能。
5. 优化固化反应条件为了获得良好的固化效果和优异的涂料性能,可通过优化固化反应条件来实现。
在选择固化剂和树脂的配比时,需考虑到固化速率和交联密度的平衡,固化温度和固化时间的控制也要充分考虑到工艺的实际可行性。
辅助固化剂和添加剂的选择与添加量也将对固化反应和产物性能产生重要影响,需综合考虑其影响机理和实际应用需求。
通过对 TGIC 固化羚基聚酯粉末涂料固化反应方程式的理解和研究,可为优化生产工艺、改进产品性能和开发具有特定性能的新型涂料提供重要的理论依据和技术支持。
对苯二甲酸乙二醇酯pet的反应机理及影响因素

苯二甲酸乙二醇酯一,概述PET苯二甲酸乙二醇酯化学式为-[OCH2-CH2OCOC6H4CO]- 英文名: polyethylene terephthalate,简称PET,为高聚合物,由对苯二甲酸乙二醇酯发生脱水缩合反应而来。
对苯二甲酸乙二醇酯是由对苯二甲酸和乙二醇发生酯化反应所得。
PET 是乳白色或浅黄色、高度结晶的聚合物,表面平滑有光泽。
在较宽的温度范围内具有优良的物理机械性能,长期使用温度可达120℃,电绝缘性优良,甚至在高温高频下,其电性能仍较好,但耐电晕性较差,抗蠕变性,耐疲劳性,耐摩擦性、尺寸稳定性都很好。
PTA的应用又比较集中,世界上90%以上的PTA用于生产聚对苯二甲酸乙二醇酯(简称聚酯,PET)。
生产1吨PET需要 0.85-0.86吨的PTA和0.33-0.34吨的MEG(乙二醇)。
聚酯包括纤维切片、聚酯纤维、瓶用切片和薄膜切片。
国内市场中,有75%的 PTA用于生产聚酯纤维;20%用于生产瓶级聚酯,主要应用于各种饮料尤其是碳酸饮料的包装;5%用于膜级聚酯,主要应用于包装材料、胶片和磁带。
可见, PTA的下游延伸产品主要是聚酯纤维。
二,PET的用途玻璃纤维增强PET适用于电子电气和汽车行业,用于各种线圈骨架、变压器、电视机、录音机零部件和外壳、汽车灯座、灯罩、白热灯座、继电器、硒整流器等。
PET工程塑料目前几个应用领域的耗用比例为:电器电子26%,汽车22%,机械19%,用具10%,消费品10%,其他为13%。
目前PET工程塑料的总消耗量还不大,仅占PET总量的1.6%。
1.薄膜片材方面:各类食品、药品、无毒无菌的包装材料;纺织品、精密仪器、电器元件的高档包装材料;录音带、录象带、电影胶片、计算机软盘、金属镀膜及感光胶片等的基材;电气绝缘材料、电容器膜、柔性印刷电路板及薄膜开关等电子领域和机械领域。
2.包装瓶的应用:其应用已由最初的碳酸气饮料发展到现在的啤酒瓶、食用油瓶、调味品瓶、药品瓶、化妆品瓶等。
共聚型磷系阻燃聚酯聚合反应动力学及其性能

共聚型磷系阻燃聚酯聚合反应动力学及其性能陈咏; 王颖; 何峰; 王静; 朱志国; 董振峰; 王锐【期刊名称】《《纺织学报》》【年(卷),期】2019(040)010【总页数】7页(P13-19)【关键词】聚酯; 缩聚反应动力学模型; 阻燃剂; 磷系阻燃聚酯【作者】陈咏; 王颖; 何峰; 王静; 朱志国; 董振峰; 王锐【作者单位】北京服装学院材料科学与工程学院北京 100029; 服装材料研究开发与评价北京市重点实验室北京 100029【正文语种】中文【中图分类】TQ311以对苯二甲酸和乙二醇为原料,通过直接酯化后再缩聚,合成聚对苯二甲酸乙二醇酯(PET)是目前聚酯生产的主要工艺流程,但同绝大多数高分子材料一样,基于PET的各种材料和制品均为易燃或可燃材料,火焰蔓延迅速,燃烧时释放出大量的热,并伴随浓烟及有毒气体,严重威胁人们的生命和财产安全,同时也造成环境污染,因此,提高聚酯材料的阻燃性能是当今聚酯发展的重要趋势[1-3]。
PET的阻燃改性主要包括共聚法和共混法[4-6]。
随着相关研究的深入,阻燃PET 改性技术从机制研究和工艺研究转向阻燃PET生产技术的开发[7-8]。
目前,对阻燃PET制备及其性能的研究已有较多的报道[9-10],而对阻燃共聚酯聚合动力学方面的研究和报道较少,特别是对于新品种阻燃聚酯而言,动力学研究将为产品产业化和操作过程优化等提供数据和模型支持。
在PET的合成中存在2种不同体系的动力学研究:封闭体系和开放体系。
封闭体系是研究正、逆反应同时存在,反应处于化学平衡状态,小分子副产物组分不予排出的动力学。
开放体系是小分子副产物不断排出体系,开放体系的反应动力学更具有实际意义。
借鉴普通PET的动力学研究方法,本文采用开放体系动力学研究方法[11-12],选用获得较多应用的磷系阻燃剂2-羧乙基苯基次磷酸为例,进行不同温度、不同磷含量的聚合实验,建立此类共聚型阻燃PET的缩聚动力学模型,以期深入分析2-羧乙基苯基次磷酸对阻燃聚酯的聚合动力学,为同类产品的技术开发提供参考。
聚酯(PET)反应过程研究:Ⅱ.酯化反应过程动力学研究

聚酯(PET)反应过程研究:Ⅱ.酯化反应过程动力学研究沈瀛坪;赵玲
【期刊名称】《化学反应工程与工艺》
【年(卷),期】1997(13)2
【摘要】对乙二醇和对苯二甲酸直接酯化反应过程的主反应动力学和生成DEG副反应的动力学进行了研究,得到了不同温度下的反应速率,进而获取了各反应的活化能和频率因子。
【总页数】5页(P179-183)
【作者】沈瀛坪;赵玲
【作者单位】华东理工大学联合反应工程研究所;华东理工大学联合反应工程研究所
【正文语种】中文
【中图分类】O633.14
【相关文献】
1.聚酯(PET)反应过程研究:Ⅳ酯化反应过程数学模拟 [J], 沈瀛坪;赵玲
2.聚酯(PET)反应过程研究:Ⅲ酯化反应过程中传质研究 [J], 沈瀛坪;赵玲
3.聚酯(PET)反应过程研究:Ⅶ后缩聚反应过程研究和数学模拟 [J], 沈瀛坪
4.聚酯(PET)反应过程研究:Ⅴ预缩聚反应过程分析和反应动力学院 [J], 沈瀛坪;赵玲
5.聚酯(PET)反应过程研究Ⅰ对苯二甲酸和乙二醇直接酯化反应过程分析及主反应化学平衡研究 [J], 沈瀛坪;赵玲
因版权原因,仅展示原文概要,查看原文内容请购买。
聚酯酯化反应通入氮气的研究

聚酯酯化反应通入氮气的研究作者:周向进1.前言聚酯是合成纤维聚合物中产能最大的品种,除应用于制造涤纶纤维外,还广泛应用于制造瓶子、薄膜、塑料等,2007年中国大陆聚酯生产能力达到2306万吨/年。
聚酯技术是一项成熟的技术,多年来围绕提高聚酯装置生产能力的研究很多,但是通过向聚酯酯化反应器通入氮气提高酯化反应速度的研究未见报道。
本文研究了在其它实验条件相同的情况下向反应器通入氮气对酯化反应速度的影响和规律,发现向酯化反应器通入氮气可以明显提高酯化反应速度。
2.原理2.1聚酯直接酯化法工艺原理聚酯(PET)的主要生产工艺分为两部分,一是酯化,二是缩聚。
酯化是以精对苯二甲酸(PTA)和乙二醇(EG)为原料,经过化学反应生成对苯二甲酸乙二醇酯(BHET)的工艺过程。
酯化反应是可逆平衡反应,反应方程式是:HOOC--COOH+2HOCH2CH2OH←→HOCH2CH2OOC--COOCH2CH2OH+2H2O (2)为了使反应平衡向正反应方向移动,需要不断移去反应生成物中的水。
增加原料EG与PTA的克分子比,也有利于提高酯化反应速度。
酯化反应是吸热反应,提高反应温度有利于提高反应速度。
但是提高温度将加剧生成二甘醇(DEG)的副反应。
因此,加快脱除副产物水以提高酯化反应速度是工艺优化和技术创新的一个选择。
2.2通入氮气的酯化工艺原理根据反应方程式(2),酯化反应过程中,系统液相主要组成是PTA、EG、BHET(及其低聚物)和H2O;气相主要组成是EG和H2O。
根据拉乌尔定律,系统压力P = PH2O + PEG(3)反应过程中,通过调节阀的作用,系统压力维持不变,设系统压力为常数C,则:P = PH2O + PEG = C(4)当系统气相通入氮气之后,系统的液相组成不变,气相组成中增加了氮气,主要成份为EG、H2O和N2三种。
维持系统压力不变时,根据拉乌尔定律,P新= PH2O + PEG + PN2 = C(5)第1页共3页通入氮气后,气相中水的分压PH2O降低,乙二醇的分压PEG也降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[M] == [–COOH] == [–OH]
– d [M] / d t == k′ [M]2
在0→t , M0→M范围内定积分,则:
Xn
=
1 / (1_ p)
== k′ [M]0 t + 1
(2
7)
2、自催化动力学
2 Xn
=
1 (1 _ p)2
= 2 k″ [M]02 t + 1
(2
8)
时间,min
2.4 聚酯反应动力学方程 2. 5 线型平衡缩聚反应的相对分子质量控制、分布及影响 因素
2.4 线型平衡缩聚反应动力学
2.4.1 聚酯反应机理
_ COOH + H
+
k1 k2
_
C (OH)2
k5
+
k3,+ _OH
k4
[
~ OH ~~C _ OH OH
]
+
~~ OCO ~~ + H2O + H+
2.4.2 聚酯反应动力学方程
1. 癸二醇202℃;2. 癸二醇,191℃;3. 癸二醇, 161 ℃;4. 二缩乙二醇166 ℃
2.4.3 线型平衡缩聚反应动力学的研究方法
0 . 50mol 已二酸 + 0 . 50mol 乙二醇 = 聚酯 +水
p = 生成水的体积/能够生成水的最大体积 = Vt / V∞
Xn
=
1
1 _p
=
=
_ k1 (1 p) 2
_ _ d [ COOH] dt
[ C (OH)2]
_ d [ COOH] _ dt
=
=
=
_ k3 [ C (OH)2] [ OH]
+
_
_
+
k1 _ [ COOH] [H +] k2
k1 k3 _ + [ COOH] [ _ OH ][H ] k2
= k [–COOH] [–OH] [H+]
1、外加酸催化动力学
1000 2 800 600 400 200
。 。 。
3
△ △ △ △
0.968 0.965 0.959 0.950 + 4 + 0.929 0.820
0 ++ + 2
. . 。
1
.
。
+ 4 6
+ 8 10 12 14 16
△
时间(× 10-2min)
图2-2 己二酸自催化与四种二元醇的缩聚反应动力学曲线
V∞
V∞
_V
t
= k [M]0 t + 1
ln k = ln A – E / RT
2.4.4 平衡缩聚反应动力学简介
d [-OCO-] / d t
=Leabharlann p nw _ k1 (1 p) 2 _ K
[
]
按照上式,当平衡常数K很大、反应程度p很高、或者小分 子存留率nw很低时,则
d [-OCO-] / d t
100 80 o 60 40 o 20
++ + + + +
20
40
60
80
100
120
140 o
+
0.988
↑
o
+
0.983 0.975 0.950 0.800
↓
o
0
200
400
600
800
时间,min
图2-1 对甲苯磺酸催化己二酸与两种二元醇的缩
聚反应动力学曲线
o癸二醇,161 ℃;+二缩乙二醇,109℃
