各种感受态细胞
感受态细胞制备(三种方法)

感受态细胞制备(三种方法)
感受态细胞的制备是一项非常重要的实验技术,可应用于许多研究领域,如分子生物学、农药毒理学、农业植物保护等。
一般来说,将培养细胞转化为感受态细胞,可以有三种方法:
1、皮下注射引起的感受态细胞制备。
由于它是一种经典的制备方法,大多数细胞都可以使用。
其核心步骤是将小量液体注入传感源头(如病毒、菌株、多糖、细菌等)皮下。
这种技术可以帮助人们制备特定种类的感受态细胞,并且可以控制病毒的感染率。
2、利用细胞克隆引起的感受态细胞制备。
这种方法涉及到使用不同种类的细菌或病毒及其克隆进行感染。
一旦细胞受感染,感受态细胞就会形成。
此外,通过诱变基因表达等方式,也可以制备出不同感受源的感受态细胞。
3、利用小分子引起的感受态细胞制备。
小分子技术中的最新研究主要集中在核酸抑制剂、蛋白质结合蛋白、信号转导调节剂等。
这些小分子可以直接结合到感受细胞的特定分子,从而影响其功能,抑制或促进感受细胞的形成。
以上是三种感受态细胞制备的方法,它们均可用于解析某一特定基因或基因产物在细胞功能中的作用。
此外,这些技术还可用于识别及检测特定感受源,并评价其对细胞株功能的影响程度。
另外,它们还可用于发现新型抗病毒剂,以提高植物抗病能力。
因此,感受态细胞的制备实验在诸多方面都具有重要的意义,值得继续探索。
大肠杆菌感受态细胞的几种制备方法

大肠杆菌感受态细胞的几种制备方法感受态细胞(Competent cells) :常态的细胞不能摄入外部溶液中的DNA,所以要转化质粒DNA进入大肠杆菌必须首先制备感受态的大肠杆菌细胞。
受体细胞经过一些特殊方法(如:CaCl,RuCl等化学试剂法)的处理后,细胞膜的通透性发生变化,成为能容许多有外源DNA 的载体分子通过的感受态细胞(competent cell) 。
转化:是将异源DNA分子引入一细胞株系,使受体细胞获得新的遗传性状的一种手段,是基因工程等研究领域的基本实验技术。
进入细胞的DNA分子通过复制表达,才能实现遗传信息的转移,使受体细胞出现新的遗传性状。
转化过程所用的受体细胞一般是限制-修饰系统缺陷的变异株,即不含限制性内切酶和甲基化酶的突变株。
α-互补现象:因为许多载体都带有一个LacZ基因的调控序列和头146个氨基酸的编码信息,编码α-互补肽,该肽段能与宿主编码的缺陷型β-半乳糖苷酶实现基因内互补(α-互补)。
当这种载体转入可编码?-半乳糖苷酶C端部分序列的宿主细胞中时,在异丙基-β-D硫代半乳糖苷(IPTG)的诱导下,宿主可同时合成这两种肽段,虽然它们各自都没有酶活性,但它们可以融为一体形成具有酶活性的蛋白质。
所以称这种现象为α-互补现象。
由互补产生的α-半乳糖苷酶(LacZ)能够作用于生色底物5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)而产生蓝色的菌落,所以利用这个特点,在载体的该基因编码序列之间人工放入一个多克隆位点,当插入一个外源DNA片段时,会造成LacZ(α)基因的失活,破坏α-互补作用,就不能产生具有活性的酶。
所以,有重组质粒的菌落为白色,而没有重组质粒的菌落为蓝色。
方法一:TSS方法制备感受态细菌(又称一步法)一、准备工作1、缓冲液1×TSS的配制事先配制1M的氯化镁:20.3g氯化镁(6分子水结晶),定容于100ml去离子水后封装,不用灭菌。
取干净的100ml 量筒和100ml 烧杯,用量筒量取100ml去离子水,加入至烧杯中,取1 g 蛋白胨,0.5g 酵母抽提物,0.5g 氯化钠,10 g PEG(MW= 3350),5ml DMSO,5ml 的1 M氯化镁,溶解后用盐酸或者氢氧化钠调整pH为6.5,混匀后用0.22um 滤器过滤除菌。
大肠杆菌感受态细胞的几种制备方法

大肠杆菌感受态细胞的几种制备方法感受态细胞(Competent cells) :常态的细胞不能摄入外部溶液中的DNA,所以要转化质粒DNA进入大肠杆菌必须首先制备感受态的大肠杆菌细胞。
受体细胞经过一些特殊方法(如:CaCl,RuCl等化学试剂法)的处理后,细胞膜的通透性发生变化,成为能容许多有外源DNA 的载体分子通过的感受态细胞(competent cell) 。
转化:是将异源DNA分子引入一细胞株系,使受体细胞获得新的遗传性状的一种手段,是基因工程等研究领域的基本实验技术。
进入细胞的DNA分子通过复制表达,才能实现遗传信息的转移,使受体细胞出现新的遗传性状。
转化过程所用的受体细胞一般是限制-修饰系统缺陷的变异株,即不含限制性内切酶和甲基化酶的突变株。
α-互补现象:因为许多载体都带有一个LacZ基因的调控序列和头146个氨基酸的编码信息,编码α-互补肽,该肽段能与宿主编码的缺陷型β-半乳糖苷酶实现基因内互补(α-互补)。
当这种载体转入可编码?-半乳糖苷酶C端部分序列的宿主细胞中时,在异丙基-β-D硫代半乳糖苷(IPTG)的诱导下,宿主可同时合成这两种肽段,虽然它们各自都没有酶活性,但它们可以融为一体形成具有酶活性的蛋白质。
所以称这种现象为α-互补现象。
由互补产生的α-半乳糖苷酶(LacZ)能够作用于生色底物5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)而产生蓝色的菌落,所以利用这个特点,在载体的该基因编码序列之间人工放入一个多克隆位点,当插入一个外源DNA片段时,会造成LacZ(α)基因的失活,破坏α-互补作用,就不能产生具有活性的酶。
所以,有重组质粒的菌落为白色,而没有重组质粒的菌落为蓝色。
方法一:TSS方法制备感受态细菌(又称一步法)一、准备工作1、缓冲液1×TSS的配制事先配制1M的氯化镁:20.3g氯化镁(6分子水结晶),定容于100ml去离子水后封装,不用灭菌。
取干净的100ml 量筒和100ml 烧杯,用量筒量取100ml去离子水,加入至烧杯中,取1 g 蛋白胨,0.5g 酵母抽提物,0.5g 氯化钠,10 g PEG(MW= 3350),5ml DMSO,5ml 的1 M氯化镁,溶解后用盐酸或者氢氧化钠调整pH为6.5,混匀后用0.22um 滤器过滤除菌。
感受态细胞制备的几种方法

感受态细胞制备的⼏种⽅法⼤肠杆菌感受态细胞的⼏种制备⽅法关于感受态细胞(Competent cells)常态的细胞不能摄⼊外部溶液中的DNA,,所以要转化质粒DNA进⼊⼤肠杆菌必须⾸先制备感受态的⼤肠杆菌细胞。
受体细胞经过⼀些特殊⽅法(如:CaCl,RuCl等化学试剂法)的处理后,细胞膜的通透性发⽣变化,成为能容许多有外源DNA的载体分⼦通过的感受态细胞(competent cell) 。
转化,是将异源DNA分⼦引⼊⼀细胞株系,使受体细胞获得新的遗传性状的⼀种⼿段,是基因⼯程等研究领域的基本实验技术。
进⼊细胞的DNA分⼦通过复制表达,才能实现遗传信息的转移,使受体细胞出现新的遗传性状。
转化过程所⽤的受体细胞⼀般是限制-修饰系统缺陷的变异株,即不含限制性内切酶和甲基化酶的突变株。
α-互补现象:因为许多载体都带有⼀个LacZ基因的调控序列和头146个氨基酸的编码信息,编码α-互补肽,该肽段能与宿主编码的缺陷型β-半乳糖苷酶实现基因内互补(α-互补)。
当这种载体转⼊可编码?-半乳糖苷酶C端部分序列的宿主细胞中时,在异丙基-?-D 硫代半乳糖苷(IPTG)的诱导下,宿主可同时合成这两种肽段,虽然它们各⾃都没有酶活性,但它们可以融为⼀体形成具有酶活性的蛋⽩质。
所以称这种现象为α-互补现象。
由互补产⽣的α-半乳糖苷酶(LacZ)能够作⽤于⽣⾊底物5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)⽽产⽣蓝⾊的菌落,所以利⽤这个特点,在载体的该基因编码序列之间⼈⼯放⼊⼀个多克隆位点,当插⼊⼀个外源DNA⽚段时,会造成LacZ(α)基因的失活,破坏α-互补作⽤,就不能产⽣具有活性的酶。
所以,有重组质粒的菌落为⽩⾊,⽽没有重组质粒的菌落为蓝⾊。
⼤肠杆菌感受态细胞的⼏种制备⽅法⽅法⼀:细菌转化的⽅法多以Mendel和Higa(1970)的发现为基础,其基本⽅法是⽤冰预冷的CaCl2或多种2价阳离⼦等处理细菌,使之进⼊感受态得以转化。
大肠杆菌感受态细胞的几种制备方法

大肠杆菌感受态细胞的几种制备方法感受态细胞(Competent cells) :常态的细胞不能摄入外部溶液中的DNA,所以要转化质粒DNA进入大肠杆菌必须首先制备感受态的大肠杆菌细胞。
受体细胞经过一些特殊方法(如:CaCl,RuCl等化学试剂法)的处理后,细胞膜的通透性发生变化,成为能容许多有外源DNA 的载体分子通过的感受态细胞(competent cell) 。
转化:是将异源DNA分子引入一细胞株系,使受体细胞获得新的遗传性状的一种手段,是基因工程等研究领域的基本实验技术。
进入细胞的DNA分子通过复制表达,才能实现遗传信息的转移,使受体细胞出现新的遗传性状。
转化过程所用的受体细胞一般是限制-修饰系统缺陷的变异株,即不含限制性内切酶和甲基化酶的突变株。
α-互补现象:因为许多载体都带有一个LacZ基因的调控序列和头146个氨基酸的编码信息,编码α-互补肽,该肽段能与宿主编码的缺陷型β-半乳糖苷酶实现基因内互补(α-互补)。
当这种载体转入可编码?-半乳糖苷酶C端部分序列的宿主细胞中时,在异丙基-β-D硫代半乳糖苷(IPTG)的诱导下,宿主可同时合成这两种肽段,虽然它们各自都没有酶活性,但它们可以融为一体形成具有酶活性的蛋白质。
所以称这种现象为α-互补现象。
由互补产生的α-半乳糖苷酶(LacZ)能够作用于生色底物5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)而产生蓝色的菌落,所以利用这个特点,在载体的该基因编码序列之间人工放入一个多克隆位点,当插入一个外源DNA片段时,会造成LacZ(α)基因的失活,破坏α-互补作用,就不能产生具有活性的酶。
所以,有重组质粒的菌落为白色,而没有重组质粒的菌落为蓝色。
方法一:TSS方法制备感受态细菌(又称一步法)For personal use only in study and research; not for commercial use一、准备工作1、缓冲液1×TSS的配制事先配制1M的氯化镁:20.3g氯化镁(6分子水结晶),定容于100ml去离子水后封装,不用灭菌。
感受态细胞制备及各种感受态的特点

感受态细胞制备制备感受态常用得方法就是电击法与CaCl2制备法,以下介绍CaCl2制备法:1、可以从-80℃冰柜中,取出一支冻存菌株,于事先照过紫外得超净台中,用无菌得接种环轻轻蘸取菌种后,在无抗平板(由于Rocetta含有氯霉素抗性,需要涂布在氯霉素抗性得平板,后面得都就是如此)上划线,并将菌种迅速放回-80℃保存,在划线板上做好相应标记,于37℃培养过夜。
2、从37℃培养过夜得新鲜平板上挑取一个单克隆,接种于2mlEP管中,37℃,220rpm震荡培养约6个小时至对数生长中后期;将该菌悬液以1:100得比例接种于50ml LB液体培养基(2瓶)中,37℃振荡培养2、5小时至OD600=0。
5。
注意:接种比例不得大于1:10。
3、在无菌条件下将细菌转移到一个无菌、预冷得离心管(50ml)中,在冰上放置5~10min; 注意:划板、接种为了防止意外发生最好多划一块平板与多接一根试管,划板、接种、转接均要严格按照无菌操作。
4、4℃5000g离心5分钟。
用预冷得去离子水洗涤沉淀,4℃ 5000g离心5分钟;Note:此步主要就是为了洗去培养基中得盐等5、沉淀加入2ml预冷得0、05mol/L CaCl2—15%甘油混合溶液,轻吹散,冰浴5分钟,4℃5000g离心5分钟;6、沉淀加入2ml预冷得0.05mol/L CaCl2—15%甘油混合溶液,轻吹散,即成为感受态细胞悬液。
分装成50~100μl得小份,贮存于-70℃可保存半年。
含15%甘油得0.05mol/L CaCl2制备方法:称取0。
28g CaCl2(无水,分析纯),溶于50ml重蒸水中,加入15ml甘油,定容至100ml,高压灭菌。
感受态细胞得特征感受态:通过特殊处理使细胞处于能够吸收外源DNA得状态。
感受态细胞得特征:(1)细胞表面暴露出一些可接受外来DNA得位点(以溶菌酶处理,可促使受体细胞得接受位点充分暴露)。
(2)细胞膜通透性增加(用钙离子处理,可使膜通透性增加,使DNA直接穿过质膜进入细胞)。
感受态细胞

1感受态细胞:细菌处于0℃,CaCl2 的低渗溶液中,菌细胞膨胀成球形,转化混合物中的DNA 形成抗DNase 的羟基-钙磷酸复合物粘附于细胞表面,经42℃短时间热冲击处理,促使细胞吸收DNA 复合物。
钙离子的作用是结合于细胞膜上,是细胞膜呈现一种液晶态。
在冷热变化刺激下液晶态的细胞膜表面会产生裂隙,使外源DNA进入。
所谓的感受态,即指受体(或者宿主)最易接受外源DNA片段并实现其转化的一种生理状态,它是由受体菌的遗传性状所决定的,同时也受菌龄、外界环境因子的影响。
将快速生长中的大肠杆菌(对数生长期)置于经低温预处理的低渗氯化钙溶液中,便会造成细胞膨胀(形成原生质球),使细菌处于容易吸收外源DNA的状态。
感受态细胞):受体细胞经过一些特殊方法(如:CaCl,RuCl等化学试剂法)的处理后,细胞膜的通透性发生变化,成为能容许多有外源DNA的载体分子通过的感受态细胞。
2分子克隆中重组体筛选和鉴定的原理方法:重组克隆的初步筛选克隆的筛选可以根据载体类型、受体细胞特性的变化、外源DNA分子本身的特性,采用不同的方法。
主要有遗传学检测、物理特性检测、分子杂交以及免疫学分析等。
从初步筛选直到分子杂交,进一步到DNA测序和基于蛋白质功能的分析,使得对克隆的检测逐步深入、精确。
.1 重组克隆的遗传学检测遗传学检测方法是重组子筛选过程中最初的检测步骤。
重组子的表征来源于载体所携带的标记和重组子结构特性。
根据这两类表征对重组子进行初步筛选。
(1) 抗药性筛选这是利用载体DNA上组装的抗药性选择标记进行筛选的方法。
常用的抗生素筛选剂:氨苄青霉素(ampicillin,Ap或Amp);氯霉素(chloramphenicol,Cm 或Cmp);卡那霉素(kanamycin,Kn或Kan);四环素(tetracymic,Tc或Tet);链霉素(2)插入失活筛选法检测克隆载体携带有外源DNA的通常方法是插入失活。
经过抗药性筛选获得的大量转化子中既包含所需要的重组子,也包含非重组子。
感受态细胞制备原理

感受态细胞制备原理
感受态细胞(Acceptablecell)又称转基因细胞、外源DNA转化细胞,是指外源基因与宿主基因组结合并在宿主细胞内稳定表达的细胞。
根据其来源的不同,可分为外源基因在大肠杆菌中表达的感受态细胞和质粒在酵母中表达的感受态细胞。
外源DNA进入细胞后,首先与细胞核内的DNA聚合酶结合,使DNA聚合酶分子分解成单链,然后由DNA聚合酶催化单链复制形成双链DNA分子。
在这一过程中,DNA聚合酶活性与病毒颗粒的基因片段大小相关。
当感受态细胞将外源DNA 导入到受体细胞后,它们与受体细胞内的DNA聚合酶和DNA 聚合酶复合体结合,从而使载体上的目的基因片段得以复制和表达。
当质粒上的目的基因被整合到受体细胞基因组中时,目的基因被激活。
当感受态细胞与受体细胞融合后,被激活的目的基因便会在受体细胞中以单拷贝形式表达出来。
因此,感受态细胞对目的基因有较强的选择压力,在表达过程中会筛选出最具表达潜力的部分。
—— 1 —1 —。
几种常用的感受态细胞

几种常用的感受态细胞
DH5α
具有α-互补性,便于鉴别重组体菌株。
该菌株可用于制作基因库、进行亚克隆等,由于该菌株同时具有deoR 变异,可以作为较大质粒的宿主菌使用。
Stbl3
常规质粒制备的宿主菌,可进行蓝白斑筛选。
该菌株是复制慢病毒载体系统推荐使用的菌株,对慢病毒载体等较大的质粒转化的效果好,有效减低错误重组的可能性。
Top10
一种用于培养质粒平板和粘粒平板的大肠杆菌菌株,可用于蓝白斑筛选。
该菌株适用于DNA 克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
2T1
具有四环素抗性基因(TetR);自身的ton A基因型能够阻止噬菌体T1和T5的感染;形成菌落时间较其他菌株快(约12小时),适合构建高质量的基因组文库。
BL21(DE3)
经过特殊改造的专门用来表达T7启动子启动基因的表达用大肠杆菌菌株。
十八种实验室常用的克隆感受态细胞
DH5α:DH5α菌株是实验室最常用的感受态细胞。
缺失核酸内切酶 (endA),提高了质粒DNA的产量和质量;重组酶缺陷型 (recA)减少插入片段的同源重组概率,保证了插入DNA 的稳定性;lacZΔM15的存在使DH5α可用于蓝、白斑筛选。
DH5α感受态细胞经特殊工艺制作,pUC19质粒检测转化效率>5×108 cfu/μg DNA。
TOP10:TOP10菌株来源于MC1061菌株,是目前实验室最常用的感受态细胞之一,基因型与DH10B高度类似(DH10B为gal E15型,而TOP10为gal U型)。
TOP10生长速度快(比DH5α快,但比Mach1-T1生长速度慢),10小时可见克隆,rec A1和end A1的突变有利于插入DNA的稳定和高纯度质粒DNA的提取。
可用于构建克隆,蓝白斑筛选等实验。
TOP10感受态细胞经特殊工艺制作,pUC19质粒检测转化效率>5×108cfu/μg DNA。
JM109:JM109菌株来源于E.coli K strain,是提取高质量DNA的理想菌株,rec A1和end A1的突变有利于克隆DNA的稳定和高纯度质粒DNA的提取。
携带hsd R17基因型背景,使得异源DNA不被内源核酸酶系统降解。
laqI q ZΔM15的存在使JM109可用于构建克隆,蓝白斑筛选实验;JM109感受态细胞经特殊工艺制作,pUC19质粒检测转化效率可达109cfu/μg DNA。
Mach1-T1:Mach1-T1菌株由野生型non-K-12 E. Coli W菌株改造而来,是目前生长速度较快的感受态细胞之一,在平板上8h可见克隆,缺失核酸内切酶(end A),提高了质粒DNA的产量和质量;重组酶缺陷型(rec A1398)减少插入片段的同源重组概率,保证了插入DNA的稳定性;lacZΔM15的存在使Mach1-T1可用于蓝、白斑筛选;tonA突变赋予Mach1-T1菌株对噬菌体T1和T5的抗性。
感受态细胞的选择与使用

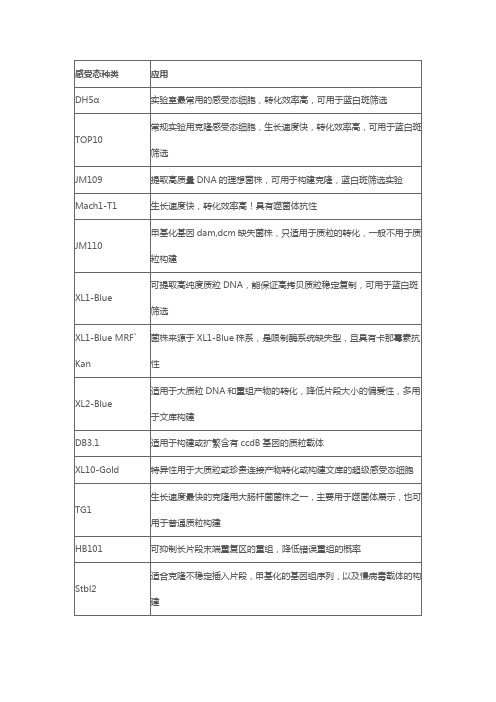
【专题】分子克隆实验专题--(五)感受态细胞的选择与使用作者: 空谷幽风(站内联系TA)发布: 2011-04-16分子克隆实验专题--(五)感受态细胞的选择与使用常用感受态细胞的特性:TOP10,DH5α:蓝白斑筛选,高效克隆,质粒抽提JM110:甲基化酶缺陷型SURE:克隆不稳定插入片段,降低同源重组DH10B:文库构建,长片段质粒的克隆(150kp质粒转化)Stbl2:克隆不稳定插入片段,正向重复,逆转录病毒序列,克隆甲基化基因组序列。
Stbl3:克隆慢病毒表达载体中的正向重复序列,降低逆转录病毒载体中长末端重复序列的非目标同源重组。
ν选择适宜的感受态细胞序列的结构,长度,载体种类以及特殊要求等。
ν选择适宜的转化方式热激转化:常规克隆,片段较短(<10kb)电转化: 建库,基因敲除,长片段(>10kb)感受态细胞使用的注意事项ν连接产物或质粒的量效价:1μg标准质粒转化感受态细胞产生的单克隆的数目,单位为cfu。
化学感受态细胞:106,107,108,109cfu电转感受态细胞:108,109,1010cfu常规的克隆根据连接产物和质粒的量选择适当效价的感受态细胞,特殊转化(如建库)则选择最高效价的感受态细胞,一般选用电转。
ν感受态细胞效价测定标准质粒:pUC18, pUC19,pBR322超螺旋,超纯质粒使用量:<5μl, <1ng设立阴性对照,多涂几板(3块以上)取平均值。
ν化学感受态细胞的使用质粒PCR扩环的产物以及进行体内重组的线性片段不宜选用DH5α高效感受态细胞进行转化。
可能原因:DH5α本身不适合这种操作;高效感受态制备的试剂对于这种转化有抑制作用。
可选用TOP10感受态细胞。
ν电转感受态细胞的使用尽量降低转化产物的离子浓度,防止细胞被击穿。
大量的连接产物提纯后进行转化,或者进行透析后再转化,有些进行体内重组的酶切产物进行提纯后进行转化。
ν氨苄平板的卫星菌落氨苄平板涂板后如果时间太长,就会产生卫星菌落,在单克隆周围生成小的克隆。
几种感受态细胞的用途、基因型和特点

几种感受态细胞的用途、基因型和特点1、DH5菌株用途:克隆菌,用于分子克隆、质粒提取。
基因型:supE44△lacU169(80lacZ△M15)hsdR17recAl endAl gyrA19thi-1relAl特点:一种用于铺制与培养质粒平板和粘性平板的抑制型菌株.其80lacZ△M15基因的产物可与pUC载体编码的β-半乳糖苷酶氨基端实现α互补,可用于蓝白斑筛选。
recAl和endAl的突变有利于克隆DNA的稳定和高纯度质粒的提取。
2、TOP10菌株用途:克隆菌,用于分子克隆,质粒提取。
基因型:F_mcrAΔ(mrr-hsd RMS-mcrBC)φ80lacZΔM15△lacⅩ74 recA1deoR araD139Δ(ara-leu)7697galU galK rpsL(StrR)endA1 nupG特点:一种用于铺制与培养质粒平板和粘粒平板的重级缺陷的抑制型菌株。
其中φ80lacZΔM15基因的产物可与pUC载体编码的β-半乳糖苷酶氨基端实现α-互补,可用于蓝白斑筛选。
该菌株适用于高效的DNA克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
3、JM109菌株用途:克隆菌,用于分子克隆。
基因型:recAl supE44endAl hsdR17Gyr A96relAl thiΔ(lac-proAB)F’[traD36proAB+lacZ△M15]特点:一种支持带有琥珀突变的载体生长的重组缺陷的抑制型菌株,对转染的DNA有修饰作用而无限制作用。
4、BL21(DE3)菌株用途:表达菌,可用于表达非毒性蛋白基因型:hsdSgal(c I TS857indl Sam7nin5lacUV5-T7)特点:该菌株用于高效表达克隆于含有T7噬菌体启动子的表达载体的基因。
T7噬菌体RNA聚合酶位于噬菌体DE3区,该区整合于BL21染色体上5、BL21(DE3)pLysS菌株用途:表达菌,可表达毒性蛋白和非毒性蛋白。
各种感受态细胞的区别、用途和特征

各种感受态细胞的区别、用处和特征Xl1-Blue菌株基因型:endA1 gyrA96(nalR) thi-1 recA1 relA1 lac glnV44 F‘[Tn10 proAB+ lacIq Δ(lacZ)M15] hsdR17(rK- mK+)。
特点:具有卡那抗性、四环素抗性和氯霉素抗性。
用处:分子克隆和质粒提取。
BL21(DE3)菌株基因型:F–ompT gal dcm lon hsdSB(rB- mB-) λ(DE3 [lacI lacUV5-T7 gene 1 ind1 sam7 nin5])。
特点:该菌株用于以T7 RNA聚合酶为表达系统的高效外源基因的蛋白表达宿主。
T7噬菌体RNA聚合酶基因的表达受控于λ噬菌体DE3区的lacUV5启动子,该区整合于BL21的染色体上。
该菌合适于非毒性蛋白的表达。
BL21(DE3)ply菌株基因型:F- ompT gal dcm lon hsdSB(rB- mB-) λ(DE3) pLysS(cmR)。
特点:该菌株带有pLysS,具有氯霉素抗性。
此质粒还有表达T7溶菌酶的基因,T7溶菌酶可以降低目的基因的背景表达程度,但不干扰IPTG诱导的表达。
合适于毒性蛋白和非毒性蛋白的表达。
用处:蛋白质表达Competent E. coliFull Product Description BL21 Star™ E. coli strains are high-performance BL21 hosts designed for improving protein yield in a T7 promoter-based expression system. Because T7 RNA polymerase synthesizes mRNA more rapidly thanE. coli RNA polymerases, transcription from the T7 promoter is uncoupled to translation in E. coli. This results in mRNA transcripts unprotected by ribosomes, which are then subject to enzymatic degradationby endogenous RNases (1). The reduced level of transcripts in the cell often leads to greatly reduced levels of protein yield (Figure1). The BL21 Star™ strains contain a mutation in the gene encodingRNaseE (rne131), which is one of the major sources of this mRNA degradation (2). BL21 Star™ cells significantly improve the stability of mRNA transcripts and increase protein expression yield from T7 promoter-based vectors (3) (Figure 2).BL21 Star™(DE3) is ideal for expressing proteins that are non-toxic to E. coli.BL21 Star™(DE3)p LysS offers lower basal-level expression of heterologous genes than BL21 Star™(DE3). It is designed for expressing proteins that are slightly growth inhibitive to E. coli.DH5α菌株基因型:F- endA1 glnV44 thi-1 recA1 relA1 gyrA96 deoR nupG Φ80dlacZΔM15 Δ(lacZYA-argF)U169, hsdR17(rK-, λ–特点:一种常用于质粒克隆的菌株。
感受态细胞分类

感受态细胞分类以感受态细胞分类为标题,写一篇文章。
感受态细胞是人体中一类非常重要的细胞,它们负责传递感觉信息给大脑,让我们能够感受到外界的刺激和环境的变化。
根据不同的感受能力和传递方式,感受态细胞可以分为视觉感受态细胞、听觉感受态细胞、触觉感受态细胞、嗅觉感受态细胞和味觉感受态细胞等。
视觉感受态细胞是我们感知世界的主要方式之一。
它们分布在我们的眼睛中,能够感受到光的强度、颜色和运动等信息。
当光线进入眼睛后,视觉感受态细胞中的感受器会受到刺激,产生电信号,然后通过视神经传递给大脑。
大脑会根据这些信号分析和处理,最终让我们看到世界的各种景象。
听觉感受态细胞则分布在我们的耳朵中,负责感受声音的振动。
当声音传入耳朵时,听觉感受态细胞中的感受器会受到声波的刺激,产生电信号,然后通过听神经传递给大脑。
大脑会根据这些信号的频率、强度和时长等信息,解析出声音的来源和含义,让我们能够听到各种声音,包括语言、音乐和自然界的声音等。
触觉感受态细胞广泛分布在我们的皮肤中,能够感受到物体的接触、压力和温度等刺激。
当我们触摸到物体时,触觉感受态细胞中的感受器会受到刺激,产生电信号,然后通过触觉神经传递给大脑。
大脑会根据这些信号的特点,判断物体的硬度、温度和纹理等信息,让我们能够感受到物体的质地和温度等变化。
嗅觉感受态细胞分布在我们的鼻腔中,负责感受气味的分子。
当我们闻到气味时,嗅觉感受态细胞中的感受器会受到气味分子的刺激,产生电信号,然后通过嗅觉神经传递给大脑。
大脑会根据这些信号的种类和浓度等信息,识别出气味的来源和特征,让我们能够分辨出各种不同的气味。
味觉感受态细胞则分布在我们的舌头上,能够感受食物的味道。
当食物进入口腔时,味觉感受态细胞中的感受器会受到食物化学物质的刺激,产生电信号,然后通过味觉神经传递给大脑。
大脑会根据这些信号的种类和浓度等信息,识别出食物的味道,包括酸、苦、甜、咸和鲜等。
这些味觉信息会影响我们对食物的喜好和选择。
各种菌株及感受态细胞

菌株及感受态细胞DH5α 菌株BL21(DE3) 菌株BL21(DE3) pLysS 菌株目录号 包装 转化效率 价格化学转化感受态细胞PBZ0401-1 5×100μl 108cfu/μgDNA 100.00 PBZ0401-2 10×100μl 108cfu/μgDNA 200.00甘油保存菌株PBZ0401-3 0.5ml 100.00目录号 包装 转化效率 价格化学转化感受态细胞 PBZ0402-1 5×100μl 108cfu/μgDNA 100.00 PBZ0402-2 10×100μl 108cfu/μgDNA 200.00甘油保存菌株 PBZ0402-3 0.5ml 100.00目录号 包装 转化效率 价格化学转化感受态细胞PBZ0403-1 2×100μl 108cfu/μgDNA 200.00 PBZ0403-2 5×100μl 108cfu/μgDNA 500.00甘油保存菌株PBZ0403-3 0.5ml 100.00说明:一种常用于质粒克隆的菌株。
E.coli DH5a 在使用pUC 系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。
可用于蓝白斑筛选鉴别重组菌株。
基因型:F -,φ80d lacZ ΔM15,Δ(lac ZYA -arg F)U169, deoR,recA1,endA1,hsdR17(r k -,m k +),phoA , supE44,λ-,thi-1,gyrA96,relA1 保存:所有受体菌均为甘油保存。
-70℃可长期保存20℃可保存年感受态为70℃保说明:该菌株用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET 系列)的基因。
T7噬菌体RNA 聚合酶位于λ 噬菌体DE3区,该区整合于BL21的染色体上。
该菌适合表达非毒性蛋白。
基因型:F -omp T hsd S B (r B -m B -)gal dcm (DE3)保存:所有受体菌均为甘油保存。
TOP10感受态细胞说明书

TOP10 感受态细胞说明书1.感受态细胞必须用干冰运输,融化后的感受态细胞不能再冻结储存。
如果用户收到感受态细胞后发现泡沫箱中的干冰已经挥发殆尽,应予以拒收。
2.收到感受态细胞后应立即储存在-70℃以下的冰箱中,在6个月内使用不影响转化效率;感受态细胞不可反复冻融,不要与限制性内切酶等经常使用的分子生物学试剂放在一起,避免因温度的波动而影响的效率。
技术支持杭州新景生物试剂开发有限公司研发部:E-mail:technical@,电话:400-0099-857。
产品介绍本公司生产的TOP10感受态细胞是采用大肠杆菌TOP10菌株经特殊工艺处理得到的感受态细胞,可用DNA的化学转化。
经pUC19质粒检测,转化效率可达108cfu/μg。
每支感受态可以酌情分装使用,降低了实验的成本。
质量稳定,使用方便,质优价廉。
TOP10菌株介绍基因型:F- ,mcrAΔ(mrr-hsd RMS-mcrBC),φ80,lacZΔM15,△lacⅩ74,recA1,ara Δ139Δ(ara-leu)7697,galU/galK ,rps,(Str R) endA1,nupG。
特点:本菌株是一种常用于质粒克隆的菌株。
适用于高效的DNA克隆和质粒扩增,能保证高拷贝质粒的稳定遗传。
其φ80、lacZ△M15基因的产物可与pUC载体编码的β-半乳糖苷酶氨基端实现α互补,可用于蓝白斑筛选。
质量标准1. 使用1 ng pUC19 Plasmid质粒DNA转化100 µl Competent Cells DH5α测试,产生的菌落数>1×108 transformants/1µg pUC19 Plasmid 。
2. β-半乳糖苷酶、α-互补性的确认:对E.coli Competent Cells TOP10使用pUC19 DNA进行转化后,在含有100 µg/ml的Ampicillin、40µg/ml的X-Gal的L-琼脂平板培养基上,产生蓝色菌落。
感受态细胞制备及各种感受态的特点

感受态细胞制备制备感受态常用的方法是电击法和CaCl2制备法,以下介绍CaCl2制备法:1、可以从-80℃冰柜中,取出一支冻存菌株,于事先照过紫外的超净台中,用无菌的接种环轻轻蘸取菌种后,在无抗平板(由于Rocetta含有氯霉素抗性,需要涂布在氯霉素抗性的平板,后面的都是如此)上划线,并将菌种迅速放回-80℃保存,在划线板上做好相应标记,于37℃培养过夜。
2、从37℃培养过夜的新鲜平板上挑取一个单克隆,接种于2mlEP管中,37℃,220rpm震荡培养约6个小时至对数生长中后期;将该菌悬液以1:100的比例接种于50mlLB液体培养基(2瓶)中,37℃振荡培养2.5小时至OD600=0.5。
注意:接种比例不得大于1:10。
3、在无菌条件下将细菌转移到一个无菌、预冷的离心管(50ml)中,在冰上放置5~10min;注意:划板、接种为了防止意外发生最好多划一块平板和多接一根试管,划板、接种、转接均要严格按照无菌操作。
4、4℃5000g离心5分钟。
用预冷的去离子水洗涤沉淀,4℃5000g离心5分钟;Note:此步主要是为了洗去培养基中的盐等5、沉淀加入2ml预冷的0.05mol/LCaCl2-15%甘油混合溶液,轻吹散,冰浴5分钟,4℃5000g离心5分钟;6、沉淀加入2ml预冷的0.05mol/LCaCl2-15%甘油混合溶液,轻吹散,即成为感受态细胞悬液。
分装成50~100μl的小份,贮存于-70℃可保存半年。
含15%甘油的0.05mol/LCaCl2制备方法:称取0.28gCaCl2(无水,分析纯),溶于50ml重蒸水中,加入15ml甘油,定容至100ml,高压灭菌。
感受态细胞的特征感受态:通过特殊处理使细胞处于能够吸收外源DNA的状态。
感受态细胞的特征:(1)细胞表面暴露出一些可接受外来DNA的位点(以溶菌酶处理,可促使受体细胞的接受位点充分暴露)。
(2)细胞膜通透性增加(用钙离子处理,可使膜通透性增加,使DNA直接穿过质膜进入细胞)。
大肠杆菌感受态细胞的几种制备方法

关于感受态细胞(Competent cells)常态的细胞不能摄入外部溶液中的DNA,,所以要转化质粒DNA进入大肠杆菌必须首先制备感受态的大肠杆菌细胞。
受体细胞经过一些特殊方法(如:CaCl,RuCl等化学试剂法)的处理后,细胞膜的通透性发生变化,成为能容许多有外源DNA的载体分子通过的感受态细胞(c ompetent cell) 。
转化,是将异源DNA分子引入一细胞株系,使受体细胞获得新的遗传性状的一种手段,是基因工程等研究领域的基本实验技术。
进入细胞的DNA分子通过复制表达,才能实现遗传信息的转移,使受体细胞出现新的遗传性状。
转化过程所用的受体细胞一般是限制-修饰系统缺陷的变异株,即不含限制性内切酶和甲基化酶的突变株。
α-互补现象:因为许多载体都带有一个LacZ基因的调控序列和头146个氨基酸的编码信息,编码α-互补肽,该肽段能与宿主编码的缺陷型β-半乳糖苷酶实现基因内互补(α-互补)。
当这种载体转入可编码?-半乳糖苷酶C端部分序列的宿主细胞中时,在异丙基-?-D硫代半乳糖苷(I PTG)的诱导下,宿主可同时合成这两种肽段,虽然它们各自都没有酶活性,但它们可以融为一体形成具有酶活性的蛋白质。
所以称这种现象为α-互补现象。
由互补产生的α-半乳糖苷酶(Lac Z)能够作用于生色底物5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)而产生蓝色的菌落,所以利用这个特点,在载体的该基因编码序列之间人工放入一个多克隆位点,当插入一个外源DN A片段时,会造成LacZ(α)基因的失活,破坏α-互补作用,就不能产生具有活性的酶。
所以,有重组质粒的菌落为白色,而没有重组质粒的菌落为蓝色。
方法一:细菌转化的方法多以Mendel和Higa(1970)的发现为基础,其基本方法是用冰预冷的Ca Cl2或多种2价阳离子等处理细菌,使之进入感受态得以转化。
用CaCl2制备新鲜或冷冻的大肠杆菌感受态细胞,常用于成批制备感受态细菌。
感受态细胞

感受态细胞1感受态细胞:细菌处于0℃,CaCl2 的低渗溶液中,菌细胞膨胀成球形,转化混合物中的DNA 形成抗DNase 的羟基-钙磷酸复合物粘附于细胞表面,经42℃短时间热冲击处理,促使细胞吸收DNA 复合物。
钙离子的作用是结合于细胞膜上,是细胞膜呈现一种液晶态。
在冷热变化刺激下液晶态的细胞膜表面会产生裂隙,使外源DNA进入。
所谓的感受态,即指受体(或者宿主)最易接受外源DNA片段并实现其转化的一种生理状态,它是由受体菌的遗传性状所决定的,同时也受菌龄、外界环境因子的影响。
将快速生长中的大肠杆菌(对数生长期)置于经低温预处理的低渗氯化钙溶液中,便会造成细胞膨胀(形成原生质球),使细菌处于容易吸收外源DNA的状态。
感受态细胞):受体细胞经过一些特殊方法(如:CaCl,RuCl等化学试剂法)的处理后,细胞膜的通透性发生变化,成为能容许多有外源DNA的载体分子通过的感受态细胞。
2分子克隆中重组体筛选和鉴定的原理方法:重组克隆的初步筛选克隆的筛选可以根据载体类型、受体细胞特性的变化、外源DNA 分子本身的特性,采用不同的方法。
主要有遗传学检测、物理特性检测、分子杂交以及免疫学分析等。
从初步筛选直到分子杂交,进一步到DNA测序和基于蛋白质功能的分析,使得对克隆的检测逐步深入、精确。
.1 重组克隆的遗传学检测遗传学检测方法是重组子筛选过程中最初的检测步骤。
重组子的表征来源于载体所携带的标记和重组子结构特性。
根据这两类表征对重组子进行初步筛选。
(1) 抗药性筛选这是利用载体DNA上组装的抗药性选择标记进行筛选的方法。
常用的抗生素筛选剂:氨苄青霉素(ampicillin,Ap或Amp);氯霉素(chloramphenicol,Cm 或Cmp);卡那霉素(kanamycin,Kn或Kan);四环素(tetracymic,T c或Tet);链霉素(2)插入失活筛选法检测克隆载体携带有外源DNA的通常方法是插入失活。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5
2011年7月
⑵ 质粒DNA的质量和浓度 A. 用于转化的质粒DNA应主要是超螺旋态的,转化率 与外源DNA的浓度在一定范围内成正比; B. 对于以质粒为载体的重组分子而言,分子量大的转 化效率低; C. 重组DNA分子的构型与转化效率也密切相关,环状 重组质粒的转化率较分子量相同的线性重组质粒高10100倍。
3
9)向管内加入800ul的无抗LB培养液,37 ℃培养 45分钟。
2011年7月
10)取适量体积的转化细胞转移到含有适当抗生素的 LB固体平板上,用灭过菌的玻璃棒涂布均匀。室温 放置几分钟。
2011年7月
37 ℃培养45分钟
热击转化实验回顾
37 ℃培养45分钟
2011年7月
谢谢大家! 祝:身体健康, 学习愉快!
6
原理:受体细胞经过一些特殊方法(如:电击法, CaCl2等化学试剂法)处理后,细胞膜的通透性发生 变化,能容许外源DNA分子通过。
感受态细胞
2011年7月
所谓的感受态,即指受体(或者宿主)细 胞最易接受外源DNA片段并实现其转化的一种 生理状态,它是由受体菌的遗传性状所决定 的,同时也受菌龄、外界环境因子的影响。
3.1 实验材料与仪器准备
E. coli DH5α菌;LB液体培养基; LB固体培养基;100 mmol/L CaCl2溶液。
2011年7月
高速冷冻离心机
恒温摇床
制冰机
3.2 CaCl2法制备感受态细胞及热击转化 2011年7月
1)从 LB 平板上挑取新活化的E. coli DH5α单菌落, 接种于2.5mL LB液体培养基中,37℃下振荡培养 12h 左右。
42℃热击
恒温水浴 CaCl2感
107
受态 一般克隆
4.感受态细胞制备及转化中的影响因素
2011年7月
⑴ 细胞的生长状态和密度 A. 最好从-70℃或-20℃甘油保存的菌种中直接转接 用于制备感受态细胞的菌液。 B. 细胞生长密度以每毫升培养液中的细胞数在 5×107个左右为佳。 C. 受体细胞一般应是限制-修饰系统缺陷的突变株, 即不含限制性内切酶和甲基化酶的突变株。
可排除dam,dcm甲基化的影响。
2011年7月
3. 感受态细胞的制备及转化
2011年7月
3.1 实验材料与仪器准备 ; 3.2 CaCl2法制备感受态细胞及热击转化; 3.3 电转感受态细胞的制备及电击转化; 3.4 化学法与物理法的比较。
5)4℃、4500g离心5分钟收集细胞后,加2 ml 100mM
的冰冷CaCl2溶液轻轻悬浮细胞,冰上放置几分钟,即 成感受态细胞悬液。
2011年7月
6)感受态细胞分装成200μl的小份,暂且不用的贮 存于-70℃可保存半年,取其中一份进行转化。
2011年7月
2)将培养好的菌悬液以 1: 100 -1: 50 的比例接种于 100mL LB液体培养基中,37℃振荡培养 3-6h 至 OD600为0.5-0.6。
3)将菌液在冰水浴中冷却15分钟,再转移至两个预 冷的50mL离心管中,4 ℃、4500g离心15分钟,收集 菌体。
2011年7月
化学转化法操作简单,不需要特殊设备,转化效率足 以满足一般克隆实验的需要,故使用范围非常广。
两种方法的比较
2011年7月
方法 转化条件 仪器要求 感受态 效率、应用
电击法 2.5 千伏电击 电转仪 电转感108电转杯 受态 基因化学法 CaCl2
11)倒置平板于37 ℃培养12-16个小时,观察菌斑 并鉴定。
2011年7月
3.3 电转感受态细胞的制备及电转化
2011年7月
1)从 LB 平板上挑取新活化的E. coli DH5α单菌 落,接种于2.5mL LB液体培养基中,37℃下振荡培 养 12h 左右。
4
12)立即添加300μl 的LB至电穿孔容器中,轻轻 混匀后转移至干净的EP管中;
13)37 ℃下孵育40-60分钟,使细胞恢复生长;
14)转移细胞至适当的选择培养基上培养。
2011年7月
电转感受态细胞的制备及电转化示意图
培养菌种
2011年7月
扩大培养 至对数期
7)向转化管中加入质粒DNA(不超过10ul),轻 度摇晃混合后于冰上放置30分钟。
2011年7月
8)将上述混合物转移到42℃的水浴锅中,热击90 秒 (不要摇动试管),然后将试管迅速转移到冰浴, 冷却1-2分钟。
2011年7月
目的基因的背景表达水平,但不干扰目的蛋白的 表达。该菌适合表达毒性蛋白和非毒性蛋白。
2. 常用的感受态菌株
4)JM109菌株 适合重组体菌株鉴别。
5)TOP10菌株 该菌株适用于高效的DNA克隆和质粒扩增,
能保证高拷贝质粒的稳定遗传。 6)HB101菌株
该菌株遗传性能稳定,使用方便,适用于各 种基因重组实验。 7)JM110或 SCS110
⑶ 试剂的质量
2011年7月
所用的CaCl2等试剂均需是最高纯度的,并用最纯 净的水配制,最好分装保存于4℃。
⑷ 防止杂菌和杂DNA的污染
整个操作过程均应在无菌条件下进行,所用器皿, 如离心管,移液枪头等最好是新的,并经高压灭菌处 理。
⑸ 整个操作均需在冰上进行,不能离开冰浴,否则细 胞转化率将会降低。
8)将 1-10μl DNA加入电转感受态细胞中,冰上培 育约5分钟 ;
9)转移DNA/细胞混合物至冷却后的2mm电穿孔容 器中,排除气泡;
10)加载P1000,准备好300μl 无抗LB ;
11)对电穿孔容器进行脉冲(200 欧姆,25μFd, 2.5 千伏);
2011年7月
2011年7月
4)小心弃去上清液,用50mL灭菌的冰水重悬菌 体,4℃、4500g离心15分钟,收集菌体;
5)照上面步骤重复2次,小心弃去上清液 ; 6)用10%甘油重悬浮细胞至最终体积为2-3ml ; 7) 将细胞按100μl等份装入微量离心管,于-80℃
保存。
冰浴15分钟
抗性平板筛 选阳性克隆
温育1h 电击
离心
漂洗离心 重悬分装
感受态 DNA
3.4 两种方法的比较
电击法: 使用瞬时高压电(数千伏特)处理细胞悬 液,微生物细胞膜在高压电的作用下发生去极化, 产生微孔,悬液中溶解的核酸即可通过细胞膜上的 孔洞进入细胞内部。
质粒DNA热击转化感受态大肠杆菌示意图
质粒DNA热击转化感受态大肠杆菌示意图
2011年7月
0℃
CaCl2低渗
冰浴 2-3分钟 热击 42℃90s
感受态
质粒DNA
冰浴
羟基-磷酸钙复合物
2
3)将100mL菌液转移至两个50mL离心管内,4℃、 4500g离心5分钟,收集菌体。
2011年7月
4)加入30mL,100mM的冰冷CaCl2溶液,摇荡重 悬细胞,冰浴30分钟。
2011年7月
冰浴30分钟
加入30mL冰冷的 100mM CaCl2,重 悬细胞
2)将培养好的菌悬液以 1: 100-1: 50 的比例接种于 100mL LB液体培养基中,37℃振荡培养 2-3h 至 OD600为0.4左右。
2011年7月
取1 mL 菌液加入到 100mL 新鲜的LB液 体培养基中。
2011年7月
化学法:使用低渗溶液处理细胞悬液(0.1M CaCl2),微生物细胞膜结构会发生一些变化,使 得细胞在热激时(42℃,90s)变得很容易从溶液 中摄取DNA。
做电击转化时,悬液中有近70%的细胞会因电击而死 亡,但是这种方法很直接,转化效率很生物转化时一般都是电击。
1
2. 常用的H5a菌株 常用于质粒克隆,可用于蓝白斑筛选。
2)BL21(DE3) 菌株 该菌株用于高效表达克隆于含有噬菌体T7启
动子的表达载体(如pET系列)的基因。该菌适合 表达非毒性蛋白。
3)BL21(DE3) pLys菌株 PLysS含有表达T7溶菌酶的基因,能够降低
质粒DNA转化感受态大肠杆菌
何彰华 赢润生物技术
2011年7月24日
本节讨论内容
1 转化的概念及原理 2 常用的感受态菌株 3 感受态细胞的制备及转化 4 转化中的影响因素
2011年6月
1. 转化的概念及原理
2011年7月
概念:在基因克隆技术中,转化特指将质粒DNA或 以其为载体构建的重组DNA导入细菌体内,使之获 得新的遗传特性的一种方法。它是微生物遗传、分 子遗传、基因工程等研究领域的基本实验技术之 一。
