盐酸决奈达隆片中文说明书
100个还未被仿制的进口独家产品

100个还未被仿制的进口独家产品
2015-03-06医药代表
本期精选了100个还没有仿制品的进口独家产品,并通过咸达数据(V3.0)确认了国内申请仿制最快的企业和进度,个个高大上。
亲爱的民族制药企业,你们如果永远都在研究各部委的政策,钻研招标的空子,忽略药物的本质,中国制药和中国足球还有什么区别!
可喜的是,总有一些企业,能给人些许安慰。
手机药筛利用咸达数据3.0
黄金版,检索出部分产品国内最快仿制进度情况,发现我们me(山) too(寨)的节奏还是挺快的,中国制药还有希望。
这些进度最快的,最有希望将来成为首仿,如果您关心医药股的话,这些家的审评进度您可盯紧了哦!假如您错过了甲磺酸阿帕替尼上市之前买入恒瑞医药、错过了复格列汀批临床前入手复星医药,难道您还要错过下面的品种吗?。
盐酸决奈达隆片说明书

核准日期:2021年12月20日修改日期:2021年12月25日盐酸决奈达隆片说明书请仔细阅读说明书并在医师指导下使用警告:在失代偿性心力衰竭或永久性心房颤动的患者中,盐酸决奈达隆片使死亡、卒中和心力衰竭的风险增加。
在症状性心力衰竭和近期有需要住院的心衰失代偿或纽约心脏学会(NYHA)IV级心力衰竭的患者中,盐酸决奈达隆片使死亡风险加倍。
盐酸决奈达隆片禁用于近期心衰失代偿需要住院或NYHA IV级的症状性心力衰竭患者。
在永久性心房颤动患者中,盐酸决奈达隆片使死亡、卒中和因心力衰竭住院的风险加倍。
盐酸决奈达隆片禁用于不打算或无法转复为正常窦性心律的心房颤动(AF)患者。
[参见禁忌和临床试验]【药品名称】通用名称:盐酸决奈达隆片英文名称:Dronedarone Hydrochloride Tablets汉语拼音:Yansuan Juenaidalong Pian【成份】本品主要成份为盐酸决奈达隆化学名称:N-{2-丁基-3- [4-(3-二丁基氨基丙氧基)苯甲酰基]苯并呋喃-5-基}甲基磺酰胺盐酸盐化学结构式:分子式:C31H44N2O5S·HCl分子量:593.2【性状】本品为白色薄膜包衣椭圆形片剂,一面刻有“4142”,另一面刻有双波标记。
除去薄膜衣后显白色。
【适应症】本品用于有阵发性或持续性心房颤动病史的窦性心律患者,减少因心房颤动(AF)住院的风险。
【规格】400 mg(按C31H44N2O5S计)【用法用量】成年人的推荐剂量为每次1片(400 mg),每日2次。
早餐和晚餐时各服一片。
开始服用本品前,必须停用Ⅰ类、Ⅲ类抗心律失常药物(例如:胺碘酮、氟卡胺、普罗帕酮、奎尼丁、丙吡胺、多非利特、索他洛尔)和CYP 3A的强效抑制剂类药物(例如:酮康唑)[参见禁忌]。
【不良反应】1.在【注意事项】部分详细说明了下列安全性问题:新发心衰或心衰恶化;肝损伤;服用非保钾类利尿剂引起低钾血症和低镁血症的患者;QT间期延长。
国家药品编码本位码数据(进口药品)截至2017年6月30日

181 H20130099 182 H20130100 183 H20130107 184 H20130108 185 H20130109 186 H20130110 187 H20130111 188 H20130112 189 H20130113 190 H20130114 191 H20130124 192 H20130125 193 H20130126 194 H20130127 195 H20130128 196 H20130129 197 H20130131 198 H20130132 199 H20130133 200 H20130134 201 H20130135 202 H20130140 203 H20130141 204 H20130142 205 H20130143 206 H20130144 207 H20130145 208 H20130146 209 H20130147 210 H20130148 211 H20130151
盐酸胺碘酮注射液 盐酸雷洛昔芬片 盐酸雷洛昔芬片 注射用盐酸头孢吡肟 注射用盐酸头孢吡肟 注射用盐酸头孢吡肟 注射用盐酸头孢吡肟 氯雷他定 拉莫三嗪分散片 丁溴东莨菪碱片 丁溴东莨菪碱片 注射用六氟化硫微泡 注射用六氟化硫微泡 注射用胸腺法新 碳酸钙 拉坦前列素滴眼液 磷酸雌莫司汀胶囊 醋酸甲羟孕酮注射液 复方氨基酸注射液 盐酸美金刚片 瑞格列奈二甲双胍片 (II) 瑞格列奈二甲双胍片 (I) 卡泊三醇软膏 丁丙诺啡透皮贴剂 丁丙诺啡透皮贴剂 丁丙诺啡透皮贴剂 硫酸氢氯吡格雷 盐酸羟甲唑啉 恩曲他滨替诺福韦片 硫酸氢氯吡格雷 氟他胺片
国产盐酸决奈达隆片治疗阵发性持续性房颤的成本-效果分析

国产盐酸决奈达隆片治疗阵发性/持续性房颤的成本-效果分析高胜男、李雪靖2,刘国强>(1.河北省药物与卫生技术综合评估学会,河北石家庄050052; 2.河北医科大学第三医院药剂科,河北石家庄050052)摘要:目的评价阵发性/持续性心房颤动(atrial fibrillation, A F )患者两种治疗方案的成本-效果分析,为医保决策及临 床使用提供参考依据。
方法基于卫生体系角度,利用Treeage Pro 2011软件构建为期20年的Markov 模型,进行如下两种 治疗方案成本-效果分析:①盐酸决奈达隆片:②盐酸胺碘酮片。
效果指标采用质量调整生命年(quality asjusted life years,Q A L Y s),成本数据来源于中国药学会数据,转移概率和效用值来源于文献。
结果基础分析结果显示,国产盐酸决奈达隆片 较盐酸胺碘酮片成本高(385 158.73元对377 863.85元),但效果更优(12.41 QALYs 对11.84 QALYs),増量成本效益比=12 798.24元/Q A L Y ,远小于人均GDP 。
敏感性分析结果表明,对结果影响最大的因素是心衰效用值、缺血性脑卒中效用值、心衰治疗费用;在支付意愿值为3倍人均GDP 时,盐酸决奈达隆片具有经济性优势的概率为94.60%,敏感性分析支持基础 分析结果。
结论国产盐酸决奈达隆片治疗阵发性/持续性A F 具有经济性优势。
关键词:决奈达隆:胺碘酮;心房颤动;成本-效果分析中图分类号:R956文献标志码: A文章编号:1672-9188(2021)03-0202-06DOI : 10.13683/j.wph.2021.03.010Cost-effectiveness analysis of dronedarone in the treatment ofparoxysmal/persistent atrial fibrillationGAO Shengnan1, LI Xuejing2, LIU Guoqiang2*(/. Hebei Medicine and Health Technology Assessment Association, Shijiazhuang 050052, Hebei Province, China;2. Department o f P harmacy, the Third Hospital o f H ebei Medical University, Shijiazhuang 050052, Hebei Province, China)Abstract: Objective To evaluate the cost-effectiveness of two treatment regimens for patients with paroxysmal/persistent atrial fibrillation, and to provide a reference for medical insurance decision-making and clinical use. Methods Based on the health system perspective, a 20-year Markov model was constructed using Treeage Pro 2011 software to conduct cost-effectiveness analysis. The effect indicators were quality-adjusted life years. The cost data came from Chinese pharmaceutical, and the transition probability and utility value came from literature. Results The basic analysis results showed that compared with amiodarone , the dronedarone's cost was higher (385 158.73 yuan vs 377 863.85 yuan), and the effect was better (12.41 QALYs vs 11.84 QALYs), the incremental cost effectiveness ratio was 12 798.24 yuan/QALY, far less than 1 time GDP. The results of sensitivity analysis showed that the factors that had the greater influence on the results were the utility value of heart failure , the utility value of ischemic stroke, and the cost of heart failure. When willing-to-pay was 3 times GDP, the probability that dronedarone would have an economic advantage is 94.60%, the sensitivity analysis supports the basic analysis results. Conclusion Domestic dronedarone hydrochloride tablets have economic advantages in the treatment of paroxysmal/persistent heart disease.Key words: dronedarone; amiodarone; atrial fibrillation; cost-effectiveness analysis收稿日期:2020-12-01作者简介:高胜男,硕士,研究方向:药物经济学、卫生技术评估。
心血管疾病药物治疗新进展PPT课件

RUTHERFORD-2研究由329名杂合型家族性 高胆固醇血症患者参与,试验数据显示,这款 PCSK9抑制剂使LDL胆固醇下降59%至66%
企业名称 辉瑞
阿斯利康 赛诺菲
拜耳 罗氏 诺华
礼来
跨国药企在华新上市品种(2012-2013)
商品名 泰阁
通用名 替加环素
主要适应证 抗生素
企业名称 商品名
4 默克
捷诺达
通用名
主要适应证
西格列汀/二甲双胍
2型糖尿病
艾乐妥
阿哌沙班
静脉血栓栓塞
诺科飞
泊沙康唑
预防曲霉菌念珠菌
赛可瑞 贝赋 任捷
倍林达
克唑替尼 凝血因子IX (重组)
抑郁症 HIV-1
尼欣那 诺维乐 拜唐苹(新规格) 雅美罗 赫赛汀(新适应证)
阿格列汀 司维拉姆 阿卡波糖 托珠单抗 曲妥珠单抗
2型糖尿病 慢性肾病 2型糖尿病 类风湿性关节炎 HER2阳性转移性胃癌
百时美施贵宝
强生
艾敏释 泰立沙 艾乐妥 施达赛 善思达
氟替卡松鼻喷剂 拉帕替尼 阿哌沙班 达沙替尼
棕榈酸帕利哌酮
中国批准时间
2013.12 2013.03
2013.02 2013.01 2012.11 2012.07
2012.05 2012.04
2011.09 2011.08 2011.04 2010.04
名称
曲前列尼尔注射液 利伐沙班片
达比加群酯胶囊
3 批准事项
批准进口 批准进口
血栓及中风
批准进口
适应症
肺动脉高压
这项研究人选307名他汀耐受的高胆固醇患者
相比,LDL胆固醇从基线值平均下降55%至76%, 与依泽替米贝相比,LDL胆固醇从基线值平均下降 33%至47%。
盐酸决奈达隆合成路线图解

O C4H9
OCOCH3 30
EtOH HCl
76%
57% NaBH4
H2SO4
O
HNO3
C4H9
O2N
31 O
O C4H9
32 O
H2N
O
THF MeSO2Cl CH3
H N S OO
CH3 O
46
78.5%
47
MeSO2Cl
H2N 48
OMe
Ac2O
AcHN 49
n-BuCHBrCOCl
OMe
AlCl3
· 150 ·
O
O
OH HBr/(CH2O)n
OH PPh3/CHCl3
OH
H3C 57
CH3
O2N 9
H2SO4
O2N
CH2Br
10
O2N 11
CH2 PPh3+ Br O
NH2OH NOH
O2N
NBS or NIS
OH
HC
n-Bu
1.Cl 2.Et3N
CH3
H3C 58
CH3
O2N
H O
N H
(上海医药工业研究院,上海 200437)
HE Xiaoqing, WU Taizhi, ZHANG Fuli*, XIE Meihua
决奈达隆临床应用的中国专家建议(2022版)解读

一、决奈达隆的分子结构和药理学特点
▲决奈达隆的分子式为C31H44N2O5S,相对分子质量为593.22,其化学名为N-[2-丁
基-3-[4-[3-(二丁氨基)丙氧基]苯基]-5-苯并呋喃基]-甲烷磺酰胺盐酸盐,与 胺碘酮有相似的化学结构,二者同属苯并呋喃衍生物;不同之处在于胺碘酮分子结构 的苯环上含有两个碘原子,而决奈达隆的结构上不含碘,且增加了甲磺酰胺基团。
三、临床应用建议
▲1.适应证和禁忌证:基于上述临床研究证据,结合国内外指南,建议决奈达隆主要用
于阵发性或持续性房颤/房扑病史的窦性心律患者,减少房颤/房扑的复发,并可降低再 住院风险。具体建议如下。 (1)推荐决奈达隆用于预防阵发性房颤的复发和持续性房颤/房扑患者恢复窦性心律后 的维持,患者无严重基础心脏疾病且左心室收缩功能正常,或伴有下列情况 ●射血分数保留的心力衰竭 ●轻度的非病理性左心室肥厚(超声室壁厚度<13mm) ●稳定性冠心病 ●瓣膜性心脏病
解读 2022-03-02
1
决奈达隆的分子结构和药理学特点
主要
12
内容
13
14
临床研究证据 临床应用建议 特殊人群用药
15
药物相互作用
概述
▲决奈达隆是Ⅲ类抗心律失常药物,一种脱碘的苯并呋喃衍生物,其抗心律失常作用机
制与胺碘酮类似,但不良反应明显减少。决奈达隆主要用于阵发性或持续性心房颤动(房 颤)/心房扑动(房扑)患者的节律控制,减少房颤/房扑的复发,并降低再住院风险。不 建议决奈达隆用于长程持续性房颤或永久性房颤,以及射血分数减低的房扑或房颤患者。 在治疗过程中应该规律监测心电图、电解质和肝肾功能,并注意与其他药物的相互作用。
二、临床研究证据
▲2.阵发性或持续性房颤/房扑患者改善预后的研究:ATHENA研究入组4628例阵发性或持
盐酸二甲双胍缓释片(Ⅲ)(奈达)详细说明书

盐酸二甲双胍缓释片(Ⅲ)(奈达)详细说明书警告乳酸酸中毒:上市后二甲双胍相关的乳酸酸中毒病例已导致死亡、低体温、低血压和顽固性缓慢型心律失常。
二甲双胍相关的乳酸酸中毒发病往往是隐蔽的,仅伴有一些非特征性的症状例如不适、肌痛、呼吸困难、嗜睡和腹痛。
二甲双胍相关乳酸酸中毒的特征有血乳酸水平升高(5 mmol/L)、阴离子间隙酸中毒(无需酮尿或酮血症)、乳酸/丙酮酸比值升高,血浆二甲双胍的浓度通常5 μg/mL。
二甲双胍相关的乳酸酸中毒风险因素包括肾损伤、合并用药(如碳酸肝酶抑制剂托吡酯)、年龄在65岁及以上、使用造影剂的放射检查、手术和其他操作、缺氧状态(如急性充血性心衰)、饮酒过量、肝损伤。
提供了对于高风险人群降低二甲双胍相关乳酸酸中毒风险的方法[见用法用量、禁忌、注意事项]。
如果怀疑发生二甲双胍相关的乳酸酸中毒,应立即停止服用本品并开始住院的一般性支持治疗,建议立即进行血液透析[见注意事项]。
一般注意事项乳酸酸中毒:上市后已经有二甲双胍相关的乳酸酸中毒的报告,包含死亡病例。
这些患者发病隐蔽并仅伴有非特异性症状例如不适、肌痛、腹痛、呼吸窘迫、嗜睡,严重的可能发生低血压和顽固性缓慢型心律失常。
二甲双胍相关乳酸酸中毒的特征有血乳酸水平升高(5 mmol/L)、血酸碱度降低(酮尿或酮血症)、阴离子间隙酸中毒(无需酮尿或酮血症)、乳酸/丙酮酸比值升高,血浆二甲双胍的浓度通常5 µg/mL。
二甲双胍能降低肝脏对乳酸的摄入,从而增加血液中乳酸的含量,增加乳酸酸中毒的风险,尤其是高风险的患者。
如果怀疑有与二甲双胍相关的乳酸酸中毒,应立即开始住院的一般性支持治疗,同时立即停止服用本品。
服用本品并诊断或非常怀疑乳酸酸中毒的患者,推荐立即进行血液透析纠正酸中毒,排除蓄积的二甲双胍(血液动力学状况良好时盐酸二甲双胍可以170 mL/min的清除率进行透析),经过这样的治疗通常症状会迅速缓解和痊愈。
应对患者及其家人进行乳酸酸中毒症状的教育,如果症状发生指导他们立即停止服用本品并就医。
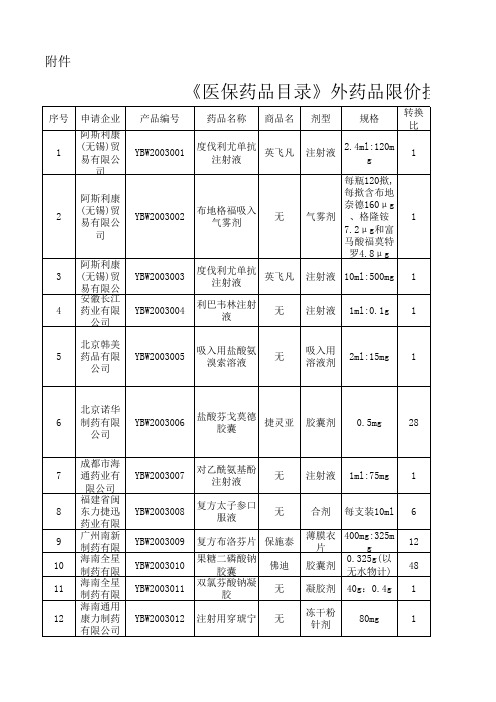
《医保药品目录》外药品限价挂网采购产品
6
卫材(苏 37 州)贸易有 YBW2003037
限公司
吡仑帕奈片
卫克泰
薄膜衣 片
2mg
28
卫材(苏 38 州)贸易有 YBW2003038
限公司
吡仑帕奈片
卫克泰
薄膜衣 片
4mg
28
长白山制 39 药股份有 YBW2003039 蒺藜皂苷胶囊 无
限公司
每粒装
胶囊剂
65mg(含蒺 藜皂苷提取
12
物56.7mg)
366.44
盒
复合膜袋
山东蓝汀制 药有限公司
990
Meiji
Seika
盒
硅塑复合膜
Pharma Co.,
153.02
Ltd.(汕头
经济特区明
上海复旦张
瓶
中硼硅玻璃管制 江生物医药 注射剂瓶 股份有限公
2566
司
盒
药用铝箔PVC硬 片
石家庄东方 药业股份有
限公司
30.19
石家庄东方
盒
空
药业股份有 39.98
阿替洛尔注射 液
替卓
注射液 10ml:5mg
1
25
山东蓝汀 制药有限
YBW2003025
可溶性纤维素 钠贴膏
雪立制
贴膏剂
8cm*8cm
1
26
山东蓝汀 制药有限
YBW2003026
可溶性纤维素 钠贴膏
雪立制
贴膏剂
8cm*12cm
1
27
山东蓝汀 制药有限
YBW2003027
可溶性纤维素 钠贴膏
雪立制
贴膏剂
力捷迅药业
有限公司
盒
决奈达隆疗效和安全性

依据基础心脏病选择房颤维持窦律 抗心律失常药物治疗策略
ESC AF Guidelines EHJ 2010
是否合并器质性心脏病的房颤维持窦律策略 消融与AAD
ESC AF Guidelines EHJ 2010
Dronedarone 具有抑制四种离子通道的电生理作用( Vaughan Williams 分 类) – 外向性离子流(Outward currents)
Ikr: 快速延迟整流钾电流阻滞 (III) Iks: 缓慢延迟整流钾电流阻滞(III) Ito: 瞬间外向钾电流阻滞 (III) Ik(Ach): 乙酰胆碱敏感性钾电流阻滞 (III)
Log-rank test results: p=0.0017
0 60 120 180 240 300 360
安慰剂
决奈达隆 400 mg bid
HR=0.80 p=0.16 95%CI = [0.59; 1.09]
决奈达隆显著延缓了房颤/房扑的首次复发
阵发性/持续性房颤患者
p=0.002
180
160
Multaq上市后肝功能损害报告
上市后至2009年7月,出现了数例肝功能损害的报告,其中2例因肝衰导 致肝脏移植 2例肝脏移植均为女性,70岁,用药前肝功能正常。发生在用决奈达隆后 4.5和6个月。2例均同时服用其他药物包括他汀 这些患者的肝功能损害与决奈达隆的关系尚未正式确立 管理当局的反应:
– 美国:2011年1月14日发布信件,“应定期检查肝酶,尤其在开始治 疗后6个月内”,还要求将决奈达隆潜在肝脏损伤的信息添加入说明 书的“警告与注意事项”和“不良反应”章节。
决奈达隆片说明书

决奈达隆的药效学及药代动力学研究概况

决奈达隆的药效学及药代动力学研究概况决奈达隆是一种有效的治疗房扑/房颤的药物,由于“去碘化”而无甲状腺和肺毒性,成为抗心律失常治疗的一个新型的更安全有效的武器。
更重要的是,决奈达隆能够显著降低房颤/房扑患者的发病率和死亡率,明显改善预后,成为抗心律失常药物中惟一一个存在独立于抗心律失常以外作用使患者获益的药物。
标签:决奈达隆;心房颤动;抗心律失常;药效学;药代动力学;决奈达隆是一种新型的Ⅲ类抗心律失常药物,由赛诺菲-安万特公司研究开发,2009年7月1日在美国批准上市(全球首次批准上市),用于急性心房纤颤(AF)与心房扑动症(AFL)。
临床研究结果显示,同时具有Ⅰ类,Ⅱ类,Ⅳ类抗心律失常药物的某些作用。
决奈达隆可抑制钠、钾、钙内流,还可拮抗α和β肾上腺素能受体。
与胺碘酮不同的是,决奈达隆很少影响甲状腺受体,治疗房颤和房扑,维持窦性心律的疗效好,患者的耐受性也较好,这一点已被大规模临床试验证实。
是美国治疗房颤和房扑使之迅速转复为窦性心律的最佳药物疗法。
目前我国临床常用的抗心律失常药物有许多潜在的毒副作用,如长期服用胺碘酮的病人中5~10%出现肺纤维化、心衰加重、甲状腺功能低下及肝毒性;伊布利特则口服生物利用度低,通常注射使用,也没有索他洛尔及普罗帕酮的毒性反应。
决奈达隆是胺碘酮的衍生物,由于它不含碘,亲脂性较低,因此其保持了胺碘酮的疗效,而没有胺碘酮的心外不良反应。
1决奈达隆的基本信息1.1化学结构决奈达隆盐酸盐化学名:N-[2-丁基-3-[4-[3-(二丁氨基)丙氧基]苯基]-5-苯并呋喃基]-甲烷磺酰胺盐酸盐化学结构式:1.2适应症决奈达隆是一种抗心律失常药物,适用于阵发性或持续性房颤或房扑患者、当前为窦性心律或需要复律的近期发生房颤或房扑并存在心血管病危险因素的患者,可减少上述患者的心血管病住院风险。
1.3用法用量口服。
对成人的唯一推荐剂量为每次一片(400mg),每日2次,于早、晚餐时服用。
【CN109908094A】盐酸决奈达隆片制备方法【专利】

( 12 )发明专利申请
(21)申请号 201910098709 .2
(22)申请日 2019 .01 .31
(71)申请人 山东希尔康泰药业有限公司 地址 272100 山东省济宁市兖州区新兖镇 民营工业园
(72)发明人 张存国 广国良 王贺
(74)专利代理机构 北京中济纬天专利代理有限 公司 11429
代理人 宋震
(51)Int .Cl . A61K 9/20(2006 .01) A61K 9/28(2006 .01) A61K 47/38(2006 .01) A61K 47/36(2006 .01) A61K 47/32(2006 .01)
( 54 )发明 名称 盐酸决奈达隆片制备方法
( 57 )摘要 本发明涉及药物制备领域,尤其是盐酸决奈
达隆 片制备方法。盐酸决 奈达隆 片制备方法 ,具 体步骤如下 :S1 :进行盐酸决 奈达隆 原料 和辅料 的 相容性试验 ;S2 :初步选择 制剂辅料 :S3 :原辅 料处理 :S4 :原辅料混合 :S5 :制粒 :S6 :颗粒干燥 : S7 :整粒 :S8:总混 :S9:压片:S10:包衣:S11 :内 包 :S12 :外包。本申 请中所 确定的 生产工艺能 较 好的体现其可行性和重现性 ;能够有效的进行药 片的制备,在加工制备的过程中能够较为准确的 对各阶段的中间产物进行及时的了解并控制,从 而保证整个生产过程的中间产物的质量,从而能 够保证最终产物满足加工要求。
发明内容 [0005] 本发明为解决上述技术问题之一所采用的技术方案是:盐酸决奈达隆片制备方 法,其特征在于:具体步骤如下:
S1:进行盐酸决奈达隆原料和辅料的相容性试验; 根据标准产品(即原研产品)中所涉及到的辅料,初步选择羟丙甲纤维素、淀粉、交联聚 维酮、泊洛沙姆188、乳糖、二氧化硅、硬脂酸镁、胃溶型薄膜包衣预混剂作为本制剂的辅料; 并进一步通过主药与辅料的相容性试验,确定本品的辅料种类; 其中盐酸决奈达隆与乳糖、淀粉、泊洛沙姆188、交联聚维酮分别按主药:辅料的质量份 数为1 :5的比 例混合 ,盐酸决奈达隆 与羟丙甲纤维素、二氧化硅、硬脂酸镁、胃溶型薄膜包衣 预混剂分别按主药:辅料的质量份数为20:1的比例混合均匀;取盐酸决奈达隆原料,按上述 比例加入各种辅料,混合均匀; 分别将上述混合均匀的样品分别于高湿(RH92 .5%)、高温(60℃)、光照(4500LX照度)条 件下放样,于5天、10天取样检测其性状、含量、有关物质,结果与0天结果进行对比 ; 原辅料相容性试验结果表明: 将主药盐酸决奈达隆与乳糖、淀粉、交联聚维酮、泊洛沙姆188、羟丙甲纤维素、二氧化 硅 、硬脂酸镁 、胃 溶型薄 膜包衣预混 剂等辅料单独混合 后进行影响因素试验 ,试验结果表 明 :决 奈达隆 性状、有关物 质均无明显变化 ;表明主药与各辅料的 相容性较好 ,可以 采 用上 述辅料进行处方筛选及工艺参数选择试验。 [0006] 所述盐酸决奈达隆原料药为白色或类白色粉末,其原料晶型为有晶型,在水中几 乎不溶 ,在甲醇 和乙 醇中易溶 ,盐酸决 奈达隆 水溶性较差 ,本品原料药的 粒径在75μm以 下 , 能满足制剂需求。 [0007] S2:初步选择制剂辅料: 根据相容性试验的结果,初步选择羟丙甲纤维素、淀粉、交联聚维酮、泊洛沙姆188、聚
《中国医药工业杂志》投稿攻略-发表论文

中国医药工业杂志一、发表说明本团队专注于论文写作与发表服务,擅长案例分析、编程仿真、图表绘制、理论分析等,论文写作、发表300起,具体价格信息联系:本团队并非任何杂志编辑中心,本中心是专业代发论文的机构,与各个杂志社具有长期良好的合作关系,也就是我们通过我们的特殊渠道将论文送给杂志社我们特定的内部人处理论文,保证较高的上稿率,以解决投稿人投稿后焦急的等待与石沉大海的结局。
通过我们可以较为容易达到发表的目地,当然,论文的质量也是重要的基础。
二、期刊简介如下本刊是我国医药工业领域内历史最长的技术刊物,重点报道我国医药工业生产和科技的成果和经验,及时介绍国际上制药新技术发展新动向,为提高生产科技水平和促进医药工业发展服务。
读者对象为医药、生物技术、化工等行业的生产、科研、教学、临床、经营管理人员。
本刊上国际上入选CA、BA和AA等著名检索系统,在CA上的收摘率在我国医药期刊中位于前列。
化学药物与合成技术R-甲氨喋呤的合成微生物药物与生物技术假蕈状芽孢杆菌纤溶酶基因的克隆与表达中药与天然药物支持向量机算法用于中药挥发油含油水体超滤通量的预测药物制剂羟喜树碱脂质体的制备及在犬体内的药动学研究药理与临床佛波酯及3-甲基胆蒽对Bhas42细胞系的诱癌和促癌作用药品分析与质控人唾液中富组蛋白5的HPLC法测定综述与专论口服脉冲控释给药系统的释药机制及其应用实验技术光纤药物溶出度过程分析仪的应用药物合成路线图解醋酸乌利司他合成路线图解管理与信息中国医药产业的机遇、挑战及相应对策化学药物与合成技术富马酸泰诺福韦酯的合成微生物药物与生物技术仙人掌多糖的双酶法提取及含量测定的优化药物制剂叔丁醇-水共溶剂体系冷冻干燥法制备紫杉醇白蛋白亚微粒药理与临床盐酸左氧氟沙星滴眼液在兔眼房水内的药动学药品分析与质控大鼠胆汁中人参皂苷和淫羊藿黄酮苷的HPLC-UV/ELSD法测定综述与专论黏膜疫苗传递系统的研究进展药物合成路线图解替卡格雷合成路线图解管理与信息2010年全国医药工业经济运行情况分析化学药物与合成技术盐酸决奈达隆的合成微生物药物与生物技术大鼠肠内菌转化间尼索地平的代谢产物中药与天然药物提取物纯度对吴茱萸碱和吴茱萸次碱溶解度与表观分配系数的影响药物制剂川陈皮素温敏型鼻用原位凝胶体外释药行为研究药理与临床氨麻苯美片在健康人体内药动学和生物等效性药品分析与质控头孢妥仑匹酯中有关物质的LC-MS~n分析综述与专论壳聚糖及其衍生物在眼部给药系统中的研究进展管理与信息新药价格管理对医药技术创新的影响化学药物与合成技术替加环素的合成微生物药物与生物技术埃坡霉素高产菌株的选育及发酵培养基的优化中药与天然药物中国沙棘中一个新的黄酮醇苷药物制剂干粉吸入剂空气动力学分散模型的建立和验证药品分析与质控中成药中违禁添加化学止咳平喘药的HPLC-DAD法检测综述与专论注射用微乳的研究进展药物合成路线图解埃索美拉唑合成路线图解管理与信息临床药动学研究中药物代谢酶多态性问题与新药注册盐酸乙氟利嗪的合成苹果酸阿莫曲坦的合成酒石酸拉索昔芬的合成化学药物与合成技术磷酸西他列汀的合成微生物药物与生物技术截短型HlNl神经氨酸酶基因的克隆及其在毕赤酵母中的表达药物制剂Kollicoat~ SR30D在盐酸青藤碱微丸型缓释片中的应用药理与临床硝苯地平缓释胶囊的人体药动学和生物等效性药品分析与质控人血浆中扎托布洛芬的LC-MS/MS法测定综述与专论新药开发中药物的盐型选择管理与信息制药企业常用消毒剂消毒效果验证化学药物与合成技术盐酸阿罗洛尔的合成微生物药物与生物技术氧化葡萄糖酸杆菌实时定量PCR检测方法的建立与应用药物制剂芦丁在Caco-2细胞模型中吸收和外排机制的研究药理与临床新型芳烷酮哌嗪衍生物YX0611-1对坐骨神经分支选择性损伤大鼠的镇痛作用药品分析与质控静脉注射蟾毒它灵和华蟾毒它灵后大鼠胆汁中代谢产物的UPLC-UV-MS法分析综述与专论海洋微生物实验室培养药物合成路线图解达比加群酯合成路线图解管理与信息中美新药研发管理系统协调性分析化学药物与合成技术非达司他的合成微生物药物与生物技术大鼠LC3蛋白的原核表达及多克隆抗体的制备药物制剂溶菌酶分子印迹微球的制备与评价药理与临床人中性粒细胞肽HNP1生物黏附性能的体外评价药品分析与质控连花清瘟胶囊中9种成分的LC-MS/MS-离子扫描切换法测定综述与专论疫苗黏膜输送系统的研究进展实验技术正交试验方差分析的Excel通用计算与应用药物合成路线图解吉非替尼合成路线图解管理与信息中国医药产业的低碳转型化学药物与合成技术氨磺必利的合成微生物药物与生物技术酶解条件对透明质酸提取及其分子量分布的影响中药与天然药物均匀设计法优化大孔树脂纯化无患子皂苷的工艺药物制剂星点设计-效应面法优化普伦斯特磷脂复合物的制备方法药理与临床右旋兰索拉唑双相释放胶囊在Beagle犬体内的药动学研究药品分析与质控手性固定相NP-HPLC法拆分比卡鲁胺对映体综述与专论喹诺酮抗HIV活性及其构效关系的研究进展药物合成路线图解阿加曲班-水合物合成路线图解管理与信息中美罕用药特殊注册审评制度的比较研究化学药物与合成技术盐酸决奈达隆的合成微生物药物与生物技术辅酶Q10的纯化药物制剂热熔挤出技术制备普罗布考固体分散体及其大鼠体内药动学研究药理与临床贝母素甲在家兔体内的药动学药品分析与质控木香药材水提液的HPLC指纹图谱综述与专论自微乳释药系统研究进展药物合成路线图解帕拉米韦合成路线图解管理与信息医药利益集团对基本药物可及性影响的研究化学药物与合成技术安贝生坦的合成其它《制剂技术大全》介绍化学药物与合成技术他克林的合成其它表达石竹黄酮糖基转移酶的酿酒酵母用于全细胞生物催化化学药物与合成技术3-(2,3-二氢苯并呋喃-5-基)丙酸的合成其它廉价培养基上采绒革盖菌MTCC138产漆酶的动力学研究微生物药物与生物技术重组毕赤酵母工程菌合成木聚糖酶的条件优化药物制剂戊二醛一步固化法制备氟尿嘧啶壳聚糖微球药品分析与质控聚苯乙烯磺酸钠树脂中的残留单体苯乙烯的GC-MS法测定其它热烈祝贺我刊编委中国科学院上海药物研究所丁健所长当选中国工程院2009年院士药品分析与质控盐酸美金刚胶囊的丹磺酰氯柱前衍生化-HPLC法测定其它硫氰酸铵与碘酸对芳烃硫氰化的简便方法药品分析与质控^18F-FLT的标记前体Nosyl-FLT的HPLC-ELSD法测定其它聚乙二醇作溶剂合成N-取代酰亚胺药品分析与质控大鼠血浆中毛萼乙素的HPLC测定制药装备与包装压敏胶骨架型透皮给药系统的生产工艺及设备概况综述与专论白蛋白作为注射用难溶性药物载体的研究进展其它LiCl与微波促选择性水解甲酯的新方法药物合成路线图解盐酸氨柔比星合成路线图解管理与信息预防HIV感染的生物医学技术研究领域的投资趋势其它2008年医药工业企业法人单位按主营业务收入百强榜化学药物与合成技术富马酸依利色林的合成微生物药物与生物技术地衣芽孢杆菌1w-72合成纤溶酶的摇瓶发酵工艺优化中药与天然药物板栗壳化学成分研究药物制剂伊曲康唑纳米粒的制备及其在小鼠体内的分布药品分析与质控丙烯酸酯压敏胶中残留单体的HPLC法测定综述与专论纳米药物晶体的制备技术研究进展药物合成路线图解盐酸决奈达隆合成路线图解管理与信息2009年我国医药政策回顾与分析化学药物与合成技术达沙替尼的合成微生物药物与生物技术麦芽糖浓度和渗透压对游动放线菌生长及阿卡波糖生物合成的综合影响药物制剂双嘧达莫阿司匹林胃内漂浮胶囊的制备及犬体内外相关性研究综述与专论吸入粉雾剂的研究进展药物合成路线图解更昔洛韦合成路线图解管理与信息我国药品委托生产的发展化学药物与合成技术抗帕金森病药Istradefylline的合成其它醛或苄醇被氧化成酸并酯化的新方法化学药物与合成技术卢非酰胺的合成其它吸入制剂(IDD)国际学术研讨会在扬州召开微生物药物与生物技术发酵提取物中棘白菌素类化合物的稳定性其它2010年第五届卡乐康缓控释论坛药物制剂周效避孕用复方依托孕烯透皮贴剂的家兔体内药物动力学和药效学评价其它全球首创的“热熔挤出技术药物创新工作坊”药物制剂基质pH及促渗剂对阿昔洛韦水凝胶贴剂体外透皮性能的影响药理与临床盐酸莫西沙星氯化钠注射液在Beagle犬体内的药物动力学药品分析与质控积雪草总苷及其制剂的含量研究.Ⅱ.积雪草总苷中积雪草苷、羟基积雪草苷和积雪草苷B含量的HPLC法测定其它消息药品分析与质控盐酸氨溴索片近红外光谱法的快速识别检测其它消息药品分析与质控川芎中洋川芎内酯A和Z-蒿本内酯的HPLC法测定综述与专论BCR-ABL蛋白激酶抑制剂的研究进展其它用对甲苯磺酸和亚硝酸钠对仲胺亚硝化的方法药物合成路线图解依普利酮合成路线图解管理与信息浅议公共健康危机频发下的制药企业社会责任化学药物与合成技术达比加群酯的合成微生物药物与生物技术均匀设计法优化埃博霉素树脂原位提取条件药物制剂阿魏酸环糊精包合物的制备及体外经皮通透性的评价药理与临床阿那白滞素对缺氧-复氧和兴奋性氨基酸所致神经细胞损伤的保护作用药品分析与质控大鼠血浆中利培酮及9-羟基利培酮的LC-MS/MS法测定综述与专论妙林类抗生素的研究进展管理与信息我国现代化医药物流发展的问题及对策化学药物与合成技术替比夫定的合成其它有奖征文——梅特勒-托利多快速水分测定仪应用微生物药物与生物技术埃希菌全细胞转化阿糖尿苷合成阿糖腺苷中药与天然药物骆驼蓬总生物碱提取物的质量标准研究药物制剂酒石酸美托洛尔脉冲控释片的制备及其体内外评价药理与临床他克莫司在中国健康人体内的药动学特征药品分析与质控乳果糖口服液中乳果糖及有关物质的高效阴离子交换色谱法测定综述与专论喹诺酮抗肿瘤活性及构效关系研究进展其它超越系列中文密度计折光率仪以旧换新公告综述与专论测定及提高亚微乳载药系统包封率的研究进展药物合成路线图解酒石酸拉索昔芬合成路线图解其它赢创亮相2010世界制药原料中国展(CPhIChina)管理与信息中、美、日三国政府医药研发投入管理比较研究其它梅特勒-托利多支援云南旱区爱心水管理与信息全球药品研发进展(2009.07)化学药物与合成技术氟苯尼考的合成微生物药物与生物技术大蒜蒜氨酸酶基因的克隆及在大肠杆菌中的表达中药与天然药物豆豉姜的化学成分研究.Ⅱ.甲醇提取物的氯仿部位和乙酸乙酯部位药物制剂静脉注射用硝酸甘油亚微乳的制备工艺及其质量评价药理与临床聚乙二醇化降纤酶对局灶性脑缺血大鼠的保护作用药品分析与质控外消旋达卢生坦的HPLC法手性拆分及含量测定综述与专论叶酸-聚酰胺-胺聚合物靶向给药系统的研究进展实验技术高效、准确、快捷地测定大批量溶出度样品管理与信息关于中药专利问题的几点思考化学药物与合成技术莫西沙星的合成微生物药物与生物技术hCG单克隆抗体的蛋白A亲和色谱纯化中药与天然药物夏枯草化学成分研究药物制剂布洛芬在Caco-2细胞模型中的转运行为考察药品分析与质控微生物发酵过程中氨基酸动态变化的毛细管电泳检测制药装备与包装压片机充填过程影响因素的研究进展综述与专论聚合物胶束在肿瘤治疗中的研究进展药物合成路线图解恩曲他滨合成路线图解管理与信息HACCP方法在药品质量风险管理中的应用化学药物与合成技术帕潘立酮的合成微生物药物与生物技术酮基还原酶基因dnrU敲除对柔红霉素合成的促进效应中药与天然药物预处理对油菜花粉超临界CO_2萃取率及化学成分的影响药物制剂遗传算法结合人工神经网络模拟药物在超临界流体中溶解度药理与临床甲氧基聚乙二醇白蛋白5-氟尿嘧啶在小鼠体内的药动学其它高产芽囊软骨素的大肠杆菌K4 kfoC突变株的分离药品分析与质控性保健品中可能违禁添加7种药物的LC-MS/MS法测定综述与专论青蒿素衍生物抗肿瘤活性研究进展药物合成路线图解雷美替胺合成路线图解管理与信息中美“Bolar例外”及其对制药产业影响的比较化学药物与合成技术莫达非尼的合成微生物药物与生物技术微生物鉴定分型技术应用于医药企业微生物污染调查中药与天然药物南蛇藤化学成分研究药物制剂叶酸介导肿瘤细胞靶向紫杉醇聚合物胶束的制备与表征其它梅特勒-托利多应邀参加第四届中美药典国际论坛药物制剂米托噻咯自微乳处方优化及体内外评价药品分析与质控偏最小二乘-近红外漫反射光谱法测定还原型谷胱甘肽片其它搭建技术新平台,挑战疫苗质量新高度——国药北京微谷生物医药有限公司和颇尔中国生命科学建立战略合作伙伴关系药品分析与质控L-缬氨酸甲酯盐酸盐中杂质与缬沙坦中有关物质的关系综述与专论难溶性药物注射给药系统的研究进展其它B41-13 利用途径工程和代谢调控提高多柔比星的产量药物合成路线图解盐酸普拉格雷合成路线图解管理与信息有关物质的研究与新药注册化学药物与合成技术阿奇沙坦的合成微生物药物与生物技术丝状真菌Zalerion arboricola来源的抗真菌化合物pneumocandin B_0的分离纯化药物制剂超临界流体技术制备胰岛素-三棕榈酸甘油酯复合微粒药品分析与质控依普利酮合成中有关物质的NMR研究综述与专论新型纳米材料量子点在生物及药学领域的研究进展药物合成路线图解西地那非合成路线图解管理与信息盘点2010年五大潜力重磅炸弹化学药物与合成技术非布索坦的合成微生物药物与生物技术表柔红霉素工程菌的构建及其原生质体紫外诱变中药与天然药物泉通颗粒的质量标准研究药物制剂水溶性聚合物对HP-β-CD-孕三烯酮包合作用的影响药理与临床人血浆中胺碘酮分散片的药动学研究药品分析与质控熊胆粉提取物中熊去氧胆酸和鹅去氧胆酸的HPLC-ELSD测定综述与专论渗透泵剂型的研究进展合成路线图解孟鲁司特钠合成路线图解管理与信息“国家基本药物目录”与医药行业化学药物与合成技术盐酸吡哆醇的合成其它《全国原料药工艺汇编》征订信息化学药物与合成技术抗肿瘤药Vorinostat的合成微生物药物与生物技术马鹿茸血疏水性肽的分离及组分3的免疫活性中药与天然药物复方柴术片中芍药苷和甘草酸的HPLC-DAD法测定其它《制剂技术大全》介绍药物制剂挤出滚圆法制备复方降脂微丸的工艺优化及其性质考察其它酯催化氨解制备酰胺药理与临床护肝宁片对卡马西平在大鼠体内药物动力学的影响药品分析与质控降血脂和降血糖类中药及保健食品中违禁添加17种化学药物的液相色谱-离子阱质谱定性检测其它伯胺的单羧基甲基化药品分析与质控犬血浆中甘草次酸及异甘草酸镁的LC-MS法测定其它亚砜脱氧制备硫醚综述与专论不同药物释放系统的体外评价方法研究进展药物合成路线图解替比夫定合成路线图解管理与信息国际多中心临床试验在中国申报和审评状况研究化学药物与合成技术雷美替胺的合成其它中国医药市场牛年看好经济寒冬难阻参展热情CPhI,ICSE&P-MEC China 展览会引领制药企业在危机中寻找商机化学药物与合成技术1-氯甲基-1,2,3,4-四氢异喹啉盐酸盐的制备微生物药物与生物技术硫酸铵与pH对酵母高密度发酵生产谷胱甘肽的影响药物制剂盐酸多西环素透皮贴剂的制备药理与临床氯化两面针碱在大鼠体内的排泄药品分析与质控中心组合设计法优化分离对乙酰氨基酚、盐酸麻黄碱和咖啡因的HPLC条件其它广告索引药品分析与质控纳滤膜在D-对羟基苯甘氨酸提取中的应用其它《制剂技术大全》介绍药品分析与质控复方儿茶胶囊中维生素B2和烟酸的HPLC测定制药装备与包装药品包装材料中锡迁移量的石墨炉原子吸收光谱法测定其它《全国原料药工艺汇编》征订信息综述与专论有机硼酸类酶抑制剂的研究进展实验技术无污染制备氯化氢有机溶剂药物合成路线图解盐酸帕洛诺司琼合成路线图解管理与信息全球药品研发进展化学药物与合成技术盐酸帕洛诺司琼的合成微生物药物与生物技术糖链对蚯蚓纤溶酶纤溶活性的影响中药与天然药物大孔吸附树脂纯化三七和甘草药材有效成分的工艺研究药物制剂微囊化工艺和相关辅料对蛋白类药物稳定性的影响药品分析与质控人血浆中米格列奈的HPLC测定综述与专论口腔黏膜给药系统研究进展药物合成路线图解盐酸坦洛新合成路线图解管理与信息全球药品研发进展(2008.07)化学药物与合成技术达沙替尼的合成微生物药物与生物技术离子束诱变筛选SG^r和ara^-双突变肌苷高产菌药物制剂氚的经皮渗透速率在离体皮肤屏障功能评价中的应用药理与临床小鼠静脉注射和吸入不同剂型两性霉素B的药动学比较药品分析与质控盐酸文拉法辛多晶型现象的研究制药装备与包装往复筛板萃取塔用于麻黄碱萃取综述与专论聚合物水分散体包衣的应用进展药物合成路线图解莫西沙星合成路线图解管理与信息新医改后医药行业的发展化学药物与合成技术尼罗替尼的合成微生物药物与生物技术抗肝癌细胞单链抗体的筛选和鉴定中药与天然药物不同工艺的茵栀黄注射液的指纹图谱研究药物制剂石杉碱甲注射用缓释微球制备方法的比较及其体内外评价药理与临床头孢拉定三种口服剂型的药动学特性与生物等效性研究药品分析与质控恩他卡朋及有关物质的HPLC-电化学检测器法测定综述与专论避孕药及其生物样品定量测定方法的进展药物合成路线图解(R)-沙美特罗合成路线图解管理与信息中成药研发、广告投入和主营业务利润的实证研究。
决奈达隆在 ESC房颤指南中的地位朱俊再稿PPT学习教案

A B
无显著结构性心脏病患者,初始用药 可选择决 奈 达 隆 、氟卡尼、普罗帕 酮与索 他洛尔 。 伴心血管危险因素的非永久性房颤患 者,决 奈 达 隆 可减少因心血管事件 入院。
B
决 奈 达 隆 可用于控制非永久性房颤患者的心室率,除了NYHA III-IV级或不稳定心衰的患者。
C
在房颤伴稳定性心衰( NYHA I-II级)患者中,决 奈 达 隆 可减少因心血管事件入院。
普罗帕酮与索他洛尔。
第10页/共35页
与胺碘酮头对头的比较
中,在房颤复发和提前
停药的联合终点,决奈 达隆并不优于胺碘酮
12个月时,决奈达隆组75 %的患者达到主要终点, 而胺碘酮组为59%。
249
99
84
255
146
126
40
12
0
61
13
0
但是由于无法耐受而导致的提前停药,决奈达隆组少于胺碘酮 组 (10.4 vs. 13.3%)。
B
决 奈 达 隆 不推荐用于治疗房颤伴NYHA III-IV级,或近期不稳定(1月内有呼吸 困难发 作)的 NYHA II级心衰患者。
第4页/共35页
选择节律控制的原则:
1、主要目的是减轻房颤相关症状 2、抗心律失常药物维持窦律的效果 不高 3、在临床上AAD治疗效果也只体现 在
房颤发作的减少而非消除 4、如果一种AAD无效可以选用另一 种AAD 5、选择AAD要主要考虑其安全性而 非疗效
HR
95% CI
p值
0.84 0.66; 1.08
0.18
非心血管因死亡
49
53
1.10 0.74; 1.62
0.65
心血管因死亡
抗心律失常新药决奈达隆_贺鹏康

=摘
要 > 决奈达隆是一种不含碘的新型抗心律失常 药物, 它可以阻 断多种离子 通道, 目前多个 临床试验已 证实其
在治疗心律失常方面的作用, 且不良反应较小。但尚需进一步试验判断它 相对胺碘酮抗心律 失常作用的
优劣。
=关 键 词 > 决奈达隆; 心律失常; 胺碘酮
Hale Waihona Puke =中图分类号 > R 97212; R 54117
题: 作为对照的安慰剂组患者心房颤动的复发率接
降低了患者的住院率及死亡率。但是相比于胺碘
近 90% , 远远高出同期进行的其 他抗心律失常 药
酮等其他抗心律失常药物的研究, 该试验在入选的
物试验中安慰剂组的复发率。研究者认为这可能
患者中并未严格对持续性心房颤动及阵发性心房
是在试验中使用的通过电话记录心律的方式较其
新药与临床 临床药物治疗杂志
C lin ica lM ed ica tion Jo urna l
20% 及 49% , 且 同等剂量决奈达 隆的上述效果 强 于胺碘酮。 R ide ly等 [ 8] 发现, 在心室细胞复极过程
中, 决奈达隆可阻断人类电压门控钾离子通道基因
试验中发现, 与安慰剂组相比, 决奈达隆明显降低了 正常人的肌酐清除率 (应用决奈达隆组平均值 138~ 119mL# m in- 1, 而安慰剂组为 142~ 149mL# m in- 1 );
组 2216% 的患 者 因 药物 不 良 反应 终 止 用药, 而 800mg# d- 1组中有 319% 的病人终止用药。导致患
慰剂组为每分钟 11616 ? 3119次 (P < 01001)。该 试验得出结论: 决奈达隆相比安慰剂在心房颤动、
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Multaq(决奈达隆,dronedarone)片使用说明书2009年12版批准日期:美国FDA,2009年7月1日欧盟EMEA 2009年12月16日;公司:Sanofi-aventis1.适应证:决奈达隆是抗心律失常药物,适用于阵发性或持续性心房颤动(AF)或心房扑动(AFL)患者,减低住院风险,近期AF/AFL发作和伴心血管风险因子患者(即年龄>70、高血压、糖尿病、既往心血管意外、左心房直径≥50 mm或左心室射血分数[LVEF]<40%),窦性心律或心律可复律的患者。
2剂量和用法:每天2次,早和晚餐各1片400mg。
3禁忌证:1.心衰类别IV或最近失代偿症状性心衰;2.II-或III-度房室(AV)阻断或病态窦房结综合征(除使用功能性心脏起搏器);3.心动过缓<50 bpm;4.同时用强CYP3A抑制剂;5. 同时用延长QT间隔及可诱发尖端扭转型室性心动过速(Torsade de Pointes)药物和草药;6. QTc Bazett间隔( )≥500 ms;7. 严重肝损伤;8.妊娠;9. 哺乳母亲。
6不良反应在说明书中任何处描述担忧下列安全性:1)新心衰或心衰恶化[见警告和注意事项(5.1)]2)钾消耗利尿药的低钾血症和低镁血症[见警告和注意事项(5.2)]3)QT延长[见警告和注意事项(5.3)]在AF或AFL患者每天2次400mg决奈达隆的安全性评价是基于5项安慰剂对照研究,ATHENA,EURIDIS,ADONIS,ERATO和DAFNE。
这些研究中,总共6285例患者被随机化和治疗,3282例患者用MULTAQ 400mg每天2次,和2875例用安慰剂。
跨研究平均暴露为12个月。
ATHENA最长随访为30个月。
在临床试验中,因为不良反应过早停药,决奈达隆-治疗患者发生11.8%和安慰剂-治疗组7.7%。
用MULTAQ治疗停药的最常见原因是胃肠道疾患(3.2 %相比安慰剂组)和QT延长(1.5%相比安慰剂组0.5%)。
在5项研究用MULTAQ每天2次400 mg观察到最频不良反应为腹泻、恶心、腹痛、呕吐和虚弱。
表1显示在AF或AFL患者用决奈达隆每天2次400 mg比用安慰剂更常见不良反应,按系统器官类别和频度下降顺序列出。
表2列举不良实验室和ECG效应。
用MULTAQ治疗患者还曾报道发生率低于1%的光敏反应和味觉异常。
用MULTAQ每天2次400 mg报道下列实验数据/ECG参数。
人口统计因子例如性别或年龄对治疗出现不良事件的评估未提示任何特殊子组不良事件过多。
12临床药理学12.1作用机制决奈达隆的作用机制未知。
决奈达隆有抗心律失常性质属于所有四种Vaughan-Williams类别,但这些活动各自对临床效应的贡献不知道。
12.2药效学电生理效应决奈达隆表现出所有四种Vaughn-Williams抗心律失常类别的性质,尽管不清楚其中那个对决奈达隆产生的临床效应重要。
健康受试者重复口服剂量达1600mg每天次或800mg每天2次共14天和1600mg每天2次共10天后研究决奈达隆对12-导联ECG参数(心率,PR,和QTc)的影响。
决奈达隆400mg 每天2次组,对心率无明显影响;在800mg每天2次注意到中度心率降低效应(约4bpm)。
对PR间隔有明确的剂量-依赖效应,400mg每天2次增加+5ms 和1600mg每天2次增至+50ms。
对QTc-间隔有中度剂量相关效应,400mg 每天2次延长+10ms而1600mg每天2次达+25ms。
DAFNE研究DAFNE是在复发性AF患者中的一项剂量-反应研究,比较评价决奈达隆与安慰剂维持窦性心律的效应。
在本研究中决奈达隆的剂量为400,600和800mg 每天2次。
这个小研究中超过400mg剂量效应不是更有效而耐受较差。
12.3药代动力学决奈达隆被广泛代谢和有低全身生物利用度;进餐其生物利用度增加。
消除半衰期是13-19小时。
吸收因为体循环前首过代谢,无食物时决奈达隆的绝对生物利用度是低,约4%。
当决奈达隆与高脂肪餐给药增加至约15%。
在食物条件下口服后3至6小时内达到血浆决奈达隆和主要循环活性代谢物(N-debutyl代谢物)峰浓度。
每天2次重复给予400 mg,在治疗4至8天内达到稳态和决奈达隆的平均积蓄比范围从2.6至4.5。
主要N-debutyl代谢物的稳态Cmax和暴露与母体化合物相似。
决奈达隆及其N-debutyl代谢物的药代动力学均中度偏离剂量正比例:剂量增加2-倍导致约2.5-至3.0倍增加Cmax和AUC。
分布决奈达隆及其N-debutyl代谢物的体外血浆蛋白结合是>98 %和不饱和。
两种化合物主要与白蛋白结合。
静脉给药后稳态时分布容积约为1400 L。
代谢决奈达隆被广泛代谢,主要被CYP 3A。
初始通路包括N-debutylation形成形成活性N-debutyl代谢物,氧化脱氨作用形成无活性的丙酸代谢物,和直接氧化作用。
各种代谢物进行进一步代谢产生超过30种未鉴定的代谢物。
N-debutyl 谢物表现出药效学活性但是强度为决奈达隆的1/10至1/3。
排泄/消除用口服决奈达隆质量平衡研究中(14C-标记)约6%的标记剂量在尿中被排泄,主要为代谢物(尿中无未变化化合物排泄),而84%在粪中排泄,主要为代谢物。
决奈达隆及其N-debutyl活性代谢物至少占血浆中由此产生的放射性小于15%。
静脉给药后决奈达隆的血浆清除率范围从130至150L/h。
决奈达隆的消除半衰期范围从13至19小时。
特殊人群性别在女性中决奈达隆的暴露平均比男性较高30%。
种族未正式评价药代动力学种族相关的差别。
然而,基于一项交叉研究比较,单剂量给药后(400 mg),亚裔男性(日本人) 比高加索男性有约2-倍较高的暴露。
未评估在其它种族中决奈达隆的药代动力学。
老年人决奈达隆的临床研究中,受试者总数73%是65岁和以上而且34%是75岁和以上。
患者年龄65岁和以上,决奈达隆的暴露是比小于65岁患者较高23%[见在特殊人群中的使用(8.5)]。
肝损伤在中度肝损伤受试者相对于正常肝功能受试者平均决奈达隆暴露增加1.3-倍,而N-debutyl代谢物平均暴露减低约50%。
有中度肝损伤受试者中药代动力学数据显著地更加变异。
尚未评估严重肝损伤对决奈达隆药代动力学的影响[见禁忌证(4)]。
肾损伤与决奈达隆的低肾排泄一致,有轻或中度肾损伤受试者与正常肾功能受试者比较,未观察到药代动力学差异[见在特殊人群中的使用(8.6)]。
有轻度至严重肾损伤患者与正常肾功能患者比较未观察到药代动力学差异。
14 临床研究14.1 ATHENA研究ATHENA是一项多中心,多国,双盲,和随机化安慰剂-对照研究of 决奈达隆在4628例有AF/AFL最近史在窦性心律或将被转换为窦性心律的患者。
研究的目的是确定是否决奈达隆能延缓任何原因死亡或住院对心血管原因.起初患者是70岁,或<70岁至少有1种风险因子(包括高血压、糖尿病、既往脑血管意外、左心房直径50mm或LVEF<0.40)。
纳入标准是以后变成患者是75岁,或70岁有至少1种风险因子。
既往6个月内患者必须同时有AF/AFL 和窦性心律记录。
在随机化时患者可能曾有AF/AFL或窦性心律,但患者不是窦性心律期望被或电学上或在抗凝后化学上转化为正常窦性心律。
受试者被随机化和治疗长达30个月(随访中位:22个月)并且给予每天2次MULTAQ 400 mg (2301例患者)或安慰剂(2327例患者),除了常规治疗对心血管病包括β-阻滞剂(71%), ACE抑制剂或血管紧张素II受体阻滞剂(ARBs)(69%),地高辛(14%),钙拮抗剂(14%),他汀类药物(39%),口服抗凝药(60%),阿司匹林(44%),其它慢性抗血小板治疗(6%)和利尿药(54%)。
研究的主要终点是对心血管原因或任何原因死亡的至首次住院时间、至任何原因死亡时间、对心血管原因至首次住院时间、和至心血管死亡时间和还探讨了至所有死亡原因时间。
患者年龄范围从23至97岁;42%为75岁或以上。
47%患者是女性和大多数是高加索人(89%)。
纳入患者中约71%无心衰史。
中位射血分数为60%。
29%患者有心衰,大多数NYHA类别II(17%)。
大多数有高血压(86%)和结构性心脏病(60%)。
表3中显示结果。
当与安慰剂比较时MULTAQ减低心血管住院或任何原因死亡的组合终点24.2%。
这个差别是完全归因于其对心血管住院的效应,主要是与AF相关住院。
表3中显示其它终点,任何原因死亡和对心血管原因首次住院。
次要终点计数某种特殊类型所有首次事件,它们是或不是在某种不同类型事件前。
在图1中显示至首次事件时间的Kaplan-Meier累计发生率曲线。
早期事件曲线分开和在随访30个月期间继续分离。
图2:按照被选择基线特征:首次心血管住院或任何原因死亡的相对风险(MULTAQ相比安慰剂)估算值与95%可信区间.14.2 EURIDIS和ADONIS研究在EURIDIS和ADONIS研究中,总共1237例窦性心律有既往AF或AFL发作的患者在门诊情况下被随机化和用或MULTAQ 400 mg每天2次(n=828)或安慰剂(n=409)在常规治疗顶部治疗(包括口服抗凝剂、β-阻滞剂、ACE抑制剂或ARBs、慢性抗血小板药、利尿药、他汀类、地高辛、和钙通道阻滞剂)。
患者至少有有1个ECG-记录AF/AFL发作纳入研究前3个月期间但是在窦性心律至少1个小时。
患者年龄范围从20至88岁,大多数是高加索人(97%),男性(70%)患者。
最常见同时患倍为高血压(56.8%)和结构性心脏病(41.5%),包括冠状动脉疾病(21.8%)。
患者随访共12个月。
从EURIDIS 和ADONIS合并资料以及在个别试验中,决奈达隆延缓至AF/AFL首次复发时间(主要终点),在12个月研究期间减低首次AF/AFL复发时间约25%,在12个月时绝对复发率差别约11%。
14.3 ANDROMEDA研究(在有严重心衰患者中增加死亡率)最近住院有症状性心衰和严重左心室收缩功能不全(室壁运动指数1.2)患者被随机化至或每天2次MULTAQ 400 mg或匹配的安慰剂,用一个对心衰所有致死亡或住院的主要组合终点。
在纳入627/1000例计划患者后(决奈达隆和安慰剂组中分别为310例和317例),和随访中位时间63天,因为决奈达隆组过量的死亡率试验被终止。
决奈达隆组25例患者(8.1%)相比安慰剂组12例患者(3.8%)死亡,危害比2.13;95% CI:1.07至4.25;p=0.027。
死亡主要原因是心衰变坏。
决奈达隆组中还有对心血管原因的过多住院(71例相比安慰剂51例)[见黑框警告和禁忌证(4)]。
