2015年版药典 无菌检查法
《中国药典》2015版-抑菌效力检查法

匀,凝固,置 30~35℃培养不超过 3 天,计数;分别接种不大于 100cfu 的白色
念珠菌、黑曲霉的菌液至沙氏葡萄糖琼脂培养基,每株试验菌平行制备 2 个平皿,
混匀,凝固,置 20~25℃培养不超过 5 天,计数;同时,用对应的对照培养基
替代被检培养基进行上述试验。
结果判定 若被检培养基上的菌落平均数不小于对照培养基上菌落平均数
的 70%,且菌落形态大小与对照培养基上的菌落一致,判该培养基的适用性检查
符合规定。
抑菌效力测定
菌种 抑菌效力测定用菌种见表 1,若需要,制剂中常见的污染微生物也 可作为试验菌株。
菌液制备 新鲜菌体培养见表 1,铜绿假单胞菌、金黄色葡萄球菌、大肠 埃希菌、白色念珠菌若为琼脂培养物,加入适量的 0.9%无菌氯化钠溶液将琼脂 表面的培养物洗脱,并将菌悬液移至无菌试管内, 然后用 0.9%无菌氯化钠溶液 冲洗并制成每 1ml 含菌数约为 108cfu 的菌悬液;若为液体培养物,离心收集菌 体,用 0.9%无菌氯化钠溶液冲洗并制成每 1ml 含菌数约为 108cfu 的菌悬液。取 黑曲霉的新鲜培养物加入 3~5ml 含 0.05%(ml/ml)聚山梨酯 80 的 0.9%无菌氯 化钠溶液,将孢子洗脱,然后,用适宜方法吸出孢子悬液至无菌试管内,加入适 量的含 0.05%(ml/ml)聚山梨酯 80 的 0.9%无菌氯化钠溶液制成每 1ml 含孢子 数 108cfu 的孢子悬液。测定 1ml 菌悬液中所含的菌数。
本试验方法和抑菌剂抑菌效力判断标准用于包装未启开的成品制剂。 培养基
培养基的制备 胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖液体培养基、 沙氏葡萄糖琼脂培养基 照无菌检查法(通则 1101)制备。 培养基的适用性检查 抑菌效力测定用培养基应进行培养基的适用性检查,包括成品培养基、由脱 水培养基或按处方配制的培养基均应检查。 菌种 试验所用的菌株传代次数不得超过 5 代(从菌种保藏中心获得的冷 冻干燥菌种为第 0 代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株 的生物学特性。培养基适用性检查的菌种及新鲜菌体培养见表 1。
无菌检查法-2015版中国药典

无菌检查法-2015版中国药典无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料、及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在环境洁净度B 级背景下的局部A 级洁净度的单向流空气区域内或隔离系统中进行,其全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度确认。
隔离系统应定期按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。
日常检验还需对试验环境进行监控。
无菌检查人员必须具备微生物专业知识,并经过无菌技术的培训。
培养基硫乙醇酸盐流体培养基主要用于厌氧菌的培养,也可用于需气菌培养;胰酪大豆胨液体培养基适用于真菌和需气菌的培养。
培养基的制备及培养条件培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基。
配制后应采用验证合格的灭菌程序灭菌。
制备好的培养基应保存在2~25℃、避光的环境,若保存于非密闭容器中,一般在3周内使用;若保存于密闭容器中,一般可在一年内使用。
1. 硫乙醇酸盐流体培养基酪胨(胰酶水解) 15.0g 酵母浸出粉 5.0g葡萄糖 5.0g 氯化钠 2.5gL-胱氨酸0.5g 新配制的0.1% 刃天青溶液1.0ml硫乙醇酸钠0.5g 琼脂0.75g(或硫乙醇酸) (0.3 ml) 纯化水1000ml除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节pH 为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节pH 值使灭菌后为7.1±0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培2养基氧化层(粉红色)不超过培养基深度的1/2。
灭菌。
在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100℃水浴加热至粉红色消失(不超过20 分钟),迅速冷却,只限加热一次,并防止被污染。
2015年版《中国药典》无菌检查法解读

2015年版《中国药典》无菌检查法解读杨晓莉;李辉;绳金房;钱维清;胡昌勤【摘要】目的解读2015年版《中国药典》无菌检查法的主要增修订情况.方法对比2015年版《中国药典》无菌检查法与2010年版《中国药典》无菌检查法的主要差异.结果 2015年版《中国药典》无菌检查法在检查内容、检查方法、培养体系及质量控制理念等方面都作了较大修订.结论 2015年版《中国药典》将无菌检查法完善成为更加科学并与国际接轨的检查方法.【期刊名称】《中国药业》【年(卷),期】2015(024)024【总页数】5页(P7-11)【关键词】无菌检查法;2015年版《中国药典》;无菌药品;培养体系;质量控制【作者】杨晓莉;李辉;绳金房;钱维清;胡昌勤【作者单位】陕西省食品药品检验所,陕西西安 710065;陕西省食品药品检验所,陕西西安 710065;陕西省食品药品检验所,陕西西安 710065;上海市食品药品检验所,上海 201203;中国食品药品检定研究院,北京 100050【正文语种】中文【中图分类】R954;R921.2无菌检查法是指用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的方法[1],是药品微生物检查体系的重要组成部分,药品微生物是关系药品安全性的关键指标之一。
无菌药品的微生物污染是影响药品生产质量和引发临床不良事件的主要因素,近年来发生的“欣弗事件及刺五加事件”等严重药害事件都是无菌药品的微生物污染导致[2]。
目前,美国、欧盟、日本等国家或组织无菌检查法已协调一致[3]。
2010年版《中国药典》及之前版本收录的无菌检查法与国际通用的标准在检查理念、培养体系、方法要求等诸多方面有显著差异。
在国家药品安全规划与标准提高的目标下,2015年版《中国药典》借鉴国外药典先进技术经验,以新的控制理念为指导,结合我国国情对无菌检查法的检测范围及环境要求、培养体系、方法适用性、检查方法、偏差调查与过程控制等方面都做了较大修订,进一步完善了无菌检查法,修订后的无菌检查法正逐步与国际通用标准一致。
《2015版《中国药典》微生物检测与洁净室环境检测技术》-1

育
飞
天
教
育
微生物细胞结构示意图
• 细菌细胞结构图 •
教 真菌细胞结构图 天 飞
育
飞
天
教
育
微生物的五大共性
飞
天
教
育
1、体积小,面积大; 2、吸收多,转化快;
3、生产旺,繁殖快;
4、适应强,易变异; 5、分布广,种类多。
飞
天
教
育
细 菌 形 态 特 征
• 革兰氏阳性细菌和革兰氏阴性细菌的细胞壁结构比较
天
教
育
试管
移液管
先用少许棉花塞于吸口端,然后用纸包好或装入金属吸 管筒内,于121℃高压蒸汽灭菌20min后烘干。
飞
天
教
育
培 养 基 的 基 础 知 识
溶
液体培养 基用滤纸 过滤,固 体培养基 用纱布块 中夹薄层 脱脂棉过 滤
化
校正酸碱度
(1)先将卵磷脂加入少量蒸馏水低温加 热溶解溶、再加吐温80混匀,,加入琼 脂,静置15分钟。
细胞壁结构 G+ G-
飞
天
教
育
脂多糖(LPS),包括脂
厚度 强度 糖类含量 脂类含量 磷壁酸 脂多糖
20-80nm 坚韧 约45% 约2% 无
10-15nm 疏松 约15% 约20% 有 有
蛋白A,核心多糖和特异
性多糖三个部分。LPS对 动物具有毒性作用,它 牢固地结合在细胞表面,
只在菌体融解时才释放,
非细胞类:病毒、亚病毒(类病毒、朊病毒)
飞
天
教
育
细菌(bacteria)
• 细菌是单细胞的原核微生物
• 细菌是所有生物中数量最多的一类,据估计,其总数约有 5×10的三十次方个。 • 细菌主要由细胞壁、细胞膜、细胞质、核质体等部分构成 • 根据形状分为三类,即:球菌、杆菌和螺形菌(包括弧菌、 螺菌、螺杆菌)
中国药典(2015年版)无菌检查法

中国药典(2015年版)无菌检查法是用于检查药典要求无菌的药品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。
如果供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查法包括薄膜过滤法和直接接种法。
只要供试品性质允许,应采用薄膜过滤法。
薄膜过滤法一般应采用封闭式薄膜过滤器,无菌检查用的滤膜孔径应不大于0.45微米,直径约为50mm。
根据供试品及其溶剂的特性选择滤膜材质,使用时,应保证滤膜在过滤前后的完整性。
直接接种法适用于无法用薄膜过滤法进行无菌检查的供试品,即取规定量供试品分别等量接种至硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基中。
中国药典2015版无菌检查法与美、欧、日药典的差异分析与讨论_潘友文

中国药典2015版无菌检查法与美、欧、日药典的差异分析与讨论潘友文(罗氏/基因泰克,美国南旧金山,94080)2016年07月29日摘要目的:分析中国药典2015版无菌检查法与美、欧、日药典无菌检查法的之间的差异性,为评价不同药典中无菌检查法的等效性提供参考。
方法:对无菌检查法的主要实验步骤和参数进行一对一比较,对有差异的步骤和参数进行科学论证和评价。
结果:中国药典2015版无菌检查法与美、欧、日药典无菌检查法的主要参数和步骤是一致的,但中国药典无菌检查法还需要做阳性对照和厌氧需氧菌的额外培养。
并且,中国药典用大肠埃希菌代替美、欧、日药典中的铜绿假单胞菌参与无菌检查法的适用性试验。
结论:各药典的无菌检查法是等效的。
在不影响方法等效性的前提下,中国药典2015版无菌检查法在阳性对照和培养方法上还可以进一步简化。
关键词:无菌检查法;中国药典;美国药典;欧洲药典;日本药典Gap Assessment and Discussion on Sterility Tests in Chinese Pharmacopoeia 2015, United States Pharmacopoeia, European Pharmacopoeia, and Japanese PharmacopoeiaYouwen Pan (Genentech, a Member of Roche, South San Francisco, USA 94080)Abstract Objective:Gap assessment and discussion on the sterility test methods in Chinese Pharmacopoeia 2015 edition (CP2015), United States Pharmacopoeia (USP), European Pharmacopoeia (EP), and Japanese Pharmacopoeia (JP). Method:The test procedures and key parameters in the sterility test methods in different pharmacopoeia were compared step by step and the differences were identified. The identified differences are scientifically evaluated for their impact to the equivalence of the methods. Result:The sterility test method in CP2015 is largely harmonized with that in USP, EP and JP except for a few differences. Positive control and extra incubation bacteria are required in CP2015 only, and Escherichia coli is used in method suitability test in CP2015 while Pseudomonas aeruginosa is used in USP/EP/JP. Conclusion:The Sterility Test Methods in CP2015, USP, EP, and JP are equivalent. The method in CP2015 could be simplified more without compromising the validity, accuracy and reliability of the method.Key words:sterility test;Chinese Pharmacopoeia 2015;United States Pharmacopoeia;European Pharmacopoeia; Japanese Pharmacopoeia无菌检查法是用于检查药典规定的无菌物品是否被微生物污染的检测方法。
2015版中国药典微生物限度

1.4.2供试品检查
• 供试液制备
– ⑵ 水不溶性非油脂类供试品
• 取供试品, 用 pH7.0 无菌氯化钠-蛋白胨 缓冲液,或 pH7.2 磷酸盐缓冲液,或胰酪 大豆胨液体培养基制备成 1:10 供试液。 分散力较差的供试品,可在稀释液中加入 表面活性剂如 0.1%的聚山梨酯 80,使供 试品分散均匀。若需要,调节供试液 pH 值至 6~8。必要时,用同一稀释液将供 试液进一步 10倍系列稀释。
1.3.3计数方法适用性试验
1. 供试液制备 2. 接种和稀释 3. 抗菌活性的去除与灭活 4. 供试品中微生物的回收
– 平皿法 – 薄膜过滤法 – 最可能数法(MPN 法)
5. 结果判断
1.4 供试品检查
• 1.4.1检验量
– 检验量即一次试验所用的供试品量(g、ml
或cm²)。
– 除另有规定外,一般供试品的检验量为10g 或
• 需氧菌总数是指胰酪大豆胨琼脂培养基上生长的 总菌落数(包括真菌菌落数);
• 霉菌和酵母菌总数是指沙氏葡萄糖琼脂培养基上 生长的总菌落数(包括细菌菌落数)。
• 若因沙氏葡萄糖琼脂培养基上生长的细菌使霉菌 和酵母菌的计数结果不符合微生物限度要求,可 使用含抗生素(如氯霉素、庆大霉素)的沙氏葡 萄糖琼脂培养基或其他选择性培养基(如玫瑰红 钠琼脂培养基)进行霉菌和酵母菌总数测定。
1.4.2供试品检查
• 供试液制备
– ⑷需用特殊方法制备供试液的供试品
• 膜剂供试品 • 肠溶及结肠溶制剂供试品 • 气雾剂、喷雾剂供试品 • 贴膏剂供试品
1.4.2供试品检查
1. 平皿法
– 平皿法包括倾注法和涂布法。 – 除另有规定外,取规定量供试品,按方法适用性
试验确认的方法进行供试液制备和菌数测定,每 稀释级每种培养基至少制备2个平皿。 – 培养和计数 除另有规定外,胰酪大豆胨琼脂培养 基平板在30~35℃培养3~5天,沙氏葡萄糖琼脂 培养基平板在20~25℃培养5 ~7天, 观察菌落 生长情况,点计平板上生长的所有菌落数,必要时 可适当延长培养时间至7 天进行菌落计数并报告 。菌落蔓延生长成片的平皿不宜计数。点计菌落 数后,计算各稀释级供试液的平均菌落数,按菌 数报告规则报告菌数。 – 若同稀释级两个平皿的菌落数平均值不小于15, 则两个平皿的菌落数不能相差1 倍或以上。
9-钱文静-2015版中国药典无菌检查法

(二)、无菌检查的特点和意义 由于抽样概率的限制,通过无菌检查发现产品 微生物污染的可能性极低,而当前坚持无菌检查的 意义在于: 产品上市前发现重大污染事件的最后一道关口; 通过无菌检查的执行情况可以窥视其无菌控制存 在的问题。
三、无菌检查法的有关概念和新理念
(三)、无菌检查的新理念 1.全过程控制
2014-9-16
(一) 2015年版无菌检查法主要修订的内容 3、培养基 ⑶灵敏度检查- ②菌液制备用培养基的修订
2010年版 1、接种金黄色葡萄球菌、铜绿假单胞 菌、枯草芽孢杆菌新鲜培养物 ——至营养肉汤培养基中或营养琼脂培 养基上; 2、接种生孢梭菌的新鲜培养物 ——至硫乙醇酸盐流体培养基中; 3、接种白色念珠菌的新鲜培养物 ——至改良马丁培养基中或改良马丁琼 脂培养基; 4、接种黑曲霉的新鲜培养物至 ——改良马丁琼脂斜面培养基上 ;
2010年版 1、硫乙醇酸盐流体培养基 ——金黄色葡萄球菌、铜绿 假单胞菌、枯草芽孢杆菌、 生孢梭菌 2、改良马丁培养基 ——白色念珠菌、黑曲霉 2015年版 1、硫乙醇酸盐流体培养基 ——生孢梭菌、金黄色葡萄球 菌、铜绿假单胞菌 2、胰酪大豆胨液体培养基 ——枯草芽孢杆菌、白色念珠 菌、黑曲霉
30
悬浮粒子最大允许数/立方米 洁 净 度 级 别 A级 B级 C级 D级 静态 ≥0.5 μm 3520 3520 352000
3520000
微生物监测的动态标准(1) 浮游 菌 cfu/ m3 1 10 100 200
沉降 菌 ( 90m m) cfu /4h(2)
动态 ≥5.0 μm 20 29 2900 ≥0.5 μm 3520 352000 3520000 ≥5.0 μm 20 2900 29000
2014-9-16
药品无菌检查

、生孢梭菌(4种 梭菌(3种菌)
菌)
改良马丁:白念、 胰酪大豆胨液体:
黑曲
枯草、白念、黑曲
(2种菌)
(3种菌)
2015年版药典的变化
• 菌种的培养条件改变
药典 金黄色葡萄球菌 铜绿假单胞菌 枯草芽孢杆菌
生孢梭菌
白色念珠菌
黑曲霉
2010年版
2015年版
营养肉汤/营养琼脂
试品的该检验量在该检验条件下无抑菌作用或抑菌 作用可以忽略不计; 如含供试品的任一容器中的试验菌生长微弱、缓慢 或不生长----供试品的该检验量在该检验条件下有抑 菌作用-----增加冲洗量、培养基用量、中和剂或灭 活剂、更换滤膜品种,重新进行方法适用性试验。
药品无菌检查法
• 供试品的无菌检查
检验数量:一次试验所用供试品最小包装容器的数量 出厂产品按表1,上市产品监督检验按表2 最少检验数量不包括阳性对照用的。
药典 培养系统1 培养系统2
2010年版
2015年版
硫乙醇酸盐流体: 硫乙醇酸盐流体:
金葡、铜绿、枯草 金葡、铜绿、生孢
、生孢梭菌 梭菌
改良马丁:白念、 胰酪大豆胨液体:
黑曲
枯草、白念、黑曲
2015年版药典的变化
• 方法适用性实验:
药典 培养系统1 培养系统2
2010年版
2015年版
硫乙醇酸盐流体: 硫乙醇酸盐流体:
• 灭菌医用器具供试品 必要时将其拆散或切成小碎段,等量接 种于各管足以浸没供试品的适量培养基中。
• 放射性药品 取供试品1支,等量接种于装量为7.5ml的流乙醇酸 盐流体培养基和TSB中。每管接种量为0.2ml。
药品无菌检查法
2015年版药典微生物修订内容

科
增订了原敷料、中药提取物及饮片的微生物限
度标准。
兴
修订内容
依
1 、菌数计数结果以10n表示;
科
2、 以需氧菌总数取代细菌数。以耐胆盐革 兰
阴性菌取代大肠菌群。
依科制药
分类及其标准
1、制剂通则、品种项下要求无菌的制剂及标示无菌
新 依
的制剂和原辅料应符合无菌检查法规定 2、 用于手术、烧伤或严重创伤的局部给药制剂 应符合无菌检查法规定
新
依
科
2015版药典微生物修订内容
兴
依 科
一综合车间(二车间)
2015.10
依科制药
微生物计数法主要内容
新 2010版
依
科
细菌数—
兴 营养琼脂培养基
依
科
霉菌和酵母菌数 — 玫瑰红钠琼脂培养基
2015版
1、 细菌数修订为 需氧菌总数。 2、 霉菌和酵母菌数修订为 霉菌和酵母菌总数。 3、 需氧菌总数: 是指胰酪大豆胨琼脂培养基 上生长的 总菌落数(包括真菌菌落 数) 。 4、 霉菌和酵母菌总数: 是指沙氏葡萄糖琼脂培养基上 生长的总菌落数(包括细菌菌落数) 。 若为因 沙 氏葡萄糖琼脂培养基上生长的细菌使霉菌和酵母 菌的计数结果不符合微生物限度要求,可使用含 有抗生素的(如氯霉素、庆大霉素)的沙氏葡萄 琼脂培养基或其它选择性培养基(如玫瑰红钠琼 脂培养基)进行霉菌和酵母菌总数测定。
依
霉菌及酵母菌总数 沙氏葡萄糖琼脂( SDA)
科
依科制药
新 修订后
依
耐胆盐的革兰氏阴性菌、大肠埃希菌、沙门菌、
科
铜绿假单胞菌、金黄色葡萄球菌、梭菌、白色
念珠菌
兴
修订前
《中国药典》2015年版微生物测定修订情况

常州药检
一、微生物计数法
分别接种不大于100cfu的铜绿假单胞菌、金黄色葡萄球 菌、枯草芽孢杆菌菌液至胰酪大豆胨琼脂培养基平 板,每一试验菌株平行制备2个平皿,30~35℃培养 不超过3天。同时,用相应的对照培养基代替被检培 养基进行上述试验。 分别接种不大于100cfu的白色念珠菌、黑曲霉菌液至 胰酪大豆胨琼脂培养基平板,每一试验菌株平行制备 2个平皿,30~35℃培养不超过5天。同时,用相应 的对照培养基代替被检培养基进行上述试验。
常州药检
一、微生物计数法 计数培养基适用性检查
菌种:金黄色葡萄球菌、铜绿假单胞菌、枯草芽 孢杆菌、白色念珠菌、黑曲霉,不得超过5代。
常州药检
一、微生物计数法
常州药检
一、微生物计数法
常州药检
一、微生物计数法
取其新鲜培养物用pH7.0无菌氯化钠-蛋白胨缓冲液或 0.9无菌氯化钠溶液制成适宜浓度菌悬液。黑曲霉制 备时在缓冲液或氯化钠溶液中加入0.05%(v/v)聚山 梨酯80。 菌液在室温下2小时内使用,2~8℃时可在24h内使用, 黑曲霉孢子悬液可2~8℃保存,在验证过的贮存期内 使用。
MPN法
常州药检
一、微生物计数法
平皿法:包括倾注法和涂布法。每株菌每种培养基 至少制备2个平皿,以算术平均值计算。使用涂布 法应采用适宜的方法使培养基表面干燥,且每个 平皿接种的供试液不少于0.1ml。
常州药检
一、微生物计数法
薄膜过滤法:一般取相当于1g(ml、10cm2)的供试 品,(若供试品中所含的菌数较多时,供试液可 酌情减量)加至适量稀释液中,混匀,过滤。用 适量冲洗液冲洗。 每株菌每种培养基至少制备一张滤膜。 同法测定供试品对照组及菌液对照组菌数。
常州药检
无菌检查法(逐字对比20版药典变化)

无菌检查法,逐字对比20版药典变化无菌检查的定义及无菌检查的适用条件无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器械、原料、辅料及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供拭品中微生物的检出。
单向流空气区域、工作台面及受控环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。
培养基的制备及培养条件培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基或成品培养基商品化的预制培养基。
胰酪胨 1.50g氯化钠 2.5g酵母浸出粉 5.0g葡萄糖/无水葡萄糖 5.5g/5.0g新配制的0.1% 刃天青溶液 1.0mlL-胱氨酸0.5g琼脂 0.75g硫乙醇酸钠 0.5g水 1000ml(或硫乙醇酸)(0.3ml)除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节PH为弱碱性,煮沸,滤清,加人葡萄糖和刃天青溶液,摇匀,调节PH, 使灭菌后在25℃的PH值为7.1土0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。
灭菌。
2、胰酪大豆胨液体培养基▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化3、中和或灭活用培养基按上述硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基的处方及制法,在培养基灭菌前或使用前加人适宜的中和剂、灭活剂或表面活性剂,其用量同方法适用性试验。
4、0.5 %葡萄糖肉汤培养基(用于硫酸链霉素等抗生素的无菌检查)▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化5、胰酪大豆胨琼脂培养基▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化6、沙氏葡萄糖液体培养基▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化7、沙氏葡萄糖琼脂培养基▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化培养基的适用性检查无菌性检查每批培养基一般随机取不少5支(瓶),置各培养基规定的温度培养14天,应无菌生长。
药典三部(2015版)-通则-1101微生物检查法

1101 无菌检查法无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区、工作台面及环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。
隔离系统应定期按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。
日常检验还需对试验环境进行监控。
培养基硫乙醇酸盐流体培养基主要用于厌氧菌的培养,也可用于需氧菌培养;胰酪大豆胨液体培养基用于真菌和需氧菌的培养。
培养基的制备及培养条件培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基或成品培养基。
配制后应采用验证合格的灭菌程序灭菌。
制备好的培养基应保存在2~25℃、避光的环境,若保存于非封闭容器中,一般在3周内使用;若保存于密闭容器中,一般可在一年内使用。
1. 硫乙醇酸盐流体培养基胰酪胨15.0g 氯化钠2.5g酵母浸出粉 5.0g 新配制的0.1% 刃天青溶液1.0ml无水葡萄糖 5.0g 琼脂0.75gL-胱氨酸0.5g 水1000ml硫乙醇酸钠0.5g(或硫乙醇酸)(0.3ml)除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节pH为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节pH,使灭菌后在25℃的pH值为7.1±0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。
灭菌。
在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100℃水浴加热至粉红色消失(不超过20分钟),迅速冷却,只限加热一次,并防止污染。
无菌检查法 版药典

除 葡 萄 糖 外 ,取 上 述 成 分 ,混 合 ,微 温 溶 解 ,滤 过 , 调 节 p H 使 灭 菌 后 在 2 5 C 的 p H 值 为 7.3±0.2,加人葡萄
糖 ,分 装 ,灭 菌 。 胰 酪 大 豆 胨 液 体 培 养 基 置 20〜25eC 培 养 。 3. 中和或灭活用培养基
培养基
硫 乙 醇 酸 盐 流 体 培 养 基 主 要 用 于 厌 氧 菌 的 培 养 ,也可用
于 需 氧 菌 培 养 ;胰 酪 大 豆 胨 液 体 培 养 基 用 于 真 菌 和 需 氧 菌 的
培养。
培养基的制备及培养条件
培 养 基 可 按 以 下 处 方 制 备 ,亦可使用按该处方生产的
符 合 规 定 的 脱 水 培 养 基 或 成 品 培 养 基 。配制后应采用验证 合 格 的 灭 菌 程 序 灭 菌 。制 备 好 的 培 养 基 应 保 存 在 2 〜
蛋 白 质 )。
•
ቤተ መጻሕፍቲ ባይዱ
供 试 品 羟 胺 残 留 量 — 供 试 品 的 残 留 羟 胺 浓 度 (nmol/ml) (nmol/mg蛋 白 质 ) 供 试 品 的 蛋 白 质 含 量 (mg/ml)
微生物检查法
1 1 0 1 无菌检查法
无 菌检 查法 系 用 于 检 查 药典 要 求 无 菌的 药 品 、生物制 品 、医 疗 器 具 、原 料 、辅 料及其他品种是否无菌的一种 方 法 。若 供 试 品 符 合 无 菌 检查 法的 规 定 ,仅表明了供试品在 该检验条件下未发现微生物污染。
结 果 判 定 空 白 对 照 管 应 无 菌 生 长 ,若加菌的培养基 管 均 生 长 良 好 ,判该 培 养 基 的灵 敏度 检査 符合规定 。
2015年版中国药典微生物限度检查法

1.1 总则:
• 环境: – 微生物计数试验环境应符合微生物限度检查的要 求。(在不低于GMP 现行版要求的D 级洁净环境 、局部洁净度不低于B 级的单向流空气区域内进 行)【10版:在环境洁净度10000级下的局部洁净 度100级的单向流空气区域内】。 – 检验全过程必须严格遵守无菌操作,防止再污染 ,防止污染的措施不得影响供试品中微生物的检 出。 – 单向流空气区域、工作台面及环境应定期进行监 测。
菌数报告规则
– 需氧菌总数测定宜选取平均菌落数小于 300cfu 的稀释级、霉菌和酵母菌总数测定宜 选取平均菌落数小于100cfu 的稀释级,作为 菌数报告(取两位有效数字)的依据。取最 高的平均菌落数,计算1g、1ml 或10 cm² 供 试品中所含的微生物数。 – 如各稀释级的平皿均无菌落生长,或仅最低 稀释级的平板有菌落生长,但平均菌落数小 于1 时,以﹤1 乘以最低稀释倍数的值报告菌 数。
1.4.2供试品检查
• 供试液制备 – ⑴ 水溶性供试品
• 取供试品,用 pH7.0 无菌氯化钠-蛋白胨 缓冲液,或pH7.2 磷酸盐缓冲液,或胰酪 大豆胨液体培养基溶解或稀释制成 1:10 供试液。若需要,调节供试液 pH 值至 6 ~8。必要时,用同一稀释液将供试液进 一步 10倍系列稀释。水溶性液体制剂也 可用混合的供试品原液作为供试液。
1.3.1菌液制备及使用
试验菌株 试验菌液的制备
金黄色葡萄球菌 〔CMCC(B) 26 003)〕
铜绿假单胞菌 〔CMCC(B)10 104〕 枯草芽孢杆菌 〔CMCC(B) 63 501〕 白色念珠菌 〔CMCC(F) 98 001〕
胰酪大豆胨琼脂培养基或胰酪大豆胨液体培 养基 【10版:营养肉汤或营养琼脂培养基】 30~35℃,18~24小时
《中国药典》2015年版通则

0100本制剂通则中原料药物系指用于制剂制备的活性物质,包括中药、化学药、生物制品原料药物。
中药原料药物系指 饮片、植物油脂、提取物、有效成分或有效部位》化学药原料药物系指化学合成、或来源于天然物质或采用生物技术获 得的有效成分(即原料药);生物制品原料药物系指生物制品原液或将生物制品原液干燥后制成的原粉。
本制剂通则中各剂型、亚剂型并不适用于所有原料药物,而应取决于原料药物特性、临床给药需求以及药品的安 全性、有效性和稳定性等。
本制剂通则适用于中药、化学药和治疗用生物制品(包 括血液制品、免疫血清、细胞因子、单克隆抗体、免疫调节 剂、微生态制剂等)。
预防类生物制品,应符合本版药典三部相应品种项下的有关要求。
除另有规定外,生物制品应于2〜8X:避光贮存和运输。
片剂系指原料药物或与适宜的辅料制成的圆形或异形的 片状固体制剂。
中药还有浸膏片、半浸膏片和全粉片等。
片剂以口服普通片为主,另有含片、舌下片、口腔貼 片、咀嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾 片、缓释片、控释片、肠溶片与口崩片等。
含片系指含于口腔中缓慢溶化产生局部或全身作用的片剂。
含片中的原料药物一般是易溶性的,主要起局部消炎、杀菌、收敛、止痛或局部麻醉等作用。
舌下片系指置于舌下能迅速溶化,药物经舌下黏膜吸 收发挥全身作用的片剂。
舌下片中的原料药物应易于直接吸收,主要适用于急症 的治疗。
口腔貼片系指粘贴于口腔,经黏膜吸收后起局部或全身作用的片剂。
口腔貼片应进行溶出度或释放度(通则0931)检查。
咀嚼片系指于口腔中咀嚼后吞服的片剂。
咀嚼片一般应选择甘露醇、山梨醉、蔗糖等水溶性辅料作填充剂和黏合剂。
咀嚼片的硬度应适宜。
分散片系指在水中能迅速崩解并均勻分散的片剂。
分散片中的原料药物应是难溶性的。
分散片可加水分散 后口服,也可将分散片含于口中吮服或吞服。
分散片应进行溶出度(通则0931)和分散均匀性检查。
可溶片系指临用前能溶解于水的非包衣片或薄膜包衣片剂。
中国药典2015版无菌检查方法适用性试验(直接接种法)
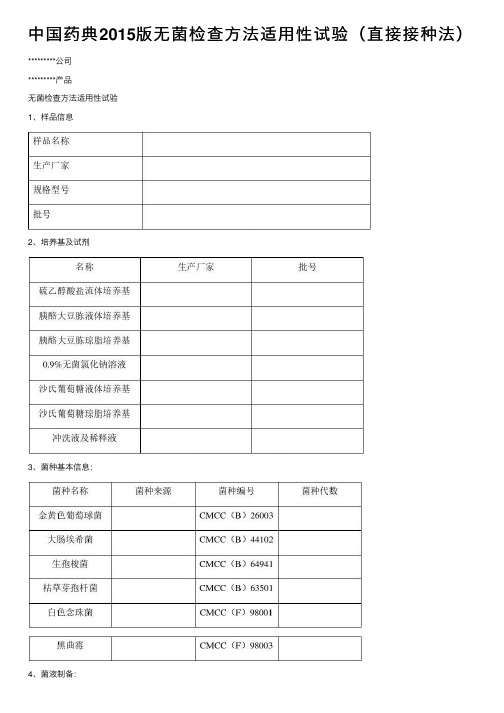
中国药典2015版⽆菌检查⽅法适⽤性试验(直接接种法)*********公司*********产品⽆菌检查⽅法适⽤性试验1、样品信息2、培养基及试剂3、菌种基本信息:4、菌液制备:2.1接种⾦黄⾊葡萄球菌、⼤肠埃希菌、枯草芽孢杆菌的新鲜培养物⾄胰酪⼤⾖胨培养基中或胰酪⼤⾖胨脂培养基上,30~35℃培养18~24⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌悬液。
2.2接种⽣孢梭菌的新鲜培养物⾄硫⼄醇酸盐流体培养基中,30~35℃培养18~24⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌悬液。
2.3接种⽩⾊念珠菌的新鲜培养物⾄沙⽒葡萄糖液体培养基或沙⽒葡萄糖琼脂斜⾯培养基上,20~25℃培养24~48⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml 含菌数⼩于100cfu的菌悬液。
2.4接种⿊曲霉菌的新鲜培养物接种⾄沙⽒葡萄糖琼脂斜⾯培养基上,20~25℃培养5~7天,加⼊3~5ml含0.05%(ml/ml)聚⼭梨酯80的0.9%⽆菌氯化钠溶液,将孢⼦洗脱。
然后,采⽤适宜的⽅法吸出孢⼦悬液⾄⽆菌试管内,⽤含0.05%(ml/ml)聚⼭梨酯80的0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌孢⼦悬液。
6、⽆菌检查直接接种法⽅法适⽤性试验6.1供试品制备:描述供试品制备过程(主要为每个样品的取样部位及⽤量)。
6.2试验组:取装量为 ml硫⼄醇酸盐流体培养基,接种规定的供试品量(同6.1),并接种⼩于100cfu的⾦黄⾊葡萄球菌;⼤肠埃希菌、⽣孢梭菌、枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉按照上述步骤操作,其中⼤肠埃希菌、⽣孢梭菌加⼊硫⼄醇酸盐流体培养基,枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉加⼊胰酪⼤⾖胨液体培养基。
6.3对照组:取装量为 ml硫⼄醇酸盐流体培养基3管,分别接种⼩于100cfu的⾦黄⾊葡萄球菌、⼤肠埃希菌、⽣孢梭菌;取相同装量的胰酪⼤⾖胨培养基3管,分别接种⼩于100cfu枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
灵敏度检査 菌 种 培养基灵敏度检查所用的菌株传代次数不得超过 5 代(从 菌 种 保 存 中 心 获 得 的 干 燥 菌 种 为 第 0 代 ),并 采 用 适 宜的菌种保藏技术进行保存,以保证试验 菌株的 生物 学特 性。 金 黄 色 葡 萄 球 菌 (Staphylococcus aureus ) C C M C C (B) 26 003〕 铜 绿 假 单 胞 菌 (Pseudomonas aeruginosa ) C C M C C ( B) 10 104〕 枯 草 芽 孢 杆 菌 仏 5)〔C M C C ( B ) 6 3 501〕 生 抱 梭 菌 sporogenes) C C M C C ( B ) 64 941〕 白 色 念 珠 菌 albicans) C C M C C ( F ) 98 001〕 黑 曲 霉 n ig e r) C C M C C ( F ) 98 003〕 苗 液 制 备 接 种 金 黄 色 葡 萄 球 菌 、铜 绿 假 单 胞 菌 、枯草 芽孢杆菌的新鲜培养物至胰酪大豆胨液体培养基中或胰酪大 豆 胨 琼 脂 培 养 基 上 ,接 种 生 孢 梭 菌 的 新 鲜 培 养 物 至 硫 乙 醇 酸 盐 流 体 培 养 基 中 ,30〜 35°C培 养 18〜 2 4 小 时 ;接 种 白 色 念 珠菌的新鲜培养物至沙氏葡萄糖液体培养基中或沙氏葡萄糖 琼 脂 培 养 基 上 ,20〜 25°C培 养 24〜 4 8 小 时 ,上 述 培 养 物 用 PH7. 0 无 菌 氣 化 钠 -蛋 白 胨 缓 冲 液 或 0. 9% 无 菌 氣 化 钠 溶 液 制 成 每 l m l 含 菌 数 小 于 lOOcfu( 菌 落 形 成 单 位 )的 菌 悬 液 。接 种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂斜面培养基上, 20〜25*C培 养 5〜7 天 ,加 人 3〜 5 m l含 a 0 5 % (m l/m l) 聚山 梨 酯 8 0 的 pH7. 0 无 菌 氣 化 钠 -蛋 白 胨 缓 冲 液 或 0. 9 % 无 菌 氣 化 钠 溶 液 ,将 孢 子 洗 脱 。然 后 ,采 用 适 宜 的 方 法 吸 出 孢 子 悬 液 至 无 菌 试 管 内 ,用 含 0.05% ( m l/m l) 聚 山 梨 醋 8 0 的 pH7. 0 无 菌 氣 化 钠 -蛋 白 胨 缓 冲 液 或 0. 9 % 无 菌 氣 化 钠 溶 液 制 成 每 l m l 含 孢 子 数 小 于 lOOcfu的 孢 子 悬 液 。 菌 悬 液 若 在 室 温 下 放 置 ,应 在 2 小 时 内 使 用 ;若 保 存 在 2〜8°C可 在 2 4 小 时 内 使 用 。黑 曲 霉 孢 子 悬 液 可 保 存 在 2 〜 8°C,在 验 证 过 的 贮 存 期 内 使 用 。 培 养 基 接 种 取 每 管 装 量 为 12ml的硫乙醇酸盐流体培 养 基 7 支 ,分 别 接 种 小 于 lO O c fu 的 金 黄 色 葡 萄 球 菌 、铜 绿 假 单胞菌、生 孢 梭 菌 各 2 支 ,另 1 支 不 接 种 作 为 空 白 对 照 ,培 养 3 天 ;取 每 管 装 量 为 9 m l的 胰 酪 大 豆 胨 液 体 培 养 基 7 支 ,分 别接种小 于lOOcfu的 枯 草 芽 孢 杆 菌 、白 色 念 珠 菌 、黑 曲 霉 各 2 支,另 1 支不接种作为空白对照,培 养 5 天 。逐 日观 察结果。 结 果 判 定 空 白 对 照 管 应 无 菌 生 长 ,若 加 菌 的 培 养 基 管 均 生 长 良 好 ,判 该 培 养 基 的 灵 敏 度 检 查 符 合 规 定 。
培养基
硫 乙醇 酸盐 流 体 培 养基主要 用于厌氧菌的 培养 ,也可用于
需 氧 菌 的 培 养 ;胰 酪 大 豆 胨 液 体 培 养 基 用 于 真 菌 和 需 氧 菌 的
培养。
培养基的制备及培养条件
培 养 基 可 按 以 下 处 方 制 备 ,亦 可 使 用 按 该 处 方 生 产 的 符
合 规 定 的 脱 水 培 养 基 或 成 品 培 养 基 。配制后应采用验 证合格
溶 液 ,摇 匀 ,调 节 p H , 使 灭 菌 后 在 25°C的 p H 值为
7.1 土0 . 2 。分 装 至 适 宜 的 容 器 中 ,其 装 量 与 容 器 高 度 的 比 例
应 符 合 培 养 结 束 后 培 养 基 氧 化 层 (粉 红 色 )不 超 过 培 养 基 深 度 的 1/2。灭 菌 。在 供 试 品 接 种 前 ,培 养 基 氧 化 层 的 高 度 不 得
3.56g,无 水 磷 酸 氢 二 钠 5 .7 7 g ,氣 化 钠 4.30g, 蛋 白 胨
l.OOg,加 水 1 0 0 0 m l,微 温 溶 解 ,滤 清 ,分 装 ,灭 菌 。
根 据 供 试 品 的 特 性 ,可 选 用 其 他 经 验 证 过 的 适 宜 的 溶 液
作 为 稀 释 液 、冲 洗 液 ( 如 0 .9 % 无 菌 氣 化 钠 溶 液 )。
如 需 要 ,可 在 上 述 稀 释 液 或 冲 洗 液 的 灭 菌 前 或 灭 菌 后 加
人表面活性剂或中和剂等。
方法适用性试验
进 行 产 品 无 菌 检 查 时 ,应 进 行 方 法 适 用 性 试 验 ,以确认 所 采 用 的 方 法 适 合 于 该 产 品 的 无 菌 检 查 。若检验程序 或 产 品 发 生 变 化 可 能 影 响 检 验 结 果 时 ,应 重 新 进 行 方 法 适 用 性 试 验 。
的 灭 菌 程 序 灭 菌 。制 备 好 的 培 养 基 应 保 存 在 2 〜 25°C、避光
的 环 境 ,若 保 存 于 非 密 闭 容 器 中 ,一 般 在 3 周 内 使 用 ;若保
存 于 密 闭 容 器 中 ,一 般 可 在 一 年 内 使 用 。
1. 硫 乙 酵 酸 盐 流 体 培 养 基
胰酪胨 大豆木瓜蛋白酶水解物
1 7 .0g 3. 0g
氣化钠 磷酸氢二钾
5.0g 2. 5g
葡 萄 糖 /无 水 葡 萄 糖 2. 5g/2. 3g
水
1000m l
除 葡 萄 糖 外 ,取 上 述 成 分 ,混 合 ,微 温 溶 解 ,滤 过 ,调 节 p H 使 灭 菌 后 在 2 V C 的 p H 值 为 7. 3 ± 0 . 2 ,加 入 葡 萄 糖 ,
无 菌 检 查 应 在 无 菌 条 件 下 进 行 ,试 验 环 境 必 须 达 到 无 菌 检 査 的 要 求 ,检 验 全 过 程 应 严 格 遵 守 无 菌 操 作 ,防止 微 生 物 污 染 ,防 止 污 染 的 措 施 不 得 影 响 供 试 品 中 微 生 物 的 检 出 。单 向 流 空 气 区 、工 作 台 面 及 环 境 应 定 期 按 医 药 工 业 洁 净 室 (区 ) 悬 浮 粒 子 、浮 游 菌 和 沉 降 菌 的 测 试 方 法 的 现 行 国 家 标 准 进 行 洁 净 度 确 认 。隔 离 系 统 应 定 期 按 相 关 的 要 求 进 行 验 证 ,其内 部环境的洁净度须符合无菌检查的要求。 日常检验还需对试 验环境进行监控。
稀释液、冲洗液及其制备方法
稀 释 液 、冲 洗液配 制后 应采用验证合格的灭菌程序灭菌。
1, 0.1% 无 菌 蛋 白 胨 水 溶 液 取 蛋 白 胨 l.O g ,加 水
1 0 0 0 m l,微 温 溶 解 ,滤 清 ,调 节 p H 值 至 7.1 士 0 .2 ,分 装 ,
灭菌。 2.
、 pH 7.0无 苗 氣 化 钠 - 蛋 白 胨 缓 冲 液 取 磷 酸 二 氢 钾
5 .胰酪大豆胨琼脂培养基
胰酪胨
15.0g
琼脂
1 5 . 0g
大豆木瓜蛋白酶水解物
5.0g
水
1000m l
氣化钠
5.0g
除 琼 脂 外 ,取 上 述 成 分 ,混 合 ,微 温 溶 解 ,调 节 p H 使 灭 菌 后 在 25°C的 p H 值 为 7_3士0.2,加 人 琼 脂 ,加 热 溶 化
胰酪胨
15_ 0g 氣 化钠
2. 5g
酵母浸出粉
5. 0g 新 配 制 的 0. 1 % 刃天
无水葡萄糖
5.0g
青溶液
1.0m l
L-胱氨酸
0. 5g 琼脂
0. 75g
硫乙醇酸钠
0.5g 水
1000ml
(或硫乙醇酸)
(0_3ml)
除 葡 萄 糖 和 刃 天 青 溶 液 外 ,取 上 述 成 分 混 合 ,微 温 溶 解 ,调 节 p H 为 弱 碱 性 ,煮 沸 ,滤 清 ,加 人 葡 萄 糖 和 刃 天 青
分 装 ,灭 菌 。 7 . 沙 氏葡萄糖琼脂培养基
动物组织胃蛋白酶水解物
琼脂
15.0g
和 胰 酪 胨 等 量 混 合 物 1 0 .0g
水
葡萄糖
40.0g
1000m l
除 葡 萄 糖 、琼 脂 外 ,取 上 述 成 分 ,混 合 ,微 温 溶 解 ,调 节 p H 使 灭 菌 后 在 25°C的 p H 值 为 5. 6 士0. 2 ,加 人 琼 脂 ,加
超 过 培 养 基 深 度 的 1/5,否 则 ,须 经 100°C水 浴 加 热 至 粉 红
色 消 失 (不 释 过 2 0 分 钟 ),迅 速 冷 却 ,只 限 加 热 一 次 ,并防
止被污染。 除 另 有 规 定 外 ,硫 乙 醇 酸 盐 流 体 培 养 基 置 3 0 〜 3 5 C
培养。
2.胰酪大豆胨液体培养基
分 装 ,灭 菌 。 胰酪大豆胨液体培养基置20〜2 5 1 培 养 。
3 . 中和或灭活用培养基
