华东理工大学物理化学97-02历年研究生入学试题
2004年华东理工大学物理化学考研试题

华东理工大学2004年硕士研究生入学考试试题一、(24分)1、气体A 的临界温度高于气体B 的临界温度,则气体A 比气体B __液化。
(难、易)2、某实际气体的温度低于其玻义耳温度,在压力较小时pV __n RT .(>,=,<)3、对于封闭系统,在恒压和只做体积功的条件下Q p =H ∆,由于焓是状态函数,所以Q p 也是状态函数,__(对,错)4、如图所示,一过程沿路径(1)由a 膨胀到b ,然后沿路径(2)由b 压缩到c ,试在图上用阴影表示出整个过程所做的功. 图5、系统经一个绝热不可逆过程从初态到达终态,其ΔS ____0(>,=,<)6、理想稀溶液中溶剂A 的化学势表达式为μA =_______________________.7、在式r m G ∆ = -RT ln K 中,r m G ∆ 是化学反应达到平衡时的摩尔吉氏函数的变化值,_______________(对、错)8、在水中加入少量肥皂,所得溶液的表面张力___________同温度下纯水的表面张力.(>,=,<)9、表面张力在数值上等于恒温恒压条件下系统增加单位表面积时环境对系统所做的可逆非体积功._________(对、错)10、当温度趋于0K 时,子配分函数q 0的值趋于___________。
11、随着粒子数增大,ln Ωmax 与ln Ω的差别越来越_________。
(大,小)12、某化合物能与水作用,若它的初浓度为1mol ⋅dm 3-,1小时后降为0.8 mol ⋅dm 3-,2小时后降为0.6 mol/dm 3-,则此反应的反应级数为__________。
13、反应A+3B→2Y 的速率方程为2A A A Bdc k c c dt -=,当,0,0A B c c =1/3时可简化为 3A A dc k c dt'-=,则k '=_____k A 。
14、电解质溶液是靠离子的定向迁移和电极反应导电。
华东理工大学(已有10试题)

华东理工大学化工学院物理化学1991——1992,1994,1996——2007(1997——2003有答案)化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999网络与数据库2003——2006自动控制原理1998控制原理2000——2007运筹学2000——2006高分子化学和物理1998——2007有机化学(含实验)1996——2007硅酸盐物理化学(含实验)1998——2007细胞生物学(含细胞遗传学)2000——2005化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007催化原理2000高分子材料成型加工2004工业水处理2000计算主意2000,2003化学与分子工程学院物理化学1991——1992,1994,1996——2007(1997——2003有答案)综合化学1998——2006有机化学(含实验)1996——2007化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999普通生物化学1996——2004第1 页/共9 页生物化学1996——2002,2005——2007,2010(2010为回忆版)化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007无机化学1998——2004,2007催化原理2000高分子材料成型加工2004工业水处理2000计算主意2000,2003生物工程学院微生物学1996——2007普通生物化学1996——2004生物化学1996——2002,2005——2007,2010(2010为回忆版)综合化学1998——2006化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999食品工艺学2000——2006化学与生物综合2007化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998,2000——2002,2006食品工程2000——2002药物化学2000——2002催化原理2000高分子材料成型加工2004工程经济学2000工业水处理2000计算主意2000,2003机械与动力工程学院机械原理1998——2006机械设计2002——2006机械零件2000——2002机械发明基础2001——2002,2004金属机械性能2002材料力学1998——2007,2010(2010为回忆版)微机技术1997,2000——2004,2006——2007微机原理1998——2007微机原理及接口2002——2006化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999物理化学1991——1992,1994,1996——2007(1997——2003有答案)高分子化学和物理1998——2007理论力学1999——2002自动控制原理1998控制原理2000——2007数据结构与操作系统2007系统软件(含操作系统)1998——2006数据结构与程序设计1996——2002网络与数据库2003——2006计算机应用基础2000——2002泵与压缩机2000——2002工程材料2002——2004工程热力学1996——2004,2007化工容器设计2000——2002金属学2000——2002流体力学(2)2002普通物理2002第3 页/共9 页物理2000宝石学2000催化原理2000高分子材料成型加工2004工程经济学2000工业水处理2000计算主意2000,2003材料科学与工程学院高分子化学和物理1998——2007综合化学1998——2006硅酸盐物理化学(含实验)1998——2007化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999材料科学基础2002——2007物理化学1991——1992,1994,1996——2007(1997——2003有答案)普通生物化学1996——2004生物化学1996——2002,2005——2007,2010(2010为回忆版)化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007宝石学2000高分子材料成型加工2004工程经济学2000工业水处理2000计算主意2000,2003信息科学与工程学院信号与系统(含数字信号处理)2002——2007微机技术1997,2000——2004,2006——2007微机原理1998——2007微机原理及接口2002——2006自动控制原理1998控制原理2000——2007数据结构与操作系统2007系统软件(含操作系统)1998——2006数据结构与程序设计1996——2002网络与数据库2003——2006计算机应用基础2000——2002测量及调节仪表2000——2002模拟电子技术和数字电子技术2000——2002工程经济学2000计算主意2000,2003资源与环境工程学院物理化学1991——1992,1994,1996——2007(1997——2003有答案)环境化学2002——2006化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007传热学2002——2005环境分析与监测2002环境工程(含环境检测)1999——2002煤化学及工艺学2000,2002宝石学2000催化原理2000第5 页/共9 页工程经济学2000工业水处理2000计算主意2000,2003药学院物理化学1991——1992,1994,1996——2007(1997——2003有答案)有机化学(含实验)1996——2007普通生物化学1996——2004生物化学1996——2002,2005——2007,2010(2010为回忆版)药理学1999化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007药物化学2000——2002植物保护2004——2006化学与生物综合2007催化原理2000理学院高等代数1996——2002,2004——2007数学分析1996——2007量子力学1998——2001,2003——2006普通物理2002物理2000艺术设计与传媒学院设计基础2002——2007设计史论2004——2007设计史概(含设计史、设计原理)2002——2003命题设计2002商学院经济学及经济学说史2003——2006(2005有答案)经济学说史(含当代经济学流派)1998——2002(2000——2002有答案)西方经济学1998——2002(2000——2002有答案)国际经济学2002——2006管理学原理2000——2007(2000——2005有答案)企业管理1998,2002国际经济学2006运筹学2000——2006会计学2001——2002财务与会计基础2004——2006管理信息系统2000——2001经济管理基础理论2003——2005(2003——2004有答案)化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999数据结构与操作系统2007系统软件(含操作系统)1998——2006数据结构与程序设计1996——2002网络与数据库2003——2006计算机应用基础2000——2002高等代数1996——2002,2004——2007工程经济学2000社会与公共管理学院环境法学2004——2006法学理论综合2005——2006社会学理论与主意2005——2007第7 页/共9 页社会调查研究主意1998,2000——2002社会研究主意2004——2005社会学概论1998——2004西方社会学史1998——2007政治学原理2004——2007政治学概论2005西方政治制度2004——2005西方社会思想史2000公共管理学2007行政管理学2004——2006(2004有答案)公共政策分析2004——2005社会保障与社会学理论2004——2005社会保障理论2006——2007外国语学院二外德语1998——2007二外日语1998——2007二外法语2004,2006——2007基础英语1999——2007(2004有答案)翻译实践(汉英互译)1998——2007汉语(古,现代汉语)和语言学基础(英)2001——2002人文科学研究院马克思主义哲学原理1999——2001,2003——2007哲学综合2007西方哲学史2005——2006政治学原理2004——2007政治学概论2005马克思主义经典原著选读2007马克思主义基本原理2007西方政治思想史2004——2005,2007西方政治制度2004——2005西方社会思想史2000马克思主义发展史1999伦理学原理2005——2006当代社会发展理论2006马克思主义发展史2003马克思主义社会发展理论2001——2002世界近现代史2005世界近代史2004,2006中国近代史2004,2006中国近现代史2005比较政治制度2006中国社会主义建设2002——2003体育系体育经济学2004——2006体育社会学2004——2006高等教诲研究所教诲学专业基础(全国统考试卷)2007教诲学2004——2006(2004有答案)教诲管理学2006教诲哲学2004科技信息研究所信息管理基础2004——2006第9 页/共9 页。
华东理工大学2009年硕士研究生入学考试试题及答案考试科目:高分子化学与物理

(答案必须写在答题纸上,写在试题上无效)(答案必须写在答题纸上,写在试题上无效)为什么?2、什么叫链转移反应?有几种形式?对聚合速率和分子量有何影响?3. 简述由小分子单体制备合成高分子化合物的三种聚合反应的类型。
4. 苯乙烯是活性很高的单体,乙酸乙烯酯是活性很低的单体,但苯乙烯的均聚速率常数却比乙酸乙烯酯的低,这是为什么?5. 为什么正离子聚合反应一般需要在很低温度下进行?五、图示为苯乙烯本体连续热聚合工艺,苯乙烯在预聚合反应釡1中转化率达20%左右后转送入下工序的聚合塔3中继续聚合,问:①为什么在反应釡1中要控制苯乙烯转化率为20%而不让转化率提高一些,以增加设备的利用率?②如果为了改善聚苯乙烯的脆性,提高其分子量是一个很好的方法,那么在该工艺中如何提高分子量?但又会面临何种负面结果?(15分)(答案必须写在答题纸上,写在试题上无效)(答案必须写在答题纸上,写在试题上无效)(答案必须写在答题纸上,写在试题上无效)(答案必须写在答题纸上,写在试题上无效)(答案必须写在答题纸上,写在试题上无效)(答案必须写在答题纸上,写在试题上无效)五、图示为苯乙烯本体连续热聚合工艺,苯乙烯在预聚合反应釡1中转化率达20%左右后转送入下工序的聚合塔3中继续聚合,问:①为什么在反应釡1中要控制苯乙烯转化率为20%而不让转化率提高一些,以增加设备的利用率?②如果为了改善聚苯乙烯的脆性,提高其分子量是一个很好的方法,那么在该工艺中如何提高分子量?但又会面临何种负面结果?(15分)答:(1)聚合初期,转化率从0%-20%左右,聚合速率变化不大,由于苯乙烯单体是聚合物的良溶剂,体系粘度也不大,反应热很容易排除。
如果转化率进一步提高,体系由于体系粘度增大,此时容易出现自加速现象,反应热大量放出,局部过热影响产物的质量和产量,甚至暴聚,所以,在反应釜中的转化率不能太高。
(7分)(2)提高分子量,由于聚合度随着温度的升高而降低,因此对于热聚合体系,可以通过降低反应温度来实现,但是这样体系粘度也会大大增加,引起物料流动困难,另外,速率下降,也可能导致反应不完全。
华东理工大学1997-2010考研化工原理试题

华东理工大学2010年化工原理部分考研真题一、简答题(10道题的顺序可能和真题不一样,但是内容一致):1.等板高度HETP的含义是什么?答:分离效果相当于一块理论板的填料塔高度。
2.常用的吸附剂有哪些?答:活性炭,硅胶,活性氧化铝,活性土,沸石分子筛,吸附树脂等。
3.萃取溶剂的必要条件是什么?答:1.与物料中B组分不互溶;2.对组分A具有选择性溶解。
4.何谓载点,泛点?答:载点:气液两相流动的交互作用开始变得比较显著的操作状态;泛点:气速进一步增大至压降陡增,在压降-气速曲线图表现为曲线斜率趋于垂直的转折点。
5.搅拌器应具备哪两种功能?强化搅拌的工程措施有哪些?答:功能:1.产生总体流动;2.产生湍动或剪切力场。
措施:1.提高转速;2.阻止液体圆周运动,如加档板,搅拌器离心或者倾斜安装;3.安装导流筒,消除短路,死区。
6.非牛顿型流体中,塑性流体的特点?答:只有施加的剪应力超过某一临界值时才开始流动,流动后多数具有剪切稀化特性,少数也具有剪切增稠特性。
7.临界含水量受哪些因素影响?答:1.物质本身性质,结构,分散程度;2.干燥介质条件:气速,温度,湿度。
8.液体沸腾的另个必要条件?答:1.过热度;2.汽化核心。
9.什么是自由沉降速度?答:重力作用下,沉降速度的增大,颗粒受阻力增大,当阻力等于其重力时的速度。
10.数学模型法的主要步骤有哪些?答:1.简化物理模型;2.建立数学模型;3.参数测定,模型检验。
二、带泵管路如图,用离心泵把水从A输送到E点,各段管路管径均为106mm×3mm,λ=0.03,AB段,DE段长度均为20m,CD段埋地下,长度为3000m。
离心泵的特性曲线为He=10+5×105qv。
(1)管路液体流量、离心泵的有效功率。
(2)管路正常时,DE上的孔板流量计高度差为R=200mm,现在CD段漏液,漏液量为0.004 m3/s,此时孔板流量计高度差为R=160mm,(孔板流量计C0为常数)求此时离心泵出口压强为多少。
华东理工大学《802物理化学》历年考研真题专业课考试试题

(4)该反应的Ky随温度升高变大还是变小?为什么?
六、(19分)
1.物质A(g)在450K于一恒容容器中发生气相分解反应A(g) B(g)+D(g)。反应开始时只有A(g)存在,压力为213kPa。反应进行到100s 时,系统总压为233kPa。试求此一级反应的速率系数,A的半衰期以及 120s时A的转化率。
(1)若气相总压为0.1mpa,则气相中苯和盐酸的摩尔分数;
(2)在气相总压为0.1mpa下1kg苯可以溶解多少千克盐酸。
四、2000年第六大题原题,有关二氧化氮那个。
五、离子独立移动定律,简单,给出醋酸钠、盐酸、和氯化钠的无限稀 释摩尔电导率,求醋酸求离子强度,分别求出氯化钾0.01mol/L、氯化镁 0.01mol/L的离子强度。表示出平均离子活度、离子活度与质量摩尔浓度 b和平均活度因子的关系。
2006年华东理工大学451物理化学考研 真题
2005年华东理工大学451物理化学考研 真题
2004年华东理工大学451物理化学考研 真题
2003年华东理工大学451物理化学考研 真题
2014年华东理工大学802物理化学考研真题(回忆版)
2012年华东理工大学802物理化学考研真题(回忆版)
一、摩尔单原子理想气体分子从0.1mpa、300k、绝热可逆至400k,求终 态压力、ΔU、ΔH、ΔS、W、Q。
11.一平动子处于能量
的能级上,则此能级的简并度
gt=______。 12.摩尔电导率 是电解质溶液浓度______时的摩尔电导率。(很小, 无限稀释,等于零) 13.用对消法测定电池反应的电势,目的在于______。(A.保护标准电 池;B.延长被测电池的寿命;C.使电池在接近可逆条件下工作) 二、(21分) 2mol理想气体由1013.25kPa,10dm ,609.4K的初态,在101.325kPa的 恒定外压下膨胀至80dm3,且内外压力相等。求此过程的Q、W、 、
华东理工大学物理化学97-02历年研究生入学试题解答
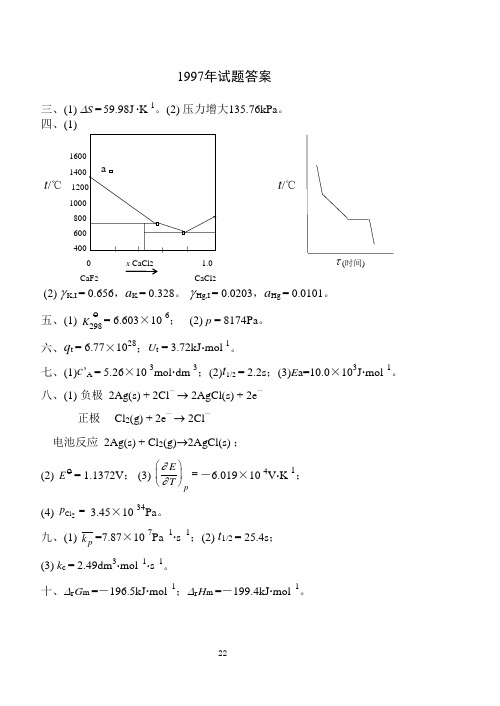
三、(1) ∆S = 59.98J ∙K -1。
(2) 压力增大135.76kPa 。
四、(1)1600 1400 t /℃ 1200 t /℃ 1000 800 600 400 0 x CaCl 2 1.0 τ (时间) CaF 2 CaCl 2(2) γ K,I = 0.656,a K = 0.328。
γ Hg,I = 0.0203,a Hg = 0.0101。
五、(1) K 298o= 6.603×10-6; (2) p = 8174Pa 。
六、q t = 6.77×1028;U t = 3.72kJ ∙mol -1。
七、(1)c ’A = 5.26×10-3mol ∙dm -3;(2)t 1/2 = 2.2s ;(3)E a=10.0×103J ∙mol-1。
八、(1) 负极 2Ag(s) + 2Cl — → 2AgCl(s) + 2e —正极 Cl 2(g) + 2e —→ 2Cl —电池反应 2Ag(s) + Cl 2(g)→2AgCl(s) ; (2)E o= 1.1372V ; (3) ∂∂E T p⎛⎝⎫⎭⎪=-6.019×10-4V ∙K -1; (4) p Cl 2= 3.45×10-34Pa 。
九、(1) k p =7.87×10-7Pa -1∙s -1;(2) t 1/2 = 25.4s ; (3) k c = 2.49dm 3∙mol -1∙s -1。
十、∆rG m =-196.5kJ ∙mol -1;∆rH m =-199.4kJ ∙mol -1。
- - a- -- -二、(1)质量百分数:2.81%。
(2) p总= 85.50kPa,V O2= 59.70cm3。
三、∆r o mH,1000=-21.73kJ∙mol-1。
四、V2 = 2.80dm3;T2 = 134.7K;∆U = -1.68kJ;∆H = -2.80kJ;∆S = -20.17J∙K-1;W = 2240J。
2000年华东理工大学物理化学考研真题答案

2000年华东理工大学物理化学考研真题答案物理化学作为化学学科的重要分支,对于深入理解化学现象和过程具有关键意义。
以下是 2000 年华东理工大学物理化学考研真题的答案及相关解析。
一、选择题1、理想气体在绝热可逆膨胀过程中()A 温度不变B 熵不变C 内能不变D 焓不变答案:B解析:绝热可逆过程熵不变。
理想气体绝热可逆膨胀时,对外做功,内能降低,温度下降,焓也降低。
2、对于封闭体系,在指定始终态间的绝热可逆途径可以有()A 一条B 二条C 三条D 无限多条答案:A解析:绝热可逆过程中熵不变,对于给定的始终态,熵值确定,所以只有一条绝热可逆途径。
3、 1mol 理想气体经一等温可逆压缩过程,则()A ΔG >ΔAB ΔG <ΔAC ΔG =ΔAD 无法比较答案:C解析:对于等温可逆过程,ΔG =ΔA 。
4、已知反应 A + B = C + D 的速率方程为 r = kAB²,则该反应()A 一定是基元反应B 一定是非基元反应C 不能确定是否为基元反应D 为二级反应答案:C解析:速率方程不能直接确定反应是否为基元反应。
该反应为三级反应。
5、某反应的活化能为 80 kJ·mol⁻¹,当反应温度由 293K 升高到303K 时,其反应速率常数约为原来的()A 2 倍B 3 倍C 4 倍D 5 倍答案:B解析:根据阿仑尼乌斯公式 k₂/k₁= expEa/R(1/T₁ 1/T₂) ,计算可得约为 3 倍。
二、填空题1、在恒温恒压下,纯物质的化学势μ 随温度 T 的变化率为 S。
2、某理想气体在绝热条件下向真空膨胀,其ΔU = 0 ,ΔH = 0 。
3、克劳修斯不等式的表达式为:∫(δQ/T) ≤ 0 。
4、电池反应 Ag⁺+ Cl⁻= AgCl(s) 的标准电动势 E⁰= 02223 V 。
5、朗缪尔吸附等温式为:θ = bp/(1 + bp) ,其中 b 为吸附系数。
三、简答题1、简述热力学第二定律的两种表述。
华东理工大学物理化学97-02历年研究生入学试题

1997年物化试题一、(16分)(1) 理想气体温度计以 为测温性质。
(2) 实际气体的压缩因子Z 。
( ①不会等于1;②可以大于、等于、小于1。
) (3) 已知1mol CO 2气体分子的已占体积 b = 0.0427×10-3m 3mol -1。
若气体可视为van der Waals 流体,则1mol CO 2气体分子本身的体积为 。
(4) 在两个不同温度热源间运转着两个可逆热机,其工作介质分别为水和理想气体,则这两个可逆热机的效率 。
(相同,不相同)(5) 一绝热、密闭容器中的氢气和氧气经点燃后迅速化合成水,其熵变∆S 0。
(>,=,<)(6) 如下两个偏导数,何者是偏摩尔量。
( )①∂∂G n T V ni j [i]⎛⎝ ⎫⎭⎪,, ; ②∂∂H n T p ni j [i]⎛⎝ ⎫⎭⎪,,(7) 对于化学反应0=∑νB BB ,其化学平衡条件为 。
(8) 若化学反应系统可视为理想溶液,则o K K x 。
(>,=,<) (9) 系统存在弯曲界面时的力平衡条件通式为 。
(10) 气体在固体表面上吸附的BET 理论与兰缪尔理论,它们最显著的不同是 。
(11) 在相同温度下移动子、线型刚体转子、单维简谐振子,何者的配分函数最大。
。
(12) 能量标度零点设在基态能级上的电子配分函数q 0 e 与电子基态能级的简并度g e 0之间的关系为 。
(13) 正反应放热的对峙反应的基本特征是 。
(14) 过渡状态理论认为,双分子基元反应的模式为_________________________ 。
(15) 已知25℃时,在无限稀释水溶液中 Na + 和21SO 42—的摩尔电导率分别为50.1×10 -4S ∙m -2∙mol -1和79.8×10 -4S ∙m -2∙mol -1,则 Na 2SO 4 的___________m =Λ∞。
(16) 电池 Ag, AgCl(s) |Cl — ¦ ¦A g + | Ag 应该用 做盐桥。
华东理工大学97-02物理化学试题

1997年物化试题一、(16分)(1) 理想气体温度计以 为测温性质。
(2) 实际气体的压缩因子Z 。
( ①不会等于1;②可以大于、等于、小于1。
) (3) 已知1mol CO 2气体分子的已占体积 b = 0.0427×10-3m 3mol -1。
若气体可视为van der Waals 流体,则1mol CO 2气体分子本身的体积为 。
(4) 在两个不同温度热源间运转着两个可逆热机,其工作介质分别为水和理想气体,则这两个可逆热机的效率 。
(相同,不相同)(5) 一绝热、密闭容器中的氢气和氧气经点燃后迅速化合成水,其熵变∆S 0。
(>,=,<)(6) 如下两个偏导数,何者是偏摩尔量。
( )①∂∂G n T V ni j [i]⎛⎝ ⎫⎭⎪,, ; ②∂∂H n T p ni j [i]⎛⎝ ⎫⎭⎪,,(7) 对于化学反应0=∑νB BB,其化学平衡条件为 。
(8) 若化学反应系统可视为理想溶液,则o K K x 。
(>,=,<) (9) 系统存在弯曲界面时的力平衡条件通式为 。
(10) 气体在固体表面上吸附的BET 理论与兰缪尔理论,它们最显著的不同是 。
(11) 在相同温度下移动子、线型刚体转子、单维简谐振子,何者的配分函数最大。
。
(12) 能量标度零点设在基态能级上的电子配分函数q 0 e 与电子基态能级的简并度g e 0之间的关系为 。
(13) 正反应放热的对峙反应的基本特征是 。
(14) 过渡状态理论认为,双分子基元反应的模式为_________________________ 。
(15) 已知25℃时,在无限稀释水溶液中 Na + 和21SO 42—的摩尔电导率分别为50.1×10 -4S ∙m -2∙mol -1和79.8×10 -4S ∙m -2∙mol -1,则 Na 2SO 4 的___________m =Λ∞。
(16) 电池 Ag, AgCl(s) |Cl — ¦ ¦A g + | Ag 应该用 做盐桥。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H o (298) f m kJ mol 1 -127.03
o (298) Sm
J K 1 mol 1
AgCl (s) Ag (sபைடு நூலகம் Cl2 (g)
96.11 42.70 222.96
九、(14分) A的分解反应 A(g) B(g) + C(g) 在380K下于一密闭容器中进行,反应开始时只 有A存在。当初压力为50.0 kPa时,实验测得反应到180 s和720 s时系统的总压分别为 93.8 kPa和98.3 kPa。设气体服从理想气体状态方程。 (1) 试求该二级反应的速度常数(以Pa-1s-1为单位表示); (2) 试求此反应的半衰期; (3) 以dm3mol-1s-1为单位表示此反应的速度常数。
1997年物化试题
一、(16分) (1) 理想气体温度计以 (2) 实际气体的压缩因子Z 为测温性质。 。( ①不会等于1;②可以大于、等于、小于1。)
(3) 已知1mol CO2气体分子的已占体积 b = 0.0427×10-3m3mol -1。若气体可视为 van der Waals 流体,则1mol CO2气体分子本身的体积为 。
37.7 31.4
25℃时CH3COOH(l)的蒸发热为49.25kJmol-1。 四、(16分) 1mol 单原子理想气体,由0.2 MPa、11.2 dm 的初态,经 pT = 常数的可逆途径压 缩到0.4 MPa。试求终态体积V2、温度T2以及U、H、S、W。 五、(14分)
* * (1) 在温度 T K 时,纯物质液体 A 和 B 的饱和蒸气压分别为 pA 和 pB ,并且 * p * > p ,设二者可以形成理想溶液。试证明此温度下溶液的蒸气总压 p总 介于 p * B A A
-947.7 -1130.9 -241.84 -393.51
102.1 136.0 188.74 213.68
(1) 求25℃时反应的标准平衡常数。 (2) 设反应的Cp = 0,求60℃时NaHCO3(s)的分解压力。
六、(10分) 计算298K、101325 Pa下1mol H2 的移动配分函数qt和移动对内能的贡献Ut。已知 H2 的摩尔质量为2.016 gmol -1,普朗克常数 h = 0.6626×10-33Js,玻尔兹曼常数 k = 13.8110-24JK-1,阿伏加德罗常数NA= 6.0221023mol -1。假定H2可视为理想气体。
T 0 K
和 lim S =________。试表述能斯特热定理
T 0 K
G
G
_________________________________________。 (10) 写出任意一个表面相的热力学基本方 程___________________________。 (11) 试写出子分配函数的析因子性质 ________________________________________。 (12) 试写出玻尔兹曼关系式________ 0 T H H
_________________。阐明其物理意义______________________________________。 (13) 阿仑尼乌斯方程 k Ae E a / R T 是否适用于所有的化学反应?________。 (是,不是)
4
二、(10分)
H2O + 2 O2。今在一定温度 H2O2水溶液在KI存在下发生分解反应:H2O2
(13) 正反应放热的对峙反应的基本特征是
(14) 过渡状态理论认为,双分子基元反应的模式为_________________________ 。 (15) 已知25℃时,在无限稀释水溶液中 Na+ 和 1 SO42—的摩尔电导率分别为50.1 2 ×10 -4Sm-2mol -1和79.8×10 -4Sm-2mol -1,则 Na2SO4 的 。 m ___________ — + (16) 电池 Ag, AgCl(s) Cl ¦¦ Ag Ag 应该用 做盐桥。
dS -dQ / T 0可以简化为dG 0的形式?___________________________。 (6) 多组分多相封闭系统的相平衡条件可以表达为________________。 (7) 对于K个组分,各组分物质的量分别为n1,n2,…,nk的均相系统,其容量性 质X与偏摩尔量Xi 之间的关系为_____________________。 (8) 在何种情况下拉乌尔定律和亨利定律才相一致?______________________ (9) 将凝聚相中的化学反应设计成可逆的原电池,得到其H和G随温度的变 化如右图。据此能斯特得到了 lim Cp = ______
十、(12分) 已知饱和韦斯顿标准电池的电动势E(V)与温度t(℃)的关系式为: E = 1.01865-4.05×10-5(t-20)-9.5×10-7(t-20)2 试求298K下2F 电量通过该电池时电池反应的rGm和rHm。
3
1998年试题
一、(16分) (1) 物质的量的基本单元可以是原子、分子、离子、自由基、电子等,也可以是 这些粒子的特定组合。 (对、错)
;
j [i]
② H n i T , p ,n
j [i]
(7) 对于化学反应 0 B ,其化学平衡条件为 B
B
。 Kx 。(>,=,<) 。
(8) 若化学反应系统可视为理想溶液,则 K o (9) 系统存在弯曲界面时的力平衡条件通式为
(10) 气 体 在 固 体 表 面 上 吸 附 的 BET 理 论 与 兰 缪 尔 理 论 , 它 们 最 显 著 的 不 同 是 。 (11) 在相同温度下移动子、线型刚体转子、单维简谐振子,何者的配分函数最 大。 。 (12) 能量标度零点设在基态能级上的电子配分函数q0 e 与电子基态能级的简并度 ge 0之间的关系为 。 。
2
(3) A和B的初始浓度如上,实验测得400K下,反应进行20s后cA=3.910-3moldm-3, 试求该反应的活化能。 设在300~400K温度范围内活化能不随温度而变。 八、(12分) 已知电池:-)Ag, AgCl(s) HCl(0.1m) Cl2(101325Pa), Pt (+ (1) 试写出电极反应和电池反应; (2) 计算25℃时该电池的电动势; (3) 计算25℃时该电池电动势的温度系数; (4) 计算25℃时AgCl(s)的分解压力。 已知数据如下:
3
与 pB 之间。 (2) 20℃时,HCl气体溶于苯中形成理想稀溶液。当达气液平衡时,液相中HCl的 摩尔分数为 0.0385 ,气相中苯的摩尔分数为 0.095 。已知 20 ℃时苯的饱和蒸气压为 10.010kPa 。试求:① 气液平衡时的气相总压;② 20 ℃时 HCl 在苯中溶解的亨利常 数。
七、(14分) 化学反应 A + 2B P 的动力学方程式为:
dcA . kA cA 0.5cB15 dt
(1) 当A和B的初始浓度分别为100.010-3moldm-3和200.010-3 moldm-3时,实验测 得300K下,反应进行20s后,A的浓度cA=10.010-3moldm-3。试求再继续反应20s后它 的浓度c’A。 (2) 试求300K时速度常数kA、kB及反应物A的半衰期。
o。 求反应CH3COOH(g) CH4(g) + CO2(g) 在1000K时的标准摩尔反应焓 r H m
3
已知数据如下:
物 质
o (298.15K) f Hm kJ mol
1
C p,m J K 1 mol 1
52.3
CH3COOH(g) CH3COOH(l) CH4(g) CO2(g) 484.09 74.85 393.51
二、(12分) 将一定量的理想气体置于右图所示的绝 热容器Ⅰ中,另一绝热容器Ⅱ是抽空的。开 启连接两绝热容器的活塞后,理想气体便从 容器Ⅰ流向容器Ⅱ,直至两容器压力相等, 发现气体温度没有变化。试由该实验证明: (1) 理想气体的内能U仅是温度T 的函数。 (2) 对于理想气体的任何过程,公式dU = nCv,mdT 都成立。 三、(12分) (1) 将2mol、10℃、101325Pa的H2O(s)变为25℃、101325Pa的H2O(l),试求其熵 变。已知 H2O(s)在 0 ℃的熔化热为 333.4Jg-1 , 10~0℃范围内H2O(s)的平均比热容为 2.067JK-1g-1 , 0 ~ 25 ℃范围内 H2O(l) 的平均比热容为 4.184JK-1g-1 , H2O 的摩尔质量 为18.02gmol-1。 (2) 已知在0℃和101325Pa下H2O(s)和H2O(l)的密度分别为0.9175与1.000gcm-3。试 计算当压力变化多少时,其熔点才能下降0.01℃。 四、(12分) (1). CaF2 和CaCl2 的二元液固相图具有如下特征:CaF2 和CaCl2 分别于1360℃和 772℃熔化;当摩尔比 nCaF : nCaCl =1:1时形成不稳定化合物CaF2CaCl2。不稳定化合
-
1200 1000 800 600 400 0 CaF2
a
t/℃
x CaCl2
1.0 CaCl2
(时间)
1
(2). 在661K,液态K和Hg的饱和蒸气压分别为0.433kPa和170.6kPa。现有一K和Hg 的等摩尔液态溶液在该温度下达气液平衡,实验测得K和Hg的蒸气压分别为0.142kPa 和1.73kpa。试按照活度标准状态的惯例 I,求K和Hg的活度系数及活度。
五、(12分) NaHCO3(s)的热分解反应为 2NaHCO3(s) = Na2CO3(s) + H2O(g) + CO2(g) 已知数据如下:
物 质
H o (298) f m kJ mol 1
