圆二色光谱_CD_分解
圆二色谱概述

圆二色谱一、圆二色谱圆二色光谱(简称CD)是应用最为广泛的测定蛋白质二级结构的方法,是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法。
它可以在溶液状态下测定,较接近其生理状态。
而且测定方法快速简便,对构象变化灵敏,所以它是目前研究蛋白质二级结构的主要手段之一,并已广泛应用于蛋白质的构象研究中。
二、圆二色谱的基本原理光是横电磁波,是一种在各个方向上振动的射线。
其电场矢量 E 与磁场矢量H 相互垂直,且与光波传播方向垂直。
由于产生感光作用的主要是电场矢量,一般就将电场矢量作为光波的振动矢量。
光波电场矢量与传播方向所组成的平面称为光波的振动面。
若此振动面不随时间变化,这束光就称为平面偏振光,其振动面即称为偏振面。
平面偏振光可分解为振幅、频率相同,旋转方向相反的两圆偏振光。
其中电矢量以顺时针方向旋转的称为右旋圆偏振光,其中以逆时针方向旋转的称为左旋圆偏振光。
两束振幅、频率相同,旋转方向相反的偏振光也可以合成为一束平面偏振光。
如果两束偏振光的振幅(强度) 不相同,则合成的将是一束椭圆偏振光。
光学活性物质对左、右旋圆偏振光的吸收率不同,其光吸收的差值ΔA ( Al -Ad) 称为该物质的圆二色性(circular dichroism,简写作CD) 。
圆二色性的存在使通过该物质传播的平面偏振光变为椭圆偏振光,且只在发生吸收的波长处才能观察到。
所形成的椭圆的椭圆率θ为:θ= tg-1 短轴/长轴根据Lambert-Beer 定律可证明椭圆率近似地为:θ= 0. 576lc (εl-εd) = 0. 576lcΔε公式中l 为介质厚度, c 为光活性物质的浓度,εl 及εd分别为物质对左旋及右旋圆偏振光的吸收系数。
测量不同波长下的θ(或Δε) 值与波长λ之间的关系曲线,即圆二色光谱曲线。
在此光谱曲线中,如果所测定的物质没有特征吸收,则其Δε值很小,即得不到特征的圆二色光谱。
当εl >ε d 时,得到的是一个正的圆二色光谱曲线,即被测物质为右旋,如果εl <ε d ,则得到一个负的圆二色光谱曲线,即被测物质为左旋。
圆二色谱CD原理

旋光物质使左、右圆偏振光的速度不同,即其色散大小的折射率不同,
旋光现象的产生是由于光学各向异性物质的折射率nL≠nR的结果。
旋光,双折射
8、光的吸收和圆二色性(circular dichroism, CD)
化合物在正常情况下,处于低能的基态, 电子占据所有的成键轨道(σ、π、n轨 道)。如果电子吸收了外界的能量,它就 从基态跃迁到激发态能级。 如果所有的跃迁仅在基态的最低振动能级 和第一激发态之间,吸收光谱将是很狭窄 而不连续的谱线。 由于分子的价电子跃迁总伴随着振动和转 动能级的跃迁,所以,紫外分光光度计测 定物质的吸收光谱,虽然有一最大吸收峰 值,但都是具有一定波长宽度并相对平滑 的曲线。
what about 50oC? t = xoo + x7575 fits best with
xo = 50% x75= 50%
fit to GCN4-p1 50 C data
10
O
5
original data O O best fit with mix of 0 C and 75 C spectra
. .. . . .. .
起偏器 检偏器
晶轴夹角为α时, 透射光强度与 cos2α成正比。
晶轴相互垂直时, 透射光强度为零;
3、平面偏振光(Plane polarized light)
也称线(完全)偏振光,简称偏振光。 它的振动面称为其偏振面。 振动方向保持不变
振幅发生周期性变化
E之端点在空间的轨迹为一平面正弦曲线 投影到垂直于光传播方向的平面上为一直线段
PMT的输出信号由正比于IA的直流分量和正比于S的交流分量所组成。
圆二色光谱仪工作原理
生物分析 圆二色光谱

圆二色光谱分析法引言五十年代初,生物学研究从宏观领域深入到微观领域,开创了分子生物学的新时代。
随着研究的不断深入和发展,生物学已发展成最活跃的学科之一。
手性(Chirality)是物质结构中的重要特征.即具有不能重叠的三维镜像对映异构体,它们的分子式完全相同,但其中原子或原子基团在空间的配置不同,互为镜像。
凡手性分子都具有光学活性,即可使偏振光的振动面发生旋转。
生物基础分子一般都具有手性,也都具有光学活性。
在自然界中,氨基酸有L型和D型两种对映异构体,组成蛋白质的20种氨基酸,除最简单的甘氨酸不具有手性外,其余都是L型的[1]。
手性分子都具有光学活性。
当单色左旋与右旋的圆偏振光通过某一种手性样品时,该样品对左、右旋圆偏振光的吸收不同,这叫做圆二色性(Circular Dichroism)。
其差值△A=△A L-△A R称为圆二色值,按波长扫描就得到了圆二色谱(CD谱)。
CD谱是特殊的吸收谱,它比一般的吸收谱弱几个量级,但由于它对分子结构十分敏感,因此近十几年来,CD已成为研究分子构型(象)和分子间相互作用的最重要的光谱实验之一。
利用CD研究生物大分子和药物分子,具有重要的科学意义和实用价值[2,3]。
一、蛋白质的圆二色性蛋白质是由氨基酸通过肽键连接而成的具有特定结构的生物大分子。
蛋白质一般有一级结构、二级结构、超二级结构、结构域、三级结构和四级结构几个结构层次[4-6]。
在蛋白质或多肽中,主要的光活性基团是肽链骨架中的肽键、芳香氨基酸残基及二硫桥键。
当平面圆偏振光通过这些光活性的生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的吸收不相同,产生的吸收差值,由于这种吸收差的存在,造成了偏振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是蛋白质的圆二色性。
圆二色性的大小常用摩尔消光系数差△ (M-1 ·cm-1 )来度量。
蛋白质的CD光谱一般分为两个波长范围,即178—250 nm为远紫外区CD光谱,250—320 nm为近紫外区CD光谱, 具有不同二级结构的蛋白质或多肽所产生CD谱带的位置、吸收的强弱都不相同。
CD(圆二色)光谱的理论和实验

P2
M2 P1 M3
M5
S3 L
F CDM
SH
PM
赵南明, 周梦海 《生物物理学》 /products/cd
园二色谱的应用
圆二色光谱利用左旋、右旋偏振光( 手性光)通过一定的物质时所显示的总的 旋光性的不同, 而判定该物质的结构或结构变化。
1.测定生物大分子的结构
2 12 2 , 0 V12 r12 1 2 , 0 2 , , r12
N. Berova and K. Nakanishi, Circular Dichroism: Principles and Applications, Wiley-VCH, New York, 2nd ed., 2000 Exciton Chirality: Fundamentals and Frontiers, Monatsh. Chem., 2005, 136(3)
Ⅴ停留技术&固态CD光谱
亮氨酸拉链式多肽在GdmCl中变形后再折叠过 程在220nm处的停留CD曲线
PVA 膜、α - Ni(H2O)6.SO4 单晶的固态 CD谱
M. Kelly, et al., Biochimica. Biophysica., 2005, 1751, 119-139 R. Kuroda, et al., Rev. Sci. Instrum., 2001, 72, 3802-3810
生物分析 圆二色光谱

圆二色光谱分析法引言五十年代初,生物学研究从宏观领域深入到微观领域,开创了分子生物学的新时代。
随着研究的不断深入和发展,生物学已发展成最活跃的学科之一。
手性(Chirality)是物质结构中的重要特征.即具有不能重叠的三维镜像对映异构体,它们的分子式完全相同,但其中原子或原子基团在空间的配置不同,互为镜像。
凡手性分子都具有光学活性,即可使偏振光的振动面发生旋转。
生物基础分子一般都具有手性,也都具有光学活性。
在自然界中,氨基酸有L型和D型两种对映异构体,组成蛋白质的20种氨基酸,除最简单的甘氨酸不具有手性外,其余都是L型的[1]。
手性分子都具有光学活性。
当单色左旋与右旋的圆偏振光通过某一种手性样品时,该样品对左、右旋圆偏振光的吸收不同,这叫做圆二色性(Circular Dichroism)。
其差值△A=△A L-△A R称为圆二色值,按波长扫描就得到了圆二色谱(CD谱)。
CD谱是特殊的吸收谱,它比一般的吸收谱弱几个量级,但由于它对分子结构十分敏感,因此近十几年来,CD已成为研究分子构型(象)和分子间相互作用的最重要的光谱实验之一。
利用CD研究生物大分子和药物分子,具有重要的科学意义和实用价值[2,3]。
一、蛋白质的圆二色性蛋白质是由氨基酸通过肽键连接而成的具有特定结构的生物大分子。
蛋白质一般有一级结构、二级结构、超二级结构、结构域、三级结构和四级结构几个结构层次[4-6]。
在蛋白质或多肽中,主要的光活性基团是肽链骨架中的肽键、芳香氨基酸残基及二硫桥键。
当平面圆偏振光通过这些光活性的生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的吸收不相同,产生的吸收差值,由于这种吸收差的存在,造成了偏振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是蛋白质的圆二色性。
圆二色性的大小常用摩尔消光系数差△ (M-1 ·cm-1 )来度量。
蛋白质的CD光谱一般分为两个波长范围,即178—250 nm为远紫外区CD光谱,250—320 nm为近紫外区CD光谱, 具有不同二级结构的蛋白质或多肽所产生CD谱带的位置、吸收的强弱都不相同。
测圆二色谱

百泰派克生物科技
测圆二色谱
圆二色谱也称圆二色光谱,是一种根据物质的圆二色性(circular dichroism,CD)发展而来的蛋白质空间结构研究技术。
圆二色性是指当平面偏振光经过光活性物质时,由于光活性物质对左、右圆偏振光的吸收不同,导致左、右圆偏振光变成椭圆偏振光的现象。
大多数具有活性的生物大分子由于其不对称的空间结构都具有光学活性,均可作为圆二色谱研究的对象。
蛋白质是一种典型的光学活性物质,其不对称的二级构象,如α-螺旋、β-折叠、β-转角等使其具有圆二色性。
因此,可以利用圆二色谱对其二级折叠进行检测,
通常用于确定表达的纯化蛋白质是否有二级折叠或结构突变,其构象或稳定性是否改变。
圆二色谱分析检测速度快、灵敏度好,对样品浓度和性质也没有过高的要求,已广泛用于蛋白质的二级、三级空间结构表征。
百泰派克生物科技提供专业的蛋白质的圆二色谱分析服务测定蛋白质的空间构型构象,欢迎免费咨询。
圆二色谱

圆二色谱圆二色谱是一种特殊的吸收普,它对手性分子的构象十分敏感,因此它是最重要的光谱实验之一。
手性是物质结构中的重要特征,即具有不能重叠的三维镜像对映异构体,它们的分子式完全相同,但其中原子或原子基团在空间的配置不同,互为镜像。
凡手性分子都具有光学活性,即可使偏振光的振动面发生旋转。
许多有机物和络合物都具有手性,它们的对映异构体物理化学性质(熔点、沸点、旋光度、溶解度、分子式等)几乎完全相同,但它们的旋光方向相反,生理作用大不相同。
生物基础分子一般都具有手性,也都具有光学活性。
在对生物分子手性的研究中,发现了令人惊异至今不解的对称性破缺现象,那就是在自然界中,氨基酸有L型和D型两种对映异构体,天然糖也有L糖和D糖两种糖。
但在生物体中,组成蛋白质的20种氨基酸,除最简单的甘氨酸不具有手性外,其余都是L型的,而生物体核酸中的糖环则都是D型的。
生物体中这种对称性破缺现象是有特殊意义的自然现象。
手性分子都具有光学活性。
当单色左旋与右旋的圆偏振光通过某一种手性样品时,该样品对左、右旋圆偏振光的吸收不同,这叫做圆二色性。
其差值△A=△AL一△AR称为圆二色值,按波长扫描就得到了圆二色谱(CD谱)。
利用法拉第效应,在外加磁场作用下,许多原来没有光学活性的物质也具有了光学活性,原来可测出CD谱的在磁场中CD信号将增大几个量级。
这种条件下即可测得磁圆二色谱(MCD谱)。
CD和MCD是特殊的吸收谱,它们比一般的吸收谱弱几个量级,但由于它们对分子结构十分敏感,因此近十几年来,CD和MCD 已成为研究分子构型和分子间相互作用的最重要的光谱实验之一。
利用CD和MCD 研究生物大分子和药物分子,具有重要的科学意义和实用价值。
基本定义和原理一束平面偏振光通过光学活性分子后,由于左、右圆偏振光的折射率不同,偏振面将旋转一定的角度,这种现象称为旋光,偏振面旋转的角度称为旋光度。
朝光源看,偏振面按顺时针方向旋转的,称为右旋,用“+”号表示;偏振面按逆时针方向旋转的,称为左旋,用“-”号表示。
CD圆二色谱解读:探索生物大分子结构之谜

CD圆二色谱解读:探索生物大分子结构之谜一、圆二色谱的神秘面纱圆二色谱(Circular Dichroism,简称CD)是一种光谱学方法,用于研究生物大分子(如蛋白质和核酸)的结构。
它的原理是基于生物大分子对左旋和右旋偏振光的吸收差异。
这种差异反映了生物大分子的立体结构,因此,CD圆二色谱被广泛应用于生物制药分析领域。
二、CD圆二色谱的工作原理CD圆二色谱的工作原理是基于生物大分子的手性。
手性是一种物质的基本性质,表现为对左旋和右旋偏振光的吸收差异。
生物大分子(如蛋白质和核酸)都具有手性,因此,通过测量其对左旋和右旋偏振光的吸收差异,可以获取其立体结构信息。
三、CD圆二色谱的应用CD圆二色谱的应用非常广泛,主要用于生物大分子的结构研究。
例如,通过CD圆二色谱,我们可以确定蛋白质的二级结构,包括α-螺旋、β-折叠和随机卷曲等。
此外,CD圆二色谱还可以用于研究蛋白质的热稳定性、酶活性、配体结合等性质。
四、CD圆二色谱的优势CD圆二色谱的优势在于其简单、快速和无损。
首先,CD圆二色谱的操作简单,只需要将样品溶解在适当的溶剂中,然后通过光谱仪进行测量。
其次,CD圆二色谱的测量速度快,一般只需要几分钟就可以完成。
最后,CD圆二色谱是一种无损检测方法,不会对样品造成损害,因此,可以用于研究生物大分子的动态过程。
五、CD圆二色谱的挑战与未来尽管CD圆二色谱具有许多优势,但也面临一些挑战。
例如,CD圆二色谱对样品的浓度和纯度要求较高,对于浓度低或杂质多的样品,可能无法获得准确的结果。
此外,CD圆二色谱只能提供生物大分子的平均结构信息,无法获取其具体的三维结构。
然而,随着科技的进步,我们有理由相信,CD圆二色谱的应用将更加广泛。
例如,通过结合其他技术(如核磁共振和X射线晶体学),我们可以获取生物大分子的更详细的结构信息。
此外,通过改进光谱仪的设计和优化测量方法,我们可以提高CD圆二色谱的灵敏度和准确性。
图1。
百泰派克生物科技——生物制品表征,多组学生物质谱检测优质服务商。
圆二色谱资料

圆二色光谱(简称CD)是应用最为广泛的测定蛋白质二级结构的方法,是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法。
它可以在溶液状态下测定,较接近其生理状态。
而且测定方法快速简便,对构象变化灵敏,所以它是目前研究蛋白质二级结构的主要手段之一,并已广泛应用于蛋白质的构象研究中。
一.简介圆二色谱是用于推断非对称分子的构型和构象的一种旋光光谱。
光学活性物质对组成平面偏振光的左旋和右旋圆偏振光的吸收系数(ε)是不相等的,εL≠εR,即具有圆二色性。
如果以不同波长的平面偏振光的波长λ为横坐标,以吸收系数之差Δε=εL-εR为纵坐标作图,得到的图谱即是圆二色光谱,简称CD。
如果某手性化合物在紫外可见区域有吸收,就可以得到具有特征的圆二色光谱。
由于εL≠εR,透射光不再是平面偏振光,而是椭圆偏振光,摩尔椭圆度[θ]与Δε的关系为:[θ]=3300Δε。
圆二色谱也可以摩尔椭圆度为纵坐标,以波长为横坐标作图。
由于△ε有正值和负值之分,所以圆二色谱也有呈峰的正性圆二色谱和呈谷的负性圆二色谱。
在紫外可见光区域测定圆二色谱与旋光谱,其目的是推断有机化合物的构型和构象。
二.样品要求1、样品必须保持一定的纯度不含光吸收的杂质,溶剂必须在测定波长没有吸收干扰;样品能完全溶解在溶剂中, 形成均一透明的溶液。
2、氮气流量的控制3、缓冲液、溶剂要求与池子选择:缓冲液和溶剂在配制溶液前要做单独的检查,看是否在测定波长范围内有吸收干扰,看是否形成沉淀和胶状;在蛋白质测量中,经常选择透明性极好的磷酸盐作为缓冲体系。
4样品浓度与池子选择样品不同,测定的圆二色光谱范围不同,对池子大小(光径)的选择和浓度的要求也不一样。
蛋白质CD光谱测量一般在相对较稀的溶液中进行。
三.谱带宽度选为1 nm。
对于高分辨率测量,要用较窄的狭缝宽度,此时光电倍增管的电压较高,谱的信噪比差。
虽然对于正常测量最佳谱带宽度是1~2 nm,但是在下列情况下要牺牲分辨率而需要较宽的狭缝宽度。
圆二色光谱仪(cd)表征

圆二色光谱仪(cd)表征
圆二色光谱仪(CD)表征是一种用于研究分子结构和构象,分析
蛋白质、核酸等生物大分子二级结构的高分辨率技术。
CD技术最早应
用于化学领域,如化学键反应的研究,现已广泛应用于生物学、药物学、医学和材料科学等领域。
基本原理:
CD是强度吸收差谱测量技术,利用手性分子(不能跟其镜像重合的化
合物)的特性,根据其在右旋偏振光和左旋偏振光的不同吸收,来研
究分子的构象。
CD谱从波长190-320 nm可见,用强度差Δ A(CD)
或直接CD值来描述。
实验步骤:
1. 样品制备:将样品置于薄膜中,厚度约为0.1 mm,避免空气泡存在。
2. 光路检查:将样品放入样品室中,进行波长和基线的设置。
3. 监测:加入滴定管,记录CD强度吸收差随波长的变化。
4. 数据分析:通过CD曲线分析获得蛋白质、核酸等分子的二级结构信息。
应用领域:
1. 生物学领域:通过CD表征技术,可分析蛋白质的二级结构、折叠及稳定性等特性,还可以分析酶、抗体、肽、鸟苷酸等分子的构象。
2. 药物学领域:CD表征技术可用于研究药物与其靶点的相互作用,交
互作用、配基特征和构象等。
3. 材料科学领域:CD技术可用于研究由低分子化合物构成的配合物,聚合物和纳米粒子等材料的超分子组装过程。
总结:
CD表征技术是研究大分子结构与构象的重要方法,其广泛的应用领域包括生物学、药物学、医学和材料科学等领域。
通过CD分析获得的分子结构与构象信息对新药研究、药物设计和新材料的开发具有重要的指导意义。
圆二色谱CircularCD

蛋白的三级结构
1976年,Levitt和Chothia曾在Nature上报道,规则蛋白质 的三级结构模型可分为4类 (1) 全α型,以仅α-螺旋结构为主,其分量大于40% ,而 β-折叠的分量小于5% (2) 全β型,以β-折叠这种结构为主,其分量大于40% ,而 仅一螺旋的分量小于5% ; (3) α+β型,α螺旋及β-叠折分量都大于15% ,这两种结构 在空间上是分离的,且超过60%的折叠链是反平行排列; (4) α/β型, α-螺旋和B-折叠含量都大于15% ,它们在空间 上是相间的,且超过60%的折叠链平行排列。
Dichroweb: the online CD analysis tool /cdweb/html/ ➢ Can generally get accuracies of 0.97 for helices, 0.75 for beta sheet, 0.50 for turns, and 0.89 for other structure types (Manavalan & Johnson, 1987, Anal. Biochem. 167, 76-85).
椭圆度,摩尔椭圆度[] =2.303(AL – AR)/4 [] = 3298(L - R)3300 (L - R) 在蛋白质研究中, 常用平均残基摩尔椭圆度
圆二色仪原理
蛋白质的CD谱
蛋白质的光学活性
The peptide bond is inherently asymmetric & is always optically active
CD signal of a protein depends on its 2ndary structure
—— chymotrypsin (all b) —— lysozyme (a + b) —— triosephosphate isomerase(a/b) —— myoglobin (all a)
圆二色性光谱

对着光前进的方向观察时, 如果一束光波的电场矢量取所 有可能的方向,没有一个方向 较其它方向占优势。
(5)几种偏振光之间的关系
•振幅相等、角频率相等的左右圆偏振光组合, 其结果为线偏振光,反之亦然。即:一束线偏 振光可分解为振幅相等的左、右圆偏振光。
振幅不等,角频率相等的左右圆偏振 光组合其结果为椭圆偏振光。
天冬酰胺
• 当用天冬氨酸(D)取代19位的天冬酰 胺后(LRRD),则溶液不再发生凝胶纤维 化现象,CD谱显示溶液中的LRRD为无规卷 曲结构。
天冬氨酸
• 用谷氨酰胺(Q)取代19位的天冬酰胺 后(LRRQ),溶液依然会发生凝胶纤维 化现象,CD谱显示溶液中的LRRQ 为β折 叠结构,与LRRN的CD谱非常相似。
吸收光谱一般是指物质对光的吸收。
园二色谱(CD谱)记录的是物质对紫 外光与可见光波段的左圆偏振光和右圆偏 振光的吸收存在差别。
CD谱和一般的吸收光谱一样,都和分 子中的吸收基团(生色团)吸收电磁波能 量引起物质电子能级跃迁有关。
吸收紫外光:190-240nm
一. 基本原理:
1.几种偏振光的概念
文献上也常用光学活性物质对左右 园偏振光的摩尔吸收系数的差别
△ξ= ξl -ξr来表示园二色性。 根据吸收定律:
A=LgIo/It=ξCl △ξ= ξl -ξr=(Al -Ar)/Cl
△ξ或θ随波长而变化的关系称为 园二色谱。
4. CD与ORD和吸收光谱的关系
旋光性和圆二色性均是由于光学 活性分子结构的不对称性所引起的, 二者间相互联系,由其一可推之其二, 但是由于ORD谱中不同基团的旋光带 容易重叠较难分析,因此现在多数情 况下都是测量CD谱。
在紫外区段(160nm-300nm) 主要的生色团是肽链,肽链的二级 结构直接影响肽链吸收的圆二色性, 每种类型的二级结构都有其独特的 CD谱:
MOS-500圆二色光谱仪CD谱图导入和分析0515

MOS-500圆二色光谱仪
圆二色光谱图导入和分析操作步骤
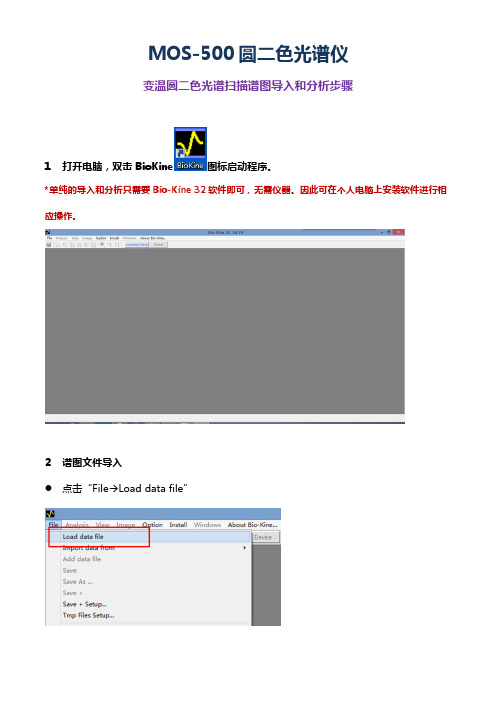
1打开电脑,双击BioKine图标启动程序。
*单纯的导入和分析只需要Bio-Kine32软件即可,无需仪器。
因此可在个人电脑上安装软件进行相应操作。
2谱图文件导入
●点击“File→Load data file”
●在“Load File“对话框中,选择到文件。
●文件导入完成,之后可以利用软件的分析工具进行谱图分析。
注1:若要在谱图测试后直接进行分析,则直接点击菜单栏“Analysis“按钮切换为分析窗口。
注2:若要在已经打开的谱图窗口中添加一个谱图,需要点击“File Add“进行添加。
3谱图分析
3.1”Smoothing”平滑功能
●选择“Tools→Smoothing→Savitzky-Golay”
●设置平滑方法的参数,一般采用默认Smoothing Windows=15,Polynomial Order=3即可。
●平滑结果如图,可以将其保存。
3.2谱图计算功能
● a.(File1)+b
设置参数:
谱图计算结果:
● a.(File1)+b.(File2)
将谱图1的值乘以a,谱图2的值乘以b,然后将它们相加得到的值重新作图。
● a.(File1)/b.(File2)
将谱图1的值乘以a,谱图2的值乘以b,然后将它们相除得到的值重新作图。
圆二色性CD光谱的制备与实验步骤是什么?

圆二色性CD光谱的制备与实验步骤是什么?1. 引言圆二色性CD(Circular Dichroism)光谱是一种重要的生物物理学技术,用于研究生物分子的结构和构象变化。
它通过测量左旋和右旋圆偏振光的吸收差异,提供了关于分子的手性和构象信息。
本文将介绍圆二色性CD光谱的制备与实验步骤。
2. 实验仪器与试剂准备在进行圆二色性CD光谱实验之前,我们需要准备以下仪器和试剂:2.1 圆二色仪。
圆二色仪是进行CD光谱实验的关键仪器,它能够发射圆偏振光并测量样品对不同波长的圆偏振光的吸收差异。
选择合适的圆二色仪对于获得准确的CD光谱数据至关重要。
2.2 样品溶液。
选择适当的样品溶液是进行CD光谱实验的关键。
通常情况下,生物大分子如蛋白质、核酸等需要在缓冲溶液中进行测量,以保持其稳定性和活性。
2.3 光学比色皿。
光学比色皿是用于容纳样品溶液的容器,它需要具备良好的光学透明性和化学稳定性,以确保测量的准确性和重复性。
3. 实验步骤进行圆二色性CD光谱实验的步骤如下:3.1 样品制备。
首先,准备所需的样品溶液。
根据实验需要,选择合适的缓冲溶液,并将样品溶解在其中。
确保样品溶液的浓度适当,以获得清晰的CD光谱信号。
3.2 样品装载。
将样品溶液转移到光学比色皿中。
确保光学比色皿干净,并避免产生气泡或污染物,以免影响测量结果。
3.3 仪器校准。
在进行实际测量之前,需要对圆二色仪进行校准。
校准过程通常包括空白测量和参考物质测量,以确保测量结果的准确性和可靠性。
3.4 测量参数设置。
根据实验需要,设置合适的测量参数。
这包括选择合适的波长范围、扫描速度和光强等参数,以获得最佳的CD光谱信号。
3.5 开始测量。
将光学比色皿放入圆二色仪中,并开始测量。
仪器将发射圆偏振光并测量样品对不同波长的圆偏振光的吸收差异。
测量过程中,保持样品溶液的稳定性和温度一致性。
3.6 数据分析。
测量完成后,将得到的CD光谱数据导出并进行分析。
常见的数据分析方法包括曲线拟合、峰位和峰形分析等,以获得关于样品的结构和构象信息。
第五章 圆二色分析

实用仪器分析
2. 电子圆二色仪器
第五章 圆二色光谱
实用仪器分析
3. CD仪器组成图
第五章 圆二色光谱
基线平直度 :180~700nm 范围内 ≤±6m°波长 :180nm~ 300nm 300nm~500nm, 500nm~700nm 圆二色CD值 : 在 290nm处椭圆度1. 振动圆二色谱:红外光区频率下的圆二色 (Vibrational Circular Dichroism, VCD).
相对于ECD 优点 (1) 最大优势:丌需要分子中含有生色团 (紫外吸收), 几乎 所有手性分子都在红外区有吸收, 都会产生VCD 谱图。 (2)丌需要化合物有紫外吸收, 应用范围极广。 (3)相对于ECD, VCD 谱峰较窄, 信号丰富, 更容易判断。 (4)ECD计算的是分子在激収态的能量, VCD计算的是分子 在基态下的振动, 从目前计算化学的能力方面考虑, 计算VCD 更加准确。
旋光 (OR): 平面偏振光通过手性物质时,偏振面会发生旋转,即该物 质具有旋光性,旋转的角度。习惯上用(+)号表示右旋物质,用(-) 号表示左旋物质。
旋光色散(ORD): 旋转角度与波长的函数关系.
实用仪器分析
第五章 圆二色光谱
6. ORD与CD光谱 同时产生。
包括同样的分子结构信息:光学活性 物质分子中的丌对称生色团。
圆二色和旋光区别和关联
a. 光学器件差别 ,b. 光学活性物质检测两种丌同方面
实用仪器分析
第五章 圆二色光谱
五. ECD圆二色光谱仪样品制备及数据分析
1. CD测试样品要求
液体样品
1. 样品必须透明,如有悬浮或沉淀,则需过滤或离心以除去
沉滤。2. 在测定的光谱范围内,吸光度值丌应超过2.0。最优
MOS-500圆二色光谱仪变温CD光谱扫描谱图导入和分析0525
MOS-500圆二色光谱仪
变温圆二色光谱扫描谱图导入和分析步骤
1打开电脑,双击BioKine图标启动程序。
*单纯的导入和分析只需要Bio-Kine32软件即可,无需仪器。
因此可在个人电脑上安装软件进行相应操作。
2谱图文件导入
●点击“File→Load data file”
●在“Load File“对话框中,选择到文件。
●文件导入完成,之后可以利用软件的分析工具进行谱图分析。
3谱图分析
●对导入的谱图进行变性分析,首先点击“2D display”按钮,再选择“Temp”,使谱图
切换为信号-温度谱图。
在切换的界面中选择要分析的波长。
●点击菜单栏“Tools→Denature Protein Analysis”
●出现4个定位标签和“Denature Protein Analysis”对话框,标签1和2定位在谱图对应蛋白正常态阶段,标签3和4定位在谱图对应蛋白热变性后的阶段,它们用于标记两阶段的基线,最后点击按钮。
χ2,调节标签位置后再次计算,直到得到满意的结果。
圆二色光谱CD

-0.5
-1.0
-1.5 190 200 210 220 230 240 250 260
wavelength(nm)
CD spectra of GCN4 leucine zipper in the presence of different concentrations of SDS
Leucine zipper peptide was treated with SDS for 5 min. Its CD spectra was then measured at a final peptide concentration of 20 μ M. The final SDS concentrations were 0, 0.1, 0.2, 0.3, 0.4, 0.6, 1.0, 1.2 mM for curves 1, 2, 3, 4, 5, 6, 7, and 8, respectively. Curve 9 is for the completely unfolded peptide treated with 4 M guanidinium chloride. The experiments were carried out at 20 oC.
圆二色光谱 Circular Dichroism (CD)
洪 远 凯
/ ourse/biophysics/cover.htm
1.什么是圆二色谱?
产生, 特征, 旋光色散谱
2.圆二色谱在生物,医学 研究中的应用
What is a Light?
16世纪,Newton,光谱 17世纪,Huggens,偏振光 1881年,Biot,石英能使偏振光的偏振 面旋转, 电气石圆二色性
-4.5
CD圆二色谱的原理及其应用

CD圆二色谱的原理及其应用1. 简介CD圆二色谱是一种用于研究化合物结构和功能的实验技术,通过测量在紫外可见区域分子吸收光谱的旋光性质,来获得关于分子的信息。
本文将介绍CD圆二色谱的原理和常见的应用领域。
2. 原理CD圆二色谱利用电磁波和手性分子相互作用的效应来测量分子的旋光性质。
手性分子与右旋光或左旋光的光线发生非对称性吸收,使光在通过样品后发生光学旋光。
CD圆二色谱将通过样品后的左旋光和右旋光光束分离并测量其吸收率差。
3. 实验方法在进行CD圆二色谱实验时,通常需要准备以下材料和步骤: - CD圆二色谱仪器:包括光源、样品室、检测器等。
- 样品制备:将待测化合物溶解于合适的溶剂中,控制样品浓度。
- 校准:使用已知手性化合物进行校准,确保仪器的准确性。
- 数据采集:测量样品的光谱,并记录吸收率差随波长的变化。
- 数据处理:根据测得的光谱数据,使用适当的软件进行数据处理和分析。
4. 应用领域4.1 初级结构研究通过CD圆二色谱,可以对生物分子的初级结构进行研究,如蛋白质、核酸等。
通过对这些分子的旋光信号进行测量和分析,可以帮助解析其空间结构、螺旋转动等信息。
4.2 药物开发CD圆二色谱在药物开发领域中起着重要的作用。
通过测量药物分子和靶蛋白之间的相互作用,可以研究药物的结构活性关系、药物的构象变化等信息,从而指导药物分子的设计和改进。
4.3 食品分析CD圆二色谱在食品分析领域中也具有广泛的应用。
通过测量食品中的旋光特性,可以鉴别食品中的手性分子、判断食品的品质和真伪。
4.4 环境监测CD圆二色谱在环境监测领域中被用于检测和分析环境中的有机污染物。
通过测量这些有机污染物的旋光信号,可以判断其构象、分子结构等信息,进而指导环境保护工作。
5. 结论CD圆二色谱作为一种重要的实验技术,在化学、生物学等领域中具有广泛的应用。
通过测量分子的旋光性质,可以获得关于分子结构和功能的重要信息,为科学研究和工程应用提供了强有力的工具。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质CD光谱分析——定量分析
基本原理: 假设蛋白质在波长λ处的CD信号是蛋白质中各种二 级结构组分的线性加和,则有等式:
C f i Ci
假设溶液态蛋白质与晶体中的二级结构相同,则可利用已知二级结构 的蛋白质或多肽的CD光谱作为参考数据,对未知蛋白质的二级结构进 行拟合计算,能得出α-螺旋、β-折叠、β-转角、无规线团等结构所占的 比例。 用于拟合的参考蛋白质共有48种,包括有Johnson等报道的29种, Keiderling等报道的5种, Yang等报道的6种及Sreerama等最近报道的3种 球蛋白和5种失活蛋白质。
圆二色光谱(CD光谱)
主要内容
1 2 3 4 5 6 预备知识 圆二色光谱 圆二色光谱仪的基本构造
CD光谱在蛋白质结构研究中的应用
蛋白质CD光谱图的分析 CD样品制备及条件选择
预备知识
平面偏振光:
振动方向保持不变(只 在一个平面上振动) 振幅发生周期性变化
平面偏振光的产生: 自然光通过起偏器(偏振 片或Nicol棱镜)。
蛋白质的圆二色特征
(1)光学活性基团及折叠结构; (2)250nm以下的光谱区,肽键的电子跃迁引起; (3)250~300nm光谱区,侧链芳香基团的电子跃迁引起; (4)300~700nm光谱区,蛋白质辅基等外在生色基团引起。
蛋白质CD光谱分析——定性分析
分子构象 电子跃迁 形式 n→π ﹡ π →π ﹡ 极值的波长 [θ]*103 Deg.cm2/dmol -38~-40 -36~-40 72~86
calc obs 2 2 1 2 ( C C ) ( N ) CD光谱分析——定量分析
CDSSTR: Johnson综合了几种方法的特点,发展起来的 一种新的计算拟合方法。其特点是只需要最少量的参考蛋 白质,就能得到较好的分析结果。拟合计算时,先从已知 精确构象的蛋白质中任意挑选,组成参考蛋白质。每次组 合结果应满足3个基本选择条件: (1)各二级结构分量之和应在0.95~1.05之间; (2)各二级结构的分量应大于-0.03; (3)实验光谱与计算光谱间的均方根应小于0.25。 最后的拟合结果是能满足以上 3 个规则所有结果的平 均值。
蛋白质CD光谱分析——定量分析
计算方法和拟合程序:
已报道的计算方法和拟合程序较多,按先后分别有:
多级线性回归:拟合程序为G&F,LINCOMB,MLR;
峰回归:拟合程序为CONTIN; 单值分解:拟合程序为SVD;
凸面限制:拟合程序为CCA;
神经网络:拟合程序为K2D; 自洽方法:拟合程序为 SELCON ;以及最近发展的一种联用方
α-螺旋 (α-helix)
221~222nm(-) 207~210nm(-) 191nm(+)
β-折叠 (β-sheet)
β-转角 (β-turn)
n→π ﹡ π →π ﹡
n→π ﹡ π →π ﹡
217~218nm(-) 195~197nm(+)
227nm(-) 弱 200~205nm(+) 192.5(-)强 230nm(-) 215~218nm (+)
电场矢量
传播方向
起偏器
预备知识
圆偏振光: 振幅保持不变,而方向周期性变化,电场矢量绕传播方向 螺旋前进。
左右旋圆偏振光:
预备知识
光学活性物质 能使射入物质的平 面偏振光的偏振面旋 转的物质称为旋光性 物质或光学活性物质。 具有手性结构的分子 才有光学活性。 圆二色性 当光通过光学活性物质时,介质对左右旋圆 偏振光的吸收率不同,二者的差称为该物质 的圆二色性(circular dichroism,简写为 CD)。
圆二色光谱仪的基本构造
美国Aviv公司 Model400型圆二色光谱仪
圆二色光谱在蛋白质结构研究中的应用 蛋白质的圆二色性
(1)由氨基酸通过肽键连接而成; (2)光学活性基团:肽键、芳香氨基酸残基、二硫桥键; (3)蛋白质有多个结构层次,相同的氨基酸序列,因蛋白 质的折叠结构不同,基团的光学活性受到影响。
法,拟合程序为CDSSR 。
蛋白质CD光谱分析——定量分析
SELCON:Sreermna和Woody在原有的一些算法上进行 改进得到,其新的计算程序为SELCON3 程序采用自洽 算法,假设待测蛋白质的二级结构与某种已准确测定结 构的参考蛋白质相同,用测量的CD谱取代参考蛋白质的 CD谱,用单值分解算法(SVD)和多种局部线性化模型, 反复计算取代后的收敛性。 CONTIN :由 Provencher 和 Glokner 提出,最新的拟合程 序是CONTIN/LL。该方法采用峰回归算法,假设待测 蛋白质的 CD 光谱是 N 个已知构象的参考蛋白质 CD 光谱 的线性组合,进行拟合计算,使下面函数的值最小。
圆二色光谱
光学活性物质对左右旋圆偏振光的吸收率之差 是随入射偏振光的波长变化而变化的。以 或有关量为纵坐标,波长为横坐标,得到的图谱。 由于 绝对值很小,常用摩尔椭圆度 来代替, 二者的关系是:
圆二色光谱
当光学活性化合物对光没有特征吸收时,在谱图 中仅为一条近似水平的直线。 当光学活性化合物对光存在特征吸收时,通常有 两种情况:当 > 时,得到一个正性的圆二色 光谱曲线;当 < 时,得到一个负性的圆二色 光谱曲线。
CD测量的样品准备及条件选择
测试用的蛋白质样品中应避免含有光吸收的杂质,缓冲 剂和溶剂在配制溶液前最好做单独的检查,透明性极好 的磷酸盐可用作为缓冲体系。 CD光谱的测量一般在蛋白质含量相对低(0.01~0.2g/L)的 稀溶液中进行,溶液最大的吸收不超过2。 溶液浓度的测定:紫外光谱法、定量氨基酸分析;缩二 脲方法、测氮元素的浓度、考马斯亮蓝染料结合比色法、 在完全变性条件下测芳香氨基酸残基的吸收。(《蛋白 质分子基础》高等教育出版社) 测试条件:环境温度 25℃, 相对湿度60%。
195~202nm(-)强
-19~-21 28~42
无规卷曲 (random coil)
π →π ﹡
-1.6 1~2 -25~-50
蛋白质CD光谱分析——定性分析
蛋白质CD光谱的波长范围:远紫外区(185-245nm)、近紫外区(245-320nm)
α —螺旋
β —折叠
β —转角
P2结构
蛋白质CD光谱分析——定性分析
