定量PCR分析的相对定量法.
荧光定量pcr结果分析

如果有标准曲线,按照标准曲线计算。
一般都就是相对量。
则用deltadeltaCT方法来计算。
举例如下:ﻫ对照组基因A得CT值为20, 内参(比如βactin)CT值15。
实验组基因A CT值18,内参CT值14。
ﻫ首先算加样量:delta CT=15-14=1。
2得1次方就是2、也就就是说实验组得加样量就是对照组得2倍、ﻫ基因A: deltaCT=20—18=2。
2得2次方就是4、也就就是说基因A得量在实验组就是对照组得4倍。
但就是由于加样量就是2倍,所以4处以2=2,最后得相对量就是2倍、
ﻫ几点注意:ﻫ1。
必须确定扩增得特异性
2、只有相同目标得CT值才能相减(扩增效率有可能不同)
3。
2得某次方只就是理论值,实际扩增效率低于2、ﻫ4。
最好不用Syber Green
由Ct值用2^—△△Ct法计算计算表达量差异得原理,可以瞧下面得图片:
ﻫ
ﻫ附件得Excel文件就是计算用得,感兴趣也可以瞧瞧由Ct值就是如何一步一步算出2^-△△Ct 得。
相对定量: ΔΔCT法和相对标准曲线法

0.13
41
相对定量结果
8
7
5.6
6
Gene Expression
5 4 3
2
1
1
8.0 0.13
Calibrator
42
t=0
t=0 t = 12 h t = 24 h t = 48 h
软件计算
为你完成所有的计算!
43
Question?
44
所以,这个公式告诉我们对照样本和处理样本之间目的 基因的倍数变化
32
ΔΔCt计算示例
Untreated Treated 1 Treated 2
Cttarg. 26.1 23.8 22.8
Ctnorm. dCt
ddCt 2(-ddCt)
16.7 9.4
0
1
16.0 7.8 -1.6
3ቤተ መጻሕፍቲ ባይዱ
17显.7示出两5.倍1 的表达-4.差3 异. 20
39
• 还记得开始时的 相对定量 实验吗? • 我们来算一下 基因表达变化
40
相对定量结果计算
Sample
Time 0
c-myc Averag
e Ct
30.49
GAPDH Average
Ct
23.63
ΔCt c-myc -
GAPDH
ΔΔCt ΔCt treated
-ΔCt untreated
6.86
Cttarg. 26.1 23.8 22.8
Ctnorm. 16.7 16.0 17.7
ΔCt 9.4 7.8 5.1
ΔΔCt 0
-1.6 -4.3
2(-ddCt)
1 3 20
首先, 均一化所有样本 (如:对照样本 –对照样本 ). 接着, 所有样本和对照样本进行比较(未知样本 – 对照样本).
荧光pcr绝对定量和相对定量的原理

荧光pcr绝对定量和相对定量的原理下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!荧光PCR(Polymerase Chain Reaction)是利用荧光标记的引物或探针来检测靶基因的数量的一种PCR技术。
荧光定量PCR技术介绍

Ct值出现过晚
增加镁离子浓度等。
(Ct>38) • PCR各种反应成分的降解或加样量的不足。
• PCR产物太长: 一般采用80-150bp的产物长度。
• 加样存在误差: 使得标准品不呈梯度。
标准曲线线性 • 标准品出现降解:应避免标准品反复冻融,或重新制备并稀释标准品。 关系不佳 • 引物或探针不佳:重新设计更好的引物和探针。
36
荧光定量PCR的结果分析
37
数据分析
Ct值大小 各复孔之间重复性 不同浓度梯度稀释的间
隔性
38
数据分析
R2>0.99 Eff%:90-110%
39
常见问题分析-扩增曲线斜率不一致提示存在抑制物
在指数增长期,扩增曲线的斜率应当有良好的一致性,即所有的曲线都应该是平行的。 如果扩增曲线的斜率不一致,就提示可能样本的质量不好。
• 模板中存在抑制物,或模板浓度过高
荧光定量PCR数据常见故障排查
问题
故障排查
• 引物设计不够优化:应避免引物二聚体和发夹结构的出现。
阴性对照有信 号/溶解曲线
•
引物浓度不佳:适当降低引物的浓度,并注意上下游引物的浓度配比。
不止一个主峰 • 镁离子浓度过高:适当降低镁离子浓度,或选择更合适的mix试剂盒。
重复性好
重复性差
42
常见问题分析-重复性差
问题
原因
解决方法
重复性差
基线,阈值设置 加样误差(操作?加样器?) 没有将试剂和样品充分混匀 低拷贝的样品 泊松分布 没有使用ROX校准
基线设置:起始循环数为3-5,终止循环数为信号 开始上升前一个循环。
阈值设置:最佳位置为指数增长期内,曲线重复性 最好的位置。
荧光定量PCR数据分析

利用实时定量PCR和2-△△CT法分析基因相对表达量METHODS 25, 402–408 (2001)Analysis of Relative Gene Expression Data Using Real-Time Quantitati ve PCR and the 2-△△CT MethodKenneth J. Livak* and Thomas D. Schmittgen¶,1*Applied Biosystems, Foster City, California 94404; and ¶ Department of Pharmaceutical Sciences, College of Pharmacy,Washington State University, Pullman, Washington 99164-6534摘要:现在最常用的两种分析实时定量PCR 实验数据的方法是绝对定量和相对定量。
绝对定量通过标准曲线计算起始模板的拷贝数;相对定量方法则是比较经过处理的样品和未经处理的样品目标转录本之间的表达差异。
2-△△CT方法是实时定量P CR 实验中分析基因表达相对变化的一种简便方法,即相对定量的一种简便方法。
本文介绍了该方法的推导,假设及其应用。
另外,在本文中我们还介绍了两种2-△△CT衍生方法的推导和应用,它们在实时定量 PCR 数据分析中可能会被用到。
关键词:反转录PCR 定量PCR 相对定量实时PCR Taqman反转录 PCR (RT-PCR )是基因表达定量非常有用的一种方法(1 - 3 )。
实时PCR 技术和RT-PCR 的结合产生了反转录定量 PCR 技术(4 ,5 )。
实时定量PCR 的数据分析方法有两种:绝对定量和相对定量。
绝对定量一般通过定量标准曲线来确定我们所感兴趣的转录本的拷贝数;相对定量方法则是用来确定经过不同处理的样品目标转录本之间的表达差异或是目标转录本在不同时相的表达差异。
pcr相对定量原理

pcr相对定量原理
PCR相对定量是一种常用的实验方法,用于测量目标基因在样品中的相对表达水平。
该方法基于聚合酶链反应(PCR)的原理,通过共扩增目标基因和内参基因,利用其在不同样品中的扩增产物浓度比值来间接推断目标基因的表达水平。
PCR相对定量的步骤通常包括以下几个关键步骤:首先,需要设计合适的引物,这些引物需要特异性地扩增目标基因和内参基因。
接下来,在PCR反应中,需要将反转录的RNA转换为cDNA,并与引物和适当的PCR反应缓冲液一起添加到PCR管中。
然后,在一系列PCR循环中,通过不断的变性、退火和延伸步骤,使DNA序列得以扩增。
最后,通过凝胶电泳、荧光测量等方法,可以测量PCR扩增产物的浓度,并计算出目标基因与内参基因之间的相对表达水平。
PCR相对定量的关键在于选择一个合适的内参基因。
内参基因通常是在不同样品中表达稳定且不受待测条件影响的基因。
通过将目标基因的表达水平与内参基因的表达水平相对比,可以消除样品间的差异,提高实验结果的可靠性。
需要注意的是,PCR相对定量的结果仅能提供一种相对的表达量信息,并不能给出精确的绝对表达水平。
因此,在进行PCR相对定量实验时,需要进行适当的内部对照组设计和统计分析,以确保实验结果的准确性和可靠性。
相对定量方法PCR技术通过2 -△△CT 方法分析相对基因表达差异

利用实时定量 PCR 技术通过2 -△△CT 方法分析相对基因表达差异Kenneth J. Livak and Thomas D. SchmittgenDepartment of Pharmaceutical Sciences, College of Pharmacy.Washington State University, Washington 99164-6534现在最常用的两种分析实时定量 PCR 实验数据的方法是绝对定量和相对定量。
绝对定量通过标准曲线计算起始模板的拷贝数;相对定量方法则是比较经过处理的样品和未经处理的样品目标转录本之间的表达差异。
2 - △△ CT 方法是实时定量 PCR 实验中分析基因表达相对变化的一种简便方法。
本文介绍了该方法的推导,假设及其应用。
另外,在本文中我们还介绍了两种 2 - △△ CT 衍生方法的推导和应用,它们在实时定量 PCR 数据分析中可能会被用到。
关键词:反转录 PCR 定量PCR 相对定量 实时PCR Taqman反转录 PCR ( RT-PCR )是基因表达定量非常有用的一种方法( 1 - 3 )。
实时 PCR 技术和 RT-PCR 的结合产生了反转录定量 PCR 技术( 4 , 5 )。
实时定量 PCR 的数据分析方法有两种:绝对定量和相对定量。
绝对定量一般通过定量标准曲线来确定我们所感兴趣的转录本的拷贝数;相对定量方法则是用来确定经过不同处理的样品目标转录本之间的表达差异或是目标转录本在不同时相的表达差异。
绝对定量通常在需要确定转录本绝对拷贝数的条件下使用。
通过实时 PCR 进行绝对定量已有多篇报道( 6 - 9 ),包括已发表的两篇研究论文( 10 , 11 )。
在有些情况下,并不需要对转录本进行绝对定量,只需要给出相对基因表达差异即可。
显然,我们说 X 基因在经过某种处理后表达量增加 2.5 倍比说该基因的表达从 1000 拷贝 / 细胞增加到 2500 拷贝 / 细胞更加直观。
定量PCR基本原理及方法-PPT精品文档

成反比,由此计算出标本中靶分子的准确含量,即:
LgX=LgY–n×Lg(1+Ev)=b - n×a (a、b为常数)
Ampliflour Probe,LUX
定量分析
基因型分析
利用扩增信号的种类来分型 —— Taqman
根据熔解曲线的不同来分型 —— FRET, Molecular Beacon LC Green
利用扩增信号的种类来分型 双Taqman探针法检测野生型和突变型
在基因型分析中,可采用两种不同的Taqman探针(分别针对野生型和突变型),即一个突 变型探针以一种荧光素(Flr)标记,而野生型探针则用不同的荧光物(Tet)标记。如果只有 一种信号被扩增出来,则样本为对应的基因型(野生型或突变型)的纯合子;如二者都被有效 地扩增出来,则样本为杂合型。
后来用与双链DNA有更强结合力的SYBR Green I取代EB
荧光定量PCR的定量原理
PCR的理论方程: Y=x×(1+ Ev)n Real-time Chemistries
Y:扩增物数量; X :起始模板数量;Ev:扩增效率;n:扩增循环数
1. 终点法定量原理
前提:在最佳实验、循环次数n一定、Ev相同
定量PCR基本原理及方法
基因有限公司 黄妤
内 容
一. 荧光定量PCR基本原理 二. 荧光定量PCR标记方法 三. 荧光定量PCR不同方法学的应用
一.荧光定量PCR基本原理
2 -δδct 相对定量法

2 -δδct 相对定量法
2-ΔΔCt相对定量法是一种常用的PCR定量分析方法,用于计
算目标基因在不同样本中的相对表达水平。
其中ΔCt表示目标基因Ct值与参考基因Ct值之差,ΔΔCt则
表示不同样本中目标基因的ΔCt值之差。
具体计算步骤如下:
1. 首先进行qPCR实验,测定目标基因和参考基因在不同样本
中的Ct值。
2. 计算目标基因和参考基因的ΔCt值,即目标基因Ct值减去
参考基因Ct值。
3. 选取一个参考样本作为对照,计算其他样本的ΔΔCt值,即
每个样本的目标基因ΔCt值减去参考样本的目标基因ΔCt值。
4. 计算2的-ΔΔCt,即2的负ΔΔCt次方,得到每个样本中目
标基因的相对表达水平。
这种方法的原理是利用参考基因来消除样本间PCR反应效率
的差异,使得结果更准确可靠。
相对定量方法适用于比较不同样本中目标基因表达量的差异,但无法提供绝对定量的数据。
相对荧光定量PCR三种常用方法、注意事项
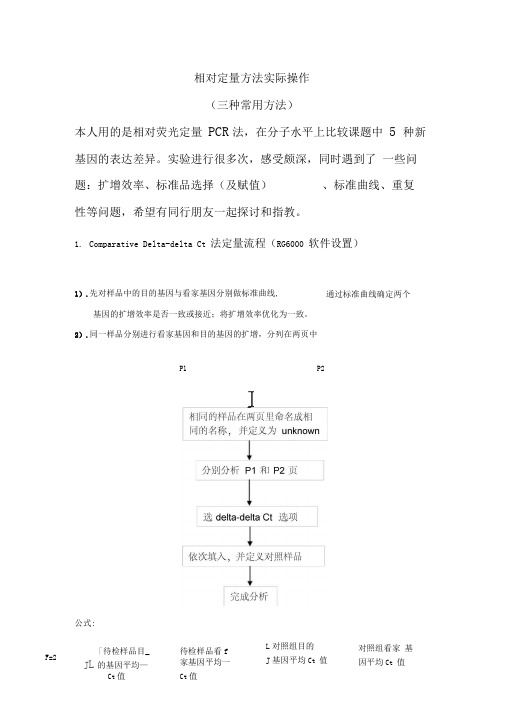
相对定量方法实际操作(三种常用方法)本人用的是相对荧光定量PCR法,在分子水平上比较课题中5 种新基因的表达差异。
实验进行很多次,感受颇深,同时遇到了一些问题:扩增效率、标准品选择(及赋值)、标准曲线、重复性等问题,希望有同行朋友一起探讨和指教。
parative Delta-delta Ct 法定量流程(RG6000 软件设置)1).先对样品中的目的基因与看家基因分别做标准曲线,基因的扩增效率是否一致或接近;将扩增效率优化为一致。
2).同一样品分别进行看家基因和目的基因的扩增,分列在两页中P1 P2公式:通过标准曲线确定两个F=2「待检样品目_待检样品看fJ L的基因平均—家基因平均一Ct值Ct值L对照组目的J基因平均Ct 值对照组看家基因平均Ct 值IComparative Delta-delta Ct 法的特点、注意事项及实际应用1). Comparative Delta-delta Ct法是很常用的一种相对定量方法,其最大特点是,当优化的体系已经建立后,在每次实验中无需再对看家基因和目的基因做标准曲线,而只需对待测样品分别进行PCR扩增即可。
2).其缺点是,每次实验都默认目的基因和看家基因的扩增效率一致,而并非真实扩增情况的反映,这里势必存在一定的误差。
3). Comparative Delta-delta Ct法展开定量实验前,在预实验中,必需对目的基因和看家基因做两组标准曲线。
Rotor-Gene的软件会自动给出两组标准曲线的R值、扩增效率等信息,如果两组标准曲线的斜率,即M值的差小于0.1,那么后续实验中就可以用Comparative Delta-delta Ct法进行相对定量分析。
反之,如果M差值大于0.1,就无法用该方法进行相对定量分析。
此时的解决方法有两种,一是优化实验,使两组标准曲线的斜率差值小于0.1,二是换用其它的相对定量方法。
应用实例:如上图,将标准品进行梯度稀释后,分别对目的基因( Gene of Interest )和看 家基因(Housekeeper Gene )做标准曲线。
qpcr数据处理公式

qpcr数据处理公式qPCR(实时定量PCR)数据处理的公式包括两个主要部分:相对定量和绝对定量。
下面将分别介绍这两个部分的数据处理公式。
1. 相对定量的数据处理公式相对定量通常是对不同样品之间的基因表达量进行比较。
该方法通过测量目标基因与参考基因(通常是内部控制基因)的相对表达量来确定基因表达量的差异。
以下是相对定量的数据处理公式:- ΔCt法Ct值是实时定量PCR放大到指定阈值的周期数。
ΔCt法通过计算目标基因Ct 值与参考基因Ct值之间的差异来比较基因表达量。
公式如下:ΔCt = Ct (目标基因) –Ct (参考基因)- 2^-ΔΔCt法ΔΔCt法是一种更精确的相对定量方法,它通过计算目标基因与参考基因的ΔCt 值差异来比较基因表达量。
公式如下:ΔΔCt = (Ct (目标基因) –Ct (参考基因))样品A –(Ct (目标基因) –Ct (参考基因))样品BFold Change = 2^-ΔΔCt其中,Fold Change表示目标基因的表达量相对于参考基因的表达量的倍数。
2. 绝对定量的数据处理公式绝对定量是测量目标基因的绝对表达量(例如拷贝数或RNA浓度)。
以下是绝对定量的数据处理公式:- 标准曲线法标准曲线法是一种常用的绝对定量方法,它通过绘制已知拷贝数或RNA浓度的标准曲线来计算未知样品的目标基因拷贝数或RNA浓度。
公式如下:y = mx + b其中,y表示Ct值,x表示已知的目标基因拷贝数或RNA浓度,m表示斜率,b表示截距。
通过将未知样品的Ct值代入该方程,可以计算出相应的目标基因拷贝数或RNA浓度。
- 相对标准曲线法相对标准曲线法是一种更精确的绝对定量方法,它通过绘制已知拷贝数或RNA 浓度的标准曲线和参考基因的Ct值来计算未知样品的目标基因拷贝数或RNA 浓度。
公式如下:y = mx + bΔCt = Ct (目标基因) –Ct (参考基因)ΔΔCt = ΔCt (样品) –ΔCt (标准曲线)Fold Change = 2^-ΔΔCt其中,y表示Ct值,x表示已知的目标基因拷贝数或RNA浓度,m表示斜率,b表示截距,ΔCt表示目标基因与参考基因的Ct值差异,ΔΔCt表示未知样品与标准曲线的ΔCt值差异,Fold Change表示目标基因的表达量相对于参考基因的表达量的倍数。
定量PCR分析的相对定量法

定量PCR分析的相对定量法预先研读科研文献,提出问题。
拟用60Co- Y射线照射HeLa细胞,经0, 2, 4, 8, 10Gy不同吸收剂量照射4小时后,研究60Co- 丫射线对GRP78 mRN表达水平的剂量影响关系。
设计拟扩增GRP78以及GAPDH (内参基因)引物序列,稀释合成后引物,验证是否合格能用,储存备用。
上下引物可以考虑预混,储存备用。
准备总RNA提取试剂盒,熟悉实验方法,即熟悉基本步骤与相应所用耗材,准备所用耗材。
知道经该试剂盒方法提取后实际剩下的总RNA体积数。
先培养二瓶细胞,长满后消化后混合,细胞计数,分成6瓶细胞,接种培养至第二天早晨。
编号。
送去钴源室60Co- 丫射线照射,无菌操作,放回培养4小时。
按试剂盒程序提取各瓶细胞总RNA编号,测定并记录各管总RNA含量与体积数。
当天反转录成cDNA并编号,测定总cDNA含量与体积数。
预约定量PCF仪器使用时间。
做5X6X2=60份定量PCR反应计划,因有5个剂量组,每一个剂量组做6次平行,2个基因。
考虑额外需要,故预混试剂拟按70份反应计划去准备。
做好96孔板中各孔排布图。
配制除样品cDNA和引物外的预混液,按计划加入96孔板中各孔指定位置内。
再有规律地依次加入规定量的cDNA样品,然后在排布图指定孔位置中加入指定量和指定种类的引物。
核实或做好加样记录。
定量PCR仪器分析开机预热、设定定量PCR仪器基本参数、位置参数和循环参数等;再次混匀96孔板中样品,将样品96孔板放入仪器中,检查后运行PCR仪器。
设计原始资料表格样式,记录各组实际扩增后所得CT值。
根据前面介绍的绝对定量法得到的标准曲线如下图,结合上表查找相应的基因含量数, 转录如下表中,然后计算相应的平均数与标准差。
Standard Curve根据均值二次校对值和校对SD用SPSS软件做结果的ANOVA统计分析,检验各组之间的差异有无统计学意义,然后用excel软件作柱状图,并在柱状图上标示出SD变化,以及有无统计显著性差异的标识。
定量PCR技术

定量PCR技术目前,用常规PCR技术判断疾病相关基因或病原微生物特异基因存在与否的定性方法已远远不能满足广大医务工作者的需要。
为了获得与疾病诊断、治疗及愈后评估有关的更多更详尽的基因水平的信息,实现对核酸信息的量化分析及比较,定量PCR (QPCR)技术迅速兴起,而且由于其具有特异、快速、敏感、准确定量的优点,已经成为目前分子生物学技术研究的热点之一,不仅在基础医学中得以应用,而且应用于临床医学及其它领域的研究中[113-118]。
一、定量PCR的含意定量PCR旨在评估样本中靶基因的分子数。
用PCR对靶基因定量,是根据一定循环次数后,PCR产物的量来推断样品中原始模板的量。
这种定量可以是绝对的,也可以是相对的。
但由于目前技术上的原因,很难获得样品中某一基因的绝对数量,而往往是通过设置内参标或外参标来作相对的定量。
二、定量PCR的可行性定量PCR是以PCR扩增为基础的,而PCR扩增是有规律可循的。
定量一般是在PC R扩增的指数期进行的。
对于一个给定的待扩增基因片段,其在样品中的起始含量越大,则指数扩增过程越短,当扩增速率趋于稳定后,则无论原来样品中起始模板含量多少,扩增片段的含量通常是一样的。
一般应预先对待测基因片段进行扩增动力学分析以了解其指数增长阶段。
如果用N0代表PCR反应体中的原始模板数,n为扩增次数,N为扩增产物量,那么理想的扩增结果应该是N=N0×2n。
但实际上DNA的每一次复制都不完全,即每一次扩增中,模板不是呈2倍增长。
如果用E代表扩增效率(指每次循环中参与复制的模板与总模板的比率),那么N= N0(1+E)n。
而且E在整个P CR扩增过程中不是固定不变的。
研究表明[30],当N0在 1-105拷贝之间,循环次数n≤2 0次时,E相对稳定,原始模板以相对固定的指数形式增加,适合定量分析;随着循环次数n的增加(>20次),E值逐渐减少,N呈非固定的指数形式增加,最后进入平台期。
荧光定量PCR实验及数据分析

荧光定量PCR实验及数据分析一、概述荧光定量PCR(Quantitative Realtime PCR,简称qPCR)是一种结合了PCR技术的高灵敏度和荧光探针技术的实时定量特性的分子生物学分析方法。
该方法通过实时监测PCR反应过程中荧光信号的变化,对模板DNA或RNA的初始浓度进行定量分析。
荧光定量PCR技术在基因表达研究、病原体检测、基因突变分析以及药物疗效评估等领域具有广泛的应用价值。
在荧光定量PCR实验中,通常使用特异性引物和荧光探针来识别并扩增目标序列。
荧光探针的设计是关键步骤之一,它必须能够与目标序列特异性结合并在PCR过程中产生可检测的荧光信号。
实验过程中还需严格控制反应条件,包括温度、时间、引物和探针的浓度等,以确保实验的准确性和可重复性。
数据分析是荧光定量PCR实验不可或缺的一部分。
通过对实验数据的收集、整理和分析,可以获取目标序列的初始浓度信息,进而对实验结果进行解读和评估。
数据分析方法包括相对定量和绝对定量两种,前者通过比较不同样本间目标序列的相对表达量来评估差异,后者则通过标准曲线法或质粒拷贝数法等方法来确定目标序列的绝对浓度。
荧光定量PCR技术是一种高效、灵敏且特异的分子生物学分析方法,对于研究基因表达、病原体检测等领域具有重要意义。
通过不断优化实验操作和数据分析方法,可以进一步提高荧光定量PCR实验的准确性和可靠性,为科学研究和临床实践提供有力支持。
1. 荧光定量PCR技术的概述荧光定量PCR技术,是一种基于DNA聚合酶链式反应的分子生物学技术,它通过引入荧光标记,实时监测PCR过程中目标DNA片段的扩增情况,从而实现对特定基因拷贝数的精确量化。
该技术结合了PCR的高效扩增能力与荧光信号的灵敏检测,使得微量DNA分子的检测成为可能,并在遗传学、分子生物学、医学诊断等领域中发挥着重要作用。
荧光定量PCR技术主要依赖于特异性引物和探针的设计,使得PCR扩增过程具有高度的特异性。
荧光定量PCR(qPCR)对基因表达的分析

荧光定量PCR(qPCR)对基因表达的分析一、实验试剂SYBR Green premix(Takara,RR420A)二、试验设备和材料无RNase的离心管、PCR管、枪头。
三、操作步骤(一)引物设计原则(1)设计引物的长度一般为18–28个核苷酸。
(2)扩增产物长度80-150 bp最好,最长是300 bp。
(3)避免重复核苷酸延伸段。
(4)目标为50% GC含量,有助于防止错配稳定化。
(5)选择Tm值匹配的引物(相差在5°C范围内),60℃左右最好。
(6)避免一个Assay中采用的所有引物之间以及各引物内出现序列互补。
(二)总RNA提取(TaKaRa MiniBEST Universal RNA Extraction Kit,9767)准备工作:Buffer RL中加入50×DTT;Buffer RWB中加入无水乙醇;配制70%DEPC乙醇。
1. 动物培养细胞的 RNA 提取(1)细胞的裂解。
①倒出培养液,使用 1×PBS清洗一次。
②向培养细胞中加入适当量(Table 1 中推荐的使用量)的裂解 Buffer RL(使用前请确认已加入 50×DTT Solution),水平放置片刻,使裂解液均匀分布于细胞表面并裂解细胞,然后使用移液枪吹打细胞使其脱落。
(6 孔细胞培养板每孔加入 350μL)③将内含细胞的裂解液转移至离心管中,用移液枪反复吹吸直至裂解液中无明显沉淀。
(2)裂解液室温静置2 min。
注:对于基因组含量较多的材料或者材料起始量较大时,可以直接按步骤 7 进行(否则 DNA 含量过高可能造成 gDNA Eraser Spin Column 堵塞),如基因组含量较低或材料起始量较少时,可以按步骤 3-6 进行。
(3)将gDNA Eraser Spin Column放到2 mL 的Collection Tube(试剂盒提供)上。
(4)将裂解液转移入到gDNA Eraser Spin Column中。
荧光定量PCR中的相对定量和绝对定量

荧光定量PCR中的相对定量和绝对定量绝对定量的⽬的是测定⽬的基因在样本中的分⼦数⽬,即通常所说的拷贝数。
相对定量的⽬的是测定⽬的基因在两个或多
个样本中的含量的相对⽐例,⽽不需要知道它们在每个样本中的拷贝数。
举例来说,如果研究项⽬中包括处理过的和未经处理的对照样本,通常可以将未经处理的样本指定为基准,规定其⽬的基因浓度为100%,将经处理的样本的定量结果除以对照样品的定量结果,就可以计算各个处理样本的基因含量相对于未处理样品的百分⽐。
绝对定量实验必须使⽤已知拷贝数的绝对标准品,必须做标准曲线。
相对定量可以做标准曲线,也可以不做标准曲线。
相对定量实验有两种⽅法:标准曲线法和C T值⽐较法。
如果使⽤标准曲线法,可以使⽤绝对标准品,也可以使⽤相对标准品,⽽且相对标准品在实验操作上更为简便易⾏。
相对标准品是只知道样品中DNA或RNA的稀释⽐例⽽不需要知道其分⼦数⽬的标准品,典型的做法是将⼀个已知pg数的样品做⼀系列梯度稀释。
C T值⽐较法是利⽤C T值与起始DNA浓度的对数成反⽐的数学关系,来计算不同样本之间的相对百分⽐,其计算公式是
绝对定量的数据易于理解,但是绝对标准品的制备和测定其DNA含量⽐较困难。
有许多商业性的标准品试剂盒供选购,可以解决这种困难。
相对定量的标准品容易在实验室⾥⾃⼰制备,但是数据处理⽐较⿇烦,对实验数据的解释有⼀定难度。
相对定量pcr计算方法

相对定量pcr计算方法
1 关于相对定量PCR
相对定量PCR(Relative Quantitative PCR)是一种技术,用于
测量在不同样本中同一基因两个水平之间的比例关系。
它采用PCR技
术将某基因在两个样本之间的表达量进行比较,从而可以估计目标基
因的相对表达量。
2 原理
相对定量PCR的原理是通过检测特定基因应该分泌的特定信号,
来对其表达水平进行强度比较,以此来估计基因在不同样品中的表达
水平。
在相对定量PCR中,会以标准样品中基因的表达量为基准,通
过比较待测样品该基因的表达水平,来估计目标基因在其中的相对表
达水平。
3 步骤
1. 准备用于PCR反应的物质,包括:核酸模板、DNA聚合酶、dNTPs、PCR用质粒、反正质样品和标准样品等。
2. 进行PCR反应,将模板和PCR用质粒以及一定浓度的催化剂混合,经固定温度变性、PCR扩增和特异性稳定等步骤,以获得PCR产物。
3. 并将混合物进行凝胶电泳,观察相对浓度上的差别。
4 计算
相对定量PCR的计算公式:
RNA相对表达量=2^(反正质样品的Ct值-标准样品的Ct值)
其中,Ct值(cycle threshold)是指PCR扩增图谱上测定出的基因特异性扩增图像所对应的横坐标值,它决定了特定的基因的表达量。
若Ct值较小,表明基因表达量较高。
4、相对定量: ΔΔCT法和相对标准曲线法

Ctnorm.
dCt
ddCt
2(-ddCt) 1 3 20
16.7 9.4 0 16.0 7.8 -1.6 显示出两倍的表达差异. 17.7 5.1 -4.3
重复样本平均Ct值
33
ΔΔCt计算示例
Cttarg. Untreated Treated 1 Treated 2 26.1 23.8 22.8
每对引物一条标准曲线
25
|
Life Technologies Proprietary & Confidential
|
9/28/2011
标准曲线可以帮助判断扩增效率
• 例如, 斜率 -3.3 说明扩增效率接近 100%. • 更小的负值 (例如 -3.5)说明扩增效率小于100%.
公式: E = 10(-1/斜率) -1
相对定量:ΔΔCT法和相对标准曲线法
定量 PCR: 相对基因表达量
2
示例实验
未处理 样本 目的基因: Plat1
处理后 样本
问题:样本处理后,Plat1基因的表达量有什么变化?
3
示例实验
未处理 样本 目的基因: Plat1
处理后 样本
问题:样本处理后,Plat1基因的表达量有什么变化?
4
实验流程
选择一个对照样本: 例如, 未处理样本 Reference ÷ Reference: Treated ÷ Reference:
18
0.0116 ÷ 0.0116 = 1 0.0484 ÷ 0.0116 = 4.2
表达倍数差异
软件计算
为你计算好所有的倍数关系.
19
ΔΔCt 法
20
|
Life Technologies Proprietary & Confidential
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定量PCR分析的相对定量法
预先研读科研文献,提出问题。
拟用60Co-γ射线照射HeLa细胞,经0,2,4,8,10Gy不同吸收剂量照射4小时后,研究60Co-γ射线对GRP78 mRNA表达水平的剂量影响关系。
设计拟扩增GRP78以及GAPDH(内参基因)引物序列,稀释合成后引物,验证是否合格能用,储存备用。
上下引物可以考虑预混,储存备用。
准备总RNA提取试剂盒,熟悉实验方法,即熟悉基本步骤与相应所用耗材,准备所用耗材。
知道经该试剂盒方法提取后实际剩下的总RNA体积数。
先培养二瓶细胞,长满后消化后混合,细胞计数,分成6瓶细胞,接种培养至第二天早晨。
编号。
送去钴源室60Co-γ射线照射,无菌操作,放回培养4小时。
按试剂盒程序提取各瓶细胞总RNA。
编号,测定并记录各管总RNA含量与体积数。
当天反转录成cDNA,并编号,测定总cDNA含量与体积数。
预约定量PCR仪器使用时间。
做5X6X2=60份定量PCR反应计划,因有5个剂量组,每一个剂量组做6次平行,2个基因。
考虑额外需要,故预混试剂拟按70份反应计划去准备。
做好96孔板中各孔排布图。
配制除样品cDNA和引物外的预混液,按计划加入96孔板中各孔指定位置内。
再有规律地依次加入规定量的cDNA样品,然后在排布图指定孔位置中加入指定量和指定种类的引物。
核实或做好加样记录。
定量PCR仪器分析开机预热、设定定量PCR仪器基本参数、位置参数和循环参数等;再次混匀96孔板中样品,将样品96孔板放入仪器中,检查后运行PCR仪器。
设计原始资料表格样式,记录各组实际扩增后所得CT值。
根据前面介绍的绝对定量法得到的标准曲线如下图,结合上表查找相应的基因含量数,转录如下表中,然后计算相应的平均数与标准差。
根据均值二次校对值和校对SD用SPSS软件做结果的ANOV A统计分析,检验各组之间的差异有无统计学意义,然后用excel软件作柱状图,并在柱状图上标示出SD变化,以及有无统计显著性差异的标识。
将该excel柱状图结果转换成PPT结论图,并给出图题、图例、实验方法主要内容以及注释。
转换成JPG文件,交给老师。
