定量检测抗缪勒氏管激素含量的试剂盒及其检测方法与相关技术
抗缪勒氏管激素检测SOP文件(iFlash3000)

抗缪勒氏管激素检测SOP文件1.检验目的:本试剂盒用于体外定量测定人血清和(或)血浆中的抗缪勒氏管激素。
2.检验原理:3.性能参数:3.1线性范围:0.10 ng/mL-16.00 ng/mL;3.2最低检测限:不大于0.010 ng/mL;3.3准确度:回收率在85.0%~115.0%范围内;3.4重复性:重复性检测的变异系数(CV)不大于10.0%;3.5批间差:3个批号试剂批间变异系数(CV)不大于15.0%;3.6特异性:用FSH浓度不低于200 IU/L的样本进行检测,检测结果不高于0.01ng/mL;用LH浓度不低于200 IU/L的样本进行检测,检测结果不高于0.01 ng/mL。
4.样品要求:4.1检测标本:血清和血浆(肝素锂、肝素钠、EDTA和柠檬酸钠抗凝)是推荐使用的样本类型。
尚未验证其他抗凝剂能否适用。
4.2采集及处理:在进行离心操作前需让血清样本完全凝结(凝结时间不小于1小时)。
所有的待测样本在测试前均应进行离心操作。
顶部含脂质的离心样本,需转移澄清、无脂质的部分到新的样本管中。
在测试前,确保已去除了残余的纤维蛋白和细胞类物质。
应小心处理患者样本,避免交叉污染。
在测试前,确保患者样本、校准品、质控品均已平衡至环境温度(20-25°C)。
为避免蒸发可能带来的影响,样本和校准品应在上机后2小时内完成测试。
4.3样品储存:在室温(20-25°C)下,样本保存时间不得超过4小时。
在2-8°C条件下,样本保存时间不得超过3天。
冷冻样本在融化后必须进行充分混匀。
样本冷冻次数不得超过1次5.设备和试剂:5.1仪器:iFlash 3000化学发光免疫分析仪。
5.2试剂:抗缪勒氏管激素测定试剂盒(化学发光法);包装量:2×50人份/盒;5.3储存要求:(1)储存:存放在2-8°C,保持竖直向上。
(2)有效期:试剂瓶及校准品未开封存放于2-8°C:可稳定365天;试剂瓶使用后存放于2-8°C或在机存储:可稳定28天;校准品复溶后在-20°C保存:可稳定28天(仅可冻融一次)。
抗缪勒氏管激素测定试剂盒(化学发光免疫分析法)产品技术要求新产业

2. 性能指标
2.1 外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2 批内精密度
批内变异系数(CV)应≤8%。
2.3 批间精密度
批间变异系数(CV)应≤15%。
2.4 准确度
回收率应在(90.0%~110.0%)范围内。
2.5 空白限
空白限应≤0.020 ng/mL。
2.6 线性
在(0.100~25.0)ng/mL浓度区间内,线性相关性系数(r)绝对值应≥0.9900。
2.7 校准品均一性
校准品均一性(CV)应≤8%。
2.8 质控品测量准确度
质控品1测定结果应在[2.80~5.20] ng/mL范围内,质控品2测定结果应在[11.2~20.8]ng/mL范围内。
2.9 质控品均一性
质控品均一性(CV)应≤8%。
2.10 溯源性
本试剂盒校准品可以溯源至企业内部校准品。
第1页共1页。
抗缪勒氏管激素(AMH)测定试剂盒(光激化学发光法)产品技术要求kemei

抗缪勒氏管激素(AMH)测定试剂盒(光激化学发光法)适用范围:本试剂盒用于体外定量测定人血清中抗缪勒氏管激素(AMH)的含量。
1.1 产品型号说明:1. 校准品浓度批特异,详见定值单。
2. 质控品质控范围批特异,详见定值单。
2.1 外观试剂盒组分齐全,内外包装均完整,标签清晰,液体试剂无渗漏。
2.2空白限不高于0.02ng/mL。
2.3准确性回收率应在85.00%~115.00%范围内。
2.4线性在[0.02,24.00]ng/mL区间内,试剂盒剂量-反应曲线线性相关系数(r)应不小于0.9900。
2.5重复性质控品测定结果的变异系数(CV)应不大于8.00%。
2.6批间差在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.00%。
2.7质控品测定值同一套质控品的测定结果应在本试剂盒规定的范围之内。
2.8特异性2.8.1与促黄体生成素(LH)浓度为500IU/L的LH在本试剂盒上测定的测定结果应不高于0.02ng/mL。
2.8.2 与促卵泡生成激素(FSH)浓度为500IU/L的FSH在本试剂盒上的测定结果应不高于0.02ng/mL。
2.8.3与抑制素A(Inhibin-A)浓度为100ng/mL的抑制素A在本试剂盒上的测定结果应不高于0.02ng/mL。
2.8.4与激活素A(Activin-A)浓度为100ng/mL的激活素A在本试剂盒上的测定结果应不高于0.02ng/mL。
2.9 稳定性取2℃~8℃保存至失效期3个月内的试剂盒,检测2.1、2.2、2.3、2.4、2.5、2.7、2.8项,结果应符合相应规定。
2.10 溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所用AMH校准品的来源、赋值过程以及测量不确定度等内容,本试剂盒配套校准品溯源至本公司抗缪勒试管激素工作校准品。
大鼠缪勒管抑制物质 抗缪勒管激素(MIS AMH) 酶联免疫分析试剂盒 说明书

大鼠缪勒管抑制物质/抗缪勒管激素(MIS/AMH)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用预期应用ELISA法定量测定大鼠血清、血浆或其它相关液体中缪勒管抑制物质/抗缪勒管激素(MIS/AMH)含量。
实验原理本试剂盒应用双抗体夹心酶标免疫分析法测定标本中MIS/AMH水平。
用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入MIS/AMH抗原、生物素化的抗大鼠MIS/AMH抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的MIS/AMH呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板:一块(96孔)2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为20,000pg/ml,做系列倍比稀释后,分别稀释20,000pg/ml,10,000pg/ml,5,000pg/ml,2,500pg/ml,1,250pg/ml,625pg/ml,312pg/ml,样品稀释液直接作为标准浓度0pg/ml,临用前15分钟内配制。
如配制10,000pg/ml标准品:取0.5ml20,000pg/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml/瓶。
4.检测稀释液A:1×10ml/瓶。
5.检测稀释液B:1×10ml/瓶。
6.检测溶液A:1×120ul/瓶(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(每孔100ul),实际配制时应多配制0.1-0.2ml。
如1ul检测溶液A加99ul检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
抗缪勒管激素(AMH)测定试剂盒(磁微粒化学发光法)产品技术要求ldm

抗缪勒管激素(AMH)测定试剂盒(磁微粒化学发光法)适用范围:该产品用于体外定量测定人血清样本中的抗缪勒管激素(AMH)含量。
1.1 规格100测试/盒50测试/盒。
1.2 主要组成成分试剂盒由试剂1、试剂2、磁分离试剂、校准品和质控品组成。
校准品和质控品浓度具有批特异性,具体浓度见瓶标签。
2.1外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3液体组分应澄清,无沉淀或絮状物;2.1.4包装标签应清晰,易识别。
2.2线性在[0.02, 30.00]ng/mL的测量范围内,试剂盒的相关系数(r)应≥0.9900。
2.3空白限应不大于0.015ng/mL。
2.4准确度回收率应在85.0%~115.0%范围内。
2.5重复性批内变异系数(CV)应不大于10.0%。
2.6批间差批间变异系数(CV)应不大于15.0%。
2.7质控品的赋值有效性质控品的测量值应在质控范围内。
2.8分析特异性试剂盒与表1中有关潜在交叉反应物应无显著的交叉反应。
表1特异性2.9 校准品和质控品的批内瓶间差2.9.1 校准品的批内瓶间差校准品A的S(瓶间)≤1.0,校准品B~校准品F的批内瓶间差CV≤10.0%。
2.9.2 质控品的批内瓶间差质控品的批内瓶间差CV≤10.0%。
2.10 溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程以及不确定度等内容,抗缪勒管激素(AMH)校准品溯源至企业校准品,企业校准品与已上市产品比对赋值。
2.11 稳定性2.11.1 效期稳定性试剂盒在2℃~8℃条件下储存,有效期为12个月,取超过有效期一个月内的试剂盒检测线性、空白限、准确度、重复性、质控品的赋值有效性应符合2.2、2.3、2.4、2.5、2.7的要求。
2.11.2 复溶稳定性2.11.2.1校准品和质控品开瓶复溶后,室温保存,可稳定4小时,在第5个小时再次检测,其中校准品A的绝对偏差应在±1ng/mL范围内,校准品B~校准品F和质控品相对偏差应在±10%范围内。
人(Human)抗缪勒管激素(AMH)ELISA试剂盒说明书

本试剂盒只能用于科学研究,不得用于医学诊断人(Human)缪勒管抑制物质/抗缪勒管激素(MIS/AMH)ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被缪勒管抑制物质/抗缪勒管激素(MIS/AMH)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的缪勒管抑制物质/抗缪勒管激素(MIS/AMH)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体-HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释底物A6mL3mL无底物B6mL3mL无终止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、250、500、1000、2000、4000pg/mL 试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
抗缪勒氏管激素测定试剂盒(化学发光法产品技术要求丽珠

2性能指标
2.1外观
试剂盒应各组分应齐全、完整,液体无渗漏;包装标签应清晰、准确、牢固。
2.2检出限
空白限(limitofblank,LoB)不大于0.01ng/mL,检出限(limitofdetection,LoD)为0.02ng/mL。
产品名称
抗缪勒氏管激素测定试剂盒(化学发光法)
型号、规格
3×14人份/盒
结构及组成
1、抗缪勒氏管激素免疫反应测试筒抗缪勒氏管激素结合磁微粒:抗抗缪勒氏管激素鼠单克隆抗体(包被抗体)包被磁微粒;抗缪勒氏管激素酶标抗体:含碱性磷酸酶标记的抗缪勒氏管激素鼠单克隆抗体(检测抗体)。2、测试筒支架
产品适用范围/预期用途
2.3准确度
将已知浓度的抗缪勒氏管激素样本加入到低值样本中,其回收率应在[85%,115%]。
2.4线性
线性范围不窄于0.05 ng/mL~23ng/mL,线性相关系数|r|应不低于0.990。
2.5重复性
测试重复性参考品,所得结果的变异系数(CV)应不大于8%。
2.6批间差
测试重复性参考品,所得结果的的变异系数(CV)应不大于10%。
抗缪勒氏管激素(AMH)测定试剂盒(光激化学发光法)产品技术要求
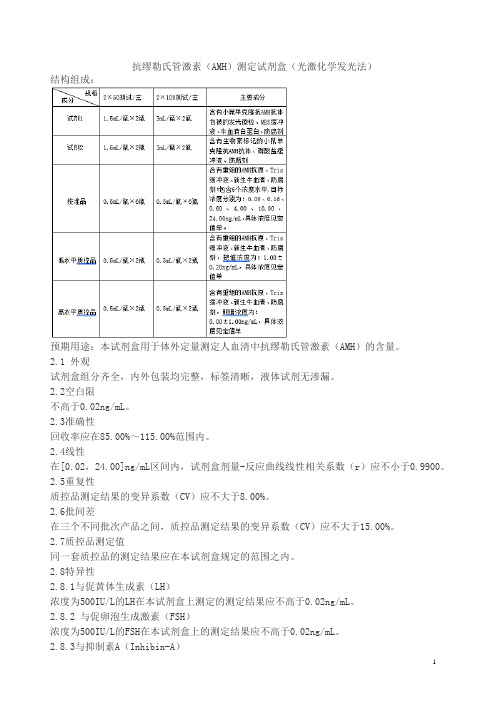
抗缪勒氏管激素(AMH)测定试剂盒(光激化学发光法)结构组成:预期用途:本试剂盒用于体外定量测定人血清中抗缪勒氏管激素(AMH)的含量。
2.1 外观试剂盒组分齐全,内外包装均完整,标签清晰,液体试剂无渗漏。
2.2空白限不高于0.02ng/mL。
2.3准确性回收率应在85.00%~115.00%范围内。
2.4线性在[0.02,24.00]ng/mL区间内,试剂盒剂量-反应曲线线性相关系数(r)应不小于0.9900。
2.5重复性质控品测定结果的变异系数(CV)应不大于8.00%。
2.6批间差在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.00%。
2.7质控品测定值同一套质控品的测定结果应在本试剂盒规定的范围之内。
2.8特异性2.8.1与促黄体生成素(LH)浓度为500IU/L的LH在本试剂盒上测定的测定结果应不高于0.02ng/mL。
2.8.2 与促卵泡生成激素(FSH)浓度为500IU/L的FSH在本试剂盒上的测定结果应不高于0.02ng/mL。
2.8.3与抑制素A(Inhibin-A)浓度为100ng/mL的抑制素A在本试剂盒上的测定结果应不高于0.02ng/mL。
2.8.4与激活素A(Activin-A)浓度为100ng/mL的激活素A在本试剂盒上的测定结果应不高于0.02ng/mL。
2.9 稳定性取2℃~8℃保存至失效期3个月内的试剂盒,检测2.1、2.2、2.3、2.4、2.5、2.7、2.8项,结果应符合相应规定。
2.10 溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所用AMH校准品的来源、赋值过程以及测量不确定度等内容,本试剂盒配套校准品溯源至本公司抗缪勒试管激素工作校准品。
抗缪勒氏管激素(AMH)测定试剂(荧光免疫层析法) 产品技术要求万孚

1.性能指标
1.1外观检查
外观应平整,标识清晰,各组分齐全,液体无渗漏。
1.2物理检查
膜条宽为4.0±0.5mm;液体移行速度应不低于10mm/min。
1.3准确度
用参考品作为样本进行测定,其测定结果的相对偏差(Bias)不应超过±15%。
1.4最低检出限
应不大于0.1 ng/mL。
1.5线性
在0.1 ng/mL~16 ng/mL 的范围内,线性相关系数r≥0.9900。
1.6精密度
1.6.1批内精密度
用同一批号的试剂分别测定 2 个不同浓度的参考品,其测定结果的变异系数(CV)应不大于10%。
1.6.2批间精密度
用三个不同批号的试剂分别测定2 个不同浓度的参考品,其测定结果的变异系数(CV)应不大于15%。
1。
抗缪勒管激素(AMH)测定试剂盒(磁微粒化学发光法)产品技术要求北京华科泰生物
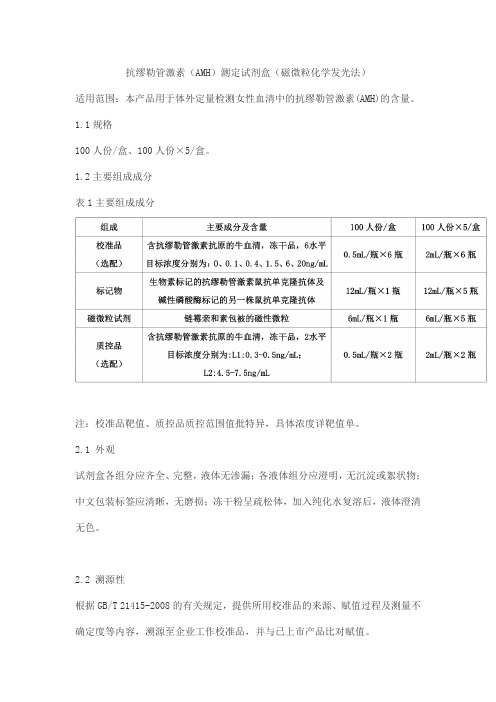
抗缪勒管激素(AMH)测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量检测女性血清中的抗缪勒管激素(AMH)的含量。
1.1规格100人份/盒、100人份×5/盒。
1.2主要组成成分表1主要组成成分注:校准品靶值、质控品质控范围值批特异,具体浓度详靶值单。
2.1 外观试剂盒各组分应齐全、完整,液体无渗漏;各液体组分应澄明,无沉淀或絮状物;中文包装标签应清晰,无磨损;冻干粉呈疏松体,加入纯化水复溶后,液体澄清无色。
2.2 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3 准确度回收率应在90%~110%之间。
2.4 线性在线性范围内[0.1,20]ng/mL,相关系数(r)应不低于0.99。
2.5 重复性分别检测高值和低值两个样本,重复性(CV%)应不高于10.0%。
2.6 批间差在三个不同批次产品之间,样本测定结果的变异系数(CV%)应不高于15.0%。
2.7 空白限空白限应不高于0.05ng/mL。
2.8 特异性表2与FSH、LH的交叉反应2.9 质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10 稳定性2.10.1 效期稳定性2℃~8℃储存,有效期12个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2 复溶稳定性2.10.2.1 校准品开瓶后(复溶后),-20℃以下储存,有效期1个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2.2 质控品开瓶后(复溶后),-20℃以下储存,有效期1个月,效期后分别检测2.5、2.9项,其结果应符合各项要求。
抗缪勒管激素测定试剂盒(化学发光免疫分析法)说明书

Statistical Approach; Approved Guideline. [9] CLSI EP09C-ED3:2018 Measurement Procedure Comparison and Bias Estimation Using
I
YY/T XXXXX—XXXX
前言
本标准按照GB/T 1.1—2009给出的规则起草。 本标准的某些内容可能涉及专利,本文件的发布机构不承担识别这些专利的责任。 本标准由国家药品监督管理局提出。 全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)归口。 本标准起草单位: 本标准主要起草人:
V cs
100%
................................... (1)
式中:
R—回收率;
V—样品A液的体积;
V0—样本B液的体积; C—样本B液加入A液后的检测浓度;
C0—测量B液的浓度; Cs—样本A液的浓度。
4.4 重复性 用同一批号试剂盒,对至少2个不同浓度的质控品或临床样本(高值质控或临床样本浓度不低于
Patient Samples; Third Edition. _________________________________
5
4 试验方法 4.1 外观
在自然光下以正常视力或矫正视力目视检查,检测结果应符合3.1的要求。
4.2 检出限 生产企业应提供试剂盒的空白限、检出限及参考区间等相关信息。根据制造商提供的信息,对5
抗缪勒氏管激素测定试剂盒(化学发光免疫分析法)产品技术要求万孚

1性能指标
1.1外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;校准品和质控品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
1.2准确度
将具有溯源性的两个浓度准确度参考品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
1.3空白限
不大于0.007ng/mL。
1.4线性
试剂盒在0.01ng/mL~23ng/mL 区间内,其相关系数(r)的绝对值不低于0.9900。
1.5重复性
变异系数CV≤8%。
1.6批间差
变异系数CV≤10%。
1.7校准品
1.7.1校准品准确度
测定校准品,C1,C2 测定结果的相对偏差在±10%范围内。
1.7.2校准品瓶内均一性
校准品C1,C2 瓶内均一性≤8%。
1.7.3校准品瓶间均一性
校准品C1,C2 瓶间均一性≤5%。
1.8质控品
1.8.1瓶内均一性
变异系数CV≤8.0%。
1.8.2瓶间均一性
变异系数CV≤5.0%。
1.8.3靶值及靶值范围
每批质控品均应提供本批产品的靶值单,并应提供赋值方法程序文件。
质控品的测试值应在靶值范围内。
抗缪勒氏管激素测定试剂盒、制备方法及检测方法[发明专利]
![抗缪勒氏管激素测定试剂盒、制备方法及检测方法[发明专利]](https://img.taocdn.com/s3/m/eb3e88102e60ddccda38376baf1ffc4ffe47e2f2.png)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202010797714.5(22)申请日 2020.08.10(71)申请人 深圳市宇诺生物技术有限公司地址 518110 广东省深圳市龙华区观澜街道新澜社区观光路1303号鸿信工业园3号厂房501;1号厂房501(72)发明人 肖宇强 张平 马金玉 周玲 赖鹏飞 (51)Int.Cl.G01N 33/74(2006.01)G01N 33/58(2006.01)G01N 33/577(2006.01)G01N 33/558(2006.01)G01N 33/543(2006.01)(54)发明名称抗缪勒氏管激素测定试剂盒、制备方法及检测方法(57)摘要本发明公开了一种抗缪勒氏管激素测定试剂盒,其特征在于,包括反应物质,所述反应物质包括检测线荧光偶合物及质控线荧光偶合物,所述检测线荧光偶合物含有荧光微球标记的抗缪勒氏管激素单克隆抗体,所述质控线荧光偶合物含有荧光微球标记的鸡IgY抗体、兔IgG抗体或鼠IgG抗体中的一种,反应物质由检测线荧光偶合物及质控线荧光偶合物在冻干保护液的保护下经过冷冻干燥制成。
该试剂盒检验准确度高、特异性强、重现性好、操作快捷。
权利要求书2页 说明书16页 附图2页CN 111999509 A 2020.11.27C N 111999509A1.一种抗缪勒氏管激素测定试剂盒,其特征在于,包括反应物质,所述反应物质包括检测线荧光偶合物及质控线荧光偶合物,所述检测线荧光偶合物含有荧光微球标记的抗缪勒氏管激素单克隆抗体,所述质控线荧光偶合物含有荧光微球标记的鸡IgY抗体、兔IgG抗体或鼠IgG抗体中的一种。
2.根据权利要求1所述的抗缪勒氏管激素测定试剂盒,其特征在于,所述反应物质由检测线荧光偶合物及质控线荧光偶合物在冻干保护液的保护下经过冷冻干燥制成。
3.根据权利要求1所述的抗缪勒氏管激素测定试剂盒,其特征在于,所述荧光微球为时间分辨荧光微球,所述时间分辨荧光微球包埋稀土离子,同时所述时间分辨荧光微球表面修饰有氨基、羧基或羟基中至少一种功能基团;所述稀土离子选自镧系元素中Sm钐、Eu铕、Gd钆、Tb铽、Dy镝中的至少一种。
北京协和洛克抗缪勒氏管激素测定试剂盒(酶联免疫吸附法)产品技术要求

抗缪勒氏管激素测定试剂盒(酶联免疫吸附法)结构组成:预期用途:用于体外定量测定女性血清中抗缪勒氏管激素(AMH)的浓度。
2.1.外观1)试剂盒各组分齐全、完整,内外包装均应完整,标识清晰。
2)液体试剂无渗漏,冻干组分呈疏松体,复溶后液体均匀(无肉眼可见颗粒、无沉淀)2.2.质控品赋值有效性分别取高、低两个浓度质控品,检测其浓度值,每个测试值均应在所示的质控范围内。
2.3.准确度回收率为85%~115%。
2.4.空白限不高于0.04ng/ml2.5.线性试剂盒的线性范围为[0.05,18]ng/mL,相关系数r不小于0.9900。
2.6.重复性用高、低2个浓度水平的样本各重复检测10次,其变异系数(CV)不大于13%。
2.7. 瓶内均一性用同一批次的1套校准品和质控品作为样本重复检测10次,除校准品A外各点测值变异系数(CV)不大于13%,校准品A吸光度值变异系数(CV)不大于13%。
2.8. 批内瓶间差用同一批次的10套校准品和质控品作为样本检测,除校准品A外各点测值变异系数(CV)不大于13%,校准品A吸光度值变异系数(CV)不大于13%。
2.9.批间差用3个批号试剂盒检测同一份样本,变异系数(CV)不大于15%。
2.10.特异性浓度为促卵泡激素(FSH)200ng/mL、促黄体生成素(LH)200ng/mL的作为样本进行特异性反应,交叉反应率应小于5%。
2.11.稳定性2.11.1 效期稳定性试剂盒在2℃~8℃保存,有效期12个月,取效期后产品进行检测,检测结果应符合2.1~2.6、2.10项要求。
2.11.2 校准品复溶稳定性校准品开瓶复溶后,在2℃~8℃保存,可以稳定3天后检测准确度和线性区间,应符合2.3、2.5项要求。
2.11.3 质控品复溶稳定性质控品开瓶复溶后,在2℃~8℃保存,可以稳定3天后检测质控品重复性和赋值有效性。
质控品重复性的变异系数(CV)不大于13%,赋值有效性应符合2.2项要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本技术介绍了一种定量检测抗缪勒氏管激素含量的试剂盒及其检测方法,试剂盒包括NHS磁珠悬浮液、抗缪勒氏管激素单抗I、抗缪勒氏管激素单抗II、偶联缓冲液、封闭液、增强液、清洗液、校准品;本技术将时间分辨荧光免疫分析法的灵敏性、磁分离技术的快速性相结合,检测方法操作简便,检测时间大大缩短,重复性良好,可大面积用于临床检测。
技术要求1.一种定量检测抗缪勒氏管激素含量的试剂盒,其特征在于,包括:NHS磁珠悬浮液、抗缪勒氏管激素单抗I、抗缪勒氏管激素单抗II、偶联缓冲液、封闭液、增强液、清洗液、校准品。
2.一种定量检测抗缪勒氏管激素含量的试剂盒的检测方法,其特征在于,包括如下步骤:(1)取抗缪勒氏管激素单抗I用偶联缓冲液稀释至浓度≥20ug/mL;(2)取100μL的NHS磁珠悬浮液于反应管中,磁性分离,保留NHS磁珠,弃上清液;加入500μL的偶联缓冲液于反应管中,涡旋15s;磁性分离,保留NHS磁珠,弃上清液;(3)取1mL已稀释的抗缪勒氏管激素单抗I加入到反应管中,涡旋30s,混匀NHS磁珠;将反应管置于旋转混合仪上,室温孵育2h;(4)孵育结束后,磁性分离,弃上清液,保留NHS磁珠;加入1mL的封闭液于反应管中,涡旋20s,将反应管置于旋转混合仪上,室温孵育1h,磁性分离,弃上清液,保留NHS磁珠;最后加入1mL的清洗液于反应管中,涡旋20s,磁性分离,弃上清液,保留NHS磁珠;重复上述清洗步骤1次;得到偶联抗缪勒氏管激素单抗I的磁珠,加入保存液后,4°保存待用;(5)取500μL抗缪勒氏管激素单抗II、200μL的Eu3+-DTPA加入到反应管中,25℃磁力搅拌反应24h,得到Eu3+标记的抗缪勒氏管激素单抗II,将Eu3+标记的抗缪勒氏管激素单抗II用蛋白柱纯化后保存待用;(6)在96孔微孔板中,依次加入偶联抗缪勒氏管激素单抗I的磁珠、50μL校准品或待测血清、150μL Tris-HCL反应缓冲液,25℃振荡孵育5min,静置2min,保留偶联抗缪勒氏管激素单抗I的磁珠,弃上清;用清洗液重复上述清洗步骤5次;再加入200μL的Eu3+标记的抗缪勒氏管激素单抗II,25℃振荡孵育5min;用清洗液重复上述清洗步骤5次;加入200μL增强液,25℃振荡孵育5min;采用时间分辨荧光免疫分析仪进行检测。
3.根据权利要求2所述的一种定量检测抗缪勒氏管激素含量的试剂盒的检测方法,其特征在于,所述偶联缓冲液为浓度0.2M、pH8.3的碳酸钠缓冲液。
4.根据权利要求2所述的一种定量检测抗缪勒氏管激素含量的试剂盒的检测方法,其特征在于,所述清洗液为含有8mmol/L Nacl、0.1%BSA、0.2%牛血清白蛋白、0.1mol/L的Tween-80、0.1%NaN3的Tris-HCL缓冲液(50mmol/L、pH7.8)。
5.根据权利要求2所述的一种定量检测抗缪勒氏管激素含量的试剂盒的检测方法,其特征在于,所述封闭液为含1%BSA的PBS缓冲液(0.02M,pH7.4)。
6.根据权利要求2所述的一种定量检测抗缪勒氏管激素含量的试剂盒的检测方法,其特征在于,所述保存液为含5%BSA,10%海藻糖,0.1%Tween-20的Tris-HCl缓冲液(0.05M,pH 8.0)。
7.根据权利要求2所述的一种定量检测抗缪勒氏管激素含量的试剂盒的检测方法,其特征在于,所述增强液为含0.03%乙酸钠、0.0002~0.0009%β-NTA、0.0024%TOPO、0.08%醋酸、0.1%无水乙醇、0.05%的Triton X-100的水溶液。
技术说明书一种定量检测抗缪勒氏管激素含量的试剂盒及其检测方法技术领域本技术涉及体外诊断领域,具体涉及一种定量检测抗缪勒氏管激素含量的试剂盒及其检测方法。
背景技术抗缪勒氏管激素又称AMH,是早期卵泡的直接产物,由二硫化物桥连接两个72KDa单体组成的糖蛋白二聚体,由女性卵巢组织的粒层细胞分泌。
AMH最初表达于初级卵泡的颗粒细胞层,在直径约0.1~0.2mm的窦前卵泡及直径约2mm左右小窦状卵泡中表达最强,而在>4mm窦状卵泡中表达逐渐减弱至完全消失,对于卵泡发育具有重要的调节作用,血清AMH水平不受垂体促性腺激素的影响,在整个月经周期中数值变化不大。
相对于目前常用的预测卵巢储备及卵巢反应性(年龄及窦卵泡数目,卵泡刺激素和雌二醇等)传统方法而言,血AMH值可即时生成,可准确、灵敏地反映卵巢储备功能。
在监测卵巢储备力、诊断卵巢相关疾病、预测IVF成功率及预防OHSS并发症等方面具有其他指标不可比拟的优势。
AMH是目前预测卵巢反应、评估卵巢储备功能的最理想生物标志物。
对于AMH的检测,目前临床的方法包括:酶联免疫法、化学发光、电化学发光法等方法。
目前最常用的是酶联免疫法利用酶联免疫法检测抗缪勒氏管激素含量,灵敏度高,特异性强,但检测时间长,不能自动化;化学发光法检测血清中AMH,能自动化检测,但需要昂贵化学发光检测系统。
传统时间分辨荧光免疫分析法中,抗体与微孔板上捕获物质结合较慢,而免疫磁珠均匀分散于溶液中,与抗体接触面积增大,从而增加了免疫磁珠与抗体的结合速率,大大提高了检测反应的比表面积,缩短了检测时间,本技术检测抗缪勒氏管激素的试剂盒将时间分辨荧光免疫层析技术与磁分离技术相结合,具有灵敏度高,操作快速简便的优点。
技术内容本技术的目的在于提供一种定量检测抗缪勒氏管激素含量的试剂盒及其检测方法,具有特异性强、检测时间短、操作快速简便,短时间即可得结果等优点。
为实现上述目的,本技术提供如下技术方案:一种定量检测抗缪勒氏管激素含量的试剂盒,包括NHS磁珠悬浮液、抗缪勒氏管激素单抗I、抗缪勒氏管激素单抗II、偶联缓冲液、封闭液、增强液、清洗液、校准品。
一种定量检测抗缪勒氏管激素含量的试剂盒的检测方法,包括如下步骤:(1)取抗缪勒氏管激素单抗I用偶联缓冲液稀释至浓度≥20ug/mL;(2)取100μL的NHS磁珠悬浮液于反应管中,磁性分离,保留NHS磁珠,弃上清液;加入500μL的偶联缓冲液于反应管中,涡旋15s;磁性分离,保留NHS磁珠,弃上清液;(3)取1mL已稀释的抗缪勒氏管激素单抗I加入到反应管中,涡旋30s,混匀NHS磁珠;将反应管置于旋转混合仪上,室温孵育2h;(4)孵育结束后,磁性分离,弃上清液,保留NHS磁珠;加入1mL的封闭液于反应管中,涡旋20s,将反应管置于旋转混合仪上,室温孵育1h,磁性分离,弃上清液,保留NHS磁珠;最后加入1mL的清洗液于反应管中,涡旋20s,磁性分离,弃上清液,保留NHS磁珠;重复上述清洗步骤1次;得到偶联抗缪勒氏管激素单抗I的磁珠,加入保存液后,4°保存待用;(5)取500μL抗缪勒氏管激素单抗II、200μL的Eu3+-DTPA加入到反应管中,25℃磁力搅拌反应24h,得到Eu3+标记的抗缪勒氏管激素单抗II,将Eu3+标记的抗缪勒氏管激素单抗II用蛋白柱纯化后保存待用;(6)在96孔微孔板中,依次加入偶联抗缪勒氏管激素单抗I的磁珠、50μL校准品或待测血清、150μL Tris-HCL反应缓冲液,25℃振荡孵育5min,静置2min,保留偶联抗缪勒氏管激素单抗I的磁珠,弃上清;用清洗液重复上述清洗步骤5次;再加入200μL的Eu3+标记的抗缪勒氏管激素单抗II,25℃振荡孵育5min;用清洗液重复上述清洗步骤5次;加入200μL增强液,25℃振荡孵育5min;采用时间分辨荧光免疫分析仪进行检测。
所述偶联缓冲液为浓度0.2M、pH 8.3的碳酸钠缓冲液。
所述清洗液为含有8mmol/L Nacl、0.1%BSA、0.2%牛血清白蛋白、0.1mol/L的Tween-80、0.1%NaN3的Tris-HCL缓冲液(50mmol/L、pH7.8)。
所述封闭液为含1%BSA的PBS缓冲液(0.02M,pH7.4)。
所述保存液为含5%BSA,10%海藻糖,0.1%Tween-20的Tris-HCl缓冲液(0.05M,pH8.0)。
所述增强液为含0.03%乙酸钠、0.0002~0.0009%β-NTA、0.0024%TOPO、0.08%醋酸、0.1%无水乙醇、0.05%的Triton X-100的水溶液。
本技术时间分辨荧光免疫定量检测AMH试剂盒的检测原理为夹心法,96孔微孔板中先加入偶联抗缪勒氏管激素单抗I的磁珠,再将校准品或待测血清加入到反应孔中,150μL Tris-HCL反应缓冲液,25℃振荡孵育5min,静置2min。
多次洗涤后,加入200μL的Eu3+标记的抗缪勒氏管激素单抗II,形成免疫磁珠-抗原-铕标/钐标抗体复合物。
洗涤后,再加入增强液,在激发光的作用下,荧光物质发射一定波长的光信号,被时间分辨免疫荧光分析仪识别,样本中被测物越多,产生的荧光信号强度越强。
将AMH浓度与荧光信号值拟定标曲线,根据待测样本的发光强度值推算AMH的浓度。
本技术具有有益效果:本技术将时间分辨荧光免疫分析法的灵敏性、磁分离技术的快速性相结合,检测方法操作简便,检测时间大大缩短,重复性良好,可大面积用于临床检测。
说明书附图图1为高纯度增强液与常见增强液时间-Eu3+计数曲线图。
具体实施方式下面将对本技术实施例中的技术方案进行清楚、完整地描述。
实施例1一种定量检测抗缪勒氏管激素含量的试剂盒,包括NHS磁珠悬浮液、抗缪勒氏管激素单抗I、抗缪勒氏管激素单抗II、偶联缓冲液、封闭液、增强液、清洗液、校准品。
一种定量检测抗缪勒氏管激素含量的试剂盒的检测方法,包括如下步骤:(1)取抗缪勒氏管激素单抗I用偶联缓冲液稀释至浓度20ug/mL;(2)取100μL的NHS磁珠悬浮液于反应管中,磁性分离,保留NHS磁珠,弃上清液;加入500μL的偶联缓冲液于反应管中,涡旋15s;磁性分离,保留NHS磁珠,弃上清液;(3)取1mL已稀释的抗缪勒氏管激素单抗I加入到反应管中,涡旋30s,混匀NHS磁珠;将反应管置于旋转混合仪上,室温孵育2h;(4)孵育结束后,磁性分离,弃上清液,保留NHS磁珠;加入1mL的封闭液于反应管中,涡旋20s,将反应管置于旋转混合仪上,室温孵育1h,磁性分离,弃上清液,保留NHS磁珠;最后加入1mL的清洗液于反应管中,涡旋20s,磁性分离,弃上清液,保留NHS磁珠;重复上述清洗步骤1次;得到偶联抗缪勒氏管激素单抗I的磁珠,加入保存液后,4°保存待用;(5)取500μL抗缪勒氏管激素单抗II、200μL的Eu3+-DTPA加入到反应管中,25℃磁力搅拌反应24h,得到Eu3+标记的抗缪勒氏管激素单抗II,将Eu3+标记的抗缪勒氏管激素单抗II用蛋白柱纯化后保存待用;(6)在96孔微孔板中,依次加入偶联抗缪勒氏管激素单抗I的磁珠、50μL校准品或待测血清、150μL Tris-HCL反应缓冲液,25℃振荡孵育5min,静置2min,保留偶联抗缪勒氏管激素单抗I的磁珠,弃上清;用清洗液重复上述清洗步骤5次;再加入200μL的Eu3+标记的抗缪勒氏管激素单抗II,25℃振荡孵育5min;用清洗液重复上述清洗步骤5次;加入200μL增强液,25℃振荡孵育5min;采用时间分辨荧光免疫分析仪进行检测。
