酶促反应动力学(2)
酶促反应动力学实验报告

酶促反应动力学实验报告酶促反应动力学实验报告摘要:本实验旨在研究酶促反应的动力学过程。
通过测量不同底物浓度下酶催化反应速率的变化,分析酶的催化特性和底物浓度对反应速率的影响。
实验结果表明,酶促反应速率与底物浓度呈正相关关系,但随着底物浓度增加,反应速率逐渐趋于饱和。
1. 引言1.1 酶的作用1.2 酶促反应动力学2. 实验方法2.1 材料准备2.2 实验步骤3. 实验结果与分析3.1 反应速率与底物浓度关系曲线3.2 酶活性计算公式及计算结果4. 讨论与结论4.1 反应速率与底物浓度关系解释4.2 实验误差及改进方案1 引言1.1 酶的作用酶是一类生物催化剂,能够加速生物体内化学反应的进行。
它们通常是蛋白质或核酸分子,并具有高度特异性。
在细胞内,酶参与调节代谢途径、合成新物质以及降解废物等重要生物过程。
1.2 酶促反应动力学酶促反应动力学研究酶催化反应速率与底物浓度、温度和pH等因素之间的关系。
其中,底物浓度是影响酶催化速率的重要因素之一。
当底物浓度较低时,反应速率随着底物浓度的增加而迅速增加;当底物浓度较高时,反应速率逐渐趋于饱和。
2 实验方法2.1 材料准备- 酶溶液:根据实验要求选择合适的酶溶液。
- 底物溶液:根据实验要求配置不同浓度的底物溶液。
- 缓冲液:用于维持实验环境中恒定的pH值。
- 试管或微孔板:用于进行反应混合和观察。
- 分光光度计:用于测量反应混合液的吸光度变化。
2.2 实验步骤1. 准备一系列不同浓度的底物溶液,并标明其浓度。
2. 在试管或微孔板中分别加入相同体积的酶溶液和不同浓度的底物溶液,混合均匀。
3. 将反应混合物放入分光光度计中,设置适当的波长并记录吸光度值。
4. 在一定时间间隔内,测量吸光度值的变化,并记录下来。
5. 根据实验数据计算反应速率。
3 实验结果与分析3.1 反应速率与底物浓度关系曲线根据实验数据绘制反应速率与底物浓度关系曲线。
实验结果显示,随着底物浓度的增加,反应速率也增加。
酶促反应动力学资料

值.
②. 判断酶的专一性或最适底物(天然底物)
同一个酶催化不同底物时
Km最小的底物称该酶的最适底物或天然底物
蔗糖酶既可催化蔗糖水解(Km=28mmol/L),
也可催化棉子糖水解(Km=350mmol/L),蔗糖为天然底物。
1903年Henri用蔗糖酶水解蔗糖实验
一 级 反 应
V Vmax
[S]
当底物浓度较低时:
反应速度与底物浓度成正比关系; 反应为一级反应。
混合级反应
V
Vmax
[S]
随着底物浓度的增高:
反应速度不再成正比例加速; 反应为混合级反应。
零级反应
V Vmax
[S]
当底物浓度高达一定程度:
反应速度不再增加,达最大速度; 反应为零级反应
酶促反应动力学
概念
研究各种因素对酶促反应速度的影响,并加
以定量的阐述。 影响因素包括有
底物浓度:米氏方程 酶浓度:Vmax=K3 [E]
V=
Vmax[S]
Km + [S]
抑制剂:可逆抑制剂和不可逆抑制剂
激活剂: pH:最适PH 温度:最适温度
一. 化学动力学
(一)、反应速度及其测定:
(2). Vmax与K3(Kcat)的意义
Vmax(不是酶的特征常数) maximum velocity
① 定义:是酶完全被底物饱和时的反应速度,与酶浓度成正比. ② 意义:Vmax=K3 [E] (k3是一级反应速率常数)
如果酶的总浓度已知,可从Vmax计算 酶的转换数即动力
第九章 酶促反应动力学
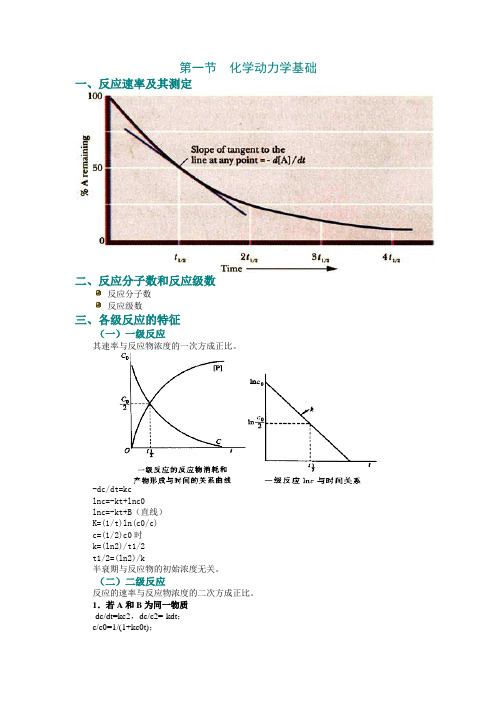
第一节化学动力学基础一、反应速率及其测定二、反应分子数和反应级数反应分子数反应级数三、各级反应的特征(一)一级反应其速率与反应物浓度的一次方成正比。
-dc/dt=kclnc=-kt+lnc0lnc=-kt+B(直线)K=(1/t)ln(c0/c)c=(1/2)c0时k=(ln2)/t1/2t1/2=(ln2)/k半衰期与反应物的初始浓度无关。
(二)二级反应反应的速率与反应物浓度的二次方成正比。
1.若A和B为同一物质-dc/dt=kc2,dc/c2=-kdt;c/c0=1/(1+kc0t);c/c0=1/2时,k=1/c0t1/2。
2.A和B的初始浓度相同k=(1/t){x/[a(a−x)] }3.A和B的初始浓度不同k=[1/t(a−b)]/ln{[b(a−x)]/[a(b−x)]}a:反应物A的初始浓度。
b:反应物B的初始浓度。
(a-x):反应时间为t时A的浓度。
(b-x):反应时间为t时B的浓度。
(三)零级反应反应速率与反应物的浓度无关。
-dc/dt=k,或dx/dt=k。
X=kt,或k=x/t。
第二节底物浓度对酶反应速率的影响一、中间产物学说中间产物学说的实验依据:(1)核酸和酶的复合物可直接用电镜观察;(2)下图;(3)复合物的溶解度和稳定性有所变化;(4)有些复合物可直接分离得到。
酶催化的反应中各成份的变化:酶反应的速度在不停地变,实验上只有初速度的测定才有意义。
酶反应的初速度与底物浓度之间的关系:二、酶促反应的动力学方程式(一)米氏方程的推导Briggs & Haldane 推导k1([Eo]-[ES])[S]=k2[ES]+k3[ES]Km=(k2+k3)/k1,[ES]=[Eo][S]/(Km+[S]) 因为v=k3[ES],而Vmax=k3[Eo] 因此v=Vmax[S]/(Km+[S])米氏方程v=Vmax[S]/(Km+[S])符合v-[S]曲线。
若Km>>[S],v=(Vmax/Km)[S]; 若[S]>>Km ,v=Vmax ;由v=Vmax[S]/(Km+[S]),得Km=[S][(Vmax/v)-1],为典型的双曲线方程。
2 酶促反应动力学(2)

2.2.4 抑制剂对酶促反应速率的影响首先应搞清失活作用与抑制作用的异同。
失活作用:指物理或化学因素部分或全部破坏了酶的三维结构,引起酶的变性,导致酶部分或全部丧失活性。
抑制作用:指酶在不变性条件下,由于活性中心化学性质的改变而引起酶活性的降低或丧失。
凡能使酶的活性下降而不引起酶蛋白变性的物质称做酶的抑制剂(inhibitor)。
使酶变性失活(称为酶的钝化)的因素如强酸、强碱等,不属于抑制剂。
通常抑制作用分为可逆性抑制和不可逆性抑制两类。
2.2.4.1竞争性抑制图2-3 竞争性抑制作用示意图 反应机理:P E ES S E k k k +→⇔+−211 (2-36)EI I E IK ⇔+ (2-37) 采用快速平衡法推导动力学方程:ES C k r 2= (2-38)S ES S E K k k C C C ==−11(2-39) I EIIE K C C C = (2-40) EI ES E E C C C C ++=0 (2-41)解之,得SI I S SC K C K C r r ++=)/1(max (2-42)E IS式中,02max E C k r =,11k k K S −=采用稳态法推导动力学方程:ES C k r 2= (2-43)0211=−−=−ES ES S E ESC k C k C C k dtdC (2-44)0=−=−EI i I E i EIC k C C k dtdC (2-45) EI ES E E C C C C ++=0(2-46)解之,得SI I m SC K C K C r r ++=)/1(max (2-47)式中: 02max E C k r =,121k k k K m +=− 令 )/1(I I m m K C K K +=′,(2-47)式可变形为Sm SC K C r r +′=max (2-48) 式中 m m K K >′将(2-48)式与米氏方程比较,可知最大反应速率测有变化,而K m 增大。
2酶促反应动力学-28页精选文档

2 酶促反应动力学教学基本内容:酶促反应的特点;单底物酶促反应动力学方程(米氏方程)的推导;抑制剂对酶促反应的影响,竞争性抑制和非竞争性抑制酶促反应动力学方程的推导;产物抑制、底物抑制的概念,产物抑制和底物抑制酶促反应动力学方程的推导;多底物酶促反应的机制,双底物酶促反应动力学的推导;固定化酶的概念,常见的酶的固定化方法,固定化对酶性质的影响及固定化对酶促反应的影响,外扩散过程和内扩散过程分析;酶的失活动力学。
2.1 酶促反应动力学的特点2.2 均相酶促反应动力学2.2.1 酶促反应动力学基础2.2.2 单底物酶促反应动力学2.2.3抑制剂对酶促反应速率的影响2.2.4多底物酶促反应动力学2.3 固定化酶促反应动力学2.4 酶的失活动力学授课重点:1. 酶的应用研究与经典酶学研究的联系与区别2. 米氏方程。
3 竞争性抑制酶促反应动力学方程。
4. 非竞争性抑制酶促反应动力学方程。
5. 产物抑制酶促反应动力学方程。
6. 底物抑制酶促反应动力学方程。
7. 双底物酶促反应动力学方程。
8. 外扩散对固定化酶促反应动力学的影响,Da准数的概念。
9. 内扩散对固定化酶促反应动力学的影响,φ准数的概念。
10. 酶的失活动力学。
难点:1. 采用稳态法和快速平衡法建立酶促反应动力学方程。
2. 固定化对酶促反应的影响,五大效应(分子构象的改变、位阻效应、微扰效应、分配效应及扩散效应)的区分。
3. 内扩散过程分析,涉及到对微元单位进行物料衡算和二阶微分方程的求解、无因次变换、解析解与数值解等问题。
4.温度对酶促反应速率和酶的失活速率的双重影响,最适温度的概念。
温度和时间对酶失活的影响。
本章主要教学要求:1. 掌握稳态法和快速平衡法推导酶促反应动力学方程。
2. 了解酶的固定化方法。
理解固定化对酶促反应速率的影响。
掌握Da 准数的概念及φ准数的概念,理解外扩散和内扩散对酶促反应速率的影响。
3. 了解酶的一步失活模型与多步失活模型,反应过程中底物对酶稳定性的影响。
第2章酶促反应动力学

酶应用的特点
1) 酶的稳定性及应用特点 2) 酶是以活力、而不是以质量购销的 3) 酶有不同的质量等级:
工业用酶 食品用酶 医药用酶 …… 实际应用酶时应注意,没有必要使用比工艺条件所需 纯度更高的酶。
酶应用的特点
酶应用的特点
酶应用的特点
酶应用的特点
• 经典酶学研究中,酶活力的测定是在反应的初始短时间内 进行的,并且酶浓度、底物浓度较低,且为水溶液,酶学 研究的目的是探讨酶促反应的机制。
酶的分类
• 例如:
编号EC1.1.1.1(已醇脱氢酶)
第一大 类(氧 化还原 酶)
第一亚 类(氧 化基团 是CHO
H)
第一亚
亚类 (NAD 为H的 受体)
在此亚 亚类中 的顺序
号
酶的催化共性
1)降低反应的活化能 如过氧化氢的分解,无催化剂时反应 活化能为75.31kJ/mol,加入过氧化氢酶后,过氧化氢分 解反应的活化能为8.37kJ/mol;
酶的分类
• 国际生物化学联合会(International Union of Biochemistry IUB)国际酶学委员会(Enzyme Commission, EC)于1961年 提出的酶的分类与命名方案的规定,按照酶进行催化反应 的类型,可将酶分为六类: 1)氧化还原酶类(oxidoreductases) 2)转移酶类(transferases) 3)水解酶类(hydrolases) 4)裂合酶(lyases) 5)异构酶(isomerases) 6)连接(或合成)酶(ligase, synthetases)
2)加快反应速率 一般非酶催化反应速率太低,不易观察, 酶催化反应速率和在相同pH值与温度下非酶催化反应速 率可直接比较的例子很少。已知己糖激酶可加快反应速率, 大于1010倍;乙醇脱氢酶大于2×108倍。
酶促反应动力学2讲课文档

第18页,共82页。
k2>>k3时
k2 + k3 Km=
k1
Km≈k2(分离能力)/k1(亲合能力)
k1
k3
E+S
ES
P+E
k2
Km越小,亲和力越强。
[S]很小时,反应速度就能达到很大。性能 优,代谢中这类酶更为重要
第19页,共82页。
③根据Km:
判断某[s]时v与Vmax的关系 判断抑制剂的类型
+ HX
RO
O—E
磷酰化酶(失活) 酸
解毒 -- -- -- 解磷定(PAM):
RO O
P RO
+ O—E
+
N
-CHNOH
磷酰化酶(失活) CH3 解磷定
O P
+ -CHNO N
CH3
OR OR +E—OH
第47页,共82页。
④有机汞、有机砷化合物
——与酶分子中-SH作用; 可通过加入过量巯基化合物解除。
如肌酸激酶使肌酸磷酸化的反应
第35页,共82页。
(2)乒乓反应或双-置换反应
A AE E
Q EQ
PE’ P E’
EB B
A和Q竞争自由酶E形式 B和P竞争修饰酶形式E’ A和Q不同E’结合 B和P也不与E结合。
第36页,共82页。
三、酶的抑制作用
失活作用:使酶Pr变性而引起酶活力丧失。 抑制作用:使酶活力下降但不引起变性。 抑制剂:能引起抑制作用的物质。
(3) kcat/km的意义:
Vmax[S] V=
Km + [S]
∵Vmax=kcat[Et] ∴
07-酶促反应动力学

17
(二)、可逆抑制和不可逆 抑制的动力学鉴别
加入一定量的抑制剂,以V~[E]作图
不可逆抑制剂:部分酶失活 原点右移, 斜率不变 当[E] > 不可逆抑制剂浓度 时能显现出酶的活性
可逆抑制剂:原点不变, 斜率下降
18
(三)、可逆抑制作用的动力学
1.竞争性抑制
底物、抑制剂和酶之间有如下平衡
S + E + I
ki2 ki1
k1 k2 k3
ES
P + E
k2 Km k1
ki 2 Ki ki1
EI Ki:抑制常数(inhibitor constant)
19
(三)、可逆抑制作用的动力学
溶液平衡时 [E] = [Ef ] + [ES] + [EI]
Arg127,Glu270,Tyr248,Zn2+
37
Ser48,His51,NAD+, Zn2+
4、活性中心位于酶表面的一个裂缝内
疏水微环境 使底物分子有效浓度很高 个别极性残基有利于催化作用
5、底物与酶通过弱相互作用结合
稳定酶与底物的结合
6、具有柔性
酶的活性中心易受影响
酶活性
一级序列决定三维结构 氨基酸残基提供了结构基础
Vmax [ S ] V Km [S ]
[S ] Km [S ] [S ] Km V Vmax Vmax Vmax Vmax
纵轴截距: Km/Vmax , 斜率: 1/ Vmax, 横轴截距: -Km
13
二、酶的抑制作用
能引起蛋白质失活的条件都影响酶的活力, 引致酶活性丧失的作用称为失活作用 抑制作用(inhibition): 引起酶活力降低或丧失的现象 抑制剂(inhibitor): 使酶发生抑制作用的物质
湖南农业大学生物化学04-酶学-02酶促反应动力学

(一)基本概念
失活(Inactivation) 使酶蛋白变性而引起酶活 力的丧失 变性剂 无 抑制(Inhibition) 酶的必需基团化学性质发 生改变,但酶没有变性,而导 致的酶活性的降低甚至丧失 有 选择性 抑制剂
抑制程度的表示方法: 不加抑制剂时的反应速率为v0,加抑制剂后的速率为vi 相对(残余)活力分数(a) 抑制分数(i) 指被抑制而失去活力的分数 a = vi / v0 i = 1 - a = 1 - vi / v0
二、底物浓度对酶反应速率的影响
(一)中间络合物学说
⊙
(二)酶促反应动力学方程式
⊙
Back
(一)中间络合物学说
1903年,Henri和Wurtz提出“酶底物中间络合物学说” 亦称 “中间产物学说”
E
+
S
k1 k2
ES
k3ELeabharlann +Pv Vmax
Henri用蔗糖酶水解蔗糖,得到双曲线
零级反应 混合级反应 一级反应 [S]
0.5 / 60 = K = 1/ 92000
766.7 S-1 Back
3、米氏常数的测定
基本原则:将米氏方程变化成相当于 y=ax+b的直线 方程,再用作图法求出Km。 双倒数作图法(Lineweaver-Burk法) 米氏方程的双倒数形式:
1 Km 1 1 — = —— . — + —— v Vmax [S] Vmax
不加抑制剂时的反应速率为v0加抑制剂后的速率为vi相对残余活力分数a抑制分数i指被抑制而失去活力的分数aviv0i1a1viv0二抑制作用的类型非专一性不可逆抑制作用irreversible酶的抑制作用专一性竞争性抑制competitive可逆抑制作用reversible非竞争性抑制noncompetitive反竞争性抑制uncompetitiveback可逆与不可逆抑制抑制剂与酶以非共价键结合而引起酶活力降低或丧失能用物理方法如透析超滤等除去抑制剂而使酶复活抑制作用是可逆的
大学生物化学课件 酶促反应动力学

当底物浓度很低时 [S] << Km,则
V≌Vmax[S]/Km ,反应速度 与底物浓度呈正比;
当底物浓度很高时, [S]>> Km ,此时 V≌Vmax ,反应速度达最大 速度,底物浓度再增高也 不影响反应速度。
KM的意义
• (1)当ν =Vmax/2时,Km=[S]。Km值等于酶促反应速率为最大速率一半时 的底物浓度 ,单位是mol/L。
出酶的转换数,即单位时间内每个酶分子催化底物转变为产物的分子数。
可逆性抑制的分类
• 竞争性抑制 • 非竞争性抑制 • 反竞争性抑制
竞争性抑制
1、抑制剂与底物结构类似,竞争酶的活性中心 2、抑制程度取决于抑制剂与酶的相对亲和力及[S] 3、动力学特点:VMAX不变,表观KM↑。
非竞争性抑制
• 1、抑制剂与酶活性中心外的必需基团结合 • 2、抑制程度取决于[I] • 3、动力学特点:VMAX↓,表观KM不变。
酶促反应动力学
(1)描述米氏方程、 Km ,VM含义及意义; (2)抑制作用的分类; (3)三种可逆性抑制剂对酶促反应动力学的影响(对KM、VM的影 响)
米氏方程
• 米氏方程(MICHAELIS-MENTEN系的速度方程。
• 方程式:
• VMAX:最大反应速率 • [S]:底物浓度 • KM:米氏常数 • V:在不同[S]时的反应速率
• (2)Km 值愈大,酶与底物的亲和力愈小;Km值愈小,酶与底物亲和力愈 大。
• (3)Km 值是酶的特征性常数,只与酶的性质,酶所催化的底物和酶促反 应条件(如温度、pH、有无抑制剂等)有关,与酶的浓度无关。酶的种类不 同,Km值不同,同一种酶与不同底物作用时,Km 值也不同。
VM
酶促反应动力学

米氏常数的应用
(1)鉴定酶:通过测定可以鉴别不同来源或相同来源但 在不同发育阶段、不同生理状态下催化相同反应的酶是 否属于同一种酶。 (2)判断酶的最佳底物:如果一种酶可作用于多个底 物,就有几个Km值,其中Km最小的底物就是酶的天然底 物。如蔗糖酶既水解蔗糖 (Km=28mmol/L),也可水解棉 子糖 (Km=350mmol/L),两者相比,蔗糖为该酶的天然底 物。 (3)计算一定反应速度下的底物浓度:如某一反应要 求的反应速度达到最大反应速度的99%,则[S]=99Km
(5)判断反应方向或趋势:催化正逆反应的酶,其正逆 两向的反应的Km不同。如果正逆反应的底物浓度相当,则 反应趋向于Km小方向进行。
第23页/共66页
4、Vmax
是酶完全被底物饱和时的反应速度,与酶浓度成正比 (Vmax=K3[E])。 不是特征性常数,与具体底物有关,且随着温度、pH和离子 强度而改变。
• 反应速率达到最大值, v与[S]无关,符合零级动 力学,只有在此条件下 才能正确测得酶活力。
第16页/共66页
km值的推导
•当
1 v= —2 Vmax 时, [S]=Km
• Km值就代表反应速 率达到最大反应速率 一半时的底物浓度 (mol/L或mmol/L)。
第17页/共66页
米氏常数的意义
反应式中,
第13页/共66页
第14页/共66页
米氏方程对酶促动力学曲线的解释
(1)当底物浓度很 低,[S]<<Km时, vmax[S]
• V = ———— km
=k[S] (米氏方程)
反应速率与底物 浓度成正比,v与 [S]的关系符合一 级动力学。
第15页/共66页
酶促反应二级动力学时,km和s的关系

酶促反应二级动力学时,km和s的关系1.引言在生物化学中,酶促反应是一种极为重要的反应类型。
而对于酶促反应的动力学研究,可以帮助我们更好地理解酶催化过程中底物浓度与反应速率之间的关系。
本文将以酶促反应二级动力学为出发点,探讨底物浓度(k m)与酶促反应速率(s)之间的关系,并讨论其相关理论和实验研究。
2.酶促反应二级动力学酶促反应的动力学研究主要包括一级动力学和二级动力学。
本文主要关注于二级动力学,其中底物浓度与酶促反应速率之间的关系十分重要。
在二级动力学中,酶底物复合物的形成速率与解离速率对反应速率的贡献都很重要。
3.底物浓度与酶促反应速率之间的关系底物浓度(k m)与酶促反应速率(s)之间的关系被称为米氏方程。
米氏方程是描述底物浓度与酶促反应速率之间关系的经典方程,其形式如下:s=Vm ax*[S]/(km+[S])其中,s表示反应速率,[S]表示底物浓度,Vm ax表示酶最大反应速率,km表示酶与底物结合形成酶底物复合物的平衡常数。
根据米氏方程,底物浓度在酶促反应速率中起到了重要作用。
当底物浓度越高时,酶促反应速率也越高。
然而,当底物浓度接近或超过酶的饱和浓度时,酶的最大反应速率(V ma x)将成为限制因素,酶促反应速率将达到平台。
4.实验研究和应用为了验证底物浓度(k m)与酶促反应速率(s)之间的关系,许多实验已经被设计和实施。
典型的实验是通过测量不同底物浓度下的酶促反应速率,然后利用米氏方程拟合实验数据,从而得到k m和Vm a x等动力学参数。
应用方面,底物浓度与酶促反应速率之间的关系在药物研发、酶工程、生物工业等领域都有重要应用。
通过调节底物浓度,可以优化酶的催化效率和反应速率,从而提高产量和纯度,降低生产成本。
5.结论酶促反应二级动力学中的底物浓度(k m)与酶促反应速率(s)之间存在着紧密的关系。
米氏方程提供了描述底物浓度与反应速率之间关系的数学模型,为实验研究和应用提供了重要的理论依据。
双底物酶促反应动力学机理

E+P E + SP
- dES dt
=
k2 ES
+ k3 ES
当进入稳态时:
d ES dt
=
-
d ES dt
即: k1 E S = k2 ES + k3 ES = ES k2 + k3
稳态理论下米氏方程的推导
又由酶的恒等式: E0 = E + ES
E = E0 - ES
- 则: k1 E0 ES S = ES k2 + k3
E
SP
中间产物假说证据
Michaelis 与 Menten 提出酶催化动力学
Michaelis
1913年
Menten
Nelson & Cox (2000) Lehninger Principles of Biochemistry (3e) p.258
二、米氏方程的导出
1、根据酶反应的中间复合物学说: 假定E+SES迅速建立平衡,底物浓度远远大于酶浓度下, K3<<K2即K3反应特别慢,可以忽略不计。
ab都达到饱和浓度时的最大反应速度五多底物的酶促反应动力学2序列机制的底物动力学方程bmasmaxkk????baakbkbavvbmam11111maxmaxmaxmaxbavkkvbvkavkvbmabmams????五多底物的酶促反应动力学六ph值对酶反应速度的影响七温度对酶促反应速度的影响八酶浓度对反应速度的影响九激活剂对酶活性的影响十抑制剂对酶活性的影响第四节酶促反应动力学二大多数酶的活性受ph影影响显著在某一ph下表现最大活力高于或低于此ph酶活力显著下降
根据正逆反应Km的差别及细胞内正逆两相底物的浓度推 测酶促反应的正逆方向。
第二章 酶促反应动力学习题答案

第三章 酶促反应动力学习题答案1. 答:酶促反应特征:(1)反应条件温和(常温);(2)高度的专一性;(3)反应效率高;(4) 反应过程易于控制。
三者主要区别:p262. 答:①Lineweaver-Burk 法:米氏方程可变形为以作图,将得一直线,直线截距为率为据此计算r max 和K m 。
此法由于采用两个独立变量物浓度很低时,反应速率也很低,取倒数,误差较大。
斜,底,②HanesWoolf 法:米氏方程可变形为作图,将得一直线,直线截距为,斜率为,据此计算r max 和K m 。
此法在底物浓度很低时误差较小。
③EadieHofstee 法:米氏方程可变形为将得一直线,直线截距为r max ,斜率为,据此计算r max 和K m 。
上述方法的共同点,是要从动力学实验中获取不同的C S 值和r 值。
而r 不能由试验直接取得,试验中能直接得到的是不同时间t 时的浓度C S 值(或C P 值)。
为此需要根据速率的定义式,在C S ~t 的关系曲线上求取相应各点切线的斜率,才能确定不同时间的反应速率r 。
这种求取动力学参数的方法又称之为微分法。
显然,用这种微分法作图求取反应速率会带来较大的误差。
④积分法米氏方程积分后可变形为作图,将得一直线,直线斜率为,截距为。
因此直接采用动力学实验中测得的时间t、底物浓度C S 数据作图,即可求取动力学参数值。
3.4.6.解:酶催化水解反应机制为采用稳态法推导反应动力学方程:7.答:(1)酶的稳定性受温度和时间的双重影响,其函数表达式为图2-11 清楚地表明了温度和时间对酶稳定性的双重影响。
在同一温度下,不同的保温时间残存酶活力有极大差异。
图(a)中不同温度下保温10min 后残余酶活力曲线只表明,在保温时间为10min时,酶在50°C 以下是稳定的,而并不能得出“酶在50°C 以下是稳定的”这一结论。
因为不同的保温时间必将对酶的稳定性产生影响。
第7章 酶促反应动力学

符合一级反应动力学,酶未被全部饱和,因此在[S]低时不能 正确测得酶活力; (2)当[S]>>Km时,v=Vmax,此条件下可正解测得酶活力 (3)当[S]=Km时,v=Vmax/2
Km的意义
1、Km是酶的特征物理常数 Km的大小只与酶的性质有关,而与酶浓度无关,但与底物、 温度、pH及离子强度有关。 2、Km可判断酶的专一性和天然底物 Km最小的底物称为该酶的最适底物或天然底物。1/km近似 表示酶与底物的亲和力。 3、当k3<<k2时,Km=k2/k1,Km=Ks(解离常数),严格 地说是1/Ks表示酶与底物的亲和力,当k3极小时,1/Km才 表示酶与底物的亲和力。
二、酶的抑制作用
➢ 酶的失活与抑制的区别 ➢ 酶抑制程度的表示方法 ➢ 酶抑制作用的类型 ➢ 可逆与不可逆抑制作用的鉴别 ➢ 可逆抑制作用动力学 ➢ 一些重要的抑制剂
(一)酶的失活与抑制的区别
凡是使酶蛋白质变性而引起酶活力丧失的作用称为失 活作用;由于酶必需基团化学性质的改变,但酶未变 性,而引起酶活力的降低或丧失而称为抑制作用。 变性剂对酶的变性作用无选择性 抑制剂对酶的抑制作用有选择性
特点:
A.抑制剂结构与底物的分子结构不相似。 B.抑制剂与酶活性中心外的必需基团结合。 C.抑制作用的强弱取决于[I],不能通过增加[S]减弱或解 除抑制。 D.Vmax降低,Km不变。
酶的可逆抑制作用——反竞争性抑制
酶只有与底物结合后才能与抑制剂结 合。L-Phe,L-Arg等对碱性磷酸酶的 作用是反竞争性抑制,肼类化合物抑 制胃蛋白酶、氰化物抑制芳香硫酸酯 酶的作用也属此类。
抑制剂只与酶—底物复合物结合生成抑制 剂—酶—底物死端复合物(ESI),从而抑 制酶的活性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
k1
k3
E+S
ES
k2
k4
E+P
当反应系统中ES的生成速率与降解速率相等时, 络合物ES的浓度保持不变,即达到稳定状态即:
d[ES]
dt = 0
医学ppt
7
9.1.2 米氏方程的推导
在反应初始阶段时,E+PES的速率极小,可以忽
略不计,E+SES, 于是ES的生成速率可表示为:
d[ES]
dt = k1([E]-[ES])[S]
丙酮酸羧化酶 丙酮酸
HCO3ATP
医学ppt
4.0 10-4 1.0 10-3 6.0 10-5
14
9.1.3 Km的意义
4、已知Km可求在某一底物浓度时的反应速率
如当[S]=4Km时,V=80%Vmax;
当[S]=10Km时,V=91%Vmax
5、Km可帮助推断某一代谢反应的方向和途径
乳酸脱氢酶
[S]
医学ppt21来自9.1.5 Km和Vmax的求法 直接线性作图法
医学ppt
22
例题
为了确定某酶的催化反应的初速度的底物依赖关系,制备 了一系列的l00ml含有不同底物浓度的反应混合物。向每 个混合物加入相同量的酶后便开始反应。通过测定每单位
时间(分钟)所形成的产物量而获得催化反应的初速度, 其结果如下表所示。
2、当[S]很大时,Vmax=k3[E], k3是一级反应速率常数; 因此k3表示当酶被底物饱和时每秒钟每个酶分子转换底 物的分子数,又称转换系数(TN)或催化常数(Kcat), Kcat越大,表示催化效率越高。
医学ppt
16
9.1.4 Vmax和K3的意义
3、生理条件下S << Km, Vmax = kcat [E] 代入米氏方程 v = kcat [E] [S] / Km + [S] = kcat [E] [S] / Km
(1)
通常[S]》[E],即[S]-[ES][S],ES分解速率与ES
S+E 和ESP+E 有关,于是ES的分解速率可表示为:
-
d[ES] dt
= k2[ES]+k3[ES]
医学ppt
(2)
8
9.1.2 米氏方程的推导
达到动态平衡时,ES生成与分解速率相等:
k1([E]-[ES])[S] = k2[ES]+k3[ES]
([E]-[ES])[S] =
k2 + k3
[ES]
k1
=Km
[E][S] [ES]= Km + [S]
医学ppt
(3)
9
9.1.2 米氏方程的推导
因为酶反应速率()与[ES]成正比,即
= k3 [ES]
代入方程(3)得:
[E][S] =k3[ES]=k3 Km + [S]
由于反应系统中[S]»[E],当酶全部被饱和形成ES时,[E]=[ES]
S + E Ks ES k P + E
= Vmax[S]
Ks +医学[pSpt ]
5
1925年,Briggs and Haldane提出了
稳态理论,对米氏方程做出了重要的修
正。
k1
E+S
ES
k2
(1)
k3
ES
k4
E+P
(2)
[ES]不仅与(1)有关,也与(2)有关。
医学ppt
6
9.1.2 米氏方程的推导
医学ppt
3
9.1.1 中间络合物学说
1903年Henri用蔗糖酶水解蔗糖实验研
究底物浓度与反应速率的关系。
C
B
为解释此现象,提出了中间络合物学说
A
S + E ES P + E
医学ppt
[S] 4
1913年,Michaelis and Menten根据 中间复合物学说提出米氏方程。
[S]>>[E], [ES]分解为产物的逆反应忽略不计
正确测得酶活力;
(2)当[S]>>Km时,v=Vmax,此条件下可正解测得酶活力
(3)当[S]=Km时,v=Vmax/2
医学ppt
12
9.1.3 Km的意义
1、Km是酶的特性常数
Km的大小只与酶的性质有关,而与酶浓度无关,但与底物、
温度、pH及离子强度有关。
2、Km可判断酶的专一性和天然底物
Km最小的底物称为该酶的最适底物或天然底物。1/km近似
得出:v = kcat / Km[E][S] kcat / Km为[E]和[S]反应形成产物的表观二级速度常数,单 位:L/mol s。 kcat / Km大小可以比较不同酶或同一种酶催化不同底物的催 化效率。
医学ppt
17
9.1.5 Km和Vmax的求法
Lineweaver-Burk双倒数作图法
表示酶与底物的亲和力。
3、当k3<<k2时,Km=k2/k1,Km=Ks(解离常数),严格地
说是1/Ks表示酶与底物的亲和力,当k3极小时,1/Km才表示
酶与底物的亲和力。
医学ppt
13
9.1.3 Km的意义
酶
底物
Km/moLL-1
谷氨酸脱氢酶 谷氨酸 -酮戊二酸 NAD+
NADH
1.2 10-4 2.0 10-3 2.5 10-5 1.8 10-5
第九章:酶促反应动力学
医学ppt
1
主要内容
底物浓度对酶促反应速率的影响
酶的抑制作用
温度对酶促反应的影响
pH对酶促反应的影响
激活剂对酶促反应的影响
医学ppt
2
9.1 底物浓度 对酶促反应速率的影响
S+E=P+E 酶促反应中,如果[S]大大过量, V与 [E]的关系如何? 实际情况下,[E]稳定,而[S]变化, V与[S]的关系如何?
酶促反应达到最大反应速率Vmax,即Vmax=k3[ES]=k3[E]
= Vmax[S]
Km医+学p[ptS]
10
9.1.2 米氏方程的推导
医学ppt
11
9.1.2 米氏方程的推导
根据米氏方程:
(1)当[S]<<Km时
Vmax[S]
v=
Km
= K [S]
符合一级反应动力学,酶未被全部饱和,因此在[S]低时不能
Eadie-Hofstee作图法
Hanes-Woolf作图法
Eisenthal & Cornish-Bowden
直接线性作图法
医学ppt
18
9.1.5 Km和Vmax的求法 双倒数作图法
0
医学ppt
19
9.1.5 Km和Vmax的求法 Eadie-Hofstee作图法
0
医学ppt
20
9.1.5 Km和Vmax的求法 Hanes-Woolf作图法
丙酮酸
乳酸
Km=1.7 10-5
丙酮酸
丙酮酸脱氢酶 乙酰辅酶A Km=1.3 10-3
丙酮酸
丙酮酸脱羧酶
医学ppt
乙醛
Km=1.0 1150-3
9.1.4 Vmax和K3的意义
1、在一定酶浓度下,酶对特定底物的Vmax也是一常数。 同一种酶对不同的底物的Vmax不一样,pH、温度和离 强度等也会影响Vmax的值。
