甲型肝炎病毒--IgM检测ELISA法作业指导书
甲肝的血清检测操作规程002

甲型肝炎病毒IgM抗体检测(HAV-IgM)操作规程文件号:WH-MY-002版本:第2版共: 3 页2009年3月1日起实施本规程每2年复审一次复审日期:2009年2月27日复审人:雷凤珠规程编写者:王莉红审批者:王金成批准日期:2009年2月28日检验科主任:雷凤珠1、检验目的:用于甲型肝炎的早期诊断。
2、检测原理:本试剂在微孔条上预包被羊抗人-IgM(u链),配以酶标抗原(HAV-HRP)及TMB显色剂等其他试剂,采用捕获法原理检测人血清(或血浆)中的甲肝IgM抗体(HAV-IgM)。
3、试剂和仪器:3.1试剂:北京万泰生物药业有限公司3.2试剂盒组成:3.3试剂稳定性:原装试剂在2-8℃避光保存,有效期6个月。
3.4仪器:3.4.1 YB-DX23D电动吸引器(上海医疗设备厂)3.4.2 TE-B型定时微量振荡器(江苏泰县)3.4.3 37℃孵箱(天津实验仪器厂)4、标本:4.1静脉抽取空腹患者标本3.0ml(真空采血管),将血液放置在37℃水浴箱中30分钟后,分离血清。
4.2样品收到后不要急于分离血清,以免血块收缩不良造成结果假阳性。
4.3溶血标本不能用于检测,因溶血可造成假阳性结果出现。
4.4用完的标本,应在样品管上注明日期,放置在2-8℃冰箱中保存一周。
4.5样品放置一周后,逐管加入1:50的84消毒液,并放置4小时后,装入医疗垃圾带由专人按医疗垃圾处理。
5、操作5.1操作步骤:5.1.1配液:将25ml浓缩洗涤液(20×)用蒸馏水或去离子水稀释至500ml备用。
5.1.2编号:将样品对应微孔按序号编号,每板应设阴、阳性对照各2孔和空白对照1孔(空白对照孔不加样品及酶标试剂,其余各步相同),5.1.3加样:分别在相应孔中加入待测样品或阴、阳性对照50ul。
5.1.4温育:置37℃温育20分钟。
5.1.5洗涤:将孔内液体用吸引器吸干,用洗涤液充分洗涤5遍,用吸引器吸干。
5.1.6加酶:每孔加入酶标试剂2滴(100ul),轻轻振荡混匀。
测定甲型肝炎IgM抗体的ELISA改良法

测定甲型肝炎IgM抗体的ELISA改良法
许执文;谢汝瑛
【期刊名称】《浙江省医学科学院学报》
【年(卷),期】1992(003)003
【总页数】2页(P37-38)
【作者】许执文;谢汝瑛
【作者单位】不详;不详
【正文语种】中文
【中图分类】R446.61
【相关文献】
1.捕获ELISA法测定抗EV71-IgM抗体用于EV71感染早期诊断 [J], 林裕龙;温坤;王压娣;晋晶;车小燕
2.甘露聚糖特异的IgG,IgM抗体的ELISA测定及应用 [J], 顾宁;王艾丽
3.Mac—ELISA法在测定脊髓灰质炎IgM抗体中的应用 [J], 高霞献;何亚玲
4.单克隆抗体ELISA法测定IgG、IgA、IgM的轻链比率 [J], 汪亚东;黄恺楦
5.ELISA测定乙型脑炎病毒特异性抗体IgM的临床意义 [J], 刘传道;唐孟光
因版权原因,仅展示原文概要,查看原文内容请购买。
甲肝抗体IGM的检测课件

ELISA类型
夹心法 间接法测抗体 竞争法 捕获法
捕获法测IgM抗体
血清中针对某些抗原 的特异性 IgM 常 和特异 性IgG同时存在,后者会 干扰IgM 抗体的测定 。 因此测定 IgM 抗 体多用 捕获法
➢ 包被抗体:用抗人μ链抗体包被固相载体上,形成固相抗 人μ链;
➢ 加入病人的血清标本; ➢ 加入特异性抗原试剂;, ➢ 加入针对特异性抗原的酶标抗体, ➢ 加底物显色.
抗HAV总抗体 抗HAV-IgM
临床意义
• 血清中抗HAVIgM出现于感染的早期(发病后数日)抗体的效价很快升 到峰值并持续较长时间(2-4周),经1-2个月后抗体的效价和阳性率明 显不降,于3个月后消失.因此抗HAVIgM阳性,尤其是效价较高时,表明 处于感染的早期,被公认为早期诊断甲肝的依据,是区别是急性感染 还是慢性感染的有力佐证。
甲型肝炎病毒IgM抗体的测定 (捕获法)
黄艳
酶联免疫吸附试验(ELISA法)
将抗体(抗原)包被在固相表面后,按不同的步骤加入 待测抗原(抗体)和酶标抗体(抗原),充分反应后用洗涤的方 法,使固相上形成的抗原抗体复合物与其他物质分离,洗 去游离的酶标抗体(抗原),最后加入底物,根据酶对底物 催化的显色反应程度,而对标本中的抗原(抗体)进行定性 或定量。
操作步骤
1.将微孔条固定在支架上,按顺序编号。 2.分别将待测标本,阴、阳性对照100μl(2滴)加入相应的 孔中,设空白对照孔。置37℃20分钟。 3.洗涤:甩去孔内液体,用洗涤液注满各孔,静置5秒,共 三次,每次洗后均需扣干。 4.每孔加HA·Ag50μl,酶结合物50μl(空白对照除外),振 荡混匀,置37℃20分钟。 5.洗涤:重复上述3 6.显色:每孔加显色剂A液50μl,再加显色剂B液50μl,振荡 混匀,置37℃15分钟。 7.每孔加终止液50μl
甲型肝炎病毒IgM抗体操作步骤

甲型肝炎病毒IgM抗体操作步骤1.检验目的:检测人血清或血浆中的抗HA V-IgM。
2.检测原理:本品系用抗人-IgM(u链)包被的微孔板,配以纯甲型肝炎抗原(HA V-Ag)和酶标记的甲型肝炎病毒抗体(抗HA V-HRP)及其它试剂,采用捕获法原理,检测人血清或血浆中的抗-HA V-IgM。
34.操作:4.1 配液:浓缩洗涤液配制前充分摇匀(如有结晶析出应充分溶解)浓缩洗涤液和蒸馏水或去离子水按1:19稀释后使用。
4.2 编号:将微孔条固定于支架,按序编号。
4.3 加样:待测样本用生理盐水作1:1000稀释,每个样本检测孔加入稀释样本100 uL。
设阴阳对照各1孔,每孔加入100 uL,并设空白对照1孔。
4.4 温育:置37℃温育20分钟,室温平衡2分钟。
4.5 洗涤:用洗涤液充分洗涤5次,洗涤完后扣干(每次应保持30-60秒的浸泡时间)。
4.6 加抗原、酶:每孔加入抗原(HA V-Ag)30 uL、酶标记抗体50uL(1滴),充分混匀。
4.7 温育:置37℃温育20分钟。
4.8 洗涤:用洗涤液充分洗涤5次,洗涤完后扣干(每次应保持30-60秒的浸泡时间)。
4.9 显色:每孔加底物A、B各50uL,轻拍混匀,置37℃暗置15分钟。
4.10 终止:每孔加终止液50uL,混匀。
4.11 测定:用酶标仪单波长450nm/630nm测定各孔OD值(用单波长测定需设定空白对照一孔,30分钟完成测定,并记录结果)。
5. 结果判定:5.1 临界值(C.O.)的计算:临界值=阴性对照孔OD均值N×2.1阴性对照OD值低于0.050←0.050计算,高于0.050按实际OD值计算。
5.2结果判定:样品OD值S/C.O.≥1者为HA V-IgM阳性样品OD值S/C.O.<1者为HA V-IgM阴性5.3 失效:如果阳性对照OD均值小于0.05,则表明不正常的操作或试剂盒已变质损坏。
在此情况下,应再次仔细阅读说明书,并用新的试剂盒重新测试。
甲型肝炎病毒IgM( HAvIgM )标准操作程序SOP文件

文件编号: ABCD-SOP-01-14AB C D 医院 免疫实验室[前言]这种抗体是感染甲肝病毒(HAV )后病人血中最早出现的一种抗体,属于HAV衣壳抗体。
[原理]Z 本试剂盒采用捕获法检测人血清或血浆中的甲肝IgM 抗体。
具有简便、快速、准确、样本不需稀释等优点,适用于甲型肝炎的早期诊断。
试剂自生产日起避光贮存于2-8℃,有效期内稳定。
[标本的收集与处理]标本为无溶血血清。
[操作步骤]1、加样:将包被板预先编号。
设空白对照1孔,阴、阳性对照各2孔。
力口阴、阳性对照血清各50ul 于相应孔内,其余各孔分别加入50ul 待测样本(不能稀释), 轻轻振荡后封板。
2、温育:置37℃水浴箱温育30分钟。
3、洗涤:扣去孔内液体,用洗涤液注满各孔,静置2分钟,扣去洗涤液,重复4次,最后一次在吸水纸上拍干。
4、加酶:除空白对照孔外,每孔加入HA.Ag50ul ,酶标记物溶液50ul,轻轻振荡后封板。
5、温育:置37℃水浴箱温育30分钟。
6、洗涤:同步骤3洗涤7、显色:每孔加底物液A 1滴(50ul ).底物液B1滴(50ul ),轻拍混匀后,置37℃水浴15分钟,目测结果或加入终止液1滴(50ul )用酶标仪判读。
[结果判定]1、目测法:在白色背景下观察各孔颜色,无色或极淡兰色判为阴性,呈明显 甲型肝炎病毒IgM ( HAvIgM ) 版序:abed 页码:第1页,共2页[试剂组成]1、包被板条2、阴性对照血清3、阳性对照血清4、醵标记物溶液5, HA. Ag[试剂厂家]深圳月亮湾生物工程有限公司[试剂的稳定性与贮存] 6、底物液A 7、底物液B 8、终止液 9、浓缩洗涤液 (用蒸储水1: 20稀释后使用)文件编号:ABCD-SOP-01-14 兰色判为阳性。
AB C D医院免疫实验室版序:abed甲型肝炎病毒IgM( HAvIgM ) 页码:第2页,共2页2、酶标仪检测法(选择波长450nm):用空白孔校零,测定各孔吸光度0D值。
人甲肝病毒IgG抗体(HAV-IgG)ELISA试剂盒使用说明书
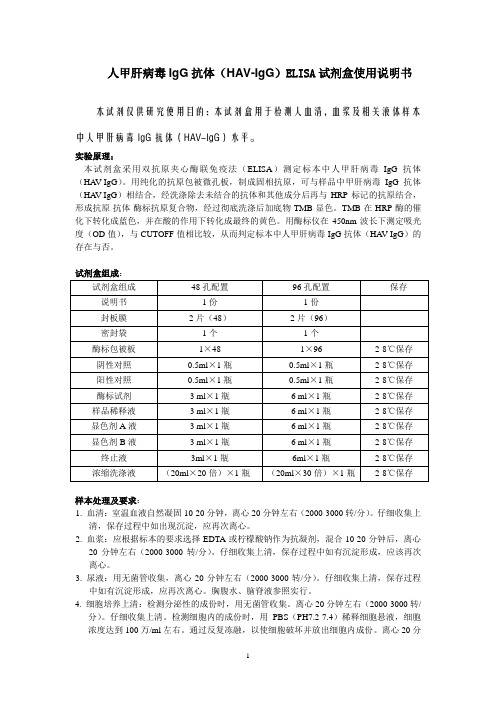
人甲肝病毒IgG抗体(HAV-IgG)ELISA试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于检测人血清,血浆及相关液体样本中人甲肝病毒IgG抗体(HAV-IgG)水平。
实验原理:本试剂盒采用双抗原夹心酶联免疫法(ELISA)测定标本中人甲肝病毒IgG抗体(HA V-IgG)。
用纯化的抗原包被微孔板,制成固相抗原,可与样品中甲肝病毒IgG抗体(HA V-IgG)相结合,经洗涤除去未结合的抗体和其他成分后再与HRP标记的抗原结合,形成抗原-抗体-酶标抗原复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
用酶标仪在450nm波长下测定吸光度(OD值),与CUTOFF值相比较,从而判定标本中人甲肝病毒IgG抗体(HA V-IgG)的存在与否。
试剂盒组成:样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
甲型肝炎病毒--IgM检测(ELISA法)作业指导书

甲型肝炎病毒--IgM检测(ELISA法)作业指导书1.原理本法是用抗人μ链捕获待测血清中特异性IgM,然后用HAV与特异性—IgM 抗体反应,再加酶标记抗M抗体,最后加底物显色。
2.标本采集2.1采集前病人准备:受检者应空腹。
2.2标本种类:血清或血浆。
2.3标本要求:采集病人静脉血2ml(可用EDTA抗凝),室温放置不超过4小时,分离血清备用。
3.标本储存:2-8°C保存不应超过1周,-20°C不应超过3个月,-70°C长期保存,应避免反复冻融。
4.标本运输:密封,室温运输。
5.标本拒收标准:污染、标本量不足、严重溶血或脂血标本不宜作此项检测。
6.试剂6.1 试剂名称:抗HAV—IgM检测ELISA试剂盒6.2 试剂生产厂家:xx技术研究所6.3 包装规格:48Test/Kit6.4 试剂盒组成:包被反应板,样品稀释液,酶标记抗体,阳性对照血清,阴性对照血清,浓缩洗涤液,底物A,底物B,终止液,封口膜,密封袋。
6.5 试剂储存条件及有效期:2-8°C避光保存,有效期6个月。
7.仪器设备7.1仪器名称:自动酶标仪7.2仪器厂家:Rayto7.3仪器型号:RT-2100C8操作步骤8.1平衡:将试剂盒各组分取出,平衡至室温(18-25°C),微孔板开封后,余者及时以自封袋封存。
8.2配液:浓缩洗涤液配制前充分摇匀(如有晶体应充分溶解),浓缩洗涤液和蒸馏水或去离子水按1:19稀释后使用。
8.3编号:将微孔条固定于支架,按序编号。
8.4加样品稀释液:用加样器在微孔反应条板孔中加入样品稀释液,每孔100μl,空下四孔准备加对照。
8.5加标本和留空白:将每份待检标本各5μl分别加入已有样品稀释液的各孔中,留下一孔不加标本作空白对照,标好位置。
8.6加对照:在预先空下的四孔中用加样器分别加入阴性对照一孔,阳性对照三孔,每孔100μl,标好位置。
对照应在所有标本加完以后再加,以保证阈值准确性。
免疫标准操作程序SOP

标准操作程序[目的]保证检测结果准确可靠。
[该SOP变动程序]本标准操作程序的变动,可由任一使用本SOP的工作人员提出,并报经专业主管、科主任批准签字。
[标本的采取和保存]采静脉血2ml,分离血清备用。
也可以使用血浆标本进行检测。
标本宜新鲜,无污染,避免溶血,避免反复冻融,不可用NaN3防腐。
[测定原理]采用兔抗-人IgMu链包被反应被,加入待测标本,同时加入HA V Ag,抗HA V-HRP,如待测标本中含有抗-HA V-IgM时,就能与包被兔抗-人IgMu链结合,并且与HA V Ag,抗-HA V-HRP 结合成复合物,加TMB底物产生显色反应,反之则无显色反应。
[操作步骤]1.将待测标本用生理盐水作(1:1000)稀释,每孔加入稀释标本100ul,设阴、阳性对照各2空,每孔加入阴性对照(或阳性对照)100ul(或2滴),并设空白对照一孔,封板,置37度孵育20分钟。
2.洗板机洗板:选择洗涤5次程序洗板后拍干。
手工洗板:弃去孔内液体,洗涤液注满各空,静置5秒,甩干,重复三次后拍干。
3.每孔加入HA V Ag30ul(或一滴),酶结合物50ul(或一滴),(空白对照孔不加),充分混匀,封板,置37度孵育20分钟。
4.洗板机洗板:选择洗涤5次程序洗板后拍干。
手工洗板:弃去孔内液体,洗涤液注满各空,静置5秒,甩干,重复三次后拍干。
5.每孔加显色剂A液、B液各50ul(或一滴),充分混匀,封板,置37度孵育10分钟。
6.每孔加入终止液50ul(或一滴),混匀。
7.用酶标仪读数,取波长450nm(建议使用双波长的酶标仪比色,参考波长630nm),先用空白孔校零,然后读取各孔OD值。
[结果判断]样品OD值除以阴性对照平均OD值大于或等于2.1判断为阳性,否则为阴性阴性对照OD值低于0.05作0.05计算,高于0.05按实际OD值计算[临床意义]血清中HA V—IgM在亚临床期即已出现,其滴度在感染后3个月维持在1000以上,早被公认为早期诊断甲型肝炎的依据。
甲肝M型抗体检测作业指导书

μ-捕捉法:反应时间:18分钟.
第一步孵育:自动吸取10 μ l经过通用稀释液作1:400稀释的样本,用抗-Fdγ试剂遮蔽用钌复合物标记的单克隆Anti-HAV中的IgG进行前处理。
第二步孵育:加入生物素标记的单克隆人IgM特异抗体、HAV抗原、链霉亲和素包被的磁珠后,样本中的Anti-HAV-IgM与HAV抗原和钌标记的Anti-HAV抗体形成双抗体夹心复合物,通过链霉亲和素与生物素的特异结合使复合物结合在固相载体上。
R2:生物素化的抗-人-IgM抗体;HAV抗原(黑盖),1瓶,10ml:生物素化的抗-人-IgM 单克隆抗体(鼠)0.4μg/l;HAV抗原(细胞培养)25U/ml;HEPES缓冲液50mmol/l,pH7.2,含防腐剂。
校准品:·Cal 1 阴性定标液1(白盖),2瓶,0.67ml/瓶,人血清, 抗HAV-IgM 阴性,含防腐剂。
· 同一批号试剂一个月后(28天)
· 7天后(放置仪器上的同一试剂盒)
· 根据要求进行标定:如质控结果超出范围时
· 根据规定进行多次标定。
定标确认:
不需要。分析仪的软件会自动检查定标曲线的有效性及偏离。
5.操作方法
按仪器操作说明进行操作。检查试剂与消耗品是否充足。
使用前需混匀微粒。仪器通过扫描试剂盒条形码自动输入测试所需的特异性参数,不需手工输入。如果特殊情况下仪器无法阅读条形码,可以手工输入15位数字。
不要加热灭活标本。标本和质控品禁用叠氮钠作稳定剂。确保病人样本、定标物、质控物在测试前温度达到20-25℃.
因为可能挥发的Biblioteka 响,放在分析仪上的样本、定标物、质控物应在两小时内测试完。
3.试剂、校准品、质控品和其他所需材料
采用罗氏原装配套试剂。
人甲肝病毒igg抗体(havigg)elisa试剂盒使用说明书
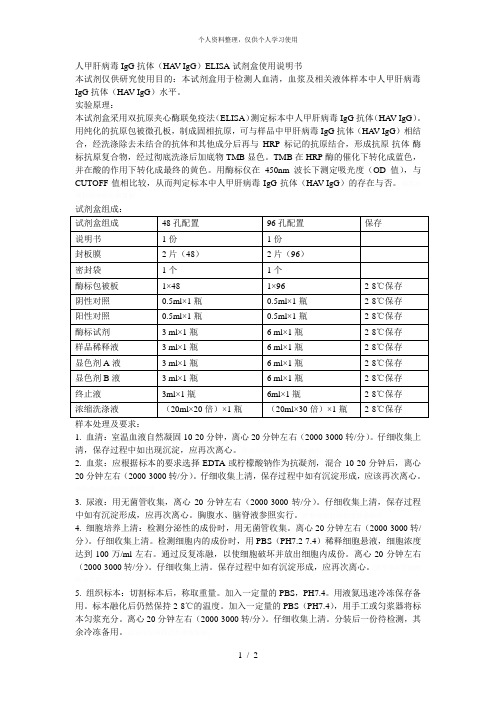
人甲肝病毒IgG抗体(HA V-IgG)ELISA试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于检测人血清,血浆及相关液体样本中人甲肝病毒IgG抗体(HA V-IgG)水平。
实验原理:本试剂盒采用双抗原夹心酶联免疫法(ELISA)测定标本中人甲肝病毒IgG抗体(HA V-IgG)。
用纯化的抗原包被微孔板,制成固相抗原,可与样品中甲肝病毒IgG抗体(HA V-IgG)相结合,经洗涤除去未结合的抗体和其他成分后再与HRP标记的抗原结合,形成抗原-抗体-酶标抗原复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
用酶标仪在450nm波长下测定吸光度(OD值),与CUTOFF值相比较,从而判定标本中人甲肝病毒IgG抗体(HA V-IgG)的存在与否。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
免疫球蛋白检测作业指导书

免疫球蛋白(IgG、IgA、IgM)检测作业指导书1 检验目的规范免疫球蛋白(IgG、IgA、IgM)检测试验,确保检测结果准确性和重复性。
2 测定方法免疫透射比浊法。
3 检测原理样品中的免疫球蛋白(IgG、IgA、IgM)抗原分别与试剂中的IgG、IgA、IgM抗体发生免疫反应,生成免疫复合物,形成一定浊度,其浊度与免疫球蛋白的含量成正比。
与通过同样处理的校准液比较,即可计算出样品中免疫球蛋白(IgG、IgA、IgM)的含量。
4 样本血清处理方法见生化标本采集程序。
稳定性:2~8℃稳定4天。
5 仪器和试剂5.1 仪器:美国贝克曼-库尔特DXC800全自动生化仪。
5.2 试剂:由武汉元景商贸公司提供原装贝克曼-库尔特试剂(详见试剂说明书),超过失效期的试剂不能使用。
5.3 校准物:Rodan混合校准品,符合WHO标准,贮存、准备严格遵照其说明书。
5.4 质控物:Rodan正常值及病理值质控品,符合WHO 标准,贮存、准备严格遵照说明书。
6 校准6.1 仪器校准:每年由该仪器维修工程师参照厂方的技术规范对仪器进行一次校准。
6.2 项目校准:试剂盒在仪器上放置稳定期后;试剂批号更换后;由质控结果随时决定。
7 操作步骤上机操作,操作程序、质量控制程序见相应生化仪操作程序。
8 参考范围IgG: 7~16.5g/L,IgA: 0.59~3.5g/L,IgM: 0.48~2.12g/L。
9 警告/危急值未规定。
10 性能指标10.1 线形上限:IgG ≤32g/L,IgA ≤7 g/L,IgM≤24g/L。
10.2 精密度:批内CV ≤4%,批间CV≤8%。
10.3 准确度:不准确度≤8%。
10.4试剂贮存:试剂密闭避光贮存2~8℃可稳定12个月。
11 干扰因素及变异的潜在来源标本出现溶血对测定结果有一定影响。
12 临床意义12.1 免疫球蛋白增高:12.1.1 各种感染,特别是慢性细菌感染如骨髓炎、慢性肺脓肿等,血Ig可升高。
检验科操作规程

检验科操作规程血常规(Sysmex KX-21血液分析仪)操作规程:1.准备稀释液:加样器取稀释液500微升加入一次性塑料试管中备用。
2.采血:75%乙醇棉球消毒患者左手中指或无名指皮肤待干后,一次性无菌采血针采血,干棉球拭去第一滴血后按要求依次采血,推血片,采血完毕后用干棉球压迫伤口止血。
3.稀释标本和全血标本室温放置3~5分钟。
4.将标本混匀,插入仪器吸样管中,按start键检测开始。
5.打印结果,异常结果应进行手工分片。
6.登记:项目齐全、及时、准确。
7.每周六下午仪器进行周保养并记录。
尿常规操作规程:1.一次性尿杯留尿。
2.尿试纸浸湿,卫生纸吸取多余尿液。
将尿试纸放在测试仪上,按start键测试开始并打印结果。
3.涂片:塑料吸管吸取少许尿液后涂片镜检并报告结果。
异常标本离心后镜检。
4.登记:准确及时项目齐全。
5.每天下班时将载物台取下清洗,擦干放回原处。
血流变操作规程:1.打开普利生自清洗旋转式粘度计机器,待温度上升至370C,打开主机,进入血流变操作程序,并等待操作。
2.静脉采血5ml加入肝素抗凝管内,充分混匀。
3.将抗凝血注入温氏管至10刻度,1小时后报告血沉数,然后以3000r/min离心20分钟,报告红细胞压积数值。
4.吸取800微升抗凝血,加入普利生自清洗旋转式粘度锥板内,按下全血实验(F5)键,测出高切、中切、低切的数值。
5.将抗凝血离心5分钟,吸取800微升血浆加入普利生自清洗旋转式粘度剂锥板内,按下血浆实验(F6)键,测出血浆粘度数值。
6.打印报告。
7.冲洗机器5遍,烘干关机。
病区化验室血常规(Sysmex-21)操作规程:1.准备稀释液,将稀释液用加样器取500微升加入一次性塑料试管中,备用。
2.采血:采病人中指或无名指,酒精消毒后用一次性采血针采血,拭去第一滴血后取20微升,完毕干棉球止血。
3.检测:室温放置3~5分钟后混匀,上机检测。
4.登记:出结果后登记病人姓名、年龄、性别、科别及结果的记录。
免疫标准操作程序SOP

标准操作程序保证检测结果准确可靠。
[该SOP变动程序]本标准操作程序的变动,可由任一使用本SOP的工作人员提出,并报经专业主管、科主任批准签字。
[标本的采取和保存]采静脉血2ml,分离血清备用。
也可以使用血浆标本进行检测。
标本宜新鲜,无污染,避免溶血,避免反复冻融,不可用NaN3防腐。
[测定原理]采用兔抗-人IgMu链包被反应被,加入待测标本,同时加入HAVAg,抗HAV-HRP,如待测标本中含有抗-HAV-IgM时,就能与包被兔抗-人IgMu链结合,并且与HAVAg,抗-HAV-HRP结合成复合物,加TMB底物产生显色反应,反之则无显色反应。
[操作步骤]1.将待测标本用生理盐水作(1:1000)稀释,每孔加入稀释标本100ul,设阴、阳性对照各2空,每孔加入阴性对照(或阳性对照)100ul(或2滴),并设空白对照一孔,封板,置37度孵育20分钟。
2.洗板机洗板:选择洗涤5次程序洗板后拍干。
手工洗板:弃去孔内液体,洗涤液注满各空,静置5秒,甩干,重复三次后拍干。
3.每孔加入HAVAg30ul(或一滴),酶结合物50ul(或一滴),(空白对照孔不加),充分混匀,封板,置37度孵育20分钟。
4.洗板机洗板:选择洗涤5次程序洗板后拍干。
手工洗板:弃去孔内液体,洗涤液注满各空,静置5秒,甩干,重复三次后拍干。
5.每孔加显色剂A液、B液各50ul(或一滴),充分混匀,封板,置37度孵育10分钟。
6.每孔加入终止液50ul(或一滴),混匀。
7.用酶标仪读数,取波长450nm(建议使用双波长的酶标仪比色,参考波长630nm),先用空白孔校零,然后读取各孔OD值。
[结果判断]样品OD值除以阴性对照平均OD值大于或等于2.1判断为阳性,否则为阴性阴性对照OD值低于0.05作0.05计算,高于0.05按实际OD值计算[临床意义]血清中HAV—IgM在亚临床期即已出现,其滴度在感染后3个月维持在1000以上,早被公认为早期诊断甲型肝炎的依据。
甲肝抗体IgM检测的标准操作程序

甲肝抗体IgM检测的标准操作程序【目的】保证检测结果准确可靠。
【该SOP变动程序】本标准操作程序的变动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、科主任。
【标本的采取和保存】随机静脉血2ml,分离血清备用。
也可使用血浆标本进行检测。
标本宜新鲜,无污染,避免无溶血,避免反复冻融,不可用NaN3防腐。
标本中含EDTA、柠檬酸钠、肝素钠等抗凝剂时,不影响结果,但是乳糜血、高溶血或高蛋白血标本可能会导致错误结果。
不要使用热灭活后标本,加热灭活将使样本中IgM抗体降解。
【实验原理】本试剂盒采用捕获方法原理检测血清或血浆样品中戊型肝炎病毒IgM抗体(HEV-IgM),微孔中预包被鼠抗人-IgM (链),加入待检人的血清或血浆后,所有的IgM 抗体都被捕获,未结合的其他成分(包括特异的IgG抗体)将被洗涤除去。
第二步,加入酶标记物,酶标记物的辣根过氧化物酶(HRP)标记的基因重组抗原HEV NE2.特异性的HEV-IgM会与辣根过氧化物酶标记的HEV重组抗原结合,洗去其他未结合物。
最后用TBA底物显色,通过酶标仪检测吸光度(OD值)从而判定样品中HEV-IgM抗体的存在与否。
【操作程序】1、实验准备:从冷藏环境中取出试剂盒,在室温下平衡30分钟,同时将浓缩洗涤液用蒸馏水或去离子水作1: 20稀释。
2、编号:三个阴性对照孔、两个阳性对照孔、一个空白孔,按照标本数量选择板条。
3、稀释:用移液器每孔加入1 I样品稀释液。
4、加待测标本:加入待测标本每孔10或阴、阳对照10 I,轻轻振荡混匀。
5、温育:用封板膜封板后置37C温育30分钟。
6、洗涤:温育后,将封膜板揭掉,吸干孔内液体,用洗涤液洗涤五遍,每次浸泡30—60秒。
(可手工洗板也可用洗板机洗板)7、加酶结合物:每孔0. 1毫升,空白对照孔不加,充分混匀,置37C孵育30分钟。
8、洗板:1)手工洗板:弃去反应板条孔内液体拍干;用洗涤液注满每孔,静置5-10秒,弃去孔内洗涤液拍干,如此反复5次,拍干。
甲型肝炎IgM定性检测作业指导书

甲型肝炎IgM定性检测作业指导书1.检验目的血清抗HAV抗体IgM是HAV急性感染的标志,在感染的早期即已出现,是早期诊断甲型肝炎的依据。
感染后3个月内可维持较高滴度,6个月后逐渐消失。
2.方法原理采用ELISA架桥法,反应板的琼脂微孔包被兔抗人-IgMμ链,加入待测样本,同时加入HAVAg、抗-HAV-HRP,当样本中有抗-HAV-IgM时,会与包被在板上的兔抗人-IgMμ链结合,并被HAVAg 捕获、再与抗-HAV-HRP联接成复合物,加入底物TMB产生显色反应,反之则无显色反应。
3.性能指标此方法快速简便、特异性强、检测灵敏度度0.5ng/ml。
4.标本收集4.1 标本类型:静脉血或动脉血的血清或血浆标本均可作为检测标本(抗凝剂可用肝素钠、枸橼酸钠、ACD、CPDA-1或EDTA,抗凝剂的质量应符合化试药品要求——化学纯或分析纯,使用的比例以厂家推荐为准);其他体液如尿液、唾液、精液、羊水、胸水、腹水、乳汁等体液可以作为检测标本,但加热灭活的血清和血库的库存血则不宜作为检测标本。
4.2标本留取:以空腹为宜,收到标本后最好立即离心留取血清或血浆(凝固血应待其充分凝固后收集血清),不能有残留的红细胞、纤维蛋白丝,使用肝素治疗的病人宜在肝素治疗前抽血。
4.3 标本保存:留取的标本最好在3小时内检测,不能立即检测的应放置于2-8℃最长达14天(可以含有凝块但要密闭以防蒸发),或者-10℃最长达14天(不能反复冻融也不能含有凝块和红细胞)。
4.4标本容器:盛放标本的容器必须为洁净的一次性真空采血管、玻璃试管、一次性的不同规格的塑料离心管4.5标本外送:如涉及到需要外送的标本,必须以规定的容器(0.5ml塑料离心管)存放并密封,并根据邮寄规则和要求进行包装,运送时还要放入冰袋(2-8℃)或干冰(-10℃)由专人运送至指定地点指定接收人。
4.6拒收标本:凡与4.1-4.5所述内容不符的标本,检验人员应向临床或就诊者说明拒收标本的原因,并提出解决的方案或建议。
甲型肝炎病毒IgM抗体检测SOP北京现代

甲型肝炎病毒IgM抗体检测试(北京现代)一、检验目的规范实验室人员操作,保证检验结果的准确性二、预期用途本试剂盒适用于体外定性检测人血清或血浆样本中甲型肝炎病毒的特异性IgM抗体。
人群未注射甲肝疫苗者对HAV普遍易感,在我国,15岁以下的儿童及青少年最容易患甲型肝炎,而患过甲型肝炎或感染过甲型肝炎病毒的人可以获得持久的免疫力。
甲型肝炎的潜伏期为15-45天,主要表现为急性肝炎,仅少数表现为急性甲型肝炎而出现发热、畏寒、食欲下降、乏力、肝肿大及肝功能异常等症状。
特异性血清学检测抗HAV-IgM抗体是早期确诊甲型肝炎的重要指标。
三、检验原理本试剂盒利用免疫层析作用原理,在硝酸纤维素膜的检测线处包被鼠抗人IgM单克隆抗体,在质控线处包被兔抗HAV抗体,在金标垫上固定胶体金标记细胞培养的纯化甲肝病毒抗原(HAV-Ag)".检测时,如为阳性样本,样本中的抗HAV-igM抗体可与金标垫上的胶体金标记的HAV-Ag发生结合,形成免疫复合物,并在层析作用下沿膜移动,经过检测线时与预包被的鼠抗人IgM单克隆抗体发生结合而凝聚显色,游离的胶体金标记HAV-Ag在质控线处与兔抗HAV抗体发生结合而凝聚显色。
如为阴性样本,则只在质控线处发生结合而凝聚显色。
四、主要组成成分1、检测卡/条主要组分a、硝酸纤维素膜( NC膜)b、金标垫c、鼠抗人IgM单克隆抗体d、细胞培养的纯化甲肝病毒抗原(HAV-Ag)e、兔抗HAV抗体2,样本稀释液:1瓶,主要组分为0.05M PBS缓冲液(pH 7.4).五、储存条件及有效期4~30℃避光密封干燥保存,有效期为12个月。
生产日期及失效日期详见标签。
检测卡/条开封后,相对湿度低于40%时,需在60分钟内检测;相对湿度高于40%时,开封即用。
六、样本要求样本应为血清或者血浆。
血清样本按常规方法由静脉采集制作。
适用于本试剂盒检测的血浆样本需采用肝素、枸橼酸钠或EDTA进行处理。
5天内检测的样本可放置4℃保存,5天后检测的样本需放置在-20℃以下冷冻保存。
ISO15189质量管理体系检验科全套SOP文件4免疫室作业指导书

ISO15189质量管理体系范本文件(第四册)免疫室作业指导书文件编号:ABCD-3-MY-01~52第A版编制:审核:批准:生效日期:2006年8月8日ABCD人民医院检验科目录修订页血清乙型肝炎病毒表面抗原检测(ELISA)1.原理在微孔条上预包被被纯化乙肝表面抗体,配以酶标记抗体(HBsAb-HRP)及TMB等其它试剂,采用夹心法原理检测人血清(或血浆)中乙肝表面抗(HBsAg)。
2.标本采集2.1 采集前病人准备:受检者应空腹2.2 标本种类:血清或血浆2.3 标本要求:采集病人静脉血3ml(可用EDTA抗凝),室温放置不超过4小时,分离血清备用。
3.标本储存:2-8℃保存不应超过1周,-20℃不应超过3个月,-70℃长期保存,应避免反复冻融。
4.标本运输:密封,室温运输。
5.标本拒收标准:污染、标本量不足、严重溶血或脂血标本不宜作此项检测。
6.试剂6.1试剂名称:乙型肝炎病毒表面抗原诊断试剂盒6.2试剂生产厂家:英科新创(厦门)科技有限公司。
6.3包装规格:96Test/Kit6.4试剂盒组成:HBsAg微孔板,HBsAg酶标记抗体,HBsAg阳性对照血清,HBsAg阴性对照血清,浓缩洗涤液,底物A,底物B,终止液,封口膜,自封袋。
6.5试剂储存条件及有效期:2-8℃避光保存,有效期9个月。
7.仪器设备7.1仪器名称:自动酶标仪7.2仪器厂家:Rayto7.3仪器型号:RT-21008.操作步骤8.1平衡:将试剂盒各组分取出,平衡至室温(18-25℃),微孔板开封后,余者及时以自封袋封存。
8.2配液:浓缩洗涤液配制前充分摇匀(如有晶体应充分溶解),浓缩洗涤液和蒸馏水或去离子水按1:19稀释后使用。
8.3编号:将微孔条固定于支架,按序编号。
8.4加样:分别用加样器在对照孔中加入阴、阳性对照血清各50μl于相应孔中。
8.5加酶:分别在每孔中加入酶标记抗体50μl,轻拍混匀。
8.6温育:置37℃温育60分钟,室温平衡5分钟。
HAVIgMELISAKit:甲型肝炎病毒IgM抗体ELISA试剂盒

HAV IgM ELISA KitEnzyme-linked immunosorbent assay for the detection IgM antibody against HAV serum or plasmaINTENDED USEEnzyme ImmunoAssay (ELISA) for the determination of IgM class antibodies to Hepatitis A Virus in human plasma and sera with the "capture" system. The kit may be used for the identification of the viral agent causing hepatitis in the patient and the follow up of the acute phase of the infection.SUMMARY AND PRINCIPLE OF THE TESTHepatitis A continues to be one of the most frequently reported vaccine-preventable diseases in the world, despite the licensure of hepatitis A vaccine in 1995. Widespread vaccination of appropriate susceptible populations would substantially lower disease incidence and potentially eliminate indigenous transmission of hepatitis A virus (HAV) infection. HAV, a 27-nm RNA agent classified as a picornavirus, can produce either asymptomatic or symptomatic infection in humans after an average incubation period of 28 days (range, 15-50 days). The illness caused by HAV infection typically has an abrupt onset ofsymptoms that can include fever, malaise, anorexia, nausea, abdominal discomfort, dark urine, and jaundice. The likelihood of having symptoms with HAV infection is related to the person's age. In children less than 6 years of age, most (70%) infections are asymptomatic; if illness does occur, it is not usually accompanied by jaundice. Among older children and adults, infection is usually symptomatic, with jaundice occurring in greater than 70% of patients. Signs and symptoms usually last less than 2 months, although 10%-15% of symptomatic persons have prolonged or relapsing disease lasting up to 6 months. In infected persons, HAV replicates in the liver, is excreted in bile, and is shed in the stool. Peak infectivity of infected persons occurs during the 2-week period before onset of jaundice or elevation of liver enzymes, when the concentration of virus in stool is highest. The concentration of virus in stool declines after jaundice appears. Children and infants can shed HAV for longer periods than adults, up to several months after the onset of clinical illness. Chronic shedding of HAV in feces does not occur; however, shedding can occur in persons who have relapsing illness. Viremia occurs soon after infection and persists through the period of liver enzymeelevation. Hepatitis A cannot be differentiated from other types of viral hepatitis on the basis of clinical or epidemiologic features alone. Serologic testing to detect immunoglobulin M (IgM) antibody to the capsid proteins of HAV (IgM anti-HAV) is required to confirm a diagnosis of acute HAV infection. In most persons, IgM anti-HAV becomes detectable 5-10 days before the onset of symptoms and can persist for up to 6 months after infection. Immunoglobulin G (IgG) anti-HAV, which appears early in the course of infection, remains detectable for the person's lifetime and confers lifelong protection against the disease. Commercialdiagnostic tests are available for the detection of IgM and total (IgM and IgG) anti-HAV in serum. HAV RNA can be detected in the blood and stool of most persons during the acute phase of infection by using nucleic acid amplification methods, and nucleic acid sequencing has been used to determine the relatedness of HAV isolates.HAV infection is acquired primarily by the fecal-oral route by either person-to-person contact or ingestion of contaminated food or water. On rare occasions, HAV infection has been transmitted by transfusion of blood or blood products collected from donors during the viremic phase of their infection. Inexperimentally infected nonhuman primates, HAV has been detected in saliva during the incubation period; however, transmission by saliva has not been demonstrated. Depending on conditions, HAV can be stable in the environment for months. Heating foods at temperatures greater than 185 F (85ºC) for 1 minute or disinfecting surfaces with a 1:100 dilution of sodium hypochlorite(i.e.,household bleach) in tap water is necessary to inactivate HAV. Because most children have asymptomatic or unrecognized infections, they play an important role in HAV transmission and serve as a source of infection for others. In one study of adults without an identified source of infection, 52% of their households included a child less than 6 years old, and the presence of a young child was associated with HAV transmission within the household. In studies whereserologic testing of the household contacts of adults without an identified source of infection was performed, 25%-40% of the contacts less than 6 years old had serologic evidence of acute HAV infection (IgM anti-HAV).The assay is based on the principle of "IgM capture" where IgM class antibodies in the sample are first captured by the solid phase coated with anti hIgM antibody. After washing out all the other components of the sample and in particular IgG antibodies, the specific IgM captured on the solid phase are detected by the addition of a purified preparation of HAV Ag, labelled with a monoclonal antibody conjugated with peroxidase (HRP). After incubation, microwells arewashed to remove unbound conjugate and then the chromogen/substrate is added. In the presence of peroxidase the colourless substrate is hydrolysed to a coloured end-product, whose optical density may be detected and is proportional to the amount of IgM antibodies to HAV present in the sample.REAGENTSMaterials provided with the kits: 1. Microtiter Well: coated with goat anti-human IgM. 2. Negative Control: 0.25ml normal serum. 3. Positive Control: 0.25ml anti-HAV IgM positive serum. 4. Enzyme Conjugate: 6 ml, monoclonal anti-HAV-HRP with HAV antigenimmunocomplex. 5. Wash Buffer Concentrate (20x): 40 ml, The buffer should be diluted 20times with distilled water before use. 6. Substrate Solution A: 6 ml Urea Peroxide 7. Substrate Solution B: 6 ml TMB solution 8. Stop Solution: 6 ml 2N Sulfuric AcidMaterials required but not provided:1. Precision pipettes: 0.02, 0.05, 0.10, 0.15, 0.20, and 1.0 ml.2. Disposable pipette tips.3. Distilled water.4. Humidified Box capable of maintaining 37°C5. Absorbent paper or paper towel.6. Microtiter plate or strip-well washer7. Microtiter plate reader.SPECIMEN COLLECTION AND PREPARATIONNo special preparation of the patient is required prior to blood collection. Blood should be collected by approved medical techniques. Remove serum or plasma from the clot or blood cells as soon as possible to avoid hemolysis. Grossly hemolytic, lipidic or turbid samples should not be used. Plasma samples containing EDTA, heparin or oxalate may interfere with test procedures and should be avoided. Specimen with extensive particulate should be clarified by centrifugation prior to use. Covered specimens may be stored for up to 48 hours at 2°-8°C prior to assaying. Specimens held for a longer time can be frozen at -20°C for mix prior to testing. Avoid repeated freeze thaw. At least, two wells of negative and positive controls each should be run in every assay.PRECAUTIONS1. Caution: Some components of this kit contain human serum. No known testmethod can offer complete assurance that products derived from human blood will not transmit infectious agents. Therefore, all blood derivatives should be considered potentially infectious. It is recommended that these reagents and human specimens be handled using established good laboratory working practices.2. Wear disposable gloves while handling kit reagents and specimens andthoroughly wash hands afterwards.3. Dispose off all specimens and materials used to perform the test as if theycontained infectious agents.4. Do not mix reagents from kits with different lot numbers.5. Cross contamination between reagents will invalidate the test results.6. All reagents and components except the conjugate must be equiliberated atroom temperature prior to use.STORAGE OF TEST KITS AND INSTRUMENTATIONUnopened test kits should be stored at 2°-8°C upon receipt. Micro titer plate, once opened, should be kept in a sealed bag with desiccants to minimize exposure to damp air. To remove the required number of strips from the micro titer plates, bring the sealed pouches to room temperature first and then open the pouches. This is very important because absorbed atmospheric moisture by cold plates significantly reduces their shelf life. Opened test kits will remain stable until the expiration date shown in 4°C, provided it is stored as described above. A micro titer plate reader with a bandwidth of 10 nm or less and an optical density range of 0-2 OD or greater at 450 nm wavelength is acceptable for use in absorbance measurement.WORKING REAGENT PREPARATION, STORAGE AND STABILITYNo reagent preparation is required except for wash buffer, which is supplied as a 20 X concentrate.WORKING WASH BUFFERDilute the 20X wash buffer concentrate with deionized or distilled water 1:20. For example, 5 ml of wash buffer concentrate should be diluted to a total volume of 100 mL with deionized or distilled water.STABILITY OF OPENED KIT COMPONENTS AND DILUTED REAGENTSThe diluted wash buffer is stable for at least one week when stored at room temperature. Substrate is stable for the expiration date of the kit. The micro titer plates should be opened after they have been kept at room temperature for 20-30 minutes. After removing the required number of strips, the plates should be resealed in the foil pouch bags along with the desiccant and stored at 2°-8°C. Exposure of the plates to humidity drastically reduces the shelf life.ASSAY PROCEDURE:1. Dispense one drop (50 ul) of Positive Control as well as Negative Control induplicate into respective wells. Set one black well as background control. 2. Dispense 50 ul of undiluted specimen into each well. Then incubate for 30minutes at 37°C3. Remove the incubation mixture by flicking plate content into a wastecontainer.4. Wash each well 4 times by filling each well with diluted 1X wash buffer,then inverting the plate vigorously to get all water out and blocking the rim of wells on absorbent paper for a few seconds.5. Add one drop of HAV -Peroxidase Conjugate into each of the wells. Do notadd Antigen and Enzyme Conjugate to the blank well. Please add 100ul washing buffer to the blank well6. Mix thoroughly the liquid in the wells. Incubate for 30 minutes at 37°C.7. Wash the plate 4 times as step 4.8. Add one drop (50µl) of Substrate Solution A and one drop (50µl) ofSubstrate Solution B (TMB) to each well and mix well. 9. Incubate for 10 minutes at 37°C.10. Add one drop (50µl) of Stop Solution into each well. Measure OD with anEIA plate reader at the wavelength of 450nm.INTERPRETATION OF RESULTSEIA Reader at 450 nm (using the OD value of the blank well to correct all the OD reading from all wells):Positive: P/N value is equal to or greater than 2.1Negative: P/N value is less than 2.1P/N value = OD value of specimen . Average OD value of Negative ControlIf the OD value of the negative control is less than 0.05, it should be reported as 0.05. If it is more than 0.05, it should be reported as the actual OD value measured.LIMITATIONS OF THE ASSAY1. HAV IgM EIA is limited to the detection of IgM antibody against HAV inserum or plasma.2. As in other sensitive immunoassays, there is the possibility that non-repeatable reaction may occur due to inadequate washing. So do aspirate the well or get rid of the entire content of wells completely before adding the washing solution.3. As with all diagnostic tests, a definitive clinical diagnosis should not bemade based only on the results of a single test. A complete evaluation by physician is needed for a final diagnosis.4. Do not use reagents from different tests that will cause incorrect results.5. Following the procedure instruction closely, especially the incubation timeand temperature.RELATED READING MATERIALS1. Dienstag J.L.. “Hepatitis A Virus : identification,characterization andepidemiologic investigations”. Progress in liver desease VI, Popper E., Schaffner F.(eds), pp 343-370, New York, Gruner and Stratton, 1979.2. Duermeyer W., Van der Veen J., Koster B. “ELISA in Hepatitis A”. Lancet.I.: 823-824, 1978 3. Parry J.V., (1981) “Hepatitis A infection: guidelines for the developmentof satisfactory assays for laboratory diagnosis”. The Institute of Medical Laboratory Sciences, 38, 303-311. 4. J., Frosner G., Hansson B.G. et al. “Serologic markers of hepatitis A and Bin chronic active hepatitis”. Scandinavian Journal of Gastroenterology, 13:525-527, 1978.5. Barbara J.A., Howell D.R., Briggs M., Parry J.V.. “Post transfusion hepatitis A”. Lancet (1982), 1-738.6.Zachoval R., Dienstag J.L., Purcell R.H. “Tests for hepatitis A virus antigen and antibody” in “Hepatitis A”. Gerety R.J. (Ed), pp 33-46, Orlando, Academic Press, Inc. 1984Manufacturer:Biocare Diagnostics Ltd.6F, Building B, 108 Xinghua Road Xiangzhou, Zhuhai, China 519000 Tel: +86-756-8238560E-mail: ******************* Website: April 10, 2008 Revision: 03。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲型肝炎病毒--IgM检测ELISA法作业指导书
1.原理
本法是用抗人μ链捕获待测血清中特异性IgM,然后用HAV与特异性—IgM抗体反应,再加酶标记抗M 抗体,最后加底物显色。
2.标本采集
2.1采集前病人准备:受检者应空腹。
2.2标本种类:血清或血浆。
2.3标本要求:采集病人静脉血2ml(可用EDTA抗凝),室温放置不超过4小时,分离血清备用。
3.标本储存:2-8°C保存不应超过1周,-20°C不应超过3个月,-70°C长期保存,应避免反复冻融。
4.标本运输:密封,室温运输。
5.标本拒收标准:污染、标本量不足、严重溶血或脂血标本不宜作此项检测。
6.试剂
6.1 试剂名称:甲型肝炎病毒IgM抗体诊断试剂盒6.2 试剂生产厂家:厦门新创生物药业股份有限公司6.3 包装规格:96Test/Kit
6.4 试剂盒组成:
HAV-IgM酶联板1块96孔,,酶标试剂1瓶,阳性对照血清1管,阴性对照血清1管,20*浓缩洗涤液,底物A 1瓶,底物B 1瓶,终止液1瓶,封口膜1张,密封袋1套。
6.5 试剂储存条件及有效期:2-8°C避光保存,有效期6个月。
7.仪器设备
7.1仪器名称:酶标仪
7.2仪器厂家:上海三科
7.3仪器型号:MC—318
8操作步骤
8.1平衡:将试剂盒各组分取出,平衡至室温(18-25°C),微孔板开封后,余者及时以自封袋封存。
8.2配液:浓缩洗涤液配制前充分摇匀(如有晶体应充分溶解),浓缩洗涤液和蒸馏水或去离子水按1:19稀释后使用。
8.3编号:将微孔条固定于支架,按序编号每板应
设阴性对照3孔,阳性对照2孔,空白1孔。
8.4加样:分别在相应孔中加入待测样品或阴,阳性对照50微升。
8.5温育(一):充分混匀,加上封板膜,置37℃温
育20分钟。
8.6洗涤(一):用洗涤液充分洗涤5次,洗涤完扣干(每次应保持30-60秒的浸泡时间)。
8.7加酶:除空白孔外,分别在每孔中加入酶标记
抗体100 l,轻拍混匀。
8.10 温育(二):充分混匀,加上封板膜,置37℃温育40分钟。
8.11 洗涤(二):用洗涤液充分洗涤5次,洗涤完扣干(每次应保持30-60秒的浸泡时间)。
8.12 显色:每孔加入底物A、B各50μl,轻拍混匀,置37℃暗处15分钟。
8.13 终止:每孔加终止液50μl,混匀。
8.14 测定:用酶标仪单波长450nm或双波长450/630nm测定各孔OD值(用单波长测定时需设空白对照一孔,30分钟内完成测定,并记录结果)。
9. 结果判断与分析
9.1 临界值(C.O.)的计算:临界值=阴性对照孔OD 值N×2.1,阴性对照OD均值大于0.1时应重新试验,小于0.05时以0.05计算。
9.2 结果判定:样品OD值S/C.O>=1者为阳性
样品OD值S/C.O<1者为阴性
10. 质量控制:每次均应有阴阳对照,其OD值应在要求范围内。
11.参考值范围:阴性
12. 临床意义:血清中抗HAV-IgM在亚临床期即已出现,其滴度在感染后3个月维持在1000以上,已被公
认为早期诊断甲型肝炎的依据。
13. 操作性能:特异性强,灵敏度高,重复性好。
14. 方法局限性
15. 注意事项
15.1 每板建议设阴阳性对照血清各两孔,设空白对照时,不加样品及酶标记抗体,其余各步相同。
15.2 洗涤时各孔均须加满,防止孔口内有游离酶未能洗净。
15.3 加试剂前应将试剂瓶翻转数次,使液体混匀。
如果滴加,滴加前应弃去1-2滴。
滴加时瓶身应保持垂直,以使滴量准确。
注意勿将试剂滴在孔壁上。
15.4 所有样品都应按传染源处理。
15.5 封口膜使用说明
15.5.1 微孔板拆封后,在取出当天所需的微孔条后,其余微孔条可以封口膜封存以避免受潮。
在封存时,注意勿把封口膜粘贴到微孔条底部,以免影响其透光性。
15.5.2 微孔板温育时,以封口膜覆盖孔口,可避免其他因素对实验带来的非预期的影响。
15.6不同品名、不同批号的试剂不可混用,以免产生错误结果。
16. 当检测系统(仪器)不能工作时,所采取的补救措施:应保证所有操作步骤正确无误;可以比对阴阳对照,肉眼判读;无法准确判读者,应留样待系统正常后复查。
17. 参考文献:中华人民共和国卫生部医政司编。
全国临床检验操作规程(第二版)410页。
18. 其它:必须按规定使用经中国药品生物制品检定所检定并贴有“检定合格”防伪标签的试剂。
