常见的电子式书写
如何正确书写电子式

如何正确书写电子式电子式:在元素符号周围,用“· ”或“×”表示原子最外层电子的图示。
书写原则:表示电子的“· ”或“×”尽量对称分占元素符号四周,一般为上下左右四方;单质或化合物中,未成键电子尽量成对对称存在,共用电子或得失电子,谁提供的,书写时应靠向谁。
1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子 ②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数 FN H H H H FS 2– Na Mg H H OO O – H4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并 ②例子:NaCl 的电子式为 ; K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况②例子:HCl 的电子式为 ;CO 2的电子式:③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 +NaCl 的形成过程 +K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
电子式的书写方法

一、原子:依据元素得原子最外层电子个数得多少,先用小黑点“•”(或“*”)等符号在元素符号上、下、左、右各表示出1个电子,多余得电子配对。
例如:二、简单离子:1、简单阳离子:简单阳离子由于在形成过程中已失去最外层电子,所以其电子式就就是其离子符号本身。
例如:Na+ K+ Mg2+ Ca2+ Ba2+ Al3+2、简单阴离子得电子式一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带得电荷数,电荷得表示方法同于离子符号。
例如,[:]H-、[:..:]..F-、[:..:]..S2-。
三、共价型单质分子:必须正确地表示出共用电子对数,并满足每个原子得稳定结构。
例如:四、共价化合物:共价化合物电子式得书写,基本与共价型单质分子相同,一般为正价者在前。
对于不同价态得元素得原子,一般将化合价绝对值大得写在中间,绝对值小得写在周边。
例如:五.复杂离子(例如NH4+、H3O+等、) 除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号得右上方标出离子所带得电荷。
复杂得阴离子,都应标出电子对等,还应加中括号,并在括号得右上方标出离子所带得电荷。
例如:六、离子化合物:离子化合物电子式得书写,就是将阴阳离子(阳离子在前,阴离子在后、)拼在一起。
对于不同价态得离子,也按其绝对值,遵照“大值在中间、小值在周边”得原则书写。
例如:七、用电子式表示化合物得形成过程:1、共价化合物得形成过程示例:2、离子化合物得形成过程示例:练习1、原子得电子式:H Ne NaAl C O2、离子得电子式:Na+ Mg+ Fe2+F- S2-NH4+ OH-3、共价化合物得电子式H2 Cl2 N2H2O NH3 CH4H2O2 HClO CO2N2H4 PCl34、离子化合物得电子式NaCl MgCl2 Na2SNaOH Na2O2NH4Cl Mg3N2。
书写电子式方法大全

精心整理如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“·”或“×”标出它的最外层电子 ②例子:钠原子;镁原子;氟原子 2.离子的电子式 (1)简单阳离子的电子式(2) (3②例子:硫离子;氟离子(4)复杂的阴离子的电子式 (过氧根离子电子式)3②例子:氢气分子;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数。
4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为; K 2S 的电子式为,(不能写成) (2)共价化合物的电子式FF S ClNa + NaMg H O K + S 2– K + K 2+ S2– N H H H精心整理①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出 两原子之间的共用电子对情况。
②例子:HCl 的电子式为;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的 共用电子对数5.基团的电子式—CH 3——OH —CHO子式表示物质的形成过程(1)共价化合物的形成过程示例:(2)离子化合物的形成过程示例:原子离子【练习】书写下列粒子的电子式Na +H +Cl -S 2-OH N a HH C N 2N O 2 N a M C l g O (NH 4)2H l 4 C F C H4 ClH C O O。
如何正确书写电子式

如何正确书写电子式电子式:在元素符号周围,用“· ”或“×”表示原子最外层电子的图示。
书写原则:表示电子的“· ”或“×”尽量对称分占元素符号四周,一般为上下左右四方;单质或化合物中,未成键电子尽量成对对称存在,共用电子或得失电子,谁提供的,书写时应靠向谁。
1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子;氟离子(3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用FN H H H H F S 2– Na Mg O – H原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况 ②例子:HCl 的电子式为 ;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数 5.用电子式表示物质的形成过程如:H 2的形成过程 +NaCl 的形成过程 +Cl Na + H H O O K + S 2– K + Cl H C O OK 2+ S2– H H H H Na Cl Cl Na + K S S2– K+ K +K2S的形成过程 2 +注意:①用“→”表示形成过程,不用“=”;②“→”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“→”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
电子式的书写

电子式是高中化学必修二的一个重要高中化学只是带你,考查形式通常为电子式的书写和判断正误,也是高考化学试题中常涉及到的一个知识点。
首先我们来看看什么是电子式?电子式就是在元素符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子的式子。
其次,中学化学网现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“·”或“×”标出它的最外层电子。
依据元素的原子最外层电子个数的多少,先用小黑点“•”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对。
②例子:元素周期表中前18号元素原子电子式如下图:2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示。
具体原因是:简单阳离子由于在形成过程中已失去最外层电子,所以其电子式就是其离子符号本身。
②例子:钠离子Na+;镁离子Mg2+;钡离子Ba2+(3)复杂的阳离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子电子式如下图(铵根离子电子式)(3)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷。
②例子:氯离子和氧离子的电子式如下图:(4)复杂的阴离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:过氧根离子和氢氧根离子的电子式分别如下图(过氧根离子电子式)(氢氧根离子电子式)3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:(氧气分子电子式)(氯气分子电子式)③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:(氯化钠电子式)(硫化钾电子式)(氯化铵电子式)(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况②例子:(氯化氢电子式)(二氧化碳电子式)③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H2的形成过程K2S的形成过程注意:①用“→”表示形成过程,不用“=”;②“→”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“→”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
中学化学正确书写电子式

如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下: 1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)复杂的阳离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子电子式如下图 (铵根离子电子式)(3)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子;氟离子 (4)复杂的阴离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:过氧根离子和氢氧根离子的电子式分别如下图(过氧根离子电子式)(氢氧根离子电子式)3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数。
4.化合物的电子式F FS 2–Na Mg H H O ON H H H H(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为;K 2S 的电子式为,(不能写成)(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况。
(完整版)中学化学中常见的电子式大全(1)
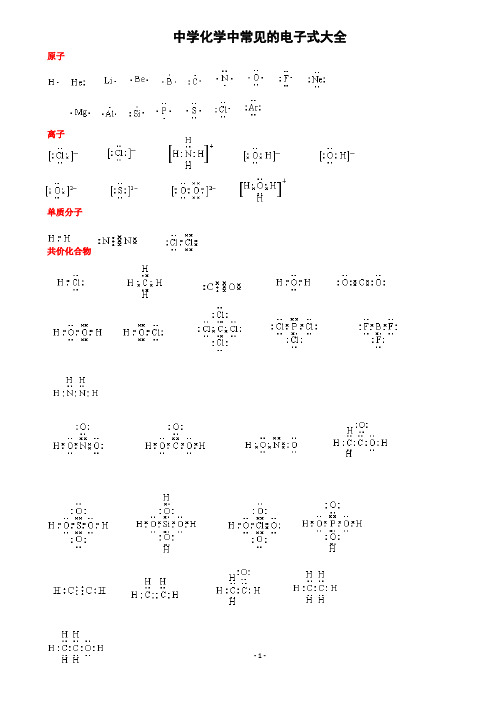
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N NO 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O H CO 2 O C O HclO H O ClNH 3 H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl ClNaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -Cl H N HHNH 4Cl+ - CaC 2 Ca 2+ 2- -CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 )(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况ClCl C C HH C H HO F N H H H H FS 2– Cl Na + Na Mg H H O OK + S 2– K + K 2+ S 2– O – H②例子:HCl 的电子式为 ;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 + NaCl 的形成过程 + K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
电子式的书写

电子式的书写要点诠释:化学反应中,一般是原子的最外层电子发生变化,为了表示这些化学反应的实质,引入了电子式,即由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
1.各种粒子的电子式的书写:(1)原子的电子式:常把其最外层电子数用小黑点“·”或小叉“×”来表示。
例如:(2)简单离子的电子式:①简单阳离子:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示,如Na+、Li+、Ca2+、Al3+等。
②简单阴离子:书写简单阴离子的电子式时不但要画出最外层电子数,而且还应用括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
例如:氧离子、氟离子电子式为:③原子团的电子式:书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还应用括号“[ ]”括起来,并在右上角标出“n-”或“n+”电荷字样。
例如铵根离子、氢氧根离子的电子式为:、(3)部分化合物的电子式:①离子化合物的电子式表示方法:离子化合物的电子式是由阳离子和带中括号的阴离子组成,且简单的阳离子不带最外层电子,而阴离子要标明最外层电子多少。
如:。
②共价化合物的电子式表示方法:在共价化合物中,原子之间是通过共用电子对形成的共价键的作用结合在一起的,所以本身没有阴阳离子,因此不会出现阴阳离子和中括号。
如:2.用电子式表示化学反应的实质:(1)用电子式表示离子化合物的形成过程:(2)用电子式表示共价化合物的形成过程:要点诠释:用电子式表示化合物的形成过程时的注意事项①反应物要用原子的电子式表示,而不是用分子或分子的电子式表示。
用弯箭头表示电子的转移情况,而共价化合物不能标。
②这种表示化学键形成过程的式子,类似于化学方程式,因此,它要符合质量守恒定律。
但是,用于连接反应物和生成物的符号,一般用“→”而不用“=”。
③不是所有的离子化合物在形成过程中都有电子的得失,如NH4+与Cl-结合成NH4Cl的过程。
1~36原子的电子式

1~36原子的电子式1到36号元素简化电子排布式如下:1、H氢:1s12、He氦:1s23、Li锂:1s2 2s14、Be铍:1s2 2s25、B硼:1s2 2s2 2p17、N氮:1s2 2s2 2p38、O氧:1s2 2s2 2p49、F氟:1s2 2s2 2p510、Ne氖:1s2 2s2 2p611、Na钠:1s2 2s2 2p6 3s112、Mg镁:1s2 2s2 2p6 3s213、Al铝:1s2 2s2 2p6 3s2 3p114、Si硅:1s2 2s2 2p6 3s2 3p215、P磷:1s2 2s2 2p6 3s2 3p316、S硫:1s2 2s2 2p6 3s2 3p417、Cl氯:1s2 2s2 2p6 3s2 3p518、Ar氩:1s2 2s2 2p6 3s2 3p619、K钾:1s2 2s2 2p6 3s2 3p6 4s120、Ca钙:1s2 2s2 2p6 3s2 3p6 4s221、Sc钪:1s2 2s2 2p6 3s2 3p6 3d1 4s222、Ti钛:1s2 2s2 2p6 3s2 3p6 3d2 4s223、V 钒:1s2 2s2 2p6 3s2 3p6 3d3 4s224、Cr铬:1s2 2s2 2p6 3s2 3p6 3d5 4s125、Mn锰:1s2 2s2 2p6 3s2 3p6 3d5 4s226、Fe铁:1s2 2s2 2p6 3s2 3p6 3d6 4s227、Co钴:1s2 2s2 2p6 3s2 3p6 3d7 4s228、Ni镍:1s2 2s2 2p6 3s2 3p6 3d8 4s229、Cu铜:1s2 2s2 2p6 3s2 3p6 3d10 4s130、Zn锌:1s2 2s2 2p6 3s2 3p6 3d10 4s231、Ga镓:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p132、Ge锗:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p233、As砷:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p334、Se硒:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p425、Br溴:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p536、Kr氪:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6电子排布的规则1、构筑原理整个体系的能量越低越好。
电子式的书写方法

知识就堤力量一. 原子:依据元素的原子最外层电子个数的多少,先用小黑点“ 下、左、右各表示出 1个电子,多余的电子配对。
例如: Na ** Mg *-Si *: P -- S - s Cl *: Ar s■n■■a a.二. 简单离子:1. 简单阳离子:简单阳离子由于在形成过程中已失去最外层电子,所以其电子式就是其离 子符号本身。
例如:Na + K + Mg 2+ Ca 2+ Ba 2+ Al 3+2.简单阴离子的电子式一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些 电子都应画出,并将符号用“ □”括上,右上角标出所带的电荷数,电荷的表示 方法同于离子符号。
例如,[H:]、[: F:]、[: S:]2。
三. 共价型单质分子:必须正确地表示出共用电子对数,并满足每个原子的稳定结构。
例如: =He=H = H: Cl : Cl =0::6:N :=N :■・ ■■ ・・・・ ・■四•共价化合物:共价化合物电子式的书写,基本与共价型单质分子相同,一般为正价者在前。
对于不同价 态的元素的原子,一般将化合价绝对值大的写在中间,绝对值小的写在周边。
例如:五. 复杂离子(例如NH4、H0等.)除应标出共用电子对、非共用电子对等外,还应加中括H[H-N=H J + [ H-O'II 广号,并在括号的右上方标出离子所带的电荷。
- -复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电 荷。
例如:[lOijir [ifi-oi]*- [ifiifi-fii]*'I IVH ■■■ ■■0*六. 离子化合物:离子化合物电子式的书写,是将阴阳离子(阳离子在前,阴离子在后.)拼在一起。
对于不同价态的离子,也按其绝对值,遵照“大值在中间、小值在周边”的原则书写。
例如:(或“ * ”)等符号在元素符号上、H■■"g:H HC="H印:H Ii=“H■・HHO:" 0=喰■ ■■■H9c»o»: :O-Na*[: CL:]'Ha +[:O:O :p-Ma 4知识就堤力量H・・"P「・・1H:K:H :€1:HCa2+[:O; O?]2- Ca1*■[: O:O :]3_Nlf-Na+Na+七.用电子式表示化合物的形成过程:1. 共价化合物的形成过程示例:H- + *C1:------------ H =C1 =■十--------------- ・3::c ::62H* 十-0 * -------------- * H = 5 = H2. 离子化合物的形成过程示例:Na^^-Cl^ --------------- -Na4" [ »Cl = ] ~z ca ci =——[f 】y尹[D丁» “ ■■ ・・K s K ——-K* [ ’ S =]Z_K*1、原子的电子式:H Ne NaAl C O2、离子的电子式:[Na4■[: N:]3-Na+Na+F- S2-Na+Mg +Fe2+知识就堤力量NH4+OH-3、共价化合物的电子式H2CI2N2出0NH3CH4 H2O2HClO CO2 N2H4PCI34、离子化合物的电子式NaCl MgCD Na2S NaOH Na?O2NH4CI Mg3N2Love is not a maybe thing. You know whe n you love some one.F- S2-。
(完整版)书写电子式方法大全

如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式 ①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)复杂的阳离子的电子式 ①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:铵根离子电子式如下图(铵根离子电子式)(3)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子(4)复杂的阴离子的电子式 ①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:过氧根离子和氢氧根离子的电子式分别如下图(过氧根离子电子式)(氢氧根离子电子式)3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数。
4.化合物的电子式(1)离子化合物的电子式FFS 2–Na Mg H H OON H H H H①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为;K 2S的电子式为 ,(不能写成)(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况。
(完整版)书写电子式方法大全

如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下: 1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)复杂的阳离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子电子式如下图 (铵根离子电子式)(3)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子 (4)复杂的阴离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:过氧根离子和氢氧根离子的电子式分别如下图(过氧根离子电子式)(氢氧根离子电子式)3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数。
4.化合物的电子式F FS 2–Na Mg H H O ON H H H H(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为;K 2S 的电子式为 ,(不能写成 )(2)共价化合物的电子式 ①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况。
高一化学电子式_结构式的书写方法
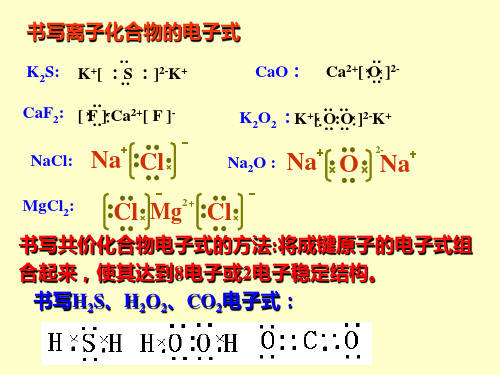
例:K
S
Mg
K
K
S K
2-
Br
Br
Br Mg
2
Br
注 意
写离子化合物电子式时,离子数目少的微粒写 在中间,离子数目多的微粒逐个写在左右,不 得合并。
课堂练习
1. 用电子式表示下列离子化合物的形成过程: (1)CaO (2)Na2O (3)CaCl2
2.下列用电子式表示化合物的形成过程正确的是( A )
_
: Cl :
: : :
一氯甲烷的电子式、结构式
Cl H
次氯酸的电子式、结构式
: :
: :
: : : O Cl H
氢氰酸的电子式、结构式
O H Cl
H : C
N: — H— C — —N
:::
三氟化硼的结构式
F B
F
F
NaOH的电子式
: :
+: : Na O H
::
-
2+ : O: H Ba : O: H
Cl Mg
Cl
常见物质的电子式及结构式
氮气的电子式、结构式
:N N: N — — —N
氯气分子的电子式、结构式
: :
: :
: : :
: Cl : Cl :
__ Cl Cl
水分子的电子式、结构式
: :
H: O: H
二氧化碳的电子式
O H H
: :
: : : O C O
:
: :
— — O — C —O
A K B Cl C O Ba Mg Cl K Cl F H K
[O ] K 2 [ Cl ] [ Ba ] [ Cl ]
Mg 2
常见的电子式书写

电子式书写规则在元素符号周围用“·”和“×”来表示原子的最外层电子(价电子),这种式子叫做电子式。
1. 原子的电子式由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元素符号周围。
排列方式为在元素符号上、下、左、右四个方向,每个方向不能超过2个电子。
例如,、、、。
2. 金属阳离子的电子式金属原子在形成阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应在元素符号右上角标出。
所以金属阳离子的电子式即为离子符号。
如钠离子的电子式为;镁离子的电子式为,氢离子也与它们类似,表示为。
3. 非金属阴离子的电子式一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。
例如,、、。
4. 共价化合物的电子式共价化合物是原子间通过共用电子对结合而成的。
书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出。
因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子。
例如,、。
5. 根离子的电子式根离子中,若不同原子间以共价键结合,画法同共价化合物,因根离子带有电荷,所以应把符号用“[]”括起来,右上角标出电荷数。
例如,铵根阳离子:;氢氧根离子:。
6. 离子化合物的电子式先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能合并。
例如,NaCl、MgCl2、Na2O的电子式分别为、、。
7. 用电子式表示物质的形成过程①离子化合物的形成过程形成用“→”表示,形成之前为原子的电子式并用弯箭头表示电子得失,形成之后为离子化合物的电子式。
例如,NaCl的形成过程为:MgCl2的形成过程为:②共价化合物或非金属单质的形成过程表示方法基本同离子化合物相同,不同的是因没有电子得失,所以不要再画弯箭头,并且“→”之后为共价化合物或非金属单质的电子式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电子式书写规则
在元素符号周围用“·”和“×”来表示原子的最外层电子(价电子),这种式子叫做
电子式。
1. 原子的电子式
由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元素符号周围。
排列方式为在元素符号上、下、左、右四个方
向,每个方向不能超过2 个电子。
例如,、、、。
2. 金属阳离子的电子式
金属原子在形成阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,
所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应
在元素符号右上角标出。
所以金属阳离子的电子式即为离子符号。
如钠离子的电
子式为;镁离子的电子式为,氢离子也与它们类似,表示为。
3. 非金属阴离子的电子式
一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子
都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方
法同于离子符号。
例如,、、。
4. 共价化合物的电子式
共价化合物是原子间通过共用电子对结合而成的。
书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出。
因不同元素原子吸引电子
能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的
原子。
例如,、。
5. 根离子的电子式
根离子中,若不同原子间以共价键结合,画法同共价化合物,因根离子带有电荷,所以应把符号用“[]”括起来,右上角标出电荷数。
例如,铵根阳离子:;氢氧根离子:。
6. 离子化合物的电子式
先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子
间隔排列,注意相同离子不能合并。
例如,NaCl、MgCl2、Na2O的电子式分别为、、。
7. 用电子式表示物质的形成过程
①离子化合物的形成过程
形成用“→”表示,形成之前为原子的电子式并用弯箭头表示电子得失,形成之后
为离子化合物的电子式。
例如,NaCl 的形成过程为:
MgCl2的形成过程为:
②共价化合物或非金属单质的形成过程
表示方法基本同离子化合物相同,不同的是因没有电子得失,所以不要再画弯箭
头,并且“→”之后为共价化合物或非金属单质的电子式。
HCl:
Cl 2:
+
+
-
2 Na [2 电子式书写中的常见错误
一、漏写没有参加成键的电子对
Cl
Cl
Cl C Cl (正确)
Cl C Cl (错误)
N N (正确)
N N (错误)
Cl
Cl
二、漏写或多加[
]及错写电荷数
Na (正确) [ Na ] ( 错 误)
H F (正确)
H [ F ] (错误)
+
-
Na [ Cl ]
(正确) Na
H Cl (错误) [ H N H ] H
+ - [ Cl ] (正确) NH 4 [
Cl ]
(错误)
三、漏标离子所带的电荷数或与化合价混淆
[ Cl ]-
Ca 2
+
[ Cl ] - (正确) [ Cl ]Ca
2
+
[ Cl ] (错误) [ Cl ]
- 1
Ca
2
+
[
Cl ] - 1
(错误)
Na
+
[ S ] 2
-
Na
+
(正确) Na
+
[ S ]Na
+
(错误) Na + 1
[ S ]
- 2
Na
+ 1
(错误)
四、将相同离子错误合并
[ Cl ]-
Mg 2+
[ Cl ]-
(正确) Mg 2 +
[ Cl ] -(错误) Na +
[ S ] 2-
Na (正确) +
S ] 2-
(错误)五、电子式中微粒排列错误
H O Cl (正确) H Cl O (错误) [ H O ] -
Ca 2+
[ O H ] - (正确) [ O H ]Ca 2
+
[ O H ] (错误)
Mg 2
+
[ N ]3
-
Mg
2
+
[ N ] 3
-
Mg
2
+
(正确) Mg 2
+ Mg 2
+
Mg 2
+
[
N ] 3
- [ N ] 3
-
(错误)
六、电子(电子对)排列错误
N N (正确)
N
N (错误)
N N
(错误) O C O (正确)
O C O (错误)
七、用电子式表示形成过程时错误
化学方程式中的反应物与生成物之间应该用“→”连接,而不用“=”连接。
H + Cl → H
Cl (正确)
H
+
Cl
= H Cl (错误)
离子化合物或离子
共价化合物
(I)NaOH
(1)H 2O
(2)Na 2O 2
(2)H 2O
(3)NH 4Cl
(3)NH 3
(4)CaH 2 (4)CO 2
+
+
-
2 (5)C 2H
(6)Na 2O (6)}HClO
(7)Na 3N (7) BF 3
(8)OH -。
