谷胱甘肽含量测定
谷胱甘肽的制备及含量测定

• 3.谷胱甘肽的主要来源 • 谷胱甘肽广泛存在于动、植物中,在生物体内有着重 要的作用。在面包酵母、小麦胚芽和动物肝脏中的含量很 高,达100~1000mg/100g,在人体血液中含26~ 34mg/100g,鸡血中含58~73mg/100g,猪血中含10~ 15mg/100g,在西红柿、菠萝、黄瓜中含量也较高(12~ 33mg/100g),而在甘薯、绿豆芽、洋葱、香菇中含量较 低(0.06~0.7mg/100g)。
谷胱甘肽的制备及含量测定
一、谷胱甘肽的背景知识
• 1.谷胱甘肽是一种什么 样的物质 谷胱甘肽(glutathiose,rglutamyl cysteingl +glycine,GSH)是一种 含γ-酰胺键和巯基的三 肽,由谷氨酸、半胱 氨酸及甘氨酸组成。 谷胱甘肽:还原型谷胱 甘肽、阿拓莫兰、古 拉定
提取工艺
1、取5g干酵母,与15ml蒸馏水充分混合后倒入25ml沸腾的水中。 2、用5ml水洗涤烧杯一并倒入,使混合液保持在95-100℃,沸腾5min。 放置冰水中速冷。 3、在2000rpm速度下离心10min,取上清液,即谷胱甘肽抽提液。 4、谷胱甘肽抽提液,调pH至3.0。 5、上处理好的732阳离子交换吸附柱吸附。 6、用0.25mol/L的NaOH溶液洗脱,洗脱流速10ml/min。收集洗脱液, 洗脱终点用亚硝基氰化钠检测。 7、中和洗脱液至pH6.5。
•
谷胱甘肽还可以保护血红蛋白不受过氧化氢、自由基 等氧化从而使它持续正常发挥运输氧的能力。还原型谷胱 甘肽既能直接与过氧化氢等氧化剂结合,生成水和氧化型 谷胱甘肽,也能够将高铁血红蛋白还原为血红蛋白。 • 谷胱甘肽保护酶分子中-SH基,有利于酶活性的发挥, 并且能恢复已被破坏的酶分子中-SH基的活性功能,使酶 重新恢复活性。 • 谷胱甘肽还可以抑制乙醇侵害肝脏所产生的脂肪肝。 • 谷胱甘肽对于放射线、放射性药物所引起的白细胞减 少等症状,有强有力的保护作用。谷胱甘肽能与进入人体 的有毒化合物、重金属离子或致癌物质等相结合,并促进 其排出体外,起到中和解毒作用 。
土壤谷胱甘肽测定

土壤谷胱甘肽测定
土壤谷胱甘肽测定是一种分析土壤中谷胱甘肽(glutathione,GSH)含量的方法。
谷胱甘肽是一种重要的抗氧化剂,对于维持土壤中微生物代谢活性和土壤生态系统的稳定具有重要作用。
谷胱甘肽测定可以通过不同的方法进行,常用的方法包括光谱法、显色法和高效液相色谱法等。
光谱法是一种简便快捷的方法,通过分析土壤中谷胱甘肽的光吸收特性来测定其含量。
在特定波长下,谷胱甘肽分子会吸收一定量的光线,通过测量吸收光的强度可以间接测定谷胱甘肽的含量。
显色法是一种常用的定性定量方法,通过化学反应使谷胱甘肽与某些试剂形成可见色素,然后通过比色测定色素的强度来判断谷胱甘肽的含量。
高效液相色谱法是一种精确和灵敏度高的测定方法,通过将土壤中的谷胱甘肽提取出来,并使用高效液相色谱仪进行分离和定量分析。
这种方法可以准确测定谷胱甘肽的含量,并且可以同时测定土壤中其他相关成分的含量。
土壤谷胱甘肽测定可以帮助研究者了解土壤中谷胱甘肽的含量和变化情况,进而评估土壤的养分供应能力、抗氧化能力以及土壤生态系统的稳定性。
这对于土壤质量评估、环境保护和农业可持续发展具有重要意义。
谷胱甘肽(GSH)含量测定

谷胱甘肽(GSH)含量测定一、实验目的1.了解植物组中中抗坏血酸-谷胱甘肽循环代谢过程;2.学习还原型谷胱甘肽含量的测定原理和方法。
二、实验原理谷胱甘肽是有谷氨酸(Glu)、半胱氨酸(Cys)、甘氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。
它作为体内重要的抗氧化剂和自由基清除剂,如与自由基、重金属等结合,从而把机体内有害的毒物转化为无害的物质,排泄出体外。
谷胱甘肽能和2-硝基苯甲酸(DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG),2-硝基-5-巯基苯甲酸为一黄色产物,在波长412nm 处具有最大光吸收。
因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
三、实验材料小麦幼嫩叶片四、实验方法及步骤1.制作标准曲线取7只干净的试管编号,按如下表格加入各试剂,反应20分钟后在412nm 下用分光光度计测其吸光度,制作标准曲线;2.样品测定a、称取小麦叶片0.2g,加入少量5%偏磷酸缓冲液研磨提取,并用5%偏磷酸缓冲液定容至6ml,8000rpm离心10min,取上清液;b、取上述上清液2ml显色,操作同标准曲线。
3.结果计算:GSH含量(ug/Gfw)= (Cx*Vt)/(Fw*Vs)注:Cx---2ml样品中GSH含量(ug),即每管中GSH的含量Vt---样品提取液总体积(ml);Vs----显色时所取样的体积(ml);FW---样品鲜重(g)。
五、实验结果1.标准曲线1.样品测定结果六、注意事项1.使用移液管吸取试剂时,视线要垂直于移液管且与液面凹面水平,不能斜视,以免量取试剂不准确。
2.在提取样品时,最好沉淀出去蛋白质,以防止蛋白质中所含巯基及相关酶对测定结果的影响。
3.在研磨叶片时,为方便研磨,刚开始时加入少量的提取液。
食用菌中谷胱甘肽的测定

食用菌中谷胱甘肽的测定谷胱甘肽是一种重要的抗氧化物质,被广泛应用于食品工业中。
食用菌是一类含有高丰富谷胱甘肽的食材,因此测定食用菌中谷胱甘肽的含量具有重要的意义。
本文将介绍几种常用的测定食用菌中谷胱甘肽的方法。
一、硫巴比妥酸法测定谷胱甘肽含量硫巴比妥酸法是目前测定谷胱甘肽含量最常用的方法之一。
该方法的原理是谷胱甘肽与硫巴比妥酸在碱性条件下反应生成黄色产物,通过测定产物的吸光度可以间接测定谷胱甘肽的含量。
具体操作步骤如下:1. 将食用菌样品粉碎并称取适量,加入酸性溶液中,破坏细胞结构释放出谷胱甘肽。
2. 加入碱性溶液和硫巴比妥酸,使谷胱甘肽与硫巴比妥酸反应生成黄色产物。
3. 使用分光光度计测定产物的吸光度,利用标准曲线计算样品中谷胱甘肽的含量。
二、高效液相色谱法测定谷胱甘肽含量高效液相色谱法是一种常用的分离和定量化合物的方法。
该方法的原理是利用色谱柱对样品中的谷胱甘肽进行分离,通过检测谷胱甘肽的峰面积或峰高来定量谷胱甘肽的含量。
具体操作步骤如下:1. 将食用菌样品制备成适宜的提取液,经过离心等处理步骤,获得待测样品。
2. 使用高效液相色谱仪,将待测样品注入进样器,经过一定的流动相条件下,在色谱柱中进行分离。
3. 通过检测谷胱甘肽的峰面积或峰高,利用标准曲线计算样品中谷胱甘肽的含量。
三、氧化还原法测定谷胱甘肽含量氧化还原法是一种直接测定谷胱甘肽含量的方法。
该方法的原理是利用谷胱甘肽与还原剂在适宜的条件下发生氧化还原反应,通过测定反应前后还原剂的含量变化来确定谷胱甘肽的含量。
具体操作步骤如下:1. 将食用菌样品制备成适宜的提取液,通过离心等处理步骤,获得待测样品。
2. 将待测样品与还原剂在适宜的条件下反应,使谷胱甘肽发生氧化还原反应。
3. 通过测定反应前后还原剂的含量变化,计算谷胱甘肽的含量。
在测定食用菌中谷胱甘肽的含量时,需要注意样品的制备过程,确保提取到的谷胱甘肽是代表样品中真实含量的。
同时,选择合适的测定方法,准确、快速地测定谷胱甘肽含量,有助于评估食用菌的品质和营养价值。
谷胱甘肽(GSH)含量测定

谷胱甘肽(GSH)含量测定一、实验目的1.了解植物组中中抗坏血酸-谷胱甘肽循环代谢过程;2.学习还原型谷胱甘肽含量的测定原理和方法。
二、实验原理谷胱甘肽是有谷氨酸(Glu)、半胱氨酸(Cys)、甘氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。
它作为体内重要的抗氧化剂和自由基清除剂,如与自由基、重金属等结合,从而把机体内有害的毒物转化为无害的物质,排泄出体外。
谷胱甘肽能和2-硝基苯甲酸(DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG),2-硝基-5-巯基苯甲酸为一黄色产物,在波长412nm 处具有最大光吸收。
因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
三、实验材料小麦幼嫩叶片四、实验方法及步骤1.制作标准曲线取7只干净的试管编号,按如下表格加入各试剂,反应20分钟后在412nm 下用分光光度计测其吸光度,制作标准曲线;2.样品测定a、称取小麦叶片0.2g,加入少量5%偏磷酸缓冲液研磨提取,并用5%偏磷酸缓冲液定容至6ml,8000rpm离心10min,取上清液;b、取上述上清液2ml显色,操作同标准曲线。
3.结果计算:GSH含量(ug/Gfw)= (Cx*Vt)/(Fw*Vs)注:Cx---2ml样品中GSH含量(ug),即每管中GSH的含量Vt---样品提取液总体积(ml);Vs----显色时所取样的体积(ml);FW---样品鲜重(g)。
五、实验结果1.标准曲线1.样品测定结果六、注意事项1.使用移液管吸取试剂时,视线要垂直于移液管且与液面凹面水平,不能斜视,以免量取试剂不准确。
2.在提取样品时,最好沉淀出去蛋白质,以防止蛋白质中所含巯基及相关酶对测定结果的影响。
3.在研磨叶片时,为方便研磨,刚开始时加入少量的提取液。
实验五植物组织中谷胱甘肽含量的测定

实验五植物组织中⾕胱⽢肽含量的测定⾕胱⽢肽含量的测定⼀、实验⽬的1、了解⾕胱⽢肽在植物抗逆中作⽤。
2、了解⽬前⾕胱⽢肽含量的测定⽅法。
3、掌握⽐⾊法测定植物体⾕胱⽢肽含量的原理与技术。
⼆、实验原理还原性⾕胱⽢肽(GSH)作为⽣物体内最主要的⾮蛋⽩巯基以及含量最丰富的低分⼦多肽,是植物细胞重要的抗氧化剂之⼀,在植物抗逆过程中直接或间接地参与了许多植物的功能活动,是⼀个良好的表⽰氧化胁迫的指标。
⾕胱⽢肽(GSH)是由⾕氨酸、半胱氨酸和⽢氨酸结合⽽成的三肽,半胱氨酸上的巯基为其活性基团。
在巯基化合物的存在下,⽆⾊的DTNB将被转变成黄⾊的5-巯基-2-硝基苯甲酸。
由于5-巯基-2-硝基苯甲酸在412 nm处具有最⼤吸收,⽽且DTNB的吸收光谱并不造成⼲扰,所以可以⽤分光光度计进⾏测定。
即:GSH和TDBN在pH=7时⽣成黄⾊物质,其颜⾊深浅与GSH的浓度成线性关系。
三、实验材料、试剂与仪器1、实验材料:⼩麦叶⽚2、实验试剂:(1)GSH标准溶液〔0.01mg/ml GSH标准溶液(=亦即10µg/ml)〕:称取50mg 分析纯GSH,溶于蒸馏⽔中,并定容于100ml,即为0.5mg/ml 之标准母液,⽤稀释10倍(0.05mg/ml=亦即50µg/ml GSH)注:⽤时再稀释5倍即为10µg/ml;(2)5%偏磷酸;(3)0.2mol/L 磷酸钾缓冲液,pH7.0;(4)TDNB试剂:称取39.6mg⼆硫代双-⼆硝基苯甲酸(TDNB),⽤0.2mol/L磷酸钾缓冲液溶解并定容于100ml;(5)1mol/L NaOH溶液。
3、实验仪器:V-1000D型可见分光光度计;离⼼机;离⼼管;刻度试管;研钵;吸⽔纸适量;移液管等。
四、⽅法与步骤1、标准曲线的制作取7⽀刻度试管,编号,按表加⼊试剂:试剂(ml)试管号1 2 3 4 5 6 7GSH标准溶液(10µg/ml)0 0.1 0.2 0.4 0.6 0.8 1.0补蒸馏⽔到2ml 2 1.9 1.8 1.6 1.4 1.2 1.0磷酸缓冲液 4 4 4 4 4 4 4DTNB试剂0.4 0.4 0.4 0.4 0.4 0.4 0.4 GSH浓度(µg/2ml即每管含量)0 1 2 4 6 8 10将上述溶液混合均匀,在室温下显⾊5min。
还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定

还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定关键词:还原型谷胱甘肽GSH氧化型谷胱甘肽GSSG测定2009-04-24 00:00 来源:互联网点击次数:6147GSH和GSSG 参照Anderson等(1992)。
取0.5 g样品,加入3 mL冰冷的6%的偏磷酸(含1 mmol•L-1 EDTA ,pH 2.8),冰浴研磨,匀浆液以20,000 g,4 ℃离心15 min,取上清液来马上测定GSH和GSSG的含量或储存在-20 ℃下等待测定。
总的GSH和GSSG含量测定如下:200 μL提取液加 1.2 mL反应液包含400 μL反应液1(110 mmol•L-1 Na2HPO4•7H20,40 mmol•L-1NaH2PO4•H2O,15 mmol•L-1EDTA,0.3 mmol•L-15,5‘-dithiobis-(2-nitrobenzoic acid)DTNB,0.04% BSA)、320 μL反应液2 (1 mmol•L-1 EDTA,50 mmol•L-1 imidazole 咪唑solution and 0.02% BSA)、400 μL反应液3(5% Na2HPO4,pH 7.5的溶液稀释50倍)、80 μL 9.0 mmol•L-1 NADPH。
测定OD412下的吸收值。
GSSG 含量测定如下:200 μL提取液加入1 mL的2-2乙烯嘧啶(稀释50倍)在25°C下水浴1 h再测定OD412下的吸收值。
GSH的含量可以从总的GSH和GSSG含量中减去GSSG含量获得。
GSH测定方法:取样品0.5 g,加入预冷的5%磺基水杨酸2.5 ml和少许石英砂,充分冰预研磨,转入离心管中,于4℃下20,000×g离心20min,将上清液分装,液氮冷冻后于-20℃保存或直接进行抗氧化剂分析。
取50 μL上清液,用5% 磺基水杨酸定容至100 μL (即加入5% 磺基水杨酸50 μL),加入24 μL 1.84 mol•L-1三乙醇胺triethlene diamine以中和样液,加入50 μL 10% 乙烯吡啶Polyvinyl pyridine (用70% 乙醇配制),25℃水浴1 h,以除去GSH,到时加入706 mL 50 mmol•L-1磷酸缓冲液,pH 7.5,内含2.5 mmol•L-1 EDTA,加入20 μL 10 mmol•L-1 NADPH 和80 μL 12.5 mmol•L-1 DTNB(二硫硝基苯甲酸),混匀,25℃保温10 min,到时加入20μL 50 U•mL-1 GR,总体积为1 mL,立即混匀,读出3 min时的OD值。
谷胱甘肽测定实验报告

一、实验目的了解植物组织中抗坏血酸-谷胱甘肽循环代谢过程,学习还原型谷胱甘肽含量的测定原理和方法。
二、实验原理谷胱甘肽(GSH)是一种具有抗氧化作用的天然三肽,由谷氨酸、半胱氨酸和甘氨酸组成。
在生物体内,谷胱甘肽具有多种生理功能,如保护细胞免受氧化损伤、参与药物和毒素的解毒过程等。
还原型谷胱甘肽含量的测定对于研究生物体内氧化还原平衡、疾病诊断和药物治疗具有重要意义。
本实验采用分光光度计法测定植物组织中还原型谷胱甘肽的含量。
该方法的原理是:在一定的pH条件下,还原型谷胱甘肽与5,5'-二硫双硝基苯甲酸(DTNB)反应,生成黄色的5-硫代2-硝基苯甲酸阴离子,于423nm波长处有最大吸收峰。
通过测定该波长处的吸光度值,可以计算出还原型谷胱甘肽的含量。
三、实验材料与仪器1. 材料:小麦幼嫩叶片、5,5'-二硫双硝基苯甲酸(DTNB)、磷酸盐缓冲液(pH 7.0)、乙二胺四乙酸(EDTA)、无水乙醇等。
2. 仪器:分光光度计、电子天平、离心机、匀浆器、恒温水浴锅、微量加样器等。
四、实验方法与步骤1. 样品制备:取小麦幼嫩叶片,用无水乙醇研磨成匀浆,离心取上清液。
2. 标准曲线绘制:分别取6支干净的试管,按表1加入试剂,反应20分钟后,于423nm波长处测定吸光度值,以DTNB浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
3. 样品测定:取6支干净的试管,按表2加入试剂,反应20分钟后,于423nm波长处测定吸光度值,根据标准曲线计算还原型谷胱甘肽的含量。
五、实验结果与分析1. 标准曲线:根据实验数据绘制标准曲线,得到线性回归方程为y=0.0048x-0.0031,相关系数R²=0.9967。
2. 样品测定:根据标准曲线计算小麦幼嫩叶片中还原型谷胱甘肽的含量为(X±SD)mg/g。
六、讨论1. 实验结果表明,小麦幼嫩叶片中含有一定量的还原型谷胱甘肽,其含量与样品制备方法和实验条件有关。
GSH含量测定

GSH含量测定一、原理还原性谷胱甘肽(GSH)是植物细胞重要的抗氧化剂之一,是一个良好的表示氧化胁迫的指标。
GSH+TDBN在pH=7时生成黄色物质,其颜色深浅与GSH的浓度成线性关系。
即:在巯基化合物的存在下,无色的DTNB将被转变成黄色的5-巯基-2-硝基苯甲酸。
由于5-巯基-2-硝基苯甲酸在412 nm处具有最大吸收,DTNB的吸收光谱并不干扰巯基的测定。
二、材料、试剂、仪器1、材料:小麦叶片2、试剂(1)GSH标准溶液:称取10mg 分析纯GSH,溶于蒸馏水中,并定容于10ml,即为1mg/ml 之标准母液,用稀释10倍(0.1mg/ml GSH);(2)5%偏磷酸;(3)0.2mol/L 磷酸钾缓冲液,pH7.0;(4)TDNB试剂:称取39.6mg二硫代双-二硝基苯甲酸(TDNB),用0.2mol/L磷酸钾缓冲液溶解并定容于100ml;(5)1mol/L NaOH溶液。
2、仪器(1)可见分光光度计:4台;(2)离心机:1台(10000转/分);(3)1/千天平-2台;(4)离心管:3支×16(10ml)(5)刻度试管:4×16支;(10或15ml)(6)普通试管(刻度试管):7支×4(15*150 标准曲线)(7)刻度吸管:0.5ml-8支; 1ml-8支; 2ml-16支; 5ml-8支;(8)研钵:1×16个;(9)比色杯4套;(10)吸水纸适量;(11)剪刀8把;(12)玻棒8支;三、方法步骤:1、制作标准曲线:取7支刻度试管,编号,按表加入试剂:将上述溶液混合均匀,在室温下显色5min。
在412nm波长下测定吸光度。
以标准溶液中GSH浓度为X,吸光度为y,制作标准回归方程,(并求出GSH含量。
)2 、样品测定:称取植物鲜样0.204g加入少量5%偏磷酸研磨提取,并用5%偏磷酸定容到10ml。
10000rpm 离心10min。
离心后取上清液2 ml,同标准曲线操作。
谷胱甘肽标准测定方法

谷胱甘肽标准测定方法
谷胱甘肽的测定方法主要有以下几种:
1. 埃尔曼(Ellman)法:这是最常用的谷胱甘肽测定方法,其原理是谷胱甘肽在DTNB(二硝基苯磺酸)的作用下,生成具有黄色的DTNB-SH,通过测定其吸光度来定量谷胱甘肽的含量。
2. 弗斯特(Foster)法:这种方法是通过测定谷胱甘肽在酸性环境下的还原能力,即测定其对2-硝基-5-苯甲酸的还原能力,通过测定其产物2-氨基-5-苯甲酸的吸光度来定量谷胱甘肽的含量。
3. 比色法:这种方法是通过测定谷胱甘肽在酸性环境下的还原能力,即测定其对2,4-二硝基苯酚的还原能力,通过测定其产物2,4-二氨基苯酚的吸光度来定量谷胱甘肽的含量。
4. 高效液相色谱法(HPLC):这种方法是通过分离、定量样品中的谷胱甘肽,通过比较其峰面积与已知浓度的谷胱甘肽峰面积来定量谷胱甘肽的含量。
5. 荧光光谱法:这种方法是通过测量谷胱甘肽的荧光光谱,通过比较其荧光强度与已知浓度的谷胱甘肽荧光强度来定量谷胱甘肽的含量。
以上方法都有其优点和缺点,选择哪种方法主要取决
于实验的目的和条件。
谷胱甘肽含量实验报告结果

谷胱甘肽含量实验报告结果1. 实验目的本实验旨在测定不同样本中谷胱甘肽的含量,探究谷胱甘肽在不同条件下的生成和消耗情况。
2. 实验方法2.1 实验材料- 谷胱甘肽标准品- 待测样本- 0.1mol/L磷酸缓冲液(pH=6.8)- 10%三氯乙酸- 1%二硫苏糖- 75mmol/L硝酸钠- 50mmol/L亚硫酸钠2.2 实验步骤1. 取不同浓度的谷胱甘肽标准品,分别加入磷酸缓冲液。
2. 将标准品和待测样本加入10%三氯乙酸中,振荡离心。
3. 取上清液稀释一半,加入1%二硫苏糖,室温放置15分钟。
4. 加入75mmol/L硝酸钠,室温放置5分钟。
5. 加入1ml 50mmol/L亚硫酸钠。
6. 在紫外-可见分光光度计上读取吸光度,得到吸光度与浓度的标准曲线。
7. 测定待测样本的吸光度,并根据标准曲线计算谷胱甘肽的含量。
3. 实验结果3.1 谷胱甘肽标准曲线谷胱甘肽浓度(µmol/L)吸光度:: ::0 0.00010 0.25020 0.48030 0.72040 0.9603.2 待测样本的吸光度和含量计算结果样本编号吸光度谷胱甘肽浓度(µmol/L):: :: ::1 0.380 15.22 0.630 25.23 0.285 11.44 0.520 20.85 0.740 29.64. 结果分析根据谷胱甘肽标准曲线,可以计算出待测样本中谷胱甘肽的含量。
根据实验结果可知,样本1中谷胱甘肽的含量为15.2µmol/L,样本2为25.2µmol/L,样本3为11.4µmol/L,样本4为20.8µmol/L,样本5为29.6µmol/L。
从结果可以看出,不同样本中谷胱甘肽含量有所差异。
这可能是因为样本来源的不同,谷胱甘肽生成和消耗速率的差异等原因导致的。
5. 实验总结本实验通过测定不同样本中谷胱甘肽的含量,初步了解了谷胱甘肽的生成和消耗情况。
谷胱甘肽检测方法

谷胱甘肽定义描述L-r谷氨酰基-L-半胱氨酰基甘氨酸含量:按干燥品计算,98.0%-101.0%性状外观性状:白色或几乎白色结晶性粉末或无色的结晶。
溶解度:易溶于水,微溶于96%乙醇及二氯甲烷。
鉴别A 比旋度符合特定的光学旋转测定(见测定项)。
B 红外吸收光谱检测(2.2.24)对比:谷胱甘肽CRS.测定溶液S:取该品5.0g,蒸馏水R溶解并稀释至50ml。
溶液澄清度溶液S澄清(2.2.1),无色(2.2.2,Method II) 比旋度(2.2.7)-15.5~-17.5(干品物质)取该品1.0g,蒸馏水R溶解并稀释至25.0ml。
有关物质采用毛细管电泳法(2.2.47)溶液应临用前新鲜配制毛细管-材料:石英(未涂层)-尺寸:有效长度0.5m,总长:0.6m,内径75 μm温度:25℃电解质溶液:取无水磷酸二氢钠R1.50g,加水R230.0ml,用磷酸R调节PH值为1.80。
加水R稀释至150.0ml,检测PH值,如有必要,用磷酸R或氢氧化钠溶液R调节PH值。
检测:采用分光光度计在200 nm处检测新毛细管的预处理:在首次进样前在压力138Kpa下用0.1mol/L盐酸溶液前冲洗毛细管20min,138Kpa压力下用水R冲洗10分钟已达到全平衡状态,用电解质溶液在350kpa 条件下冲洗40min,在电压20kv条件下保持60min。
预处理的毛细管:138 kPa压力下,用电解质溶液冲洗毛细管40min;批间冲洗:138 kPa压力下,依次用水R冲洗毛细管1min,0.1mol/L氢氧化钠溶液冲洗2min;水R冲洗1min,0.1mol/L盐酸溶液冲洗3min,最后用电解质溶液冲洗10min;进样:3.45 kPa压力下维持5s;注入电解质溶液(空白溶液),对照溶液(b)、(c)和供试溶液a、b迁移:电压为20KV运行时间:45min相对迁移率:相对于内标物质(约14min)杂质A=约0.77杂质B=约1.04;杂质E=约1.2杂质C=约1.26;杂质D=约1.3系统适用性分辨率:内标物质产生的峰与对照溶液C中那个杂质B产生的峰之间最低为1.5,如有必要,使用稀氢氧化钠溶液上调PH值峰-谷比:最低位2.5.其中:HP=杂质D产生的基线峰以上的高度HV=对照溶液中谷胱甘肽产生的峰的分离曲线的最低点以上的高度如有必要采用磷酸下调PH。
长白山野生蓝莓中还原型谷胱甘肽含量的测定

长白山野生蓝莓中还原型谷胱甘肽含量的测定谷胱甘肽(L-γ-谷氨酰-L-半胱氨酰-甘氨酸,Glutathione)是一种同时具有γ-谷氨酰基和巯基的生物活性三肽化合物,作为生物体内的非蛋白巯基化合物,谷胱甘肽主要有还原型(GSH)和氧化型(GSSG)两种形态,在机体中大量存在并起主要作用的是还原型谷胱甘肽。
临床上,谷胱甘肽可以迅速提高机体免疫力,在抗氧化、抗辐射、清除自由基、解毒、促进铁质吸收等方面具有良好的效果且无副作用;在食品加工领域,谷胱甘肽具有增强食品营养价值和强化食品风味等功能。
科学家们一直研究它在各种生物体内的生理作用,其中GSH在人体各种组织细胞中的含量以及与各种疾病、组织损伤的关系至今仍然是研究的热点[1-2]。
蓝莓,又称笃斯、越橘,俗称都柿,为杜鹃花科越橘属野生落叶灌木,其果实为浆果,成熟后为蓝紫色,球形或椭圆形,果皮有白霜。
蓝莓的果味鲜美、营养丰富,英国权威营养学家将蓝莓列为15种健康食品之首,联合国粮农组织也将蓝莓列为人类五大健康食品之一。
本研究采用DTNB作为GSH的衍生化试剂进行超声波细胞破壁,这种操作可以对蓝莓粉末破壁的同时又可以給衍生化试剂充分的反应时间进行衍生化反应而生成稳定的GSH衍生化产物。
其目的是利用衍生化试剂所进行的化反应来避免巯基化合物从细胞内流出时而被外界的其他化学环境破坏,从而生成稳定的产物,利用其产物的颜色来进行分光光度分析而得到样品中的GSH含量及定性信息。
1 材料与方法1.1实验材料、试剂与仪器1.1.1材料蓝莓购于延吉市千盛超市。
1.1.2试剂与药品5,5-二疏基-2,2-二硝基苯甲酸/DTNB、还原型谷胱甘肽、磷酸氢二钠、氢氧化钠、石油醚、海砂。
1.1.3实验仪器JA-3100精密电子天平(深美仪器有限公司);FA1004电子天平(上海良平仪器仪表有限公司);CX-100高速多功能粉碎机(上海市晟喜制药机械有限公司);DHG-*****-Ⅲ电热恒温鼓风干燥箱(上海新苗医疗器械制造有限公司);KQ-500DE型医用数控超声波清洗器(昆山市超声仪器有限公司);TDL-5000B冷冻离心机(上海安亭科学仪器厂);PHS-3CpH计(上海仪电科学仪器股份有限公司);UV-1800紫外/可见分光光度计(上海美谱达仪器有限公司);SJ-2028R榨汁机(佛山市顺德区金宜美电器有限公司);80目网筛;索氏提取器。
谷胱甘肽

高效液相色谱法
原理:高效液相色谱法是由于溶质在同定相和流动相之间的分配系数、亲和力、分子大小、吸附能力等不同, 而进行连续分离的过程 。
操作步骤: ①色谱条件 色谱柱:Kromasil C18柱(4.6 mm × 250 mm,5 μm) 。 流动相:磷酸二氢钠和辛烷磺酸钠混合溶液(磷酸二氢钠3.0 g、辛烷磺酸钠1.0 g,加水溶解并定容至500 mL,用磷酸调溶液pH为3):乙腈 = 96:4(体积比) 。 检测波长:210 nm,流速0.8 mL/min,柱温30℃,进样量10 μL 。 ②制作标准溶液 准确称取谷胱甘肽标准品适量,用去离子水溶解于容量瓶中,混合均匀,定容,制成25 μg/mL、50 μg/mL、100 Vg/mL、200 μg/mL、400 μg/mL、800 μg/mL系列浓度样品液,作为标准溶液 。
谷胱甘肽能帮助保持正常的免疫系统功能,并具有抗氧化作用、整合解毒作用。半胱氨酸上的巯基为其活性 基团(故常简写为G-SH),易与某些药物、毒素等结合,使其具有整合解毒作用。谷胱甘肽不仅可用于药物,更 可作为功能性食品的基料,在延缓衰老、增强免疫力、抗肿瘤等功能性食品广泛应用。
谷胱甘肽有还原型(G-SH)和氧化型(G-S-S-G)两种形式,在生理条件下以还原型谷胱甘肽占绝大多数。 谷胱甘肽还原酶可以催化两型间的互变,该酶的辅酶还可以为磷酸戊糖旁路代谢提供的NADPH。
方法步骤:
1、DTNB贮存液配制:将0.01 mol/L的DTNB溶解于0.05 mol/L的磷酸缓冲液(pH7.0)中形成DTNB贮存液 。
2、DTNB分析液配制:将DTNB贮存液用0.5 mol/L、pH8.0的Tris - HCl缓冲液稀释100倍,配成DTNB分析 液,避光放置,现配现用 。
谷胱甘肽

谷胱甘肽的制备及含量测定一、实验目的1.了解谷胱甘肽的理化性质,作用,制备工艺2.掌握谷胱甘肽的含量检测的方法二、实验原理谷胱甘肽广泛存在于动、植物中,在生物体内有着重要的作用。
在面包酵母、小麦胚芽和动物肝脏中的含量很高,达100~1000mg/100g,在人体血液中含26~34mg/100g,鸡血中含58~73mg/100g,猪血中含10~15mg/100g,在西红柿、菠萝、黄瓜中含量也较高(12~33mg/100g),而在甘薯、绿豆芽、洋葱、香菇中含量较低(0.06~0.7mg/100g)。
谷胱甘肽的含量测定本实验采用亚硝基铁氰化钠法。
其原理是:谷胱甘肽在氨水存在下,与亚硝基铁氰化钠发生巯基反应,生成红色化合物。
测定中加入硫酸铵可以增加颜色反应的强度。
三实验器材1 .器材:50ml量筒一个100ml烧杯一个1ml,5ml移液管各一支50ml容量瓶一个,100ml容量瓶一个732阳离子交换吸附柱紫外分光度计比色皿3个试管若干收集器,蠕动泵电磁炉冰块若干离心机离心管PH试纸2.试剂:干酵母5g 0.25mol/LNaOH(1g NaOH 配置成100ml) 亚硝基氰化钠50%H2SO4(25ml,) 硫酸铵粉末1g 亚硝基铁氰化钠,氨水(班上一起配,)四、实验步骤提取工艺1、取5g干酵母,与15ml蒸馏水充分混合后倒入25ml沸腾的水中。
2、用5ml水洗涤烧杯一并倒入,使混合液保持在95-100℃,沸腾5min。
放置冰水中速冷。
3、在2000rpm速度下离心10min,取上清液,即谷胱甘肽抽提液。
4、谷胱甘肽抽提液,调pH至3.0。
5、上处理好的732阳离子交换吸附柱吸附。
6、用0.25mol/L的NaOH溶液洗脱,洗脱流速10ml/min。
收集洗脱液,洗脱终点用亚硝基氰化钠检测。
7、中和洗脱液至pH6.5。
8、真空浓缩,干燥,得还原性谷胱甘肽粗品谷胱甘肽的含量测定1、在试管中加入1.0g硫酸铵粉末,以使体系中硫酸铵达到过饱和;1ml待测的谷胱甘肽溶液,3ml硫酸铵饱和溶液,摇匀。
植物叶片中GSH含量测定
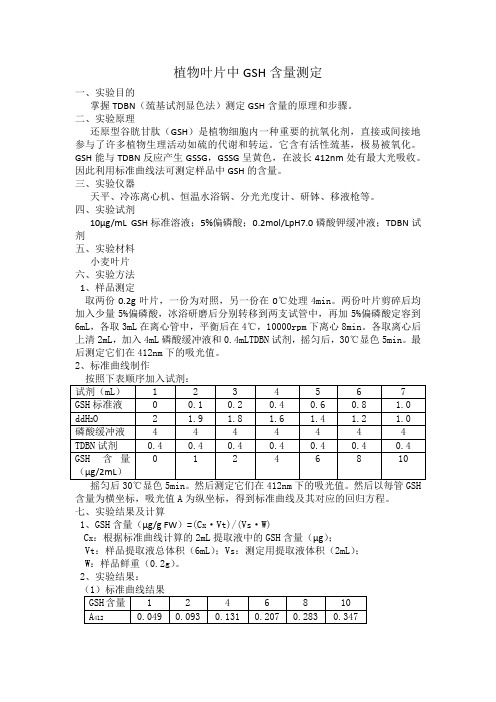
植物叶片中GSH含量测定一、实验目的掌握TDBN(巯基试剂显色法)测定GSH含量的原理和步骤。
二、实验原理还原型谷胱甘肽(GSH)是植物细胞内一种重要的抗氧化剂,直接或间接地参与了许多植物生理活动如硫的代谢和转运。
它含有活性巯基,极易被氧化。
GSH能与TDBN反应产生GSSG,GSSG呈黄色,在波长412nm处有最大光吸收。
因此利用标准曲线法可测定样品中GSH的含量。
三、实验仪器天平、冷冻离心机、恒温水浴锅、分光光度计、研钵、移液枪等。
四、实验试剂10µg/mL GSH标准溶液;5%偏磷酸;0.2mol/LpH7.0磷酸钾缓冲液;TDBN试剂五、实验材料小麦叶片六、实验方法1、样品测定取两份0.2g叶片,一份为对照,另一份在0℃处理4min。
两份叶片剪碎后均加入少量5%偏磷酸,冰浴研磨后分别转移到两支试管中,再加5%偏磷酸定容到6mL,各取3mL在离心管中,平衡后在4℃,10000rpm下离心8min。
各取离心后上清2mL,加入4mL磷酸缓冲液和0.4mLTDBN试剂,摇匀后,30℃显色5min。
最后测定它们在412nm下的吸光值。
2、标准曲线制作含量为横坐标,吸光值A为纵坐标,得到标准曲线及其对应的回归方程。
七、实验结果及计算1、GSH含量(µg/g FW)=(C x·Vt)/(Vs·W)C x:根据标准曲线计算的2mL提取液中的GSH含量(µg);Vt:样品提取液总体积(6mL);Vs:测定用提取液体积(2mL);W:样品鲜重(0.2g)。
2、实验结果:(1)标准曲线结果得到标准曲线及回归方程如下图:(2)样品测定结果计算。
氧化型谷胱甘肽含量测定试剂盒说明书

氧化型谷胱甘肽含量测定试剂盒说明书微量法100T/96S注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:GSH/GSSG是细胞内最重要的氧化还原对之一。
因此,测定细胞内GSH和GSSG含量以及GSH/GSSG比值,能够很好地反映细胞所处的氧化还原状态,也是谷胱甘肽氧化还原循环的主要指标之一。
测定原理:利用2-VP法测GSSG含量。
自备仪器和用品:低温离心机、水浴锅、可调节移液器、可见分光光度计/酶标仪、微量玻璃比色皿/96孔板、和蒸馏水。
试剂组成和配置:试剂一:液体100mL×1瓶,4℃保存。
试剂二:液体600μL×1支,4℃保存。
试剂三:液体50mL×1瓶,4℃保存。
试剂四:液体2.5mL×1瓶,4℃保存。
试剂五:液体15μL×1瓶,-20℃保存。
临用前加入0.3mL试剂三稀释,4℃保存。
试剂六:粉剂×1瓶,4℃保存。
临用前加入20mL试剂三溶解,现配现用。
粗酶液提取:1.组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
8000g4℃离心10min,取上清液(如上清不清澈,再离心3min)待测。
2.细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);8000g4℃离心10min,取上清液(如上清不清澈,再离心3min)混匀待测。
3.血清等液体:直接测定。
GSSG含量测定:1.分光光度计/酶标仪预热30min,调节波长到412nm,蒸馏水调零。
2.试剂三置于25℃(一般物种)或者37℃(哺乳动物)水浴中保温30min。
3.取1mL EP管,加入100μL上清液,5μL试剂二,盖紧后混匀,得混合液,置于37℃水浴30min;取21μL混合液于96孔板,然后依次加入20μL试剂四、2μL试剂五和140μL试剂六,迅速混匀后,测定30s和150s光吸收A1和A2,计算ΔA=A2-A1。
谷胱甘肽的测定实验报告

一、实验目的1. 了解谷胱甘肽在生物体内的作用和重要性。
2. 掌握谷胱甘肽含量的测定原理和方法。
3. 通过实验,提高实验室操作技能和数据分析能力。
二、实验原理谷胱甘肽(GSH)是一种由谷氨酸、半胱氨酸和甘氨酸组成的天然三肽,具有强大的抗氧化作用。
在生物体内,谷胱甘肽参与多种生物化学反应,包括抗氧化、解毒、细胞信号传导等。
本实验采用比色法测定植物组织中谷胱甘肽的含量。
比色法测定谷胱甘肽含量的原理如下:1. 在一定条件下,还原型谷胱甘肽(GSH)与5,5'-二硫代双(2-硝基苯甲酸)(DTNB)反应,生成黄色的2-硝基5-巯基苯甲酸(TNB)。
2. 通过测定TNB在特定波长下的吸光度,可以计算出样品中谷胱甘肽的含量。
三、实验材料与仪器1. 材料:植物组织(如芦笋、花椰菜等)、DTNB溶液、EDTA-Na2溶液、Na2HPO4溶液、NaH2PO4溶液、蒸馏水等。
2. 仪器:可见光分光光度计、低温高速离心机、匀浆器、恒温水浴锅、微量加样器等。
四、实验步骤1. 样品制备:取一定量的植物组织,加入适量的蒸馏水,用匀浆器充分匀浆,制成匀浆液。
在低温高速离心机中以3000 r/min离心10分钟,取上清液作为待测样品。
2. 标准曲线绘制:分别配制不同浓度的GSH标准溶液,按照实验方法测定其吸光度。
以GSH浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
3. 样品测定:取一定量的待测样品,按照实验方法测定其吸光度。
根据标准曲线,计算出样品中谷胱甘肽的含量。
4. 数据处理:将实验数据输入计算机,进行统计分析,得出实验结果。
五、实验结果与分析1. 标准曲线:根据实验数据绘制标准曲线,得到线性方程:y = 0.046x + 0.0058,相关系数R2 = 0.9986。
2. 样品测定:取一定量的芦笋匀浆液,按照实验方法测定其吸光度,计算得到谷胱甘肽含量为0.023 mg/g。
3. 数据分析:通过实验结果可以看出,植物组织中谷胱甘肽含量较高,说明植物具有较好的抗氧化能力。
土壤谷胱甘肽测定

土壤谷胱甘肽测定土壤是生物生存和繁衍的基础,对维持生态平衡起着重要的作用。
土壤中的营养元素和微量元素对植物的生长和发育起着至关重要的作用。
然而,随着人类经济活动的不断发展,土壤环境受到了极大的破坏和污染。
因此,了解土壤中重要营养元素和微量元素的含量以及进行污染的监测就显得至关重要了。
谷胱甘肽是一种重要的抗氧化剂,在植物中起着重要的作用。
它可以保护植物的细胞膜和细胞器不受氧化损伤,并参与调控植物的抗逆性。
谷胱甘肽的含量与土壤环境质量密切相关,也是评价土壤环境污染程度的重要指标之一。
土壤谷胱甘肽的测定可以通过多种方法进行,如高效液相色谱法、气相色谱法和电化学法等。
其中,高效液相色谱法是目前应用最广泛、效果最好的一种方法。
高效液相色谱法(HPLC)是一种利用高压泵将样品溶液在色谱柱中进行分离的技术。
在进行谷胱甘肽测定时,首先需要将土壤样品进行提取和预处理。
土壤样品中的谷胱甘肽需要先与溶剂进行萃取,然后通过离心等方法分离出稀释提取出的溶液。
随后,将分离出的溶液进行进一步的处理和净化,以去除干扰物质,以确保测定结果的准确性。
最后,将处理后的样品注入到色谱柱中,通过高压泵将样品溶液按照一定的流速送入色谱柱,实现谷胱甘肽与其他物质的分离。
通过检测谷胱甘肽的相对保留时间和相对峰面积,可以计算出土壤样品中谷胱甘肽的含量。
谷胱甘肽的测定结果通常以谷胱甘肽重量浓度(ng/g)表示。
然而,由于土壤样品的复杂性,其测定过程中可能会受到一些干扰因素的影响,例如土壤中的其他物质和颗粒物质。
因此,在进行谷胱甘肽测定时,需要进行一系列的质量控制措施,以确保测定结果的准确性和可靠性。
目前,土壤谷胱甘肽测定已经成为土壤质量评价和环境污染监测的重要工具之一。
通过测定土壤中谷胱甘肽的含量,可以评估土壤的抗逆性和耐受性情况,了解土壤环境的质量和污染程度,为环境保护和土壤修复提供科学依据。
综上所述,土壤谷胱甘肽测定是一项重要且先进的分析技术,可以用于评估土壤环境质量和监测土壤污染程度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.1mol/L(pH6.8)磷酸钠缓冲液:配制方法见附录。
4mmol/L二硫代硝基苯甲酸(5,5’-dithiobis-2-nitrobenoic acid,DTNB)溶液:称取15.8mg DTNB,用0.1mol/L、pH6.8磷酸缓冲液溶解,定容至10ml,混匀,4℃保存。现用现配。
另取2支试管,分别加入1ml上清液、1ml 0.1mol/L磷酸缓冲液(pH7.7)。向一支试管加入0.5ml4mmol/LDTNB溶液,另一支试管中加入0.5ml0.1mol/L磷酸缓冲液(pH6.8),将两支试管置于25℃保温10min。按照制作标准曲线的方法,迅速测定显色液在波长412nm处的吸光度,分别记作ODs和ODc。重复3次。
0
2.提取
取材后,称取2.5g样品置于研钵中,加入5ml经4℃预冷的50g/L三氯乙酸溶液(含5mmol/L Na2-EDTA),在冰浴条件下研磨成匀浆后,于4℃、12000g离心20min。收集上清液来测定谷胱甘肽含量,测量提取液体积。
3.测定
取1支试管,依次加入1ml蒸馏水、1ml0.1mol/L磷酸缓冲液(pH7.7)和0.5ml 4mmol/L DTNB荣毅仁,混匀,即为绘制标准曲线的0号管液。以此溶液作为参比,在波长412nm处对分光光度计进行调零。
项目
试管号
0
1
2
3
4
5
100μmol/L还原型谷胱甘肽标准液/ml
0
0.2
0.4
0.6
0.8
1.0
蒸馏水/ml
1.0
0.8
0.6
0.4
0.2
0
0.1mol/LpH7.7磷酸缓冲液/ml
1.0
1.0
1.0
1.0
1.0
1.0
4mmol/L DTNB试剂/ml
0.5
0.5
0.5
0.5
0.5
0.5
相当于还原型谷胱甘肽物质的量/μmol
【计算结果】
显色反应后,分别记录样品管混合液的吸光度(ODs)和空白对照管反应混合液的吸光度(ODc)。根据吸光度差值,从标准曲线上查出相应的还原型谷胱甘肽量,计算还原型谷胱甘肽含量(μmol/g)。
还原型谷胱甘肽含量(μmol/g)=
式中,n为由标准曲线查的的溶液中还原型谷胱甘肽物质的量(μmol);V为样品提取液总体积(ml);Vs为吸取样品液体积(ml);m为样品质量(g)。
【注意事项】
1.在提取样品时,需要沉淀出去蛋白质,以方志蛋白质中所含巯基及相关酶对测定结果的影响。
2.利用本方法还可以测定样品中总谷胱甘肽(GSSG+GSH)和氧化型谷胱甘肽(GSSG)的含量。在谷胱甘肽还原酶(GR)作用下,将GSSG还原成GSH再进行测定和计算。
3.建议在第一次测定时先做2或3个样品本底对照,如果样品中本底对照和空白对照非常接近,则说明样品液中不存在干扰物质,可以不再检测样品本底对照。
谷胱甘肽含量测定
———————————————————————————————— 作者:
———————————————————————————————— 日期:
ﻩ
植物生理学模块实验指导
李玲主编
科学出版社
还原型谷胱甘肽含量的测定方法(分光光度计法)
【实验目的】
了解植物组中中抗坏血酸-谷胱甘肽循环代谢过程,学习还原型谷胱甘肽含量的测定原理和方法。
【实验原理】
谷胱甘肽是有谷氨酸(Glu)、半胱氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。谷胱甘肽能和5,5’-二硫代-双-(2-硝基苯甲酸)(5,5’-dithiobis-2-nitrobenoic acid,DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG)。2-硝基-5-巯基苯甲酸为一黄色产物,在波长412nm处具有最大光吸收。因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
【器材与试剂】
1.实验仪器与用具
研钵、高速冷冻离心机、微量移液枪、离心管、试管、水浴锅、容量瓶(100ml、200ml、1000ml)、分光光度计
2.实验试剂
50g/L三氯乙酸(TCA)溶液(含5mmol/LNa2-EDTA):称取5g三氯乙酸,用蒸馏水溶解稀释至100ml。再称取186mgNa2-EDTA·2H2O,加入到100ml 50g/L三氯乙酸溶液中溶解。
100μmol/L还原型谷胱甘肽标准液:称取3.1mg还原型谷胱甘肽,加入少量无水乙醇溶【实验步骤】
1.标准曲线制作
取6支试管,编号,按照表1加入各种试剂,混匀,25℃保温反应10min。以0号管为参比调零,测定显色液在412nm处的吸光度。以吸光度为纵坐标,还原型谷胱甘肽物质的量(μmol)为横坐标,绘制标准曲线。
