实验六 植物单细胞培养
植物细胞培养

选择适宜的培养基:较高激素浓度,特别是
生长素,必要的附加物质,例如水解酪蛋白、 Pro、Gln。 继代多次,以获得均匀一致疏松的愈伤组织。
4.2 细胞悬浮培养
4.2.1 细胞悬浮培养的概念和意义
悬浮培养是将单个游离细胞或小细胞团悬浮 在液体培养基中进行培养增殖的技术。
Culture wheel cell suspensions
Plants
Cell suspension
Artificial seeds
Isolation protoplasts
Mutation select
Secondary products
4.2.3 细胞悬浮培养的方法
(1)培养基 对于用愈伤组织制备的悬浮细胞培养的培养 基以原愈伤组织继代时的培养基除去琼脂为好。
为了提高细胞的分散度,对于生长素和细胞分裂
素的比例需要进行一些调节。
4.2.3 细胞悬浮培养的方法
(2)培养细胞的起始密度及细胞记数
①最低有效密度的概念 在悬浮细胞培养中,使悬浮培养细胞能够增 殖的最少接种量称为最低有效密度或者临界的起 始密度。 最低有效密度由于培养材料、原种培养条件, 原种保存时间长短、培养基的成分不同而有差异, 一般为104-105细胞/ml。
活细胞测定的方法
A、醋酸酯荧光素(FDA)染色法 FDA本身无荧光,无极性,可自由通过原生质 体膜进入细胞内部,进入后由于受到活细胞内脂酶 分解,而产生有荧光的极性物质荧光素,不能自由 出入原生质体膜,在荧光显微镜下观察到荧光的是 有活力的,反之无活力。具体操作: 取0.5ml细胞悬浮液放入到小试管中,加入FDA 溶液,使最后浓度达到0.01%,混匀,室温下作用 5min,荧光显微镜观察。
植物细胞工程实验

植物细胞工程实验植物原生质体的分离植物原生质体培养方法起源于植物单细胞的培养方法。
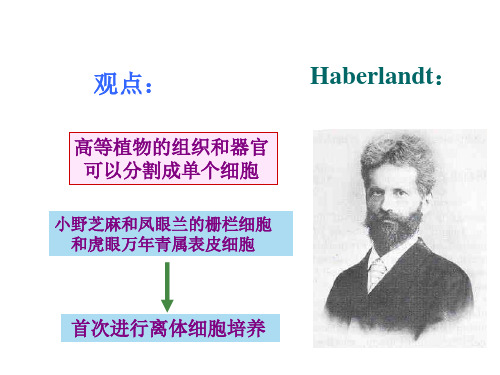
1954年,植物单细胞培养才获得成功。
Mllir 培养的万寿菊及烟草悬浮细胞植入到长有愈伤组织的培养基上得到了它们的单细胞克隆,并建立了看护培养的方法;1960年Jones 等建立了微室培养法。
同年,Cocking应用酶法分离原生质获得成功,从而在实验条件下很容易获得大量的原生质体。
随着多种适用于原生质体分离的商品酶的出现,原生质体的培养方法也得到了不断地改进,现在常用的原生质体培养方法有:液体浅层培养法、双层培养法、琼脂糖包埋法、琼脂岛培养法以及使用条件培养基或饲喂培养等。
实验目的:了解植物原生质体分离的基本原理及其过程实验原理:植物原生质体是除去细胞壁后为原生质所包围的“裸露细胞”,是开展基础研究的理想材料。
其中酶解法分离原生质体是一个常用的技术,其原理是植物细胞壁主要由纤维素、半纤维素和果胶质组成,因而使用纤维素酶、半纤维素酶和果胶酶能降解细胞壁成分,除去细胞壁。
原生质体分离纯化或融合后,在适当的培养基上应用合适的培养方法,能够再生细胞壁,并启动细胞持续分裂,直至形成细胞团,长成愈伤组织或胚状体,再分化发育成苗。
其中,原生质体的分离是最基础的环节。
实验内容:植物原生质体的分离实验设备:人工气候培养箱(愈伤组织培养的重要途径)、超净工作台、解剖镜、高速离心机、万分之一电子天平、真空泵等。
实验材料、用品:三角瓶、离心管、烧杯、200目滤网、解剖刀、长、短镊子、培养皿、滤纸、0.2μm滤膜、滤器、培养瓶(注:以上用品要进行高压灭菌)、高压灭菌锅、倒置显微镜。
实验试剂:KH2PO4、KNO3、CaCI2﹒2H2O、MgSO4﹒7H2O、KI、CuSO4﹒5H2O、甘露醇13%、纤维素酶4%、果胶酶0.4%、蔗糖。
实验步骤:精选饱满的黄瓜种子,浸种20~30min后,用0.1% HgCl2表面消毒8~10min,无菌水洗涤4~5次,剥皮,种子接入1/2MS培养基中。
植物培植实验报告范文(3篇)

一、实验目的1. 掌握无菌操作的植物组织培养方法;2. 通过配置MS培养基母液,掌握母液的配置和保存方法;3. 通过诱导植物叶片形成愈伤组织,学习愈伤组织的建立方法;4. 了解植物细胞通过分裂、增殖、分化、发育,最终长成完整再生植株的过程,加深对植物细胞全能性的理解;5. 探讨不同激素配比对植物愈伤组织形成的影响。
二、实验原理植物组织培养是利用植物细胞的全能性,通过特定的培养基和条件,使植物细胞或组织在体外条件下生长发育成完整植株的技术。
植物组织培养主要包括脱分化、再分化两个过程。
脱分化是指植物组织在培养条件下,由已分化的细胞重新获得分裂和分化的能力,形成愈伤组织;再分化是指愈伤组织在特定条件下,通过细胞分裂、增殖、分化等过程,形成具有特定形态和功能的器官。
三、实验材料与仪器实验材料:- 植物叶片(如小麦、水稻、玉米等)- MS培养基母液- 乙醇、氯化汞(HgCl2)、次氯酸钠等消毒剂- 琼脂- 烧杯、量筒、培养皿、解剖刀、剪刀、镊子、超净工作台、高压灭菌锅、水浴锅等实验仪器:- 培养室- 电子分析天平- 橡皮筋等四、实验步骤1. 材料预处理:- 将植物叶片用无菌水清洗,去除表面污物;- 用70%乙醇消毒30秒,然后用无菌水冲洗3次;- 用氯化汞(HgCl2)或次氯酸钠消毒5分钟,再用无菌水冲洗3次;- 将消毒后的叶片切成约1cm×1cm大小的块状。
2. 愈伤组织诱导:- 将预处理后的叶片块状接种于MS培养基中;- 在培养室中,将培养皿放置于适宜的温度(25℃左右)和光照条件下; - 观察愈伤组织的形成情况,记录愈伤组织的颜色、质地、大小等特征。
3. 激素配比试验:- 将愈伤组织接种于不同激素配比的MS培养基中;- 观察愈伤组织的生长情况,记录愈伤组织的颜色、质地、大小等特征; - 比较不同激素配比对愈伤组织形成的影响。
4. 再分化培养:- 将愈伤组织接种于含有生长素和细胞分裂素的MS培养基中;- 在培养室中,将培养皿放置于适宜的温度(25℃左右)和光照条件下; - 观察再分化过程,记录芽和根的形成情况。
单胞藻培养实验报告模板(3篇)

第1篇实验报告名称:单胞藻培养实验一、实验目的1. 了解单胞藻的基本特性及培养方法。
2. 掌握单胞藻的培养技术,包括培养条件、培养基配制、接种与培养过程等。
3. 学习使用显微镜观察单胞藻的生长状态,分析影响单胞藻生长的因素。
二、实验原理单胞藻是一种广泛存在于自然界中的单细胞藻类,具有繁殖速度快、生长周期短、营养价值高等特点。
本实验通过培养单胞藻,了解其生长规律,为实际应用提供理论依据。
三、实验材料与仪器1. 实验材料:牟氏角毛藻、新月菱形藻、三角褐指藻、金藻3011等单胞藻。
2. 仪器:培养皿、移液器、显微镜、天平、温度计、pH计、高压灭菌锅等。
四、实验方法1. 培养基配制:根据不同藻种,配制相应的培养基。
牟氏角毛藻培养基:海水1000ml,硅藻粉5g,葡萄糖2g,碳酸氢钠2g,磷酸二氢钾1g,硫酸镁0.5g;新月菱形藻培养基:海水1000ml,硅藻粉5g,葡萄糖2g,碳酸氢钠2g,磷酸二氢钾1g,硫酸镁0.5g;三角褐指藻培养基:海水1000ml,硅藻粉5g,葡萄糖2g,碳酸氢钠2g,磷酸二氢钾1g,硫酸镁0.5g;金藻3011培养基:海水1000ml,硅藻粉5g,葡萄糖2g,碳酸氢钠2g,磷酸二氢钾1g,硫酸镁0.5g。
2. 接种与培养:将单胞藻接种于培养基中,置于恒温培养箱中培养。
牟氏角毛藻、新月菱形藻、三角褐指藻培养温度为28~30℃,金藻3011培养温度为28~30℃。
每天观察单胞藻的生长状态,并记录数据。
3. 观察与测量:使用显微镜观察单胞藻的生长状态,测量单胞藻的密度、体积、细胞形态等指标。
五、实验步骤1. 准备实验材料与仪器。
2. 配制培养基,并进行高压灭菌。
3. 将单胞藻接种于培养基中,置于恒温培养箱中培养。
4. 每天观察单胞藻的生长状态,并记录数据。
5. 使用显微镜观察单胞藻的生长状态,测量单胞藻的密度、体积、细胞形态等指标。
6. 分析实验数据,得出结论。
六、实验数据与分析1. 牟氏角毛藻培养数据:- 培养天数:5天- 密度:1.2×10^6/ml- 体积:2.5μm^3- 细胞形态:短柱形2. 新月菱形藻培养数据:- 培养天数:5天- 密度:1.0×10^6/ml- 体积:2.0μm^3- 细胞形态:新月形3. 三角褐指藻培养数据:- 培养天数:5天- 密度:1.5×10^6/ml- 体积:2.8μm^3- 细胞形态:三角形4. 金藻3011培养数据:- 培养天数:5天- 密度:1.3×10^6/ml- 体积:2.3μm^3- 细胞形态:棒状根据实验数据,分析不同藻种的生长特点及影响因素,得出以下结论:1. 牟氏角毛藻、新月菱形藻、三角褐指藻和金藻3011均能在适宜的培养条件下生长。
植物单细胞培养

植物的单细胞培养1、植物的单细胞培养在适宜的条件下,一个来自已分化的根、茎、叶等组织的细胞,经过离体培养可以发育成同其亲本一样的完整植株。
植物组织培养技术的重要理论基础是植物细胞的全能性。
2、植物单细胞培养的意义(1)有利于观察细胞个体的分裂、分化、生长和繁殖情况;(2)有利于获得纯细胞系;(3)有利于进行细胞特性、细胞生长规律、细胞代谢过程及其调节控制规律等方面的研究;(4)有利于生物转化和天然化合物的生产。
3、植物单细胞的分离技术(1)从外植体直接分离单细胞外植体经过切割、捣碎或酶解,然后经过一定孔径的不锈钢筛网过滤,得到细胞悬浮液。
(2)从愈伤组织分离单细胞将愈伤组织进行振荡培养,使其分散成小的细胞团或单细胞,然后用适当孔径的不锈钢筛网过滤,除去大的细胞团和残渣,离心除去小的残渣,得到单细胞悬浮液。
(3)通过原生质体再生法获得单细胞外植体、愈伤组织或细胞团经过纤维素酶和果胶酶等的作用,除去细胞壁而获得原生质体。
4、植物单细胞的培养方法(1)平板培养法单细胞悬浮液的制备(外植体、愈伤组织、原生质体)→单细胞悬浮液的密度调整(调整后的密度为植板细胞密度的2倍)→固体培养基的配制→单细胞悬浮液与固体培养基等量混合→暗培养(培养期间对细胞频繁的镜检会对细胞的生长产生有害作用,应尽量减少镜检次数)→继代培养(选取生长良好的由单细胞形成的细胞团,可以获得由单细胞形成的细胞系)。
特点:操作简便,分离单细胞系较容易,但培养细胞气体交换不畅。
(2)看护培养法将生长活跃的愈伤组织接种在固体培养基上→在愈伤组织块上方放置一片面积为1cm2的无菌滤纸,滤纸下方紧贴愈伤组织→借助于微型移液管从细胞悬浮液中提取适量单细胞悬浮液,然后接种在无菌滤纸上面→将在滤纸上由单细胞形成的细胞团转移到新鲜的固体培养基中进行继代培养,获得由单细胞形成的细胞系。
(3)微室培养法借助于微型移液管从细胞悬浮液中提取适量单细胞悬浮液,置于一张无菌载片上。
六年级科学上册实验报告单

六年级科学上册实验报告单一、实验名称:观察植物细胞实验目的:1、学会制作植物细胞临时装片。
2、认识植物细胞的基本结构。
实验材料:洋葱鳞片叶、清水、稀碘液、镊子、刀片、滴管、纱布、载玻片、盖玻片、显微镜。
实验步骤:1、准备(1)用洁净的纱布将载玻片和盖玻片擦拭干净。
(2)在载玻片中央滴一滴清水。
2、制作洋葱鳞片叶内表皮临时装片(1)用镊子从洋葱鳞片叶内侧撕取一小块透明薄膜——内表皮。
(2)把撕下的内表皮浸入载玻片上的水滴中,用镊子展平。
(3)用镊子夹起盖玻片,使它的一边先接触载玻片上的水滴,然后缓缓地放下,盖在要观察的材料上,这样才能避免盖玻片下面出现气泡而影响观察。
(4)在盖玻片的一侧滴一滴稀碘液。
(5)用吸水纸从盖玻片的另一侧吸引,使碘液浸润标本的全部。
3、观察(1)将制作好的临时装片放在显微镜的载物台上,用低倍镜观察。
(2)转动粗准焦螺旋,使镜筒缓缓下降,直到物镜接近玻片标本为止(此时眼睛一定要看着物镜)。
(3)一只眼向目镜内看,同时逆时针方向转动粗准焦螺旋,使镜筒缓缓上升,直到看清物像为止。
再略微转动细准焦螺旋,使看到的物像更加清晰。
实验现象:在显微镜下,可以看到洋葱鳞片叶内表皮细胞排列紧密,呈长方形。
细胞壁、细胞膜、细胞质、细胞核、液泡等结构清晰可见。
细胞核被碘液染成了深色,液泡较大,充满了细胞液。
实验结论:植物细胞由细胞壁、细胞膜、细胞质、细胞核和液泡等结构组成。
二、实验名称:探究种子萌发的环境条件实验目的:探究种子萌发需要的环境条件。
实验材料:四个透明塑料容器、绿豆种子、纸巾、水。
实验步骤:1、在四个透明塑料容器的底部铺上湿润的纸巾。
2、在每个容器中放入相同数量的绿豆种子。
3、对四个容器分别进行以下处理:(1)容器 1:不做任何处理,提供充足的空气、适量的水分和适宜的温度,作为对照组。
(2)容器 2:加入过多的水,使种子完全浸没在水中,提供充足的空气和适宜的温度,探究水分对种子萌发的影响。
植物单细胞培养概论

电炉
推车
酒精灯
封口膜
接种器具
灭菌器
培养瓶
40
3.培养设备
①带日光灯的培养架,主要用于接种后材料的培养。
41
②恒温箱:又称培养箱,可用于原生质体和酶制剂的保 温,也可用于组织培养材料的保存及暗培养。
42
③摇床与转床:在液体培养基中,可改善培养基中的培 养材料的通气状况。如从疏松的愈伤组织中获得单个细 胞。但注意要设定适合的温度及转速。
•(3)观察时要保持温度和培养时的一致。
30
三、影响单细胞培养的因子
1、培养基成份
植板密度较高时,与悬浮培养中或愈伤组织中相似的 培养基即可;较低时,则成份非常复杂,可加入椰子 汁,水解酪蛋白或酵母浸出液等化学不明确物质;
2、初始细胞植板密度(>临界密度)
•临界密度:单细胞培养时,初始植板密度低于某值培 养细胞就不能进行分裂和发育成细胞团,则该值就是 临界密度。 •初始植板密度应根据培养基的营养状况而改变,培养 基越复杂则植板细胞的临界密度越低,反之则相反。 一般要求每毫升在1000个细胞以上。 •其他:植物生长激素、温度、PH、二氧化碳含量等
• (4)接种时培养基的温度要控制,一般不超过35 ℃。
23
3、看护培养法
• 3-1 看护培养的含义及用途 • 含义:指用一块活跃生长的愈伤组织来看
护单个细胞,并使其生长和增殖的方法。 • 用途;诱导形成单细胞系。 • Muir(1954)首先用此法培养出烟草单细胞
株。Sharp(1972)成功将此法用于番茄的花 粉培养,诱导花粉形成单倍体细胞系。
31
第二节:细胞悬浮培养 Suspension culture
概念:是指离体的植物细胞悬浮在液体培养 基中进行无菌培养。由愈伤组织液体培养技 术发展而来。
细胞单层培养实验报告

一、实验目的1. 熟悉细胞单层培养的基本原理和操作流程。
2. 掌握细胞单层培养技术,为后续实验研究打下基础。
3. 学习观察细胞在不同培养条件下的生长状态和形态变化。
二、实验原理细胞单层培养是指将动物细胞从组织中取出,经过消化、分散等步骤,在体外模拟体内生理环境条件下,使细胞在培养皿中生长并形成单层细胞的过程。
细胞单层培养技术是生物学和医学研究中常用的技术手段,可以用于细胞生物学、分子生物学、遗传学等领域的实验研究。
三、实验材料与仪器1. 材料:小鼠脾细胞、DMEM培养基、胎牛血清、胰蛋白酶、PBS缓冲液、细胞计数板、细胞培养箱、无菌操作台、移液器、显微镜等。
2. 仪器:细胞培养箱、显微镜、移液器、无菌操作台、细胞培养皿等。
四、实验步骤1. 细胞复苏:将冻存的小鼠脾细胞复苏,将冻存管放入37℃水浴中,待细胞完全融化后,用移液器吸取细胞悬液,加入适量DMEM培养基,混匀。
2. 细胞消化:向细胞悬液中加入适量胰蛋白酶,置于37℃水浴中消化3-5分钟,直至细胞分散成单个细胞。
3. 细胞计数:将消化后的细胞悬液用PBS缓冲液稀释,取适量加入细胞计数板,在显微镜下观察并计数活细胞数。
4. 细胞接种:将细胞悬液用移液器转移至细胞培养皿中,使细胞均匀铺展。
将培养皿放入细胞培养箱中,在37℃、5%CO2条件下培养。
5. 细胞观察:在显微镜下观察细胞生长状态,记录细胞形态、生长速度、附着情况等。
6. 细胞传代:当细胞生长至约80%铺满培养皿时,用胰蛋白酶消化细胞,将细胞悬液转移至新的培养皿中,继续培养。
五、实验结果与分析1. 细胞形态:细胞在培养皿中呈圆形或椭圆形,细胞核清晰可见,细胞间有少量细胞间隙。
2. 细胞生长速度:细胞在培养箱中生长速度较快,约24小时分裂一代。
3. 细胞附着:细胞在培养皿中附着良好,细胞铺展均匀。
4. 细胞传代:细胞传代过程中,细胞生长状态良好,无明显形态变化。
六、实验结论本实验成功掌握了细胞单层培养技术,细胞在体外培养条件下生长状态良好,为后续实验研究提供了可靠的细胞来源。
植物细胞培养

(2)气升式反应器
●在反应器环流管底部有一个空气喷嘴,空 气以高速度(250-300m/S)喷入环流管, 气泡被分散于环流管液体中 ●借助于环流管内气-液混合物密度与反应主 体密度之差,气-液混合物连续循环流动。 ●培养罐液体中的溶解氧会不断减少,通过 环流管又达到饱和。
(一)植物单细胞的获得
1、从外植体直接分离单细胞
●外植体经过切割、捣碎或酶解,然后经过
一定孔径的不锈钢筛网过滤,得到细胞悬 浮液。 ●悬浮液中所含的完整细胞数量很少, 分散性较好,可以看作是游离的单细胞悬 浮液。
2、从愈伤组织分离单细胞
1)经过愈伤组织诱导获得脱分化愈伤组织 的薄壁细胞团。 2)将细胞团转移到液体培养基中,进行振 荡培养,使细胞团分散成为单细胞,然后用 适当孔径的不锈钢筛网过滤,除去细胞团和 残渣,得到单细胞悬浮液。
2.低温处理法
1) 将收集得到的细胞或小细胞团,在4℃左右 的低温条件下处理1~3d,植物细胞在低温 下全部停止生长繁殖, 2)然后再悬浮于新鲜的液体培养基中,在25℃ 培养,于是细胞几乎同时开始生长繁殖,处 于同步状态。
3.限制营养处理法
1)将细胞或小细胞团悬浮在营养物质受到限 制的培养液中培养几天,由于营养缺乏, 细胞的生长繁殖受到限制,几乎所有的细 胞都停止生长; 2)然后再将细胞转移到新鲜的培养液中,进 行悬浮培养,则细胞几乎同步地开始生长繁 殖。
1. 平板培养法
●概念:将制备好的单细胞悬浮液,按照一定
的细胞密度,接种在1mm的薄层固体培养基 上进行培养,称之为平板培养。
●由Bergman1960年首创的,其目的是
为了获得单细胞系 ,并研究其生理 生化和遗传上的规律。
特
• 自一个单细胞。 •
植物细胞培养

植物细胞培养植物细胞培养是一项重要的生物学研究技术,通过将植物细胞放入适宜的培养基中,提供适宜的养分和生长条件,使其在无菌条件下进行繁殖和生长。
这项技术在植物生物技术和植物育种研究中有着广泛的应用,可以用于植物组织培养、植物再生、基因工程、植物病毒研究等方面。
接下来,我将详细介绍植物细胞培养的原理、步骤、方法及其应用。
一、植物细胞培养的原理植物细胞培养的原理是利用植物细胞的分裂和再生能力,在培养基上形成功能完整的植株。
培养基中提供的养分和生长因子可以满足植物细胞的营养需求,而适宜的温度和光照条件则有利于细胞分裂和再生。
在无菌条件下进行培养,可以避免外界的微生物污染和干扰,保证细胞培养的成功率。
二、植物细胞培养的步骤植物细胞培养主要包括材料准备、杀菌、建立无菌培养条件、组织处理、细胞培养和植株再生等步骤。
1.材料准备:选择适宜的植物材料,如幼苗的茎尖、子叶、胚乳、花药等作为外植体。
同时准备培养基、培养器具和培养条件所需的试剂和设备。
2.杀菌:将外植体浸泡在含有杀菌剂的溶液中,进行表面消毒,以去除外植体表面的细菌和真菌。
3.建立无菌培养条件:在无菌操作台上进行操作,使用无菌培养器具和培养基,保持操作环境的无菌状态。
4.组织处理:将外植体切割成适当的大小,要求每个组织片段都含有足够的细胞和组织分化能力。
5.细胞培养:将组织片段放置在含有适宜濃度的培养基中,提供适宜的养分和生长因子,调节温度和光照条件,使细胞进一步分裂和分化。
6.植株再生:当细胞分裂和分化达到一定程度时,可以通过调节培养基的成分和添加适宜的激素来诱导细胞形成胚乳、芽和愈伤组织,最终形成功能完整的植株。
三、植物细胞培养的方法植物细胞培养可以通过不同的方法来实现,包括愈伤组织培养、悬浮细胞培养、胚愈伤组织培养等。
1.愈伤组织培养:将外植体的某些部位培养在含有适宜生长因子的培养基上,刺激组织的分裂和分化,形成愈伤组织,进而形成植株。
2.悬浮细胞培养:将植物细胞分散在液体培养基中,进行无瓶培养。
S9实验九 植物单细胞分离技术(理论)要点

实验九植物单细胞分离技术(理论)一、植物细胞培养概述指以单细胞(single cell)或细胞团(cell aggregate)为单位进行的植物组织培养方式。
1、技术特点:◆操作简单◆试验重复性好◆单次实验群体大2、培养的植物细胞的特点A、培养时生长速度慢B、直径为20 ~ 150um,比细菌大C、纤维素细胞壁非常脆弱D、生理与代谢活性低E、需求营养成分复杂F、不易于保存G、次生物质的合成与积累和细胞分化过程有关3、细胞培养液的性质◆培养液具有一定的黏度◆提供细胞生长发育所需的营养◆黏度随细胞浓度的增加而增大◆需不停搅拌而进行通气二、植物细胞悬浮培养(一)悬浮细胞培养的优点A、提供大量的均匀的植物细胞B、细胞增殖速度比愈伤组织快C、适宜大规模培养D、增加培养细胞与培养液的接触面,改善营养供应E、避免有害物质的过分积累F、保证氧的充分供给(二)悬浮培养细胞的建立与测定1、诱导建立诱导细胞悬浮培养的方法A、选择一块易破碎的愈伤组织,转移到适合的培养液中,经1~2个周期振荡培养,得到呈分散状的细胞培养物。
B、选择有用的培养材料,进行匀浆处理,过滤,转入液体培养基中培养。
C、选择有用的材料多次转移与液体振荡培养,得到分散程度高的细胞。
悬浮培养的材料:愈伤组织的疏松程度、分散效果的好坏。
2、生长与增殖扩增曲线:◆S形◆延迟期、对数生长期、平台期、衰减期悬浮培养细胞起始浓度:◆一般在0.5 ×105~2.5 ×105个/ml ◆悬浮培养的单个细胞,3~5d 可见分裂状况3、悬浮培养物的保持A、培养瓶◆100ml或250ml的三角瓶作容器◆装20ml或50ml的培养液B、振荡培养装置◆旋转式摇床◆转速控制在120r/min以下◆体积不宜过大,温度可调C、继代培养◆定期继代培养,最适周期为1~2周◆继代时间为1周的可用1:4的接种量◆继代时间为2周的可用1:10的接种量◆移液管口径可稍大,易吸取细胞◆接种前后要用酒精灯灼烧瓶口◆定期检查是否有微生物污染4、生长测定◆对任何一建立细胞系都应进行生长动态测定◆不同培养基及不同条件,细胞的最大生长速率可由细胞数、细胞干重或细胞蛋白的对数对培养时间作坐标而测定◆临界起始浓度:低于此值,细胞无法生长,略高于此值,则延迟期伸长§常用的生长测定方法A、细胞计数血球计数板:计算公式:细胞数/ml = 5大格内细胞总数×5× 104 ×稀释倍数B、细胞体积◆一定量的细胞悬浮液放入15ml刻度的离心管中离心◆以每毫升培养液中细胞体积的毫升数来表示细胞体积C、细胞的鲜重与干重◆将一定量的细胞悬浮液加到预先称重的尼龙布上,用水冲洗并抽滤,然后称重◆测干重时,将离心收集的细胞转移到预先称重的定量滤纸上,然后80℃烘箱内10 ~ 12h,在干燥器中冷却称重◆细胞鲜重与干重一般以每毫升悬浮培养物的重量表示(三)悬浮培养工艺1、成批培养把细胞接种到一个与外界隔绝的只允许气体和挥发性的代谢物质交换的、营养液体积保持不变的密闭系统中培养。
实验六 真菌的形态结构观察

实验六真菌的形态结构观察一、实验目的1.了解真菌的形态特征和结构;2.能够正确的取样、移植、培养、观察真菌。
二、实验原理真菌是一类单细胞或多细胞的生物,特征是:无光合作用,不产生氧气,不含胆固醇,细胞壁主要由纤维素组成。
1.真菌的分类(1)单细胞真菌:酵母菌(Saccharomyces cerevisiae);(2)多细胞真菌:接合菌(Mucor,Candida);(3)真菌细胞的结构外部结构:真菌细胞由细胞壁和细胞膜组成,细胞壁主要由纤维素组成,内部结构比较复杂;内部结构:真菌细胞的细胞质内含有大量的线粒体、内质网、高级别。
真核细胞中的酶除了线粒体外都存在于基粒内,其中许多蛋白质与真菌细胞壁的合成有关。
菌丝:真菌的细胞排列成长针-旗骨离散的菌株就叫菌丝体。
应该说多数真菌就是由菌丝体组成,它是真菌营养生长的主要状态。
菌丝体分两种:附着菌丝和游离菌丝,前者直接附着在菌体和器官表面,在形成分生孢子和生殖器官时具有特殊功能;后者在菌体内部自由延伸,是真菌的营养体。
三、实验所需仪器材料显微镜、手工切片刀、无菌显微镜盖玻片、无菌移液管、无菌移液球头、无菌培养皿、无菌培养基、酵母菌(或红曲菌)。
四、实验内容及步骤1.样品的取样及培养(1)取一小块酵母菌固体培养基,用无菌移液管取一点准备用于制备手工切片。
取一小颗干燥的红曲菌附贴于无菌显微镜盖玻片或无菌培养皿,加一滴蒸馏水,封好后放置于28℃下静置。
(2)将酵母菌固体培养基化开于无菌平板培养基上,在37℃下培养;(3)将红曲菌培养于液态培养基中,28℃下振荡培养1周。
2.取菌样(1)用无菌移液球头将少许酵母菌菌落,挤入一滴50%甘油中,搅拌至仔细混合,直到小颗粒完全分散于甘油中;(2)用无菌移液球头沾取一小颗红曲菌菌落,放入至少2ml的蒸馏水中,振摇均匀。
3.制备手工切片(1)将步骤2中的甘油溶液滴在无菌显微镜盖玻片上,加一滴蒸馏水使其完全平均。
(2)将红曲菌的蒸馏水液沿玻片边滴入,用无菌移液管挤出一滴,放置5-10分钟,待红曲菌的细胞凝聚在玻片上。
植物细胞培养

45
5、继代的方法和最佳时期
继代方法:
用注射器或移液管吸取一定量的含单细 胞和小细胞团的悬浮培养物,并移到含有 新鲜培养基的培养瓶里,继续进行培养。
46
继代
47
最佳继代时期:
了解细胞数目增长变化S形曲线后, 选择对数生长期和直线生长期!
(3)将分离出的单个细胞接种到培养基的滤纸上。 (4)恒温培养。
28
3、要求:
(1)看护愈伤组织处于活跃生长状态; (2)愈伤组织和所要培养的细胞可以是同一个物 种,也可以不同。
离体单细胞在直接培养技术下不分裂,看护培养 下则分裂,为什么?
因为看护愈伤组织提供了营养和 其他的促进细胞分裂的物质。
初始植板密度应根据培养基的营养状况而改变,培 养基越复杂则植板细胞的临界密度越低,反之则相反。 一般要求每毫升在1000个细胞以上。
35
3、生长激素
加1种细胞分裂素和几种氨基酸。临界密 度只需25-30细胞/毫升。
4、pH
5、CO2
36
第三节 悬浮培养
Suspension culture
一、特点
单细胞培养 (单细胞克隆)
3
植物细胞不同于微生物的特点
• 生长速度较慢; • 细胞较大,常结合成聚集体; • 细胞壁脆弱; • 生理代谢活性较低; • 所需培养基复杂; • 稳定性差,容易变异; • 次生物质的积累与细胞分化过程有关
4
初生代谢产物&次生代谢产物
• 初生代谢产物(primary metabolites)是指糖、 蛋白质、脂类和核酸等这些对植物有机体生命 活动来说不可缺少,且几乎存在于所有绿色植 物中的物质。
8 第八讲(3) 植物单细胞培养技术

3.3 微室培养法
程 序: 1 借助于微型移液管从 细胞悬浮液中提取适量单 细胞悬浮液 ,置于一张无 菌载片上。在这滴培养液 四周与之隔一定距离加上 一圈石蜡油,构成微室的 ”围墙”,在围墙左右两 侧再各加一滴石蜡油,每 滴之上置一张盖片作为微 室的“支柱”。
3.3 微室培养法
程 序: 2 将第三张盖片架在两个“支 柱”之间,构成微室的“屋 顶” 3 单细胞悬浮液在微室中
3.1 平板培养法
程 序: 2 单细胞悬浮液的密度调整
要求:调整后的密度为植板细胞密度的2倍 调整方法:①如果密度过大,加入液体培养基进行 稀释; ②如果密度小,通过低速离心使细胞沉 降后,再加入适量液体培养基。
3.1 平板培养法
程 序: 3 固体培养基的配制
当细胞植板密度过高(104或105个/ml),使用和 在悬浮培养中或愈伤组织培养中成分相似的纯合 成培养基 当细胞植板密度过小,细胞对培养基的要求 就变得越加复杂 注意:要选择适合单细胞培养的培养基
植物单细胞培养技术
周口师范学院生命科学系
1 植物单细胞培养的意义
1.1 有利于观察细胞个体的分裂、分化、生长和繁 殖情况; 1.2 有利于获得纯细胞系; 1.3 有利于进行细胞特性、细胞生长规律、细胞代 谢过程及其调节控制规律等方面的研究; 1.4 有利于生物转化和天然化合物的生产。
2 植物单细胞的分离技术
3.2 看护培养法
程 序: 3 借助于微型移液管从细胞 悬浮液中提取适量单细胞 悬浮液 ,然后接种在无菌 滤纸上面。 4 将在滤纸上由单细胞形成的 细胞团转移到新鲜的固体培 养基中进行继代培养,获得 由单细胞形成的细胞系。
为什么有愈的存在给单细胞传递了某些生物信息 2 愈伤组织为细胞的生长繁殖提供了某些物质条件
单细胞培养的方法

单细胞培养的方法单细胞培养,听起来是不是超级酷呢!这就像是在微观世界里进行一场独特的冒险。
你知道吗,单细胞培养就像是在为一个小生命打造一个专属的温馨小窝。
我们要小心翼翼地呵护着它,给它提供最适宜的环境,让它能茁壮成长。
首先呢,选择合适的培养基可太重要啦!这就好比是给小细胞准备的美味大餐,得营养丰富又合它口味。
不同的细胞就像不同的小朋友,有着各自的喜好和需求。
有的喜欢甜一点的,有的喜欢酸一点的,我们得摸准它们的脾气。
然后呢,无菌操作那可是必须严格执行的呀!这就像是给小细胞打造一个纯净的世界,不能有任何杂质和污染来打扰它。
一点点细菌或者灰尘都可能让我们的努力白费呢,那可不行!还有啊,培养条件也得精心调控。
温度啦、湿度啦、氧气含量啦,都得恰到好处。
这就像给小细胞创造一个四季如春的舒适环境,让它能舒舒服服地生活。
再来说说接种吧,这可是个精细活儿。
要轻轻地把单细胞放到它的新家——培养基里,不能太粗鲁哦,不然会吓到它的。
培养的过程中,我们要时刻关注着小细胞的状态,就像妈妈时刻关注着宝宝一样。
看看它有没有吃饱喝足,有没有健康成长。
要是发现有什么不对劲,得赶紧想办法解决呀!你说这像不像在照顾一个小宝贝?单细胞培养可不就是这样嘛,需要我们的耐心和细心。
反问一下,要是我们不用心,怎么能让这些小细胞茁壮成长呢?当我们成功培养出健康的单细胞时,那种成就感简直无与伦比!就好像我们创造了一个小小的奇迹。
这就是单细胞培养的魅力所在呀,让我们能深入到微观世界,探索生命的奥秘。
总之,单细胞培养是一项充满挑战和乐趣的工作。
它需要我们的专业知识,更需要我们对生命的敬畏和热爱。
让我们一起努力,在这个微观的领域里创造更多的精彩吧!。
单细胞培养
成分 数量(mg· L-1)
NH4NO3 600 MgSO4· 7H2O 300 KI 0.75 MnSO4· H 2O 10.00 CoCL2· 6H2O 0.025 葡萄糖 68400 鼠李糖 125 核糖 125 甘露醇 125 柠檬酸 10 肌醇 100 氯化胆碱 0.5 盐酸硫胺素 10 维生素A 0.005 P-对氨基苯甲酸 0.01 水解酪蛋白 125
• 优点:简便、成功率高 • 缺点:不能在显微镜下直接观察
3)饲养培养(feeder layer culture):
•原理:平板法+看护法 •评价:单细胞和原生质体培养的理想方法。 注:饲养层细胞没有种属特异性。
4)微室培养(microchamberculture) 人工制造一个小室,将单细胞培养在小室 中的少量培养基上,使其分裂增殖形成细 胞团的方法,称为微室培养法。此法首先 是由Jones等(1960)设计
细胞密度和植板率
I 细胞密度:指单位体积内的细胞数量,是影响 细胞培养的关键因子。
平板培养要求保证细胞密度为10
4
-10
5
个/ml 。
II平板培养的效果用植板率来衡量。
植板率(plate efficiency) :能长出细胞团的 单细胞在接种单细胞中所占的比例。 PE =平板中新形成的细胞团数/平板中接种的细胞数 ×100%
液体培养
悬浮细胞
过筛
要求:松散性好,增殖快,再生能力强。其外观 一般是鲜艳的乳白或淡黄色,呈细小颗粒状,松 散易碎。
适于悬浮培养
适于再生植株
将愈伤组织在液体培养基中培养,建立悬浮培养物
优点:细胞团成小细胞团或单细胞;在培养基 中均匀分布;有空气交流。 注:由愈伤组织分离单细胞的关键是获得均一、 松散的适合悬浮培养的愈伤组织
单细胞培养技术

姓名:QQ 姓名: 学号: 学号:09081703210005
Bergman在1960年首创的 Bergman在1960年首创的 平板培养法: 平板培养法:分散的植物细胞接种于含薄 层固体培养基的培养皿内的培养过程 一般来说,是将配置好的单细胞悬浮液, 一般来说,是将配置好的单细胞悬浮液, 按照一定的细胞密度(通常为 按照一定的细胞密度(通常为103~105个 /ml),接种在1mm厚的薄层固体培养基上进 /ml),接种在1mm厚的薄层固体培养基上进 接种在1mm 行培养
为了便于计数可以在培养基底部垫一张坐标纸便于计数可以在培养基底部垫一张坐标纸然后在放大镜下数出坐标纸的每一个小方格然后在放大镜下数出坐标纸的每一个小方格中的细胞团数目将几个小格中的细胞团数中的细胞团数目将几个小格中的细胞团数汇总即为平板上的细胞团数汇总即为平板上的细胞团数
单细胞培养技术单细胞培养技术平板培养
植板率= 每个平板上形成的细胞团数/ 植板率=(每个平板上形成的细胞团数/每个 平板上接种的细胞总数)×100% 平板上接种的细胞总数) 平板上形成的细胞团数需要直接计量。为了 平板上形成的细胞团数需要直接计量。 便于计数,可以在培养基底部垫一张坐标纸, 便于计数,可以在培养基底部垫一张坐标纸, 然后在放大镜下数出坐标纸的每一个小方格 中的细胞团数目,将几个小格中的细胞团数 中的细胞团数目, 汇总, 汇总,即为平板上的细胞 培养基 侧面观
含有单细 胞和细胞 聚集体的 滤出液
熔化的 White 琼脂培 养基
优点:在培养基中分布均匀,便于在显微 优点:在培养基中分布均匀, 镜下对细胞进行定点观察,是单细胞株筛选 镜下对细胞进行定点观察, 和突变体筛选的常用方法。 和突变体筛选的常用方法。 缺点:通气差,排泄物容易积累而造成细胞 缺点:通气差, 毒害
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验六植物单细胞培养
实验目的:学习常用植物单细胞培养的方法
实验原理:在适宜的条件下,一个来自已分化的根、茎、叶等组织的细胞,经过离体培养可以发育成同其亲本一样的完整植株。
植物组织培养技术的重要理论基础是植物细胞的全能性。
实验用具:净化工作台,镊子、移液枪、涂布器、摇床。
实验步骤:
1、制作用于单细胞培养的培养基
2、将愈伤组织进行振荡培养,使其分散成小的细胞团或单细胞,然后用适
当孔径的不锈钢筛网过滤,除去大的细胞团和残渣,离心除去小的残渣,得到单细胞悬浮液。
3、平板培养法:单细胞悬浮液的制备(外植体、愈伤组织、原生质体)→单
细胞悬浮液的密度调整(调整后的密度为植板细胞密度的2倍)→固
体培养基的配制→单细胞悬浮液与固体培养基等量混合→暗培养
(培养期间对细胞频繁的镜检会对细胞的生长产生有害作用,应尽量减
少镜检次数)→继代培养(选取生长良好的由单细胞形成的细胞团,
可以获得由单细胞形成的细胞系)。
特点:操作简便,分离单细胞系较容
易,但培养细胞气体交换不畅。
4、液体培养:分离方法同“3”液体浅层培养。
优点:操作简单,对原生
质体的损伤小,且易于添加新鲜培养基和转移培养物。
缺点:原生质体
分布不均匀,常常发生原生质体之间的粘连现象而影响其进一步的生长
和发育。
此外,难以跟踪观察某一个细胞的发育情况。
作业:每隔2~4h观察各自培养的结果,会出培养结果图。
