鲍林定律PPT讲解
晶体结构基本规则

0.18
0.23
0.37
0.715 NaCl
0.654 NaCl
0.577 NaCl
NaCl
NaCl
立方ZnS
6
6
4
0.225~0.414,4配位 0.414~0.732,6配位
五、鲍林法则(Pauling`s rules)
1928年,鲍林在总结大量实验数据的基础上, 归纳和推引了关于离子晶格的五条规则。这些 规则在晶体化学中具有重要的指导意义,人们 称这些规则为鲍林法则。
六方最紧密堆积--ABABAB
四面体空隙:Q与位于其下层的三个球;1-2-Q与下层的等大球; 3-4-Q与下层的等大球; 5-6-Q与下层的等大球;共形成4个四面 体空隙。如在第三层上再放一层,则总共是8个四面体空隙。
面心立方最紧密堆积--ABCABC
四面体空隙:Q与位于其下层的三个球;1-6-Q与下层的等大球; 5-4-Q与下层的等大球; 2-3-Q与下层的等大球;共形成4个四面 体空隙。如在第三层上再放一层,则总共是8个四面体空隙。
(2)晶体中组成质点大小不同,反映了离 子半径比值r+/r-不同,因而配位数和晶体结 构也不同。
(3)晶体中组成质点大的极化性能不同,反 映了各离子的极化率不同,则晶体的结构也 不相同。
离子的极化
离子极化------离子晶体中,每个离子都处在周 围离子所形成的电场作用下。在周围电场作用 下,离子的电子云发生变形,这一现象称为离 子极化。
算得到:
a0 = 2r+ + 2r- = 2(0.133) + 2(0.181) = 0.628 nm
a0 = 0.363 nm
极化力是指一个离子对它周围离子所产生的电 场强度,它反映了离子极化其它离子的能力。
鲍林规则 离子晶体结构PPT文档共20页

60、人民的幸福是至高无个的法。— 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
鲍林规则 离子晶体结构
56、极端的法规,就是极端的不公。 ——西 塞罗 57、法律一旦成为人们的需要,人们 就不再 配享受 自由了 。—— 毕达哥 拉斯 58、法律规定的惩罚不是为了私人的 利益, 而是为 了公共 的利益 ;一部 分靠有 害的强 制,一 部分靠 榜样的 效力。 ——格 老秀斯 59、假如没有法律他们会更快乐的话 ,那么 法律作 为一件 无用之 物自己 就会消 灭。— —洛克
鲍林规则与价键理论

资源共享。
感谢各位同学的文字输入〔真正体会到了人多速度快〕,并在此特别感谢马艺闻教师的校对与修正。
?鲍林规那么与价键理论?第一章鲍林规那么§1历史背景与概括1926至1927年间戈尔德施米特〔〕在简单离子化合物构造资料的根底上提出了他的晶体化学定律:晶体的构造取决于组成者的数量关系、大小关系与极化性能..........................[1]。
这一定律抓住了晶体化学的根本要领,思路相当明晰。
但它主要用于二元化合物,对诸如硅酸盐等复杂化合物它虽然正确,却失之过于笼统、不详细,指导作用有甚大局限。
在这个时期,布喇格〔〕[2]和鲍林〔〕在硅铝酸盐的晶体化学研究上获得很大的成就。
1928和1929年间鲍林在戈尔德施米特定律的根底上,结合大量复杂多样含氧酸盐的晶体构造信息,总结了一整套关于离子化合物晶体构造的规那么[3]。
这些规那么将无机化合物晶体化学的研究概况上升到一个新的高度。
在鲍林规那么的表述中,突出了形成离子配位多面体的原理及制约配位多面体互相连结........................的规律.....................,同时也联络离子晶体构造的稳定性问题。
它将离子晶体构造看作是按照一定方式连结起来的配位多面体的集合............,这种配位多面体以正离子为核心而取诸配位负离子的中心为其顶点。
换言之。
可将正离子周围形成的负离子配位多面体看作是根本的“构造元件〞,对“构造元件〞按一定规那么进展“组装〞那么形成离子晶体。
鲍林第一规那么主要涉及配位多面体的几何、物理特性。
第二规那么〔电价规那么〕涉及多面体共用棱和面将降低构造稳定性的问题。
第四规那么涉及怎样的多面体倾向于不共用其多面体几何元素的问题。
第五规那么那么要求同种离子或离子基团在离子晶体构造中结合方式的类别趋于最少。
在这几项规那么中前两项规那么最为重要,它们是这一套规那么的核心。
鲍林规那么乃是大量实测立体构造信息与对晶体能量研究相结合的成果。
《朗伯比尔定律》课件

Hale Waihona Puke 谢谢THANKS光衰减是指光在介质中传播时,因介质对光线的吸收和散射作用而使光线强度逐渐减小的现象。
朗伯比尔定律中的光衰减与物质浓度和光程长度有关,浓度越高、光程越长,光衰减越强。
光衰减是朗伯比尔定律的重要基础,通过测量光衰减可以推算物质浓度。
朗伯比尔定律的应用
朗伯比尔定律是颜色混合的重要理论基础,通过该定律可以理解不同波长的光线如何混合形成各种颜色。
《朗伯比尔定律》ppt课件
目录
CONTENTS
朗伯比尔定律概述朗伯比尔定律的原理朗伯比尔定律的应用朗伯比尔定律的实验验证朗伯比尔定律的扩展与改进朗伯比尔定律的案例分析
朗伯比尔定律概述
总结词
朗伯比尔定律是一种描述光的吸收和散射与物质浓度的关系的定律,其公式为A=kcl。
详细描述
朗伯比尔定律定义了光吸收与物质浓度的关系,其中A表示吸光度,k表示吸收系数,c表示物质浓度,l表示光程长度。
通过颜色混合的案例,展示朗伯比尔定律在颜色合成方面的应用。
详细描述
介绍红、绿、蓝三原色如何通过不同比例混合得到各种颜色,并解释这一过程中朗伯比尔定律的作用。说明不同颜色光的发光强度与其对应浓度的关系,以及如何通过实验测量颜色的光谱分布。
通过颜色测量的案例,展示朗伯比尔定律在颜色定量分析中的应用。
总结词
颜色混合
利用朗伯比尔定律,可以精确地匹配和复制特定的颜色,这对于印刷、摄影、电视和电影制作等行业至关重要。
颜色匹配
在图像处理和视频编辑中,朗伯比尔定律用于调整图像的色彩平衡,确保颜色准确性和一致性。
颜色校正
基于朗伯比尔定律,科学家和工程师设计了各种颜色测量仪器,用于测量物体表面的颜色。
高中生物 1.1《分离定律》课件 浙教版必修2

第二,豌豆成熟后籽粒都留在豆荚中, 便于观察和 计数;
第三,豌豆具有多个稳定的,可区分 的性状。
精选ppt
异花授粉: 两朵花之间的授粉过程。
自花授粉: 两性花的花粉,落到同一朵花 的雌蕊柱头上的过程。
闭花授粉: 花在未开放时,雄蕊花药中的花粉 传到雌蕊的猪头上,传粉后花瓣才 展开,即开花。
孟德尔豌豆杂交实验的结果
精选ppt
在一对对性状的杂交实验中, F2为何辉出现性状分离现象呢? 为何紫花和白花的比例接近3:1呢?
精选ppt
游戏环节
随机抓取20次, 请同学们统计结果, 出现了几种字母组合? 每种组合的比例是多少呢?
精选ppt
孟德尔通过试验和统计,分析大胆的对分析现 象提出了如下假说:
生物:1.1《分离定律》 课件PPT(浙教版必修2)
精选ppt
精选ppt
猜猜讲的是谁
八年耕耘源于对科学的痴迷, 一畦畦豌豆蕴藏遗传的秘密。 实验设计开辟了研究的新路, 数学统计揭示出一串的规律。
精选ppt
——遗传学的奠基人
精选ppt
为什么用豌豆 做遗传实验容易取得成功?
精选ppt
用豌豆作为实验材料的理由
植物体中自花授粉和雌雄异花的同株授粉。 广义上讲,遗传因子组成相同的个体间交配均课程自交。 自交是获得纯合子的有效方法。
精选ppt
显性性状: 孟德尔把杂种子一代中显现出来的性状,如紫花;
隐性性状: 把未显现出来的性状,如白花。
精选ppt
×P高Fra bibliotek矮×
F1
高
F2
高
矮
结构矿物学 2011-04 晶体结构稳定性

电价规则:稳定离子结构的离子电价等于 与其相邻异号离子的各静电键强度的总和
鲍林(Pauling)规则
• 2nd Rule:电价规则 如NaCl
6 ( + 1/6 ) = +1 (sum from Na’s) charge of Cl = -1
+ 1/6
Na + 1 /6 Na
+ 1 /6
Cl
Na
结构矿物学(4/10)
北京大学 秦善
2011.11
晶体结构的稳定性
晶体结构的稳定性
晶体结构稳定性规则
吉布斯自由能 戈尔德施密特定律 鲍林规则
温度的影响 压力的影响 化学组成的影响
固溶体 类质同像 型变
吉布斯自由能
The Gibbs Free Energy dG = VdP – SdT
-
Na
+ 1 /6
鲍林(Pauling)规则
• 2nd Rule:电价规则
如 [CO3]-2 • C+4的CN = 3,静电键强=4/3 • 每一个O2-贡献4/3即平衡 • 每一个O2-剩下2/3电荷,所 以[CO3]-2
鲍林(Pauling)规则
3rd Rule: 多面体规则
The sharing of edges, and particularly of faces, of adjacent polyhedra tend to decrease the stability of an ionic structure
600 1000 1400 1800 2200 2600
Liquid
After Swamy and Saxena (1994) J. Geophys. Res., 99, 11,787-11,794.
鲍林规则

§1-4 鲍林规则
1、鲍林第一规则---负离子配位多面体规则 每一个正离子周围必然形成一个负离子多面体,正
、负离子间的距离取决于正、负离子半径和,而配位 数则取决于正、负离子半径比。(即形成何种配位多 面体)
这条规则从几何角度表现了晶体结构的稳定性。
‹#›/228
§1-4 鲍林规则 § 1-3 鲍林规则
例1:根据半径比推算AB型离子晶体的结构类型。 LiF、TlCl、ZnSe Li+:60pm,Tl+:147pm,Zn2+:74pm F-:136pm,Cl-:181pm,Se2-:198pm LiF r+/r-=60pm/136pm=0.44,配位数为6,属NaCl型 TlCl r+/r-=147pm/181pm=0.81,配位数为8,属CsCl型 ZnSe r+/r-=74pm/198pm=0.37,配位数为4,属ZnS型
‹#›/228
§1-4 鲍林规则 § 1-3 鲍林规则
例3:AgCl,AgBr,AgI是什么结构? AgCl、AgBr中Ag+的配位数都是6,属于NaCl型; AgI中Ag+的配位数都是4,属于立方ZnS型。 这是由于离子间很强的极化作用,使离子间强烈靠近, 配位数降低,结构类型发生转变。I-的变形性大于Cl和Br-。
(2) 质点大小不同,晶体结构也不同。(大小关系) (3) 质点的极化性能不同,晶体结构也不同。(极化作用)
‹#›/228
§1-4 鲍林规则 § 1-3 鲍林规则
(1)组成晶体结构的化学式类型不同,晶体的结 构就不同 化学式表示了原子的种类和数量关系。无机化 学 中 按 化 学 式 , 如 NaCl 、 TiO2 、 Al2O3 、 BaTiO3 、 MgAlO4 等 类 型 分 为 AX 、 AX2 、 A2X3、ABO3、AB2O4。其中A、B均代表正离 子,X代表负离子, O代表氧离子。
鲍林规则晶格课件

02
鲍林规则晶格的构造
构造方法一
总结词
基于原子间相互作用
详细描述
鲍林规则晶格的构造方法一基于原子间相互作用,通过原子间的键合关系确定 晶格结构。这种方法考虑了原子间的电子云重叠和交换作用,能够准确地描述 晶格的稳定性。
构造方法二
总结词
基于量子化学计算
详细描述
鲍林规则晶格的构造方法二基于量子化学计算,通过计算原子间的相互作用能来 确定晶格结构。这种方法能够更精确地描述晶格的电子结构和能量状态,对于理 解晶格的物理和化学性质具有重要意义。
光学性质
鲍林规则晶格的光吸收、 光散射等光学性质,与晶 格中原子的振动模式有关 。
磁学性质
鲍林规则晶格的磁学性质 ,如磁化率、磁矩等,与 晶格中原子的电子结构有 关。
化学性质
化学键合
鲍林规则晶格中的原子通过共价 键、离子键或金属键等方式相互
连接,形成稳定的晶体结构。
化学活性
鲍林规则晶格的化学活性,如反应 速率、反应机理等,与其原子间的 相互作用密切相关。
总结词
鲍林规则晶格在表面科学领域的应用
详细描述
表面科学是研究物质表面原子结构、性质和 行为的科学。鲍林规则晶格在表面科学领域 具有重要的应用价值。通过研究表面原子在 鲍林规则晶格上的排列和行为,可以深入了 解表面现象和反应机制,为表面改性、催化 剂设计等领域提供理论支持和实践指导。
06
鲍林规则晶格的发展前景与挑战
构造方法三
总结词
基于实验数据和模拟
详细描述
鲍林规则晶格的构造方法三基于实验数据和模拟,通过对比实验数据和模拟结果来确定晶格结构。这种方法能够 综合考虑实验观测和理论计算的结果,提高构造晶格结构的准确性和可靠性。
科学大师-鲍林

欧洲游学 索未菲实验室 德国 玻尔实验室 丹麦哥本哈根
薛定谔和德拜实验室 瑞士苏黎世大学
鲍林对量子力学有了极为深刻的了解,坚定了他用量子力学方法解决化学 键问题的信心。鲍林从读研究生到去欧洲游学,所接触的都是世界第一流 的专家,直接面临科学前沿问题,这对他后来取得学术成就是十分重要的。
1930年,鲍林再一次去欧洲,到布术,回国后,被加州理 工学院聘为教授
加州理工学院
导师是著名化学家诺伊斯 鲍林在加州理工学院,经导师介绍,还得到了迪肯森、托尔曼的精心指导, 迪肯森精通放射化学和结晶化学, 托尔曼精通物理化学,这些导师的精心指 导,使鲍林进一步拓宽了知识面,建立了合理的知识结构。1925年,鲍林以 出色的成绩获得化学哲学博士。他系统地研究化学物质的组成、结构、性质 三者的联系,同时还从方法论上探讨了决定论和随机性的关系。他最感兴趣 的问题是物质结构,他认为,人们对物质结构的深入了解,将有助于人们对 化学运动的全面认识。
Vitamin C
Pauling's book, How to Live Longer and Feel Better, advocated the very high intake of Vitamin C.
这场围绕维生素C的大论战已延续了20多年,至今余波未了。论战一方的当事人莱纳 斯.鲍林是惟一一位先后两次获得诺贝尔奖的科学家,但他却被称为是“最受尊敬和 最受嘲弄的科学家”,其主要的原因就在于他极力主张超大剂量服用维生素C。 引发论战的人 1994年8月19日,美国著名学者莱纳斯.鲍林(Linus Pauling)以93岁高龄 在他加利福尼亚州的家中逝世。“美国之音”在播发他逝世的消息时说道:“鲍林先 生是惟一一位先后两次单独获得诺贝尔奖的科学家。”鲍林曾被英国《新科学家》周 刊评为人类有史以来20位最杰出的科学家之一,与牛顿、居里夫人及爱因斯坦并肩。 爱因斯坦昔日曾由衷地称赞鲍林:“此人是真正的天才。”然而,路透社在报道鲍林 逝世的消息时却说,他是“本世纪最受尊敬和最受嘲弄的科学家之一”。 一个“最受尊敬”的科学家之所以“最受嘲弄”,在于他提出了对维生素作用的 新观点,尤其是主张超大剂量服用维生素C。鲍林自称是“化学家、物理学家、结晶 学家、分子生物学家和医学研究者”,他不是医生。可他偏偏引发了医学领域一场旷 日持久的大论战。
朗伯-比耳定律35页PPT

•
27、法律如果不讲道理,即使延续时 间再长 ,也还 是没有 制约力 的。— —爱·科 克
•
28、好法律是由坏风俗创造出来的。 ——马 克罗维 乌斯
•
29、在一切能够接受法律支配的人类 的状态 中,哪 里没有 法律, 那里就 没有自 由。— —洛克
•
30、风俗可以造就法律,也可以废除 法律。 ——塞·约翰逊
朗伯-比耳定律
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功,谁就会和我一样成功。——莫扎特
《朗伯比尔定律》课件

THANK YOU
图像处理与计算机视觉
图像处理
朗伯比尔定律用于图像处理中的颜色分析和 转换,例如将彩色图像转换为灰度图像或进 行颜色空间的转换。
计算机视觉应用
在计算机视觉领域,朗伯比尔定律用于图像 分析和理解,例如物体识别、场景分类和目 标跟踪等。
04
朗伯比尔定律的实验验证
实验设备与材料
光源
单色光源或宽带光源
样品池
颜色匹配
利用朗伯比尔定律,颜色科学家可以精确地 匹配不同材料或产品的颜色,确保产品外观 的一致性和准确性。
颜色测量
通过测量物体对不同波长光的反射率,利用 朗伯比尔定律计算出物体的颜色,广泛应用
于化妆品、纺织品和印刷行业。
环境监测的应用案例
要点一
大气污染监测
朗伯比尔定律可以用于测量大气中各种污染物的浓度,如 颗粒物、二氧化硫等,帮助环境监测机构评估空气质量。
《朗伯比尔定律》ppt课件
• 朗伯比尔定律概述 • 朗伯比尔定律的原理 • 朗伯比尔定律的应用 • 朗伯比尔定律的实验验证 • 朗伯比尔定律的扩展与改进 • 朗伯比尔定律的实际应用案例
01
朗伯比尔定律概述
定义与公式
总结词
朗伯比尔定律是一种描述光的吸收和散射与物质浓度的关系的定律,其公式为 A=kcl。
02
朗伯比尔定律的原理
光的吸收与发射
总结词
描述光在物质中传播时,物质对 光的吸收和发射过程。
详细描述
光在物质中传播时,物质会吸收 特定波长的光,同时也会发射出 特定波长的光。物质的吸收和发 射特性与其分子结构有关。
光的散射与反射
总结词
描述光在物质中传播时,物质对光的 散射和反射过程。
鲍林规则.离子晶体结构ppt课件

2.电价规则(鲍林第二规则)
在一个稳定的离子型晶体结构中,每一个负离子的电价
Z-应该等于(或近似等于)其邻近的正离子到该负离子
的各静电键强度 S 的总和 Z
Si
(
Z n
)i
。
其中Si为第i种正离子静电键强度,Z+为正离子的电荷, n为其配位数。
静电键强度实际是离子键强度,也是晶体结构稳定性 的标志。
(3)属于CsCl结构:CsBr,CsI
9
2、NaCl型结构
11))鲍鲍林林规规则则:: ①第一规则: ①第一规则:
rNa rNa
0.095nm, r 0.095nm,Crl
Cl
0.181nm, r 0.181nm,r
r r
0.502.552,5 ,0.401.44-104.7-03.27,32C,NC+=N6=,6,
四个[CaF8] 共顶相连
③[CaF8]立方体可以共棱和共面相连,实际上共棱相连
12
(2)结构特点 立方晶系,面心立方点阵,把Ca2+作立方堆积,F占据全部四面体空隙,若F-作立方堆积,Ca2+只 占据一半的立方体空隙。 • 从空间格子观点看,一套Ca2+面心立方格子与两 套F-面心立方格子穿插而成。 晶胞内有4个CaF2分子。
正离子之间,有尽量互不结合的趋势(特别倾向于共顶相连)。 如硅酸盐晶体M2S,存在[MgO6]八面体,[SiO4]四面体,∵Si4+Si4+斥力>Mg2+- Mg2+∴[SiO4]孤立存在,[SiO4]与 [MgO6]共顶, 共棱相连,结构才稳定。 5.节约规则(鲍林第五规则) 在同一晶体中,同种正离子与同种负离子的结合方式应最大限 度地趋于一致。
材料化学05鲍林规则精品PPT课件

2.5.5 离子的极化
前面的讨论一直假定晶体中的离子可以视 作刚性的圆球。在这样的圆球中,带正电的原子 核位于球的中心位置,而带负电的电子则在围绕 原子核的圆球形轨道上旋转。正电荷的重心和负 电荷的重心在这一圆球中是重合的且位于圆球的 几何重心处。然而,当一个理想中的圆球形离子 处于实际晶体结构之中时,情况就会有所变化。
换。
对于一个特定的晶体结构类 型,这个级数收敛于一个常 数,称为马德隆常数。
EPi
Z Z e2 r0
6
12 2
8 3
6 4
24 5
在1 mol NaCl晶体中共有2NA个离子,而每个离子都与其他 离子发生相互作用,所以体系总的吸引能应为
2
N
A
Z Z e2 A r0
离子的有效半径:在离子晶体中一对相邻接触 的阴阳离子中心之间的距离就是这两个离子的 有效半径之和。
关于离子半径
阴阳离子中心之间的距离可以借助于 X 射线衍射分析 技术加以准确的测定,但是阴阳离子的分界线在什么 地方却难以判断。解决这一困难的方法之一就是对由 大量晶体测定的阴阳离子半径和进行比较分析。
U Z Z e2 N A A 1 1
r0
n
这个公式称为波恩兰德离子晶体晶 格能方程。
U Z Z e2 N A A 1 1
r0
n
晶格能的大小与离子晶体的物理性能之间有密切的关系。 一般说来,晶格能越大,晶体的硬度就越大,熔点越高, 热膨胀系数越小。
若不同的离子晶体具有相同的晶体构型 (A相同) 、相同的 阳离子电价和阴离子电价 (Z+、Z相同),则晶格能随r0 (也 相当于晶胞常数) 的增大而减小,相应的,晶体的熔点降低 而热膨胀系数增大;
鲍林定律ppt讲解[宝典]
![鲍林定律ppt讲解[宝典]](https://img.taocdn.com/s3/m/423a9e4a3a3567ec102de2bd960590c69ec3d8d6.png)
鲍林定律的历史背景与概况(见书第一页)1926至1927年间歌德施密特在简单离子化合物结构的基础上提出了他的晶体化学定律:晶体的结构取决于组成者得数量关系,大小关系与极化性能。
这一定律抓住了晶体化学的基本要领,思路相当清晰。
但它的主要用于二元化合物,对诸如硅酸盐等复杂化合物它虽然正确,却失之与过于笼统、不具体,指导作用有甚大局限。
在这个时期,布拉格和鲍林在硅铝酸盐的晶体化学研究上取得很大的成就。
1928至1929年之间把您在歌德施密特定律的基础上,结合大量复杂多样含氧酸盐的晶体结构信息,总结了一整套例子化合物晶体结构的规则。
这些规则将无机离子化合物晶体化学的研究概括和上升到一个新的高度。
鲍林第一规则配位多面体规则,其内容是:“在离子晶体中,在正离子周围形成一个负离子多面体,正负离子之间的距离取决于离子半径之和,正离子的配位数取决于离子半径比。
”第一规则实际上是对晶体结构的直观描述,如NaCl晶体是由[NaCl6]八面体以共棱方式连接而成。
鲍林第二规则电价规则指出:“在一个稳定的离子晶体结构中,每一个负离子电荷数等于或近似等于相邻正离子分配给这个负离子的静电键强度的总和,其偏差≤1/4价”。
静电键强度S=正离子数Z+/正离子配位数n ,则负离子电荷数Z=∑Si=∑(Zi+/ni)。
电价规则有两个用途:其一,判断晶体是否稳定;其二,判断共用一个顶点的多面体的数目。
例如,在CaTiO3结构中,Ca2+、Ti4+、O2-离子的配位数分别为12、6、6。
O2-离子的配位多面体是[OCa4Ti2],则O2-离子的电荷数,与O2-离子的电价相等,故晶体结构是稳定的。
又如,一个[SiO4]四面体顶点的O2-离子还可以和另一个[SiO4]四面体相连接(2个配位多面体共用一个顶点),或者和另外3个[MgO6]八面体相连接(4个配位多面体共用一个顶点),这样可使O2-离子电价饱和。
鲍林第三规则多面体共顶、共棱、共面规则,其内容是:“在一个配位结构中,共用棱,特别是共用面的存在会降低这个结构的稳定性。
8-9 鲍林近似能级图与科顿能级图-上传

第8 讲原子结构8-9 鲍林近似能级图与科顿能级图8-9 Paulinq’s Approximate Energy Level DiagramandCotton’s Energy Level Diagram多电子原子的轨道能级主量子数n 相同时,l 越大,能量越高;如:E<E3p < E3d3s角量子数l 相同时,n 越大,能量越高;如:E<E2s < E3s1s主量子数n 相同时,l 越大,能量越高;如:E3s <E3p < E3d角量子数l 相同时,n 越大,能量越高;如:E1s <E2s < E3s多电子原子的轨道能级能级交错主量子数n 和角量子数l 都不同,屏蔽效应和钻穿效应的综合结果,可能发生能级交错的现象,这种交错还随原子序数的递增而变化。
如:E4s <E3d,E5s <E4d < E6s < E4f < E5d等价轨道n、l 都相同的轨道能量相同(简并轨道)如:E2p x= E2p y= E2p z-同层的p、d、f 亚层-各有3、5、7 条等价轨道(简并轨道)意义:反映了与元素周期系一致的核外电子填充的一般顺序,图中的能级顺序是指价层电子填入电子各能级的顺序。
鲍林的近似能级图能量周期鲍林的近似能级图-电子填充顺序-根据顺序图,电子填入轨道时遵循下列次序:1s2s2p3s3p4s3d4p5s4d 5p6s4f5d6p7s5f6d7p科顿的原子轨道能级图ns和(n-1)d轨道、(n-1)d和(n-2)f轨道在一定原子序数范围内能量发生交错的变化◼科顿的原子轨道能级图•能量相近的能级分为一组——能级组•能级组的划分是导致周期表中化学元素划分为周期的原因知行合一、经世致用。
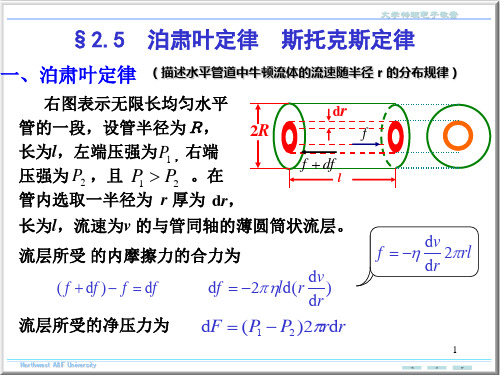
大学物理泊肃叶定律 斯托克斯定律ppt课件
土壤颗粒半径 r
9v 2.50105m
2( 0 )g
6
颗粒半径 r
9vT
2( )g
4
离心分离
因生物大分子半径很小,收尾速度vT 太小,无法实现沉降
分离。必须通过增大力场的办法使其的收尾速度达到要求。
B
O
C
以离心场替代重力场,所以 g 应由
ω
ω
ω 2 x取代,得出颗粒的收尾速度为
A C
vT
2 9
( 2 x)r 2
O
v
离心加速度经常用重力加速度的倍数来表示,
x
ω
粒子
以此表明离心机离心能力的大小。
沉降系数
S
vT
2x
dx
2 xdt
2
r2
S是单位离心加速度引起的沉积速度。
IS制中单位为秒(s).常用斯威德伯(S).
1 S = 10-13 s
5
例 如果土壤颗粒匀速下沉的距离 s = 0.150 m ,所用时间 t = 67 s , 80℃时土壤颗粒的密度ρ= 2.65×103 kg·m -3 ,水的密度 ρ0= 9.982×102 kg·m -3 , 粘滞系数η = 1.005×10 -3 Pa·s , 求 土壤颗粒半径。
牛顿流体中作低速运动的小球所受阻力的大小:
f 6 rv
r 式中 为牛顿流体的黏滞系数, 为小球
v 半径, 为小球相对于流体的速度。
测定流体的粘滞系数、进行沉降分离和离心分离。
沉降分离 三力平衡时有
4 3
r3
g
6
rvT
4 r3g
3
收尾速度
vT
2 9
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
鲍林定律的历史背景与概况(见书第一页)
1926至1927年间歌德施密特在简单离子化合物结构的基础上提出了他的晶体化学定律:晶体的结构取决于组成者得数量关系,大小关系与极化性能。
这一定律抓住了晶体化学的基本要领,思路相当清晰。
但它的主要用于二元化合物,对诸如硅酸盐等复杂化合物它虽然正确,却失之与过于笼统、不具体,指导作用有甚大局限。
在这个时期,布拉格和鲍林在硅铝酸盐的晶体化学研究上取得很大的成就。
1928至1929年之间把您在歌德施密特定律的基础上,结合大量复杂多样含氧酸盐的晶体结构信息,总结了一整套例子化合物晶体结构的规则。
这些规则将无机离子化合物晶体化学的研究概括和上升到一个新的高度。
鲍林第一规则
配位多面体规则,其内容是:“在离子晶体中,在正离子周围形成一个负离子多面体,正负离子之间的距离取决于离子半径之和,正离子的配位数取决于离子半径比。
”第一规则实际上是对晶体结构的直观描述,如NaCl晶体是由[NaCl6]八面体以共棱方式连接而成。
鲍林第二规则
电价规则指出:“在一个稳定的离子晶体结构中,每一个负离子电荷数等于或近似等于相邻正离子分配给这个负离子的静电键强度的总和,其偏差≤1/4价”。
静电键强度S=正离子数Z+/正离子配位数n ,则负离子电荷数Z=∑Si=∑(Zi+/ni)。
电价规则有两个用途:
其一,判断晶体是否稳定;
其二,判断共用一个顶点的多面体的数目。
例如,在CaTiO3结构中,Ca2+、Ti4+、O2-离子的配位数分别为12、6、6。
O2-离子的配位多面体是[OCa4Ti2],则O2-离子的电荷数,与O2-离子的电价相等,故晶体结构是稳定的。
又如,一个[SiO4]四面体顶点的O2-离子还可以和另一个[SiO4]四面体相连接(2个配位多面体共用一个顶点),或者和另外3个[MgO6]八面体相连接(4个配位多面体共用一个顶点),这样可使O2-离子电价饱和。
鲍林第三规则
多面体共顶、共棱、共面规则,其内容是:“在一个配位结构中,共用棱,特别是共用面的存在会降低这个结构的稳定性。
其中高电价,低配位的正离子的这种效应更为明显”。
假设两个四面体共顶连接时中心距离为1,则共棱、共面时各为0.58和0.33。
若是八面体,则各为1,0.71和0.58。
两个配位多面体连接时,随着共用顶点数目的增加,中心阳离子之间距离缩短,库仑斥力增大,结构稳定性降低。
因此,
结构中[SiO4]只能共顶连接,而[AlO6]却可以共棱连接,在有些结构,如刚玉中,[AlO6]还可以共面连接。
鲍林第四规则
不同配位多面体连接规则,其内容是:“若晶体结构中含有一种以上的正离子,则高电价、低配位的多面体之间有尽可能彼此互不连接的趋势”。
例如,在镁橄榄石结构中,有[SiO4]四面体和[MgO6]八面体两种配位多面体,但Si4+电价高、配位数低,所以[SiO4]四面体之间彼此无连接,它们之间由[MgO6]八面体所隔开。
鲍林第五规则
节约规则,其内容是:“在同一晶体中,组成不同的结构基元的数目趋向于最少”。
例如,在硅酸盐晶体中,不会同时出现[SiO4]四面体和[[Si2O7]双四面体结构基元,尽管它们之间符合鲍林其它规则。
这个规则的结晶学基础是晶体结构的周期性和对称性,如果组成不同的结构基元较多,每一种基元要形成各自的周期性、规则性,则它们之间会相互干扰,不利于形成晶体结构。
