叶黄素及其在饲料中含量的分析
天然叶黄素在水产饲料中的研究与应用

技术学堂TECHNOLOGY FORUM094·《当代水产》 2019·1天然叶黄素在水产饲料中的研究与应用1 天然叶黄素在水产动物中的功能1.1 着色功能天然叶黄素为橙黄色,色泽鲜艳,有极强的着色能力,目前大量应用于家禽的皮肤、蛋黄和脚胫的着色。
由于动物体不能自身合成叶黄素,只能消化吸收饲料中的叶黄素及其酯,用于自身沉积色素的需要,通过转移和机体内脂肪酸酯化后,最终沉积于皮下脂肪、蛋黄和脚胫等组织中。
在水产养殖业中,主要是利用天然叶黄素的着色功能。
1.2 抗氧化功能天然叶黄素具有较强的抗氧化功能,能抑制活性氧自由基的活性,阻止活性氧自由基对正常细胞的破坏。
有关实验证明,活性氧自由基可与DNA、蛋白质、脂类发生反应,削弱它们的生理功能。
而叶黄素可通过物理或化学淬灭作用灭活单线态氧,从而保护机体免受伤害,增强机体的免疫能力。
1.3 其它生物学功能在水产动物的养殖中,叶黄素不仅能起到着色、抗氧化的作用,还有很多其它的生物学功能:作为受精激素,改善卵质;提高免疫,促进生长和成熟;增强鱼体对高氨和低氧的耐受性;作为维生素A 的前体;水生动物脂质过氧化反应的抑制剂;抗紫外辐射的保护作用;在繁殖季节,成熟的雄鱼将叶黄素集中到皮肤上,形成雄鱼的第二性征——婚姻色;而雌鱼则集中在卵巢,形成幼体的保护色。
2 天然叶黄素在水产动物中研究与应用颜色是水产品品质的重要指标之一,色泽的沉积往往代表着鱼类的野生时限,色泽鲜亮往往成为人们判断水产品质量和风味的标准,市场售价也会提高。
水产动物自身不能生成叶黄素,必需从食物中摄取。
而在现代集约化养殖条件下,大量使用人工配合饲料,而水产配合饲料中叶黄素含量较少,且养殖周期较短,使水产动物不能获取充足的叶黄素,造成其体表或肌肉色泽变差。
目前,天然叶黄素已在黄颡鱼、胡子鲶、大口鲶、大黄鱼等特种养殖鱼类和对虾中开展研究,并且已成功应用于许多黄色系品种如黄颡鱼、胡子鲶、大口鲶、金鲳(卵形鲳鲹)、大黄鱼、泥鳅、黄鳝、甲鱼(鳖)、鳗鱼、青蛙等特种经济水产动物,还成功应用于南美白对虾、中华绒螯蟹等甲壳类动物中。
叶黄素测定结果对比修改版
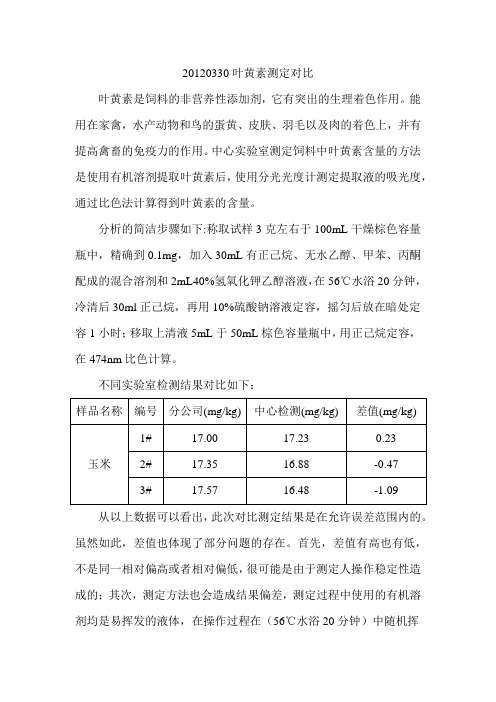
20120330叶黄素测定对比叶黄素是饲料的非营养性添加剂,它有突出的生理着色作用。
能用在家禽,水产动物和鸟的蛋黄、皮肤、羽毛以及肉的着色上,并有提高禽畜的免疫力的作用。
中心实验室测定饲料中叶黄素含量的方法是使用有机溶剂提取叶黄素后,使用分光光度计测定提取液的吸光度,通过比色法计算得到叶黄素的含量。
分析的简洁步骤如下:称取试样3克左右于100mL干燥棕色容量瓶中,精确到0.1mg,加入30mL有正己烷、无水乙醇、甲苯、丙酮配成的混合溶剂和2mL40%氢氧化钾乙醇溶液,在56℃水浴20分钟,冷清后30ml正己烷,再用10%硫酸钠溶液定容,摇匀后放在暗处定容1小时;移取上清液5mL于50mL棕色容量瓶中,用正己烷定容,在474nm比色计算。
不同实验室检测结果对比如下:从以上数据可以看出,此次对比测定结果是在允许误差范围内的。
虽然如此,差值也体现了部分问题的存在。
首先,差值有高也有低,不是同一相对偏高或者相对偏低,很可能是由于测定人操作稳定性造成的;其次,测定方法也会造成结果偏差,测定过程中使用的有机溶剂均是易挥发的液体,在操作过程在(56℃水浴20分钟)中随机挥发的体积是不确定的,此外,加入30mL正己烷,没有标明是精确加入,造成计算时会有偏差;为什么会造成计算偏差呢?原因在于在定容时,加入30mL正己烷后,用10%硫酸钠溶液定容的,我们都知道抽提剂+正己烷,其中正己烷、甲苯等溶剂是不溶于硫酸钠的,加入硫酸钠(作用是除去醇溶性杂质)后抽提剂+正己烷就与硫酸钠分层,抽提剂+正己烷在上层,硫酸钠在下层,最后我们是从抽提剂+正己烷中抽取5毫升再用正己烷定容至50毫升后测定吸光度的。
所以我们说在56℃水浴20分钟,冷清后30ml正己烷,这时加入正己烷的量很关键,加多了吸光度会偏低,加少了吸光度会偏高。
而且,我们用的是分光光度法测量的,分光光度法有一个缺陷就是准确度不高,也就是说对474nm波长下有吸收的物质不一定是叶黄素还有别的黄色物质。
叶黄素2%_饲料_万寿菊提取物_成分表_理论说明

叶黄素2% 饲料万寿菊提取物成分表理论说明1. 引言1.1 概述本篇文章旨在探讨叶黄素2%饲料中的万寿菊提取物成分表及其理论说明。
叶黄素作为一种重要的营养物质,在动植物中起着多种重要的生理功能。
近年来,研究人员发现万寿菊作为一种天然的植物提取物,含有丰富的叶黄素,并且具备许多与叶黄素类似的生物活性成分。
1.2 文章结构本文主要分为五个部分:引言、叶黄素2%饲料、万寿菊提取物成分表、理论说明和结论。
首先,我们将介绍叶黄素和万寿菊提取物的相关背景知识,包括其简介、应用领域以及对动物的影响。
然后,我们将详细介绍万寿菊提取物的成分表,包括提取方法和成分分析,并对成分表进行解读和意义探讨。
接下来,我们将探讨叶黄素与万寿菊提取物之间的关系以及它们可能存在的作用机制。
最后,我们将总结主要发现,并对研究限制和进一步研究的建议进行讨论。
1.3 目的本文的主要目的是深入了解叶黄素2%饲料中的万寿菊提取物成分,并探讨其理论说明。
通过对叶黄素和万寿菊提取物的研究,我们希望揭示它们在饲料中的应用潜力以及对动物生长和健康的影响。
此外,我们也将关注理论与实际效果之间的一致性,评估现有理论依据在实践中是否得到验证。
通过这篇文章,我们希望为相关领域的研究人员提供参考和启发,并为进一步研究奠定基础。
2. 叶黄素2% 饲料2.1 叶黄素介绍叶黄素是一种天然的色素物质,属于类胡萝卜素家族,广泛存在于植物中,特别是在绿叶蔬菜和水果中含量较高。
它具有很强的抗氧化作用,并且对人体健康和动物生长发育有重要影响。
2.2 叶黄素在饲料中的应用叶黄素已经被广泛应用于动物饲料中。
由于其良好的抗氧化性能和对动物免疫系统的调节作用,添加适量的叶黄素可以提高动物的生长速度、产蛋率和肉质品质,并减少因氧化损伤而导致的营养损失和疾病风险。
2.3 叶黄素对动物的影响研究表明,适量添加叶黄素到动物饲料中可以有效改善动物的抗氧化能力,降低机体内自由基含量,保护细胞膜免受氧化损伤。
叶黄素及其在饲料中含量的分析

叶黄素及其在饲料中含量的分析叶黄素在饲料中的检测及应用情况分析摘要:近年来食品安全上频频暴露出各种问题,为了切实维护人民群众身体健康和生命安全,国务院通知(明确一些,什么编号的通知)加强食品添加剂监管,禁止在食品生产经营中以及饲料、畜禽水产养殖中非法添加非食用物质(好象还有预粉料也有要求),滥用食品添加剂。
目前有八种着色剂允许在饲料中添加,叶黄素便是其中之一。
关键词:叶黄素饲料着色剂前言:中国是饲料工业和畜牧业大国,随着人们对食品安全和各种饲料添加剂的日益关注,叶黄素经常作为着色剂添加在饲料中,本文就叶黄素及其在饲料行业中的分析情况作一介绍。
(这段过度有点勉强,读起来感觉很牵强,前言一般是引子,能够将文章意义引申出来) 叶黄素,又名“植物黄体素”,广泛存在于蔬菜、水果和一些花卉中,是一类天然色素的总称,分子式为C40H56O2,属类胡萝卜素活性物质。
类胡萝卜素据其结构不同主要分为两大类:一类是碳氢型,称胡萝卜类;另一类是氧化型,由碳、氢、氧组成,称为叶黄素类。
叶黄素类化合物又有六类分别为:黄体素(又叫叶黄素)、玉米黄素、隐黄素、柑桔黄素、虾黄素(又叫虾青素)、角黄素(又叫斑蝥黄)、斑蝥黄质。
叶黄素中只有那些具有含氧功能团如羟基、酮基和羧基的化合物才能使动物靶组织着色,其它化合物沉积很少。
研究表明(Nelson 1989)(这个应该是参考文献啦!)积累在肉鸡皮下脂肪及蛋黄脂类物质中的叶黄素主要是黄体素(Lutein) 和玉米黄质(Zeaxanthin) 。
也就是说黄体素和玉米黄质具有着色活力被称作活性叶黄素。
(这段文字的目标是:介绍叶黄素的基础知识以及功效机理,跟目标关联不大的内容最好去掉,文章会显得紧凑)随着人们对动物产品色泽的要求,营养学研究重点不仅要促进畜禽水产品生长,而且也有越来越多的研究集中在如何提高畜禽水产品的色、香、味、营养等商品的品质上,通过在饲料中添加叶黄素类着色剂以满足消费者需求即是其目标。
天然叶黄素及其在水产饲料中的应用

天然叶黄素及其在水产饲料中的应用曾胡龙,程宗佳,赵典惠,陶正国(广州立达尔生物科技股份有限公司,广州510663)摘要:天然叶黄素(Xanthophyll )是指自然界中广泛存在的一大类含氧类胡萝卜素,主要来源于植物和藻类,其中万寿菊(Tagetes erecta L.)花中天然叶黄素含量远高于一般植物,是生产天然叶黄素的优质原料。
万寿菊花提取的天然叶黄素通过了国内外权威机构严格的安全性评估,对人体、动物体无害,且有益于机体健康,已广泛应用于食品、医药、饲料等领域。
天然叶黄素添加到水产饲料中,不仅能够有效改善水产动物体色,同时在提高水产动物抗氧化能力、作为维生素前体、改善动物健康状况和生长性能方面有一定效果。
文章对天然叶黄素及其安全性、在水产饲料中的应用情况进行了综述。
关键词:天然叶黄素;类胡萝卜素;水产饲料;着色剂中图分类号:S963文献标志码:A文章编号:1001-0084(2021)03-0027-05Brief Introduction of Research on Application ofNatural Xanthophyll in AquafeedZENG Hulong,CHENG Zongjia,ZHAO Dianhui,TAO Zhengguo(Guangzhou Leader Bio-Technology Co.,Ltd,Guangzhou 510663,China )Abstract:Natural xanthophyll is a large class of oxygen-containing carotenoids that widely exists in nature,which mainly comes from plants and algae.The content of natural xanthophyll in marigolds (Tagetes erecta L.)flowers is much higher than that of the ordinary plants,which make the marigolds the quality raw material source for extracting natural xanthophyll.The natural xanthophyll extracted from marigolds has passed the strict safety assessments by authoritative institutions both domestic and abroad.The extracted natural xanthophyll is harmless to human and animal bodies,also beneficial to health.It has been widely used in food,medicine,feed and other fields.Adding natural xanthophyll to aquatic animal feed can effectively improve the body color and the antioxidant capacity of aquatic animals.Furthermore,the natural xanthophyll also has nutritional value as a vitamin precursor,and has certain effects on improving animal health and growth performance.The natural xanthophyll,its safety andits application in aquatic feed were reviewed and summarized in this paper.Key words:natural xanthophyll;carotenoids;aquafeed;pigment收稿日期:2021-02-18基金项目:广东特支计划“科技创业领军人才项目“(2019TY05N038)作者简介:曾胡龙(1982—),男,江西抚州人,硕士,水产工程师,研究方向为水产饲料添加剂,*******************。
饲料中添加叶黄素对金鱼体色的影响

k - 时 , 和 L g 1 +a 值 基 本 保 持 稳 定 ; 对 照 组 相 比 , 与 叶黄 素 添 加 量 为 2 0和 3 0mg. g 1 , b 0 0 k - 时 + 值
Uni e st v r iy, Sh gh 01 6, Chi an ai2 30 na)
E fcu f g lf h( r si sa r ts) o r a fZhja g feto itr a to h l e e n b d oo ro od i Ca a su u a u .J u n lo ein s
t r e p i r oo r fb d oo f g lf h.Th eu t h we h t t e e wa o sg ic n f c o he r ma y c lu s o o y c lr o o d i s e r s l s o d t a h r s n inf a t ef t f s i e
Ex o aina d Utlz to f u t n t su cs plr to n iia in o Aq a i Ge ei Reo re,Mi ity o u a in h n h iOca c c nsr f Ed c t ,S a g a e n o
浙 江大 学 学报 ( 农业与生命科学版) 3() 1 ~1 ,00 62: 6 7 21 8 4
J u n l fZ ein iest ( rc 8 i c. o r a hja gUn vri Ag i. LL f S i o y e
叶黄素生物学功能及其在饲料中应用的研究进展

叶黄素生物学功能及其在饲料中应用的研究进展杨雨江;张辉;崔焕忠;郑鑫【摘要】叶黄素是在自然界中含量非常丰富的类胡萝卜素,其免疫调节功能及抗氧化特性日益受到人们关注.人们进行了大量用于增强动物体色的研究,并逐步尝试在饲料中添加应用.作者对叶黄素的生物学功能及其在饲料中应用的研究进展进行了简要概述.【期刊名称】《中国畜牧兽医》【年(卷),期】2014(041)005【总页数】4页(P121-124)【关键词】叶黄素;生物学功能;饲料【作者】杨雨江;张辉;崔焕忠;郑鑫【作者单位】吉林农业大学动物科技学院,吉林长春130118;吉林农业大学动物科技学院,吉林长春130118;吉林农业大学动物科技学院,吉林长春130118;吉林农业大学动物科技学院,吉林长春130118【正文语种】中文【中图分类】S816.7叶黄素(lutein)是一种类胡萝卜素(carotenoid),在自然界中广泛存在,色泽鲜艳,着色力强,是构成蔬菜、水果、花卉、玉米等植物色素的主要组分(Krinsky等,2005)。
人类首次在胡萝卜中发现叶黄素是在19世纪初,现在研究结果发现,多种植物中都富含叶黄素,万寿菊中含量较高。
人体与动物体内不能合成叶黄素,只能从食物或饲料中获得。
叶黄素分子具有10个共轭双键,使其具有较强的抑制自由基能力(张薇等,2012)。
随着研究的深入,结果发现叶黄素具有多种生物功能,如在增强机体免疫功能、提高机体抗氧化能力、减少癌症的发生和发展、降低心血管疾病发病率、保护视觉等方面发挥独特的功能(Vishwanathan等,2009;Schweigert等,2011)。
由于叶黄素安全无毒,具有较强抗氧化等生物学功能,已被允许在多种食品和饲料中添加,应用领域逐渐扩大。
1.1 叶黄素对机体免疫功能的影响类胡萝卜素的免疫调节活性已被广泛认同,自从发现叶黄素具有调节机体免疫反应作用以来,人们相继开展了叶黄素对机体体液免疫和细胞免疫影响的研究,结果发现其对体液免疫和细胞免疫都具有调节作用。
叶黄素对七彩神仙鱼生长和体色的影响

叶黄素对七彩神仙鱼生长和体色的影响宋雪璐;李小勤;陈再忠;王磊;还殿宇;冷向军【摘要】为研究叶黄素对七彩神仙鱼体色和生长的影响,在“牛心汉堡”饲料中分别添加0、50、100、200、300和400 mg/kg叶黄素,饲喂初始平均体质量(10.3±0.3)g的七彩神仙鱼8周.结果显示,添加叶黄素50~200 mg/kg,对鱼体增重率无显著影响,但添加量达200 mg/kg后,饲料系数显著增大,添加量达300mg/kg后,增重率显著降低.在养殖4周、8周时,鱼体皮肤亮度(L*)无显著变化,皮肤黄度(b*)和叶黄素含量随叶黄素添加量增加而显著升高;8周时,各叶黄素添加组的皮肤b*值和叶黄素含量显著高于4周时,当叶黄素添加量达300 mg/kg后,皮肤b*值(4周、8周)和全鱼叶黄素含量(8周)趋于稳定;4周时,各处理组间的皮肤红度(a*)无显著差异;8周时,当叶黄素添加量达1 00 mg/kg后,皮肤a*值显著降低;饲料中添加300 mg/kg叶黄素显著提高了七彩神仙鱼肝脏总抗氧化能力.研究表明,在饲料中添加叶黄素可有效改善七彩神仙鱼体表黄色,提高肝脏总抗氧化能力,但高添加量的叶黄素会降低鱼体生长性能,七彩神仙鱼饲料中的叶黄素添加量建议为200~300 mg/kg.%To assess the effects of dietary xanthophyll on the growth and body color of discus fish (Symphysodon sp.),xanthophyll was added into the basal diet (beef heart hamburg) with the levels of 0,50,100,200,300 and 400 mg/kg,respectively.The six experimental diets were fed to discus fish with an initial body weight of (10.3±0.3) g for 8 weeks.The results showed that the supplementation of 50-200 mg/kg xanthophyll had no significant effects on the weight gain rate,but the feed coefficient ratio significantly increased and the weight gain rate significantly decreased when the xanthophyll supplementation reached 200 or 300 mg/kgrespectively.After 4 or 8 weeks'feeding,the skin lightness (L*) showed no significant differences among groups,but the skin yellowness (b*)increased with the increase of dietary xanthophyll.The b* value and xanthophyll content in skin of all xanthophyllsupplemented groups in the 8th week were higher than those in the 4th week.The b* values in the 4th week and 8th week,and the xanthophyll content in whole fish in the 8th week remained relatively stable when the xanthophyll supplementation reached 300 mg/kg.In the 4th week,the skin redness (a*) showed no significant difference among groups,but in the 8th week,the a* values significantly decreased when the xanthophyll supplementation reached 100 mg/kg.The hepatic total antioxidant capacity was significantly strengthened by the supplementation of 300 or 400 mg/kg xanthophyll.The above results showed that dietary xanthophyll could effectively improve the yellowness of the skin and strengthen the hepatic total antioxidant capacity of discus fish,but the high inclusion of xanthophyll reduced the growth of the fish.The supplementation level of xanthophyll was suggested to be 200-300 mg/kg.【期刊名称】《水产学报》【年(卷),期】2017(041)004【总页数】7页(P566-572)【关键词】七彩神仙鱼;叶黄素;体色;生长【作者】宋雪璐;李小勤;陈再忠;王磊;还殿宇;冷向军【作者单位】上海海洋大学水产与生命学院,上海201306;上海海洋大学水产与生命学院,上海201306;上海海洋大学农业部淡水水产种质资源重点实验室,上海201306;上海海洋大学水产与生命学院,上海201306;上海海洋大学水产与生命学院,上海201306;上海海洋大学水产与生命学院,上海201306;上海海洋大学水产与生命学院,上海201306;上海海洋大学农业部淡水水产种质资源重点实验室,上海201306;上海市水产养殖工程技术研究中心,上海201306;水产动物遗传育种中心上海市协同创新中心,上海201306【正文语种】中文【中图分类】S963.73七彩神仙鱼(Symphysodon aequifasciata)属于慈鲷科(Cichidae)盘丽鱼属(Symphysodon),原产于南美洲亚马逊河流域,是观赏鱼市场中的名贵品种。
不同品种玉米中叶黄素、玉米黄素及β-胡萝卜素含量的分析

0引言玉米是世界上种植面积最大和总产量最高的粮食作物,同时也是我国第一大作物,对保障我国粮食安全具有重要战略意义[1]。
玉米中含有较多的营养成分,其中为人所熟知的是胡萝卜素、叶黄素和玉米黄素[2]。
胡萝卜素有α、β、γ等同分异构体,其中以β-胡萝卜素生理活性最强,是重要的维生素A源[3]。
β-胡萝卜素分子式为C40H56,其化学结构为两边反向对称,分子结构中包含有两个β-紫罗兰酮和4个异戊二烯,中心断裂可产生两个维生素A分子[4]。
因此β-胡萝卜素是动物体内维生素A的重要来源,且具有预防眼疾、保护视力、预防和改善肿瘤、抗衰老的功能[5]。
而对于叶黄素和玉米黄素,经研究发现它们是一组同分异构体,化学结构为C40H56O2,叶黄素是α-胡萝卜素的衍生物,玉米黄素则是β-胡萝卜素的衍生物[6]。
叶黄素和玉米黄素对人体的健康有多种营养功能,如防止视网膜损伤[7]、抗氧化[8]、调节免疫功能[9]以及抑制肿瘤细胞增殖,延缓动脉粥样硬化等[10]。
因此,二者已被认为是重要的营养物质。
通过上述研究成果我们可以大概地了解到叶黄素、玉米黄素、β-胡萝卜素它们有自己的独特的性质,而叶黄素、玉米黄素作为一种同分异构体,对其特性的研究更为人们所重视和感兴趣。
同分异构体虽然是分子式相同,但作用还是有一定区别的。
本次研究收集同一产地不同品种的玉米,测定并筛选出叶黄素、玉米黄素、β-胡萝卜素含量相对较高的优良品种,为后续对叶黄素、玉米黄素、β-胡萝卜素研究提供一些帮助,从不同品种玉米中叶黄素徐从华,马挺军*(北京农学院食品科学与工程学院,北京102206)摘要:对21种玉米中叶黄素、玉米黄素和β-胡萝卜素的含量进行定量分析,从而筛选出含量较高的品种,为农业生产及功能育种提供有效的依据。
采用HPLC检测叶黄素、玉米黄素和β-胡萝卜素的含量。
结果显示,叶黄素与玉米黄素高含量的三个品种是强49、大2和农16,其中含量最高的品种为强49,β-胡萝卜素含量最高的品种是强49,其β-胡萝卜素含量为752.63mg/100g,叶黄素含量为854.40mg/100g,玉米黄素含量为227.80mg/100g。
饲料中添加叶黄素对金鱼体色的影响

浙江大学学报(农业与生命科学版) 36(2):168~174,2010Journal of Zhejiang University(Ag r ic &Life Sci )文章编号:1008-9209(2010)02-0168-07DOI:10.3785/j.issn.1008-9209.2010.02.008饲料中添加叶黄素对金鱼体色的影响冷向军,石英,李小勤,徐海华,杨志刚(上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海201306)摘 要:为考察饲料中添加叶黄素对金鱼体色的影响,在基础饲料中分别添加0、50、100、150、200和300mg kg-1叶黄素,饲喂平均体质量(7 8 0 3)g文种金鱼10周,用色差计(WSC-S)对金鱼体表三刺激值进行测定.结果表明:饲料中添加叶黄素对金鱼增质量率无显著影响,但添加300mg kg-1叶黄素显著增大了饲料系数(P<0 05);饲料中添加叶黄素0~150mg kg-1时,金鱼体表+a*值(红色)随叶黄素添加量的增加而增加,L*值(亮度)随叶黄素添加量的增加而降低;当叶黄素添加量大于150mgkg-1时,+a*和L*值基本保持稳定;与对照组相比,叶黄素添加量为200和300mg kg-1时,+b*值(黄色)显著增加(P<0 05);随叶黄素添加量从0增加到150mg kg-1,金鱼鳞片、皮肤、肌肉和尾鳍中的叶黄素含量也增加,当添加量大于150mg kg-1时,上述各部位叶黄素含量达到最高并基本稳定;添加100、150、200和300mg kg-1叶黄素均可显著提高金鱼血清酪氨酸酶活力(P<0 05).上述结果表明,在金鱼饲料中添加叶黄素150mg kg-1可有效改善金鱼体色.关 键 词:金鱼;叶黄素;体色中图分类号:S965.117.73+2 文献标志码:AL ENG Xiang-jun,SHI Y ing,LI Xiao-qin,XU H a-i hua,Y A NG Zh-i g ang(K ey L abor ator y ofE x p lor ation and Utiliz ation of A quatic Genetic Resour ces,Mi nistr y of Ed ucation,S hanghai OceanUnivers ity,Shanghai201306,China)Effect of dietary xanthophyll level on body colour of goldf ish(Carassius auratus).Journal of Z hejiang U niv ersity(A g ric &L ife Sci ),2010,36(2):168-174Abstract:To investig ate the effect of adding x anthophyll in diet on body colour of goldfish,six diets added w ith x anthophyll of0(contro l g roup),50,100,150,200,or300mg kg-1w ere prepared,and fed to go ldfish w ith initial body mass of(7 8 0 3)g for10weeks.A color imeter(WSC-S)was chose to determine values of three pr imary colours of body color of goldfish.T he r esults showed that there was no significant effect of addit ional xanthophyll on growth of goldfish,but feed conver sion ratio(FCR)was increased(P<0 05)by the addit ional xanthophyll of300mg kg-1,compared with control g roup.In the respect o f body colour,+a*value(redness)was incr eased,and L*value(luminance)was decreased by x anthophyll addition from0to150 mg kg-1.When the addition level of x anthophyll w as higher than150mg kg-1,+a*value and L*value kept constant.T he+b*value(yello wness)of body surface was incr eased by additio nal xantho phy ll of200 mg kg-1or300mg kg-1.With the increase of xanthophyll addition in diet,xanthophyll contents in skin,收稿日期:2009-04-13基金项目:上海市重点学科建设基金资助项目(Y1101);上海市教委 水族科学与技术专业教育高地"建设基金资助项目(B-8502-06-0014).作者简介:冷向军(1972 ),男,四川眉山人,教授,从事水产动物营养与饲料学研究.E-mail:xjleng@.通信作者:李小勤,女,副教授,从事生物技术研究.E-mail:x qli@.李小勤,等:饲料中添加叶黄素对金鱼体色的影响scale,muscle and tail fin were also increased.W hile the additional xanthophyll content was150mg kg-1, go ldfish had the highest content of xanthophyll in these tissues.Ser um tyrosinase activity w as significantly increased by the additional xanthophyll o f100,150,200,or300mg kg-1.Results above show that the optimal x anthophyll addition in diet for go ldfish pigmentation is150mg kg-1.Key words:g oldfish(Car ass ius aur atus);xanthophyll;bo dy colo ur鱼类呈现出的斑澜色彩,主要由类胡萝卜素决定(红、黄、蓝等色泽),也与黑色素、鸟嘌呤等色素基团有关.鱼类本身不能合成类胡萝卜素,必需从食物中摄取.鲑鳟鱼类肌肉的色泽问题早已引起了研究者的关注,在饲料中添加虾青素可使鲑鳟鱼类肌肉呈现出红色,满足市场需求[1],这也是目前鱼类着色研究的主要领域.而在其他鱼类方面,有关着色的研究报道则甚少.观赏鱼的斑澜体色是其价值的重要体现,保持其艳丽体色是观赏鱼养殖的重要内容.金鱼(Carassius auratus)起源于我国,以其艳丽体色和优雅形态,深受水族爱好者喜爱,是我国乃至世界范围内重要的观赏鱼.有关金鱼着色的研究很少,国内仅见陈晓明[2]报道的在饲料中添加5%法夫酵母(富含虾青素)喂养金鱼(5 5g)60d,可使金鱼体色明显变红,头、鳞、肌肉虾青素含量显著增加;以及陈林等[3]报道的在饲料中分别加入2 柠檬黄、胭脂红、果绿、亮蓝4种食用色素饲喂金鱼(20g)110d,对金鱼外观体色及体色三刺激值(红、绿、蓝刺激值)均无显著影响[3].叶黄素是一类重要的类胡萝卜素,包括黄体素,玉米黄质等,是许多鱼类色泽的重要物质基础,目前尚未见其对金鱼体色影响的研究;因此,本实验以金鱼为研究对象,在饲料中添加不同含量叶黄素,考察对金鱼体色的影响,从而提高金鱼的观赏价值和商品价值,为叶黄素在观赏鱼饲料中的合理应用提供理论依据.1 材料与方法1 1 实验设计与饲料在基础饲料中分别添加0(对照组)、50、100、150、200和300mg kg-1叶黄素(商品名为金黄素Y20,其叶黄素含量20g kg-1,主要成分为黄体素,由广州智特奇生物科技有限公司生产并提供),并等量减少麦麸用量以保持配方平衡.各主要原料粉碎过60目筛,混合均匀,用绞肉机加工成直径2 0m m颗粒饲料,晾干,于4 保存备用.基础饲料组成见表1.表1 基础饲料配方及常规营养组成T able1 Formula and nutritional composition of basal diet%原料比例营养成分含量鱼粉22 0粗蛋白34 82豆粕25 0粗脂肪5 67菜粕15 0水分10 74面粉22 0麦麸9 95磷酸二氢钙1 8微量矿物元素预混料0 5维生素预混料0 4氯化胆碱0 35豆油1 5鱼油1 5总计100 0注:维生素和微量矿物元素按照鲤鱼标准(NRC,1993)添加.1 2 实验用鱼实验用金鱼取自上海天夫观赏鱼养殖场,属文种金鱼,外观、体形、色泽和大小基本一致,健康状况良好,背部为红色,腹部为黄色,平均体质量(7 8 0 3)g.实验分为6个处理组,每处理组3个重复,每重复18尾鱼,共324尾鱼.1 3 实验管理实验用鱼饲养于上海海洋大学生态养殖实验室,共18口自动充气循环控温的玻璃水族缸(0 8m 0 5m 0 5m).以基础饲料驯化1周,摄食正常后开始养殖实验,每天按体质量4%~5%分4次投喂(8:30,12:00,15:30,169第2期浙江大学学报(农业与生命科学版)19:00),并根据水温、摄食情况进行调整.实验期间水温25~28 ,DO>5m g L-1、NH3-N<0 3m g L-1.饲养时间共10周.1 4 测定指标与方法1 4 1 生长指标 于实验结束后饥饿24 h,称量鱼体质量,计算增质量率、饲料系数和成活率.增质量率(m ass gain,M G)=(末均质量-初均质量)/初均质量 100%;饲料系数(feed co nversion r atio,FCR)=总投饲量/(末质量-初质量);成活率(sur vival rate,SR)=实验末鱼尾数/实验初鱼尾数 100%.1 42 金鱼体表三刺激值(L*、a*、b*值)的测定 用L*(明度)、a*(+a*偏红,-a*偏绿)、b*值(+b*偏黄,-b*偏蓝)代表颜色状态.所用色差计为上海精密科学仪器有限公司物理光学仪器厂生产的WSC-S型测色色差计(o/d光源,带光泽,稳定性 Y 0 6).测定时,先用吸水纸将鱼体表面的水分吸干,再将色差计的探头紧贴于鱼体侧最宽处侧线以上测量,并记录L*、a*、b*值[3].1 4 3 肌肉基本生化成分的测定 饲养实验结束后,每缸取鱼3尾,取背部白肌于-18 低温冷冻保存.肌肉基本生化成分的测定包括水分、粗蛋白、粗脂肪[4].1 4 4 叶黄素含量测定 养殖实验结束后,每缸取鱼3尾,取侧线以上背部鳞片、皮肤、肌肉及尾鳍,立即测定叶黄素含量[5]:将样品剪碎,盛于25mL容量瓶中,加入7 5mL提取液(己烷 丙酮 无水乙醇 甲苯=10 7 6 7),塞上塞子旋转振摇1m in,加入1m L40% KOH-甲醇溶液,旋转振摇1m in,于56 水浴20min(冷却烧瓶颈部以防溶剂损失),冷却,于暗处放置1h,加入7 5mL己烷,旋转振摇1 min,用10%硫酸钠液定容,猛烈振摇1min,置于暗处1h,取上清液于474nm波长下测定吸光值,根据标准曲线计算叶黄素含量.1 4 5 血清酪氨酸酶活力测定[6] 养殖实验结束后,每缸随机取鱼4尾于尾静脉处抽血, 4000r min-1离心10min,取上层血清,-70 冷冻备用.取3mg mL-1L-多巴0 5m L,加入1m L28 预热的磷酸缓冲液,加入0 1mL 血清,室温下立即测定475nm处吸光度值 OD0,10min后再测一次吸光度值 OD10,以每m in在475nm处吸光度增加0 001定义为1个酶活力单位.酶活力/(U mL-1)= ( OD10- OD0)/(0 001 V T),其中V为样品体积,m L,T为时间,min.1 5 数据统计实验数据以平均值 SD表示,采用SPSS 11 5统计软件进行单因素方差分析和多重比较,P<0 05时差异显著.2 结 果2 1 叶黄素对金鱼生长性能的影响叶黄素对金鱼生长性能的影响见表2.饲料中添加叶黄素,对金鱼增质量率无显著影响(P>0 05);但叶黄素添加量大于100m g kg-1时,饲料系数有增加趋势,其中添加300 m g kg-1叶黄素组饲料系数较对照组显著增加(P<0 05);各组金鱼成活率均保持在较高水平,其中添加150和200mg kg-1叶黄素组与对照组相比金鱼成活率显著提高(P<0 05).2 2 叶黄素对金鱼肌肉成分的影响由表3可见,饲料中添加0~300mg kg-1叶黄素,对金鱼肌肉水分、脂肪、蛋白质含量无显著影响(P>0 05).2 3 叶黄素对金鱼体表L*、a*、b*值的影响 经10周饲养后,随叶黄素添加量由0mg kg-1增加到150m g kg-1,肉眼可见金鱼体表颜色更加鲜艳亮丽,逐渐变红,当叶黄素添加量大于150mg kg-1,金鱼体色不再有明显变化. 叶黄素对金鱼体表L*、a*、b*值的影响见表4.饲料中添加叶黄素0~150m g kg-1时,金鱼体表的+a*值(代表红色,数值越大,颜色越红)随叶黄素添加量的增加而增加,L*值(代表亮度,数值越大,色泽越浅)随叶黄素添加量的增加而降低;当叶黄素添加量大于150m g kg-1,+a*和L*值基本保持稳定;与对照组相比,叶黄素添加量为200和300m g kg-1时,显著提高了金鱼体表的+b*值(代表黄色)(P< 0 05).170第36卷李小勤,等:饲料中添加叶黄素对金鱼体色的影响表2 叶黄素对金鱼生长性能的影响T ab le 2 Effect of additional x anth op hyll on g row th performance of goldfish项目叶黄素添加量/(mg kg -1)050100150200300初均质量/g 7 8 0 27 8 0 37 8 0 37 8 0 27 7 0 28 0 0 1末均质量/g 19 9 0 420 1 0 319 5 0 519 9 0 319 4 0 420 2 0 4增质量率/%155 1 3 1157 7 2 7150 0 5 0155 1 2 4151 9 3 1152 5 3 8饲料系数1 83 0 04b 1 80 0 06b 1 91 0 03ab 1 88 0 04b 1 94 0 05ab 2 10 0 05a 成活率/%94 3 1 2b96 5 3 0ab96 3 3 2ab97 9 2 7a98 15 3 5a95 7 3 7ab注:同行数据后的不同小写字母表示在P <0 05水平差异显著;含相同字母或未标字母者表示在P <0 05水平差异不显著.表3 叶黄素对金鱼肌肉成分的影响T able 3 Effect of additional xan thophyll on muscle com pos ition of goldfish项目叶黄素添加量/(mg kg -1)050100150200300水分/%78 5 0 278 6 0 378 1 0 279 3 0 478 5 0 278 5 0 3脂肪/%DM 14 0 0 914 2 0 714 3 0 314 5 1 014 5 0 314 1 0 4蛋白质/%DM79 9 0 479 3 0 978 3 1 279 4 0 778 8 0 679 1 0 5注:同行数据后未标字母者表示在P <0 05水平差异不显著.表4 叶黄素对金鱼体表三刺激值的影响T able 4 Effect of additional x anthoph yll on L *,a *,b *values of body colour of goldfish项目叶黄素添加量/(mg kg -1)050100150200300L *64 68 0 69a 62 84 1 63ab 62 69 2 03ab 61 90 0 89b 62 52 1 53ab 62 73 1 36ab a *30 91 0 91b 32 39 2 52ab 32 30 2 22ab 35 72 1 59a 33 06 1 78ab 34 29 1 34ab b *58 16 2 82b55 55 2 38b57 77 1 54b59 16 2 13ab67 45 3 37a66 26 4 19a注:同行数据后的不同小写字母表示在P <0 05水平差异显著.2 4 叶黄素对金鱼不同组织叶黄素含量的影响叶黄素对金鱼不同组织叶黄素含量的影响见表5.饲料中添加50~300mg kg -1叶黄素,显著增加了鳞片、皮肤、肌肉及尾鳍叶黄素含量(P <0 05);当饲料中叶黄素添加量由0mg kg -1增加到150m g kg -1时,金鱼鳞片、皮肤、肌肉和尾鳍叶黄素含量随叶黄素添加量的增加而增加,当叶黄素添加量超过150m g kg-1,各组织的叶黄素含量基本趋于稳定.表5 叶黄素对金鱼不同组织叶黄素含量的影响T ab le 5 Effect of additional x anth op hyll on x anth op hyll conten ts of different tis sues of goldfis h项目叶黄素添加量/(mg kg -1)050100150200300鳞片45 28 6 64d 69 36 3 88c 93 81 6 00b 121 77 7 25a 116 42 6 45a 113 53 2 83a 皮肤59 65 7 43c 80 98 2 76b 94 89 3 12a 99 17 2 47a 95 67 6 45a 88 77 7 97a 肌肉5 39 0 85c 8 29 0 96b 8 97 1139ab 13161?1160a 12180?1118a 12122?1146a 尾鳍33195?1144d65102?1129c80199?8124b114150?4197a94154?5157b97171?5116b注:同行数据后的不同小写字母表示在P <0105水平差异显著.171第2期浙江大学学报(农业与生命科学版)分别就饲料中叶黄素添加量与鳞片、皮肤、肌肉和尾鳍叶黄素含量进行折线回归分析(表6).当叶黄素添加量在0~150m g!kg-1时,鳞片、皮肤、肌肉及尾鳍叶黄素含量与叶黄素添加量呈显著线性相关(01948<R2<01995);当叶黄素添加量大于150mg!kg-1后,各组织叶黄素含量与叶黄素添加量的相关性有所降低;鳞片叶黄素含量与叶黄素添加量之间的回归直线见图1(其他组织叶黄素含量与叶黄素添加量间的回归直线图略).欲使金鱼鳞片、皮肤、肌肉及尾鳍中叶黄素含量达最大值并趋于稳定,饲料中叶黄素添加量分别为151137、129180、155108和144181m g!kg-1,此时,鳞片、皮肤、肌肉及尾鳍叶黄素含量分别为120159、97150、11194和108183mg!kg-1(表6).图1鳞片叶黄素含量与叶黄素添加量之间的回归直线图Fig.1Regr ess line of additional xanthophyll and xanthoph yll contents in scale of g oldfis h表6金鱼各组织叶黄素含量与饲料叶黄素添加量的折线回归分析Table6Regress equ ation of additional xan thophyll and x anthoph yll conten ts in tiss ues of goldfish组织叶黄素含量(y)/(mg!kg-1)叶黄素添加量(x)/(mg!kg-1)直线方程1(0[x[150)直线方程2(150[x[300)交叉点(x,y)鳞片0[x[300y=014864x+461966(R2=01995)y=-010512x+128134(R2=01875)(151137,120159)皮肤0[x[300y=012751x+611778(R2=01948)y=-01104x+111(R2=01717)(129180,97150)肌肉0[x[300y=010443x+51068(R2=01979)y=-010037x+121512(R2=01929)(155108,11194)尾鳍0[x[300y=015433x+301152(R2=01993)y=-010914x+122106(R2=01424)(144181,108183)215叶黄素对金鱼血清酪氨酸酶活力的影响饲料中添加叶黄素对金鱼血清酪氨酸酶活力的影响见表7.添加100、150、200和300m g!kg-1叶黄素均可显著提高血清酪氨酸酶活力(P<0105),其中以添加150m g!kg-1叶黄素组血清酪氨酸酶活力最高.表7饲料中添加叶黄素对金鱼血清酪氨酸酶活力的影响T able7Effect of additional x anth oph yll on s erum tyrosin as e activity of goldfish 项目叶黄素添加量/(mg!kg-1)050100150200300酪氨酸酶活力/(U!mL-1)0145?0108c0146?0108c0168?0107b0186?0104a0183?0107ab0178?0111ab 注:同行数据后的不同小写字母表示在P<0105水平差异显著.3讨论311叶黄素对金鱼生长性能的影响叶黄素分子中含有多个不饱和双键,可清除氧自由基,增强巨噬细胞对微生物或外源性抗原物质的氧化杀灭作用,加强机体非特异性免疫功能[7].在饲料中添加5%富含虾青素的法夫酵母可使罗氏沼虾成活率提高2117%[8].本实验中,随叶黄素添加量增加,金鱼成活率也得到了显著提高(P<0105),其原因可能与叶黄素提高了机体免疫力有关.今后有待于对相关免疫指标进行测定,以确定叶黄素对机体免疫功能的影响.172第36卷李小勤,等:饲料中添加叶黄素对金鱼体色的影响饲料中添加叶黄素,对金鱼增质量率无显著影响,但叶黄素添加量大于100mg!kg-1后,饲料系数有增加趋势,其中添加300mg!kg-1叶黄素组饲料系数较对照组显著增加(P< 0105).这种现象的原因尚不清楚,是否与过高叶黄素添加对机体免疫产生了反馈抑制,降低了对饲料的利用效率有关,尚有待进一步研究. 312叶黄素对金鱼体色的影响刘金海等[9]对不同品系金鱼色素组分进行比较研究,发现红色金鱼所含色素以红色(虾青素)为主,其次为橙色、杏黄色等色素组分; Sim pson[10]指出,在有鳍鱼类中,虾青素、黄体素是分布最为广泛的色素.本实验中所采用的金鱼属文种金鱼,体表具有红色(背部),黄色(腹部),可认为其物质基础主要来源于虾青素、黄体素;在饲料中添加叶黄素(以黄体素为主,黄色)饲喂金鱼,金鱼体色除更艳丽外,还表现出红色加深.根据Simpson[10]的理论,依照水产动物对虾青素的代谢能力,金鱼可被划分为红鲤型(red carp ty pe),该类水产动物包括大部分淡水鱼,具有将黄体素、玉米黄质转变形成虾青素的能力;因此,本实验中摄食添加叶黄素饲料的金鱼,除直接贮存黄体素外,还将部分黄体素转化成了虾青素,因而具有更红体色.在今后研究中,应测定鳞片、皮肤虾青素含量,以了解金鱼将黄体素转化成虾青素的效率.因此,欲改善金鱼体色,可在饲料中添加虾青素或叶黄素(以黄体素为主),或添加富含这些色素的原料.目前,关于金鱼着色的研究报道很少.添加富含虾青素的法夫酵母,使饲料虾青素含量为60mg!kg-1,可使金鱼体色明显变红,头、鳞、肌肉部位虾青素含量比对照组分别提高了2216%、4515%和3110%[2];以小球藻和节旋藻(富含虾青素、黄体素)分别饲喂红鲤、金鱼,提高了皮肤中类胡萝卜素含量,显著改善了鱼体体色[11];将4种食用色素:偶氮类水溶性色素柠檬黄、胭脂红,非偶氮色素亮蓝,及果绿(柠檬黄、亮蓝混合物)分别按2j添加于饲料,对金鱼体色及体表色差数值无显著影响(P>0105)[3],这4种色素非类胡萝卜素,不能被金鱼吸收或吸收后在体内被分解,无法沉积,对鱼类着色并无意义.本实验中,添加150mg!kg-1叶黄素可使金鱼鳞片、皮肤、肌肉及尾鳍中叶黄素含量显著增加(P<0105),体色明显变红,此添加量略高于本实验室在胡子鲶[12]的研究结果(100mg!kg-1叶黄素).不同鱼类对体色具有不同要求,对适宜的叶黄素添加量也有不同要求.金鱼体色的差异可用肉眼进行区别,但难以量化.本实验以色差计测定了金鱼体表的L*,a*,b*值.色差计是利用仪器内部光源来照射被测物体表面,通过具有特定光谱灵敏度的感光元件对反射光进行度量.本实验中,添加叶黄素0~150m g!kg-1时,金鱼体表的+a*值(红色度)随叶黄素添加量的增加而增加,L*值(明度)随叶黄素添加量的增加而降低;当叶黄素添加量大于150mg!kg-1后,+a*和L*值基本保持稳定.色差值的变化规律与鳞片、皮肤叶黄素含量的变化具有基本一致的趋势,也与肉眼所见色泽变化相一致,可用来对观赏鱼体色进行定量判别.313叶黄素对血清酪氨酸酶活力的影响酪氨酸酶是生物合成黑色素的关键酶,其表达和活性决定黑色素的生成速度和产量[13-14].关于叶黄素对酪氨酸酶活性、黑色素合成的影响目前尚未见报道.本实验在饲料中添加100~300 mg!kg-1叶黄素,显著提高了金鱼血清酪氨酸酶活性,提高了鳞片、皮肤、肌肉和尾鳍叶黄素含量,具有较对照组更红、更艳丽的体色.这种现象与酪氨酸酶活性的增加似乎相矛盾,这存在2种可能,一方面,酪氨酸酶活性增加,并未导致黑色素含量增加;另一方面,酪氨酸酶活性的增加,使得黑色素产量增加,但黑色素的增加,相对于叶黄素在皮肤、鳞片的含量而言较少,大量叶黄素的存在,掩盖了黑色素表达.今后,有待于对皮肤、鳞片黑色素进行测定,对黑色素细胞、红色素细胞、黄色素细胞等进行组织学观察,以了解叶黄素对酪氨酸酶活性、黑色素合成的影响,以及不同色素间的相互作用.4结论在饲料中添加叶黄素可显著提高金鱼体色红度值+a*和黄度值+b*,增加鳞片、皮肤、肌173第2期浙江大学学报(农业与生命科学版)肉及尾鳍中叶黄素含量,使金鱼体色更艳丽.金鱼饲料中叶黄素的适宜添加量为150 mg!kg-1.References:[1]L ENG Xiang-jun,LI Xiao-qin(冷向军,李小勤).Th erecent advance of aquatic anim al pigm entation[J].Journal of Fisheries of China(水产学报),2006,30(1):138-143.(in Chinese)[2]CH EN Xiao-m ing,XU Xu e-ming,JIN Zheng-yu(陈晓明,徐学明,金征宇).Pigm entation of Car assiusauratus with astaxanthin-riched Phaf f ia raod oz y ma[J].Journal of Fis hery Sciences of China(中国水产科学),2004,11(1):70-73.(in Chinese)[3]CH EN Lin,FU Qiu-juan(陈林,符秋娟).T he effectof four food pigm ents on body colou r of goldfish[J].Journal of Shanghai Fisheries Univers ity(上海水产大学学报),2007,16(1):79-82.(in Chin ese)[4]AOAC(Association of official analytical chem ists).Official Methods of Analysis,15t h[M].AOAC,W ashington D C,1990.[5]Quack enbu sh F W,M iller S position andanalysis of the car otenoids in marig old petals[J].Journa-l Ass ociation of O fficial Analytical Chemists,1972,55(3):75-81.[6]DING Yu-tin g,YANG Geng-s hen g(丁玉庭,杨更生).E ffect of ex traneous source factors on tyrosinas eactivity of guinea pig skin[J].Food Science(食品科学),1999(4):12-14.(in Chin es e)[7]W ANG Jun-bo(王军波).Xanth op hyll and immun efun ction[J].Food and Nutrition of China(中国食物与营养),2004(10):41-44.(in Chinese)[8]J IN Zh eng-yu,GUO S h-i dong,LB Yu-h ua(金征宇,过世东,吕玉华).Pigmentation and grow th ofM acr obrach ium rosenbe rg ii(de M an)w ithastaxanthin-riched P haf f ia raod oz y ma[J].FeedIndustry(饲料工业),1999,20(10):29-31.(in Chinese) [9]LIU Jin-hai,WANG An-li,W ANG W e-i na(刘金海,王安利,王维娜).Comparative studies on th e totalpigment and pigment com position of goldfis h[J].ActaHydrobiologica Sinica(水生生物学报),2007,31(1):73-77.(in C hines e)[10]Simp son K L.Car otenoidsinfishfeeds[M].Carotenoidsas Colorants and Vitamin A Precu rs ors.New York:Academ ic Pr ess,1981:463-537.[11]Gou veia L,Rema P,Pereira O,e t al.Colourin gornamen tal fish(Cyp rinus car pio and Carassiusaur atu s)w ith m icroalgal b iom as s[J].AquacultureNu trition,2003,9(2):123-130.[12]LENG Xiang-ju n,LI Xiao-qin,WU S h-i lin,et al.(冷向军,李小勤,吴世林,等).Effect of xanthophylladdition on body color of Clarias f u sc us[J].Journal ofFisheries of China(水产学报),2003,27(1):38-42.(inChin ese)[13]GONG S heng-zhao,YANG Zh uo-ru,CH ENG Jian g(龚盛昭,杨卓如,程江).Inhib itory kin etics ofcin nam ic acid on tyrosin as e-catalyzing reaction[J].Journal of Chemical Engineering of Chines e Univers ities(高校化学工程学报),2007,21(2):345-349.(inChin ese)[14]Chen Y M,Chavin parative biochemicalaspects of integumen tal and tum or tyrosinase activity invertebrate melanogenesis[M]//M on tagna W,H u F.The Pigmentary System.Oxford:Pergam on,1967:253-268.174第36卷。
饲料中叶黄素含量对北京鸭皮肤及胸肌颜色的影响

处理4 65.2950±0.48672 一0.3050±0.23784 5.7750±0.69791bc
处理5 65.0500±0.41782 -0.0580±0.27878 6.5160±0.45522c
种脂溶性的类胡萝卜素,广泛的存 在于玉米等天然的饲料原料中。一 方面它可以抗氧化,抵御自由基对 机体的损伤,另一方面,叶黄素会沉 积在畜禽的皮肤中。影响畜禽皮肤 的着色。北京鸭是我国优良的肉鸭
饲料中叶黄素含量 对北京鸭皮肤及胸肌颜色的影响
李贺贺1,程炳金1,马雷国I,高伟2,韩月杰3 (1.河北乐寿农牧集团饲料事业部技术部,河北沧州061000; 2.河北乐寿鸭业总部质管部, 河北沧州061000; 3.河北乐寿鸭业总部工程技术中心,河北沧州061000;)
本文旨在研究饲料中不同叶黄
素含量对北京鸭生长后期(15~39
背部皮肤及胸大肌的L*、a*、b* (分
别表示亮度值、红度值、黄度值)。
1.3.2烤炙之后,胸肌颜色的测
定 每个试验组随机选择3只试验
多数的消费者在购买畜禽产品时, 产品的色泽是消费者挑选的重点之 一。为了满足消费者的这种心理,大 多数生产企业会在饲料中添加色素 来提高畜禽产品的色泽。
目前,叶黄素是使用最为广泛 的色素添加剂之一。叶黄素作为一
而增加,且处理5与对照组达到显 撚随着饲料中叶黄素的增加而有所
著性差异。
增加,这表明饲料中叶黄素对北京
'鸭胸肉的影响不会随烤炙而消失。
表5北京鸭胸肌颜色L*、a*、b*
差异。而b*随着饲料中叶黄素的增 加而增加。试验各组与对照组均达 到显著性差异。
2.1.2饲料中叶黄素对北京鸭背 部皮肤颜色的影响
饲料级叶黄素品质评价方法初探

一
2 5 5
总 类胡 萝 b素百分 吸光 系数 。
1 . 3 检 测 过 程 关键 控 制 点
1 . 3 . 1 称 样 量
国标 法 规 定 为 0 . 1 5 ~ 0 . 2 g , 经 实 验对 比 称 样 量
用 移管 准确 称 取 l m L滤液 到 1 0 m L容 量瓶 中 . 用 无
水 乙醇 稀释 至刻度 , 混匀。 试 液测 定 : 将试 样 分析液 置 于 l e m石 英 比色皿 中, 以无 水 乙醇 做空 白对 照 , 用 紫 外一 可见 分 光光 度 计在 4 4 5 + 1 n m处 的最大 吸收波 长处 测定 吸光度
围时 , 必 须调 整称样 量或 稀释倍 数 , 减少 检测误 差 。
1 . 3 . 2 超 声 提 取 时 间
着生 产厂 家付 出更 多 的成本 。 同时 , 批 与批之 间 含
量差 异较 大 时 .如 果 ቤተ መጻሕፍቲ ባይዱ方师 未及 时调 整 添加量 . 则
叶黄 素提取时 间不 同 , 检测 结果 也存在 差异 。 如 图 1 所示 , 因此 , 在检 测 过程 中 , 必 须 保证 2 0 a r i n以
之一。
然 。本 文分 别从 叶 黄 素 含 量 、 皂化程 度、 玉米黄质含 量、 p H 值 四 个 指 标 阐述 了叶 黄 素 产 品 品质 的 检 测 方 法 . 同 时结 合例
子 详 述检 测 注 意事 项 。
关键 词 : 叶黄素 ; 品质 ; 评 价 方 法
1 . 1 具体 分析 步骤
140117影响蛋黄颜色的因素及调控措施 (2)

2009年第26卷第1期一叶黄素因素叶黄素类化合物种类繁多,常见的有:黄体素,广泛分布于植物子叶中,其中黄玉米、苜蓿草、金盏花粉、草粉中含量丰富,着色效果较好;玉米黄质,玉米、辣椒、柑橘、苜蓿草、万寿菊及蘑菇中含量丰富,着色效果好;隐黄素,玉米、番木瓜、苜蓿和柑橘中含量丰富,着色效果差些;柑橘黄素,在柑橘皮、辣椒中含量丰富,细菌和真菌中也含有少量的柑橘黄素,着色效果一般;虾黄素,存在于虾、蟹、牡蛎、昆虫等动物体内,与蛋白质结合时呈蓝色,煮熟后结合键被破坏呈红色。
真正有着色意义的叶黄素只有黄体素和玉米黄质。
叶黄素中的各种色素显色效果不同,黄体素产生黄色,玉米黄质为橙色,虾黄素产生红色,柑橘黄素偏红色,因此,它们之间的分布比例将显示不同的色调。
黄色叶黄素(如黄体素)能明显提高蛋黄的黄色度和明亮度,红色度的高低由红色叶黄素(如玉米黄质)决定,黄色叶黄素与红色叶黄素搭配可产生橙色,但红色叶黄素能抑制黄色叶黄素提高蛋黄黄色度的作用,所以应注意红色叶黄素的用量。
二饲料因素1原料饲料原料中所含叶黄素的量是影响着色效果的重要因素,利用饲料原料增色的途径有:一是直接饲喂天然增色剂,这是生产无公害鸡蛋的发展方向。
常用的天然增色剂有黄玉米、苜蓿、三叶草、益母草、金盏菊、万寿菊、南瓜和艾叶粉等。
如每千克黄玉米粉内含胡萝卜素8.3mg ,用60%的黄玉米配合日粮饲喂10天,蛋黄颜色即可从1级提高到8级。
在鸡日粮中添加海带等海产植物或虾类等水产植物,分别按干品2%~5%和4%加入,几天后可使蛋黄明显增色。
二是在日粮中补充常用的蛋黄着色剂,分化学合成着色剂和天然着色剂,前者着色稳定,但过量易产生毒副作用,在生产中应控制用量。
天然着色剂毒副作用小,但价格昂贵。
天然着色剂常用的有两种:①金黄色素:美国公司生产,每千克含22g 活叶黄素,可以和其它着色剂一起使用,一般每吨蛋鸡饲料中添加金黄色素250g~350g 。
②露康定:德国巴斯夫公司生产的胡萝卜素,每10g 露康定可向蛋鸡提供110万国际单位的维生素A ,可减少配合饲料中维生素A 的添加量,每吨饲料中添加60g ,可使蛋黄变为深黄色。
饲料添加剂叶黄素的测定

饲料添加剂叶黄素的测定田芸;杜明花;殷东东【摘要】目的:测定饲料添加剂中叶黄素的含量.方法:选择由万寿菊花提取物制备的叶黄素浸膏作为研究对象,先采用无水乙醇+甲苯+丙酮+正己烷(6∶7 ∶7 ∶10)萃取试样,再采用紫外可见分光光度计测定波长为(474±1)nm处的叶黄素含量.结果:测定5份试样的叶黄素含量,测得叶黄素含量的质量分数分别为154.7、152.7、153.1、151.5、154.9、150.6、150.1、148.1、154.4 g/kg和152.1 g/kg,平均值为152.2 g/kg,RSD为1.4%;测定6份准确度试验的溶液,测得叶黄素精密度含量分别为152.7、153.7、153.4、152.7、152.4 g/kg和152.7 g/kg,平均值为152.9 g/kg,RSD为0.3%.结论:紫外可见分光光度计在测定饲料添加剂中叶黄素含量的准确性良好,能有效确保最终产品质量合格.【期刊名称】《食品安全导刊》【年(卷),期】2018(000)030【总页数】1页(P117)【关键词】饲料添加剂;叶黄素;测定【作者】田芸;杜明花;殷东东【作者单位】山东天音生物科技有限公司;山东天音生物科技有限公司;山东天音生物科技有限公司【正文语种】中文叶黄素又被称为植物黄体素,是一种经溶剂萃取等工艺制得的黄色至暗黄色的浸膏,目前尚未有人工合成单一异构体的叶黄素成功的报告,大多数叶黄素均是从万寿菊花朵等天然植物中提取获得,因此,其具有良好的抗氧化作用,然后将其作为饲料着色剂和添加剂添加到蛋鸡、肉鸡、鸭、鱼饲料中,不仅能使蛋心变红、动物皮肤脂肪变黄,还能提升商品肉蛋品质和促进其营养含量增加[1]。
本文主要是采用紫外分光光度法对饲料添加剂中的叶黄素含量进行测定,现报告如下。
1 实验材料及方法1.1 实验材料紫外可见分光光度计、超声波清洗器、、石英比色皿(1 cm)。
叶黄素浸膏、甲醇、正己烷、无水乙醇、甲苯、丙酮、萃取剂HEAT(无水乙醇+甲苯+丙酮+正己烷=6∶7∶7 ∶10)、10%硫酸钠水溶液(取100 g无水硫酸钠,加纯净水溶解,再移入100 mL容量瓶中)、40%氢氧化钾-甲醇溶液(取40 g纯氢氧化钾,加入20 mL纯净水迅速搅拌溶解,再加入50 mL甲醇,搅拌至澄清,再移入100 mL容量瓶中)。
饲料配方中常用原料及限量
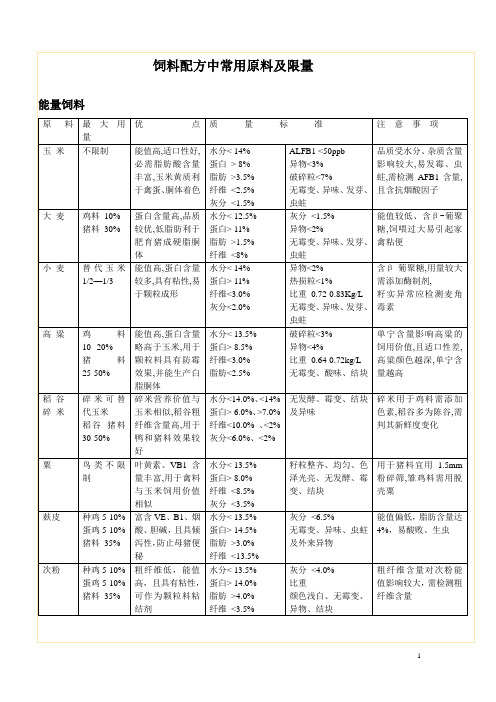
蛋白粉
鸡料10%
猪料10%
高能、高蛋白,蛋氨酸、胱氨酸、亮氨酸含量丰富,叶黄素含量高,有利于禽蛋及皮肤着色
60%40%
水分<11.0%、11.0%
粗蛋白>60%、40.0%
粗脂肪>1.0%、1.0%
粗灰分<3.7%、4.0%
叶黄素>200、100ppm
色泽一致,呈金黄色,无发霉、变质、虫蛀、结块,不带异嗅气味,不得掺杂
纤维<4.0%
灰分<5.0%
呈片状或细条状,无发酵、霉变、结块、异味及异嗅,无异物
蛋白含量低,生甘薯含生长抑制因子,通过加热可改善消化性,消除不良影响
乳清粉
肉鸡4%
乳猪25%
乳糖含量丰富,乳蛋白利用率高,具有可口的乳香味,适口性好,且含未知生长因子
水分< 5.0%
蛋白> 11.0%
脂肪>0.5%
灰分<9.0%
粗蛋白>45%、40.0%
粗灰分<8.0%、9.0%
粗纤维<1.0%、1.5%
细胞数>270、180亿个/g
重金属<10mg/kg
As<10mg/kg
无霉变、结块
酵母品质以反应底
物不同而变异,可
通过显微镜检测酵
母细胞总数判断酵母质量
动物蛋白
原料
最大用量
优点
质量标准
注意事项
鱼粉
幼畜禽
10%
成年畜禽5%
芝麻粕
肉大鸡5%
产蛋鸡8%
肉猪10%
蛋氨酸、色氨酸、B2、烟酸含量高,能值高于棉、菜粕,具有特殊香味
水分<7.0%
粗蛋白>44.0%
天然叶黄素对黄颡鱼生长性能和皮肤着色的影响

天然叶黄素对黄颡鱼生长性能和皮肤着色的影响王鲁波;薛敏;王嘉;吴秀峰;郑银桦;曹春燕【摘要】研究了天然叶黄素(源自万寿菊,含量为4.64%)的添加水平对黄颡鱼生长和皮肤着色效果的影响.在黄颡鱼基础饲料中,分别添加0%、0.15%、0.30%、0.60%、8.00%的受试物,在不影响饲料营养水平的基础上设计最高剂量组为可能摄入剂量组的10倍以上,经挤压熟化工艺加工后,实际检测叶黄素含量为未检出(检出限=0.5 mg/kg)、24.2、54.2、118.0、1 700.0mg/kg,依次命名为C、L24.2、L54.2、L118、L1700.饲养90 d后发现,添加天然叶黄素的4个剂量组的特定生长率和饲料效率、L24.2组的蛋白沉积率、L54.2组和L118组及L1700组的能量沉积率均显著高于对照组(P<0.05).体侧和腹部皮肤的黄度(b*)和饱和度(C*)随饲料中天然叶黄素含量的增加而逐步升高,L118组可达到饱和,并与L1700组之间没有显著差异(P>0.05),L118组和最高剂量组皮肤中黄色素过度沉积,并向肌肉中转移.皮肤中叶黄素的蓄积系数呈现先升高后下降的趋势,最高为76.25 mg/kg饲料.结果表明,24.2~1700mg/kg的天然叶黄素显著提高了初始体质量21 9的黄颡鱼的生长性能.天然叶黄素作为黄颡鱼皮肤着色剂的最适剂量为76.25 mg/kg饲料.%A 90 d experiment was conducted to investigate the effects of dietary natural lutein levels on growth, and body pigmentation of Pelteobagrus fulvidraco. Five experimental diets were designed with 0%, 0.15%, 0.3%, 0.6% and 8% of test compound and the highest dose was ten times more than possible dose. Five extruded pellets were determined xanthophylls dosage as non detected, 24.2, 54.2, 118 and 1700 mg/kg, respectively, which were named C, L24.2, L54.2, L 118 and L 1700 accordingly. Each treatment was randomly assigned four replicates with 30 fish in each tank. We foundpigment inclusion did significantly enhance growth performance and feed efficiency of P. fulvidraco. Productive protein value of L24.2 group, energy productive values of L 54.2, L 118, L 1700 groups were significantly higher than those of control group (P<0.05). Yellowness (b*) and saturation (c*) of lateral and ventral skin obviously increased until they reached saturation in L 1 18, which showed no difference with L 1700 group(P>0.05). Pigmentation of skin in L 1 18 and L 1 700 deposited excessively and transferred into muscle. Bioaccumulation factor of skin pigment increased firstly and then decreased, the highest in fish fed 76.25 mg/kg diet. The results showed 24.2-1700 mg/kg pigment inclusion significantly improved growth performance of P. fulvidraco. The optimum concentration of pigment as a colorant in yellow catfish was 76.25 mg/kg feed.【期刊名称】《水产学报》【年(卷),期】2012(036)007【总页数】9页(P1102-1110)【关键词】黄颡鱼;天然叶黄素;生长;着色【作者】王鲁波;薛敏;王嘉;吴秀峰;郑银桦;曹春燕【作者单位】中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081;中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081;中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081;中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081;中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081;中国农业科学院饲料研究所,国家水产饲料安全评价基地,北京100081【正文语种】中文【中图分类】S963天然叶黄素是一类广泛存在于蔬菜、花卉、水果、植物和蛋黄中无维生素 A活性的二羟基含氧类胡萝卜素, 呈桔红色或橙黄色, 其主要成分为叶黄素(1utein)和玉米黄质(zeaxanthin)[1]。
天然叶黄素在鱼类饲料中的应用

要有 4 种,分别为黑色素细胞、黄色素细胞、红色素细 周知,胆汁酸与脂溶性物质(如胆固醇)的吸收有关
胞和虹彩细胞。黑色素细胞受控于神经和内分泌系 (NRC,2011)。根据国内外的文献报道,推测万寿菊天
统,黄色素细胞和红色素细胞由激素调节,虹彩细胞 然叶黄素的吸收过程为:在食糜中伴随着脂肪被乳化
则由神经调节。前 3 种色素细胞内含有色素颗粒,通 成乳滴,乳滴在脂肪分解酶和胆汁的作用下进一步被
3 天然色素与鱼类的体色 自然界中鱼类的体色多种多样、五彩斑斓,体色
对鱼类的生理、行为和形态分布发挥着至关重要的作 用。最常见的鱼体颜色是背部深灰、腹部偏白,这是与 鱼类的生活环境密切相关,背部颜色与陆地颜色相 近,使得陆地上的动物由上往下看不易发觉,腹部颜
感性降低。 2 天然叶黄素在我国食品和饲料中规定的应用范围
过吸收特定波长的入射光而使鱼体呈现各种颜色;虹 消化,叶黄素最终被增溶在混合型的胶体微粒中,此胶
彩细胞的反射层能反射一定波长的光而使鱼体呈现 体微粒由胆汁酸、磷脂、胆固醇、脂肪酸和单酰甘油组
颜色。其中黄色素细胞的主要色素含有叶黄素和玉米 成,呈一个盘状结构,最外面由胆汁酸包围。然后这种
黄质、角黄素、隐黄质、金枪鱼黄素等叶黄素类的类胡 胶体微粒容易被肠道上皮细胞吸收,被吸收的叶黄素
[3] 曾小玲.在生长猪日粮中添加生物素的研究[D].华南农业大学, 1999.
[4] Martelli G,Sardi L,Parisini P,et al. The effects of a dietary sup- plement of biotin on Italian heavy pigs'(160 kg)growth,slaughter- ing parameters,meat quality and the sensory properties of cured hams[J]. Livest. Prod. Sci., 2005,93:117-124.
叶黄素混合物对鹦鹉鱼着色指标的影响

叶黄素又名“植物黄体素”,主要存在于蔬菜、花卉、水果与某些藻类生物中。
有研究表明叶黄素与饲料混合在一起投喂可使鱼体呈现不同的颜色,对维持鱼体肌肉、鳍条等组织颜色起着重要的作用。
叶黄素在鱼类着色上应用广泛,但在鹦鹉鱼上的着色尚未研究。
本试验通过研究不同浓度的叶黄素与不同浓度的磷脂、维生素E混匀作为饵料添加剂来观察对鹦鹉鱼着色的影响,以便为叶黄素混合物在鹦鹉鱼工厂化健康养殖中的应用提供参考。
1试验材料与方法1.1试验鱼520尾鹦鹉鱼取自天津市天祥水产有限责任公司养成车间。
挑选健康,大小均匀,体重5.08±0.88g,体长为5.3±0.5cm。
1.2试验药物叶黄素:浙江芭士曼生物科技有限公司,浓度为1%。
磷脂:上海津琪食品有限公司,浓度为100%。
维生素E:嘉兴芗园生技食品有限公司,浓度为50%。
2.试验方法2.1试验管理按照投喂方式的不同,试验设13组,有两组平行。
叶黄素按1‰(A1)、3‰(A2)、5‰(A3)浓度比例分别和磷脂按1‰(a1)、3‰(a2),维生素E1‰(b1)、3‰(b2)比例用水与成品饲料混匀的方式进行投喂。
实验设置13组。
分别放在水泥池(150cm×150cm×150cm)中,每池20尾,水池中水体积为80L。
一周换一次水,每次换水的量是实际水体积的1/4,水温保持25-28℃,pH6.5-7.5,溶氧8mg/L。
每天投喂三次,日投饵量是体重的1%。
试验时间30d,每天认真观察并记录鹦鹉鱼的摄食、残饵及死亡情况。
2.2着色指标的测定我们采用色差分析仪分别测量鹦鹉鱼的亮度(L)、红度(a)、黄度(b)。
测量前要擦干鱼体表面附着的水份,用仪器测量鹦鹉鱼表皮得出数据。
3结果与分析叶黄素混合物对鹦鹉鱼着色指标的影响我们用1‰、3‰、5‰浓度的叶黄素分别与1‰、3‰浓度的磷脂或1‰、3‰维生素E进行混合投喂,得到的亮度、红度、黄度数据由SPSS软件分析如下,结果见表2。
叶黄素的测定方法(立达尔公司企标方法)[优质文档]
![叶黄素的测定方法(立达尔公司企标方法)[优质文档]](https://img.taocdn.com/s3/m/0a80621b6d85ec3a87c24028915f804d2b168799.png)
叶黄素的测定方法A1.原理美国分析化学协会的分析方法——AOAC43.018—43.023“关于干燥植物和饲料中叶黄素的测定方法”是国际上通用的测定叶黄素的分析方法直接应用AOAC方法,会导致金菊黄复合预混合饲料中10—20%叶黄素的破坏。
这是由于金菊黄复合预混合饲料在生产过程中已经皂化,AOAC方法的皂化过程会使叶黄素水解和变性。
故采用下列简易方法:A2.仪器分析天平(准确到0.0001克),恒温水浴锅,50ml、100ml棕色容量瓶,5ml、10ml移液管,50ml、100ml烧杯,分光光度计。
A3.试剂丙酮(分析纯),无水酒精(分析纯),甲苯(分析纯),正己烷(分析纯),异丙醇(分析纯)。
提取剂(正己烷:丙酮:无水酒精:甲苯=10:7:6:7体积比)丙酮—异丙醇混合液(丙酮:异丙醇=1:1体积比)苏丹I标准溶液A4.实验步骤A4.1 称取0.5克金菊黄复合预混合饲料样品,于100ml棕色容量瓶中,精确到0.0001g加入约50ml提取剂,用胶塞塞紧,摇匀。
A4.2 用水浴锅加热10min,然后用自来水冷却至室温。
用提取剂定容至刻度,摇匀,静止10min。
A4.3 取上清液10ml至100ml 棕色容量瓶,加入30ml正己烷、20ml提取剂,然后用10%的硫酸钠溶液定容至刻度,剧烈振荡10min,置于暗处静止至澄清(15min)。
A4.4 取上清液5ml至50ml棕色容量瓶中,加正己烷定容至刻度,摇匀,测定溶液于474 nm 处的吸光度。
A4.5 计算A474×F×5000叶黄素(克/公斤)= ————————m×236注释:A474:474nm处的吸光度。
F:仪器偏离因子=0.561/A474(工作液)苏丹I标准溶液(工作液)的制备:(1)称0.0248克经过重结晶处理的苏丹I于100ml棕色容量瓶中,加丙酮—异丙醇混合液溶解,摇匀,定溶至刻度。
(2)取2ml于50ml棕色容量瓶,加丙酮—异丙醇混合液溶解,摇匀,定溶至刻度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
叶黄素在饲料中的检测及应用情况分析
摘要:近年来食品安全上频频暴露出各种问题,为了切实维护人民群众身体健康和生命安全,国务院通知(明确一些,什么编号的通知)加强食品添加剂监管,禁止在食品生产经营中以及饲料、畜禽水产养殖中非法添加非食用物质(好象还有预粉料也有要求),滥用食品添加剂。
目前有八种着色剂允许在饲料中添加,叶黄素便是其中之一。
关键词:叶黄素饲料着色剂
前言:中国是饲料工业和畜牧业大国,随着人们对食品安全和各种饲料添加剂的日益关注,叶黄素经常作为着色剂添加在饲料中,本文就叶黄素及其在饲料行业中的分析情况作一介绍。
(这段过度有点勉强,读起来感觉很牵强,前言一般是引子,能够将文章意义引申出来) 叶黄素,又名“植物黄体素”,广泛存在于蔬菜、水果和一些花卉中,是一类天然色素的总称,分子式为C40H56O2,属类胡萝卜素活性物质。
类胡萝卜素据其结构不同主要分为两大类:一类是碳氢型,称胡萝卜类;另一类是氧化型,由碳、氢、氧组成,称为叶黄素类。
叶黄素类化合物又有六类分别为:黄体素(又叫叶黄素)、玉米黄素、隐黄素、柑桔黄素、虾黄素(又叫虾青素)、角黄素(又叫斑蝥黄)、斑蝥黄质。
叶黄素中只有那些具有含氧功能团如羟基、酮基和羧基的化合物才能使动物靶组织着色,其它化合物沉积很少。
研究表明(Nelson 1989)(这个应该是参考文献啦!)积累在肉鸡皮下脂肪及蛋黄脂类物质中的叶黄素主要是黄体素(Lutein) 和玉米黄质(Zeaxanthin) 。
也就是说黄体素和玉米黄质具有着色活力被称作活性叶黄素。
(这段文字的目标是:介绍叶黄素的基础知识以及功效机理,跟目标关联不大的内容最好去掉,文章会显得紧凑)
随着人们对动物产品色泽的要求,营养学研究重点不仅要促进畜禽水产品生长,而且也有越来越多的研究集中在如何提高畜禽水产品的色、香、味、营养等商品的品质上,通过在饲料中添加叶黄素类着色剂以满足消费者需求即是其目标。
叶黄素在饲料中主要用于三黄鸡的皮肤、脚胫、禽蛋蛋黄、禽腹脂和水产动物如大黄鱼,小黄鱼,塘虱、甲鱼、黄颡鱼、斑点叉尾鮰、虾、蟹等的着色。
1999年7月26日农业部公告第105号规定有6种着色剂允许添加到饲料中,分别是:β-阿朴-8-胡萝卜素醛;辣椒红;β-阿朴-8-胡萝卜素酸乙酯;β,β-胡萝卜素-4,4-二酮(斑蝥黄);叶黄素(万寿菊提取物);虾青素。
农业部同时不断更新(饲料添加剂品种目录),以明确可在饲料中添加品种。
在2003年12月9号发布(中华人民共和国农业部公告第318号),在此目录中的着色剂产品除了以上6种外还增加了叶黄素和β-胡萝卜素两种可用于家禽,此次公告提出了化工合成的叶黄素被允许添加在饲料中。
绝大多数动物(包括鸡在内)都不能自身合成叶黄素,动物所需的叶黄素都必须来源于饲料,采食后将某些色素转移到动物组织中或转化为动物体色素表现出不同的色泽。
所以饲料配方师必须首先了解饲料原料中存在的天然叶黄素含量,以确定饲料中额外添加叶黄素量,以避免因多加造成成本的浪费,或少加造成着色效果不理想。
(这段建议提到前言最前面,才体现你写这篇文章的意义,并将前面两段合成一段)
针对不同的适用范围目前国家标准有两个方法测定叶黄素的含量,一个是GB/T 23187-2008饲料中叶黄素的测定,此方法适用于单一饲料、添加剂预混合饲料、浓缩饲料及配合饲料中叶黄素的测定,方法的定量限为0.5mg/kg(1);另一个是GB/T 21517-2008饲料添加剂叶黄素的测定,适用于以植物万寿菊中脂溶性提取物为原料,经皂化后,制成水剂或采用淀粉、玉米芯粉、白炭黑等辅料,有效成分主要是叶黄素和它的同分异构体玉米黄质,也有少量的其他类胡萝卜素和蜡质,饲料工业中作为着色剂类饲料添加剂(2)。
这个标准中介绍了两种测定方法,一种是采用无水乙醇提取,提取过程比较简单,在波长445nm处检测,测定的结果为总类胡萝卜的含量,测试结果一般比源于美国AOAC970.64中方法高约
(1~2)g/kg (这个数据来源),另一种是液相色谱法,主要用来作为产品中不同组分(叶黄素和玉米黄质)的定性鉴别和测试这两种组分的百分含量。
我们简单介绍下AOAC 法主要检测流程(3):
称取0.70g 试样于100mL 棕色容量瓶中,加入60mL 抽提剂(正已烷:无水乙醇:甲苯:丙酮按10:6:7:7体积比混合,摇匀备用)于容量瓶中,摇晃30秒;直接用胶塞塞住,放进56℃水浴锅中加热10分钟。
取出用冷水冷却至室温(不要去掉胶塞),用抽提剂定容,晃1分钟,放在暗处15分钟;准确移取10mL 上清液于100mL 的容量瓶中(容量瓶中已加入20mL 抽提剂,30mL 正已烷),用10% Na 2SO 4水溶液定容至刻度,剧烈晃1分钟,后放在暗处15分钟,直至澄清。
移取5mL 上清液于50mL 的容量瓶中,用正已烷定容,晃匀。
用正已烷做空白,在波长474nm 处尽快比色,测出吸光度A 。
计算结果:
G f A Kg g ⨯⨯⨯=
2365000)/(474叶黄色含量
A 474—试样在波长474nm 比色的吸光度;
f=0.561/A 474苏丹I0.04mmol (0.98~1.02); G —样品重,g 。
饲料中用的叶黄素按来源一般分为天然叶黄素和合成叶黄素两种,常见含天然叶黄素的饲料原料有玉米蛋白粉、黄玉米、金盏菊花、苜蓿粉等,黄玉米中平均叶黄素含量约20ppm (玉米黄质+黄体素) ;苜蓿粉中叶黄素含量在50-275ppm 之间,变化极大;金盏菊花中含高含量的类胡萝卜素3500-4500ppm ,其中叶黄素比例在90%左右,是良好经济的肉禽着色来源,使用于饲料中主要为其叶黄素提取物;玉米蛋白粉与玉米的叶黄素构成相同(55%黄体
素,45%玉米黄质),平均叶黄素含量约200 到 220ppm (4)。
下面我们参考AOAC 法,随机抽取生产中未添加叶黄素的饲料成品和不同产地的玉米蛋白粉来检测叶黄素含量,得如下表一数据:
表一
试样名称
叶黄素含量(mg/kg ) 试样名称 叶黄素含量(mg/kg )
111快大小鸡料 7.51 玉米蛋白粉 244 203出口肥鸭料 9.47 玉米蛋白粉 216 209出口肥鸭料 10.21 玉米蛋白粉 225 302瘦肉型小猪料 13.62 玉米蛋白粉 266 802快大瘦肉型小猪料
15.10 玉米蛋白粉 232 8611膨化鱼料 10.46 玉米蛋白粉 203 8613膨化鱼料 8.80 玉米蛋白粉 255 8618膨化鱼料 5.48 玉米蛋白粉 245 8686膨化鱼料 9.14 玉米蛋白粉 267 8993膨化鱼料
7.75 玉米蛋白粉 205 平均值 9.75 平均值 236 变异系数(%)
29.18
变异系数(%)
23.46
从表一可看出即使在饲料生产中未另外添加叶黄素,但生产出来的饲料成品中仍含有5-15mg/kg 左右的天然叶黄素;玉米蛋白粉是饲料行业用得较多的一种原料,其含天然叶黄素的平均含量在236mg/kg 。
饲料原料中存在的天然叶黄素含量随着原料不同差异较大。
所以配方师在做饲料配方时要以各原料实际检测的叶黄素含量数据为依据,以达到良好的着色效果。
叶黄素属非营养添加剂,在水产饲料中,仅允许添加来自万寿菊的天然叶黄素。
不过,
有报道显示,部分水产养殖户违规使用化合而成的叶黄素。
化工工合成色素会在畜产品中沉积,给健康带来威胁;而且人工合成或提取着色剂时,其中可能存在的中间副产物如一些万寿菊的提取物中, 不仅含有黄体素和米黄质, 还可能含有黄体素二棕榈酸酯和黄体素二肉豆蔻酯, 而这两者都是禁止使用的, 同时还可能含有溶剂残余的影响(5)。
因此,为了着色剂的安全使用,保证人类健康,饲料企业在使用叶黄素时,能达到希望的颜色即可,控制其添加量。
参考文献
【1】GB/T 23187-2008饲料中叶黄素的测定高效液相色谱法(1)
【2】GB/T 21517-2008饲料添加剂叶黄素(2)
【3】AOAC Of fi cial Method 970.64 (3)
【4】原料中叶黄素含量的评价及其应用曾岳明 (4)
【5】饲料叶黄素的研究新进展郭吉余刘汉林苏基双 1996年第6期广东饲料 (5)。
