大学化学期末考试卷(含答案)
大学有机化学期末考试题及参考答案

CH 3CHCH 2COOHBr大学有机化学期末考试题及参考答案一、命名法命名下列化合物或写出结构式(每小题1分,共10分) 1. 2.3. 4.5. 6. 邻苯二甲酸二甲酯7.苯乙酮8. 间甲基苯酚9. 2,4–二甲基–2–戊烯10. 环氧乙烷二、选择题(20分,每小题2分) 1.下列正碳离子最稳定的是( )(a) (CH 3)2CCH 2CH 3, (b) (CH 3)3CCHCH 3, (c) C 6H 5CH 2CH 2+++2.下列不是间位定位基的是( )CHCH 2(CH 3)2CHCOCH(CH 3)2ACOOHBSO 3HCCH 3DCHO(CH 3)2CHCH 2CHC(CH 3)2(CH 3)2CHCH 2NH 23.下列卤代烃与硝酸银的乙醇溶液作用,生成沉淀最快的是( ) A B C4.不与苯酚反应的是( )A 、NaB 、NaHCO 3C 、FeCl 3D 、Br 25. 发生S N 2反应的相对速度最快的是( ) (a) CH 3CH 2Br, (b) (CH 3)2CHCH 2Br, (c) (CH 3)3CCH 2Br6.下列哪种物质不能用来去除乙醚中的过氧化物( ) A .KI B 硫酸亚铁 C 亚硫酸钠 D 双氧水 7.以下几种化合物哪种的酸性最强( ) A 乙醇 B 水 C 碳酸 D 苯酚8. S N 1反应的特征是:(Ⅰ)生成正碳离子中间体;(Ⅱ)立体化学发生构型翻转;(Ⅲ)反应速率受反应物浓度和亲核试剂浓度的影响;(Ⅳ)反应产物为外消旋混合物( )A.I 、IIB.III 、IVC.I 、IVD.II 、IV 9.下列不能发生碘仿反应的是( )A B C D 10.下列哪个化合物不属于硝基化合物( )A B C D三、判断题(每题1分,共6分)1、 由于烯烃具有不饱和键,其中π键容易断裂,表现出活泼的化学性质,因此其要比相应烷烃性质活泼。
( )2、 只要含有α氢的醛或者酮均能够发生碘仿反应。
《大学化学》期末考试试卷附答案

《大学化学》期末考试试卷附答案一、选择题(共15小题,每小题3分,共45分)1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。
A、增大B、不变C、减小D、先增大后减小2、当主量子数n=3时,则角量子数l的取值为()。
A、1、2、B、 0、1、2C、0、1D、0、±1、3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。
A、反应已停止B、反应物中的一种已消耗完C、正逆反应的速率相等D、反应物均已消耗完毕4、下列化合物晶体中,既存在离子键又存在共价键的是()。
A、H2OB、 NaBrC、 CH3OHD、Na2O25、蔗糖的凝固点为()。
A、0℃B、高于0℃C、低于0℃D、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。
A、 s区B、d区C、 f区D、 p区7、质量作用定律只适用于()。
A、实际上能进行的反应B、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为1的反应D、已进行完的反应8、对于反应 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于()。
A、1B、6C、3D、129、下列物质中熔点最高的是()。
A、SiB、CO2C、ZnSD、Fe3C10、下列叙述中错误的是( )。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应11、某元素原子的外层电子构型为3s23p3原子中未成对电子数为()。
A、1B、2C、3D、012、等温等压下且不做非体积功条件下,反应自发进行的判据是()。
A、ΔHΘ<0B、ΔSΘ<0C、ΔG<0D、ΔfHmΘ<013、水具有反常的沸点,是因为分子间存在()。
A、色散力B、诱导力C、取向力D、氢键14、欲配制pH=5.0的缓冲溶液,则下列哪一种化合物及其盐的混合溶液合适?()。
大学有机化学期末考试试卷(B)及答案

—南昌大学考试试卷—【适用时间:2012 ~2013 学年第一学期试卷类型:[ B ]卷】2012~2013 学年第 一 学期 有机化学 试卷[ B ]参考答案一、填空题:(每小题 2 分,共 30 分)1、(5705) [解]2、(5710)[解]3、(5723)[解]4、(5740)[解]5、(5742)[解] C(CH 2OH)46、(5751)[解]7、(5758)[解]8、(5769)[解]9、(5766)[解] CH 2=CHCH 2COOH10、(5776)[解] CH 3CH =CH 2, (CH 3)2CHCH 2N(CH 3)2 11、(5787) [解]N OHNO 2OOO+CH 3COOHPhCOCH 3 , CH 3COHOOOOOOCOOEtO O O ONCH 2PhOO CH 3CH 3HCH 3NH 2HOOC13、(5811)[解]14、(5837)[解]15、(5862)[解]二、选择题:(每小题 2 分,共 30 分)1、(7755)[解] (C)2、(7735)[解] (C)3、(7745)[解] (C)4、(7759)[解] (A)5、(7763)[解] (C)6、(7766)[解] (D)7、(7809)[解] (C)8、(7812)[解] (B)9、(7815)[解] (B) 10、(7819)[解] (D) 11、(7820)[解] (C) 12、(7821)[解] (C) 13、 (7828)[解] (C) 14、(7826)[解] (B) 15、(7825)[解] (C三、合成题:(每小题 5 分,共 20 分)1、(2066)[解] 由1-丁醇 (1) 浓H 2SO 4,△ (2) Br 2(3) KOH/C 2H 5OH ,NaNH 2得1-丁炔 (4) HgSO 4 ,H + ,H 2O2、(2073)[解] (1) 乙醇氧化得乙醛 (2) 乙醇① HBr ② Mg(乙醚) ③ CH 3CHO ,H 3O + ④ HBr ⑤ Mg(乙醚) ⑥ HCHO,H 3O + ⑦ PBr 3 ⑧ KOH/醇3、(2137)[解] (1) OH -缩合 (2) H +(-H 2O) (3) NaOX(OH -) (4)H +4、(2140)[解] (1) PhCOOOH ,重排得内酯 (2)H 3O +四、机理题:(每小题 5 分,共 10 分)1、(2567)[解] 酰基上的亲核取代反应。
中国医科大学医用化学期末考试复习题及参考答案

说明:作业练习。
单选题:1.下列化合物不属于脂环烃的是A.环己炔B.2-甲基环己烯C.甲苯D.1,2-二甲基环己烷正确答案:"C"2.能区别苯和苯甲醚的试剂是A.NaHCO3B.NaOHC.NaClD.浓HCl正确答案:"D"3.下列化合物不能发生消除反应的是A.氯化苄B.氯乙烷C.2-氯丁烷D.叔丁基溴正确答案:"A"4.下列化合物有顺反异构体的是A.丙烯B.1-氯丙烯C.环己烯D.2-丁炔正确答案:"B"5.下列各糖中不能与托伦试剂反应的是A.α-D-吡喃葡萄糖B.α-D-呋喃果糖C.蔗糖D.麦芽糖正确答案:"C"6.下列脂肪酸碘值最大的是A.亚油酸B.油酸C.软脂酸D.硬脂酸正确答案:"A"7.下列化合物属于五元杂环的是A.呋喃B.嘌呤C.吡啶D.吡喃正确答案:"A"8.为配制pH=5.05的缓冲溶液,已知pKa(HAc)=4.75, 用等浓度的HAc溶液和NaAc溶液配制时,其体积比约为A.2B.0.5C.0.3D.1正确答案:"B"9.下列说法中错误的是A.所有稳定单质的标准摩尔生成热都等于零B.氧气和氮气的标准摩尔燃烧热都等于零C.二氧化碳的标准摩尔燃烧热等于零D.氢气的标准摩尔燃烧热就是气态水的标准摩尔生成热正确答案:"A"10.温度由20℃升至30℃,某反应的速率增加1倍,该反应的活化能为A. 51.2 kJ·mol-1B.345.7mol-1C.22.24mol-1D.150.1mol-1正确答案:"C"11.相同温度下,欲使两种稀溶液间不发生渗透,应使两溶液A.物质的量浓度相同B.质量浓度相同C.质量分数相同D.渗透浓度相同正确答案:"D"12.在纯水中,加入一些酸,其溶液的A.[H+]与[OH-]乘积变大B.[H+]与[OH-]乘积变小C.[H+]与[OH-]乘积不变D.[H+]等于[OH-]正确答案:"C"13.Mg(OH)2在下列溶液或溶剂中的溶解度最小的是A.0.010mol·L-1NH3溶液B.0.010mol·L-1NaOH溶液C.0.010mol·L-1MgCl2溶液D.0.010mol·L-1NH4Cl溶液正确答案:"B"14.已知AgCl、Ag2CrO4、Ag2C2O4和AgBr的分别为1.56×10-10、1.1×10-12、3.4×10-11和5.0×10-13,在下列难溶盐的饱和溶液中,Ag+离子浓度最大的是 A.AgClB.Ag2CrO4C.Ag2C2 O4D.AgBr正确答案:"C"15.将25mL2.0mol·L-1 NaOH溶液加水稀释至500mL,其质量浓度为A.4g·L-1B.5g·L-1C.0.1g·L-1D.0.14mol·L-1正确答案:"A"16.将红细胞置于下列溶液中,可使红细胞保持正常形状的是A.0.9g·L-1NaCl溶液B.5g·L-1葡萄糖溶液C.0.1mol·L-1NaCl溶液D.0.15mol·L-1NaCl溶液正确答案:"D"17.将下列物质加入HAc溶液中,能产生同离子效应的是A.HClB.NaClC.Na2CO3D.H2O正确答案:"A"18.某一难溶强电解质A2B在水溶液中达到溶解平衡时,[A+]=xmol·L-1,[B2+]=ymol·L-1,则下列等式中正确的是A.KspΘ=x2yB.KspΘ=0.5x2yC.KspΘ=4x2yD.KspΘ=xy正确答案:"A"19.下列说法中正确的是A.25℃时,以液态氨为溶剂的溶液中,存在pKNH3+pKNH4+B.25℃时,HCl溶液中存在着[H3O+]+[OH-]=14C.25℃时,HAc的KHAc=1.75×10-5,所以cHAc=0.1mol·L-1的溶液中D.25℃时,Ca3(PO4)2的Ksp与溶解度S的关系为正确答案:"C"20.用半透膜将两溶液分开,其溶剂渗透方向错误的是A.向渗透浓度高的方向B.向单位体积内溶剂分子多的方向C.向渗透压力高的方向D.向单位体积内溶质粒子数多的方向正确答案:"B"21.对于反应H2O OH- + H+,下列说法不正确的是A.H+是酸,OH-是它的共轭碱B.[OH-]越大,则[H+]越小C.当[H+]≥1mol·L-1时溶液中还存在OH-D.[OH-]=1mol·L-1,则pH=14正确答案:"A"22.正常人血液中缓冲系的缓冲比为A.10/1B.1/10C.1/20D.20/1正确答案:"D"23.用H2CO3~HCO3-(pKa=6.37)缓冲系组成了下列pH值的不同缓冲溶液,如总浓度相同,则缓冲能力最强的缓冲溶液为A.pH=5.37的缓冲溶液B.pH=6.37的缓冲溶液C.pH=7.0的缓冲溶液D.pH=7.37的缓冲溶液正确答案:"B"24.KH2PO4~K2HPO4组成的缓冲溶液中,抗碱成分是A.H3PO4B.H2PO4-C.HPO42-D.PO43-正确答案:"B"25.为配制pH=5.05的缓冲溶液,已知pKa(HAc)=4.75, 用等浓度的HAc溶液和NaAc溶液配制时,其体积比约为A.2.0B.0.5C.0.3D.1.0正确答案:"B"26.在一绝热箱中装有水,水中有一电阻丝,由蓄电池供电,通电后水及电阻丝的温度均略升高,今以水为系统,其余为环境,则A.Q<0,W=0,ΔU<0B.Q=0,W<0,ΔU>0C.Q>0,W=0,ΔU>0D.Q<0,W=0,ΔU<0E.Q=0,W=0,ΔU=0正确答案:"C"27.一封闭系统,当状态从A到B发生变化时,经历二条任意的途径,则A.Q1=Q2B.W1=W2C.Q1+W1=Q2+W2D.Q1-W1=Q2-W2E.ΔU=0正确答案:"C"28.在标准状态下的反应H2(g)+Cl2(g)→2HCl(g), 其=-184.61 kJ·mol-1,由此可知HCl(g)的标准摩尔生成热应为A.-184.61KJ·mol-1B.-92.30KJ·mol-1C.-369.23KJ·mol-1D.-46.15KJ·mol-1E.+184.61KJ·mol-1正确答案:"B"29.下列说法中,正确的是A.化学反应的热效应等于ΔrHB. 等温等压条件下,化学反应的热效应QP=ΔrHC.只有在等压条件下的化学反应才有焓变ΔrHD.焓的绝对值是可以测量的E.ΔrH与过程有关正确答案:"B"30.已知反应B→A和B→C所对应的等压反应热分别为Δr Hm,20)和ΔrHm,30,则反应A→C的ΔrHm,10是A.Δr Hm,10=ΔrHm,20+ΔrHm,3B.Δr Hm,10=ΔrHm,20 - ΔrHm,3C.Δr Hm,10=ΔrHm,30 - ΔrHm,2D.Δr Hm,10=2ΔrHm,20 - ΔrHm,3E.Δr Hm,10=ΔrHm,20 - 2ΔrHm,3正确答案:"C"31.用判断反应进行的方向和限度的条件是A.等温B.等温等压C.等温等压且不作有用功D.等温等压且不作膨胀功E.等压正确答案:"C"32.今有下列物质:① LiCl(s),② Cl2(g),③ Li(s),④ Ne(g),⑤ I2(g)。
北京理工大学珠海学院2023学年第二学期《分析化学》期末考试卷及答案(B卷)

北京理工大学珠海学院《分析化学》2023 一 2023 学年其次学期期末考试试卷〔B 卷〕班级姓名学号成绩一、选择题〔每题2分,共50分)【得分:】1.依据测定原理和使用仪器的不同,分析方法可分为( )。
A.质量分析法和滴定分析法B.气体分析法和仪器分析法C.化学分析法和仪器分析法D.色谱分析法和质谱分析法2.以下可用于削减测定过程中的偶然误差的方法是〔)。
A.进展比照试验 B.进展空白试验C.进展仪器校准D.增加平行试验次数3.以下各数中有效数字位数为四位的是:( )A. WCao=25.30%B. [H+]=0.0235 mol/LC.pH=10.46D.420Kg4.天平称量确定误差极值为0.2mg,假设要求称量相对误差小于0.1%,则应至少称取〔) 。
A. 1gB. 0.2gC. 0.lgD. 0.02g5.直接法配制标准溶液必需使用( )。
A.基准试剂B.化学纯试剂C.分析纯试剂 D.一般试剂6.化学计量点是指( )。
A.指示剂发生颜色变化的转变点B.标准溶液与被测物质按化学计量关系定量反响完全的那一点C.反响到达质量相等的那一点D.停顿滴定的那一点7.共轭酸碱对的Ka 与Kb 的关系是〔)。
A.KaKb=1B.KaKb =KwC.Ka/Kb =KwD.Kb /Ka =Kw8.浓度为 0.1 mol/LHAC(pKa=4.74)溶液的 pH 是( )。
A.4.87B.3.87C.2.87D.1.879.标定盐酸溶液常用的基准物质是〔 )。
第页共8页A.无水Na2CO3B.草酸〔H2C2O4·2HO)C.CaCO3 D.邻苯二甲酸氢钾10.用EDTA 直接滴定有色金属离子M,终点所呈现的颜色是〔)。
A.游离指示剂的颜色B.EDTA-M 络合物的颜色C.指示剂-M 络合物的颜色D.上述A+B 的混合色11.一般状况下,EDTA 与金属离子形成的协作物的协作比为〔)。
A.1: 2B.1: 1C.2: 1D.1:412.氧化复原滴定法中,常常承受的指示剂类型不包括〔)。
2020-2021某大学《有机化学》期末课程考试试卷A5(含答案)

2020-2021《有机化学》期末课程考试试卷A5专业: 考试日期:总分:100分 考试时间:120分钟 试卷类型 闭卷一、命名或写出结构式(每小题2分,总计20分)。
1、 2、3、 4、5、6、水杨酸7、 D -葡萄糖 8、 甘油9、 10、1-甲基-4-异丙基环己烷的优势构象二、选择题(每小题2分,总计18分)。
1、C 4H 9OH 的同分异构是:( )A 、B 、C 、D 、 2、下列物质的沸点最高的为:( )A 、3,3-二甲基戊烷B 、 庚烷C 、 2-甲基-己烷D 、 己烷 3、下列物质与FeCl 3能发生显色反应的为:( )A 、B 、C 、D 、 4、下列物质酸性最强的为:( ) A 、 B 、 C 、 D 、5、下列化合物中,能与I 2/OH -发生碘仿反应的是( )A 、B 、C 、D 、6、下列物质在非极性溶剂中碱性最强的为:( )A 、 N -甲基苯胺B 、乙酰苯胺C 、 邻苯二甲酰亚胺D 、 苯胺7、衡量油脂不饱和程度所用方法的名称为:( )A 、 皂化值B 、碘值C 、酸值D 、等电点值 8、下列化合物的正确名称是( )A 、对甲基苯磺酰胺B 、对甲苯基苯磺酰胺C 、N-甲基对甲苯磺酰胺D 、甲氨基对甲苯磺酰胺9、下列化合物可以发生Cannizzaro (康尼扎罗)反应的是( )A 、B 、C 、D 、三、完成反应方程式(每空2分,总计22分)。
1、2、3、4、5、CH 3CH 2OCH 2CH 3CH 3CH 2CHOHCOOCH 2CH 3CH 3COOCH 3OCH 33CH 3CH 3CH3CH 3CHCH 2C CH 2OHCH 2CH 3Br H COOHCH 3C CH 2CH 3OOHCH 3CH 3OCH 2CH 3CH 3C OOH CH 3COOHCOOH O 2NOHH 3H 5CC H HH 3C COOCH 3浓+ CH 3CH 2CHOCHO HOOCCH 22CH 2CH 2COOH O H 2CH 3CHCH 2CH 2CH 2COOHOH催化剂OCH3+ HNO 3H 2SO 4CHCCH 3CH 3CH 2OH?(1)HCN (2)H +??HC CH2H 3+O?-?32+?CH3SO 2NHCH 3O CHOCCH 3OCH 3CHO OCH 3CH 3C OOH O2CH 3CH CH 3CH 2C CH 3CH2CH 2OH CH 3CHO 院系:___________ 班级:___________ 姓名:____________ 学号:___________………………………密…………………封……………………线…………………………四、鉴定题(10分)。
大学无机化学综合测试题+答案(吉林大学、武汉大学、第二版) 试题 期末考试 —— 内蒙古民族大学.DOC (13)

内蒙古民族大学2013-2014学年一学期课程考试试卷答案(A 卷)课程名称:普通化学和无机化学 考试时间:120分钟 年级:xxx 级专业: xxx题目部分,(卷面共有53题,100分,各大题标有题量和总分) 一、单项选择题(20小题,共20分)1、在 10℃,101 kPa 下, 在水面上收集 1.00 dm 3气体,经干燥后气体的体积变为(10 ℃,O H 2p = 1.227 kPa)A 、0.012 dm 3B 、0.988 dm 3C 、0.908 dm 3D 、0.992 dm 3 答案:B2、当 1 mol 难挥发非电解质溶于 4 mol 溶剂中, 溶液的蒸气压与纯溶剂的蒸气压之比为 A 、 1:5 B 、 1:4 C 、 4:5 D 、 5:4 答案:C3、下列叙述正确的是A 、m r S ∆= (∑ S ∆生成物-∑ S ∆反应物)B 、 一个自发进行的反应,体系自由焓(Gibbs 自由能)减少等于体系对环境所作最大功 -G = WC 、 某气相反应m r G ∆是指反应物与产物都处于298K ,且气体总压为101.3 kPa 时 该反应的自由能变(Gibbs 自由能)D 、 同类型的二元化合物可用它们的NH 4+值直接比较其热力学稳定性 答案:D4、已知 Zn(s) +21O 2(g)= ZnO(s) m rH ∆ 1= -351.5 kJ ·mol -1Hg(l) +21O 2(g) = HgO(s ,红) m rH ∆ 2= -90.8 kJ ·mol -1则 Zn(s) + HgO(s ,红) = ZnO(s) + Hg(l) 的 mrH ∆为(kJ ·mol -1)A 、 442.3B 、 260.7C 、 -260.7D 、 -442.3 答案:C5、液态水在100℃、101 kPa 下蒸发,下述正确的是 A 、 ΔU = 0 B 、 ΔH = 0 C 、 ΔG = 0 D 、 ΔS = 0 答案:C6、在一定温度下,将1.00 mol SO 3放入1.00 dm 3的反应器中,当反应: 2SO 3(g)2SO 2(g) + O 2(g) 达到平衡时,容器内有SO 2 0.60 mol ,反应的平衡常数K c 为A 、0.36B 、0.68C 、0.45D 、0.54 答案:B7、某溶液中含有0.01 mol ·dm -3 AgNO 3、0.01 mol ·dm -3 Sr(NO 3)2和0.01 mol ·dm -3 Pb(NO 3)2、0.01 mol ·dm -3 Ba(NO 3)2四种盐,向该溶液中逐滴加入K 2CrO 4溶液时,则沉淀的先后顺序是A 、Ag 2CrO 4,PbCrO 4,SrCrO 4,BaCrO 4B 、 PbCrO 4,Ag 2CrO 4,SrCrO 4,BaCrO 4C 、 SrCrO 4,PbCrO 4,Ag 2CrO 4,BaCrO 4D 、PbCrO 4,Ag 2CrO 4,BaCrO 4,SrCrO 4(注:K sp (Ag 2CrO 4) =1.1 ⨯ 10-12,K sp (PbCrO 4) = 1.8 ⨯ 10-14 K sp (BaCrO 4) = 1.2 ⨯ 10-10,K sp (SrCrO 4) = 2.2 ⨯ 10-5) 答案:D8、铅蓄电池放电时,电解质密度的变化是 A 、 密度不变 B 、密度变大 C 、密度变小 D 、不能确定 答案:C 9、对于反应I 2+ 2ClO-3=2IO-3+ Cl 2,下面说法中不正确的是A 、此反应为氧化还原反应B 、I 2得到电子,ClO-3失去电子C 、I 2是还原剂,ClO -3是氧化剂D 、 碘的氧化数由0增至 +5,氯的氧化数由 +5 降为0答案:B10、一个氧化还原反应在特定温度下的m r G ∆可由下列测量计算的是 A 、该温度下反应的平衡常数 B 、速率常数随温度的变化C 、该温度下相应电池的电动势D 、该温度下反应的 m r H ∆ 答案:A11、某一级反应的半衰期t 1/2是30 min ,则其反应速率常数k 为 A 、0.023 min -1 B 、20.8 min -1 C 、0.23 min -1 D 、不能确定 答案:A12、在确定的温度范围内,Arrhenius 公式适用的条件是 A 、仅适用于基元反应 B 、可适用于任何反应C 、仅适用于具有简单级数的反应D 、适用于有明确反应级数及速率常数k ,且在该温度区间内E a 近似不随温度变化的一些反应 答案:D13、硫代乙酰胺(TA)水解反应CH 3C NH 2S+ H 2O −→−H 2S +CH 3C NH 2O的速率定律为-d[TA d ]t = k [H +][TA],若在25 ℃ 的TA 和H +浓度均为0.10 mol ·dm -3 的溶液中加醋酸钠,下面叙述中正确的是 A 、反应速率变慢,但k 保持不变 B 、反应速率和k 都变小C 、反应速率增加,但k 保持不变D 、反应速率和k 都增加 答案:A14、已知H 2O 2分解是一级反应, 若浓度由1.0 mol ·dm -3降至0.60mol ·dm -3需20 min , 则浓度从0.60 mol ·dm -3降至0.36 mol ·dm -3,所需的时间是 A 、超过 20 min B 、20 min C 、低于 20 min D 、无法判断 答案:B15、设有两个化学反应A 和B ,其反应的活化能分别为E A 和E B ,E A > E B ,若反应温度变化情况相同(由T 1→T 2),则反应的速率常数k A 和k B 的变化情况为 A 、k A 改变的倍数大 B 、k B 改变的倍数大 C 、k A 和k B 改变的倍数相同 D 、k A 和k B 均不改变 答案:A16、下列元素电负性大小顺序中,正确的是 A 、Be > B > Al > Mg B 、B > Al > Be ≈ Mg C 、B > Be ≈ Al > Mg D 、B ≈ Al < Be < Mg 答案:C17、NaCl 结构是阴离子排成最紧密堆积,阳离子占据的是 A 、所有八面体空穴 B 、 所有四面体空穴 C 、二分之一的八面体空穴 D 、四分之一的八面体空穴 答案:A18、根据分子轨道理论,下列分子或离子中键级最高的是A 、+22OB 、+2OC 、O 2D 、-2O答案:A19、下列分子中偶极矩大于0的分子是 A 、SF 4 B 、 PF 5 C 、SnF 4 D 、BF 3答案:A20、下列分子或离子中,键角最大的是 A 、XeF 2B 、NCl 3C 、-23COD 、+4PCl答案:A二、填空(20小题,共20分)1、30℃时纯水的蒸气压为 4243 Pa 。
【期末复习】大学《无机化学与化学分析》第二学期期末考试试卷答案

D
D
A
C
C
1.既溶于过量氨水,又溶于过量NaOH溶液的是。
(A) Ni(OH)3(B) Fe(OH)3(C) Zn(OH)2(D) Al(OH)3
2.下列各组离子中的所有离子都能将I-氧化的是。
(A) Hg2+, Ni2+, Fe2+(B) Ag+, Sn2+, Pb2+
(C) Co2+, Cr2O72-, Sb3+(D) MnO4-, Cu2+, Fe3+
5. (×)平行实验的精密度越高,其分析结果的准确度也越高。
6.(×) CrCl3在金属焊接时用于清除金属表面氧化物。
7.(×)铁(Ⅲ)、钴(Ⅲ)、镍(Ⅲ)氧化物的氧化性从强到弱的次序为:Fe2O3>Co2O3> Ni2O3。
8. (√)锰的氧化物的酸性随氧化数的增大而逐渐增强。
9.(×)同一金属组成不同氧化数的卤化物,高氧化数卤化物多为离子型化合物。
16.读取滴定管数时,下列错误的是。
(A)在常量分析中,滴定管读数必须读到小数点后第四位
(B)读数时,应使滴定管保持垂直
(C)读取弯月面下缘最低点,并使视线与该点在同一水平面上
(D)读数前检查管壁是否挂水珠,管尖是否有气泡
17.间接碘量法中加入淀粉指示剂的适宜时间是。
(A)滴定开始时
(B)用标准滴定溶液滴定近50%时
天津大学试卷专用纸
学院专业班年级学号姓名共5页第2页
8.下列各族元素中,金属的化学活泼性随原子序数增加而减弱的是。
(A) IA (B) IIA (C) IIIA (D) IB
9.下列硫化物中,不溶于Na2S溶液的是。
贵州师范大学大二下有机化学期末考试题库及答案

贵州师范大学大二下有机化学期末考试题库及答案一、选择题:(本题包括13小题,1-9题每题只有1个选项符合题意,每小题3分,10-13题每题有1-2个答案,每小题4分,共43 分) 下列物质中属于氧化物的是A、O2B、Na2OC、NaClOD、FeSO42、根据我省中心气象台报道,近年每到春季,我省沿海一些城市多次出现大雾天气,致使高速公路关闭,航班停飞雾属于下列分散系中的A溶液B悬浊液C乳浊液D胶体3、能用H++OH-=H2O来表示的化学反应是A氢氧化镁和稀盐酸反应BBa(OH)2溶液滴入稀硫酸中C澄清石灰水和稀硝酸反应D二氧化碳通入澄清石灰水中4、下列反应中必须加入还原剂才能进行的是ACl2→Cl-BZn→Zn2+CH2→H2ODCuO→CuCl25、将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是()A冷水B沸水CNaOH溶液DNaCl溶液6、某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和SO42-的离子个数比为A1∶2B1∶4C3∶4D3∶27、在碱性溶液中能大量共存且溶液为无色透明的离子组是AK+、MnO4-、Na+、Cl-BK+、Na+、NO3-、CO32-CNa+、H+、NO3-、SO42-DFe3+、Na+、Cl-、SO42-8、对溶液中的离子反应,下列说法:①不可能是氧化还原反应;②只能是复分解反应;③可能是置换反应;④不能有分子参加其中正确的是A①③B③C①②D③④9、下列反应属于氧化还原反应的是ACaCO3+2HCl=CaCl2+CO2↑+ H2OBCaO+H2O=Ca(OH)210、下列反应的离子方程式书写正确的是A氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++CuB稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑C氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓D碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑11、从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是A2NaBr+Cl2=2CaCl+Br2BAlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaClC2H2S+SO2=2H2O+3S↓DC+CO22CO12、下列物质属于钠盐的是ANa2OBCH3COONaCNaHSO4DNa2O213、在下列反应中,HCl 作氧化剂的是ANaOH+HCl=NaCl+H2OBZn+2HCl=ZnCl2+H2↑CMnO2+4HCl(浓)MnCl2+2H2O+Cl2↑DCuO+2HCl=CuCl2+H2O二、填空题:(25分)14、下列物质:⑴Na⑵Br2⑶Na2O ⑷NO2⑸CO2⑹SO3⑺NH3⑻H2S ⑼HCl ⑽H2SO4⑾Ba(OH)2⑿NaCl ⒀蔗糖⒁NaCl溶液15、属于电解质的是,属于非电解质的是,能导电的是16、(1)在Fe3O4+4CO3Fe+4CO2的的中,是氧化剂,是还原剂,元素被氧化,元素被还原(4分)(2)写出下列物质的电离方程式:(3分)NaHSO4,K2SO4,NH4NO317、(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:(5分);(2)、如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是:(3)此时最好用含氢氧化稆的胃药(如胃舒平)离子方程式:三、简答题:(4分)18、已知NaCl中混有Na2CO3固体,请用简要的语言说明除去Na2CO3的方法,并写出有关的反应化学方程式(4分)四、实验题:(17分)19、(1)用下列仪器的编号回答问题(7分)①容量瓶②蒸馏烧瓶③酸式滴定管④量筒⑤烧杯⑥托盘天平⑦分液漏斗⑴加热时必须垫石棉网的有,⑵使用时必须检查是否漏水的有,⑶标有零刻度的有(2)在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同](4分)试回答⑴此实验中,观察到的现象有①,②⑵写出实验过程中反应的离子方程式为由A和B两种盐组成的混合物,进行了下列实验:(6分)试判断,A、B分别是写出实验过程中加水时时发生反应的离子方程式五、计算题:(15分)20、(1)实验室制取氧气时,取一定量的氯酸钾和二氧化锰的混合物加热:2KClO3、2KCl+3O2↑(2)开始时二氧化锰含量为265﹪,当二氧化锰的含量为30﹪时,求氯酸钾的分解率是多少?7分)(3)将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是多少?(8分)参考答案1B 2D 3C 4A 5B 6A 7B 8B 9C 10A 11CD 12BC 13B14⑶⑻(9)(10)(11)(12);(4)(5)(6)(7)(13);(1)(14)15Fe3O4、CO、C、Fe16略;17HCO3-+H+=CO2↑+H2O;因产生CO2压力增大而加剧胃壁穿孔;Al(OH)3+3H+=Al3++3H2O;18将将混合物溶解,加入足量的盐酸,反应后将溶液加热至干即可,Na2CO3+2HCl=2NaCl+CO2↑+H2O19(1)、②⑤⑵、①③⑦⑶、③⑥;20(1)溶液里有白色沉淀产生;(2)小球下沉到烧杯底;(3)Ba2++2OH-+2H++SO42-=BaSO4↓+4H2O;21K2CO3、CuSO4(可对换),Cu2++CO32-=CuCO3↓2240.6﹪231.25mol/L 16.1%。
医用化学大一期末考题及答案

医用化学大一期末考题及答案一、填空题1.___________ 是一种由超声波下放,以消除肝脏中的脂肪和其他物质的医疗过程。
答案:腔内化学疗法2.在医用化学中,_________ 是指一种衡量溶液中氢离子活动度的指标。
答案:酸碱指数3.___________ 是通过气管插管向患者的气管和肺部输送气体。
答案:呼吸器4.___________ 是一种常用的用于治疗宫外孕的激素类药物。
答案:甲状腺素5.检测疾病标记物常用的方法包括酶联免疫吸附法(ELISA)和_________。
答案:放射免疫测定法二、选择题1.透析是一种常用的治疗方式,以下哪种透析方式是通过腹膜进行的?A. 血液透析B. 透析机C. 血液净化D. 腹膜透析答案:D. 腹膜透析2.化学发光是一种在医学诊断中常用的分析方法,以下哪种物质常被用于产生化学发光?A. 激素B. 酶C. 荧光标记物D. 细菌答案:C. 荧光标记物3.医用化学中的溶液稀释常用的单位是:A. ppmB. %(百分比)C. mol/LD. mEq/L答案:B. %(百分比)4.化学治疗是治疗癌症的主要方式之一,以下哪种药物常被用于化学治疗?A. 抗生素B. 维生素C. 激素D. 抗癌药答案:D. 抗癌药5.pH指数常被用于表示溶液的酸碱程度,以下哪种溶液的pH值最接近7?A. 酸性溶液B. 中性溶液C. 碱性溶液D. 盐溶液答案:B. 中性溶液三、简答题1.请简要描述医用化学在疾病诊断中的应用。
医用化学在疾病诊断中起着重要作用。
通过检测患者体内的生物标记物,可以确定患者是否患有某种疾病以及疾病的严重程度。
医用化学常用的检测方法包括酶联免疫吸附法(ELISA)、放射免疫测定法等。
这些检测方法可以通过血液、尿液、唾液等样本来获取患者的生物信息,从而进行疾病的早期诊断和治疗。
2.请简要介绍医用化学在药物治疗中的应用。
医用化学在药物治疗中起到重要的作用。
通过研究药物的化学结构和性质,医学工作者可以设计合成出更加有效和安全的药物。
dh1a

重庆大学大学化学(Ⅰ)期末考试试卷(A)试卷号:B070006学院___________ 专业___________姓名___________ 学号___________(请考生注意:本试卷共 5 页)一、对的在题末括号内填“+”、错的填“-”。
(本大题分7小题, 每小题1分, 共7分)1、温度升高能使反应速率增大的原因是反应的活化能随之降低了。
答:()2、一个反应如果是放热反应,当温度升高时,表示补充了能量,因而有助于提高该反应进行的程度。
答:()3、现有H2CO3、H2SO4、NaOH、NH4Ac 四种溶液,浓度均为0.01 mol⋅dm-3,同温度下在这四种溶液中,c(H+) 与c(OH-) 之乘积均相等。
答()4、非金属元素之间形成的二元或多元化合物都不是离子化合物。
答()5、电极极化的结果使得实际分解电压变大,因此在计算阴极实际析出电势时,E实析(阴)=E理- η阴(η阴表示阴极超电势)。
答()6、利用KSCN 可以检出溶液中微量Fe3+的实验事实,可以推测K( 稳,[Fe(SCN)6]3-) < K( 稳,[Fe(H2O)6]3+)。
答()7、凡是d 轨道中存在未成对电子的过渡金属离子的水溶液一般都具有一定的颜色,而没有未成对 d 电子的过渡金属离子的水溶液都是无色的。
答()二、将一个或两个正确答案的代码填入题末的括号内。
若正确答案只有一个,多选时,该题为0分;若正确答案有两个,只选一个且正确,给1分,选两个且都正确给2分,但只要选错一个,该小题就为0分。
(本大题分15小题, 每小题2分, 共30分)1、假定空气中,体积分数ϕ(O2) = 0.21,ϕ(N2) = 0.79。
如果大气压力为98.7 kPa,则氧的分压力为答:()(1) 20.7 kPa (2) 41.3 kPa (3) 77.3 kPa (4) 42.7 kPa2、确定电子自旋运动状态的量子数是答:()(1)n (2)m(3)m s (4)l3、下列物质中,属于原子晶体的是答:()(1)CO2(2)SiO2(3)CsCl(4)CaO4、BaCO3能溶于盐酸的最合理解释是答:()(1)BaCO3的K较大;(2)BaCO3在水中的溶解度较大;(3) 能反应生成CO2气体离开系统,使溶解平衡发生移动;(4)BaCO3的K较小。
(完整版)大学有机化学期末考试题(含三套试卷和参考答案).doc

一 . 命名下列各化合物或写出结构式(每题 1 分,共 10 分)1.(H3C)2HCC(CH 3 )3C CH H2.3-乙基-6-溴-2-己烯-1-醇3.O 4.5. CH 3 CHO邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空 2 分,共 48 分)1.CH CHBrKCN/EtOHCH2Cl2.高温 、高压①O3+ C12② H 2O Zn 粉3.HBrMgCH = C H 2醚CH 3COC14.+CO 2CH 35.1, B 2H 62, H 2O 2, OH -1, Hg(OAc) 2 ,H 2 O-THF 2, NaBH 46.OOOOO7.CH 2ClNaOH H 2O Cl8.CH 3+ H 2 O OH -SN1 历程Cl+9.OCH 3 O C 2 H 5 ONa+ CH 2=CH C 2 H 5 ONaC CH 3O10.① CH 3COCH 3② H 2O H +BrBrZnEtOH11.OH+C CH 3 + Cl 212.CH 3HNO 3Fe,HCl(CH 3CO) 2O( 2)H 2SO 4Br 2NaOHNaNO 2 H 3 PO 2H 2SO 4三 . 选择题。
(每题 2 分,共 14 分)1. 与 NaOH 水溶液的反应活性最强的是()(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3 )3CH 2Br (D). CH 3(CH 2)2CH 2BrCH 32. 对 CH 3Br 进行亲核取代时,以下离子亲核性最强的是: ( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是()(A) CH 3CCH(B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C H OH(F) p-CH C H OH6 53 6 44. 下列化合物具有旋光活性得是: ()COOHA,HOHCH 3B, HCOOHOHCH 3C, (2R, 3S, 4S)-2,4- 二氯 -3- 戊醇5. 下列化合物不发生碘仿反应的是 ( ) A 、 C 6 5 3、2 5H COCH3B C H OHC 、 CH 3 22D 、 32 3CHCOCHCH CHCOCHCH6. 与 HNO 2作用没有 2 生成的是( )A 、H 22 NB 3 2NCONH、CHCH ( NH )COOHC 、C 6 53 D6 52H NHCH、C H NH7. 能与托伦试剂反应产生银镜的是 ( )A 、 CCl 3COOH B、 3C 、 CH CHCOOHClCOOHD、 HCOOH2四 . 鉴别下列化合物(共 6 分)苯胺、苄胺、苄醇和苄溴五 . 从指定的原料合成下列化合物。
大学无机化学综合测试题+答案(吉林大学、武汉大学、第二版) 试题 期末考试 —— 内蒙古民族大学.DOC (17)

内蒙古民族大学2013-2014学年一学期课程考试试卷答案(C 卷)课程名称:普通化学和无机化学 考试时间:120分钟 年级:xxx 级专业: xxx题目部分,(卷面共有53题,100分,各大题标有题量和总分) 一、单项选择题(20小题,共20分)1、下列各混合溶液中,具有缓冲作用的是 A 、HCl (1 mol ·dm -3) + NaAc (2 mol ·dm -3) B 、 NaOH (1 mol ·dm -3) + NH 3 (1 mol ·dm -3) C 、 HCl (1 mol ·dm -3) + NaCl (1 mol ·dm -3) D 、NaOH (1 mol ·dm -3) + NaCl (1 mol ·dm -3) 答案:A2、在0.10 dm 3 0.10 mol ·dm -3 HAc 溶液中,加入0.10 mol NaCl 晶体,溶液的pH 将会 A 、升高 B 、降低 C 、不变 B 、无法判断 答案:B3、0.10 mol ·dm -3 Na 2HPO 4水溶液的pH 值约为 (H 3PO 4:p K a1 = 2.1,p K a2 = 7.2 ,p K a3 = 12.7) A 、4.65 B 、 9.95 C 、 7.40 D 、7.33 答案:B4、20 cm 3 0.10 mol ·dm -3 HCl 和20 cm 3 0.20 mol ·dm -3 NH 3·H 2O 混合,其pH 为(NH 3·H 2O :K b = 1.76 ⨯ 10-5) A 、11.25 B 、 4.75 C 、 9.25 D 、4.25 答案:C5、用0.20 mol ·dm -3 HAc 和0.20 mol ·dm -3 NaAc 溶液直接混合(不加水),配制1.0 dm 3 pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3 HAc 溶液为 (p K a (HAc) = 4.75)A 、6.4 ⨯ 102 cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102 cm 3D 、3.6 ⨯ 102 cm 3 答案:D6、0.045 mol ·dm -3 KNO 2溶液的pH = 8.0,则HNO 2的K a 是 A 、4.5 ⨯ 10-2 B 、4.5 ⨯ 10-10 C 、4.5 ⨯ 10-8 D 、4.5 ⨯ 10-4 答案:D7、向含有0.010 mol ·dm -3 的C O 242-溶液中逐滴加入AgNO 3溶液,要求只生成Ag 2C 2O 4沉淀,而又不会生成Ag 2O 沉淀,则溶液的pH 应是 A 、< 7.9 B 、 < 10.4 C 、 > 10.6D 、< 9.7答案:B8、已知铜的相对原子质量为63.55,在0.50mol·dm-3 CuSO4水溶液中通过4.825 ⨯104库仑电量后,可沉积出Cu约为A、7.94 gB、15.89 gC、31.78 gD、63.55 g答案:B9、下列一系列反应,提供了使I- 氧化成I2的机理:NO +12O2−→−NO2NO2 + 2I- + 2H+−→−NO + I2 + H2OI2 + I-−→−I3-此一系列反应中的催化剂是A、NOB、O2C、H+D、NO2答案:A10、反应2NO2Cl(g)=2NO2(g) + Cl2(g) 的反应机理包括两步基元反应(1) NO2Cl(g)=NO2(g) + Cl(g)(2) NO2Cl(g) + Cl(g)=NO2(g) + Cl2(g)已知总反应的速率常数k的单位是s-1,则A、总反应是二级反应B、第一步反应比第二步反应快得多C、总反应是三级反应D、第二步比第一步反应快得多答案:D11、在测定溶液中过二硫酸铵[(NH4)2S2O8] 和碘化钾进行反应的反应速率时加入硫代硫酸钠的目的是A、与碘反应B、与过二硫酸盐反应C、催化作用D、起氧化剂作用答案:A12、某化学反应进行1h,反应完成50 %,进行2h ,反应完成100 %,则此反应是A、零级反应B、一级反应C、二级反应D、三级反应答案:A13、硫代乙酰胺(TA)水解反应CH3C NH2S+ H2O−→−H2S +CH3C NH2O的速率定律为-d[TA d ]t = k [H +][TA],若在25 ℃ 的TA 和H +浓度均为0.10 mol ·dm -3 的溶液中加醋酸钠,下面叙述中正确的是 A 、反应速率变慢,但k 保持不变 B 、反应速率和k 都变小C 、反应速率增加,但k 保持不变D 、反应速率和k 都增加 答案:A14、在下列元素的原子中,第一电离能最低的是 A 、Be B 、B C 、C D 、N答案:B15、下列各组元素中,电负性依次减小的是 A 、K > Na > Li B 、O > Cl > H C 、As > P > H D 、三组都对答案:B16、下列分子中,具有配位键的是 A 、 CO B 、 CO 2 C 、NH 3 D 、H 2O答案:A17、氯苯的偶极矩是1.73D ,预计对二氯苯的偶极矩应当是 A 、4.36 D B 、1.73 D C 、0 D 、1.00 D答案:C18、下列分子中相邻共价键的夹角最小的是 A 、BF 3 B 、CCl 4 C 、NH 3 D 、H 2O答案:D19、试判断下列说法,正确的是A 、离子键和共价键相比,作用范围更大B 、所有高熔点物质都是离子型的C 、离子型固体的饱和水溶液都是导电性极其良好的D 、阴离子总是比阳离子大 答案:A20、按分子轨道理论,O 2、-2O 、+2O 的稳定性由大到小的顺序是 A 、O 2 >+2O >-22O B 、+2O > O 2 >-22OC 、-22O > O 2 >+2OD 、+2O >-22O > O 2答案:B二、填空(20小题,共20分)1、20℃ 时纯水的蒸气压为 2338 Pa 。
大学有机化学期末考试题(含三套试卷和参考答案)
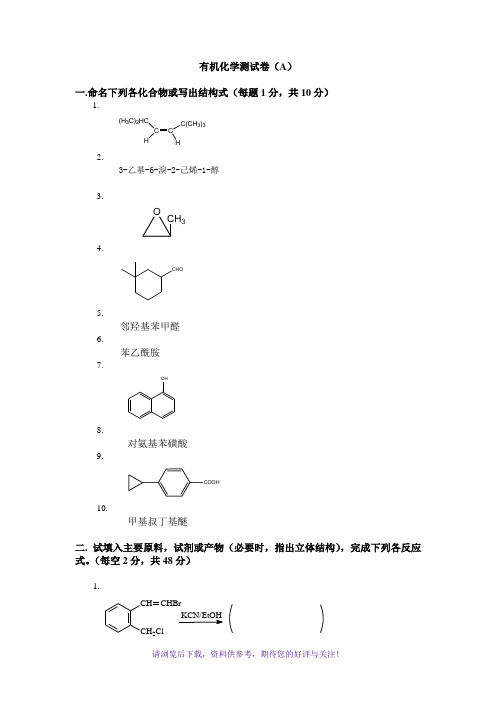
有机化学测试卷(A)一.命名下列各化合物或写出结构式(每题1分,共10分)1.C CH C(CH3)3(H3C)2HCH2.3-乙基-6-溴-2-己烯-1-醇3.OCH34.CHO5.邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空2分,共48分)1.CH CH2ClCHBrKCN/EtOH2.3.4.+CO2CH35.46.OOOO 7.CH2ClCl8.3+H2O-SN1历程+ 9.C2H5ONaOCH3O+ CH2=CH C CH3O10.+C12高温高压、CH = C H2HBrMgCH3COC1BrBrZn EtOH11.C O CH 3+Cl 2H +12.Fe,HClH 2SO 43CH 3(CH3CO)2O2NaOH24NaNO H PO (2)三. 选择题。
(每题2分,共14分)1. 与NaOH 水溶液的反应活性最强的是( )(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3)3CH 2Br (D). CH 3(CH 2)2CH 2Br32. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是( )(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C 6H 5OH (F) p-CH 3C 6H 4OH4. 下列化合物具有旋光活性得是:( )A,CH 3CH 3B,C, (2R, 3S, 4S)-2,4-二氯-3-戊醇5. 下列化合物不发生碘仿反应的是( )A 、 C 6H 5COCH 3B 、C 2H 5OH C 、 CH 3CH 2COCH 2CH 3D 、CH 3COCH 2CH 36. 与HNO2作用没有N2生成的是( )A、H2NCONH2B、CH3CH(NH2)COOHC、C6H5NHCH3D、C6H5NH27. 能与托伦试剂反应产生银镜的是( )A、CCl3COOHB、CH3COOHC、 CH2ClCOOHD、HCOOH四.鉴别下列化合物(共6分)苯胺、苄胺、苄醇和苄溴五.从指定的原料合成下列化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学化学期末考试卷学院:专业:行政班:姓名:学号:座位号:------------------------------- 密封线-------------------------------题目第一题第二题第三题第四题第五题总分阅卷人得分一、选择题(每小题 1.5 分,共24 分):1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。
A、增大 B 、不变 C 、减小 D 、先增大后减小2、当主量子数n=3 时,则角量子数l 的取值为()。
A、1、2、 B 、0 、1、2 C 、0、1 D 、0、±1、3、某温度下,反应2NO(g)+O2(g)=2NO2(g) 达到平衡,是因为()。
A、反应已停止 B 、反应物中的一种已消耗完C、正逆反应的速率相等 D 、反应物均已消耗完毕4、下列化合物晶体中,既存在离子键又存在共价键的是()。
A、H2O B 、NaBr C 、CH3OH D 、Na2O25、蔗糖的凝固点为()。
A、0℃ B 、高于0℃C、低于0℃ D 、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。
A、s 区 B 、d 区 C 、f 区 D 、p 区7、质量作用定律只适用于()。
A、实际上能进行的反应 B 、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为 1 的反应D、已进行完的反应8、对于反应Cr 2O72- + 6Fe2+ + 14H+ = 2Cr 3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式2- + 6Fe2+ + 14H+ = 2Cr中n 等于()。
A、1 B 、6 C 、3 D、129、下列物质中熔点最高的是()。
A、Si B 、CO2 C 、ZnS D 、Fe3C10、下列叙述中错误的是( ) 。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应原子中未成对电子数为()。
11、某元素原子的外层电子构型为3s23p23p3A、1 B 、2 C 、3 D 、012、等温等压下且不做非体积功条件下,反应自发进行的判据是()。
A、ΔHΘ<0 B 、ΔSΘ<0 C 、ΔG<0 D 、ΔfHmΘ<013、水具有反常的沸点,是因为分子间存在()。
A、色散力 B 、诱导力 C 、取向力 D 、氢键14、欲配制pH=5.0 的缓冲溶液,则下列哪一种化合物及其盐的混合溶液合适?()。
A、HF (pKa=3.45) B 、CH3COOH (pKa=4.75)C、NH3·H2O (pKb=4.75) D 、HCN(pKa=9.31)15、对于下列基元反应: A + 2B = C ,其速率常数为k,若某个时刻( 时间以s计) ,A的浓度为2mol/L ,B的浓度为3mol/L ,则反应速率v=()。
A、6k mol · L -1 · s-1 B 、12k mol · L-1 · s-1C、18k mol · L -1 · s-1 D 、36k mol · L-1 · s-1Θ16、在温度T 的标准状态下,若已知反应A→2B的标准摩尔反应焓△r Hm,1,与反ΘΘ应2A→C的标准摩尔反应焓△r H m,2,则反应C→4B的标准摩尔反应焓△r H与m,3 ΘΘΘ△r H m,1 及△r H m,2 的关系为△rH m,3=()。
ΘΘΘΘA、2 △r H m,1+△r H m,2 B 、△r H m,1-2 △r Hm,2ΘΘΘΘC、△r H m,1+△r H m,2 D 、2 △r H m,1- △r Hm,2二、填空题(21 分):2+(C 3+(C 2+(C 3+(C1、原电池(-)Pt |Fe 1) ,Fe 2)|| Fe 3) ,Fe 4)| Pt( +) 负极上发生的电极反应式:____________________;正极上发生的电极:______________________________________。
该电池属于____________电池。
2、根据热力学第一定律,封闭体系的热力学能变化值反应的ΔU=_______________。
_3、决定电子运动状态的四个量子数中,____________________反映了原子轨道的形状;__________________________反_映了原子轨道的空间取向;对于自旋量子数ms,可以取的数值只能为___________________________。
_4、在等温等压条件下,某反应的K 的值等于_______________。
Θ=1,则其ΔrG Θm5、同离子效应能使弱电解质的解离度______________。
如HAc 溶液中加入_________________或______________(_ 两类物质)均能起到同离子效应的作用。
6、在等温下,若化学平衡发生移动,其平衡常数___________(填减小、增大、不变) 。
7、原子轨道沿两核连线以“头碰头”方式重叠形成的共价键叫_______键,以“肩并肩”方式重叠形成的共价键叫_______键。
8、根据杂化轨道理论,BF3 分子中 B 采取______________________杂化,BF3 的空间构型为______________________;NH3 分子中N 采取___________________杂化, NH3的空间构型为______________________。
9、已知PbI2 的溶度积Ks=8.49×10 2 在0.010 mol/dm -9,则PbI-9,则PbI 3Pb(NO3) 2 溶液中3) 2 溶液中3的溶解度为______________ mol/dm。
++5e-=Mn2++4H 2+)=1.51V 。
试根据能斯特公式10、已知MnO4 +8H 2O,φ(MnO4 /Mn2+) 与pH的关系式是________________________________。
_确定φ(MnO4 /Mn11、CCl4分子与H2O分子间的相互作用力有__________________________。
_三、问答题(每题 6 分,共计18 分):2+的核外电子排布式?1、写出7N原子、25Mn原子、20Ca7N:25Mn:2+20Ca2、影响化学反应速率的主要因素有哪些?质量作用定律的意义是什么?对一般的化学反应,速率方程式的反应级数能否直接根据化学反应方程式来写?为什么?3、当铜锌原电池(-)Zn |Zn 2+(1mol/L) || Cu2+(1mol/L)| Cu(+) 工作一段时间后,原电池的电动势是否发生变化?为什么?四、判断题(每题 1 分,共计7 分)1、反应的ΔH就是反应的热效应。
()2、催化剂能改变反应历程,降低反应的活化能,但不能改变反应的ΔrG mΘ。
()3、两种分子酸HX溶液和HY溶液有同样的pH,则这两种酸的浓度相同。
()4、多电子原子轨道的能级只与主量子数n 有关。
()5、电极电势的数值与电极反应的写法无关,而平衡常数的数值随反应式的写法而变。
()6、对于某一化学反应,若升高温度,其正反应速率v 增加,逆反应速率v 减小。
()7、在微观粒子中,只有电子具有波粒二象性。
()五、计算题(共30分):1、(6 分)计算下列反应的(1) ΔrHmΘ(298.15K) ;(2) 298.15K 进行1mol 反应时的体积功w` 和(3)ΔrUmΘ(298.15K) 。
R=8.314J?mol-1 ?K-1CH4(g) + 4 Cl 2(g) = CCl 4(l) + 4 HCl(g)Θ(298.15K)/kJ?mol-1 -74.81 0 -135.44 -92.307ΔfHm2、(6 分)某温度时,8.0molSO2 和4.0molO2在密闭容器中进行反应生成SO3 气体,测得起始时和平衡时(温度不变)系统的总压力分别为300kPa和220kPa。
试利用上述实验数据求该温度时2SO2(g) + O 2(g) = 2SO 3(g) 的标准平衡常数和SO3 的转化率。
3、(9 分)已知Ag e Ag, 0.799V ,如果在溶液中加入NaCl,使产生AgCl 沉淀后,溶液中的[Cl–]=1mol/L ,试计算其电极电位。
4、(9 分)向含有KCl、KI 各0.01mol· l-1 的混合溶液中,逐滴加入沉淀剂AgNO3 溶液,那种离子先沉淀?氯离子沉淀时溶液中碘离子的浓度是多少?(已知:Ks(AgI)=8.51 ×10-17 ,Ks(AgCl)=1.77 ×10-10 )大学化学期末考试卷答案一、选择题(每小题 1.5 分,共24 分)1 2 3 4 5 6 7 8C B CD C D B B9 10 11 12 13 14 15 16A C C C DBC D二、填空题(21 分)1. Fe 2+ –e = Fe 3+、Fe 3++e = Fe 2+ 、浓差电池2. ΔU = q+w_3. 角量子数,磁量子数,±1/24. 0 kJ/mol5. 降低,醋酸盐,强酸6. 不变7. σ键,π键8. sp2,平面三角形;不等性sp3,三角锥形9. 9.2 ×10-4 mol/L 。
2+)= φ(MnO4/Mn2+) –(0.05917/5)lg[ C Mn2+/( C 10. φ(MnO4 /Mn 8H+? C MnO- )]411. 色散力、诱导力三、问答题(每题 6 分,共计18 分)1、7N:1s22s22p322s22p325Mn:1s22s22p63s23p63d54s22s22p63s23p63d54s22+:1s22s22p63s23p620Ca2、影响化学反应速率的主要因素有:浓度、温度、压力和催化剂。
质量作用定律的意义:对于元反应,化学反应速率与反应物的浓度(以反应方程式中反应物的化学计量系数为指数)的乘积成正比。
反应级数指反应速率方程中各反应物浓度的指数之和。
对于元反应,反应速率方程等于反应物浓度(以方程式中其系数为指数)的乘积,因此其反应级数为方程式中反应物的系数之和。
对于复杂反应,反应速率方程并不一定等于反应物浓度(以方程式中其系数为指数)的乘积,,所以反应级数不能直接根据反应方程式来写。
3、原电池的电动势会发生变化。
铜锌原电池工作一段时间后,电解质溶液中的铜离子浓度降低,锌离子浓度增大,根据能斯特公式可知,随着铜离子浓度降低,锌离子浓度增大,原电池电动势变小。
