结构式 结构简式 分子式
乙醇 乙酸

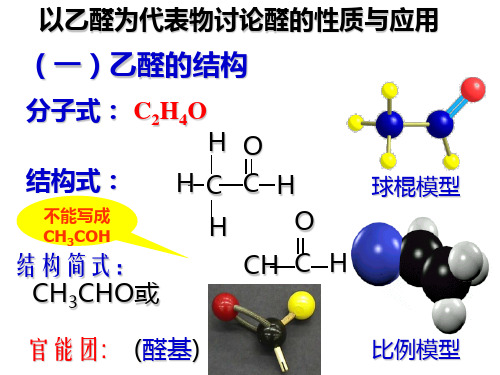
乙醇乙酸⑴乙醇①乙醇的分子结构:乙醇的分子式C2H6O,结构式,结构简式CH3CH2OH或C2H5OH。
乙醇的官能团为-OH(羟基),乙醇分子结构可以看成是乙烷分子(CH3CH3)中的1个氢原子被羟基取代的产物,也可以看成是水分子(H—OH)中的1个氢原子被乙基(-C2H5)取代的产物。
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
②乙醇的化学性质:Ⅰ.氧化反应:a.可燃性:在空气中燃烧,火焰颜色为蓝色,放出大量的热量。
C2H5OH+ 3O2−−点燃2CO2+3H2Ob.催化氧化:2C2H5OH+ O22CH3CHO+2H2O 催化剂为Cu或Ag。
c.能使酸性KMnO4溶液褪色或酸性K2Cr2O7溶液变色,乙醇直接被氧化为乙酸。
Ⅱ.与金属钠的反应:金属钠置换了羟基中的氢,反应的化学方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑决定有机化合物的化学特性的原子或原子团叫做官能团。
常见的有:卤素原子(-X)、羟基(-OH)、硝基(-NO2)和碳碳双键等。
⑵乙酸①乙酸的分子结构:乙酸分子式C2H4O2,结构式为,乙酸的结构简式为CH3COOH。
②乙酸的化学性质Ⅰ.乙酸的酸性:——具有酸的通性:a.乙酸是一元弱酸,能使紫色石蕊试液变红。
b.Zn+2CH3COOH−Zn (CH3COO)2+H2↑c.ZnO+2CH3COOH−Zn (CH3COO)2+H2Od.Zn(OH)2+2CH3COOH−Zn (CH3COO)2+2H2Oe.ZnCO3+2CH3COOH−Zn (CH3COO)2+H2O+CO2↑Ⅱ.酯化反应【实验探索】乙酸乙酯的制备【操作】在试管中先加入3mL乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL乙酸;连接好装置,用酒精灯慢慢加热。
【现象】液面上有透明的难溶于水的油状液体生成,并可闻到香味。
【分析】a.浓硫酸的作用是作催化剂、吸水剂。
b.该反应的实质是酸脱羟基醇脱氢。
乙酯结构简式

乙酯结构简式
一、引言
乙酯是一种常用的有机化合物,其分子式为C2H5O2,结构简式为CH3COOCH2CH3。
它具有较低的沸点和挥发性,常用于工业生产、溶剂和香精等领域。
本文将对乙酯结构简式进行详细介绍。
二、乙酯的化学性质
1. 乙酯的组成结构
乙酯分子由一个甲基(CH3)和一个乙酰基(CH3CO-)组成,两者通过氧原子(O)相连。
2. 乙酯的物理性质
乙酯是一种无色透明液体,有刺激性气味。
其密度为0.895 g/cm³,沸点为77.1℃,熔点为-83.6℃。
3. 乙酯的化学性质
乙酯在空气中易挥发,可与空气形成易燃混合物。
它能与强碱反应生成相应的盐类,并能被水和强酸水解。
三、乙酯的制备方法
1. 醋酸与乙醇反应法:将浓硫酸加入混合物中作催化剂,使醋酸与乙
醇反应生成乙酯。
2. 醋酸与氯化铵反应法:将醋酸和氯化铵混合后加热,生成乙酰氯。
再将乙酰氯和乙醇反应生成乙酯。
四、乙酯的用途
1. 工业生产:乙酯是一种重要的工业原料,可用于制造塑料、人造丝等。
2. 溶剂:由于其挥发性和溶解性良好,常被用作油漆、涂料、胶水等的溶剂。
3. 香精:乙酯具有特殊的香味,因此被广泛用于香精制造中。
五、结论
本文对乙酯结构简式进行了详细介绍,并探讨了其化学性质、制备方法和用途。
通过本文的阐述,可以更好地了解和认识这种重要的有机化合物。
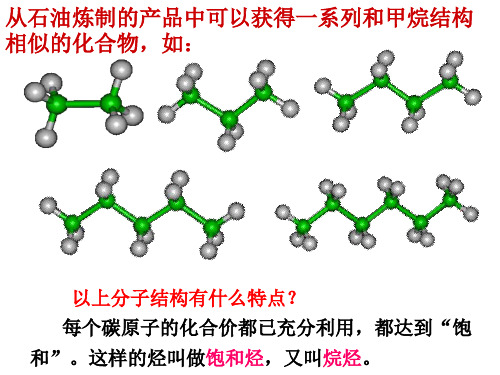
必修二第三章烷烃.

体的数目分别几种?
一种 三种
2
3
1
2
3
4
2
3
下列各烷烃沸点高低(1)正戊烷(2) 2-甲基丁烷(3)丁烷(4)2,2-二甲基丙 烷(5)乙烷顺序正确的是 A、(1)﹥(2) =(3) ﹥(4) ﹥(5) B、(4)﹥(2) ﹥ (3) ﹥(1) ﹥(5) C、(5)﹥(4) ﹥ (3) ﹥(2) ﹥(1) D、(1)﹥(2) ﹥ (4) ﹥(3) ﹥(5)
分子式
C2H6
H HH
HC CCH H HH CH3CH2CH3 C3H8
几种烷烃的球棍模型及对应的结构式
丁烷
分子式
结构式
C3H8 HHHH HC C C C H HHHH
结构简式 CH3CH2CH2CH3
练习:
戊烷
己烷
比较分子结构的异同:
HHH
相同点
HC C CH
①只含C、H两种元素。 H H H
②每个碳以四个单键与氢原子或另外的碳原子
相结合,且每个碳原子所能结合的氢原子数
目已经达到了最大值。
不同点 ①C、H原子数不同,分子式不同。 ②随着碳原子数的增多,逐渐相差若干个
CH2 原子团。
烷烃
HHH
1.烷烃的概念
HC C CH
碳原子都以碳碳单键相连H成链H状,H碳原子剩
余的价键全部与氢原子结合,使每个碳原子的
物 分子组成:碳原子数不同,
分子式不同。
练习: 下列哪组是同系物( B )
A、CH3CH2CH2CH3 B、CH3CH3 c、CH3CH2CH=CH2
CH3CHCH3 CH3
CH3CHCH3 CH3
CH2
H2C
烷烃
4—甲基—3—乙基
⑦写名称
取代基在前,“某烷”在后,将两者名写在一起
6 7 8 CH3 CH2 —CH2 —CH3 | | 例: CH3—CH—CH2—CH2—CH—CH2—CH3 |2 1 3 4 5| CH3 CH3
2,2,5—三甲基—5—乙基辛烷
练习:用系统命名法命名下列有机物
CH3—CH2—CH2 | CH2 戊烷 | CH3 CH3 |2 1 5 4 3 CH3—CH2—CH—CH—CH3 | CH3
同分异构现象和同分异构体
[讨论]下面是正丁烷和异丁烷的组成和某些物质性质,试分析有 何异同并探讨其原因。 名 称 分子式 C4H10 相对分子质量 熔 58 点 沸 点 相对密度 0.5788 正丁烷 -138.4 -0.5
CH 3—CH—CH— CH2 —CH 3 2 CH 3 CH 3CHCH2CH 2CH 3
CH 3 或者: CH 3CH(CH3 )CH2CH 2CH 3
它们对应的结构简式:
乙烷: H H | | H-C-C-H | | H H 丙烷: H H H | | | H-C-C-C-H | | | H H H
CH3CHCH3 CH3
3烷烃的名称:
碳原子数 分子式 名称
1 CH4
2 C 2H 6
3 4 5 C3H8 C4H10 C5H12
甲烷 乙烷
丙 烷 丁烷
戊烷
6 7 8 9 10 碳原子数 分子式 C6H14 C7H16 C8H18 C9H20 C10H22 名称
己 烷 庚 烷 辛烷 壬烷 癸 烷
碳原子数大于十时,以汉字数字代表称某烷,
①找起点 主链中离支链最近端作为起点 先简单取代基 再繁取代基 ②编序号 用阿拉伯数字给主链碳原子编号 以确定支链的位置
卤代烃

在工农业生产中的应用
致冷剂 溶剂 卤代烃 灭火剂 麻醉剂 农药 医用
CH2BBr CH2 r
CHCl2CHBr2
CH2Br H
结论:所有的卤代烃都能发生水解反应,
但卤代烃中无相邻C或相邻C上无H的不能发生消去反应
取代反应 反应物 CH3CH2Br NaOH水溶液、加热
消去反应 CH3CH2Br NaOH醇溶液、加热 C-Br,邻碳C-H CH2=CH2
反应 条件 断键
CH3
E、CH3-CH2-CH-CH3 结论 发生消去反应,含卤原子的相邻碳原子上要有H原子 卤代烃中无相邻C或相邻C上无H的不能发生消去反应
Br
下列化合物在一定条件下,既能发生消去反应,又能发 生水解反应的是: CH3Cl (CH3)3CCH2Cl Cl Cl CH3CHBrCH3
(CH3)3CCl
生成物 结论
C-Br
CH3CH2OH
溴乙烷和NaOH在不同条件下 发生不同类型的反应
用化学方程式表示下列转变
H3C CH2 Br H2C CH2
OH OH
消去
NaOH 醇 △ △ Br2 水
取代
NaOH 水
CH2
H2C CH2
加成
H2C
Br Br
练习:写出C4H9Cl的同分异构体 练习:写出C3H6Cl2的同分异构体
H OH H2C CH2
浓H2SO4 170℃
CH2= CH2↑ + H2O
其他 卤代烃的消去
H2C CH2 + 2NaOH
醇
△
HC CH + 2NaBr + 2H2O
Br Br
1-氯丁烷与NaOH醇溶液共热时可能的产物?
乙醛的分子结构

△
CH3COONH4
解释: 银被还原,乙醛被氧化成乙酸, 解释: 银被还原,乙醛被氧化成乙酸,乙酸又和氨 反应生成乙酸铵。 反应生成乙酸铵。
银镜反应注意事项
(1)试管内壁必须洁净; )试管内壁必须洁净; (2)60℃水浴加热,不能用酒精灯直接 ) ℃水浴加热, 加热; 加热; (3)加热时不可振荡和摇动试管; )加热时不可振荡和摇动试管; (4)须用新配制的银氨溶液,氨水不能 )须用新配制的银氨溶液, 过量(防此生成易爆炸的物质); 过量(防此生成易爆炸的物质); (5)乙醛用量不可太多; )乙醛用量不可太多; (6)实验后,银镜用 浸泡, )实验后,银镜用HNO3浸泡,再用水 洗。
燃烧 催化氧化 被弱氧化剂氧化 Cu(OH)2 能使高锰酸钾、 能使高锰酸钾、溴水褪色
CO2、H2O
银镜反应
羧 酸
作业
P113~114 一、二、三、四(三、四做在 作业本上)
能被还原成醇 甲醛的化学性质 与乙醛相似 能被氧化成羧酸 能起银镜反应, 能起银镜反应,能与新制的 氢氧化铜反应
用途:浸制标本,制药,香料,燃料。 用途:醛类:含有醛基 的有机物
饱和一元醛的通式: 饱和一元醛的通式: CnH2n+1CHO 或者: 或者: CnH2nO 醛类具有和乙醛类似的化学性质: 醛类具有和乙醛类似的化学性质: 加成反应 氧化反应
三、乙醛的化学性质
2、乙醛的氧化反应 c 被弱氧化剂氧化 Ⅱ 和Cu(OH)2反应
现象:试管内有红色沉淀产生 红色沉淀产生 现象:试管内有红色沉淀 注意: 注意:a 氢氧化铜必须 新制; 新制;b 直接加热
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 CH3CHO + 2Cu(OH)2 2Cu(OH) + 2H2O
乙烯wq

医用高分子材料简表
用
途
材
料
体 内 部 分
人工血管 涤纶、聚四氟乙烯、硅橡胶、尼龙等 人工心脏 聚氨酯橡胶、硅橡胶、聚四氟乙烯等 人工食道 聚乙烯、聚乙烯醇、聚四氟乙烯 人工骨和人工关节 聚甲基丙烯酸甲酯、尼龙、聚氯乙烯 齿科材料 尼龙、聚甲基丙烯酸甲酯 人工血浆 葡聚糖(右旋糖酐)、聚乙烯醇 人工皮肤(创伤覆盖保护材料) 聚乙烯醇缩甲醛、尼龙、涤纶
1. 乙烯发生的下列反应中不属于加成反应
的是( D )
A.与H2反应生成乙烷
B.与水反应生成乙醇
C.与溴水反应并使之褪色
D.与氧气反应生成CO2和H2O
2.下列物质不可能是乙烯加成产物的是 ( B ) A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
4. 加聚反应:
3、将15g CH4和C2H4的混合气体通入盛有足 量溴水的容器中,溴水的质量增加了7g,则 混合气体中CH4与C2H4的体积比为
(A)1:2 (B)2:1 (C)3:2 (D)2:3
4.现有两种烯烃: CH2=CH2和CH2=CR2 (R—为烃基),它们的混合物进行聚合反应, 产物中可含有 ( ) ① CH2—CH2 ② CH2—CH2—CR2—CH2 ③ CH2—CH2—CH2—CR2 ④ CH2—CH2CHR—CHR ⑤ CH2—CR2 A.①⑤ B.②④ C.①③⑤ D.①②③⑤
延伸:
烯烃(单烯烃)
1、概念:分子里含有碳碳双键的链烃叫烯烃。 不饱和烃:C原子所结合的H原子数少于饱和烃里
的H原子数的碳氢化合物。
2、烯烃的通式: CnH2n (n≥2) 3、烯烃的同系物
乙烯的制取与性质

5、制备的乙烯中含有哪些杂质,如何净化? 、制备的乙烯中含有哪些杂质,如何净化? 加热较长时间,液体会逐渐变黑, 加热较长时间,液体会逐渐变黑,乙醇被浓 硫酸碳化生成C单质,加热时会有 硫酸碳化生成 单质,加热时会有SO2、 单质 、 CO2生成,生成的乙烯有刺激性气味。 生成,生成的乙烯有刺激性气味。 生成
(将浓硫酸缓 慢地注入到乙 醇中, 醇中,边注入 边轻轻摇动) 边轻轻摇动)
制备时需注意的问题: 制备时需注意的问题:
1、沸石或碎瓷片的作用? 、沸石或碎瓷片的作用? 2、浓硫酸的作用? 、浓硫酸的作用? 3、温度计的位置? 、温度计的位置? 4、为何要迅速升温到170℃,并控温在该温度? 、为何要迅速升温到 ℃ 并控温在该温度? 5、制备的乙烯中含有哪些杂质,如何净化? 、制备的乙烯中含有哪些杂质,如何净化?
C
4、乙烯的用途 、
乙烯的产量是衡量一个国家石 乙烯的产量是衡量一个国家石 (1)有机化工原料油化工发展水平的重要标志。 ) 油化工发展水平的重要标志。
(2)植物生长调节剂,催熟剂 )植物生长调节剂,
如果把青 如果把青桔子和熟苹果放在同一个塑料 袋里,系紧袋口 这样一段时间后青 系紧袋口,这样一段时间后 袋里 系紧袋口 这样一段时间后青桔子 就可以变黄 成熟,这就是乙烯的功劳。 乙烯的功劳 就可以变黄、成熟,这就是乙烯的功劳。
⑵、与酸性KMnO4的作用: 与酸性 的作用
CH2=CH2 KMnO4 紫色 CO2 MnSO4 无色 可用于鉴别
CH4和C2H4 烷烃和烯烃) (烷烃和烯烃)
讨论:此反应的作用? 讨论:此反应的作用? 思考:甲烷中混有乙烯,应如何除去, 思考:甲烷中混有乙烯,应如何除去, 以得到干燥的甲烷气体? 以得到干燥的甲烷气体?
(一)乙醛的结构
知识运用
1、判断下列哪些能使酸性KMnO4溶液褪色? 判断下列哪些能使酸性KMnO 溶液褪色? 乙烯、甲烷、 甲苯、乙醛、 乙烯、甲烷、苯、 甲苯、乙醛、葡萄 苯酚、 糖、SO2、H2S、苯酚、裂化汽油 乙烯、 甲苯、乙醛、葡萄糖、 乙烯、 甲苯、乙醛、葡萄糖、SO2、 苯酚、 H2S、苯酚、裂化汽油
(4)乙醛与 乙醛与Cu(OH)2的反应 乙醛与
Cu2++2OH- = Cu(OH)2(新制蓝色絮状) 新制蓝色絮状 2Cu(OH)2+CH3CHO NaOH CH3COOH+Cu2O↓+2H2O
△
该实验可用于检验醛基的存在. 该实验可用于检验醛基的存在
注意
问题
1.Cu(OH)2应现配现用; 应现配现用; 2.成功条件:碱性环境、加热. 2.成功条件:碱性环境、加热. 成功条件
O
H O C O H
H2CO3
甲醛的化学性质
O=
从 结构: 氧化反应
H—C—H
分析
(注意:相当于含有两个醛基的特殊结构) 注意:相当于含有两个醛基的特殊结构) 含有两个醛基的特殊结构
+ H—C—H + 4[ Ag(NH3)]+ 4OH2
O= O=
△
2NH4+ + CO3 2- + 6NH3 + 4Ag↓+ 2H2O
肉桂醛
CH2=CH—CHO
苯甲醛
CHO
3、甲醛 、
结构 性质 :
O 1mol甲醛最多可以还原 1mol甲醛最多可以还原 H C H molAg? 得到多少molAg? 得到多少
与乙醛相似 甲醛的氧化产物是什么? 甲醛的氧化产物是什么?
炔烃

高中化学炔烃编稿老师佘平平一校黄楠二校杨雪审核王艳会【考点精讲】一、乙炔1. 结构(1)四式:分子式:C2H2电子式:结构式:H-C≡C-H结构简式:CH≡CH(2)空间构型:直线型,呈对称结构,故为非极性分子。
(3)键参数:键长:1.20×10-10m(比单键和双键都短);键角:180°键能:812kJ/mol(不等于三个单键键能之和,分子中有两个键比较弱)2. 实验室制法和化学性质(1)药品:电石(CaC2)和水(2)装置:(3)注意事项:a. 原理和特点:尽管它是用块状固体与液体反应且不需加热,但实验室不能用启普发生器的原因有三点:①该反应较剧烈,不易控制。
②反应放出的热量大,易损坏启普发生器。
③反应后生成的石灰乳是糊状,可夹带少量CaC2进入启普发生器底部,堵住球形漏斗和底部容器之间的空隙,使启普发生器失去作用。
b. 实验室一般用简易装置制备乙炔。
一般情况下用电石得到的乙炔气中夹杂着H2S、PH 3、AsH 3等有特殊臭味的气体,可用CuSO 4溶液除去杂质气体。
c. 为得到平稳乙炔气流,控制反应速度,可用饱和食盐水代替水。
(4)化学性质: ① 氧化反应:a. 可燃性:2C 2H 2+5O 2−−→−点燃4CO 2+2H 2O (液)+2600kJ 现象:火焰明亮、带浓烟燃烧时火焰温度很高(>3000℃),用于气焊和气割。
其火焰称为氧炔焰。
b. 被KMnO 4氧化:能使紫色高锰酸钾溶液褪色。
② 加成反应:可以跟Br 2, H 2, HX 等多种物质发生加成反应。
现象:溴水褪色可用酸性KMnO 4溶液或溴水褪色区别烷烃。
二、炔烃的通式和性质1. 通式:C n H 2n -2,与二烯烃通式和环烯烃的通式相同,说明有一个叁键或两个双键或有一个双键和一个环则减少四个氢原子。
2. 性质:具有同乙炔类似的性质——氧化反应、加成反应等。
【典例精析】例题1 已知烯烃、炔烃在臭氧作用下发生以下反应:CH 3—CH =CH —CH 2—CH =CH 222OH O−−−→①②CH 3CHO +OHC —CH 2—CHO +HCHO CH 3—C≡C—CH 2—C≡CH 32OH O−−−→①②CH 3COOH +HOOCCH 2COOH +HCOOH 某烃的化学式为C 10H 10,在臭氧作用下发生反应:C 10H 1032O H O−−−→①②CH 3COOH +3HOOC —CHO +CH 3CHO (1)C 10H 10分子中含_______________个双键,_______________个叁键。
高三(有机化学)专题复习

2,3,3,7,7-五甲基辛烷
原则5:小-----支链编号之和最小。
总结:烷烃系统命名法原则:
① 长-----选最长碳链为主链。
② 多-----遇等长碳链时,支链最多为主链。 ③ 近-----离支链最近一端编号。
④ 简-----两取代基距离主链两端等距离时, 从简单取代基开始编号。
⑤ 小-----支链编号之和最小。
答案:B
【解题方法漫谈三】
③新课标下可能出现的新题型
■现代光谱技术的应用
10.下图是一种分子式为C4H8O2的有机物的红外光谱 谱图,则该有机物的结构简式可能为: 。
三、有机物的命名
内容:烷、烯、炔、苯的同系物、 烃的衍生物的命名
有机物的命名
(一)、普通命名法(适用于简单化合物) 1~10个碳: 甲、乙、丙、丁、戊、己、庚、辛、壬、癸; 10个碳以上:十一、十二等。
碳架异构体:正、异、新。
CH3CH2CH2CH3
正丁烷
CH3CHCH3 CH3
异丁烷
(二)系统命名法(IUPAC命名法)
1、烷烃 步骤:
选主链 例 CH3 支链编号 CH3
书写名称
CH2 CH3 1 2 3 4 5 6 7 8 CH3-CH-CH2-CH2-CH—C-CH2-CH3 CH3 2,6,6 — 三 甲基 —5 —乙基 辛烷
★同分异构体的书写 分子式→官能团异构→碳链异构 →位置异构→立体异构
例1:写出分子式为C8H10O含有一个苯环的 所有物质的结构简式
C8H8O
例2:写出分子式为C4H8链状的有机物的结构简式 (考虑立体异构) 顺反异构判断:双键一侧的碳上连有不同的基团,
对映异构判断:手性分子 乳酸、葡萄糖等 (手性碳原子-----一个碳原子连接四个不同的基团) 例3:写出分子式为C4H8O2酯类有机物的结构简式 C5H10O2 分碳法 只须 R1—COOH中烃基 写 对应酸 酯 的同分异构体 写出
联苯肼酯结构式

联苯肼酯结构式
联苯肼酯是一种有机化合物,其化学结构式如下:
分子式:C16H13N3O
分子量:265.30
结构简式:(C6H5)2NC(=O)N(C6H5)CH2O
联苯肼酯的分子结构由两部分组成:一是联苯基团,二是肼基团。
其中,联苯基团由两个苯环通过一个亚甲基(-CH2-)连接而成,形成了两个邻位取代基。
肼基团则是由一个氨基(-NH2)和一个羰基(-C=O)组成。
在联苯肼酯的结构中,两个基团通过亚甲基连接,形成了一个七元环状结构。
这种结构使得联苯肼酯具有较高的稳定性和化学反应性。
联苯肼酯的合成方法有多种,其中一种常用的方法是利用苯胺和甲醛为原料,通过缩合反应生成联苯肼酯。
具体反应过程如下:
1.甲醛与苯胺反应生成苯亚甲基苯胺;
2.苯亚甲基苯胺与盐酸反应生成苯亚甲基氯化铵;
3.苯亚甲基氯化铵与氢氧化钠反应生成苯亚甲基肼;
4.苯亚甲基肼与氧化剂反应生成联苯肼酯。
联苯肼酯是一种重要的有机合成中间体,广泛应用于医药、农药、染料等领域。
在医药领域,联苯肼酯可用于合成抗疟疾药物、抗肿瘤药物等;在农药领域,联
苯肼酯可用于合成杀虫剂、杀菌剂等;在染料领域,联苯肼酯可用于合成偶氮染料等。
联苯肼酯是一种具有重要应用价值的有机化合物,其独特的化学结构使得它在许多领域中都有着广泛的应用前景。
有机物结构的表示方法(6式两模型)

1-丁烯 结构式
H
HH
H CCC CH
HH H
结构
CH2 CH CH2 CH3
简式
CH2 CHCH2CH3
注意:2、碳碳双键、碳碳叁键中的 “=” “≡”不能省略
HO
乙酸 H C C O H 结构式: H
O
结构简式: CH3 C O H
CH3 COOH
注意:3、醛基羧基结构简式有特殊的写法 (碳氧双键可省) —COOH —CHO
C14H10
Cl
O OH
4、请写出下列有机物分子的结构简式:
⑴Leabharlann ⑵OO⑶
O
⑷
OH
书写键线式时应注意事项:
1、一般表示2个以上碳原子的有机物; 2、只忽略C-H键其余的化学键不能忽略。 必须表示出C=C、C≡C键和其它官能团。 3、除碳氢原子不标注,其余原子必须 标注(包括含羟基、醛基和羧基等官能 团中氢原子)。 4、计算分子式时不要忘记顶端的碳原 子。
练习:1、写出下列有机化合物结构简式 和键线式。
键线式:
优点:既能一定程度上表示分子的空间构型, 又很简练。
分子式: C4H8
CH2 CHCH2 CH3
键线式:
分子式: C2H4O2
O
CH3 C O H
键线式:
O OH
分子式: C6H12O6
CH2OH CHOH CHOH CHOH CHOH CHO
键线式: HO
OH OH H
OH OH O
HO
乙醛 H C C H 结构式: H
O
结构简式: CH3 C H
CH3COH× CH3CHO
注意:3、醛基羧基结构简式有特殊的写法
甲醚结构式

甲醚结构式
甲醚结构式是:
甲醚,分子式C2H6O,分子量46.07。
亦称二甲醚。
结构简式CH3-O-CH3,无色可燃性气体或压缩液体。
有乙醚气味,熔点-138.5℃,沸点-24.5℃。
溶于水、四氯化碳、丙酮、氯仿、乙酸甲酯等。
二甲醚是一种重要的甲醇下游产品,具有其独特的优点,对金属无腐蚀性,在温度和湿度高场所具有较好的稳定性。
用途
主要作为甲基化剂用于生产硫酸二甲酯,还可合成N,N-二甲基苯胺、醋酸甲酯、醋酐、亚乙基二甲酯和乙烯等;也可用作烷基化剂、冷冻剂、发泡剂、溶剂、浸出剂、萃取剂、麻醉药、燃料、民用复合乙醇及氟里昂气溶胶的代用品。
用于护发、护肤、药品和涂料中,作为各类气雾推进剂。
硝基甲苯的结构简式

硝基甲苯的结构简式
硝基甲苯是一种有机化合物,它的分子式为C7H7NO2,分子量为135.14。
它是一种无色液体,有刺激性气味,沸点为210℃,沸点为110℃,比重为1.09,微溶于水,微溶于乙醇。
硝基甲苯的结构简式如下:
硝基甲苯的分子中有一个硝基基团,它由一个氮原子和一个氧原子组成,它们以双键连接在一起,形成一个硝基基团。
此外,硝基甲苯的分子中还有一个苯环,它由六个碳原子和一个氢原子组成,它们以双键连接在一起,形成一个苯环。
硝基甲苯的分子中的硝基基团和苯环以单键连接在一起,形成一个硝基甲苯分子。
硝基甲苯是一种重要的有机化合物,它可以用于制造染料、涂料、柔性塑料、润滑油、消毒剂等。
此外,它还可以用于制造药物,如抗生素、抗癌药物等。
综上所述,硝基甲苯是一种重要的有机化合物,它的分子式为C7H7NO2,它的结构简式由一个硝基基团和一个苯环以单键连接在一起组成。
它可以用于制造染料、涂料、柔性塑料、润滑油、消毒剂和药物等。
分子式结构简式

分子式结构简式C8H10N4O2——咖啡因咖啡因是一种广泛存在于大多数饮料和食物中的化合物,其化学分子式为C8H10N4O2。
咖啡因是一种天然生物碱,可提供刺激作用,使人感到兴奋和警觉。
它可以通过多种方式进入人体,例如饮用咖啡、茶、可乐等含咖啡因的饮料,或者食用含有咖啡因的巧克力、能量饮料等食品。
咖啡因对人体有一系列的影响。
首先,咖啡因能够刺激中枢神经系统,增强大脑的警觉性和注意力。
这就是为什么许多人在早晨醒来后会选择喝一杯咖啡来提神的原因。
其次,咖啡因还能够促进肌肉的收缩,增加肌肉的耐力和力量。
这也是为什么许多运动员在比赛前会选择摄入适量的咖啡因以改善体能表现的原因。
然而,咖啡因也有一些负面的影响。
首先,咖啡因是一种利尿剂,会增加尿液的产生,导致人体排尿频繁。
其次,摄入过多的咖啡因可能会导致失眠、心悸、焦虑等不适症状。
此外,长期摄入过多的咖啡因还可能对心血管系统产生不利影响,增加心脏病和高血压的风险。
虽然咖啡因有一些负面的影响,但适量摄入咖啡因对大多数人来说是安全的。
根据研究,成年人每天摄入400毫克的咖啡因是安全的。
这个数量相当于大约4杯普通咖啡的咖啡因含量。
然而,孕妇、儿童、青少年和心血管疾病患者等特定人群需要限制咖啡因的摄入量。
除了提供兴奋作用外,咖啡因还具有一些其他的生理效应。
例如,咖啡因可以促进脂肪的分解,有助于减肥。
此外,咖啡因还可以扩张支气管,缓解哮喘症状。
这些额外的效应使咖啡因成为一种被广泛应用于医药和保健领域的化合物。
总的来说,咖啡因作为一种广泛存在于饮料和食物中的化合物,对人体具有多方面的影响。
适量摄入咖啡因可以提神、增加警觉性和改善体能表现。
然而,过量摄入咖啡因可能会导致一系列不适症状,并对心血管系统产生不利影响。
因此,在摄入咖啡因时需要注意适量,并根据个人情况进行调整。
同时,特定人群需要限制咖啡因的摄入量。
咖啡因作为一种被广泛应用于医药和保健领域的化合物,其额外的生理效应也值得关注和研究。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在化学中,分子是由两个或多个原子以一定比例结合成的粒子。
以下是分子的三种不同的表述方式:
1. 分子式:分子式是指化学式,是分子中各原子的种类和数量的表示方法。
分子式通常用元素符号表示,并通过小写字母和数字表示元素的种类和数量。
例如,水的分子式是H2O,其中H表示氢,O表示氧,数字2表示有2个氢原子与一个氧原子结合而成。
2. 结构式:结构式是指分子结构的图示方式,通常用线条、点和符号等来表示原子之间的化学键和空间关系。
结构式给出了分子中原子之间结构和键的类型以及它们之间的相对位置。
例如,水的结构式是H-O-H(或H-O-H),其中H和O之间通过化学键相连,而两个H原子和O原子位于同一平面上。
3. 简式式:简式式是一种简化的结构式,它仅描述分子中的基本结构,并省略了许多细节。
通常,简式式用缩写的方式表示原子,如C表示碳,H表示氢,O表示氧等。
例如,乙醇的简式式是CH3CH2OH,其中CH3表示一个甲基基团(即一个碳原子和三个氢原子的组合),CH2表示一个亚甲基基团(即一个碳原子和两个氢原子的组合),OH表示一个羟基
(即氢氧根离子)。
总之,分子式、结构式和简式式都是用来描述分子的不同方式,在化学中都具有非常重要的应用。
