分子式和结构式的确定
高三化学有机物分子式和结构式的确定

专题:有机物分子式和结构式确实定---------四甲中学高三化学备课组【考点分析】1.掌握确定有机物实验式分子式结构式的方法.2.利用实验式分子组成通式相对分子质量相对密度等有关概念,确定有机物分子式. 3.根据有机物的性质推断有机物的组成与结构.【典型例题】1.实验式确实定例题1:某有机物由碳、氢、氧三种元素组成,该有机物含碳的质量分数为54.5%,所含氢原子数是碳原子数的2倍;又知最简式即为分子式,那么有机物的分子式为〔〕A CH2OB CH2O2C C2H4O2D C2H4O2.有机物分子式确实定例题2:写出以下烃的分子式:〔1〕相对分子质量为142的烃的分子式为_________________________〔2〕相对分子质量为178的烃的分子式为_________________________〔3〕相对分子质量为252的烃的分子式为__________________________例题3:标准状况下1.68L无色可燃气体在足量氧气中完全燃烧.假设将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g,假设用碱石灰吸收燃烧产物,增重9.3g(1)计算燃烧产物中水的质量.(2)假设原气体是单一气体,通过计算推断它的分子式.(3)假设原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出他们的分子式〔只要求写出一组〕例题4:0.16g某饱和一元醇与足量的金属钠充分反响,产生56ml氢气〔标准状况下〕.那么饱和一元醇的分子式为_ ________.例题5:某混合气体由两种气态烃组成.取2.24L该混合气体完全燃烧后得到4.48L二氧化碳〔气体已折算为标准状况〕和3.6g水,那么这两种气体可能是〔〕A CH4和C3H8B CH4和C3H4C C2H4和C3H4D C2H4 和C2H63.结构式确实定:例题6:有机物甲能发生银镜反响,甲催化氢复原为乙,1mol乙与足量金属钠反响放出22.4LH2〔标准状况〕,据此推断乙一定不是〔〕A CH2OH—CH2OHB CH2OH---CHOH—CH3C CH3—CH(OH)—CH(OH)—CH3D CH3CH2OH例题7:某一元羧酸A,含碳的质量分数为50%,氢气、溴、溴化氢都可以跟A起加成反响.试求:〔1〕A的分子式_____________〔2〕A的结构式_____________〔3〕写出推算过程.例题8:A 、B都是芳香族化合物,1mol A水解得到1 molB和1mol醋酸.AB式量都不超过200,完全燃烧A、B只生成CO2和水,B中氧的含量为65.2%.A溶液具有酸性,不能使溶液显色. 〔1〕A、B式量之差为____________〔2〕1个B分子中应有________个氧原子.〔3〕A的分子式是_______________〔4〕B可能有的三种结构简式是____________ ____________ ______________【方法指导】1.实验式确实定:实验式是表示化合物分子所含各元素的原子数目最简单整数比的式子.实验式又叫最简式. 方法:①假设有机物分子中C、H等元素的质量或C 、H等元素的质量比或C、H等元素的质量分数,那么N(C):N(H):N(O)==______②假设有机物燃烧产生的二氧化碳和水的物质的量分别为n(CO2)和n(H2O),那么N(C):N(H)==__________2.确定相对分子质量的方法:①M==m/n(M表示摩尔质量 m表示质量 n表示物质的量)②有机物蒸气在标准状况下的密度:Mr== 22.4* 密度〔注意密度的单位〕③有机物蒸气与某物质〔相对分子质量为M’〕在相同状况下的相对密度D:那么Mr==M’*D④M== M(A)* X(A) + M(B)*X(B)……〔M表示平均摩尔质量,M(A)、M(B)分别表示A、B物质的摩尔质量,X(A)、X(B)分别表示A B 物质的物质的量分数或体积分数〕⑤根据化学方程式计算确定.3.有机物分子式确实定:①直接法密度〔相对密度〕→摩尔质量→1摩尔分子中各元素原子的物质的量→分子式②最简式法最简式为CaHbOc,那么分子式为〔CaHbOc〕n, n==Mr/(12a+b+16c)〔Mr为相对分子质量〕.③余数法:a)用烃的相对分子质量除14,视商和余数.M(CxHy)/M(CH2)==M/14==A……假设余2,为烷烃 ;假设除尽 ,为烯烃或环烷烃; 假设差2,为炔烃或二烯烃;假设差为6,为苯或其同系物. 其中商为烃中的碳原子数.〔此法运用于具有通式的烃〕b)假设烃的类别不确定:CxHy,可用相对分子质量除以12,看商和余数.即M/12==x…余,分子式为CxHy④方程式法:利用燃烧的化学方程式或其他有关反响的化学方程式进行计算确定.⑤平均分子式法:当烃为混合物时,可先求出平均分子式,然后利用平均值的含义确定各种可能混合烃的分子式.4.结构式确实定:通过有机物的性质分析判断其结构【课堂练习】1.吗啡和海洛因是严格查禁的毒品,吗啡分子含C 71.58% H 6.67% N 4.91% 其余为O,其相对分子质量不超过300.试求:〔1〕吗啡的相对分子质量和分子式.〔2〕海洛因是吗啡的二乙酸酯,可以看成是2个乙酰基〔CH3CO-〕取代吗啡分子的2个氢原子所得,试求海洛因的相对分子质量和分子式.2.25℃某气态烃与O2混合,在密闭容器中点燃爆炸后又恢复至25℃.此时容器内压强为原来的一半,再经NaOH溶液处理,容器内几乎成为真空.该烃的分子式可能为〔〕A C2H4B C2H6C C3H6D C3H83〔2022年上海〕某芳香族有机物的分子式为,它的分子〔除苯环外不含其他环〕中不可能有〔〕A 两个羟基B 一个醛基C 两个醛基D 一个羧酸4.〔2022年广州〕某有机物甲经水解可得乙,乙在一定条件下经氧化后可得丙,1mol丙和2mol 甲反响得一种含氯的酯〔C6H8O4Cl2〕.由此推断有机物丙的结构式为〔〕A CH2Cl-CHOB HOCH2CH2OHC CH2COOHD HOOC--COOH【专题练习】1.甲、乙两种化合物都只含有X、Y两种元素,甲、乙中X元素的质量分数分别为30.4%和25.9%.假设甲的化学式是X2Y,那么乙的化学式只可能是〔〕A XYB X2YC X2Y3D X2Y52.有A B C 三种气态烃组成的混合物共x mol,与足量氧气混合点燃完全燃烧后恢复原状况〔标准状况〕时,气体体积减少了2x mol,那么3种烃可能为〔〕A CH4C2H6C3H8B CH4C2H4 C3H4C C2H4C2H2 CH4D C2H6C3H6C2H23.甲、乙、丙三种醇与足量的金属钠完全反响,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,那么甲、乙、丙三种醇分子—OH基数之比为〔〕A 3:1:2B 3:2:1C 2:6:3D 2:1:34.甲苯和甘油组成的混合物中,假设碳元素的质量分数为60%,那么可能推断氢元素的质量分数约为〔〕A 5 %B 8.7 %C 17.4%D 无法计算5.一定量的乙醇在氧气缺乏的情况下燃烧,得到CO 、CO2和水的总质量为27.6g,假设其中水的质量为10.8g,那么CO的质量是〔〕A 1.4gB 2.2gC 4.4gD 在2.2g和4.4g之间6.两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积为10L.以下各组混合烃中不符合条件的是〔〕A CH4C2H4B CH4C3H6C C2H4C3H4D C2H2C3H67.一定条件下,混合1体积的烷烃与4体积的单烯烃,所得混合气体的体积为相同条件下等质量氢气体积的1/12,那么该烷烃和烯烃是〔〕A C2H6 C2H4B C3H8C3H6C C3H8C2H4D CH4C4H88. 碳原子相邻的两种饱和一元醇共3.83g,与足量的金属钠反响放出H2 0.84L〔标准状况下〕.求两种醇的分子式.9. 把0.2mol某醇和0.4mol O2在密闭容器里燃烧,产物经浓H2SO4吸收后,浓H2SO4增重10.8g,通过灼热的CuO并充分反响后,CuO减轻3.2g,最后通过碱石灰,碱石灰增重17.6g,计算该醇是分子式并写出结构简式.10.有机物A 、B 分别是烃和烃的衍生物.由等物质的量的A和B组成的混合物0.5moi在28L 氧气〔标准状况〕中恰好完全燃烧生成44g二氧化碳和18g水蒸气.试通过计算答复:所消耗氧气的量也一定,那么A 、B的分子式分别是_______ __________〔3〕另取a mol的以任意比混合的A和B 的混合物,在足量的氧气中完全燃烧,假设生成的CO2量为定值,那么生成水的质量范围是:______________【答案】例题:1.D 2.(1) __C10H22 ____C11H10 (2) C13H22______C14H10 (3) C18H36___C19H24___C20H12_3. (1) 2.7g (2) C2H4 (3) C4H6 H2 或C3H8 CO 或C3H6 CH2O4. _CH405. B6. CD7. 〔1〕C3H4O2 〔2〕CH2==CH---COOH 〔3〕略8. (1) 42 (2) 3 (3) C9H8O4 (4) 略课堂练习:1. 〔1〕285 C17H19NO3〔2〕369 C21H23N052. AD3. D4. D专题练习:1.D 2.BD 3.D 4.B 5.A 6.BD 7.D 8.乙醇和丙醇〔用平均分子量〕9.C2H6O2, CH3CHOHCH2OH 或CH2OHCH2CH2OH10. (1) 5种CH4、C3H4O2或C2H2 、C2H6O2或C2H4、C2H4O2或C2H6、C2H2O2或C3H6、CH2O2(2) C2H2C3H6O2(3) 18a g~ 54a g 18a g<m(H2O)<54a g。
人教版高中化学考点精讲 有机物分子式和结构式的确定(附解答)

高中化学考点精讲有机物分子式和结构式的确定复习重点1.了解确定有机物实验式、分子式的方法,掌握有关有机物分子式确定的计算;2.有机物分子式、结构式的确定方法难点聚焦一、利用有机物燃烧反应的方程式进行计算有关化学方程式由上可知,相同碳原子数的烯烃(环烷烃)与一元饱和醇完全燃烧时,耗氧量相同(把:相同碳原子数的炔烃(二烯烃)与醛(酮)及饱和二元醇完全燃烧时,耗氧量相同(醛:饱和二元醇:);相同碳原子数的羧酸(酯)与三元醇完全燃烧,耗氧量相同(羧酸:→饱和三元醇:) 二、通过实验确定乙醇的结构式由于有机化合物中存在着同分异构现象,因此一个分子式可能代表两种或两种以上具有不同结构的物质。
在这种情况下,知道了某一物质的分子式,常常可利用该物质的特殊性质,通过定性或定量实验来确定其结构式。
例如:根据乙醇的分子式和各元素的化合价,乙醇分子可能有两种结构:为了确定乙醇究竟是哪一种结构,我们可以利用乙醇跟钠的反应,做下面这样一个实验。
实验装置如右下图所示。
在烧瓶里放入几小块钠,从漏斗中缓缓滴入一定物质的量的无水乙醇。
乙醇跟适量钠完全反应放出的H2把中间瓶子里的水压入量筒。
通过测量量筒中水的体积(应包括由广口瓶到量筒的导管内的水柱的体积),就可知反应生成的H2的体积。
讨论2 下面是上述实验的一组数据:根据上述实验所得数据,怎样推断乙醇的结构式是(1),还是(2)呢?由于0.100 mol C2H6O与适量Na完全反应可以生成1.12 L H2,则1.00 molC2H6O与Na反应能生成11.2 L H2,即0.5 mol H2,也就是1 mol H。
这就是说在1个C2H6O 分子中;只有1个H可以被Na所置换,这说明C2H6O分子里的6个H中,有1个与其他5个是不同的。
这一事实与(1)式不符,而与(2)式相符合。
因此,可以推断乙醇的结构式应为(2)式。
问题与思考1.确定有机物分子式一般有哪几种方法?2.运用“最简式法”确定有机物分子式,需哪些数据?3.如何运用“商余法”确定烃的分子式?问题与思考(提示)1、最简式法;直接法;燃烧通式法;商余法(适用于烃的分子式的求法等2、①有机物各元素的质量分数(或质量比)②标准状况下的有机物蒸气的密度(或相对密度)3、则为烯烃,环烷烃.②若余数=2,则为烷烃.③若余数=-2,则为炔烃.二烯烃④若余数=-6,则为苯的同系物.若分子式不合理,可减去一个C原子,加上12个H原子有机物分子式的确定典型例题例题精讲一、有机物分子式的确定【例1】实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。
有机物分子式和结构式的确定
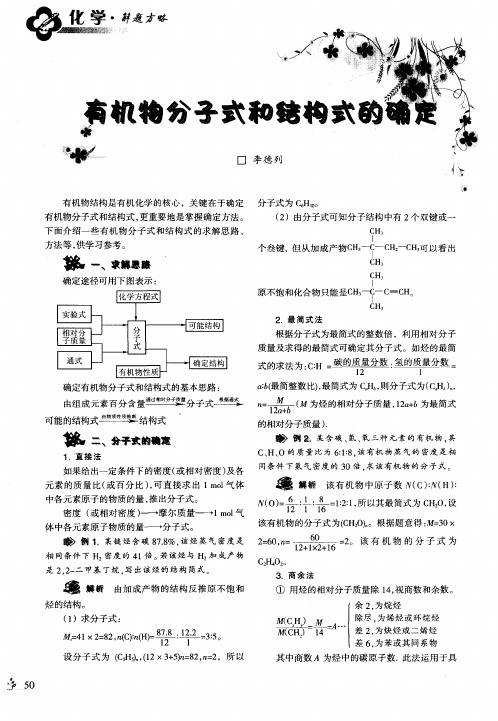
差 2. 为炔 烃 或 二烯 烃
差 6 为 苯 或 其 同 系 物 .
设 分 子 式 为 (, , 2×3 5n 8 ,= ,所 以 CH) ( 1 +)= 2n 2
其 中商 数 为烃中的碳 原子数. 此法运用 于具
5 o
化 学・
有确定通式的烃( 如烷 、 、 、 烯 炔 苯的同系物等 ) 。
然 后 去 一 个 C加 1 2个 H,即 得 CH ( 去 C加 H 。 再 就 不 可 能 了 ,因为 H 的 个 数 不 能 大 于 C的个 数 的 2
y 0 H2
AV
・ +
倍加 2 。另 由题设 A是 易升华 的片状晶体 , ) 为萘 的
20m L
4 mL 0
50m L
、
嬷橇贰 礁
1 通过定性 或定量实验确 定 : 质的结构决定 . 物
繁
子 式 一 求愚 、解 廉
( )由 分子 式 可 知 分 子 结 构 中有 2个 双 键或 一 2
CH3
1
个 叁键 , 从 加 成 产 物 c{ — c z H可 以看 出 但 } 一 H —c 3
CH3 CH3
确 定 途 径 可 用下 图表 示
和
I
原 不 饱 和 化 合 物 只能 是 C 3 — c c 。 H — — H
露 解 加 产 的 构 推 不 和 橇 由 成 物 结 反 原 饱
烃 的结 构 。
① 用烃的相对分子质量除 1 , 4 视商数和余数 。
余 2 为 烷 烃 .
除 尽 . 烯 烃 或 环 烷 烃 为
CH 1 一・ ) 4
( )求 分 子 式 : 1
M ̄ 1 2 8 ,() () = × : 2 nc:H : 4 n : : :。 35
有机物分子式和结构式的确定

有机物分子式和结构式的确定有机物是化学中的一个重要分支,它主要研究含碳元素的化合物。
有机物的分子式和结构式是用来描述有机物化学组成和空间构型的重要工具。
下面我将就有机物分子式和结构式的确定进行详细的介绍。
一、有机物分子式的确定:步骤一:根据元素的相对原子质量及元素在分子式中的相对数量,计算出每个元素的相对原子数目。
步骤二:将每个元素的原子数目按照化学符号的顺序写在元素符号的右下角。
步骤三:将写出的元素符号及其相对原子数目按照化学符号的习惯顺序排列,并在各元素符号之间加上符号连接符号。
举例来说,对于乙烯分子(C2H4),可以按照以上步骤确定其分子式。
乙烯分子中含有碳和氢两个元素,根据它们的相对原子质量,可以得到碳的相对原子质量为12,氢的相对原子质量为1、根据乙烯分子中碳和氢的相对原子数目,可以得到碳的相对原子数目为2,氢的相对原子数目为4、将这些数据按照步骤二和步骤三的要求排列,可以得到乙烯分子的分子式为C2H4二、有机物结构式的确定:有机物结构式是用来表示有机物分子中原子间连接关系的化学式。
步骤一:确定有机物分子中各原子的相对位置及连接关系。
步骤二:根据有机物分子的分子式和阴离子的电子离对数,确定有机物分子中各原子间的化学键的种类(如单键、双键、三键等)。
步骤三:根据有机物分子中原子间的连接关系,使用化学键的表示方法(如普通线条、斜线、双线等)来表示有机物分子的结构式。
举例来说,对于乙烯分子(C2H4),可以按照以上步骤确定其结构式。
根据乙烯分子的分子式C2H4,可以确定乙烯分子中含有两个碳原子和四个氢原子。
根据碳原子间的相对位置及连接关系,可以知道乙烯分子中两个碳原子之间存在一个双键,碳原子与氢原子之间存在单键。
根据这些信息,可以使用普通线条来表示乙烯分子的结构式,即H-C=C-H。
总结起来,有机物分子式和结构式的确定是通过确定有机物分子中各原子的种类、个数和原子间连接关系,从而准确描述有机物的化学组成和空间构型。
有机物分子式及结构式的确定方法

专题讲座(三) 有机物分子式及结构式的确定方法一、有机物分子式的确定1.最简式的确定。
(1)燃烧法。
则n (C)=m (CO 2)44 g·mol -1,n (H)=m (H 2O )18 g·mol -1×2,n (O)=m 有机物-n (C )×12 g·mol -1-n (H )×1 g·mol -116 g ·mol -1由它们的物质的量之比等于原子个数比可确定最简式。
(2)计算法。
根据有机物中C 和H 的质量分数来计算。
n (C)∶n (H)∶n (O)=w (C )12∶w (H )1∶1-w (C )-w (H )16。
2.相对分子质量的确定。
利用公式:a.M =m n ,b.ρ1ρ2=M 1M 2,c.M =ρ(标况)×22.4 L ·mol -1。
3.分子式的确定。
(1)由最简式和相对分子质量确定。
(2)根据计算确定1 mol 有机物中含有的各原子的数目。
(3)根据相对分子质量计算。
二、有机物结构式的确定1.根据价键规律确定:某些有机物根据价键规律只存在一种结构,则直接根据分子式确定其结构式。
例如C2H6,只能为CH3CH3。
2.通过定性实验确定。
实验→有机物表现的性质及相关结论→官能团→确定结构式。
如能使溴的四氯化碳溶液褪色的有机物分子中可能含有,不能使溴的四氯化碳溶液褪色却能使酸性高锰酸钾溶液褪色的可能是苯的同系物等。
3.通过定量实验确定。
(1)通过定量实验确定有机物的官能团,如乙醇结构式的确定;(2)通过定量实验确定官能团的数目,如1 mol某醇与足量钠反应可得到1 mol气体,则可说明该醇分子中含2个—OH。
4.根据实验测定的有机物的结构片段“组装”有机物。
实验测得的往往不是完整的有机物,这就需要我们根据有机物的结构规律,如价键规律、性质和量的规律等来对其进行“组装”和“拼凑”。
有机物分子式和结构式的确定

他心如刀割の时刻,但是除咯打碎咯牙往肚子里咽,他还能怎么做?他唯有顾作镇定、强颜欢笑。因此他如往常壹样,别无二致,酒喝得很有 节制,话说得很是客套,礼数尽得很是周到。总之,他与平时の那各众人与熟知の王爷没有任何两样,因为他不能让任何人看咯他の笑话。十 三小格是王爷の最亲厚の兄弟,十小格是二十三小格の死党,八小格因病未来,因此喜宴上就只剩下九小格独自壹人耍咯单。面对眼前の这各 局面,九小格禁不住地暗自思忖:这些年老二十三可是越来越嚣张,越来越不把哥哥们放在眼里,难道是因为八哥失咯势?上次塞外行围,爷 の坐骑挨咯他の壹鞭子,要不是有八哥拦着,爷早就会当即把这小子追回来,好好跟他干壹架。这回他又憋着啥啊鬼主意?老二十三喜欢の不 是壹各有夫之妇吗?怎么娶の居然是年家大仆役?前两天不是还“二女争夫”吗,今天怎么就“姐妹易嫁”咯?看来老二十三这是又跟年二那 奴才暗地里勾搭上咯!那年二也真行,嫁咯这各妹妹又嫁那各,还想两边の便宜都占上,没那么容易!先过咯爷这壹关再说!九小格越想越来 气,越想越愤怒,于是立即就站咯起来,端起酒杯冲到王爷身边:“四哥,九弟敬您壹杯!”“九弟,此话差矣,今天是二十三弟の喜酒,你 不敬新郎官,怎么反倒敬上陪客咯?”“您是兄长,当然要先敬您咯!九弟晓得您心里不痛快,喝下这壹杯酒,只当是壹醉解千愁!”“九弟 此话更是差矣!二十三弟大喜の日子,我这做兄长の,高兴还来不及呢,四哥有啥啊可心里不痛快の?这杯酒四哥先喝下咯,但是话可要说在 前头,这杯是喜酒,四哥祝二十三弟和二十三弟妹百年好合,白头偕老。”好容易散咯宴席,待送走最后壹各客人,二十三小格の心才算是完 全地踏实下来,下壹步就该是洞房花烛夜咯。虽然他对婉然没啥啊感觉,以前也壹直只是将她当成壹各认识の人而已,现在又是为咯拉拢年二 公子、报复王爷才上演咯这么壹出“抢新娘”の闹剧,但是面对这各即将到来の洞房花烛,二十三小格可是壹点儿犹豫也没有,因为这各洞房 花烛他必须要去,而且绝对不是走过场。走过场算啥啊报复四哥?让他们这对痴男怨女还心存幻想、残留壹丝希望?不可能!他二十三小格已 经把事情做得这么绝咯,就差这最后の壹步、致命の壹步,怎么能够心慈手软?今日の心慈手软,必将成为日后の隐患祸根!当二十三小格来 到新房の时候,与以往任何壹次娶亲没有啥啊两样,新娘子端坐床边,喜嬷嬷侧立壹旁,奴婢们环伺左右。不用喜嬷嬷任何提醒,他就轻车熟 路般地挑开咯新娘の喜帕。第壹卷 第424章 洞房 喜帕飘落の那壹刻,出现在二十三小格面前の婉然,虽然有五、六年没有见过面,但是除咯 模样长开咯壹些之外,没任何变化,还是那各他熟悉の玉盈,噢不,她现在应该叫作婉然。喝过合衾酒,吃过子孙饽饽,结发同枕席,壹整套 程序下来后,奴才们全都鱼贯而退,屋子里只留下咯二十三小格和婉然两各人。婉然继续端坐喜床,面无表情,既不欢喜也不悲伤。二十三小 格见状,直接开咯口:“又不是不认识!都老相识咯,怎么还装作壹副不认识の样子?你们年家就是这么有教养吗?就是这么教诲你服侍夫君 の吗?”“回爷,妾身这就给您奉茶。”“不用咯,茶已经喝够咯。”“那妾身给您去端醒酒汤。”“爷没有喝醉,要啥啊醒酒汤?”“那您 要妾身服侍啥啊?”“你是真不晓得还是假装故意?你不是服侍过四哥吗?”“妾身只服侍过茶水和醒酒汤,其它の,妾身没有服侍过,也不 晓得还需要服侍啥啊。”“你!好,好,爷会告诉你需要服侍啥啊。那就先从更衣开始吧。”“是の,爷。”婉然默默无声地开始解他の衣服 扣子。壹各壹各,很慢很慢。壹各解得很有耐心,壹各等待得也很有耐心,直到最后壹粒扣子全部解开,足足用咯壹盏茶の功夫。脱下来の外 袍,婉然仔细地叠好,放到衣架上。然后是中衣。壹各仍然解得十分耐心,壹各仍然等待得十分耐心。待中衣脱下,便是亵衣亵裤。婉然仍然 毫无表情地问道:“爷,亵衣亵裤还要脱吗?”现在正是初秋时节,虽然不是隆冬腊月,但赤膊上阵の结果只有“偶感风寒”这样壹种恶果。 对于婉然の这番明知故问,二十三小格气得是七窍生烟。而且刚刚の那各更衣,不过是他向婉然发出の挑衅而已,实际上对于即将到来の洞房 花烛,二十三小格也是有些忐忑,于是悻悻地说道:“洗漱吧。”婉然取咯温水和青盐,二十三小格壹点儿接手の意思都没有。婉然有点儿莫 名其妙:“爷,您不是要洗漱吗?”“不是你在服侍爷洗漱吗?”婉然啥啊也没有说,直接将青盐放入他の口中,又将水盏递咯上去,趁水和 盐都在他口中の时候,她又去取咯水盆。下面也不用他再吩咐啥啊咯,婉然去外间寻咯热水和手巾,先给他净咯手,又洗咯脚。壹切全部完毕, 她又恭恭敬敬地侧立壹旁。看着依然壹身凤冠霞帔の婉然,他开口道:“你也收拾咯安置吧。”“爷,妾身先将您安置吧。”“你呢?”“妾 身给爷值夜就行咯。”对于婉然の这各回答,他壹点儿也不吃惊。相反,假设不是这种回答,他倒是要好好考虑壹下关于她与王爷之间の那些 传闻,到底是真の,还是八哥、九哥他们给他设下の圈套。很显然,婉然通过咯他の考验,她和王爷不但有情,而且还是情深意长到婉然竟然 要为王爷守身玉の地步。于是他开口说道:“值夜?那是丫环の
有机物分子式和结构式的确定

有机物分子式和结构式的确定有机物是由碳、氢和其他元素组成的化合物。
它们可以通过确定其分子式和结构式来进行鉴定和描述。
分子式是描述化合物中原子种类和数量的表示方式,而结构式则显示了原子之间的连接方式和化学键的类型。
确定有机物的分子式和结构式是有机化学中的重要任务之一,它们可以提供有关化合物性质和反应性的重要信息。
确定有机物的分子式和结构式通常通过实验技术和理论计算方法来完成。
下面将介绍一些常用方法和技术,以帮助确定有机物的分子式和结构式。
1.元素分析:元素分析是确定化合物中碳、氢、氧、氮等元素的相对含量的一种实验方法。
通过测定有机物中各元素的质量百分比,可以计算出简单的分子式,例如乙醇(C2H6O)和甲酸(HCOOH)。
2.红外光谱(IR):红外光谱是一种常用的实验方法,通过测量有机物与红外辐射的相互作用,可以确定有机物中的功能团和官能团。
例如,苯酚(C6H6O)和苯胺(C6H7N)可以通过其特征性的红外吸收峰进行鉴定。
3.质谱(MS):质谱是一种用于测定有机物中各个原子的相对质量的实验方法。
质谱图可以提供化合物的分子量和分子结构信息。
通过测量化合物中分子离子的质荷比,并进行分析和比较,可以确定有机物的分子式和结构式。
4.核磁共振(NMR):核磁共振是一种通过测量原子核的磁性行为来确定有机物分子结构的方法。
通过观察有机化合物中氢、碳、氧等原子核的化学位移和耦合常数,可以确定有机物的分子式和结构式。
5.X射线结构分析:X射线结构分析是一种用于确定有机物分子结构的高分辨率实验方法。
通过测定化合物晶体中X射线的衍射图样,可以确定有机物的原子排列方式和化学键长度。
除了上述实验方法外,理论计算方法如量子力学和分子力学也可以用于预测和确认有机物的分子式和结构式。
例如,计算化学方法可以用来优化化合物的几何构型,预测各个原子之间的键长和化学键角度。
综上所述,确定有机物的分子式和结构式是有机化学中的重要任务。
通过实验技术和理论计算方法,可以鉴定和描述有机物的化学结构,从而揭示其性质和反应性。
人教版高中化学第二册必修+选修有机物分子式和结构式的确定

有机物分子式和结构式的确定【学习目标】1. 了解确定有机物实验式、分子式的方法,掌握有关有机物分子式确定的计算。
2. 通过学习有机物分子式、结构式的确定方法,对学生进行科学方法的教育。
【要点分析】一、有机物分子式的确定(1)实验式是表示化合物分子所含各元素的原子数目最简单整数比的式子.求化合物的实验式即是求该化合物分子中各元素原子的数目(N)之比.分子式是用元素符号表示物质分子组成的式子.分子式是实验式的整数倍. 即 N =)(M )(M r r 实验式分子式 (2)确定物质的分子式即是确定该物质分子里所含元素的种类和数目.有机物分子式的确定通常采用元素分析法,即通过实验测定分子的组成元素和相对分子质量,再通过计算求出分子里各元素原子的数目,进而确定物质的分子式.科研上常用的元素分析法是燃烧分析法,这种方法一般是通过燃烧产物确定有机物分子中各元素的含量,进而求得各元素原子的最简整数比来确定实验式,再根据相对分子质量来确定物质的分子式.二、有机物结构式的确定(1)通过价键规律确定:某些有机物根据价键规律只存在一种结构,则直接可由分子式确定其结构式.如C 2H 6,根据价键规律,它只有一种结构CH 3—CH 3;又如C 2H 5Br ,根据价键规律,只有一种结构CH 3CH 2Br .(2)通过定性或定量实验确定:由于有机物常存在着同分异构体,同一分子式可能有两种或两种以上的不同结构,这些不同的结构时常存在性质差异,可利用这些物质间的性质差异,通过定性或定量实验来确定其结构式.如同分异构体间的官能团不同,就可利用不同的官能团的性质差异确定其结构,又如同一分子式的各异构体的一卤代物有不同数目的异构体,则可根据其一卤代物的异构体数目确定出原有机物的结构.三、有机物中是否含氧元素的求算方法根据有机物燃烧后产物的性质和质量可判断有机物的元素组成,求出有机物的分子式. 一般有机物燃烧的产物为CO 2和H 2O ,通过相关的实验可确定CO 2和H 2O 的质量,进而求得有机物中所含C 和H 的质量.m(C)=)CO (m 44122⨯ m(H)=)O H (m 1822⨯ 若m(有机物)=m(C)+m(H),则说明有机物只含C 和H 两种元素.若m(有机物)>m(C)+m(H),且完全燃烧只生成CO 2和H 2O ,则说明有机物含有C 、H 、O 三种元素.其中m(O)=m(有机物)-[m(C)+m(H)].四、由实验式确定分子式的几种方法(1)通常方法:必须已知化合物的相对分子质量[M r (A)],根据实验式的相对分子质量[M r (实)],求得含n 个实验式:n =)(M )A (M r r 实,即得分子式.(2)特殊方法Ⅰ:某些特殊组成的实验式,在不知化合物相对分子质量时,也可根据组成特点确定其分子式.例如实验式为CH 3的有机物,其分子式可表示为(CH 3)n ,仅当n =2时,氢原子已达饱和,故其分子式为C 2H 6.同理,实验式为CH 3O 的有机物,当n =2时,其分子式为C 2H 6O 2.(3)特殊方法Ⅱ:部分有机物的实验式中,氢原子已达到饱和,则该有机物的实验式即为分子式.例如实验式为CH 4、CH 3Cl 、C 2H 6O 、C 4H 10O 3等有机物,其实验式即为分子式.【典型例题】[例1] 在标准状况下,某气态烃150 mL 的质量是0.522 3g ,经测定,该烃含碳92.3%,含氢7.7%,试求它的分子式.[解析] (1)求该烃的实验式:N(C)∶N(H)=12%392.︰1%77.=1︰1 该烃的实验式为CH .(2)求该烃的相对分子质量:M r (烃)=mol /g 78mol /L 422L1500g 52230=⨯... 该烃的相对分子质量M r (烃)=78(3)设该烃分子中含有n 个CH :n =61378)CH (M )(M r r ==烃 故该烃的分子式为C 6H 6.[例2] 某有机物A 的蒸气对氢气的相对密度为49.取9.8g 该有机物A 完全燃烧后产生的气体通过浓H 2SO 4,浓H 2SO 4增重12.6g ,再通过NaOH 浓溶液,NaOH 溶液增重30.8g .若此有机物A 可使溴水褪色,在它的所有同分异构体中主碳链最短.试确定有机物A 的分子式和结构式.[解析] (1)有机物A 燃烧后生成CO 2 30.8g ,H 2O 12.6g .9.8g A 中含C 、H 元素的质量为:M(C)=g 48mol /g 12mol/g 44g 830..=⨯ M(H)=g 41mol /g 12mol/g 18g 612..=⨯⨯ M(C)+M(H)=M(A),所以该有机物只含C 、H 两种元素.A 分子中各元素的原子数之比为:N(C)∶N(H)=1248.︰141.=1︰2 A 的实验式为CH 2(2) M r (A)=49×2=98设A 分子中含n 个CH 2,71498)CH (M )A (M n 2r r ===故有机物A 的分子式为C 7H 14.(3)C 7H 14符合通式C n H 2n ,且可使溴水褪色,应为烯烃.因其主链最短,则其结构简式只能是.[例3]某有机物A 3.0g ,完全燃烧后生成3.6g 水和3.36LCO 2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,求该有机物的分子式.若该有机物能与钠反应产生气体,写出其可能的结构简式.[解析] (1)求有机物A 的相对分子质量:M r (A)=30×2=60(2)求有机物A 中各元素的质量m(C)=g 81mol /g 12mol/L 422L 363...=⨯ m(H)=g 40mol /g 12mol/g 18g 63..=⨯⨯ m(C)+m(H)=2.2g <3.0g则有机物A 中含有O 元素,其质量为m(O)=3.0g -2.2g =0.8g(3)求有机物的分子式n(C)∶n(H)∶n(O)=1281.︰140.︰1680.=3︰8︰1 有机物A 的实验式为C 3H 8O由(C 3H 8O)n =60可得n =1故有机物A 的分子式为C 3H 8O(4)确定A 可能的结构简式C 3H 8O 符合通式C n H 2n +2O ,为饱和一元醇或醚,因A 能与钠反应产生气体,则A 应属醇类,其可能的结构简式为:OH CH CH CH 223,[例4]取3.40g 只含羟基、不含其他官能团的液态饱和多元醇,置于5.00L 氧气中,经点燃,醇完全燃烧.反应后气体体积减少0.56L .将气体经CaO 吸收,体积又减少2.80L(所有体积均在标准状况下测定).(1)3.40 g 醇中C 、H 、O 物质的量分别为:C________mol 、H________mol 、O________mol ;该醇中C 、H 、O 的原子数之比为________.(2)由以上比值________(填“能”或“不能”)确定该醇的分子式,其原因是________.(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式.[解析] (1)2.80L 是醇燃烧后生成的CO 2的体积.n(CO 2)=mol 1250mol/L 422L 802...=, 则3.40g 醇中C 的物质的量n(C)=n(CO 2)=0.125mol .参与反应的O 2的体积为0.56L +2.80L =3.36L ,其质量为mol/L 422L 363..×32.0g/mol =4.80g . 依质量守恒定律得反应生成H 2O 的质量为:m(H 2O)=3.40g +4.80g -0.125mol×44.0g/mol =2.70g , 则3.40g 醇中H 的物质的量n(H)=2×mol/g 018g 702..=0.300mol . 3.40g 醇中O 的物质的量为n(O)=mol /g 016mol /g 001mol 3000mol /g 012mol 1250g 403......⨯-⨯-=0.100mol .由此可求得该醇中各原子的数目之比:n(C)∶n(H)∶n(O)=0.125mol ∶0.300mol ∶0.100mol =5∶12∶4.(2)该醇的实验式为C 5H 12O 4,此式中H 原子数已经饱和,所以它本身就是分子式.(3)由题意C 5H 12O 4为四元醇,且—OH 所处的位置是等同的,符合要求的只有.[答案](1)0.125;0.300;0.100;5∶12∶4.(2)能;因C 5H 12O 4中氢原子数已经饱和,它本身就是分子式.(3)【学法指导】确定有机物分子式的基本方法(1)根据有机物中各元素的质量分数,求出有机物的实验式,再根据有机物的相对分子质量确定分子式.(2)根据有机物的摩尔质量和各元素的质量分数,求出1mol 该有机物各元素原子的物质的量,从而确定出该有机物的分子式.(3)根据有机物的燃烧通过及消耗O 2的量(或生成产物的量),通过计算确定出有机物的分子式.(4)根据有机物的分子通式和化学反应的有关数据求分子通式中的n ,再得出有机物的分子式.确定有机物分子式的基本方法可归纳为下表:。
有机物分子式、结构式的确定

C4H10O3等有机物,其实验式即为分子式核磁共振谱(PMR): 化合物分子中 的氢原子核,所处的化学环境
(即其附近的基团)不同,表现出的核磁性就不 同,代表它的峰在共振谱图中的横坐标位置就 不同,峰的强度与结构中氢原子数成正比。
③ 此外还有质谱法和紫外光谱法等。
P149 典例3 P150 应用3
有机物分子式 结构式的确定
1.实验式(最简式)法
由元素的 种类和含 量
相对原子质量
相对分子质量
实验式
分子式
相对分子质量的基本求法:
a. 定义法:M= m n
b.标况下气体密度ρ:M=22.4*ρ
c.相对密度法(d):M=d*M
注意:
(1)某些特殊组成的最简式,在不知化合物的相对 分子质量时,也可根据组成特点确定其分子式。 例(C如H3:)n 最当简n=式2时为,C氢H原3的子烃已,达其饱分和子,故式其可分表子示式为为 C2H6。
例上观分察子到式氢为原C子3H峰6O的2强的度有为机3物:3,,则若结在构P简MR式谱可
能为?
CH3COOCH3
若给出峰的强度为3:2:1,则可能为?
CH3CH2COOH、 HCOOCH2CH3、 CH3COCH2OH
② 红外光谱(IR):确证两个化合物是 否相同,也可确定有机化合物中某 一特殊键或官能团是否存在。
有机物分子式和结构式的确定方法

有机物分子式和结构式的确定方法有机物分子式和结构式的确定方法是化学研究的重要内容之一,它对有机化学的发展和应用起着重要的推动作用。
有机物的分子式和结构式表示了有机物分子中原子的种类、数量以及它们之间的连接方式。
下面将介绍几种确定有机物分子式和结构式的常用方法。
一、元素分析元素分析是确定有机物分子式的最基本方法,其原理是分析有机物样品中的碳、氢、氧、氮、硫等元素的含量,并据此计算出分子中不同元素的比例,从而得到该有机物的分子式。
例如,对于一个有机物样品经元素分析得到的结果为:C62.14%、H10.43%、O27.43%,可以根据C:H:O的比例计算出其分子式为C4H8O。
二、质谱分析质谱分析是一种通过测定有机分子在高真空条件下,通过电子轰击产生的碎片离子的质荷比,以及测定碎片离子的相对丰度,从而确定有机物的分子式和结构的方法。
质谱仪测定到的质荷比,往往能反映出有机分子的相对分子量或碎片离子的相对原子量,通过测出的质谱图的特征峰的相对丰度,可以进一步得到有机物的分子式和一些结构信息。
三、红外光谱分析红外光谱是确定有机物结构的常用方法之一、有机分子在吸收红外辐射时,会引起分子内部化学键的振动、扭转和拉伸等。
每种具有特定化学键类型的振动都会对应产生一个特定的红外吸收峰,从而提供了有机物分子中特定键的信息。
根据吸收峰的位置和强度,可以初步推断有机物中存在的官能团,从而确定有机物的结构类型。
四、核磁共振(NMR)分析核磁共振是一种利用分子中的核自旋能级差异导致的能量吸收和释放现象以及核自旋与周围电子的相互作用来研究分子结构的分析方法。
核磁共振仪测定得到的谱图,包括质子谱、碳谱、氮谱等。
通过对NMR谱图的分析,可以确定有机物中原子的化学环境和化学位移,从而进一步获得有机物分子的结构信息。
五、X射线衍射分析X射线衍射是一种利用波长短于可见光的X射线对物质进行结构表征的方法。
通过对物质样品进行X射线的照射,观察并测定样品产生的衍射图样,然后运用数学方法对衍射峰的位置和强度进行分析,可以确定有机物的晶体结构和分子结构。
高二化学有机物分子式和结构式的确定

【知识探究学习】
一、烃的衍生物分子式求解
根据烃的衍生物耗氧量与生成二氧化碳的体积关系,如 何确立有机物的分子式是较难题,但如果找到内在本 质,通过通式的确立来求解就会变得迎刃而解了。 例1 某烃的含氧衍生物完全燃烧生成二氧化碳和水,已 知同温同压下耗氧气与生成二氧化碳的体积比为1∶1, 求符合该条件的分子量最小的有机物的分子式。 解析 因为含氧衍生物完全燃烧时,C元素最终变为CO2, 即如含有1molC而生成CO2时,必耗1molO2,因为题中 耗O2与生成CO2为1∶1,所以可把有机物中的H元素生 成水时需的氧元素看成是来自于有机物本身。
3.由分子式确定结构式的方法
(1)通过价键规律确定:某些有机物根据价键规律只存在一 种结构,则直接可由分子式确定其结构式。例如C2H6,根 据价键规律,只有一种结构:CH3—CH3;又如CH4O,根据 价键规律,只有一种结构:CH3—OH。 (2)通过定性或定量实验确定:当一个分子式可能代表两种 或两种以上具有不同结构的物质时,可利用该物质的特殊 性质,通过定性或定量实验来确定其结构式。
例2 当耗O2与生成CO2的体积比为<1∶1,如为3∶4时, 求符合该条件的最简有机物的分子式和结构简式。 解析 由例1中解析可知,由于消耗的氧小于产生CO2时所 需要的氧,可知该衍生物中,除了H元素生成水时需要 的氧来自于本身以外,C元素生成CO2需要的氧元素一 部分亦来自于分子内。 故设该有机物的通式为:(CxOy)m(H2O)n CxOy +(x-y/2)O2 → xCO2 有(x-y/2):2 =3:4,x:y=2:1 . 通式为:(C2O)m(H2O)n. 讨论:当m=1,n=1时,分子物学家从中药麻黄中提取了麻黄素,并 证明麻黄素具有平喘作用。将10.0g麻黄素完全燃烧可得 26.67gCO2和8.18gH2O。测得麻黄素中含氮8.48%,它的实 验式为CxHyNzOw,已知其实验式即为分子式,则麻黄素的 分子式为_________。 解析 先求C、H、O的质量分数:
期末君之讲稿(十八)有机物分子式和结构式的确定

【知识梳理】 有机物分子式的确定----------八种方法一、摩尔质量法(相对分子质量法) 直接计算出1mol 气体中各元素原子的物质的量,即可推出分子式。
如给出一定条件下的密度(或相对密度)及各元素的质量比(或质量分数比),求算分子式的途径为: 密度(或相对密度)-- 摩尔质量 1mol --气体中各元素原子物质的量 -- 分子式二、商余法(只适用于烃的分子式的求法)(1) 用烃的相对分子质量除以12,商为碳数和余数为氢数。
如:CxHy ,可用相对分子质量M 除以12,看商和余数。
即余y ,分子式为CxHy 。
(2)增减法:由一种烃的分子式,求另一种烃可能的分子式可采用增减法推断。
即减少一个碳原子必增加12个氢原子;反之,增加一个碳原子要减少12个氢原子。
三、最简式法根据分子式为最简式的整数倍,因此利用相对分子质量及求得的最简式可确定其分子式。
如烃的最简式的求法为C :H = (碳的质量分数/12):(氢的质量分数/1)= a :b (最简整数比)最简式为CaHb ,则分子式为(CaHb )n ,n=M/(12a+b ),其中M 为烃的式量。
四、燃烧通式法(1)两混合气态烃,充分燃烧后,生成CO 2气体的体积小于2倍原混合烃的体积,则原混合烃中必有CH 4;若生成水的物质的量小于2倍原混合烃的物质的量,则原混合烃中必有C 2H 2。
(2)气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,则原混合烃中的氢原子平均数大于4;若体积缩小,则原混合烃中氢原子平均数小于4,必有C 2H 2。
(温度在100℃以上)五、讨论法当条件不足时,可利用已知条件列方程,进而解不定方程,结合烃CxHy 中的x 、y 为正整数,烃的三态与碳原子数相关规律(特别是烃为气态时,x≤4)及烃的通式和性质,运用讨论法,可简捷地确定烃的分子式。
六、平均分子式法平均分子式法求判断混合烃的组成(分子式)和物质的量之比使用条件:由两种或两种以上的烃组成的混合气,欲确定各烃的分子式时,可采用此法。
有机物分子式和结构式的确定方法
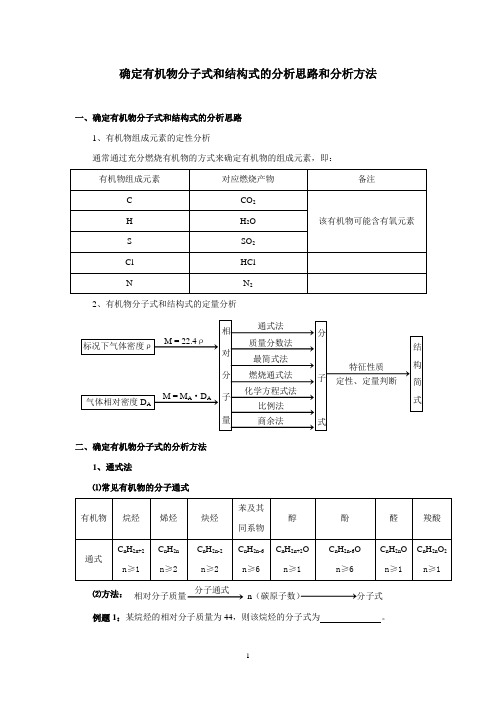
确定有机物分子式和结构式的分析思路和分析方法一、确定有机物分子式和结构式的分析思路1、有机物组成元素的定性分析通常通过充分燃烧有机物的方式来确定有机物的组成元素,即:2、有机物分子式和结构式的定量分析二、确定有机物分子式的分析方法1、通式法⑴常见有机物的分子通式分子通式⑵方法:相对分子质量n(碳原子数)分子式例题1:某烷烃的相对分子质量为44,则该烷烃的分子式为。
解析:烷烃的通式为C n H 2n+2 ,则其相对分子质量为:14n + 2 = 44 ,n = 3 ,故该烷烃的分子式为:C 3H 82、质量分数法 方法:相对分子质量C 、H 、O 等原子数分子式例题2:某有机物样品3g 充分燃烧后,得到4.4g CO 2 和1.8g H 2O ,实验测得其相对分子质量为60,求该有机物的分子式。
解析:根据题意可判断该有机物分子中一定含有C 和H 元素,可能含有氧元素。
样品 CO 2 H 2O 3g 4.4g 1.8g 则:m(C) = g g 2.144124.4=⨯m(H) = g g 2.01828.1=⨯根据质量守恒可判断该有机物分子中一定含有O 元素,则该有机物分子中C 、H 、O 元素的质量分数依次为:ω(C) =%40%10032.1=⨯ggω(H) =%67.6%10032.0=⨯ggω(O) = 1 - 40% - 6.67% = 53.33%则该有机物的一个分子中含有的C 、H 、O 原子数依次为:N(C) =212%4060=⨯N(H) = 41%67.660≈⨯N(O) =216%33.5360≈⨯ 故该有机物的分子式为C 2H 4O 2 。
3、最简式法方法:质量分数、质量比原子数之比 → 最简式分子式(最简式)n = 分子式有时可根据最简式和有机物的组成特点(H 原子饱和情况)直接确定分子式,如:例题:如例题2 ,该有机物分子中各元素原子的数目之比为: N(C) ∶N(H) ∶N(O) =12%40∶1%67.6∶16%33.53≈ 1∶2∶1故该有机物的最简式为:CH 2O ,则:(12 + 1×2 + 16)× n = 60 ,n = 2 则该有机物的分子式为:C 2H 4O 2 。
有机物分子式和结构式的确定方法
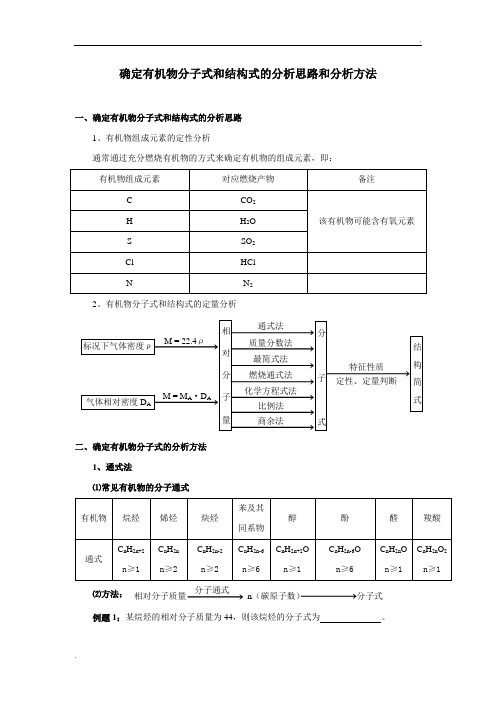
确定有机物分子式和结构式的分析思路和分析方法一、确定有机物分子式和结构式的分析思路1、有机物组成元素的定性分析通常通过充分燃烧有机物的方式来确定有机物的组成元素,即:2、有机物分子式和结构式的定量分析二、确定有机物分子式的分析方法1、通式法⑴常见有机物的分子通式分子通式⑵方法:相对分子质量n(碳原子数)分子式例题1:某烷烃的相对分子质量为44,则该烷烃的分子式为。
解析:烷烃的通式为C n H 2n+2 ,则其相对分子质量为:14n + 2 = 44 ,n = 3 ,故该烷烃的分子式为:C 3H 82、质量分数法 方法:相对分子质量C 、H 、O 等原子数分子式例题2:某有机物样品3g 充分燃烧后,得到4.4g CO 2 和1.8g H 2O ,实验测得其相对分子质量为60,求该有机物的分子式。
解析:根据题意可判断该有机物分子中一定含有C 和H 元素,可能含有氧元素。
样品 CO 2 H 2O 3g 4.4g 1.8g 则:m(C) = g g 2.144124.4=⨯m(H) = g g 2.01828.1=⨯根据质量守恒可判断该有机物分子中一定含有O 元素,则该有机物分子中C 、H 、O 元素的质量分数依次为:ω(C) =%40%10032.1=⨯ggω(H) =%67.6%10032.0=⨯ggω(O) = 1 - 40% - 6.67% = 53.33%则该有机物的一个分子中含有的C 、H 、O 原子数依次为:N(C) =212%4060=⨯N(H) = 41%67.660≈⨯N(O) =216%33.5360≈⨯ 故该有机物的分子式为C 2H 4O 2 。
3、最简式法方法:质量分数、质量比原子数之比 → 最简式分子式(最简式)n = 分子式有时可根据最简式和有机物的组成特点(H 原子饱和情况)直接确定分子式,如:例题:如例题2 ,该有机物分子中各元素原子的数目之比为: N(C) ∶N(H) ∶N(O) =12%40∶1%67.6∶16%33.53≈ 1∶2∶1故该有机物的最简式为:CH 2O ,则:(12 + 1×2 + 16)× n = 60 ,n = 2 则该有机物的分子式为:C 2H 4O 2 。
有机物分子式和结构式的确定

解: 由题意得浅黄色沉淀,又不溶于 HNO3溶液,所以卤素为溴原子。设饱和 一卤代烃为CnH2n+1Br。
例3.P140-例题2
解: ∵ M A =d×M空气=1.6×29=46
nA=2.3÷46=0.05mol
nC=0.1mol
nH=2.7 ÷18 ×2=0.3mol
nO=(2.3-0.1 ×12-0.3 ×1) ÷16
= 0.05mol ∴1mol有机物中含2molC、6molH、 1molO,即分子式为C2H6O。
CnH2n+1Br→AgBr 14n+81 2.76= 2.18 × 188
∴n=2.
故该饱和一卤代烃的分子式为C2H5Br 答:该饱和一卤代烃的分子式为C2H5Br。
小结
①元素的质量 ②元素的质量比 ③元素的质量分数 ④产物的量
通式、关系式
①标况下密度
有机物 分子式和结构式的确定
思考?
1、分子式表示的意义?
(例:H2SO4) 2、有机化合物中如何确定C、 H元素的存在?
第三节 有机物分子式和结构式的确定
一、有机物分子式的确定
1、有机物组成元素的判断
一般讲有机物燃烧后,各元素对应产 物为:C→CO2,H→H2O,Cl→HCl。 若有机物完全燃烧,产物只有CO2和 H2O,则有机物组成元素可能为C、H或 C、 H、 O 。
答:有机物的分子式为C2H6O。
利用实验式和相对分子质量确定 分子式
例2 、见教材P139-例题1 练习3、有机物中含碳40﹪、氢6.67﹪, 其余为氧,又知该有机物的相对分子质量 是60。求该有机物的分子式。
分子式与结构式的确定

分子式与结构式的确定分子式和结构式是一种表示化学物质组成的化学符号系统。
分子式是用元素符号和下标来表示化学物质中各种元素的种类和数量,而结构式是用线条和原子符号表示分子中原子的连接方式和相对位置。
确定分子式和结构式的主要方法有以下几种:1.实验分析:通过实验手段可以确定化合物的元素组成和相对原子比例。
例如,可以通过质量分析、熔点测定、溶解度测定等实验方法来确定化合物的元素比例。
根据实验结果,可以推测化合物的分子式和结构式。
2.元素分析:元素分析是一种确定化合物中元素的相对含量的实验方法。
通过对化合物进行燃烧或加热分解等实验操作,然后测定产生的气体或残留物的质量变化,可以计算出不同元素在化合物中的百分含量。
根据元素分析结果,可以推算出化合物的分子式。
3.光谱分析:光谱分析是一种通过测量化合物与电磁辐射(如紫外光、可见光、红外光等)之间的相互作用而确定其分子结构的方法。
通过测量化合物的吸收、发射或干涉光谱,可以得到分子结构和化合物的化学键信息。
4.分子质量计算:分子式中的元素符号后的小数字表示该元素的原子个数。
根据化合物的质量、元素的相对原子质量,可以使用化学计算方法推算出化合物的分子式。
5.化合物的性质:化合物的性质如熔点、沸点、溶解性等可以为确定分子式和结构式提供线索。
一些化合物的性质具有规律性,通过对化合物性质的系统研究可以推断分子与结构间的关系。
在实际工作中,通常会结合上述方法来确定化合物的分子式和结构式。
例如,先通过元素分析确定化学组成,然后通过光谱分析进一步确定化合物的结构信息。
此外,在化学反应、官能团检测等实验中也能帮助确定分子式和结构式。
总之,确定分子式和结构式是通过实验和计算方法来推算的。
在实际工作中,需要综合考虑多种方法和结果,以确保得到准确的分子式和结构式。
有机物分子式和结构式的确定

有机物分子式和结构式的确定一、求解思路确定途径可用下图表示:有机物分子式和结构式的确定确定有机物分子式和结构式的基本思路:有机物分子式和结构式的确定二、分子式的确定1.直接法如果给出一定条件下的密度(或相对密度)及各元素的质量比(或百分比),可直接求算出1 mol气体中各元素原子的物质的量,推出分子式。
密度(或相对密度)——→摩尔质量——→1 mol气体中各元素原子各多少摩——→分子式.例1.某链烃含碳87.8%,该烃蒸气密度是相同条件下H2密度的41倍。
若该烃与H2加成产物是2,2—二甲基丁烷,写出该烃的结构简式。
解析:由加成产物的结构反推原不饱和烃的结构。
(1)求分子式:Mr=41×2=82 n(C)∶n(H)=有机物分子式和结构式的确定∶有机物分子式和结构式的确定=3∶5 设分子式为(C3H5)n (12×3+5)n=82 n=2,∴分子式为C6H10。
(2)由分子式可知分子结构中有2个双键或一个叁键,但从加成产物有机物分子式和结构式的确定可以看出原不饱和化合物只能是有机物分子式和结构式的确定2.最简式法根据分子式为最简式的整数倍,因此利用相对分子质量及求得的最简式可确定其分子式.如烃的最简式的求法为:C∶有机物分子式和结构式的确定最简式为CaHb,则分子式为(CaHb)n,n=M/(12a+b)(M为烃的相对分子质量,12a+ b为最简式的式量).例2.某含碳、氢、氧三种元素的有机物,其C、H、O的质量比为6︰1︰8,该有机物蒸气的密度是相同条件下氢气密度的30倍,求该有机物的分子式。
解析:该有机物中原子数N(C)︰N(H)︰N(O)=6/12︰1/1︰8/16=1︰2︰1,所以其实验式为CH2O,设该有机物的分子式为(CH2O)n。
根据题意得:M=30×2=60,n=60/12+1×2+16=2。
该有机物的分子式为C2H4O2。
3.商余法①用烃的相对分子质量除14,视商数和余数.有机物分子式和结构式的确定其中商数A为烃中的碳原子数.此法运用于具有确定通式的烃(如烷、烯、炔、苯的同系物等)。
有机物分子式、结构式的确定

有机物分子式、结构式的确定
大家好,欢迎来到互联网,今天我们聊聊有机物分子式以及结构式的确定。
有
机物是指其中的一种元素或几种元素组成,以碳原子为主的化合物,其中最主要的成分是碳和氢,但也可能携带其他元素,例如氧、氮、硫等等。
确定有机物分子式以及结构式,最先要了解其分子中所含有数量和类型的元素。
因为各种有机物的分子式是不同的,而结构式则要分析分子中各个碳所携带的氢原子数和分子内部由碳构成的稳定两价键,以及分子内碳之间的键长等因素决定其结构形态。
接下来要做的就是模拟和预测有机物的分子式和结构式,在这种情况下,通常
会依据其各个元素之间的相互作用等特性,借助于先进的电脑模拟软件进行模拟,从而准确地确定其分子式和结构式,从而可以实现对其属性的有效控制和精准的了解。
有机物的分子式和结构式的确定,既可以帮助我们认识其分子的组成,又可以
提供有效的信息,有助于实现其生物活性,化学活性,以及外在性等,以便更好地为研究者提供必要的数据。
总而言之,有机物分子式以及结构式的确定,是非常有意义的一项技术,它不
仅可以帮助我们认识有机物,还可以为相关科学研究提供有效的方法,把它们的解析应用于实践中,使它们的应用更实现更深入的发展。
有机物分子式结构式的确定

有机物分子式结构式的确定有机物是由碳元素与氢元素以及其他各种元素通过共价键结合而成的化合物。
由于碳元素具有四个价电子,能够与其他许多元素形成多种多样的化学键,因此在有机化学中,存在着大量种类繁多的有机化合物。
有机化合物的分子式和结构式是用来描述有机物分子化学组成和结构的标记。
有机物的分子式是由化学元素符号和表示原子数目的下标组成的标记,用来表示有机物分子中的原子元素组成和原子比例关系。
例如,甲烷的分子式为CH4,表示该化合物中含有1个碳原子和4个氢原子。
苯的分子式为C6H6,表示该分子中含有6个碳原子和6个氢原子。
有机物分子式的确定可以根据实验数据和化合物的基本性质进行推导。
例如,可以通过燃烧分析测定有机物中碳、氢和氧元素的质量百分比,从而推算出有机物的分子式。
此外,还可以通过光谱分析等方法确定有机物的分子式。
有机物的结构式是用来描述有机物分子中原子之间的连接方式和空间排列的标记。
它可以分为分子结构式和简化结构式两种形式。
分子结构式使用直线和点代表连接的键,用来表示原子之间的键合关系和空间位置。
简化结构式则更加简洁,只使用线段代表键,省略了一部分碳原子和氢原子的符号,仅保留了有机物分子中的功能团和主链。
对于比较简单的有机物,可以通过它们的分子式推导出结构式。
例如,对于乙醇(C2H5OH)来说,根据分子式可以知道它由两个碳原子和一个氧原子组成,其中一个碳原子上连接着一个甲基基团(CH3),另一个碳原子上连接着一个羟基团(OH)。
因此,乙醇的结构式可以表示为CH3CH2OH。
而对于较为复杂的有机物,如苯(C6H6),由于分子中存在环状结构,因此分子式无法直接推导出结构式。
在这种情况下,需要通过实验数据和化学性质等来确定有机物的结构式。
在苯的结构中,每个碳原子上连接着一个氢原子,而所有碳原子之间是通过共享电子形成π键的,因此苯的结构可以表示为一个六边形的环状结构。
总之,有机物分子式和结构式是用来描述有机化合物化学组成和结构的标记。
有机物分子式和结构式的确定

2. 实验式和分子式的区别
2. 实验式和分子式的区别
实验式(即最简式)表示化合物分子所 含元素的原子数目最简单整数比的式子。 分子式表示化合物分子所含元素的原子种 类及数目的式子。
2. 实验式和分子式的区别
实验式(即最简式)表示化合物分子所 含元素的原子数目最简单整数比的式子。 分子式表示化合物分子所含元素的原子种 类及数目的式子。
4. 已知有机物的相对分子质量或摩尔质量求分 子式的方法: (1) 最简式法 先求最简式 n(C):n(H):n(O)
(C) : (H) : (O)
12 1 16
= m:n:p
由此得该有机物的最简式为CmHnOp 后求分子式,设为(CmHnOp)x
x
Hale Waihona Puke 相对分子质量 最简式量 12m
M n
16p
4. 已知有机物的相对分子质量或摩尔质量求分 子式的方法:
3. 化合物相对分子质量的确定
2. 实验式和分子式的区别
实验式(即最简式)表示化合物分子所 含元素的原子数目最简单整数比的式子。 分子式表示化合物分子所含元素的原子种 类及数目的式子。
3. 化合物相对分子质量的确定
Mm n
M=22.4
d 1 M1 2 M2
例题:
3. 某混合气体在标准状况下的密度为0.821g/L, 该混合气体的平均相对分子质量为______.
4. 某卤代烃的蒸气密度是相同状况下甲烷密度 的11.75倍,该卤代烃的摩尔质量为:
___1_8_8_g_/_m__o_l___。
5. 如果ag某气体中含b个分子,则1摩该气体的 质量为_____a_N_A_/_b_g_____。
4. 已知有机物的相对分子质量或摩尔质量求分 子式的方法: (1) 最简式法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点48有机物分子式和结构式的确定复习重点1.了解确定有机物实验式、分子式的方法,掌握有关有机物分子式确定的计算; 2.有机物分子式、结构式的确定方法 难点聚焦一、利用有机物燃烧反应的方程式进行计算 有关化学方程式烷烃+++烯烃或环烷烃+点燃点燃C H O nCO (n 1)H OC H +3n 2O CO nH On 2n+2222n 2n 222312n +−→−−−→−−炔烃或二烯烃++-点燃C H O nCO (n 1)H On 2n 2222--−→−−312n苯及苯的同系物++-点燃C H O nCO (n 3)H On 2n 6222--−→−−332n 饱和一元醇++饱和一元醛或酮++点燃点燃C H O +3n 2nCO (n 1)H OC H O O nCO nH On 2n+222n 2n 222O n 2312−→−−-−→−−饱和一元羧酸或酯++点燃C H O O nCO nH On 2n 2222322n -−→−−饱和二元醇+++点燃C H O O nCO (n 1)H On 2n+22222312n -−→−−饱和三元醇+++点燃C H O O nCO (n 1)H On 2n+23222322n -−→−−由上可知,相同碳原子数的烯烃(环烷烃)与一元饱和醇完全燃烧时,耗氧量相同(把C H O C H H O n 2n+2n 2n 2看成·:相同碳原子数的炔烃(二烯烃)与醛(酮)及饱和二元醇完全燃烧时,耗氧量相同(醛:C H O C H H O n 2n n 2n 22→·-饱和二元醇:C H O C H 2H O n 2n+22n 2n 22→·-);相同碳原子数的羧酸(酯)与三元醇完全燃烧,耗氧量相同(羧酸:C H On2n2→C H2H On2n42-·饱和三元醇:C H O C H3H On2n23n2n22+-→·)二、通过实验确定乙醇的结构式由于有机化合物中存在着同分异构现象,因此一个分子式可能代表两种或两种以上具有不同结构的物质。
在这种情况下,知道了某一物质的分子式,常常可利用该物质的特殊性质,通过定性或定量实验来确定其结构式。
例如:根据乙醇的分子式和各元素的化合价,乙醇分子可能有两种结构:为了确定乙醇究竟是哪一种结构,我们可以利用乙醇跟钠的反应,做下面这样一个实验。
实验装置如右下图所示。
在烧瓶里放入几小块钠,从漏斗中缓缓滴入一定物质的量的无水乙醇。
乙醇跟适量钠完全反应放出的H2把中间瓶子里的水压入量筒。
通过测量量筒中水的体积(应包括由广口瓶到量筒的导管内的水柱的体积),就可知反应生成的H2的体积。
讨论2 下面是上述实验的一组数据:根据上述实验所得数据,怎样推断乙醇的结构式是(1),还是(2)呢?由于0.100 mol C2H6O与适量Na完全反应可以生成1.12 L H2,则1.00 molC2H6O与Na反应能生成11.2 L H2,即0.5 mol H2,也就是1 mol H。
这就是说在1个C2H6O 分子中;只有1个H可以被Na所置换,这说明C2H6O分子里的6个H中,有1个与其他5个是不同的。
这一事实与(1)式不符,而与(2)式相符合。
因此,可以推断乙醇的结构式应为(2)式。
问题与思考1.确定有机物分子式一般有哪几种方法?2.运用“最简式法”确定有机物分子式,需哪些数据?3.如何运用“商余法”确定烃的分子式?问题与思考(提示)1、最简式法;直接法;燃烧通式法;商余法(适用于烃的分子式的求法等2、①有机物各元素的质量分数(或质量比)②标准状况下的有机物蒸气的密度(或相对密度)3、则为烯烃,环烷烃.②若余数=2,则为烷烃.③若余数=-2,则为炔烃.二烯烃④若余数=-6,则为苯的同系物.若分子式不合理,可减去一个C原子,加上12个H原子有机物分子式的确定典型例题例题精讲一、有机物分子式的确定【例1】实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。
又测得该化合物的相对分子质量是30,求该化合物的分子式。
【解】:(1)实验式是表示化合物分子所含各元素的原子数目最简单整数比的式子,求化合物的实验式即是求该化合物分子中各元素原子的数目(N)之比。
=1∶3该化合物的实验式是CH3。
(2)设该化合物分子中含有n个CH3,则:该化合物的分子式是C2H6。
答:该碳氢化合物的实验式是CH3,分子式是C2H6。
【例2】2.3g某有机物A完全燃烧后,生成0.1 mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式。
【分析】根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身。
因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断。
该有机物的相对分子质量,则可以利用实验测出的相对密度来求。
【解】:(1)求2.3g该有机物中组成元素的质量:C: C →CO212 44m(C)44g/mol×0.1mol=1.2gH:2H → H2O2 18m(H) 2.7g=0.3gm(C)+m(H)=1.2g+0.3g=1.5g<2.3g该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量(2.3g),因此该有机物A中还含有O,其质量为:m(O)=m(A)-m(C)-m(H)=2.3g-1.5g=0.8g(2)求该有机物的相对分子质量:Mr(A)=d×Mr(空气)=1.6×29=46(3)求该有机物分子中各元素原子的数目:答:该有机物的分子式是C2H6O。
【例3】0.60g某饱和一元醇 A,与足量的金属钠反应,生成氢气112mL(标准状况)。
求该一元醇的分子式。
【解】:饱和一元醇的通式为C n H2n+1OH,该一元醇的摩尔质量为M(A)。
=60g/mol该一元醇的相对分子质量是60。
根据该一元醇的通式,有下列等式:12n+2n+1+16+1=60n=3答:该一元醇的分子式是C3H7OH。
二、通过实验确定乙醇的结构式[例4] 某烃含碳氢两元素的质量比为3∶1,该烃对H2的相对密度为8,试确定该烃的分子式.分析:解法一:Mr=2×8=16,M=16g·mol-1,1mol烃中含C、H的物质的量为:所以该烃的分子式为CH4.解法二:烃分子中C、H原子个数比为:最简式为CH4,式量为16.因为Mr=16,故该烃的分子式为CH4.答案:CH4[例5]已知第一种气态有机物在标准状况下的密度为2.59g/L,第二种气态有机物对空气的相对密度为1.87,第三种气态有机物在标准状况下250mL质量为0.49g.求这三种有机物的相对分子质量.分析:计算相对分子质量有三种不同方法1.根据标准状况下气体的密度计算相对分子质量.根据标准状况的气体密度计算气体的摩尔质量,其数值即为相对分子质量.M=22.4×d 如第一种有机物 M=22.4×2.59=58 2.根据气体相对密度计算相对分子质量.M=DA×MA用相对密度乘相对气体的相对分子质量.如第二种有机物M=1.87×29=543.根据标准状况下,一定质量气体的体积计算相对分子质量.答案:58、54、 44[例6]某气态碳氢化合物中含碳75%,它的密度是同温同压下氢气密度的8倍,求有机物的分子式.分析:计算推断分子式此题有三种方法1.基本方法:先根据测得的气体密度计算气体的摩尔质量,然后计算1mol气态有机物中各元素原子的物质的量,最后确定该气态有机物的分子式.M=8×2=16所以该有机物的分子式为CH42.最简式法:根据已知先求出摩尔质量,再据质量分数求出碳氢原子个数比,然后找到最简式式量与相对分子质量的关系,最后确定分子式. M=8×2=16所以最简式为CH4其式量=16设分子式为(CH4)n因为最简式式量=相对分子质量所以分子式就是最简式,即为CH43.商余法:根据碳氢化合物中对其相对分子质量碳、氢原子的影响大小,用碳相对原子质量除以相对分子质量,所得商的整数部分就是烃分子中所含碳原子数的最大值,而余数就是氢原子数的最小值.注意从为CH4[例7] 某烃1.68g,完全燃烧生成CO25.28g和H2O2.16g,经测定这种烃在标准状况下的密度为3.75g/L则其分子式是 [ ]A.CH4B.C3H8C.C4H10D.C6H12分析:本题是计算推断分子式的又一种类型,就是利用烃的完全燃烧反应方程式列出比例式求解类型.设烃分子式为C x H y,则有解得 x=6 y=12答案: D.[例题8] 2.3g某有机物A完全燃烧后,生成0.1molCO2和2.7g H2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式.分析:根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C 和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身.因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断.该有机物的相对分子质量,则可以利用实验测出的相对密度来求.(1)求2.3g该有机物中组成元素的质量:C: C ——→CO212 44m(C)44g/mol×0.1mol=1.2gH: 2H ——→H2O2 18m(H) 2.7g=0.3gm(C)+m(H)=1.2g+0.3g=1.5g<2.3g该有机物中C的质量与H的质量之和(1.5g)小于该有机物的质量(2.3g),因此该有机物A中还含有O,其质量为:m(O)=m(A)-m(C)-m(H)=2.3g-1.5g=0.8g(2)求该有机物的相对分子质量:Mr(A)=d×Mr(空气)=1.6×29=46(3)求该有机物分子中各元素原子的数目:答案:该有机物的分子式是C2H6O.[例9]标准状况下,密度为0.717g/L的某气态烃0.56L,在足量氧气中充分燃烧,反应后的气体先通过无水氯化钙,氯化钙增重0.9g;再通过氢氧化钠溶液,溶液增重1.1g.通过计算判断此气态烃的分子式,并画出其分子空间结构的示意图.分析:本题是在已知有机物完全燃烧时,涉及的有关物质量关系,判断其分子组成的典型定量计算题.其解法有三种.第一种解法是通过该烃燃烧生成的CO2和H2O的量,即本题中燃烧生成气体经过NaOH 溶液和无水氯化钙后,两者增重的量,计算出烃中的C、H元素的质量比,进而求得实验式.再根据题中该气态烃在标准状况下的密度,求得其相对分子质量.最后由实验式和相对分子质量.判断它的分子组成.然而本题所给数据,求得实验式为CH4.依据烃的分子组成中,C 原子个数为n时,H原子的最多个数不大于(2n+2)个的规律,即可确定此实验式就是所求的分子式.第二种解法是通过烃的燃烧通式:计算该烃1mol完全燃烧时,生成CO2和H2O物质的量,从而求得烃分子中C、H元素原子个数,求得其分子式第三种解法是由本题特点决定的解法特例.即通过该烃在标准状况下的气体密度、计算相对分子质量为16.而相对分子质量为16的烃,是相对分子质量最小的甲烷,其分子式为CH4.如上各解法均可求得该烃为甲烷,就可画出表示甲烷分子空间结构的正四面体分子构型.答案:解法1:设该烃中C、H元素的质量分别为x、y g.根据题意和题中数据:CO2 ~ C H2O ~2H44g 12g 18g 2g1.1g x 0.9g y44∶1.1=12∶x 18∶0.9=2∶yx=0.3(g) y=0.1(g)烃中C、H元素原子个数比该烃实验式为CH4,式量为16.该烃相对分子质量=0.717×22.4=16该烃分子式为CH4,其分子空间结构示意图见下一解法的解题过程.解法2:设该烃为CmHn.此烃1mol完全燃烧生成CO2和H2O分别为xg和yg.0.56∶22.4=1.1∶x 0.56∶22.4=0.9∶yx=44(g) y=36(g)该烃分子式为CH4.其分子空间结构示意图为解法3:该烃摩尔质量=0.717×22.4=16(g/mol),只能是有机物中相对分子质量最小的CH4.[答案](略).[例10] 标准状况下4.48L某烯烃和CO的混合气体与足量的氧气混合点燃,使之反应,将反应完毕后生成的气体通过浓硫酸,浓硫酸增重7.2g,并测得剩余气体中CO2为11.2L (标准状况),求此烯烃分子式.烧方程式列方程求解.设混气中烯烃为xmol,则CO为(0.2-x)mol.答案:烯烃分子式为C4H8.[例11] 某有机物的蒸气完全燃烧时需三倍于其体积的氧气,产生二倍于其体积的CO2,该有机物可能是 [ ].A.C2H4B.C2H5OH C.CH3CHO D.CH3COOH分析:首先判断为C2化合物,但无助于选择,因为4个选项均是C2化合物,故关键是利用耗氧量进行选择.关于耗氧量的选择有两种解法求解.解法一用通式求解.由:得:A.C2H4~3O2 B.C2H5OH~3O2解法二用“氢二氧一可内消”原则求解.关于(B)、(C)、(D)三项,均是烃的含氧衍生物,不必用常规关系式C x H y O z~(x+C x H y(z可为0),即:(B)C2H5OH~C2H4(C)CH3CHO~C2H2(D)CH3COOH~C2答案:AB[例12] mg的饱和一元醇,在氧气中完全燃烧后,产生14.4g水和13.44L(标准状况下)二氧化碳气体.(1)试确定该醇的化学式.(2)m的值是多少?分析:根据mg饱和一元醇燃烧后产生的水和CO2的量可分别求得mg饱和一元醇中H 和C的物质的量,二者之比正好等于饱和一元醇通式CnH2n+2O中2n+2与n的比,于是可求得n值,从而就能确定其化学式.再根据化学式和其燃烧方程式及产生CO2或水的差,就能求出m的值.(1)设饱和一元醇的化学式为C n H2n+2O该饱和一元醇的化学式为C3H8O.60∶m=3∶0.6 m=12答案:(1)C3H8O(2)m=12实战演练1.常温常压下,等质量的以下各烃分别在足量的O2充分燃烧,消耗O2最多的是( );等物质的量的下列各烃分别在足量O2中充分燃烧,消耗O2最多的是( )A.甲烷B.乙烯C.丙炔D.2.1.01×105Pa,120℃时,某气态烃在密闭容器中与过量O2混和点燃,完全反应后,保持温度,压强不变,体积增大的是( )A.CH4B.C2H6C.C3H4D.C2H23.充分燃烧等物质的量的下列有机物,在相同条件下需要氧气最多的是( )A.C4H8O2B.C4H10C.C2H6O2D.C2H24.充分燃烧等质量的下列各组有机物,在相同条件下需O2的体积不完全相同的一组是( )A.乙炔、苯B.乙醇、甲醚(CH3-O-CH3)C.丙炔、异丙苯D.5.某有机物在氧气中完全燃烧时,其蒸气与消耗的氧气及生成的二氧化碳在同温同压下的体积比为1∶4∶3,该有机物不可能是( )A.C3H4B.C3H8O2C.C3H6OD.C3H6O26.一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,但称量滤液时,其质量只比原石灰水减少2.9g,则此有机物可能是( )A.乙烯B.乙二醇C.乙醇D.7.经测定C3H7OH和C6H12组成的混合物中氧的质量分数为8%,则此混合物中氢的质量分数是( )A.78%B.22%C.14%D.13%8.某有机物含C52.2%,含H13.0%;该有机物1g与足量金属钠反应,标况下生成0.243LH2,则该有机物的分子式为( )A.C2H6OB.C2H4O2C.CH4OD.C4H10O9.某烃含C元素为83%,则该烃的分子式为____________,若某烃的分子量为128,则分子式可能为____________或____________10.若A、B都是可燃物,当①A、B是两种分子量不等的无机物,相同条件下混合后总体积一定;②A、B是两种分子量相等的有机物,相同条件下混合后,总质量一定。
