国际乳腺癌会议CSCO BEST OF BCC 2021 新辅助治疗热点解读(全文)
【衡道丨干货】2021CSCO结直肠癌诊断指南共识
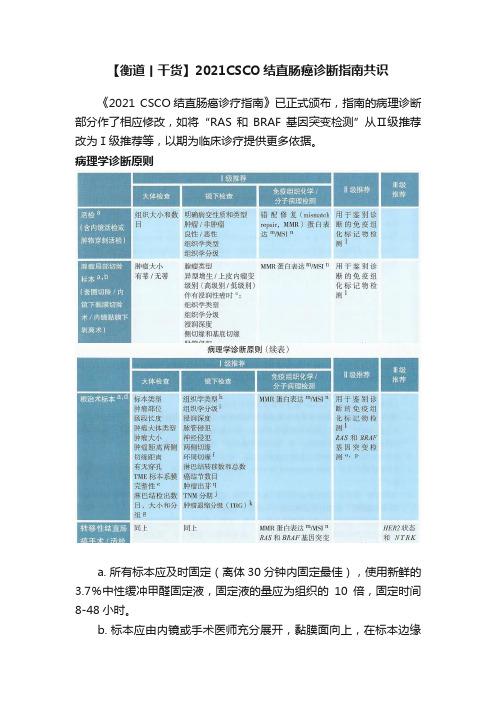
【衡道丨干货】2021CSCO结直肠癌诊断指南共识《2021 CSCO结直肠癌诊疗指南》已正式颁布,指南的病理诊断部分作了相应修改,如将“RAS和BRAF基因突变检测”从Ⅱ级推荐改为Ⅰ级推荐等,以期为临床诊疗提供更多依据。
病理学诊断原则a. 所有标本应及时固定(离体30分钟内固定最佳),使用新鲜的3.7%中性缓冲甲醛固定液,固定液的量应为组织的10倍,固定时间8-48小时。
b. 标本应由内镜或手术医师充分展开,黏膜面向上,在标本边缘用大头针固定于软木板或泡沫板上钉板固定。
应每隔2-3mm垂直于黏膜面切开全部取材。
c. “腺瘤伴浸润性癌”是指腺瘤含有穿透黏膜肌层浸润到黏膜下层的腺癌(pT1)。
“腺瘤伴高级别上皮内瘤变”包括了腺瘤伴重度异型增生、原位癌和黏膜内癌。
“高级别腺癌”、“肿瘤距离切缘小于1mm”、“脉管侵犯”和“高级别肿瘤出芽”为预后不良因素。
d. 根治术标本,通常沿肿瘤对侧剪开肠管后固定,建议钉板固定。
e. 全直肠系膜切除术(total mesorectal excision, TME)的直肠癌标本,系膜完整性评估标准见附表1。
f. “环周切缘”是指没有腹膜覆盖的肠壁“基底”切缘,建议手术医师在环周切缘处涂色或加以标识。
“环周切缘阳性”是指肿瘤距离切缘小于或等于1mm。
g. 淋巴结按淋巴引流方向进行取材并分组(肠旁、中间、中央),未经新辅助治疗的根治术标本,检出淋巴结总数原则上不少于12枚。
若第一次未找到12枚淋巴结,建议复检。
h. 结直肠癌组织学分型参考WHO消化系统肿瘤分类2019版,见附表2。
i. 组织学分级包括传统的4级分法和WHO分类的2级分法,基于腺体形成的程度,见附表3。
j. TNM病理分期(pTNM)采用AJCC/UICC第8版,pTNM前加前缀m、r和y分别代表多发性原发肿瘤、复发性肿瘤和治疗后肿瘤的TNM病理分期。
k. 肿瘤退缩分级(TRG)的病理学评估依据残留肿瘤成分以及纤维化程度进行分析。
Ⅰ-ⅢB期非小细胞肺癌肿瘤完全切除术后辅助治疗指南(2021全文版)

Ⅰ-ⅢB期非小细胞肺癌肿瘤完全切除术后辅助治疗指南(2021全文版)肺癌是我国最常见的恶性肿瘤之一,尤其是非小细胞肺癌(NSCLC)占据了85%以上。
然而,对于NSCLC患者的治疗和管理却存在诸多争议。
其中,肿瘤完全切除术后的分子检测指征和内容、辅助治疗的指征和方案选择,以及术后的随访管理等问题尤为突出。
此外,即使接受了术后辅助化疗,许多NSCLC患者仍然存在较高的复发和死亡风险。
因此,寻找更优化的治疗方案是非常必要的。
本指南的专家组由32名来自14个省、市、自治区的专家组成,他们分别来自胸外科、肿瘤科、呼吸科、放疗科和病理科。
专家组通过投票和讨论审议,针对83个辅助治疗临床实践中的关键问题进行了审议,并呈送更大范围的专家团审阅收集建议而形成指南推荐。
本指南旨在归纳总结Ⅰ-ⅢB期NSCLC患者肿瘤完全切除术后的诊断、分子检测、辅助治疗、术后管理等问题,以规范NSCLC患者的术后辅助治疗方法、降低患者复发率、延长患者生存时间和提高患者生活质量。
同时,本指南还充分吸收了全球最新的临床研究成果,并参考了国际指南和中国国情,以确保指南的科学性和实用性。
对于肺癌患者的治疗和管理,尤其是对于NSCLC患者的辅助治疗,本指南提供了新的优化治疗方案,如吉非替尼辅助治疗Ⅲ期研究和最新的奥希替尼辅助治疗Ⅲ期全球注册研究。
这些研究表明,对于可切除的表皮生长因子受体(EGFR)突变阳性NSCLC患者,表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)可显著降低其复发率。
因此,本指南建议在肿瘤完全切除后,应对患者进行EGFR突变检测,并根据检测结果选择合适的辅助治疗方案。
总之,本指南为NSCLC患者的术后辅助治疗提供了全面的指导和建议,有助于规范化治疗和管理,降低患者复发率、延长患者生存时间和提高患者生活质量。
对于早中期非小细胞肺癌(NSCLC)患者,外科手术是一种重要的局部治疗手段,包括解剖性肺叶切除术、复合肺叶切除术、全肺切除术等,同时还需要进行系统性淋巴结清扫或采样,以达到肿瘤完全切除的标准。
TP与EC-T新辅助化疗方案治疗三阴性乳腺癌的pCR率及不良反应比较

临床医学研究与实践2021年1月第6卷第2期临床医学乳腺癌是女性常见的恶性肿瘤之一,三阴性乳腺癌(TNBC)是三种乳腺肿瘤标志物[雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体-2(HER-2)]均为阴性的乳腺癌类型,内分泌治疗、分子靶向治疗对于TNBC患者效果不大,预后差且死亡率高,化疗是其主要的临床治疗方法。
新辅助化疗(NAC)可以起到缩小肿瘤、了解肿瘤对化疗药物的敏感度、遏制肿瘤细胞增殖的作用,使肿瘤患者降期甚至达到病理学完全缓解(pCR)。
pCR是术前NAC 有效评价手段,且术后患者是否达pCR对治疗具有重要意义,Lancet一项荟萃分析:pCR在某些特定亚群中具有预测远期生存的作用[1]。
相关文献证实,接受NAC的乳腺癌患者,若能达到pCR,则预示着较好的远期效果[2-3]。
部分研究结果显示,新辅助用药ddEC-wTCb在临床实践中耐受性较差,pCR与非铂治疗方案的历史pCR率相当,Cb 在TNBC患者NAC中的作用尚不清楚[4]。
因此,铂类在术前化疗中的地位仍待确定,目前已有少量研究显示铂类可以提高TNBC患者术前化疗的pCR率,但由于缺乏随机对照的Ⅲ期临床研究数据,目前并不能常规推荐含铂方案作为TNBC的优选方案。
本研究主要观察TP(卡铂联合紫杉醇)与EC-T(表柔比星+环磷酰胺序贯紫杉醇)两种NAC 方案治疗TNBC的pCR率及临床不良反应,报道如下。
1资料与方法1.1一般资料回顾性分析2018年1月至2020年5月在漯河市中心医院普外科及肿瘤内科行NAC的TNBC患者的临床资料及术后病理资料。
纳入标准:女性患者;经影像学检查证实无远处转移,并且存在可测量病灶,临床分期为Ⅱ~Ⅲ期,TP与EC-T新辅助化疗方案治疗三阴性乳腺癌的pCR率及不良反应比较何岩1,李红伟1,张磊1,范柳笛2(1.漯河市中心医院,河南漯河,462000;2.漯河医学高等专科学校,河南漯河,462000)摘要:目的比较TP(紫杉醇+卡铂)与EC-T(表柔比星+环磷酰胺序贯紫杉醇)新辅助化疗(NAC)方案治疗三阴性乳腺癌(TNBC)的病理学完全缓解(pCR)率及临床不良反应。
2021ASCO-GI即将来袭:精华在手,五大癌肿热点将先看!

3.雷莫芦单抗亚洲数据公布,为后续拿下国内胃癌⼆线适应症奠定坚实基础雷莫芦单抗是第⼀个、同时也是⽬前唯⼀以中国患者为主的晚期胃癌⼆线⼈群中经I I I期临床研究证实延长⽣存期获益的靶向药物,被纳⼊全球及亚洲胃癌治疗指南作为1类推荐。
R a m u c i r u m a b最新亚洲I I I期临床R A I N B O W-A s i a达到预设的研究终点,结果显⽰,R a m u c i r u m a b联合紫杉醇组患者中位⽆进展⽣存期(P F S)较安慰剂组显著延长(m P F S 4.14个⽉v s 3.15个⽉;p=0.0184),并显⽰出与全球关键注册临床试验R A I N B O W⼀致的中位总⽣存期(O S)获益(H R=0.963)。
患者整体耐受性良好。
除了单药,雷莫芦单抗联合伊⽴替康作为⼆线治疗的I I期临床试验结果,显⽰中位P F S和O S为4.2和9.6个⽉,D C R为85%,虽然没有达到主要终点,但该研究纳⼊了更多⽼年患者,所以结果依旧是令⼈⿎舞。
4.v a r l i t i n i b联合每周紫杉醇⼆线治疗E G F R/H E R2共表达晚期胃癌患者初显疗效V a r l i t i n i b(A S L A N001)是⼀种⾼效、⼝服、可逆的泛H E R⼩分⼦抑制剂,其作⽤对象是⼈表⽪⽣长因⼦受体H E R 1、H E R2和H E R4。
在美国,V a r l i t i n i b被授予治疗胃癌和肝外胆管癌(⼀种亚型胆管癌)的孤⼉药物称号。
之前报道过v a r l i t i n i b联合化疗⼀线治疗晚期胃癌的临床研究失败,此次v a r l i t i n i b联合每周紫杉醇治疗9例患者,其中4例患者为S D,结论:V a r l i t i n i b300m g b i d+紫杉醇每周80m g具有可管理的安全性,⽬前,⼆期试验正在进⾏中。
5.D S-8201冲击胃癌⼀线,正在开展临床试验,期待中D S-8201a由阿斯利康和第⼀三共合作开发的靶向HE R2的抗体偶联(A D C)药物。
2021年新辅助治疗与转化治疗—探索适合中国胃癌患者的围手术期治疗模式(全文)

2021年新辅助治疗与转化治疗—探索适合中国胃癌患者的围手术期治疗模式(全文)我国胃癌发病率高,进展期及晚期患者比例大,围手术期治疗方案的选择始终是临床中的难点问题。
新辅助治疗可使肿瘤降期、肿瘤体积缩小、肿瘤活性降低以利于手术切除,提高手术R0切除率和病理完全缓解(pathologic complete response,pCR)率,同时化疗还可消灭其他部位的潜在微小转移灶,从而提高局部控制率和总生存率。
进展期胃癌围手术期化疗在美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)以及中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)指南均作为常规推荐,但其中新辅助化疗和转化治疗作为近年来的热点及极易混淆的概念,两者从治疗模式上相似,但前者的目的是通过肿瘤降期使初始可切除患者达到提高手术根治性的目的, 而后者则是在晚期病例中努力争取手术切除的机会。
本文将对两者进行回顾总结,探索适合中国胃癌患者的围手术期治疗模式。
一、新辅助治疗MAGIC及FNCLCC/FFCD研究通过比较Ⅱ/Ⅲ期胃癌围手术期化疗与单纯手术在生存方面的疗效,从而建立了新辅助化疗治疗胃食管腺癌的标准模式,也为胃癌围术期治疗开辟了新篇章。
MAGIC结果表明,与单纯手术相比,ECF(表柔比星、顺铂和氟尿嘧啶)方案围手术期化疗可带来生存获益;FNCLCC/FFCD则明确了顺铂+氟尿嘧啶在胃癌新辅助化疗中的意义。
基于上述两个大型随机对照实验的研究成果,NCCN胃癌治疗指南将新辅助术前化疗推荐为进展期胃癌的常规方案(Ⅰ类证据)。
但针对新辅助化疗的获益人群、最佳方案以及治疗周期等问题仍存在诸多争议,重要的相关临床研究结果正陆续揭晓。
2018年的FLOT4研究是近年来胃癌围手术期治疗的重要研究之一。
2021版CSCO乳腺癌指南:HER2+早期乳腺癌新辅助治疗更新要点解读(全文)

2021版CSCO乳腺癌指南:HER2+早期乳腺癌新辅助治疗更新要点解读(全文)2021版CSCO乳腺癌指南关于HER2+早期乳腺癌术前新辅助治疗的更新聚焦于三方面:新辅助治疗适应证、新辅助治疗Ⅰ级推荐、新辅助治疗后辅助治疗选择。
新辅助治疗适应证:将临床分期与分子分型相结合作为依据2021版CSCO指南仍然强调,术前新辅助治疗的适应证应结合肿瘤分子分型、临床分期及患者意愿个体化确定。
这一理念也是CSCO于2018年率先在国内提出的,即对于HER2+乳腺癌的患者,若肿瘤≥2 cm(T>2)或有淋巴结转移(N≥1),推荐给予新辅助治疗。
图1 2021版CSCO指南关于术前新辅助治疗的适应证对于美国国家综合癌症网络(NCCN)指南,2018版仍然仅依据临床分期确定新辅助治疗适应证;2020版和2021版则指出,对于HER2+、三阴性乳腺癌,若T≥2或N≥1,推荐给予新辅助治疗。
可见,CSCO指南提出的分子分型与临床分期相结合的理念比NCCN指南早了2年。
图2 2018版和2020版NCCN指南推荐然而,2021版美国临床肿瘤学会(ASCO)指南指出,对于T1a和T1b的患者,不应常规给予新辅助治疗。
这意味着T1c的患者可予新辅助治疗。
鉴于“对T1c患者予新辅助治疗”这一理念尚未经过临床研究和实践验证,CSCO乳腺癌指南仍采用目前认为的最先进、最可行选择标准,即对于HER2+、T≥2或N≥1的患者给予新辅助治疗。
图3 2021版CSCO指南推荐新辅助治疗Ⅰ级推荐:TCbHP和THP2021版CSCO乳腺癌指南指出,对于HER2+乳腺癌新辅助治疗策略,TCbHP和THP为Ⅰ级推荐,而大家常用的AC-THP为Ⅱ级推荐;对于HER2+乳腺癌辅助治疗,Ⅰ级推荐AC-THP和TCbHP(T:紫杉类;A:蒽环类;C:环磷酰胺;Cb:卡铂:H:曲妥珠单抗;P:帕妥珠单抗)。
图4 2021版CSCO乳腺癌指南推荐对于NCCN指南,2020版对HER2+乳腺癌新辅助/辅助治疗方案推荐了8种方案;然而,2021版更加强调去蒽环化,推荐首选TCHP,而次选AC-THP,但仍是对新辅助和辅助治疗给予统一推荐。
乳腺癌的最新治疗方案

乳腺癌的最新治疗方案乳腺癌是一种常见的恶性肿瘤,每年都有大量的患者被诊断出患病。
在过去,乳腺癌的治疗主要是通过手术切除和放疗来进行,同时辅以化疗和内分泌治疗。
但是,随着医疗科技的不断进步,乳腺癌的治疗方案也在不断地更新。
本文将介绍乳腺癌的最新治疗方案及其优势。
一、靶向治疗靶向治疗是指通过作用于患者肿瘤细胞上的特定分子,以达到抑制肿瘤细胞生长和扩散的治疗方式。
在过去,乳腺癌的治疗主要通过化疗或内分泌治疗来进行。
但是,这些治疗方法并不能精准地针对肿瘤细胞,同时也对正常细胞造成了一定的影响。
而靶向治疗则能够更准确地作用于肿瘤细胞上的特定分子,从而对肿瘤细胞具有极强的杀伤作用。
目前,乳腺癌的靶向治疗主要有HER2、PD-L1、CDK4/6 抑制剂等。
HER2 靶向治疗是指通过作用于 HER2 受体的抗体或抑制剂,抑制肿瘤细胞增殖的治疗方式。
HER2 受体是一种常见的癌症相关受体,其在大部分乳腺癌病人中都会高表达,因此 HER2 靶向治疗对乳腺癌的治疗非常有效。
目前 HER2 靶向治疗的药物主要包括赫赛汀、帕鲁曲单抗、拉普利尼布等。
PD-L1 靶向治疗是最新的癌症治疗方式之一。
PD-L1 受体的高表达与肿瘤细胞的逃避免疫监视有关,因此通过针对 PD-L1 受体的抑制剂,可以增强机体免疫功能,加强肿瘤杀伤作用。
目前PD-L1 靶向治疗的药物主要包括宣布利单抗、阿特珠单抗等。
CDK4/6 抑制剂是最近几年发展起来的一种治疗方式。
CDK4/6 是细胞周期调控的重要分子,在癌症细胞中常常异常活跃。
CDK4/6 抑制剂通过抑制 CDK4/6 分子的活动,可以抑制肿瘤细胞增殖并促进其凋亡。
目前 CDK4/6 抑制剂的药物主要包括帕博利珠单抗、利塞平等。
二、超声刀治疗超声刀是一种利用高频声波产生热量杀死肿瘤细胞的设备。
在乳腺癌治疗中,超声刀的应用得到了越来越广泛的关注。
与传统的手术切除相比,超声刀治疗具有许多优势。
首先,超声刀可以更加精准地作用于肿瘤部位,从而减少手术创伤和术后疼痛。
乳腺癌新药进展及疗法

最新乳腺癌新药进展及最新疗法乳腺癌发病率居所有女性恶性肿瘤首位,根据世界卫生组织国际癌症研究机构(简称IARe)发布的《2020年全球最新癌症负担》数据,全球乳腺癌新增人数达226万,已超越肺癌成为"全球第一大癌症"。
据《202 0中国肿瘤登记年报》数据显示,我国2020年乳腺癌新发病例41.6万例, 占全球乳腺癌新增人数的18.4% ,乳腺癌防治工作仍面临巨大挑战。
《2020年全球最新癌症负担》目前,我国乳腺癌的主要治疗方式有手术治疗、化学药物治疗、放射线治疗、内分泌治疗、靶向治疗等,而新药的研发与上市对于提高乳腺癌患者生存期,改变乳腺癌治疗格局具有深远意义。
下面请让我们一起来盘点2021年度乳腺癌药品新进展:阿贝西利(AbemaCiClib)——对抗激素受体阳性乳腺癌的抗癌新星激素受体阳性(HR+浮L腺癌患者约占总人数的70%~80% ,因HR+ 患者群体肿瘤生长最慢、复发转移率最低,内分泌治疗是其主流的治疗方式。
在内分泌治疗联合分子靶向治疗开展背景下,CDK4/6抑制剂便是其中一个重头戏。
因为在细胞周期发展中,细胞周期蛋白(CyClin)和细胞周期蛋白依赖性激酶(CDK)4/6被鉴定为细胞生长和分裂的关键调节因子。
当CDK4/6过度表达时,细胞将会出现失控增殖。
CDK4/6是雌激素受体(ER)等多条信号通路的共同下游靶点,在激素受体(ER)阳性乳腺癌中,ER -CyClin-CDK4/6信号通路活跃增加,因此细胞便出现异常生长。
如果抑制CDK4/6激酶的活性,就能通过信号通路的下游来抑制细胞增殖。
当CDK4/6抑制剂和内分泌治疗联合应用于激素受体阳性乳腺癌治疗上,就相当于双重抑制信号通路,效果更佳。
阿贝西利(AbemaCiClib)作为年初刚在国内上市流通的CDK4/6抑制剂,由礼来公司开发,通过MONARCH系列临床验证,为无数乳腺癌患者带来更优的生存质量,改变了乳腺癌的治疗格局。
2023非小细胞肺癌新辅助免疫化疗专家共识

2023非小细胞肺癌新辅助免疫化疗专家共识近年来,新辅助治疗和免疫治疗在改善NSCLC患者的治疗和预后方面表现出巨大潜力,比如:免疫治疗能改善患者长期生存、有早期潜在益处等,新辅助治疗能降低肿瘤分期、提高切除率和更及时地处理微转移等优势。
为顺应三阳\细胞肺癌治疗的发展趋势,国内外胸外科专家共同制定了非小细胞肺癌新辅助免疫治疗专家共识。
旨在通过增加临床医生对新辅助免疫治疗在NSCLC 治疗中应用的全面认识,促进临床实践的进步。
共识1:可切除的IB-IIIA期NSCLC患者可考虑术前使用新辅助免疫治疗联合含粕双药化疗或新辅助单药免疫治疗1 .疗效相当:前瞻性随机对照试验(包括Rosell和Roth的影响较大的研究)表明,对于早期NSCLC,新辅助化疗(NCT)+手术与手术+术后辅助化疗同样有效。
这些发现表明,包括新辅助治疗在内的全身性治疗策略在总生存期方面优于单纯手术。
2 .临床试验结果:CheCkMate-159、TOP1501和LCMC3等11期临床试验为新辅助免疫治疗可切除的IB-InA期NSCLC的安全性、可行性和疗效提供了证据。
这些评估新辅助单药治疗或联合治疗的试验报告了积极结局,如MPR x PCR和肿瘤降期,进一步支持新辅助免疫治疗的潜在益处。
3 .耐受性良好:与常规化疗相比,使用免疫检查点抑制剂QQS)的免疫治疗患者的耐受性通常较好,且可能阻碍手术切除的治疗相关毒性较少。
免疫治疗耐受性的改善使患者能够在不损害全身治疗潜在益处的情况下接受完全手术切除。
4 .临床前研究:使用动物模型进行的临床前研究表明,与辅助免疫治疗相比,新辅助免疫治疗可能提供更大的生存获益,支持了在术前启动免疫治疗可能改善远期结局的假设。
5 .正在进行的III期临床试验:目前正在进行几项大规模III期临床试验,如CheckMate-816x KEYNOTE-671s IMpower-030x AEGEAN和CheckMate-77T探索了新辅助免疫治疗联合粕类化疗。
乳腺癌化放疗精准治疗指南

乳腺癌化放疗精准治疗指南乳腺癌化放疗精准治疗指南中日友好医院精准医学中心首都医科大学附属北京妇产医院精准医学中心2021年3月8日本指南,结合《NCCN 2021乳腺癌治疗指南》、PharmGKB及其他资料制定。
综合考虑了如何精准地增加辅助内分泌治疗、辅助化疗和辅助放疗的疗效,及如何尽量避免和干预治疗中的毒副作用。
乳腺癌精准治疗基因检测内容,分为:辅助内分泌治疗基因检测组套、辅助化疗基因检测、辅助放疗基因组套。
在实际应用中,尚可从这些组套中,选测拟用药物对应的基因,以降低患者费用负担。
一、乳腺癌辅助内分泌治疗,基因检测组套:6、8、10、33、243、244、245 药物基因 06CYP2D6(2850C>T) 基因中文名细胞色素氧化酶2D6 细胞色素氧化酶2D6 编码 6 8 10 乳腺癌,AA基因型的患者,代谢药物活性只有GG型的15%,药物易蓄积,代33 谢活性成分4-OH-他莫西芬的活性下降,患者总体生存率较GG型高。
GA基因型也比GG型高。
GG 基因型者总体生存率最低。
244 245 243 绝经后乳腺癌患者,使用来曲唑和阿那曲唑时,出现疼痛(including joint pain, muscle pain, bone pain, arthritis, diminished joint function, or other musculoskeletal problems),244位点的CC和245位点的AA为风险基因型。
当244/245为(TT/AA, CT/AA, CC/GG, CC/AG and CC/AA)时,OR为3.151 ER或PR阳性的乳腺癌患者,243的T碱基者、242的T碱基者,,使用芳香化乳腺癌,PM者,抗雌激素效果最差,预后差;IM者,抗雌激素效果较差,预后也较差。
EM者,抗雌激素效果好,预后好。
临床意义他莫昔芬 08CYP2D6(100C>T) 10CYP2D6(1758G>A) 细胞色素氧化酶2D6 33SULT1A1(638G>A) 磺基转移酶1A1的638位点,代谢酶244ESR1(454-397T > 阿那曲唑、来曲唑 C) 245ESR1(453-351A > G) 阿那曲唑243MAP4K4 (T>C) 雌激素受体基因雌激素受体基因有丝分裂原激活蛋白依西美坦激酶4 酶抑制剂阿那曲唑或依西美坦,骨质疏松和骨折风险增加。
乳腺癌治疗:NSABP临床试验成果

乳腺癌治疗:NSABP临床试验成果让我们了解一些背景信息。
乳腺癌是全球女性最常见的恶性肿瘤,严重威胁着女性的健康。
过去几十年里,随着医疗技术的不断发展,乳腺癌的治疗方法也得到了极大的改进。
而NSABP(NationalSurgical Adjuvant Breast and Bowel Project)临床试验是一项全球领先的乳腺癌研究项目,旨在评估和优化乳腺癌的治疗策略。
在NSABP临床试验中,研究者们对乳腺癌的治疗方法进行了广泛的研究,包括手术、化疗、放疗、内分泌治疗和靶向治疗等。
这些研究为乳腺癌的治疗提供了宝贵的依据。
其中一个重要的研究结果是关于乳腺癌手术的选择。
在NSABP B06试验中,研究者们比较了保乳手术与全乳切除手术的疗效。
结果显示,两种手术方式的生存率并无显著差异。
这一发现使得保乳手术成为了乳腺癌治疗的一种重要选择,有助于提高患者的生活质量。
NSABP临床试验还研究了化疗在乳腺癌治疗中的作用。
在NSABPB14试验中,研究者们评估了化疗在早期乳腺癌治疗中的价值。
结果显示,对于淋巴结阳性的患者,化疗可以显著提高生存率。
这一发现使得化疗成为了淋巴结阳性乳腺癌患者治疗的标准方案。
放疗在乳腺癌治疗中也扮演着重要角色。
在NSABP B04试验中,研究者们比较了放疗与不放疗的疗效。
结果显示,放疗可以显著降低局部复发风险,提高生存率。
因此,放疗已成为乳腺癌治疗的重要组成部分。
除了传统治疗方法,NSABP临床试验还关注了靶向治疗在乳腺癌治疗中的应用。
在NSABP B31试验中,研究者们评估了靶向治疗药物曲妥珠单抗(Herceptin)的疗效。
结果显示,对于HER2阳性的患者,曲妥珠单抗可以显著提高生存率。
这一发现使得曲妥珠单抗成为了HER2阳性乳腺癌患者的标准治疗药物。
NSABP临床试验还研究了内分泌治疗在乳腺癌治疗中的作用。
在NSABP B20试验中,研究者们评估了内分泌治疗药物三苯氧胺(Tamoxifen)的疗效。
2021 CSCO:转移性胃癌治疗指南更新解读(全文)

2021 CSCO:转移性胃癌治疗指南更新解读(全文)更新要点一:指南框架的更新相较于2020版,新版《CSCO胃癌诊疗指南》进一步将晚期转移性胃癌的治疗细分为转移性胃癌的治疗与支持治疗两部分,前者新增了胃癌腹膜转移的综合治疗,后者包括了在胃癌治疗中不可忽视的营养治疗与常见并发症处理。
更新要点二:免疫治疗在HER2阴性胃癌的一线治疗推荐具体内容:对于HER2阴性胃癌的一线治疗,Ⅰ级推荐新增:“PD-L1 CPS≥5人群可采用化疗(FOLFOX/XELOX)联合纳武利尤单抗(1A 类证据)”;Ⅲ级推荐新增:“PD-L1 CPS≥1人群可采用帕博利珠单抗单药(1B类证据)”。
更新依据:CheckMate 649研究建立了免疫检查点抑制剂用于PD-L1 CPS≥5、HER2阴性转移性胃癌的一线治疗新标准。
该研究评估了纳武利尤单抗+化疗对比化疗用于HER2阴性转移性胃癌一线治疗的疗效和安全性。
初步分析结果显示,在CPS≥5的人群中,纳武利尤单抗+化疗与化疗相比能显著降低死亡风险(29%),中位总生存期(OS)达到14.4个月,较化疗组延长3.3个月。
次要研究终点分析显示,在CPS≥1和意向性治疗(ITT)人群中,纳武利尤单抗+化疗对比化疗均观察到显著的无进展生存期(PFS)获益,获益随CPS评分提高而增加。
此外,2021 AACR公布的CheckMate 649研究中国人群的数据显示,在PD-L1 CPS≥5、CPS≥1及意向性治疗(ITT)人群中,纳武利尤单抗联合化疗的OS、PFS和客观缓解率(ORR)均显著优于化疗。
总人群中纳武利尤单抗+化疗组的中位OS为14.3个月,中位PFS 为8.3个月,ORR为59%。
此外,ATTRACTION-4研究旨在评估纳武利尤单抗+化疗对比化疗用于不可切除或复发性胃/胃食管结合部腺癌一线治疗的疗效。
中期分析显示,纳武利尤单抗+化疗组和化疗组的中位PFS分别为10.45个月和8.34个月(HR=0.68,P=0.0007);两组的中位OS结果类似。
AC方案与FAC方案新辅助化疗对乳腺癌的应用价值分析

AC方案与FAC方案新辅助化疗对乳腺癌的应用价值分析随着医学技术的不断进步,乳腺癌的诊断和治疗方法也在不断地更新和完善。
辅助化疗作为乳腺癌治疗的一种重要手段,对于提高患者的生存率和生活质量起着重要作用。
AC方案与FAC方案作为目前常用的乳腺癌辅助化疗方案,在临床实践中得到了广泛的应用。
本文将从AC方案与FAC方案新辅助化疗对乳腺癌的应用价值进行分析,为临床医生和患者提供参考。
一、AC方案与FAC方案的治疗原理AC方案是指环磷酰胺(Cyclophosphamide)和阿霉素(Adriamycin)的联合应用,而FAC方案是指5-氟尿嘧啶(5-FU)、阿霉素和环磷酰胺的联合应用。
这两种方案都是经典的乳腺癌辅助化疗方案,其治疗原理主要是通过化疗药物抑制和杀死癌细胞,阻止癌细胞的生长和扩散,从而达到治疗的目的。
1. 高效性:AC方案与FAC方案能够有效地杀灭癌细胞,使肿瘤缩小甚至消失,从而为手术切除提供条件。
2. 综合疗效好:AC方案与FAC方案的联合应用,能够在不同程度上杀死癌细胞,减少调理癌细胞的机会,提高治疗的综合效果。
3. 治疗路径短:AC方案与FAC方案能够在短时间内达到治疗效果,缩短治疗路径,减少对患者的伤害。
4. 术前化疗:AC方案与FAC方案可以作为术前化疗方案,可以缩小肿瘤体积,减少手术难度,提高手术成功率。
5. 减轻患者痛苦:AC方案与FAC方案的联合应用可以减轻乳腺癌患者的痛苦,提高生活质量。
1. 提高手术切除率:AC方案与FAC方案能够在短时间内缩小肿瘤体积,提高手术切除率,降低术后复发率。
2. 延长生存期:AC方案与FAC方案的联合应用能够有效地清除残留的癌细胞,降低癌症的复发率,延长患者的生存期。
4. 降低治疗成本:AC方案与FAC方案的联合应用可以缩短治疗时间,减少化疗费用,降低患者的经济负担。
5. 提高患者的心理状态:AC方案与FAC方案的联合应用可以改善患者的心理状态,增强患者的抗病能力,提高治疗的成功率。
中国乳腺癌新辅助治疗专家共识解读PPT课件

THANK YOU
感谢聆听
本次专家共识的发布,将为乳 腺癌新辅助治疗提供规范化的 指导,有助于提高治疗效果和 患者生活质量,推动我国乳腺 癌治疗水平的进一步提升。
对参与制定工作的各位专家表示感谢
感谢参与本次专家共识制定的各位专家,他们的学术造诣和临床经验为共 识的制定提供了有力支持。
感谢各位专家在繁忙的工作中抽出宝贵时间,对共识意见进行认真评审和 修改,为共识的完善和质量提升做出了重要贡献。
乳腺癌治疗面临挑战
尽管乳腺癌治疗手段不断进步,但仍面临复发、转移等挑战,如 何提高治疗效果和患者生活质量是亟待解决的问题。
新辅助治疗意义与重要性
提高治疗效果
新辅助治疗在乳腺癌治疗中具有重要 意义,通过术前治疗缩小肿瘤、降低 肿瘤分期,从而提高手术成功率和患 者生存率。
个体化治疗
新辅助治疗可实现个体化治疗,根据 不同患者的病理生理特征制定针对性 治疗方案,提高治疗效果和患者生活 质量。
专家共识制定背景与目的
规范化治疗
针对乳腺癌新辅助治疗领域存在的争议和困惑,制定专家共识旨在规范治疗流 程,提高治疗效果和患者生存率。
指导临床实践
专家共识结合最新临床研究成果和实践经验,为临床医生提供科学、实用的治 疗建议,指导临床实践。
02
乳腺癌新辅助治疗概述
新辅助治疗定义及发展历程
定义
新辅助治疗是指在乳腺癌患者接受手术或放疗等局部治疗之前,先给予系统性的全身治疗,旨在缩小肿瘤、降低 肿瘤分期、提高手术成功率和改善患者预后。
80%
加速新药研发与应用
专家共识对新辅助治疗药物的研 发和应用提出了更高要求,将推 动相关药物的加速上市和广泛应 用。
乳腺癌新辅助化疗疗效病理评估指标

乳腺癌新辅助化疗疗效病理评估指标引言:乳腺癌是女性常见的恶性肿瘤之一,治疗方法多种多样,其中新辅助化疗是治疗乳腺癌的一种常用方式。
疗效评估是治疗乳腺癌过程中的重要环节,病理评估指标是新辅助化疗后疗效评估的重要依据之一。
在本文中,我们将重点探讨乳腺癌新辅助化疗疗效病理评估指标。
一、肿瘤大小病理评估中,乳腺癌肿瘤大小是一项重要的指标。
通常情况下,乳腺癌新辅助化疗后,肿瘤大小会缩小。
肿瘤大小的减小程度可直接反映出治疗效果的好坏。
此外,大部分临床医生在添加新辅助化疗治疗后, 还会根据肿瘤大小的变化来决定是否需要手术等进一步治疗措施。
二、病理完全缓解(pCR)乳腺癌新辅助化疗的最终目的是实现病理完全缓解,也就是通过化疗使肿瘤完全消失。
病理缓解的判定标准是病理标本中没有任何的癌细胞存在。
实现病理完全缓解会极大地提高患者预后,同时也是评估新辅助化疗疗效的最佳指标之一。
三、Ki-67 指数Ki-67 指数是新辅助化疗后疗效评估的另一重要指标。
Ki-67 表达量是癌细胞增生指标之一,通常情况下,Ki-67表达量越高,癌细胞增殖能力越强。
在乳腺癌治疗中,一些研究表明,Ki-67 指数越低,乳腺癌患者长期效果越好。
四、HER2 指数HER2 指数是乳腺癌疗效评估的又一指标。
HER2 是一种引起癌细胞增殖的蛋白质,通常来说,HER2表达量越高,乳腺癌的预后越差。
在新辅助化疗后的疗效评估中,HER2 指数也成为重要的评估因素之一。
结论:病理评估指标是乳腺癌治疗中非常重要的一环,新辅助化疗后的病理评估指标直接影响到患者的预后。
本文主要探讨了乳腺癌新辅助化疗后的病理评估指标,具体包括肿瘤大小、病理完全缓解、Ki-67 指数和HER2 指数。
对于乳腺癌治疗中的临床医生而言,掌握这些病理评估指标,可以更准确地评估疗效,提高治疗效果,降低患者风险,是非常有必要的。
乳腺癌新辅助化疗的共识与争议

乳腺癌新辅助化疗的共识与争议背景乳腺癌是一种常见的女性恶性肿瘤,其发生率不断增加。
新辅助化疗是指在手术之前,通过化疗药物控制肿瘤的大小,以便更好的进行手术治疗。
新辅助化疗能够有效控制肿瘤的大小,使得手术更加容易进行,并且能够评估治疗的效果。
共识1.新辅助化疗可以减少手术难度。
通过使用新辅助化疗,可以有效地控制肿瘤的大小,使得手术更加容易进行。
这有助于减轻手术的难度,降低手术风险,减少切口大小,减少切除面积,减少心理压力等。
一些较大的肿瘤或者较小的乳房,经常需要进行切除或者切下,这可能会给患者带来外部美观上的影响和身体上的不适。
使用新辅助化疗来缩小肿瘤大小,可以减轻这些影响,并且保留适当的组织和器官,缩小女性乳房和乳腺的患病率。
2.女性乳腺癌疾病的性质决定了新辅助化疗的必要性。
新辅助化疗是针对乳腺癌这样一种高度恶性的肿瘤,推动化疗药物渗透到肿瘤细胞内部,破坏肿瘤内部的结构和功能,从而达到控制肿瘤大小和治疗乳腺癌的目的。
根据乳腺癌疾病的性质,病人可能会因各种原因而忽略实体瘤,也可能会在发现肿瘤后迅速增长而无法进行操作而患癌。
如果采取新辅助化疗的手段,可以很好地控制肿瘤大小,预防手术时的一些不可预测的危险。
3.新辅助化疗的副作用可以通过合理的药物方案得到控制。
新辅助化疗的副作用包括恶心、呕吐、脱发、血小板的减少以及感染的风险等。
但是通过合理的药物方案,可以将副作用降到最低限度。
现在的治疗药物逐渐趋于高效、低毒性,患者的耐药性上升,药物选择也变得越来越多样化。
因此,新辅助化疗的副作用并没有成为一个绝对的难点,并且可以通过合理的药物方案得到控制。
争议1.新辅助化疗的效果还有一定的不确定性。
虽然新辅助化疗可以有效控制肿瘤的大小,但是其效果的确切程度还有一定的不确定性。
在一些情况下,一些药物可能会失去作用,导致肿瘤在化疗结束后重新生长。
此外,有些患者对化疗药物会出现耐药性,使得化疗的效果减弱。
2.新辅助化疗会增加治疗的时间和费用。
新辅助化疗和pcr讲解学习

Sikov WM, et al. J Clin Oncol. 2015 Jan 1;33(1):13-21.
在标准方案中加入卡铂或贝伐珠单抗 均可显著提高TNBC患者乳腺病理完全缓解率
46%(40~53%) 60%(54~66%)
P=0.0018
48%(41~54%) 59%(52~65%)
L+H
n = 152
ypT0/isypN0*
60
p = 0.0007
50
40
p = 0.13
30
46.8
20 27.6
10 20.0
0 L
n = 150
H
n = 145
L+H
n = 145
*排除15例淋巴结无法评估的患者 L=拉帕替尼; H= 曲妥珠单抗
Baselga J, et al. Lancet 2012; 6736(11):61847-61853.
73%
75%
相比于NeoShpere,拉帕替尼联合曲妥珠单抗的双靶向治疗(NeoALTTO 研究) 也达到了很大的pCR提高(46.8% vs 27.6%),但是最终 EFS/OS未有显著性差异,因此拉帕替尼未能获得新辅助适应症
Gianni L, Pienkowski T, Im Y-H, et al. 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): a multicentre, open-label, phase 2 randomised trial [published online ahead of print May 11, 2016]. Lancet Oncol. doi: 10.1016/S1470-2045(16)00163-7.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国际乳腺癌会议CSCO BEST OF BCC 2021 新辅助治疗
热点解读(全文)
新辅助治疗是乳腺癌综合治疗的重要组成部分。
在第17届St. Gallen 国际乳腺癌会议(SG-BCC 2021)中,新辅助治疗成为了又一热点话题。
新辅助治疗理念的升级
新辅助治疗可靶向全身,也可靶向局部。
就靶向局部而言,新辅助治疗可降期手术、降期保乳,对于局控较好的患者,如N0-N1级的患者可保腋窝。
从获得体内药敏信息的角度,研究者可通过新辅助治疗进行早期疗效检测及策略调整,依据新辅助疗效决策辅助治疗。
此外,新辅助治疗还可以为患者基因检测提供时间,并为药物研发提供平台。
第一阶段:新辅助治疗人群选择
新辅助治疗的实施主要分为三个阶段以及两个节点。
在第一阶段时,研究者应当思考哪类患者应进行新辅助治疗。
对于“所有需要辅助治疗的患者是否都需要新辅助治疗?”这一问题,St Gallen大会共识投票中60%专家持反对态度,这可能是出于对部分患者过度治疗的担忧,如低危的HER-2阳性小肿瘤患者。
在APT研究中,紫杉醇联合曲妥珠单抗方案可达到93.3%的7年无病生存期(DFS)。
T1c及以下分期的患者占总入组患者的90%以上,T2患者比例不足10%。
因此,很多专家对于美国临床肿瘤学会(ASCO)指南推荐T1c及以上HER-2阳性乳腺癌患者接受新辅助治疗的更新持保留态度。
ASCO指南中的该项推荐是基于众多纳入了T1c患者的临床试验,但从临床实践角度,方案选择及疗效评估的实操性均不强。
因此,徐教授认为,HER-2阳性乳腺癌(cT≥2或cN≥1)患者是新辅助治疗的优选人群。
在对于早期乳腺癌进行新辅助人群选择时,研究者应当考虑以下问题:(1)对于患者而言,新辅助治疗是临床试验还是临床实践?(2)新辅助治疗是否可以改变患者局部或全身治疗策略?从临床实际角度出发,以治疗目的为导向,才是临床实践选择新辅助治疗人群的依据。
第二阶段:临床实施
在临床实施阶段,研究者应当思考何种方案是新辅助治疗的标准方案。
虽然新辅助治疗的病理学完全缓解(pCR)率令人鼓舞,但大多数专
家认为,新辅助治疗“标准”方案的确定应基于长期无病生存率(EFS)或总生存期(OS)终点。
具有生存证据的辅助治疗方案一定是标准的新辅助治疗方案,但“标准”不代表“优秀”。
因此,徐教授表示,期待能够提高pCR并改善生存的更优方案出现。
可提高pCR,不损害患者生存的方案是否可以作为新辅助治疗的方案?徐教授认为,从局部将期以保证腋窝降期的处理角度而言,提高pCR的方案是有价值的。
对于不同分子亚型,新辅助治疗的意义也不尽相同。
三阴性乳腺癌(TNBC)患者是一类异质性强、预后较差且缺乏驱动基因的患者群体。
因此,研究者正在思考,如何利用新辅助平台拓展以紫杉醇+蒽环为基础的化疗方案。
对于“紫杉醇+蒽环+铂类”是否可以作为常规推荐这一问题,St Gallen大会共识投票中60%专家持反对态度。
这是因为在既往针对紫杉醇+蒽环+铂类方案的临床研究中,仅Geparsict研究表明该方案提高了DFS,其余研究仅显示出pCR的提高,因此该方案不应当成为标准治疗。
但中国的指南及共识表示,年轻TNBC患者,尤其是具有BRCA基因突变患者的新辅助化疗可优选紫杉醇类药物联合铂类药物(TP)方案。
随着IMpassion031研究结果的公布,很多人对于免疫疗法寄予了厚望。
但对于免疫检查点抑制剂(ICI)是否加入TNBC患者新辅助治疗这一问题,大部分专家持反对态度。
这是由于ICI在新辅助治疗研究中的结果不一致,且未发现程序性死亡配体-1(PD-L1)是免疫检查点抑制剂的有效生物标志物。
因此,研究者应当思考新辅助免疫治疗的优势人群及其最佳配伍方案。
对于HER-2阳性乳腺癌患者的新辅助治疗,研究者应当思考如何优化治疗方案。
以蒽环取舍为例,对于淋巴结阳性患者,海外专家倾向于新辅助治疗中加入蒽环类药物;而对于淋巴结阴性患者,海外专家大多认为没有必要在新辅助治疗中加入蒽环类药物。
图1. HER-2阳性乳腺癌患者的新辅助治疗专家投票结果
在《NCCN侵袭性乳腺癌指南2021版》中,蒽环类药物不再是HER-2阳性乳腺癌辅助和新辅助治疗的一类推荐。
这是否意味着蒽环类药物
全豁免时代的来临?徐教授持不赞同的观点,并表示:“对于低危或敏感型患者,我们应当思考双靶联合或不联合化疗的降阶处理;对于偏高危患者,我们应当思考蒽环药物联合“紫杉类+曲妥珠单抗+帕妥珠单抗”方案(THP)或“紫杉类+卡铂+曲妥珠单抗+帕妥珠单抗”方案(TCbHP);对于高危HER-2阳性乳腺癌患者新辅助治疗的蒽环类药物取舍仍存争议。
”
对于低危或敏感型患者,研究者应当思考双靶或双靶+单化疗的方案;对于三阳性乳腺癌患者,研究者应当思考双靶+内分泌治疗的方案。
此外,研究者认为新辅助内分泌治疗在ER阳性以及HER-2阴性乳腺癌中的重要性增加。
众所周知,内分泌治疗对于激素受体阳性及HER-2阴性乳腺癌意义重大,但新辅助内分泌治疗至今未成为标准治疗,这是由于人群的选择、方案的选择、疗程的长短、评效的标准均缺乏统一的标准。
多基因检测工具的应用可使部分患者免去辅助治疗中的化疗,协助新辅助研究的患者筛选,使中、低评分的患者从新辅助内分泌治疗中获得更好的疗效及更高的保乳率。
因此,超过70%的专家认为穿刺活检的基因组分析可用于选择ER阳性及HER-2阳性乳腺癌患者进行新辅助内分泌治疗和化疗;超90%的专家认为对于低基因组风险的乳腺癌
患者,化疗并不优于内分泌治疗。
就疗效评价指标而言,Ki67在IMPACT研究以及POETIC研究中均显现出可预测预后的能力。
对于新辅助内分泌治疗不敏感型患者,ADAPT研究将Ki67与基因检测技术有机结合。
对于基因中风险患者,若患者可在3-4周内使Ki67<10%,并接受完全的内分泌治疗,5年无侵袭性疾病生存(iDFS)率可达93%。
图2. ADAPT研究设计
第三阶段:术后治疗策略的转换
目前,海外专家正面临如何转化术后治疗策略的困惑。
对于TNBC或HER-2阳性乳腺癌患者,pCR是一个良好的界定终点。
但对于ER阳
性或HER-2阴性的患者,尚无良好的指标。
对于ER阳性乳腺癌患者,多数专家将解剖分析以及肿瘤负荷作为指标之一,如淋巴结≥4枚或肿瘤>5cm的患者应接受辅助化疗。
但该困惑不易出现在中国。
这是由于接受新辅助内分泌治疗的患者多具有高龄、激素受体强阳性的特点,因此后续治疗较难转化为化疗。
达到pCR的HER-2阳性乳腺癌患者的后续治疗方案也仍是一个待解的难题。
在欧美专家共识中,初始的淋巴结状态与后续给药之间具有较强的相关性,以淋巴结阴性的患者为例,其后续可选择单靶方案。
对于未达到pCR的患者,多数专家认为应用T-DM1进行辅助强化治疗,即使肿瘤<5mm的情况下,患者也应当接受T-DM1治疗。
但该共识与中国专家的观点存在出入。
中国专家认为,对于新辅助治疗后已达pCR的患者,术后辅助治疗应继续原靶向治疗。
基于T-DM1可及性、现有医保政策。
经济因素以及毒副作用等诸多因素,对于疗效较好但仍未达到pCR的患者,中国专家更倾向于选择双靶治疗方案。
基于CREATE-X研究,卡培他滨成为了未达到pCR的三阴性乳腺癌患者的辅助强化标准。
但由于三阴性乳腺癌异质性较强,研究者应当根据患者的生物标志物进行强化治疗。
目前已有相关研究正在进行中,如ICI的强化。
总结
新辅助治疗在现有框架下正不断完善,但仍不完美。
研究者应当更加精准地筛选人群,并给予相应的治疗方案。
在优化方案的选择方面,研究者要兼顾局部和全局、近期和远期、疗效和毒性。
此外,早期评估与方案调整也应得到更多的重视。
对于术后残余肿瘤病灶的患者,可在生物标志物指导下,选择不交叉耐药方案进行强化治疗。
在第17届St Gallen会议中,研究者提出pCR预后情况与初始解剖分析有较强相关性。
徐教授认为,这可能是由于局部晚期乳腺癌患者的异质性更强,亚临床转移病灶更高,后续pCR评估可能被低估,因此造成晚期乳腺癌患者达到pCR,但其预后不及早期患者。
对于这类患者,研究者可利用CTC或ctDNA等检测方式为患者提供更好的治疗策略。
此外,MDT团队应当参与新辅助治疗,使流程更加规范及精准。
