高中化学优质课课件 (1)
高中化学-人教版(新课程标准)选修一归纳整理优质课件(22张PPT)(共22张PPT)可编辑全文

走近材料发展史
——选修一第3章知识整合
陶瓷
陶瓷· 化学成分:黏土(Al2O3·2SiO2·2H2O)· 制作工艺:混合、成型、干燥、烧结、冷却· 材料特性: 抗氧化、耐腐蚀、耐高温、绝缘、易成型· 实际应用:生活用品、艺术品
陶瓷
合金
合金· 定义:是由两种或两种以上的金属或金属和非金属融合而成的具有金属特性的物质。· 化学成分:两种或两种以上金属或金属和非金属 · 制作工艺:高温熔合· 材料特性:一般硬度较大,熔点比各成分金属低,性能可通过所添加的合金元素的种类、含量和生成合金的条件来加以调节,大大拓展了金属材料的使用范围和价值。
D
A
巩固提升
3.下列物质中,不含有硅酸盐的是( )[来源:学科网]A.水玻璃 B.硅芯片 C.黏土 D.普通水泥4.有关材料的用途不正确的是( )A.高温结构陶瓷可以制作耐酸设备 B.氧化铝陶瓷不可以用于制作耐高温设备C.氮化硅陶瓷可以制造轴承 D.光导纤维可用于传能、传像、照明等
塑料
塑料 · 化学成分:合成树脂 · 制作工艺:聚合反应(可通过加入各种添加剂提高性能)· 材料特性:成本低廉、性能多样 · 实际应用:见教材P63-64表格
塑料
ቤተ መጻሕፍቲ ባይዱ
知识梳理
请通过情景模拟活动结合第三章所学知识,自主完成导学案【知识回顾】部分内容。
巩固提升
1.有关合金的叙述错误的是( )A.铁与非金属氯、氧等很难形成合金 B.合金是混合物C.合金不具有固定的熔点 D.形成合金后,其熔点要提高2.钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。根据它们的主要性能,下列用途不切合实际的是( )A.用来做保险丝 B.用于制造航天飞机 C.用来制造人造骨 D.用于制造船舶
《氧化还原反应》说播课课件(全国高中化学优质课大赛获奖案例)

电子转移
设计意图 透过现象看本质,充分地理解氧化还原反应的本质。
解决问题视频
二、再分类
设计意图 ➢复习了交叉分类的方法 ➢加深了四大基本反应类型与 氧化还原反应的关系 ➢紧扣教学目标
三、双线桥的表示法
设计意图
为下节课氧化剂还原剂作 准备
教学流程
05 总结归纳
三个“一”
设计意图
简单明了地展示 紧扣本节课的教学目标
还原反应
得氧 失氧
局限
化合价升高 化合价降低
判断依据
失电子(共用电子对偏离) 电 子
得电子(共用电子对偏向) 转 移
本质特征
2.双线桥表示方法
教学反思
恳请各位评委和各位老师批评指导 谢谢大家
教学分析 教法学法 教学过程 教学反思
教学重点
氧化还原反应的 判断依据和本质
教学难点
氧化还原反应的本质
突破难点的关键:化合价的升降与得失电子的关系。
教法学法分析
设计思路
学生掌握
已有的知识
按四大基本反应 分类的思想
质 疑
迁
移
CO+CuO=Cu+CO2
发 展 史
新知识
氧化还原反应
化合价的判断 解 疑
说播题目
氧化还原反应(第一课时)
教学分析
教材分析
教学分析 教法学法 教学过程 教学反思
教材 位置
人教版必修一第二章第三节
既复习了初中的基本反应
承 类型及氧化反应和还原反
教材
上
应的相关知识,又复习了 新学习的分类思想
作用
启 今后学习元素化合物、电 下 化学奠定基础
学情分析
教学分析 教法学法 教学过程 教学反思
全国高中化学优质课一等奖人教版必修第一册高一化学《原子结构与元素周期表》精美课件

副族
VIII族 副族
主族
0 族
名称
IA
III IIA
B
IV V BB
VI VII BB
VIII族
I II III IV V VI VII 0 B B A A A A A族
说明:
(1)电子层数=周期序数; (2)主族元素族序数=原子最外层电子数
(3)主族元素由短周期和长周期元素共同构成 ,副族元素完全由长周期元素子数是L层电子数的
1/2,则该元素的原子是( B )
A.Li
B.Si
C.Al D.K
2.下面关于多电子原子核外电子的运动规律的叙述正确的是( )
A.核外电子是分层运动的
A
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量低的电子在离核远的区域绕核旋转
3、结构:
(1)周期
第一周期:2种元素
短周期 第二周期:8种元素
周期 (横行)
长周期
第三周期:8种元素 第四周期:18种元素 第五周期:18种元素 第六周期:32种元素(镧系:57-71,共15种 )
第七周期:32种元素(锕系:89-103,共15种)
小结:七横七周期,三短四长
(2)族
主族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
能量大小
小
大
距核远近
近
远
思考与谈论P.87探究电子排布规律
3、原子核外电子的排布规律
• •
最各外电层元子不素层超最过多8容个纳K电的子电(各L子K电数层目子不M为超层2过的n22N电)子数O
P
• 次2外He层(电氦子)数目不2超过18个,倒数第三层
全国高中化学优质课一等奖碳酸氢钠和氯化钙溶液真的不反应吗?课件

a+b+c=0.50
b×10-8.2/a = Ka2 = 4.7×10-11 c×10-5.8/a = Kw/Ka1 = 10-14/(4.4×10-7)
a = c(HCO3-) = 0.49 mol/L b = c(CO32-) =3.7×10-3 mol/L c = c(H2CO3) =7.0×10-3 mol/L
碳酸氢钠与氯化钙 溶液真的不反应吗?
提出问题
• 碳酸氢钠(NaHCO3),又称小苏打,是中学最常见的酸式盐,其溶 液略显碱性。
• 氯化钙(CaCl2),是中学常用的干燥剂,其溶液显中性。 • 原有认识:NaHCO3溶液与CaCl2溶液混合不反应
• 但是, NaHCO3和CaCl2溶液真的不反应吗?
Qc = c(Ca2+)·c(CO32-) =0.25 ×3.7×10-3 = 9.25×10-4>Ksp 有CaCO3沉淀生成
生成 气体
1 mL 0.5 mol/L CaCl2溶液
1 mL 1 mol/L NaHCO3溶液
理论分析
NaHCO3溶液和CaCl2溶液混合时,溶液中存在另外2个化学平衡:
氢氧化钙
HCO3- + H2O Ca2+ + 2OH-
H2CO3 + OHCCO32-
Ca2+ + CO32-
CaCO3
HCO3- + H+
H2CO3
生成 沉淀
资料卡片:
25℃时 H2CO3的电离常数 Ka1=4.4×10-7 Ka2=4.7×10-11 CaCO3的溶度积 Ksp=2.8×10-9
综上所述
Ca2+ + 2HCO3-
《苯》【高中 化学 优质课 教学PPT课件】

2、取代反应:
(1)苯与Br2的反应
只发生单取代反应
液溴(纯溴)
注意:
溴苯(无色油状液体,密度大于水)
①FeBr3的作用:催化剂 ②苯不与溴水发生反应,应使用液溴
苯与溴的反应(改进装置)
(1)如何改进,证明产物中有HBr?
产物先通入有机溶剂(四氯化 碳或苯),再通入硝酸银溶液 中
环烷烃除了环丙烷中三个碳原子在同一平面,其他都是立体结构
四、苯的用途
苯是一种重要的化工原料,也常用作有机溶剂
洗涤剂 医药
苯
炸药
染料、香料、 农药、有机溶 剂等。
总结:能燃烧,易取代,难加成
不与溴水和
反映
特殊结构
KMnO4反应
决定
特殊性质
单键
双键
取代 加成
C、H元素
决定
可燃
思维导图
与Br2 作用
与酸性 KMnO4 作用
Br2试剂 反应条件 反应类型
现象
结论
点燃
现象 结论
甲烷
乙烯
纯溴
溴水
光照 取代
加成
不褪色
褪色
不被 酸 性KMnO4 溶液 氧 化
易被酸性 KMnO4 溶液 氧 化
淡蓝色火焰,火焰明亮,
无烟
有黑烟
含碳 量低
含碳量较高
苯
纯溴 催化剂
取代 不褪色 苯不被酸性 KMnO4溶液氧化
火焰明亮,有浓烟
熔点:5.5℃; 若用 冰 冷却,可凝结成 无 色 晶体。
三 、苯的化学性质
在通常情况下比较稳定,在一定条件下能发生燃 烧、加带有浓烟
2C6H6 + 15O2 点燃 12CO2 + 6H2O
高中化学《烃及其衍生物转化关系图》优质课PPT课件
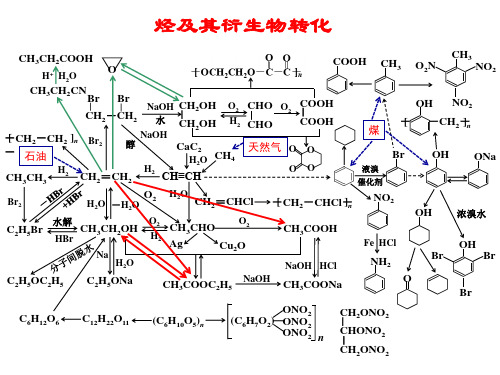
已知:化合物A、B、F互为同分异构体。
NH2 O=CH
(1)下列说法不正确的是 A
A.化合物C能发生氧化反应,不发生还原反应
B.化合物D能发生水解反应
C.化合物E能发生取代反应
D. 化合物F能形成内盐
合成染料中间体X和医药中间体Y。 ?
已知:化合物A、B、F互为同分异构体。
(2) B+C→D的化学方程式是
天然气 O O
OO
OH NO2 煤 -[ -CH2-]n
Br
液溴 催化剂
OH ONa
Br2
C2H5Br
H2O -H2O O2
水解
HBr CH3CH2OH
O2 H2
Na H2O
H2O CH2=CHCl
CH3CHO
O2
Ag
Cu2O
-[ CH2-CHCl-]n NO2
CH3COOH
NaOH HCl
Fe HCl
烃及其衍生物转化
-- - -
-
CH3CH2COOH
H+ H2O
O
COOH
CH3
O2N
CH3 NO2
CH3CH2CN Br Br CH2-CH2
NaOH CH2OH 水 CH2OH
O2 CHO O2 COOH
H2 CHO
COOH
-[ CH2-CH2 ]n - 石油
Br2
NaOH
醇
CaC2
H2O
CH4
CH3CH3 H2 CH2=CH2 H2 CH≡CHΒιβλιοθήκη NH2OH 浓溴水
OH
Br
Br
C2H5OC2H5 C2H5ONa
CH3COOC2H5 NaOH CH3COONa
鲁科版高中化学必修第一册《1、硅 无机非金属材》优质课公开课课件、教案

鲁科版高中化学必修第一册《1、硅无机非金属材》优质课公开课课件、教案第4章元素与材料世界第1节硅无机非金属材料一、【教学目标】(一)、知识与技能1、了解硅和二氧化硅在自然界中的物理性质和存在,用途。
2、掌握硅和二氧化硅的化学性质。
(二)、过程与方法1、自主学习,培养学生自学能力。
2、活动探究,通过硅与碳、二氧化硅与二氧化碳的比较,培养学生的归纳能力、比较能力。
(三)、情感、态度与价值观1、培养学生学习元素化合物的正确方法:结构决定性质、性质决定用途。
2、通过对硅及其用途的学习使学生热爱自然、热爱化学。
3、联系生产生活及新科技,学以致用,培养学生对化学学习的兴趣。
二、【教学重点】1、硅和二氧化硅的物理、化学性质2、硅和二氧化硅的特殊性质三、【教学难点】硅和二氧化硅的性质、结构四、【教学准备】1.查阅相关资料,常见半导体材料有哪些?硅有哪些主要用途?2.光导纤维的主要成分是什么?光通信比普通电缆通信有哪些优点?光纤除用于通信外,还可用于哪些领域?3.查阅有关资料,说明消防员穿的棉布衣服为什么比普通棉布衣服不易着火燃烧?五、【学法指导】学习从不同的角度出发对常见材料进行分类的方法,能根据同一类别不同物质的性质归纳出该类物质的通性,并能运用通性简单预测其他物质的性质。
六、【教学过程】第1课时硅和二氧化硅一、半导体材料和单质硅导入新课: 计算机的芯片,传导电话、电视的光缆,化学实验室里的玻璃仪器,你能想像的出它们都是以硅或硅的化合物为材料制成的吗?质疑:除了以硅酸盐为主要成分的传统无机非金属材料外,你还知道其他无机非金属材料吗?自然界中的岩石、沙子、土壤是由什么构成?1. 存在半导体材料硅。
硅在元素周期表中的位置硅元素位于周期表的第3周期第ⅣA族,其原子结构示意图为位于金属和非金属的交界线上。
2、硅的物理性质:单质硅有晶体硅和无定形硅两种。
晶体硅呈灰黑色,有金属光泽,硬而脆,熔点很高,是良好的半导体材料。
高中化学优质课一等奖《铁及其重要化合物》精品课件

Fe3+
产生淡黄色沉淀―→Fe3+
(5)利用Fe2+的还原性
①
Fe2+溶液溴水溴水褪色―→Fe2+ Fe3+溶液 溴水不褪色―→Fe3+
②
Fe2+溶液KMnO4溶液紫色褪去―→Fe2+
Fe3+溶液
不褪色―→Fe3+
[知能拓展] ①若只检验Fe3+,最好选用KSCN溶液,此法 最灵敏。
②若只检验Fe2+,最好方法是加KSCN溶液无现象,再滴 入氯水,溶液变红。但加入试剂顺序不能颠倒。
③检验Fe3+是否混有Fe2+,最好用酸性KMnO4溶液或溴 水,不能用NaOH溶液、KSCN等。
④检验既含Fe3+又含Fe2+,分二次检验,用KSCN溶液检 验Fe3+,用酸性KMnO4溶液检验Fe2+。
❖ 1、 如图两圆相交部分A、B、C、D分别表示两
物质间的反应。下列各对应反应的离子方程式书 写不正确的是 ( )
FFee23++NaOH白为红色红褐沉褐色淀色沉―迅淀→速―F→变eF2为+e3灰+ 绿色,最后变
(4)利用Fe3+的氧化性
①
Fe2+溶液Cu片无明显现象―→Fe2+ Fe3+溶液 铜被腐蚀,溶液变为绿色―→Fe3+
②
Fe2+溶液淀粉-KI试纸不变蓝―→Fe2+
Fe3+溶液
变蓝―→Fe3+
③
Fe2+H2S水溶液无现象―→Fe2+
(5)某同学在实验时向 E 中加入了过量的一种固体物质,发 现淡黄色褪去,现对褪色原因进行探究。提出你的假设: ________;为了对你所提出的假设进行验证,你设计的实验方 案是______________________。
答案:(1) FeCl2
KSCN溶液
(2)d
(3)Fe3O4+8HCl===2FeCl3+FeCl2+4H2O
高中化学《镁的提取及应用》优质课PPT课件

三、镁的化学性质 (3)镁与水的反应
镁可与热水反应
Mg+2H2O==Mg(OH)2+H2↑ (4)镁与酸的反应
Mg+2H+==Mg2++H2↑
镁
合
四、镁的用途
金
制
品
镁型材、镁锭、镁合金、制
烟火、闪光粉、镁盐等。
氧化镁――熔点2800℃, 常被用做耐高温材料。
煅烧
CaCO3 === CaO+CO2↑ CaO+H2O==Ca(OH)2 。
电解
(3)写出电解饱和食盐水的离子方程式 2Cl‒+2H2O === 2OH‒+Cl2↑+H2 ,↑
若要保证电解后的溶液有恢复为原来的饱和食盐水,则可采取的方法是 通入HCl气体 。
三、镁的化学性质
(1)与非金属的反应 镁在O2中燃烧
镁的提取 及应用
镁的物理性质
从海水中提取镁的流程
镁的化学性质 镁的应用
与非金属反应 在二氧化碳中燃烧 与水反应 与酸反应
1. 镁粉在焰火、闪光粉、鞭炮中是不可缺少的原料,工业制造镁粉
是将镁蒸气在某冷却剂中冷却,下列可作为冷却剂的是( D )
①空气 ②O2 ③Ar ④H2
⑤N2 ⑥H2O
A. ①③④⑤ B. ①③④
镁的提取及应用
学习目标 了解镁的存在及物理性质 掌握镁的化学性质和工业制法
你知道轻盈起飞的舰载机的组成材料吗?
一、镁的物理性质 1. 银白色金属 2. 密度小 镁合金的密度小、硬度和强度大 镁合金大量用于制造火箭、导弹、飞机
