英国药典2012 有关物质项译文
欧洲药典-凡例翻译

07/2010:10000 1. 凡例1.1. 概述凡例的内容适用于各论和欧洲药典中的其它章节。
欧洲药典以英语和法语形式发行,欧洲药典委员会的签署国可将药典内容译成其它语言,但若发生争议,应以英语和法语版为权威。
在欧洲药典中,如无特殊规定,“药典”是指欧洲药典,官方缩写Ph. Eur.也指欧洲药典。
文章中如果引用了各论中的标题和副标题意味着文章内容符合相关各论的要求。
文章参考药典中各论内容时,以斜体的各论题目或相关数字表示。
制剂在有效期内必须性质稳定,明确的有效期或说明书应由权力机构批准。
任何各论的物质也必须服从其使用期限。
任何药品的有效期和有效期的计算由权力机构经稳定性研究的试验结果决定。
除凡例和各论中另有说明,各论中的说明为强制要求;除了特定的引用信息,如果各论引用总论中内容时,该总论要求为法定要求。
各论中描述的有效成分(药用物质),辅料(辅助物质),药物制剂和其它成分用于人和兽的使用(除非明确限制不可使用)。
药品项目必须符合各论的要求,否则不符合药典质量。
但并不要求产品放行前,生产商要做各论中的每项试验以满足药典要求。
生产商可通过原始数据,例如生产过程验证,和中间体控制,确保药品是否符合药典要求。
公布的环境参数,权力机构可适当采信,但不排除故意满足药典要求的可能。
检测和试验方法应基于药典标准的官方方法。
经权利机构允许可采用其它替代的分析方法以达到控制目的,并证明该方法是否能达到各论各标准。
若出现争论或异议,应以药典方法为准。
药典各论中的某些物质有多个等级可满足各种需要,除各论中另有说明,要求适用于各等级。
在一些各论中,特别是辅料,一系列相关的功能特性都有介绍,其中给出了一些特性的检测方法。
质量体系:在适宜的质量体系架构下,产生有疑问的项目时,应以各论中的质量标准为法定标准。
通则:各论中介绍的药物和制剂也应符合通则中的相关要求。
交叉引用的通则在各论中不特别指出。
除非限定了适用条件,如规定适用于药典各论中的物质,通则的内容适用于各论定义范围内的所有药物和制剂。
EP2.2.25译文

紫外可见分光光度法吸光度的定义:溶液的吸光度可以定义为以10为底的单色光辐射的透光率的倒数的对数。
A=log10(1/T)=log10(I0/I)T= I0/II0=单色光反射的入射光强度I=单色光反射的透射光的强度吸光度A与辐射路径的长度和溶液中物质的浓度成正比。
A= εcbε=摩尔吸光度,b的单位是厘米,c的单位是摩尔每升。
A1 per cent1 cm代表10g/l的溶液在1cm比色池中在特定波长下的吸光度,A1 per cent1 cm =10ε/Mr除非另有规定,在规定波长下在20±1℃,1cm比色池中测定吸光度。
除非另有规定,测定时对照采用相同的溶剂或者混合溶剂。
溶剂在规定波长处的吸收不应该超过0.4,最好小于0.2。
将吸光度或者吸光度的函数作为纵坐标,波长或波长的函数作为横坐标。
如果专论中规定的最大吸收处的单一值,则可认为测得值不超过±2 nm。
仪器:适用于紫外及可见区光谱测定的分光光度计由一个能在200-800nm范围内提供单色光的光学系统和一个测定吸光度的装置所组成。
波长的控制:利用高氯酸钬溶液的最大吸收来确认波长范围。
在表2.2.25-1中列出了氢或氘高压灯或汞蒸汽。
在紫外范围内的允许偏差为±1 nm,在可见范围内的偏差为±3 nm。
选用合适的参比物。
表2.2.25-1控制波长范围的最大吸收吸光度的控制:用合适的滤器或重铬酸钾溶液在表2.2.25-1中的波长下测定吸光度,每个波长下都有一个真实值以及允许的偏差。
吸光度的偏差限度±0.01。
重铬酸钾在使用之前要在130℃下干燥至恒重。
在235nm,257nm,313nm和350nm波长下,溶解57.0-63.0mg重铬酸钾于0.005M硫酸中并稀释到1000ml。
在430nm波长下,溶解57.0-63.0mg重铬酸钾于0.005M硫酸中并稀释到100.0ml。
可以使用合适的参比物。
英国药典 二氧化硅含量标准-概述说明以及解释

英国药典二氧化硅含量标准-概述说明以及解释1.引言1.1 概述概述部分的内容可以介绍英国药典和二氧化硅含量标准的背景和重要性。
英国药典(British Pharmacopoeia)是英国政府主导的药典,旨在确保药品的质量和安全,并提供关于药品的规范和标准。
它是全球最古老、最为广泛使用的药典之一,被广泛认可和接受。
二氧化硅是一种常见的化学物质,具有广泛的应用领域。
在医药工业中,二氧化硅常用作药品的填充剂、稳定剂和流变剂。
它不仅可以增加药品的体积,还可以提高药品的稳定性和流动性。
然而,不同的药品需要不同的二氧化硅含量,过多或过少的二氧化硅都可能会影响药品的质量和疗效。
因此,为了确保药品的一致性和质量,制定了二氧化硅含量的标准。
这些标准指定了药品中二氧化硅的最大和最小含量,以及什么样的测试方法可以用于测量二氧化硅含量。
这些标准的制定是基于科学研究和国际共识,旨在保证药品的质量和安全。
了解英国药典中关于二氧化硅含量的标准对于制药行业和药品生产者来说至关重要。
遵循英国药典的要求能够确保药品在生产过程中的质量和稳定性,并且能够满足患者的需要和期望。
对于药学研究者和相关领域的专业人士来说,了解这些标准还能够为他们的研究和开发提供指导和参考。
总而言之,英国药典中关于二氧化硅含量的标准起着至关重要的作用,不仅可以保证药品的质量和安全,还能够为药品生产者和研究人员提供指导和参考。
在药品生产和研究中,遵循这些标准能够确保药品的一致性和有效性,从而更好地满足患者的需求。
1.2 文章结构文章结构部分:文章的结构非常重要,可以帮助读者更好地理解和组织所阐述的内容。
本文将按照以下结构进行组织:第一部分是引言,主要包括概述、文章结构和目的三个方面。
在概述部分,将简要介绍英国药典中的二氧化硅含量标准的重要性和应用背景。
接下来,在文章结构部分,将详细介绍本文按照何种结构进行组织,在本文中的各个部分分别阐述的内容。
最后,明确本文的目的,即为读者提供关于英国药典中二氧化硅含量标准的全面了解。
EP 2034 药用物质中英文

04/2013:2034EP 7.5SUBSTANCES FOR PHARMACEUTICAL USE药用物质DEFINITION 定义Substances for pharmaceutical use are any organic or inorganic substances that are used as active substances or excipients for the production of medicinal products for human or veterinary use. They may be obtained from natural sources or produced by extraction from raw materials, fermentation or synthesis.药用物质是指人用或兽用医疗产品生产中所使用的活性物质或辅料,其可能是有机的或无机的物质。
这些物质可能是从自然途径获取,或从原料中萃取、发酵或合成得到。
This general monograph does not apply to herbal drugs, herbal drugs for homoeopathic preparations, herbal drug preparations, extracts, or mother tinctures for homoeopathic preparations, which are the subject of separate general monographs (Herbal drugs (1433), Herbal drugs for homoegopathic preparations (2045), Herbal drug preparations (1434), Extracts (0765), Mother tinctures for homoeopathic preparations (2029)). It does not apply to raw materials for homoeopathic preparations, except where there is an individual monograph for the substance in the non-homoeopathic part of the Pharmacopoeia.本通论不适用于草药制品、顺势疗法制剂用草药、草药制剂、提取物、或顺势闻法制剂的药酒母体,这些品种应参照各自的各论(草药制品(1433)、顺势疗法制剂用草药(2045)、草药制剂(1434)、提取物(0765)、或顺势闻法制剂的药酒母体(2029))。
药品检验专业英语

药检专业词汇的学习
• 学习方式:
- 单个的词汇学习-词典(公共英语) - 在语境中学习(强烈建议的)
• 梳理出几条线索,对照英文原文语境
1. 药检实验室的质量管理体系 2. 药典 3. 常用的仪器 4. „
以“收样环节”为例学习相关词汇
• 已有知识基础: 1. 填写检验申请表 2. 药品状态的检查:名称、批号、数量、包装等 3. 收检登记与留样 4. 样品移交
药检专业英语词汇--药品监管国际协调机构
WHO:2个专家委员会: http://www.who.int/medicines/en/
• WHO Expert Committee on Specifications for Pharmaceutical Preparations药品专家委员会
• WHO Expert Committee on Biological Standardization (ECBS)生物制品专家委员会
药检专业英语词汇-卫生系统
• 卫生系统(health system)
-国家药物政策(national drug policy)
• 国家药品监管(national drug regulation)
-药品检验(Drug quality control)
药检专业英语词汇-药品监管
药品监管-drug regulation 药品监管机构-drug regulation authority (DRA) 药品监管的目的:质量、安全和有效:quality, safety and efficacy 药品监管的组成部分:
对照GPCL,找到每个环节相对应的词汇:
1. 检验申请表:standard test request form 2. 收样:incoming samples, samples received by laboratories 3. 外观检查:visual inspection of submitted sample 4. 登记:registration 5. 留样:retention, 移交:transfer
欧洲药典附录中文版.

第二部分、附录附录1 溶液的澄清度 (2)附录2 溶液颜色检查 (3)附录3 旋光度 (7)附录4 铵盐检查法 (9)附录5 氯化物检查法 (11)附录6 硫酸盐灰分 (13)附录7 铁 (14)附录8 重金属 (16)附录9 干燥失重 (21)附录10 硫酸盐检查法 (23)附录11 红外吸收分光光度法 (25)附录12 pH测定 (29)附录13 滴定 (34)附录14 氯化物鉴别反应 (37)附录15 指示剂颜色与溶液pH 的关系 (38)附录1 溶液的澄清度在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液Ⅰ。
如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
试剂:硫酸肼溶液:取1.0g硫酸肼溶于水,加水稀释至100.0ml,静置4~6小时。
乌洛托品(六亚甲基四胺)溶液:在100ml容量平中,以25.0ml水溶解2.5g乌洛托品。
浊度标准贮备液:在存放乌洛托品溶液的100ml容量瓶中,加25.0ml的硫酸肼溶液。
混合,静置24小时,贮存在无表面要求的玻璃容器中,可在2个月内使用。
该浊度液不得黏附玻璃,用前必须充分摇匀。
浊度标准原液:取浊度标准贮备液15ml,加水稀释、定容至1000ml。
该液临用前制备,至多保存24小时。
浊度标准液:由浊度标准原液与水按表1-1配制,即得。
本液应临用前配制。
表1-1附录2 溶液颜色检查按本药典规定,用下面两种方法之一可以检出溶液在棕色-黄色-红色范围内的颜色。
如果溶液A的外观与水或所用溶剂相同,或者颜色浅于标准比色液B9,则可判定溶液A为无色。
药品检验报告中的一些词语的英文翻译

药品检验报告中的一些词语的英文翻译检验报告Certificate of analysis化工有限公司chemical CO. , LTD制药(药业)有限公司Pharmaceutical co. ,Ltd.化工厂CHEMICAL PLANT精细化工有限公司FINE CHEMICAL CO., LTD品名PRODUCT //title批号batch NO.生产日期manufacturing date // manu. Date检验日期Analysis date有效期Exp date // expiry date检验标准quality standard //inspecting basis //Specification数量QUANTITY 报告日期report date 包装规格package企业标准Company Standard//enterprise standard检查项目test items//analytical items性状appearance // characteristics//description//Character分子式molecular formula 分子量molecular wt化学式Chemical formula鉴别identification溶液外观appearance of solution澄清度&颜色clarity & color白色或类白色结晶粉末white or almost white crystalline powder味微苦 a little bitter taste无色无味odorless,smelless酸碱度acidity and alkalinity铅盐Plumbum salts 砷盐Arsonium salts有关物质related substances 分为:individual impurity substance NMT….;total impurity substance NMT。
药材英国药典标准1(中文)

白芍饮片通则[定义] 传统草药制剂中使用的白芍饮片是经过酒炙、去皮和干燥的白芍药材。
按干燥品计算,含芍药苷不得少于1.6%。
[制作] 夏秋二季采挖,洗净,除去头尾和细根,置沸水中煮后除去外皮或去皮后再煮,晒干。
干燥的根部先充分润洗,然后横切或纵切成薄片,干燥即得。
[鉴别] A 根的切片呈灰白色或淡棕色,边缘颜色较深,大约2mm厚。
表面光洁或有短的纵皱纹及细根痕。
横切片呈直径约4.5cm椭圆形状,切面有明显的放射状脉管组织。
纵切片大约10cm长,1.5cm宽,切面纵向有明显的脉管组织。
B 微粉化,粉未呈黄白色。
用水合氯醛溶液溶解后于显微镜下观测,粉未中有很多单个或成群存在的圆形的,矩形的或伸长状的薄壁组织细胞,有些还具有凹痕的或珠状的细胞壁。
很多细胞中还含有黄白色或粉红色的糊化淀粉粒。
草酸钙簇晶直径11~35微米,存在于薄壁细胞中,常排列成行或一个细胞中含数个簇晶。
具缘纹孔导管和网纹导管直径20~65微米。
纤维长梭形,直径15~40微米,壁厚,微木化,具大的圆形纹孔。
C 在含量测定项下记录的色谱图中,溶液(1)有一个峰的保留时间与溶液(2)的主峰保留时间一致。
D 照薄层色谱法(附录ⅢA),配制下列溶液:(1)取本品粉未0.5g,加乙醇10mL,振摇5分钟,滤过,滤液蒸干,残渣加乙醇1 mL使溶解(2)取芍药苷和4-对羟基苯乙酮对照品用乙醇溶解,制成0.1% (w/v)的溶液色谱条件:(a)硅胶G板(默克硅胶G60预制板适用)(b)展开剂:甲酸-乙酸乙酯-甲醇-二氯甲烷(0.2:5:10:40)(c)点样量:10μL,条带状点样(d)展距15cm(e)晾干,喷以5%香草醛硫酸溶液,105℃中加热5分钟,使斑点显色清晰,立即检测系统适应性:在溶液(2)的色谱图中,应显示两个相互分离的斑点。
判断:在Rf值大约0.4处,溶液(1)的色谱与溶液(2)相应的位置上,显相同颜色的蓝紫色斑点,溶液(1)的色谱应呈现以下斑点:[检查]牡丹(Tree Peony)在含量测定项下的色谱图中,溶液(1)在芍药苷相对保留时间约1.2处无色谱峰干燥失重取本品1g,在100~105℃干燥3小时,减失重量不得超过12.0%.酸不溶性灰分不得过0.5%(附录Ⅺ k)总灰分不得过6.5%(附录Ⅺ J)重金属镉不得过百万之三;铅不得过百万之五。
英国药典Appendix XVI C翻译

第一部分Appendix XVI C. Efficacy of Antimicrobial Preservation (Ph. Eur. general text 5.1.3)如果药物制剂本身没有足够的抗菌活性,那么就应该加抗菌防腐剂。
在药品正常的储存和使用过程中,液体制剂特别是多剂量液体制剂,尤其需要添加防腐剂。
这样不仅可以阻止细菌繁殖、限制微生物污染;还可以防止细菌污染给患者身体带来的危害和对药品本身的污染。
抗菌防腐剂在GMP中不能被替代。
抗菌防腐剂的效果根据药物制剂的组成成分的不同、防腐剂加入的形式的不同、或使用容器或封口的不同而增强或减弱。
在最终的包装容器内的制剂,我们需要验证它在整个有效期内的抗菌活性。
这样才能保证在贮存过程中抗菌活性不会减弱。
样品从最终容器中取出时就需要立即进行验证了。
在药物制剂发展期间(注:研发Research & Development,D就是发展期间,将活性分子变成处方制剂的过程),应该需要证明药物制剂本身的抗菌活性。
如果没有就需要添加合适的防腐剂、或防腐剂能够保护制剂免于遭受微生物污染的不良效果和在贮存和使用过程中细菌的繁殖。
抗菌活性应该通过以下一系列测试来证实。
这些测试并不用于常规的对照目的。
测试抗菌防腐剂的有效性测试包括三方面内容:一、不论最后的包装容器是什么,都需要用规定的接种物,也就是合适的微生物对制剂进行攻击。
二、在规定的温度下贮存已接种制剂。
三、在一段时间间隔内抑制容器内的样本生长,然后计数这样被除去的样本中的菌数。
在测试条件下,如果在规定时间和温度下,接种后制剂中的菌落数有重大的下降或没有增加,那么药物制剂中防腐剂的作用就是可以接受的。
接受标准(即在规定时间内减少微生物的数量)随着制剂类型的不同而不同。
因为制剂类型的不同所达到的保护的程度也不同。
(见表5.1.3-1/2/3)。
微生物检测(见附录二)绿脓假单胞杆菌A TCC 9027; NCIMB 8626; CIP 82.118.金黄色酿脓葡萄球菌ATCC 6538; NCTC 10788; NCIMB 9518; CIP 4.83.白色念珠菌A TCC 10231; NCPF 3179; IP 48.72.黑曲霉A TCC 16404; IMI 149007; IP 1431.83.使用单菌株攻击而且设计微生物可以在合适的地方补充其他菌株或品种,这样就能代表可能的制剂污染。
英国药监局OOS翻译

MHRA-英国医药与保健食品管理局Laboratory AnalysisInvestigations of "Out of Specification (OOS) / Out of Trend (OOT)/ Atypical-results" have to be done in cases of:在如下情况下应开展OOS /OOT /异常结果结果调查– Batch release testing and testing of starting materials.批放行检验及原物料检验– In-Process Control testing: if data is used for batch alculations /decisions and if in a dossier and on Certificates of Analysis.过程控制检验:如果数据用作在记录或者检验报告作为批计算/决定– Stability studies on marketed batches of finished products and or active pharmaceutical ingredients, on-going / follow up stability (no stress tests)成品和/或原料药市售批次的稳定性研究,用作持续跟踪稳定性(非破坏性试验)– Previous released batch used as reference sample in an OOS investigation showing OOS or suspect results.产品放行批之前在OOS调查中的参考品显示OOS或者非预期结果。
– Batches for clinical trials.临床试验批• All solutions and reagents must be retained until all data has been second person verified as being within the defined acceptance criteria.所有溶液和实际必须保留,直到数据被第二个人证实在规定的可接受标准内。
HPLC法测定对氨基水杨酸钠中有关物质的含量

HPLC法测定对氨基水杨酸钠中有关物质的含量李春盈;何宇芬;卢俊钢;张玉英;梁小蕙【摘要】目的建立对氨基水杨酸钠有关物质含量的测定方法.方法采用反相离子对高效液相色谱法,以十八烷基键和硅胶为填充剂;以乙腈-10%(质量浓度)四丁基氢氧化铵溶液如-0.05 mol·L-1NaH2PO4(体积比100∶ 2∶900)为流动相;流速为1.0 mL· min-1;检测波长为220 nm;柱温为30℃.结果对氨基水杨酸钠与已知杂质间氨基酚线性范围均为0.2~2.0 μg·mL-1(r均为0.999 9,n=5),检出限分别为0.050、0.068 ng;ll批对氨基水杨酸钠样品中已知杂质间氨基酚质量分数均小于0.01%,最大单个未知杂质质量分数均小于0.05%,杂质总质量分数均小于0.06%.结论本方法准确、可靠,专属性强,可用于对氨基水杨酸钠中有关物质的测定.【期刊名称】《广东药学院学报》【年(卷),期】2013(029)002【总页数】4页(P155-158)【关键词】对氨基水杨酸钠;有关物质;高效液相色谱法【作者】李春盈;何宇芬;卢俊钢;张玉英;梁小蕙【作者单位】广州市药品检验所,广东广州510160;广州市药品检验所,广东广州510160;广州市药品检验所,广东广州510160;广州市药品检验所,广东广州510160;广州市药品检验所,广东广州510160【正文语种】中文【中图分类】R917对氨基水杨酸钠(PAS-Na)为目前治疗结核病的常用药物之一,口服对氨基水杨酸钠基本上被淘汰,但静滴给药对长期发热中毒症状明显的肺结核患者仍能发挥独特的疗效[1],研究报道PAS-Na还能治疗慢性重度锰中毒等其他适应证[2-3]。
由于本品制剂需静脉给药且疗程较长,临床报道存在急性过敏、发热等不良反应及滴注用药时溶液容易变色等现象[4-5],因此必须严格控制PAS-Na中有关物质的含量。
英国药典2012版序言翻译

序言《英国药典(2012)》代替《英国药典(2011)》。
在顾问团、专家组及工作小组的共同合作与支持下,由英国药典委员会制定。
内容涵盖将近3375篇专论,关于药品实践中使用到的物质、制剂以及论文。
其中有些是国家专论,而其他则转载自《欧洲药典(第七版)》。
该版连同其姐妹篇《英国药典(兽医)2012》,包含了《欧洲药典(第七版)》的所有专论,由附录7.1及7.2进行了修订。
使用英国药典可以在该综合性的索引纲要中找到所有的英国现行的人用药药典标准。
2012英国药典共有6卷组成,如下:第一/二卷药用物质第三卷处方制剂:一般专论处方制剂: 特定专论第四卷草药,草药制剂,草药产品,用于生产顺势疗法制剂的物料,血液制品,免疫学制品,放射性药品制剂和外科药物第五卷红外参考光谱,附录,补充章节,索引第六卷英国药典(兽用药)2012生效日期此版英国药典专论于2012年1月1日起生效。
根据1968年《药品法》中第65(4)部分规定,此版本或者更早版本的英国药典中删除的专论仍然有效。
有关欧洲药典的出版执行日期见补充章节IV B:执行日期。
欧洲药典专论的标题旁边有一连串星星符号。
凡例英国药典凡例(第二部分)的修改内容如下:修改凡例中的度量衡制,使用‘L’作为‘公升’的缩写贯穿新版药典,并按照欧洲指令的80/181/EEC允许继续使用‘l’。
(见以下的编辑修改。
)修改了英国药典凡例(第三部分),以适应《欧洲药典(第七版)》的变更要求。
工作小组已召集新成立的英国药典委员会吸入性药物工作小组,对现行英国药典吸入性药物的专论、相关的一般专论以及补充章节进行审核。
工作小组将会提出建议,以确保英国药典能够适当地对现行销售的吸入性药物质量加以控制。
新增内容在本序言的结尾,给出了首次包括在英国药典2012中的专论清单,包括35个新的国家专论以及31个转载自由附录7.1及7.2进行了修订的欧洲药典(第七版)的新专论。
传统草药;顺势疗法制剂关于传统草药所用物料及加工物料专论的发展完善工作一直在持续进行。
分析化学英语术语翻译

分析化学英语术语翻译玻璃漏斗Glss funnel long stem试管test tube test tube brush test tube holder test tube rck蒸发皿evporting dish smll烧杯beker锥形瓶Erlenmeyer量筒grd cylinder 洗瓶plstic wsh bottle勺皿csserole ,smll stoppered flsk 分液漏斗seprlory funnel wter bth/oil bth strring br mgnetic stirrer冷凝器condenser Bllst bottle圆颈烧瓶Round-buttom flsk 试剂瓶regent bottles托盘天平pltform blnce XX秤0.1g 托盘pn 指针刻度表pointer nd sclecrossbems nd sliding weights 游码分析天平two-pn/single-pn nlyticl blnce滴定管burette glss bed(bsic) nozzle移液管pipette 胖肚elongted glss bulb洗耳球rubber suction bulb玻棒glss rod玻璃活塞stopcock容量瓶pyknowmeter flsks比重瓶(one-mrk)volumetric flsks胖肚吸管one-mrk pipette刻度吸管grduted pipettes实验仪器清单1、柜子抽屉中:锥形瓶(conicl flsk) 250ml锥形瓶(conicl flsk) 250ml×4 药匙(medicine spoon)×1 (Erlenmeyer flsk) 100 ml×3 滴管(drip tube;dropper)×2烧杯(beker) 500 ml×1 玻棒(Glss stic)×2250 ml×3 木试管夹(test tube clmp;test tube holder)×1 100 ml×3 胖肚吸管(strws) 25 ml×150 ml×2 10 ml×1容量瓶(volumetric flsk) 100 ml×2 乳钵(mort)×150 ml×4 洗耳球(er wdhing bulb)碘量瓶(iodin numoe flsk;iodineflsk) 500 ml×3试剂瓶(regent bottle) (无色)×2(棕色)×2 配洗液:量筒(cylinder)100 ml×1 K2Cr2O72g+5ml水→65mlH2SO4(grduted cylinder)10ml×1 边加边搅拌(stir)。
氨基磺酸片英国药典翻译

氨甲环酸片通则功能和使用抗纤维蛋白溶解药定义氨甲环酸片含氨甲环酸,该片剂应遵从片剂项下的规定以及下列规定。
氨甲环酸C8H15NO2的含量标示量的95.0%~105.0%鉴别取本品细分适量(约相当于氨甲环酸0.5g),加5ml水,振摇15分钟至氨甲环酸溶解,过滤,取滤液,加乙醚2ml,搅匀,再加甲醇10ml,搅匀,放置至析出结晶。
晶体干燥后,遵从下列测定。
A,其红外吸收光谱,附录ⅡA,应与氨甲环酸的对照图谱(RS344)一致B,取1ml 1%w/v的溶液,加入1ml0.2% w/v的茚三酮的甲醇溶液(96%),水浴加热2min,溶液产生深蓝紫色。
C,取0.2g溶解于10ml的5M氢氧化钠中,加0.2ml苯甲酸,剧烈摇匀10min,用2M的盐酸酸化至PH 4,过滤,用5ml乙醚洗涤残留物,在50℃, 压力2kPa 下干燥,残留物的熔点约为186℃,附录ⅤA.检查有关物质进行液相色谱法,附录Ⅲ D,使用下面的溶液(1)取本品细分适量(约相当于氨甲环酸1g),加100ml水,振摇10分钟至氨甲环酸溶解,过滤,取滤液。
(2)0.01%w/v的氨甲环酸欧洲药典标准品的水溶液。
(3)0.001%w/v的氨甲环酸杂质C的欧洲药典标准品的水溶液。
(4)0.001%w/v的4-氨甲苯酸的水溶液。
(5)1%的氨甲环酸杂质英国药典标准品的水溶液。
色谱条件(a)不锈钢柱(25cm*4.6mm),十八烷基硅烷键合硅胶填料,粒径(5μm)(hypersil柱合适)。
(b)用下面描述的流动相作为等度洗脱液。
(c)流速0.9ml/ml。
(d)室温。
(e)检测器波长220nm。
(f)进样体积20μl。
流动相取无水磷酸二氢钠11.0g,加水500ml溶解,再加三乙胺5ml和十二烷基硫酸钠1.4g,溶解,摇匀,再用2M的正磷酸调PH值至2.5,然后加水至600ml。
加甲醇400ml,摇匀。
取溶液(1)注入色谱仪,使色谱仪的运行时间等于氨甲环酸保留时间(约为13min)的3倍,由溶液(5)的色谱图和氨甲环酸杂质的英国药典标准品提供的对照图谱来鉴别杂质。
USP碳酸氢钠译文

Sodium BicarbonateNaHCO384.01Carbonic acid monosodium salt.Monosodium carbonate [144-55-8].» Sodium Bicarbonate contains not less than 99.0 percent and not more than 100.5 percent of NaHCO3, calculated on the dried basis. 以干燥品计,碳酸氢钠含量应为99.0%-100.5%Packaging and storage— Preserve in well-closed containers.包装与贮存:应密闭保存Labeling— Where Sodium Bicarbonate is intended for use in hemodialysis, it is so labeled.注释:应用于血液透析时应注明。
Identification— A solution of it meets the requirements of the tests for Sodium 191and for Bicarbonate 191.鉴别:本品的水溶液应与钠盐和碳酸氢盐的鉴别一致。
Loss on drying 731— Dry about 4 g, accurately weighed, over silica gel for 4 hours: it loses not more than 0.25% of its weight. 干燥失重:取本品约4g,精密称定,于硅胶干燥器中干燥4小时,减失重量不得过0.25%Insoluble substances— Dissolve 1 g in 20 mL of water: the resulting solution is complete and clear.不溶物质:取本品1g溶解于20ml水中,溶液应澄清。
【标准】usp原文翻译

【关键字】标准232元素杂质—限度介绍本通则明确了药品中各元素杂质的限度。
元素杂质包括催化剂、环境污染物,可能存在于原料药、赋形剂、制剂中。
这些杂质或自然产生,或有意添加,或由于不注意而引入(例如,与处理设备相互作用)。
当知道元素杂质存在,或有意添加,或有引入的可能性,应当保证这些杂质符合限度要求。
可以采用基于风险的控制策略来确保产品满足限度标准。
由于砷、镉、铅和汞普遍存在的特性,风险控制策略至少应考虑这四种元素。
不管采用什么分析方法,所有药品均应满足元素杂质限度标准。
本章提出的限度标准不适用于赋形剂与原料药,除非本章或各论中明确说明。
然而赋形剂与原料药中元素杂质水平必须报告。
本章提出的限度标准同样不适用于兽用产品和常规疫苗。
饮食补充剂和它们的成份的相关规定见于《饮食补充剂中的元素杂质》.形态分析对于元素氧化态、有机络合态、化合态的测定,称为形态分析。
每种元素可能存在不同的氧化态或络合态。
然而,砷和汞应特别关注,因为它们的无机态和络合有机态具有不同的毒性。
砷的限度标准是基于无机态(毒性最大)。
假定样品中所有砷都是无机态,可用总砷测定法检测。
当总砷法结果超过限度标准,应当使用能够对不同形态砷定量的分析方法,以确定无机态砷是否满足法定要求。
汞的限度标准是基于无机(2+)氧化态。
甲基汞(毒性最强),但对于药品,通常不是问题。
这样,汞限度标准的确定是基于汞最常见的无机形态。
对于可能含有甲基汞的产品(例如,从鱼中得到的物质),相应的汞限度标准将在各论中提及。
接触途径元素杂质的毒性跟接触程度(生物利用度)有关。
对于每一种元素杂质接触程度取决于给药途径:口服、肠外注射、吸入。
这些限度确定是基于慢性接触。
为建立标准需要,另两种给药途径,黏膜和局部接触可认为跟口服相同,而表1中的PDE值也适用于这些产品[注意—药品的给药途径在制剂通则中介绍制剂通则1151 . ]Change to read:药品表1的第二至第四栏给出的限度值是一些元素杂质的基本日剂量PDE值(病人按指定给药途径服用)。
药物分析 专业词汇中英文对照

药物分析专业词汇中英文对照绪论释药系统(drug delivery system,DDS)中国药典(Chinese Pharmacopoeia,ChP)美国药典(The United States Pharmacopoeia,USP)美国国家处方集(The National Formulary,NF)英国药典(British Pharmacopoeia,BP)欧洲药典(European Pharmacopoeia,Ph.Eup)国际药典(The International Pharmacopoeia,Ph.Int)良好药品实验研究规范(Good Laboratory Practice,GLP)良好药品生产规范(Good Manufacture Practice,GMP)良好药品供应规范(Good Supply Practice,GSP)良好药品临床试验规范(Good Clinical Practice,GCP)分析质量管理(Analytical Quality Control,AQC)第1章药物的鉴别试验药物的鉴别试验identification test一般鉴别试验general identification test专属鉴别试验specific identification test灵敏度sensitivity最低检出量minimum detectable quantity最低检出浓度minimum detectable concentration第2章药物的杂质检查巯基醋酸mercaptoacetic acid古蔡氏Gutzeit二乙基二硫代氨基甲酸银siliver diethyldithio-carbamate硫酸灰分sulphated ash炽灼残渣residue on ignition热重分析法thermogravimetric analysis,TGA差示热分析法differential thermal analysis,DTA差示扫描量热法differential scanning calorimetry,DSC碱性酒石酸铜试验Fehling’s reagent异红紫酸盐isopurpurate2,3-二氨基萘2,3-diaminonaphthalene4,5-苯并苯硒二唑4,5-benzopiazselenol第3章定量分析样品前处理与测定方法的效能指标汞齐化法amalgamation method氧瓶燃烧法oxygen flask combustion method葡萄糖醛酸甙glucuronides硫酸酯sulphates血浆plasma血清serum全血whole blood治疗药物浓度监测therapeutic drug monitoring,TDM结合bound游离free缀合物conjugate l液-液提取法liquid-liquid extraction,LLE离子对试剂ion pair reagent离子对提取法ion pair extraction method反离子counter液-固提取法liquid-solid extraction LSE半自动样品制备系统advanced automated sample processor,AASP 烷基化alkylations酰基化acylations L硅烷化silylations精密度precision标准差standard deviation,SD orS相对标准差relative standard deviation变异系数coefficient of variation,批内精密度within-run precision日内精密度within-day precision批间精密度between-run precision日间精密度day to day precision准确度accuracy定量限limit of quantitation,LOQ检测限limit of detection,LOD选择性selectivity专属性specificity线性与范围linearity and range重现性ruggedness耐用性robustness散布图scatter diagram+y r:L!z7\9^'T3l'h*M荧光偏振免疫测定法fluorescence polarization immunoassay第4章巴比妥类药物的分析溴化十六烷基三甲基苄铵cetyltrimethylbenzylammonium bromide,CTMA 氯化四癸基二甲基苄铵T etradacyldimethybenzylammonium chloride,TDBA第5章芳酸及其酯类药物的分析苯甲酸及其钠盐benzoic acid and sodium benzoate布美他尼bumetanide羟苯乙酯ethylparoben丙磺舒probenecid酚黄乙胺etamsylate第6章胺类药物的分析第7章杂环类药物的分析二硝基氯苯反应Vongerichten反应戊烯二醛反应反应第8章生物碱类药物的分析生物碱alkaloids阿片gum opium扫尾剂tailing-suppressing reagent蒂巴因thebaine诺司卡品noscapine竞争离子competing ions亲脂性lipophicity拖尾因子tailing factor金刚烷adamantane第9章维生素类药物的分析维生素vitamin去氢维生素A dehydroretinol去水维生素A anhydroretinol鲸醇kitol三氯化锑反应Carr-Price反应维生素B1 thiamine hydrochloride;盐酸硫胺2,3,5-三苯基氯化四氮唑2,3,5-triphenyltetrazolium chlorid,TTC红四氮唑red tetrazoline,RT蓝四氮唑blue tetrazoline,BT3,3’-二甲基氧苯基-双-4,4’-(3,5-二苯基)氯化四氮唑{3,3’-dianisole-bis[4,4’-(3,5-dipheny)tetrazolium chloride]}有色甲……formazan铁-酚试剂iron-phenol reagente铁-柯柏试剂iron-Kober reagent南药07药理复试题一、名词解释(5分*10)1、一级动力学消除;2、非竞争性拮抗剂;3、动作电位时程;4、前致癌物;5、初次接触效应;6、synergism;7、mutation;8、GLP;9、acute toxicity;10、uptake1。
英国药典 二氧化硅含量标准

英国药典二氧化硅含量标准全文共四篇示例,供读者参考第一篇示例:英国药典(British Pharmacopoeia)是一个权威的药品标准集,其中包含了一系列的标准和规范,确保药品的质量、安全和有效性。
在英国药典中,二氧化硅是一个常见的成分,用在许多药品和保健品中。
针对二氧化硅的含量标准,英国药典做了详细的规定,以确保药品中的二氧化硅含量符合安全标准。
二氧化硅,又称为二氧化硅,是一种无机化合物,常用作药品和化妆品中的填充剂、载体和分散剂。
在药品中,二氧化硅可以起到提高药物的稳定性、流动性和溶解性的作用。
如果二氧化硅的含量过高或者存在质量问题,可能会对药品的质量和安全性造成影响。
根据英国药典的规定,药品中二氧化硅的含量必须符合严格的标准。
具体来说,英国药典规定了二氧化硅在药品中的含量范围和检测方法。
一般来说,药品中二氧化硅的含量应当控制在合理的范围内,以保证药品的质量和安全性。
除了药品中的二氧化硅含量标准,英国药典还规定了二氧化硅的质量标准和纯度要求。
生产厂家在选用二氧化硅原料时,必须确保原料的质量符合药典标准,避免原料中含有有害物质或杂质。
生产厂家在生产过程中也必须严格控制二氧化硅的纯度,确保药品中的二氧化硅符合纯度要求。
英国药典对药品中二氧化硅的含量标准做出了详细的规定,以保证药品的质量和安全性。
生产厂家必须严格遵守这些标准,确保药品中的二氧化硅含量符合规定范围,避免对患者造成不良影响。
在今后的药品生产和监管中,我们应当密切关注英国药典的相关规定,保证药品的质量和安全性,为患者提供更好的治疗和保健服务。
【此段落(2000字)献给英国药典二氧化硅含量标准】。
第二篇示例:英国药典是世界上最有声望和权威的药典之一,它规定了药品的质量标准、成分、用途、剂量等方面的要求。
在药品生产过程中,二氧化硅是一种常见的辅助剂,用于改善药品的流动性、稳定性和分散性。
因此,对药品中二氧化硅含量进行监控是非常重要的。
英国药典对药品中二氧化硅含量的标准做了详细的规定。
USP葡萄糖译文
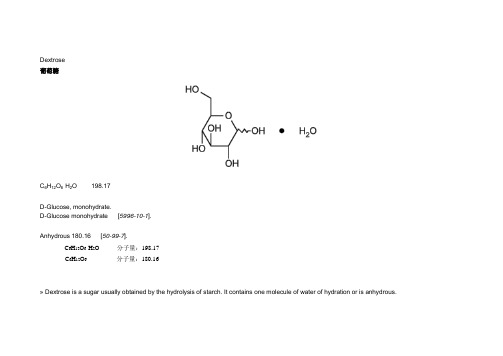
Dextrose葡萄糖C6H12O6·H2O 198.17D-Glucose, monohydrate.D-Glucose monohydrate [5996-10-1].Anhydrous 180.16 [50-99-7].C6H12O6·H2O 分子量:198.17C6H12O6分子量:180.16» Dextrose is a sugar usually obtained by the hydrolysis of starch. It contains one molecule of water of hydration or is anhydrous.葡萄糖是淀粉水解而得到的一种糖,常以一水葡萄糖或无水葡萄糖的形式存在。
Packaging and storage— Preserve in well-closed containers.包装与贮存:本品保存在密闭容器中。
Labeling— Label it to indicate whether it is hydrous or anhydrous.注释:注明其为无水状态或水合物状态。
Identification— Add a few drops of a solution (1 in 20) to 5 mL of hot alkaline cupric tartrate TS: a copious red precipitate of cuprous oxide is formed.鉴别:加本品溶液(1比20)数滴于5mL热的碱性酒石酸铜试剂中,会形成大量红色的氧化亚铜沉淀。
Color of solution— Dissolve 25 g in water to make 50.0 mL of solution: the solution has no more color than a solution prepared by mixing 1.0 mL of cobaltous chloride CS, 3.0 mL of ferric chloride CS, and 2.0 mL of cupric sulfate CS with water to make 10 mL, and diluting 3 mL of this solution with water to 50 mL. Make the comparison by viewing the solutions downward in matched color-comparison tubes against a white surface.溶液颜色:取本品25g,用水溶解配制成50mL的溶液,该溶液颜色不得深于对照液颜色(将1.0mL氯化钴溶液、3.0mL氯化铁溶液和2.0mL硫酸铜溶液混匀后用水配制成10mL,取3mL该溶液用水稀释至50mL即得到对照液)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
英国药典2012 有关物质项译文
液相色谱法(见2.2.29)
供试品溶液:取20mg本品用2mL乙腈溶解之后,用流动相A稀释至10.0mL。
对照溶液(a):去1.0mL待测溶液用流动相A稀释至100.0mL。
再取该液1.0mL 用流动相A稀释至10.0mL。
对照溶液(b):取布洛芬杂质B对照品1.0mL用乙腈稀释至10.0mL(溶液A)。
取20mg布洛芬标准品用2mL乙腈溶解,加入1.0mL溶液A,并用流动相A稀释至10.0mL。
对照溶液(c):用1mL乙腈溶解布洛芬(峰鉴别用)对照品,并用流动相A稀释至5mL。
色谱柱:
型号:l = 0.15 m, Ø = 4.6 mm;
固定相:十八烷基键合硅胶,直径5µm;
流动相:
流动相A:将0.5体积的磷酸和340体积的乙腈、600体积的水混合,平衡后用水稀释至1000体积。
流动相B:乙腈
时间(min)
流动相A
(体积百分比)
流动相B
(体积百分比)
0-25 100 0 25-55 100→15 0→85
相对保留时间:布洛芬保留时间约为21min,杂质J约为0.2min,杂质N约为0.3,杂质A约为0.9,杂质B约为1.1。
系统适应性:对照溶液(b)
峰谷比:最小值1.5;Hp为杂质B的色谱峰顶点至基线的高度,Hv为布洛芬色谱峰和杂质B色谱峰分离的最低点至基线的高度。
根据需要调整流动相A中乙腈的浓度。
限度:
杂质A、J、N:每种杂质均不超过对照溶液(a)色谱图中主成分峰面积的1.5倍(0.15%);
非特定杂质:每种杂质均不超过对照溶液(a)色谱图中主成分峰面积的0.5倍(0.05%);
总杂:不超过对照溶液(a)色谱图中主成分峰面积的2倍(0.2%);
忽略限度:对照溶液(a)色谱图中主成分峰面积的0.3倍(0.03%)。
杂质F 气相色谱法(2.2.28)- 使用常规步骤
甲基化溶液:取1mLDMF-DMA和1mL吡啶,用乙酸乙酯稀释至10mL。
供试品溶液:取本品50.0mg于密封小瓶中,用1.0mL乙酸乙酯溶解,加入1mL甲基化溶液,密封,置于烘箱100°C高温加热20min。
冷却后,室温氮气吹干,用5mL乙酸乙酯溶解残留物。
对照溶液(a):用乙酸乙酯溶解0.5mg布洛芬杂质F,稀释至10.0mL。
对照溶液(b):取50.0mg布洛芬标准品于密封小瓶中,用1.0mL对照溶液(a)溶解,加入1mL甲基化溶液,密封,置于烘箱100°C高温加热20min。
冷却后,室温氮气吹干,用5mL乙酸乙酯溶解残留物。
色谱柱:
填料:石英玻璃
规格:l = 25 m, Ø = 0.53 mm
固定相:聚乙二醇20 000(膜厚度2µm)
载气:氦
流速:5.0mL/min
温度:柱温150 °C,注射口200 °C,检测器250 °C
火焰离子化检测
进样量:1µL供试品溶液和1µL对照溶液(b)
运行时间:布洛芬保留时间的两倍
系统适应性:相对保留时间参照布洛芬(保留时间约17min),杂质F≈1.5
限度:杂质F,最高不得超过0.1%
重金属(2.4.8)
最高为10ppm
取12mL溶液S按照试验B方法进行检测。
用经甲醇稀释的铅标准溶液(100ppm Pb)制备对照溶液。
