GCP试验用相关药物或物品发放登记表
药物临床试验相关资料交接清单

本
受试者筛选入选表
份份
医疗器械发放登记表
份
受试者鉴认代码表
份
完成实验受试者编码目录表
份
受试者日记卡(如有)
份
免检单
份
其它
交接日期
年月日
交接地点
交接人签名
申办方:
专业科室:
机用申办者提供的《医疗器械临床实验相关资料交接清单》,但不得低于本中心规定的要素要求。.联系方式:机构办公室电话:联系人:马宝花、朱娜
药物临床实验相关资料交接清单
临床实验项目名称
实验方案编号
申办者
研究中心名称:
中心编号:
专业组:
主要研究者:
病历
本
表
本
知情同意书
份
研究者手册
本
受试者筛选入选表
份份
药物发放登记表
份
受试者鉴认代码表
份
完成实验受试者编码目录表
份
受试者日记卡(如有)
份
免检单
份
其它
交接日期
年月日
交接地点
交接人签名
申办方:
专业科室:
机构资料管理员确认签名日期:
备注:.可采用申办者提供的《药物临床实验相关资料交接清单》,但不得低于本中心规定的要素要求。.联系方式:机构办公室电话:联系人:马宝花、朱娜
医疗器械临床实验相关资料交接清单
临床实验项目名称
实验方案编号
申办者
研究中心名称:
中心编号:
专业组:
主要研究者:
病历
本
表
本
知情同意书
份
药物临床试验资料归档表

附件 3:药物临床试验资料归档表项目名称:项目起止时间:年月日至年月日科室:主要研究者:编号内容1CFDA 临床试验批件2药检报告3研究者手册4多方协议(已签名)(研究者、申办者、合同研究组织)5受试者补贴或检查费等发放记录6试验方案及其修正案、知情同意书、病例报告表样表7伦理委员会审批件8学术委员会审批件9临床试验有关实验室检查正常值范围10医学或实验室操作的质控证明11研究者履历及相关文件12研究者职责分工及签名样张13培训记录14监查员访视记录15受试者鉴认代码表、受试者筛选表与入选表记录16完成试验受试者编码目录17试验用药品与试验相关物资的运货单18试验用药品登记表(保管、发放及清点记录)19临床试验用药最终清点记录、申办者收回药量、记录及销毁证明20已签名的知情同意书21原始医疗文件22病例报告表(已填写,签名,注明日期)23研究者致申办者的严重不良事件报告24申办者致药品监督管理局、伦理委员会的严重不良事件申办者:有否说明□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无□有□无ICF 份□□有无□□CRF 份有无□有□无□□有无报告25 中期或年度报告□ □有 无26 临床试验总结报告□有 □无27 其他□ □有 无主要研究者签名:机构审核接收者签名:归档者签名:日期:日期:年 月 日年 月 日。
药物临床试验资料列表【模板】

伦理委员会批件(分中心伦理批件)
19
伦理委员会成员表
20
协议书(已签名复印件)
21
临床试验有关的实验室检测正常值范围
22
医学或实验室操作的质控证明
23
试验用药物的标签
24
试验用药物运送交接记录
25
试验相关物资的运送交接记录
26
设盲试验的破盲规程(如有)
27
应急信封(如有)
28
启动会培训记录29Fra bibliotek受试者筛选入选表
30
受试者签认代码表
31
试验药物发放回收记录表
32
注射用药的注射单(如有)
33
试验药物发药处方
34
参加临床试验各单位名称及联系方式
备注:
1.快速审查上述材料需要提供3套完整材料(中英文-如适用),并盖章以供备案存档使用;
2.会议审查上述材料需要提供3套完整材料(中英文-如适用),并盖章以供备案存档使用;第5、6、8、11、12项需提供与到会人数(25份)相等的副本,申请材料使用中文。
附表1.4
药物临床试验资料列表
临床试验保存文件
申请
伦理
启动
1
药物临床试验项目申请表(附表1.1)
2
临床试验项目课题组成人员说明(附表1.2)
3
研究者/PI简历(附表1.3)
4
报送资料目录
5
临床试验方案摘要、申请项目的临床前整套研究资料摘要
6
试验方案及其修正案(已签字)
7
研究者手册(及研究者手册更新件)
8
知情同意书(包括译文)及其他书面资料
9
研究病历
10
病例报告表
药物临床试验项目需要递交的资料目录
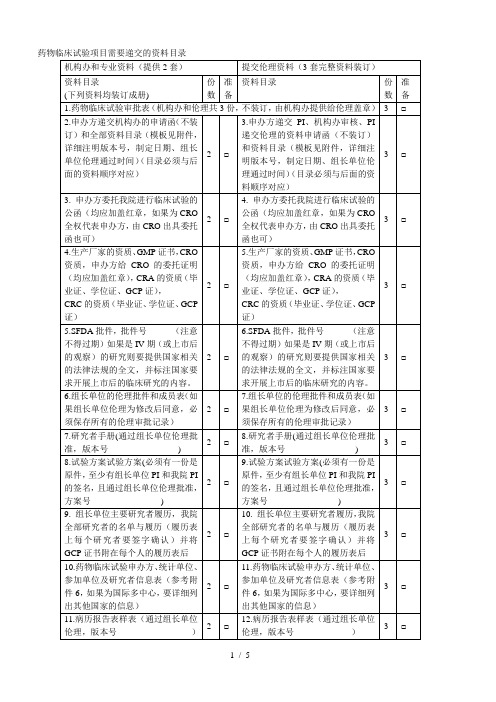
药物临床试验项目需要递交的资料目录附件2:药物临床试验申办方、统计单位、参加单位以及研究者信息表(国内项目国际多中心项目)(注:若为国际多中心项目,请先填写国际多中心的内容,国内项目可以不填)附件3:申办方前期提交机构办的备案资料封面模板试验药物名称:______________________________________药物临床试验批件号:________________________________药物临床试验方案号:________________________________我机构专业的中心号:________________________________(除项目名称用三号字居中之外,其余内容均用小四号字,1.5倍行距)项目名称(三号字,居中)青岛大学附属医院机构办备案资料手机号码:_______________________________电子邮箱:_______________________________传真;___________________________________所属部门和职务:_________________________详细通讯地址:___________________________邮政编码:_______________________________备案单位:_______________________________(加盖公章)备案单位性质:□申办方□CRO □其他________________备案时间:年月日项目名称xxxx药物临床试验资料目录资料目录请按照附件1中的目录排列,有版本号的必须注明版本号,制定日期,中心伦理通过时间.(该目录最终版本必须与相关资料顺序对起来)机构备案资料递交申请函青岛大学附属医院国家药物临床试验机构管理办公室:兹有青岛大学附属医院国家药物临床试验机构________专业申请参加一项____________________________________________________公司的多中心II期临床试验:_______________________________________________________我院为□组长单位(□参加单位),主要研究者为:__________。
文件5-药物临床试验文件清单

40
已签名的知情同意书(注意与相应时间点获EC批准的版本号一致;既往入组受试者签署新版本的ICF等)
原件
41
原始医疗文件(如研究病历或原始病历)
原件
42
病例报告表(已填写,签名,注明日期)
原件
43
研究者Hale Waihona Puke 申办者的严重不良事件报告原件
44
研究中止∕终止报告(如果存在)
原件
45
申办者和∕或研究者致药品监督管理局、伦理委员会的严重不良事件报告及其它安全性信息通告
原件
7
病例报告表(样表,版本时间和版本号)
8
知情同意书(样表,版本时间和版本号)
原件
9
受试者招募广告及其提供给受试者的书面文件
10
保险和赔偿措施或相关文件(如果适用)
原件
11
多方协议(已签名,研究者、申办者、合同研究组织)(可选)
原件
12
学术审查通知函
原件
13
组长单位中心伦理批件(如果适用)
复印件
14
54
SAE上报记录表
临床试验完成后
55
剩余试验药物退回或销毁证明
56
完成试验受试者编码目录
57
治疗分配与破盲证明
58
最终监查报告
59
最终稽查报告
60
试验完成报告(致伦理委员会国家食品药品监督管理局)
61
总结报告
原件
46
申办者致研究者的安全性信息通告(如果有)
原件
47
受试者鉴认代码表
原件
48
受试者筛选表与入选表
原件
49
试验用药品登记表(发放、回收记录;二级药库入库记录;退还/销毁记录;温湿度冰箱记录)
(模板)GCP科研药物出入库记录表

出库 数量
40 片
出库 事由
空腹 I 周期 发放
给药人
出库 结存
260 片
出库冰箱及温湿度
□1□2□3 冷藏柜
□阴凉柜温湿度:25ຫໍສະໝຸດ 、45%□1□2□3 冷藏柜
□阴凉柜
温湿度:
.
□1□2□3 冷藏柜
□阴凉柜
温湿度:
.
□1□2□3 冷藏柜
□阴凉柜
温湿度:
.
□1□2□3 冷藏柜
□阴凉柜
温湿度:
.
□1□2□3 冷藏柜
试验药物(□受试制剂 参比制剂)出/入库记录表
试验药物出入库记录表
科研药物出/入库记录表
YCSZXYY-SYZX-SOP-A007-V1.1-R02 V1.0
项目名称:
方案编号:
□预试验 □正式试验 □空腹组 □餐后组
药物名称/编号:
规格:
药物入库
储存条件:
有效期:
批号/包装号:
.
药物出库
时间
2017-09-17 09:03
注:○1 时间填写格式:2017-09-17 09:03 ○2 药物出入库数量均记录至最小单位 ○3 全名签字。
主要研究者:
.
第页
试验药物出入库记录表
YCSZXYY-SYZX-SOP-A007-V1.1-R02 V1.0
试验药物(□受试制剂 参比制剂)出/入库记录表
项目名称:
方案编号:
□预试验 □正式试验 □空腹组 □餐后组
入库 数量
300 片
入库 事由
申办方 提供
入库 结存
300 片
入库冰箱及温湿度
□1□2□3 冷藏柜
药物临床试验物资交接记录表

入选表
受试者鉴认
代码表
药物发放使用
登记表
药物临床试验物资交接记录表
项目名称: 科室:
名称 时间 数量 规格 交付人 接收人
CRF
知情同意书
原始病历 科研病历 门诊病历
日记卡
记录卡
受试者筛选
Байду номын сангаас入选表
受试者鉴认
代码表
药物发放使用
登记表
名称时间数量规格交付人接收人crf知情同意书原始病历科研病历门诊病历日记卡记录卡受试者筛选入选表受试者鉴认代码表药物发放使用登记表药物临床试验物资交接记录表项目名称
药物临床试验物资交接记录表
项目名称: 科室: 名称 时间 数量 规格 交付人 接收人
CRF
知情同意书
原始病历 科研病历 门诊病历
日记卡
记录卡
试验用药品管理基本信息表(药物)

回收药品保存条件
项目CRC联系方式
姓名: 联系电话:
公司名:
项目CRA联系方式
姓名: 联系电话:
公司名:
**市妇幼保健院药物临床试验机构JG-form-033-1.0
试验用药品管理基本信息表
试验名称
申办方
承担专业
主要研究者
相关信息
备注
药品名称、包装规格
及保存条件
计划入组例数
受试者编号规则
筛选号:
随机号:
药品编号
药品随机方法
方案规定给药日程
用法用量及注意事项
药品回收
□是(□已用空包装 □未用药品(如为注射液等是否需要统计剩余量□是 □否 □不适用))
试验用药分类_回收登记表

药物总
数量
分发总
数量
回收总
数量
剩余
数量
退回
申办者
销毁
研究者
签名/日期
申办者
签名/日期
备注:
研究者:申办者:
试验中心:试验中心地址:
药品名称:药物规格与批号:
受试者
编号
受试者
姓名
接收药品
数量
接收日期
服药时间ቤተ መጻሕፍቲ ባይዱ
服药情竞
退回数量
退回原因
回收人
签名/日期
受度者服药监督人(签名):日期:
剩余药物处置登记表
临床试验题目:
临床试验方案编号:试验中心编号:
研究者:申办者:
试验中心:试验中心地址:
药物名称
包装规格
试验用药分类/回收登记表
临床试验题目:
临床试验方案编号:试验中心编号:
研究者:申办者:
试验中心:试验中心地址:
药物名称
包装规格
与批号
分发人
签名/日期
分发日期
分发数量
接收人
签名/日期
回收数量
回收原因
回收人
签名/日期
药物总数量:分发总数量:回收总数量:剩余数量
受试者用药登记表
临床试验题目:临床试验方案编号:
GCP一级质控表格

2.是否为受试者本人签字(多份受试者签
字文书,签字式样是否有明显不同)
3.受试者签字日期是否在入组之前
4.是否有研究者的签名
5.研究者签字日期是否与受试者签字日期
相符
6.已签署的知情同意书是否交给受试者一
份
7.病例报告表的填写是否准确、完整、及
时、清晰
8.检查单是否齐全
9.病例报告表的内容是否可溯源
2.参与的申办方、主研单位、合作研究机 构是否有增加或减少
3.参与试验的研究人员是否具有 GCP 培训 证书
4.是否召开了方案培训会
5.是否明确了参与试验的研究者职责
6.发生 SAE 的报告部门和程序是否明确
7.试验用药(包括试验药物和对照药物)
是否有药检合格证明
8.研究者文件夹保存的试验方案及其修正 案是否有申办方和研究者的签名
9.研究者是否存在违反方案的行为
10.研究者是否有增加或减少
11.随机过程是否规范
12.病例入选、完成情况是否按照预期的进 度要求
13.实验室样本处理和储存是否符合要求
14.试验用药品的储存是否符合要求
二、知情同意书、CRF、原始记录的审查
审查项目
是 否 备注(NA 或具体情况)
1.所有入组受试者是否已经签署知情同意 书
转 归
以上如有严重不良事件,是否在获知 24 小时内上报 CFDA、SDFDA、卫生部医政 司医疗处、申办方及我院伦理委员会、机构办公室 □是 否(原因)
是否双盲试验 □是,是否揭盲 □否
□是□否,(如揭盲,是否遵从揭盲程序。□是 □否)
四、是否及时提交伦理委员会审查和备案
审查项目 1.方案是否修改 2.方案修改是否及时提交伦理委员会 3.知情同意书是否修改 4.知情同意书的修改是否及时提交伦理委 员会
临床试验用药物转运表

第 页/共 页
《XXXX》临床试验用药物转运表(模板三)
项目名称/研究中心
药物名称
受试者筛选号
日期
访视 周期
药物 数量 (盒)
药物编号
规格/包装 受试者缩写
时间及温度 转运开始 转运结束
接收人
转运期间 最高温 最低温
转运人
备注
版本号:院第一附属医院专用 1.0,版本日期: 年 月 日
第 页/共 页
药物二:___盒
药物一:___盒
药物二:___盒
版本号:院第一附属医院专用 1.0,版本日期: 年 月 日
接收人
转运期间 最高温 最低温
转运人
备注
第 页/共 页
《XXXX》临床试验用药物转运表(模板五)
项目名称/研究中心 药物名称 受试者筛选号
访视 数量 Biblioteka 药日期周期 [盒]药物编号
转运人
接收人
规格/包装
受试者缩写
回收日期
数量 [粒]
包装 [瓶/盒]
返还人
转运人
备注
CRC
受试者
受试者
CRC
版本号:院第一附属医院专用 1.0,版本日期: 年 月 日
第 页/共 页
《XXXX》临床试验用药物转运表(模板四)
项目名称/研究中心
受试者筛选号
日期
访视周期 药物名称及数量
受试者缩写 时间及温度
药物编号 转运开始 转运结束
药物一:___盒
药物二:___盒
药物一:___盒
药物二:___盒
药物一:___盒
药物二:___盒
药物一:___盒
药物二:___盒
药物一:___盒
GCP中心药房文件清单

销毁授权
9
其他
10
试验过程(由管理员进行记录管理)
药物的接收验收记录
11
药物储存维护记录
12
药物发放回收、使用记录
13
与科室间交接记录(如适用)
14
药物退还/销毁记录
15
录
17
其他
递交时,将此表电子档发至药物管理员邮箱。
GCP中心药房文件清单
项目编号
项目名称
专业科室
主要研究者
申办者
CRO
科室药物管理员姓名
联系方式
CRA姓名
联系方式
CRC姓名
联系方式
阶段
文件名称
备注
1
试验前(有申办者在启动前递交)
临床试验药物管理申请表
2
试验方案“药物管理”章节
3
药物研究手册、说明书
4
包装标签
5
相关SOP
6
管理表格样表
7
药物生产企业GMP证书或符合GMP声明
GCP中心药房临床试验药物器械试剂管理告知书

药/械/试剂管理信息
1.药/械/试剂名称、规格、生产厂家、保存条件(注明试验、对照或其他)
①
②
③
④
2.药/械/试剂发放规则/随机方法:
3.药/械/试剂销毁 □申办方(请将销毁复印件返回中心药房存档) □项目科室(申办方提供书面授权同意销毁文件)
4.药/械/试剂是否需要留样 □需要(如需要,请提供留样管理手册,并书面说明留样量计算过程) □不需要
填写人(申办方/CRO公司)签字及日期:
确认人(GCP中心药房)签字及日期:
GCP中心药房临床试验药物/器械/试剂管理告知书源自项目名称科室主要研究者
注意事项
1.该表填写完成签字后的扫描件需于寄送药物/器械/试剂5个工作日前发送至GCP中心药房邮箱38762349@。
2.药房只接收研究药物/研究试剂/研究器械。配套使用的试剂、耗材等请另行单独包装寄送给相应负责人员。
5.寄送药物/器械/试剂请使用正规物流或冷链公司,每一箱附有相应的装箱清单、交接单、药检报告,运送途中须有温湿度监测,监测记录可现场直接打印。
6.项目药物/器械/试剂的交接(接收与退回)均必须通过中心药房,首次接收及退回需CRA到场。
7.项目结束后机构中心药房确认所有药物/器械/试剂(除留样)已退回申办方方能关闭中心。
5.其他注意事项:
6.申办方/CRA联系方式
姓名:电话/邮箱:公司:
接收联系人
GCP中心药房药物管理员:郭老师(电话)18048532176 (邮箱)38762349@
东城根院区(I期病房)地址:成都市青羊区东城根下街24号成都市妇女儿童中心医院东城根街院区9楼GCP中心药房
中心院区(Ⅱ、Ⅲ、Ⅳ期、器械、试剂)地址:成都市青羊区日月大道1617号成都市妇女儿童中心医院儿科大楼1楼GCP中心药房
GCP部分总结

CFDA:国家食品药品监督管理局WHO:世界卫生组织ADR:药物不良反应OTC:非处方药RX:处方药CND:麻醉药品委员会PEN:处方事件监测SRS:自愿报告系统GPMSP:药品上市后监测实施标准ICH:人用药物注册技术国际协调会议ITT:意向性分析FAS:全分析集PP:符合方案集化学药品如何分类?(1)未在国内外上市销售的药品(2)改变给药途径且未在国内外上市销售的制剂(3)已在国内外上市销售但尚未在国内上市销售的药品(4)改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂(5)改变国内已上市的销售药品的剂型,但不改变给药途径的制剂(6)已有国家药品标准的原料药或者制剂新药的临床研究包括临床试验(分为I期,II期,III期,IV期)和生物等效性研究I期试验对象是健康人,试验组例数20-30例II期实验对象是病人,试验例数不少于100对III期实验对象是病人,试验例数不少于300例IV期实验对象是病人,试验例数不少于2000例试验开始前应需要对申办者什么资料进行审核?国家食品药品监督管理局的临床研究批件企业法人营业执照复印件,药品生产企业合格证复印件联系人的法人委托书原件,联系人身份证或/和工作证复印件试验药物临床前实验室资料(全套)研究者手册临床试验方案及其修正案研究病历或/和CRF知情同意书研究者履历及相关文件伦理委员会批件,伦理委员会成员签到表临床试验有关的实验室检测正常值范围表医学或实验室操作质控证明试验用药品与试验相关物资的验收单试验药物的药检证明紧急破盲信封(临时保存,试验结束时归还申办者)试验药物发放登记表必须包括哪些内容?受试者姓名代码药物编码发药日期,以及分发给每个受试者的药物数量回收剩余药物的数量药品管理员签字发生严重不良事件如何处理?医疗救治:研究者负责对受试者采取有效的处理措施和积极的救治,并决定是否中止观察破盲:必要时有主要研究者决定是否需要紧急破盲;若需要,则执行紧急破盲SOP判断因果关系:研究者应尽快判断不良事件与药物之间的因果关系记录:研究者应对严重不良事件的发生、处理情况如实、详细记录报告:研究者应立即向主要研究者、项目负责人报告.项目负责人负责在24小时内向省级及以上药品监督管理部门、省级以上卫生行政部门、临床试验组长单位的主要研究者、伦理委员会、早办者等提交快速报告。
