高效液相色谱法按分离机制的不同分为
维生素C不同的测定方法及各种方法优缺点比较

维生素C不同的测定方法及各种方法优缺点比较目前研究维生素C测定方法的有很多,如荧光法、2,6-二氯靛酚滴定法、2,4-二硝基苯肼法、光度分析法、化学发光法、电化学分析法及色谱法等,各种方法对实际样品的测定均有满意的效果。
目前国内维生素C含量测定仍以光度法为主流,但近年来色谱法,特别是HPLC 法上升趋势尤为明显。
一、荧光法1.原理样品中还原型抗坏血酸经活性炭氧化成脱氢型抗坏血酸后,与邻苯二胺(OPDA)反应生成具有荧光的喹喔啉(quinoxaline),其荧光强度与脱氢抗坏血酸的浓度在一定条件下成正比,以此测定食物中抗坏血酸和脱氢抗坏血酸的总量。
脱氢抗坏血酸与硼酸可形成复合物而不与OPDA反应,以此排除样品中荧光杂质所产生的干扰。
本方法的最小检出限为0.022 g/ml。
2.适用范围本方法适用于蔬菜、水果及其制品中总抗坏血酸的测定二、2,6-二氯靛酚滴定法(还原型VC,GB/T6195—1986)1、原理:还原型抗坏血酸还原染料2,6-二氯靛酚,该染料在酸性中呈红色,被还原后红色消失。
还原型抗坏血酸还原2,6-二氯靛酚后,本身被氧化成脱氢抗坏血酸。
在没有杂质干扰时,一定量的样品提取液还原标准2,6-二氯靛酚的量与样品中所含维生素C的量成正比。
本法用于测定还原型抗坏血酸,总抗坏血酸的量常用2,4-二硝基苯肼法和荧光分光光度法测定。
2、优点简便、快速、比较准确等,适用于许多不同类型样品的分析。
3、缺点2,6一二氯靛酚法虽然简便,但是药品价格昂贵。
而且不能直接测定样品中的脱氢抗坏血酸及结合抗坏血酸的含量,易受其他还原物质的干扰。
如果样品中含有色素类物质,将给滴定终点的观察造成困难。
三、分光光度法1、原理:维生素C在空气中尤其在碱性介质中极易被氧化成脱氢抗坏血酸,pH>5,脱氢抗坏血酸内环开裂,形成二酮古洛糖酸。
脱氢抗坏血酸,二酮古洛糖酸均能和2,4-二硝基苯肼生成可溶于硫酸的脎,脎在500nm波长有最大吸收。
高压液相色谱HPLC常见故障及排除方法[重点]
![高压液相色谱HPLC常见故障及排除方法[重点]](https://img.taocdn.com/s3/m/6e2358a11b37f111f18583d049649b6648d70936.png)
高压液相色谱HPLC常见故障及排除方法诊状(一)保留时间变化可能的原因: 解决方法1.柱温变化:柱恒温2.等度与梯度间未能充分平衡:至少用10倍柱体积的流动相平衡柱3.缓冲液容量不够:用>25mmol/L的缓冲液4.柱污染:每天冲洗柱5.柱内条件变化:稳定进样条件,调节流动相6.柱快达到寿命:采用保护柱(二)保留时间缩短可能的原因: 解决方法1.流速增加:检查泵,重新设定流速2.样品超载:降低样品量3.键合相流失:流动相PH值保持在3~7.5检查柱的方向4.流动相组成变化:防止流动相蒸发或沉淀5.温度增加:柱恒温(三)保留时间延长可能的原因: 解决方法1.流速下降:管路泄漏,更换泵密封圈,排除泵内气泡2.硅胶柱上活性点变化:用流动相改性剂,如加三乙胺,或采用碱至钝化柱3.键合相流失:同前(二)34.流动相组成变化:同前(二)45.温度降低:同前(二)5(四)出现肩峰或分叉可能的原因: 解决方法1.样品体积过大:用流动相配样,总的样品体积小于第一峰的15%2.样品溶剂过强:采用较弱的样品溶剂3.柱塌陷或形成短路通道:更换色谱柱,采用较弱腐蚀性条件4.柱内烧结不锈钢失效:更换烧结不锈钢,加在线过滤器,过滤样品5.进样器损坏:更换进样器转子(五)鬼峰可能的原因: 解决方法1.进样阀残余峰:每次用后用强溶剂清洗阀,改进阀和样品的清洗2.样品中未知物:处理样品3.柱未平衡:重新平衡柱,用流动相作样品溶剂(尤其是离子对色谱)4.三氟乙酸(TFA)氧化(肽谱) : 每天新配,用抗氧化剂5.水污染(反相) : 通过变化平衡时间检查水质量,用HPLC级的水(六)基线噪声可能的原因: 解决方法1.气泡(尖锐峰) : 流动相脱气,加柱后背压2.污染(随机噪声) : 清洗柱,净化样品,用HPLC级试剂3.检测器灯连续噪声:更换氘灯4.电干扰(偶然噪声) : 采用稳压电源,检查干扰的来源(如水浴等)5.检测器中有气泡:流动相脱气,加柱后背压(七)峰拖尾可能的原因: 解决方法1.柱超载:降低样品量,增加柱直径采用较高容量的固定相2.峰干扰:清洁样品,调整流动相3.硅羟基作用加三乙胺,用碱致钝化柱增加缓冲液或盐的浓度降低流动相PH值,钝化样品4.同前(四)4 : 同前(四)45.同前(四)3 5. : 同前(四)36.死体积或柱外体积过大:连接点降至最低,对所有连接点作合适调整,尽可能采用细内径的连接管7.柱效下降:用较低腐蚀条件,更换柱,采用保护柱(八)峰展宽可能的原因: 解决方法1.进样体积过大:同(四)12.在进样阀中造成峰扩展:进样前后排出气泡以降低扩散3.数据系统采样速率太慢:设定速率应是每峰大于10点4.检测器时间常数过大:设定时间常数为感兴趣第一峰半宽的10%5.流动相粘度过高:增加柱温,采用低粘度流动相6.检测池体积过大:用小体积池,卸下热交换器7.保留时间过长:等度洗脱时增加溶剂含量也可用梯度洗脱8.柱外体积过大:将连接管径和连接管长度降至最小9.样品过载:进小浓度小体积样品液相色谱柱使用及保养液相色谱仪由高压液体泵、检测器及液相色谱柱等三部分组成,其中液相色谱柱的正确安装和使用,是液相色谱工作的关键;也是液相色谱工作者获得正确可靠的实验数据的必经之路。
20-高效液相色谱

5. 离子色谱
其分离原理与离子交换色谱原理一样, 电导检测器检测。 问题:由于流动相都是强电解质,其电导率比 待测离子约高 2 个数量级,这种强背景电导会完
全掩盖待测离子信号。
1975年Small提出,在离子交换柱之后,再串结一根
抑制柱。该柱装填与分离柱电荷完全相反的离子交 换树脂。通过分离柱后的样品再经过抑制柱,使具 有高背景电导的流动相转变为低背景电导的流动相, 从而可用电导检测器检测各种离子的含量。
在反相色谱法中,通过调节流动相的pH,抑制样品组 分的解离,增加它在固定相中的溶解度,以达到分离 有机弱酸、弱碱的目的,称为离子抑制色谱法(ISC)
(1)适用范围 弱酸 3.0≤pKa≤ 7.0 弱碱 7.0≤pKa≤ 8.0
(2)抑制剂 弱酸(乙酸)、弱碱(氨水)或缓冲盐 (3)影响k的因素 a.与流动相的极性有关(同反相色谱) b.与流动相pH有关:弱酸 pH≤pKa k↑, tR↑ 弱碱 反之
由苯乙烯与二乙烯苯交联而成
21
20.4.2 化学键合相
化学键合固定相: 目前应用最广、性能最佳的固定相; 一般的键合相用硅胶为载体: a. 硅氧碳键型: ≡Si—O—C b. 硅氧硅碳键型:≡Si—O—Si — C (ODS)
1. 非极性键合相 键合相表面基团为非极性烃基, 如C18 、C8、 C1 和苯基等。一般用于反相色谱
33
选择流动相时应注意的几个问题
(1)尽量使用高纯度试剂作流动相,防止微量杂质长期累 积损坏色谱柱和使检测器噪声增加。 (2)使用前需要用微孔滤膜过滤,除去固体颗粒。
(3)流动相使用前最好脱气。
34
20.6 高效液相色谱仪
35
记录系统
输液系统
高效液相色谱法的分类及原理

高效液相色谱法的分类及其分离原理高效液相色谱法分为:液-固色谱法、液-液色谱法、离子交换色谱法、凝胶色谱法。
1.液-固色谱法(液-固吸附色谱法)固定相是固体吸附剂,它是根据物质在固定相上的吸附作用不同来进行分配的。
①液-固色谱法的作用机制吸附剂:一些多孔的固体颗粒物质,其表面常存在分散的吸附中心点。
流动相中的溶质分子X(液相)被流动相S带入色谱柱后,在随载液流动的过程中,发生如下交换反应:X(液相)+nS(吸附)<==>X(吸附)+nS(液相)其作用机制是溶质分子X(液相)和溶剂分子S(液相)对吸附剂活性表面的竞争吸附。
吸附反应的平衡常数K为:K值较小:溶剂分子吸附力很强,被吸附的溶质分子很少,先流出色谱柱。
K值较大:表示该组分分子的吸附能力较强,后流出色谱柱。
发生在吸附剂表面上的吸附-解吸平衡,就是液-固色谱分离的基础。
②液-固色谱法的吸附剂和流动相常用的液-固色谱吸附剂:薄膜型硅胶、全多孔型硅胶、薄膜型氧化铝、全多孔型氧化铝、分子筛、聚酰胺等。
一般规律:对于固定相而言,非极性分子与极性吸附剂(如硅胶、氧化铜)之间的作用力很弱,分配比k较小,保留时间较短;但极性分子与极性吸附剂之间的作用力很强,分配比k大,保留时间长。
对流动相的基本要求:试样要能够溶于流动相中流动相粘度较小流动相不能影响试样的检测常用的流动相:甲醇、乙醚、苯、乙腈、乙酸乙酯、吡啶等。
③液-固色谱法的应用常用于分离极性不同的化合物、含有不同类型或不;数量官能团的有机化合物,以及有机化合物的不同的异构体;但液-固色谱法不宜用于分离同系物,因为液-固色谱对不同相对分子质量的同系物选择性不高。
2.液-液色谱法(液-液分配色谱法)将液体固定液涂渍在担体上作为固定相。
①液-液色谱法的作用机制溶质在两相间进行分配时,在固定液中溶解度较小的组分较难进入固定液,在色谱柱中向前迁移速度较快;在固定液中溶解度较大的组分容易进入固定液,在色谱柱中向前迁移速度较慢,从而达到分离的目的。
高效液相色谱法(HPLC)

高效液相色谱法(HPLC) High Performance LiquidChromatography§3-1 高效液相色谱法概述一、定义以高压输出液体为流动相,以小粒径填料填充色谱柱的色谱分析方法。
高效液相色谱法是继气相色谱之后,70年代初期发展起来的一种以液体做流动相的新色谱技术.二、HPLC特点1、高压经典的液相色谱法,流动相在常压下输送,所用的固定相柱效低,分析周期长。
而现代液相色谱法中,流动相改为高压输送(150~350 ⨯105 Pa,最高输送压力可达450⨯105 Pa);2、高速由于流动相流速高,分析时间大大缩短,几min、十几min可完成一个分析任务。
3、高效HPLC色谱柱是以特殊的方法用小粒径的填料填充而成,从而使柱效大大高于经典液相色谱(每米塔板数可达几万或几十万)。
4、高灵敏度利用高灵敏度的检测器,检测灵敏度大大提高。
紫外检测器10-9g荧光检测器10-11g高效液相色谱三、液相色谱分离原理及分类液相色谱分离的实质是样品分子(以下称溶质)与溶剂(即流动相或洗脱液)以及固定相分子间的作用,作用力的大小,决定色谱过程的保留行为。
根据分离机制不同,液相色谱可分为:液固吸附色谱、液液分配色谱、化学键合相色谱、离子交换色谱以及分子排阻色谱等类型。
四、液相色谱与气相色谱的比较1、相同点(1)基本原理一致:不同组分在两相中的作用力不同。
(2)基本概念一致:基本概念:保留值、塔板数、塔板高度、分离度、选择性等与气相色谱一致。
(3)基本理论一致:塔板理论与速率方程也与气相色谱基本一致。
2、不同点由于在液相色谱中以液体代替气相色谱中的气体作为流动相,而液体和气体的有性质本质不同,因此,两种方法也有不同之处:(1)仪器设备和操作条件不同;(2)应用范围不同;气相色谱仅能分析在操作温度下能气化而不分解的物质。
对高沸点化合物、非挥发性物质、热不稳定化合物、离子型化合物及高聚物的分离、分析较为困难。
高效液相色谱法

(2)化学键合固定相 ) B. 极性键合相 极性键合相指键合有机分子 中含某些极性基团,与空白硅胶相比, 中含某些极性基团,与空白硅胶相比,其极性 键合相表面能量分布均匀,是一种改性的硅胶, 键合相表面能量分布均匀,是一种改性的硅胶, 常用的极性键合相有氨基、氰基等。 常用的极性键合相有氨基、氰基等。氨基键合 相是分离糖类最常用的固定相,常用乙腈-水 相是分离糖类最常用的固定相,常用乙腈 水
二、液相色谱的流动相
1. 流动相特性
(mobile phases of LC) )
(2)化学键合固定相 )
化学键合固定相是应用最广的色谱法。 化学键合固定相是应用最广的色谱法。将固定液的官能团键
合在载体上形成的固定相称为化学键合相,其特点是不流失, 合在载体上形成的固定相称为化学键合相,其特点是不流失, 一般认为有分配与吸附两种功能。 一般认为有分配与吸附两种功能。 a. 硅氧碳键型: 硅氧碳键型: ≡Si—O—C b. 硅氧硅碳键型:≡Si—O—Si — C 硅氧硅碳键型: 稳定,耐水、耐光、耐有机溶剂,应用最广 稳定,耐水、耐光、耐有机溶剂, c. 硅碳键型: 硅碳键型: d. 硅氮键型: 硅氮键型: ≡Si—C ≡Si—N
4.6
高效液相色谱法
高效液相色谱法(high pressure Liquid 高效液相色谱法 chromatography,HPLC)是利用物质在两 , 是利用物质在两 相之间吸附或分配的微小差异达到分离的目的。 相之间吸附或分配的微小差异达到分离的目的。 当两相作相对移动时, 当两相作相对移动时,被测物质在两相之间做 反复多次的分配, 反复多次的分配,这样使原来微小的差异产生 了很大的分离效果,达到分离、 了很大的分离效果,达到分离、分析和测定一 些理化常数的目的。 些理化常数的目的。
HPLC原理和操作详解.

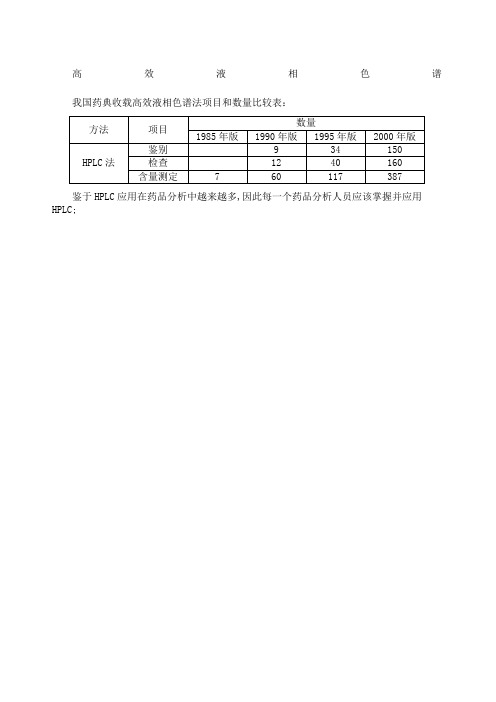
高效液相色谱我国药典收载高效液相色谱法项目和数量比较表:鉴于HPLC应用在药品分析中越来越多,因此每一个药品分析人员应该掌握并应用HPLC。
I.概论 (2)一、液相色谱理论发展简况 (2)二、HPLC的特点和优点 (2)三、色谱法分类 (3)四、色谱分离原理 (3)II.基本概念和理论 (5)一、基本概念和术语 (5)二、塔板理论 (8)三、速率理论(又称随机模型理论) (9)III.HPLC系统 (10)一、输液泵 (11)二、进样器 (13)三、色谱柱 (14)四、检测器 (17)五、数据处理和计算机控制系统 (20)六、恒温装置 (20)IV.固定相和流动相 (20)一、基质(担体) (20)二、化学键合固定相 (22)三、流动相 (23)1.流动相的性质要求 (23)2.流动相的选择 (24)3.流动相的pH值 (24)4.流动相的脱气 (25)5.流动相的滤过 (25)6.流动相的贮存 (26)7.卤代有机溶剂应特别注意的问题 (26)8.HPLC用水 (26)V.HPLC应用 (27)一、样品测定 (27)二、方法研究 (27)附件:高效液相色谱法(HPLC)复核细则 (28)一、对起草单位的要求: (28)二、对复核单位的要求: (28)I.概论一、液相色谱理论发展简况色谱法的分离原理是:溶于流动相(mobile phase)中的各组分经过固定相时,由于与固定相(stationary phase)发生作用(吸附、分配、离子吸引、排阻、亲和)的大小、强弱不同,在固定相中滞留时间不同,从而先后从固定相中流出。
又称为色层法、层析法。
色谱法最早是由俄国植物学家茨维特(Tswett)在1906年研究用碳酸钙分离植物色素时发现的,色谱法(Chromatography)因之得名。
后来在此基础上发展出纸色谱法、薄层色谱法、气相色谱法、液相色谱法。
液相色谱法开始阶段是用大直径的玻璃管柱在室温和常压下用液位差输送流动相,称为经典液相色谱法,此方法柱效低、时间长(常有几个小时)。
HPLC原理和操作详解
高效液相色谱我国药典收载高效液相色谱法项目和数量比较表:鉴于HPLC应用在药品分析中越来越多,因此每一个药品分析人员应该掌握并应用HPLC;I.概论一、液相色谱理论发展简况色谱法的分离原理是:溶于流动相mobile phase中的各组分经过固定相时,由于与固定相stationary phase发生作用吸附、分配、离子吸引、排阻、亲和的大小、强弱不同,在固定相中滞留时间不同,从而先后从固定相中流出;又称为色层法、层析法;色谱法最早是由俄国植物学家茨维特Tswett在1906年研究用碳酸钙分离植物色素时发现的,色谱法Chromatography因之得名;后来在此基础上发展出纸色谱法、薄层色谱法、气相色谱法、液相色谱法;液相色谱法开始阶段是用大直径的玻璃管柱在室温和常压下用液位差输送流动相,称为经典液相色谱法,此方法柱效低、时间长常有几个小时;高效液相色谱法High performance Liquid Chromatography,HPLC是在经典液相色谱法的基础上,于60年代后期引入了气相色谱理论而迅速发展起来的;它与经典液相色谱法的区别是填料颗粒小而均匀,小颗粒具有高柱效,但会引起高阻力,需用高压输送流动相,故又称高压液相色谱法High Pressure Liquid Chromatography,HPLC;又因分析速度快而称为高速液相色谱法High Speed Liquid Chromatography,HSLP;也称现代液相色谱;二、HPLC的特点和优点HPLC有以下特点:高压——压力可达150~300 Kg/cm2;色谱柱每米降压为75 Kg/cm2以上;高速——流速为0.1~10.0 ml/min;高效——可达5000塔板每米;在一根柱中同时分离成份可达100种;高灵敏度——紫外检测器灵敏度可达0.01ng;同时消耗样品少;HPLC与经典液相色谱相比有以下优点:速度快——通常分析一个样品在15~30 min,有些样品甚至在5 min内即可完成;分辨率高——可选择固定相和流动相以达到最佳分离效果;灵敏度高——紫外检测器可达0.01ng,荧光和电化学检测器可达0.1pg;柱子可反复使用——用一根色谱柱可分离不同的化合物;样品量少,容易回收——样品经过色谱柱后不被破坏,可以收集单一组分或做制备;三、色谱法分类按两相的物理状态可分为:气相色谱法GC和液相色谱法LC;气相色谱法适用于分离挥发性化合物;GC根据固定相不同又可分为气固色谱法GSC和气液色谱法GLC,其中以GLC应用最广;液相色谱法适用于分离低挥发性或非挥发性、热稳定性差的物质;LC同样可分为液固色谱法LSC和液液色谱法LLC;此外还有超临界流体色谱法SFC,它以超临界流体界于气体和液体之间的一种物相为流动相常用CO,因其扩散系数大,能很快达到平衡,故分析时间2短,特别适用于手性化合物的拆分;按原理分为吸附色谱法AC、分配色谱法DC、离子交换色谱法IEC、排阻色谱法EC,又称分子筛、凝胶过滤GFC、凝胶渗透色谱法GPC和亲和色谱法;此外还有电泳;按操作形式可分为纸色谱法PC、薄层色谱法TLC、柱色谱法;四、色谱分离原理高效液相色谱法按分离机制的不同分为液固吸附色谱法、液液分配色谱法正相与反相、离子交换色谱法、离子对色谱法及分子排阻色谱法;1.液固色谱法使用固体吸附剂,被分离组分在色谱柱上分离原理是根据固定相对组分吸附力大小不同而分离;分离过程是一个吸附-解吸附的平衡过程;常用的吸附剂为硅胶或氧化铝,粒度5~10μm;适用于分离分子量200~1000的组分,大多数用于非离子型化合物,离子型化合物易产生拖尾;常用于分离同分异构体;2.液液色谱法使用将特定的液态物质涂于担体表面,或化学键合于担体表面而形成的固定相,分离原理是根据被分离的组分在流动相和固定相中溶解度不同而分离;分离过程是一个分配平衡过程;涂布式固定相应具有良好的惰性;流动相必须预先用固定相饱和,以减少固定相从担体表面流失;温度的变化和不同批号流动相的区别常引起柱子的变化;另外在流动相中存在的固定相也使样品的分离和收集复杂化;由于涂布式固定相很难避免固定液流失,现在已很少采用;现在多采用的是化学键合固定相,如C18、C8、氨基柱、氰基柱和苯基柱;液液色谱法按固定相和流动相的极性不同可分为正相色谱法NPC和反相色谱法RPC;正相色谱法采用极性固定相如聚乙二醇、氨基与腈基键合相;流动相为相对非极性的疏水性溶剂烷烃类如正已烷、环已烷,常加入乙醇、异丙醇、四氢呋喃、三氯甲烷等以调节组分的保留时间;常用于分离中等极性和极性较强的化合物如酚类、胺类、羰基类及氨基酸类等;反相色谱法一般用非极性固定相如C18、C8;流动相为水或缓冲液,常加入甲醇、乙腈、异丙醇、丙酮、四氢呋喃等与水互溶的有机溶剂以调节保留时间;适用于分离非极性和极性较弱的化合物;RPC在现代液相色谱中应用最为广泛,据统计,它占整个HPLC应用的80%左右;随着柱填料的快速发展,反相色谱法的应用范围逐渐扩大,现已应用于某些无机样品或易解离样品的分析;为控制样品在分析过程的解离,常用缓冲液控制流动相的pH值;但需要注意的是,C18和C8使用的pH值通常为2.5~7.52~8,太高的pH值会使硅胶溶解,太低的pH值会使键合的烷基脱落;有报告新商品柱可在pH 1.5~10范围操作;正相色谱法与反相色谱法比较表正相色谱法反相色谱法固定相极性高~中中~低流动相极性低~中中~高从上表可看出,当极性为中等时正相色谱法与反相色谱法没有明显的界线如氨基键合固定相;3.离子交换色谱法固定相是离子交换树脂,常用苯乙烯与二乙烯交联形成的聚合物骨架,在表面未端芳环上接上羧基、磺酸基称阳离子交换树脂或季氨基阴离子交换树脂;被分离组分在色谱柱上分离原理是树脂上可电离离子与流动相中具有相同电荷的离子及被测组分的离子进行可逆交换,根据各离子与离子交换基团具有不同的电荷吸引力而分离;缓冲液常用作离子交换色谱的流动相;被分离组分在离子交换柱中的保留时间除跟组分离子与树脂上的离子交换基团作用强弱有关外,它还受流动相的pH值和离子强度影响;pH值可改变化合物的解离程度,进而影响其与固定相的作用;流动相的盐浓度大,则离子强度高,不利于样品的解离,导致样品较快流出;离子交换色谱法主要用于分析有机酸、氨基酸、多肽及核酸;4.离子对色谱法又称偶离子色谱法,是液液色谱法的分支;它是根据被测组分离子与离子对试剂离子形成中性的离子对化合物后,在非极性固定相中溶解度增大,从而使其分离效果改善;主要用于分析离子强度大的酸碱物质;分析碱性物质常用的离子对试剂为烷基磺酸盐,如戊烷磺酸钠、辛烷磺酸钠等;另外高氯酸、三氟乙酸也可与多种碱性样品形成很强的离子对;分析酸性物质常用四丁基季铵盐,如四丁基溴化铵、四丁基铵磷酸盐;,流动相为甲醇-水或乙腈-水,水中加入3~10 mmol/L的离子对色谱法常用ODS柱即C18离子对试剂,在一定的pH值范围内进行分离;被测组分保时间与离子对性质、浓度、流动相组成及其pH值、离子强度有关;5.排阻色谱法固定相是有一定孔径的多孔性填料,流动相是可以溶解样品的溶剂;小分子量的化合物可以进入孔中,滞留时间长;大分子量的化合物不能进入孔中,直接随流动相流出;它利用分子筛对分子量大小不同的各组分排阻能力的差异而完成分离;常用于分离高分子化合物,如组织提取物、多肽、蛋白质、核酸等;II.基本概念和理论一、基本概念和术语1.色谱图和峰参数色谱图chromatogram——样品流经色谱柱和检测器,所得到的信号-时间曲线,又称色谱流出曲线elution profile;基线base line——经流动相冲洗,柱与流动相达到平衡后,检测器测出一段时间的流出曲线;一般应平行于时间轴;噪音noise——基线信号的波动;通常因电源接触不良或瞬时过载、检测器不稳定、流动相含有气泡或色谱柱被污染所致;漂移drift——基线随时间的缓缓变化;主要由于操作条件如电压、温度、流动相及流量的不稳定所引起,柱内的污染物或固定相不断被洗脱下来也会产生漂移;色谱峰peak——组分流经检测器时响应的连续信号产生的曲线;流出曲线上的突起部分;正常色谱峰近似于对称形正态分布曲线高斯Gauss曲线;不对称色谱峰有两种:前延峰leading peak和拖尾峰tailing peak;前者少见;拖尾因子tailing factor,T——T=,用以衡量色谱峰的对称性;也称为对称因子symmetry factor或不对称因子asymmetry factor;中国药典规定T应为0.95~1.05;T <0.95为前延峰,T>1.05为拖尾峰;峰底——基线上峰的起点至终点的距离;峰高peak height,h——峰的最高点至峰底的距离;峰宽peak width,W——峰两侧拐点处所作两条切线与基线的两个交点间的距离;W =4σ半峰宽peak width at half-height,Wh/2——峰高一半处的峰宽;Wh/2=2.355σ标准偏差standard deviation,σ——正态分布曲线x=±1时拐点的峰宽之半;正常峰的拐点在峰高的0.607倍处;标准偏差的大小说明组分在流出色谱柱过程中的分散程度;σ小,分散程度小、极点浓度高、峰形瘦、柱效高;反之,σ大,峰形胖、柱效低;峰面积peak area,A——峰与峰底所包围的面积;A=×σ×h=2.507 σ h=1.064 Wh/2h2.定性参数保留值死时间dead time,t——不保留组分的保留时间;即流动相溶剂通过色谱柱的时间;在反相HPLC中可用苯磺酸钠来测定死时间;死体积dead volume,V——由进样器进样口到检测器流动池未被固定相所占据的空间;它包括4部分:进样器至色谱柱管路体积、柱内固定相颗粒间隙被流动相占据,Vm 、柱出口管路体积、检测器流动池体积;其中只有Vm参与色谱平衡过程,其它3部分只起峰扩展作用;为防止峰扩展,这3部分体积应尽量减小;V0=F×tF为流速保留时间retention time,tR——从进样开始到某个组分在柱后出现浓度极大值的时间;保留体积retention volume,VR——从进样开始到某组分在柱后出现浓度极大值时流出溶剂的体积;又称洗脱体积;VR =F×tR调整保留时间adjusted retention time,t'R——扣除死时间后的保留时间;也称折合保留时间reduced retention time;在实验条件温度、固定相等一定时,t'R只决定于组分的性质,因此,t'R 或tR可用于定性;t'R=tR-t调整保留体积adjusted retention volume,V'R ——扣除死体积后的保留体积;V'R=VR -V或V'R=F×t'R3.柱效参数理论塔板数theoretical plate number,N——用于定量表示色谱柱的分离效率简称柱效;N取决于固定相的种类、性质粒度、粒径分布等、填充状况、柱长、流动相的种类和流速及测定柱效所用物质的性质;如果峰形对称并符合正态分布,N可近似表示为:N=2=162=5.542N为常量时,W随tR成正比例变化;在一张多组分色谱图上,如果各组分含量相当,则后洗脱的峰比前面的峰要逐渐加宽,峰高则逐渐降低;用半峰宽计算理论塔数比用峰宽计算更为方便和常用,因为半峰宽更易准确测定,尤其是对稍有拖尾的峰;N与柱长成正比,柱越长,N越大;用N表示柱效时应注明柱长,如果未注明,则表示柱长为1米时的理论塔板数;一般HPLC柱的N在1000以上;若用调整保留时间t'R 计算理论塔板数,所得值称为有效理论塔板数N有效或Neff;理论塔板高度theoretical plate height,H——每单位柱长的方差;H=;实际应用时往往用柱长L和理论塔板数计算:H=,H有效=;4.相平衡参数分配系数distribution coefficient,K——在一定温度下,化合物在两相间达到分配平衡时,在固定相与流动相中的浓度之比;K=;分配系数与组分、流动相和固定相的热力学性质有关,也与温度、压力有关;在不同的色谱分离机制中,K有不同的概念:吸附色谱法为吸附系数,离子交换色谱法为选择性系数或称交换系数,凝胶色谱法为渗透参数;但一般情况可用分配系数来表示;在条件流动相、固定相、温度和压力等一定,样品浓度很低时Cs 、Cm很小时,K只取决于组分的性质,而与浓度无关;这只是理想状态下的色谱条件,在这种条件下,得到的色谱峰为正常峰;在许多情况下,随着浓度的增大,K减小,这时色谱峰为拖尾峰;而有时随着溶质浓度增大,K也增大,这时色谱峰为前延峰;因此,只有尽可能减少进样量,使组分在柱内浓度降低,K恒定时,才能获得正常峰;在同一色谱条件下,样品中K值大的组分在固定相中滞留时间长,后流出色谱柱;K值小的组分则滞留时间短,先流出色谱柱;混合物中各组分的分配系数相差越大,越容易分离,因此混合物中各组分的分配系数不同是色谱分离的前提;在HPLC中,固定相确定后,K主要受流动相的性质影响;实践中主要靠调整流动相的组成配比及pH值,以获得组分间的分配系数差异及适宜的保留时间,达到分离的目的;容量因子capacity factor,k——化合物在两相间达到分配平衡时,在固定相与流动相中的量之比;k=;因此容量因子也称质量分配系数;分配系数、容量因子与保留时间之间有如下关系:k===K=,t'R =k t;上式说明容量因子的物理意义:表示一个组分在固定相中停留的时间t'R 是不保留组分保留时间t的几倍;k=0时,化合物全部存在于流动相中,在固定相中不保留,t'R=0;k越大,说明固定相对此组分的容量越大,出柱慢,保留时间越长;容量因子与分配系数的不同点是:K取决于组分、流动相、固定相的性质及温度,而与体积Vs 、Vm无关;k除了与性质及温度有关外,还与Vs、Vm有关;由于t'R、t较Vs、Vm易于测定,所以容量因子比分配系数应用更广泛;选择性因子selectivity factor,α——相邻两组分的分配系数或容量因子之比;α==设k2>k1;因k=t'R/t,则α=,所以α又称为相对保留时间美国药典;要使两组分得到分离,必须使α≠1;α与化合物在固定相和流动相中的分配性质、柱温有关,与柱尺寸、流速、填充情况无关;从本质上来说,α的大小表示两组分在两相间的平衡分配热力学性质的差异,即分子间相互作用力的差异;5.分离参数分离度resolution,R——相邻两峰的保留时间之差与平均峰宽的比值;也叫分辨率,表示相邻两峰的分离程度;R=;当W1=W2时,R=;当R=1时,称为4σ分离,两峰基本分离,裸露峰面积为95.4%,内侧峰基重叠约2%;R=1.5时,称为6σ分离,裸露峰面积为99.7%;R≥1.5称为完全分离;中国药典规定R应大于1.5;基本分离方程——分离度与三个色谱基本参数有如下关系:R=××其中称为柱效项,为柱选择性项,为柱容量项;柱效项与色谱过程动力学特性有关,后两项与色谱过程热力学因素有关;从基本分离方程可看出,提高分离度有三种途径:①增加塔板数;方法之一是增加柱长,但这样会延长保留时间、增加柱压;更好的方法是降低塔板高度,提高柱效;②增加选择性;当α=1时,R=0,无论柱效有多高,组分也不可能分离;一般可以采取以下措施来改变选择性:a. 改变流动相的组成及pH值;b. 改变柱温;c. 改变固定相;③改变容量因子;这常常是提高分离度的最容易方法,可以通过调节流动相的组成来实现;k2趋于0时,R也趋于0;k2增大,R也增大;但k2不能太大,否则不但分离时间延长,而且峰形变宽,会影响分离度和检测灵敏度;一般k2在1~10范围内,最好为2~5,窄径柱可更小些;二、塔板理论1.塔板理论的基本假设塔板理论是Martin和Synger首先提出的色谱热力学平衡理论;它把色谱柱看作分馏塔,把组分在色谱柱内的分离过程看成在分馏塔中的分馏过程,即组分在塔板间隔内的分配平衡过程;塔板理论的基本假设为:1 色谱柱内存在许多塔板,组分在塔板间隔即塔板高度内完全服从分配定律,并很快达到分配平衡;2 样品加在第0号塔板上,样品沿色谱柱轴方向的扩散可以忽略;3 流动相在色谱柱内间歇式流动,每次进入一个塔板体积;4 在所有塔板上分配系数相等,与组分的量无关;虽然以上假设与实际色谱过程不符,如色谱过程是一个动态过程,很难达到分配平衡;组分沿色谱柱轴方向的扩散是不可避免的;但是塔板理论导出了色谱流出曲线方程,成功地解释了流出曲线的形状、浓度极大点的位置,能够评价色谱柱柱效;2.色谱流出曲线方程及定量参数峰高h和峰面积A根据塔板理论,流出曲线可用下述正态分布方程来描述:C=e 或C=e由色谱流出曲线方程可知:当t=tR 时,浓度C有极大值,Cmax=;Cmax就是色谱峰的峰高;因此上式说明:①当实验条件一定时即σ一定,峰高h与组分的量C进样量成正比,所以正常峰的峰高可用于定量分析;②当进样量一定时,σ越小柱效越高,峰高越高,因此提高柱效能提高HPLC分析的灵敏度;由流出曲线方程对V0~∞求积分,即得出色谱峰面积A=×σ×Cmax =C;可见A相当于组分进样量C0,因此是常用的定量参数;把Cmax=h和Wh/2=2.355σ代入上式,即得A=1.064×Wh/2×h,此为正常峰的峰面积计算公式;三、速率理论又称随机模型理论1.液相色谱速率方程1956年荷兰学者Van Deemter等人吸收了塔板理论的概念,并把影响塔板高度的动力学因素结合起来,提出了色谱过程的动力学理论——速率理论;它把色谱过程看作一个动态非平衡过程,研究过程中的动力学因素对峰展宽即柱效的影响;后来Giddings和Snyder等人在Van Deemter方程H=A+B/u+Cu,后称气相色谱速率方程的基础上,根据液体与气体的性质差异,提出了液相色谱速率方程即Giddings方程:H=2λdp++\s\up 52p+\s\up 52p+\s\up 52f 2.影响柱效的因素1涡流扩散eddy diffusion;由于色谱柱内填充剂的几何结构不同,分子在色谱柱中的流速不同而引起的峰展宽;涡流扩散项A=2λdp ,dp为填料直径,λ为填充不规则因子,填充越不均匀λ越大;HPLC常用填料粒度一般为3~10μm,最好3~5μm,粒度分布RSD≤5%;但粒度太小难于填充均匀λ大,且会使柱压过高;大而均匀球形或近球形的颗粒容易填充规则均匀,λ越小;总的说来,应采用细而均匀的载体,这样有助于提高柱效;毛细管无填料,A =0;2分子扩散molecular diffusion;又称纵向扩散;由于进样后溶质分子在柱内存在浓度梯度,导致轴向扩散而引起的峰展宽;分子扩散项B/u=2γDm/u;u为流动相线速度,分子在柱内的滞留时间越长u小,展宽越严重;在低流速时,它对峰形的影响较大;Dm为分子在流动相中的扩散系数,由于液相的Dm很小,通常仅为气相的10-4~10-5,因此在HPLC中,只要流速不太低的话,这一项可以忽略不计;γ是考虑到填料的存在使溶质分子不能自由地轴向扩散,而引入的柱参数,用以对Dm进行校正;γ一般在0.6~0.7左右,毛细管柱的γ=1;3传质阻抗mass transfer resistance;由于溶质分子在流动相、静态流动相和固定相中的传质过程而导致的峰展宽;溶质分子在流动相和固定相中的扩散、分配、转移的过程并不是瞬间达到平衡,实际传质速度是有限的,这一时间上的滞后使色谱柱总是在非平衡状态下工作,从而产生峰展宽;液相色谱的传质阻抗项Cu又分为三项;①流动相传质阻抗Hm =Cmd2pu/Dm,Cm为常数;这是由于在一个流路中流路中心和边缘的流速不等所致;靠近填充颗粒的流动相流速较慢,而中心较快,处于中心的分子还未来得及与固定相达到分配平衡就随流动相前移,因而产生峰展宽;②静态流动相传质阻抗Hsm =Csmd2pu/Dm,Csm为常数;这是由于溶质分子进入处于固定相孔穴内的静止流动相中,晚回到流路中而引起峰展宽;Hsm对峰展宽的影响在整个传质过程中起着主要作用;固定相的颗粒越小,微孔孔径越大,传质阻力就越小,传质速率越高;所以改进固定相结构,减小静态流动相传质阻力,是提高液相色谱柱效的关键;H m 和Hsm都与固定相的粒径平方d2p 成正比,与扩散系数Dm成反比;因此应采用低粒度固定相和低粘度流动相;高柱温可以增大Dm,但用有机溶剂作流动相时,易产生气泡,因此一般采用室温;③固定相传质阻抗Hs =Csd2fu/Ds液液分配色谱,Cs为常数,df为固定液的液膜厚度,Ds为分子在固定液中的扩散系数;在分配色谱中Hs 与df的平方成正比,在吸附色谱中Hs与吸附和解吸速度成反比;因此只有在厚涂层固定液、深孔离子交换树脂或解吸速度慢的吸附色谱中,Hs 才有明显影响;采用单分子层的化学键合固定相时Hs可以忽略;从速率方程式可以看出,要获得高效能的色谱分析,一般可采用以下措施:①进样时间要短;②填料粒度要小;③改善传质过程;过高的吸附作用力可导致严重的峰展宽和拖尾,甚至不可逆吸附;④适当的流速;以H对u作图,则有一最佳线速度uopt,在此线速度时,H最小;一般在液相色谱中,uopt很小大约0.03~0.1mm/s,在这样的线速度下分析样品需要很长时间,一般来说都选在1mm/s的条件下操作;⑤较小的检测器死体积;3.柱外效应速率理论研究的是柱内峰展宽因素,实际在柱外还存在引起峰展宽的因素,即柱外效应色谱峰在柱外死空间里的扩展效应;色谱峰展宽的总方差等于各方差之和,即:σ2=σ2柱内+σ2柱外+σ2其它柱外效应主要由低劣的进样技术、从进样点到检测池之间除柱子本身以外的所有死体积所引起;为了减少柱外效应,首先应尽可能减少柱外死体积,如使用“零死体积接头”连接各部件,管道对接宜呈流线形,检测器的内腔体积应尽可能小;研究表明柱外死体积之和应<VR/;其次,希望将样品直接进在柱头的中心部位,但是由于进样阀与柱间有接头,柱外效应总是存在的;此外,要求进样体积≤VR/2;柱外效应的直观标志是容量因子k小的组分如k<2峰形拖尾和峰宽增加得更为明显;k大的组分影响不显着;由于HPLC的特殊条件,当柱子本身效率越高N越大,柱尺寸越小时,柱外效应越显得突出;而在经典LC中则影响相对较小;III.HPLC系统HPLC系统一般由输液泵、进样器、色谱柱、检测器、数据记录及处理装置等组成;其中输液泵、色谱柱、检测器是关键部件;有的仪器还有梯度洗脱装置、在线脱气机、自动进样器、预柱或保护柱、柱温控制器等,现代HPLC仪还有微机控制系统,进行自动化仪器控制和数据处理;制备型HPLC仪还备有自动馏分收集装置;最早的液相色谱仪由粗糙的高压泵、低效的柱、固定波长的检测器、绘图仪,绘出的峰是通过手工测量计算峰面积;后来的高压泵精度很高并可编程进行梯度洗脱,柱填料从单一品种发展至几百种类型,检测器从单波长至可变波长检测器、可得三维色谱图的二极管阵列检测器、可确证物质结构的质谱检测器;数据处理不再用绘图仪,逐渐取而代之的是最简单的积分仪、计算机、工作站及网络处理系统;目前常见的HPLC仪生产厂家国外有Waters公司、Agilent公司原HP公司、岛津公司等,国内有大连依利特公司、上海分析仪器厂、北京分析仪器厂等;一、输液泵1.泵的构造和性能。
高效液相色谱和气相色谱的异同点范文

高效液相色谱和气相色谱的异同点不同点:一、流动相不同:HPLC为液体流动相,GC为永久性气体作流动相(通常叫做载气)二、进样器不同:高效液相为平头进样针,气相色谱为尖头进样针三、色谱柱长不同:(1)气相色谱柱通常几米到几十米(气相色谱由于载气的相对分析量较低,分子间隙大,故粘度低,流动性好,组分在气相中流动速度快,因此可以增加柱长,以提高柱效)。
(2)液相色谱柱通常为几十到几百毫米四、分析种类有差异:气相色谱分析的对象多为(不适绝对):分子质量小于1000,低沸点,易挥发,热稳定性好的化合物。
液相色谱:更适用于分析高沸点,难挥发,热稳定性差,分子质量较大(1000 - -2000)的液体化合物。
五:样品柱前变化不同:气相色谱的样品在柱前必须变为气体(气化室汽化),而液相色谱的样品在柱前则无变化。
六、所用检测器有差异:液相主要为:紫外检测器,荧光检测器、示差折光检测器.....气相色谱主要为:氢火焰离子化检测器(FID),热导检测器(TCD),电子捕获检测器(ECD),火焰光度检测器(FPD),氮磷检测器(NPD).....相同点:基本原理相同。
都是利用物质在流动相和固定相中的分配系数的差别,从而在两相间反复多次(1000-次,甚至更多)的分配,使原来分配系数差别很小的各组分分离开来。
Owen发现异卵双生牛的天然免疫耐受现象(1945),明确自身识别问题,伯耐特(Burnet,1949)提出免疫耐受理论,梅德华(Medawar,1953)实验证实胚胎期耐受理论。
耶那(Jerne,1955)提出天然抗体选择学说,完成免疫网络学说(1974),伯耐特等(Burnet & Talmage, 1957)完善克隆选择学说等免疫防御(immunologic 抗感染defense)免疫稳定(immunologic 消除炎症或衰老细胞homeostasis)免疫监视(immunologic 控制癌变细胞surveilance)1.高压:液相色谱法以液体为流动相(称为载液),液体流经色谱柱,受到阻力较大,为了迅速地通过色谱柱,必须对载液施加高压。
高效液相色谱法的常见问题及解决方法

高效液相色谱法的常见问题及解决方法高效液相色谱法按分离机制的不同分为液固吸附色谱法、液液分配色谱法(正相与反相)、离子交换色谱法、离子对色谱法及分子排阻色谱法,这些方法在使用的过程中往往会遇到诸如鬼峰、基线漂移、拖尾、分叉峰、保留时间漂移、柱压过高等系列问题,如何解决这些问题呢?1.用HPLC进行分析时保留时间有时发生漂移,有时发生快速变化,原因何在?如何解决?关于漂移问题:①温度控制不好,解决方法是采用恒温装置,保持柱温恒定;②流动相发生变化,解决办法是防止流动相发生蒸发、反应等;③柱子未平衡好,需对柱子进行更长时间的平衡;关于快速变化问题①流速发生变化,解决办法是重新设定流速,使之保持稳定;②泵中有气泡,可通过排气等操作将气泡赶出;③流动相不合适,解决办法为改换流动相或使流动相在控制室内进行适当混合;2.液相色谱中峰出现拖尾或出现双峰的原因是什么?①筛板堵塞或柱失效,解决办法是反向冲洗柱子,替换筛板或更换柱子;②存在干扰峰,解决办法为使用较长的柱子,改换流动相或更换选择性好的柱子;③可能柱超载,减少进样量;3.HPLC灵敏度不够的主要原因及解决办法①样品量不足,解决办法为增加样品量;②样品未从柱子中流出。
可根据样品的化学性质改变流动相或柱子;③样品与检测器不匹配。
根据样品化学性质调整波长或改换检测器;④检测器衰减太多。
调整衰减即可;⑤检测器时间常数太大,解决办法为降低时间参数;⑥检测器池窗污染。
解决办法为清洗池窗;⑦检测池中有气泡。
解决办法为排气;⑧记录仪测压范围不当。
调整电压范围即可;⑨流动相流量不合适。
调整流速即可;⑩检测器与记录仪超出校正曲线。
解决办法为检查记录仪与检测器,重作校正曲线。
4.做HPLC分析时,柱压不稳定,原因何在?如何解决?①泵内有空气,解决的办法是清除泵内空气,对溶剂进行脱气处理;②比例阀失效,更换比例阀即可;③泵密封垫损坏,更换密封垫即可;④溶剂中的气泡,解决的办法是对溶剂脱气,必要时改变脱气方法;⑤系统检漏,找出漏点,密封即可;⑥梯度洗脱,这时压力波动是正常的。
乙醇的测定

乙醇含量的测定通常情况下乙醇含量的测定有以下几种方法:乙醇含量的测定,目前多采用蒸馏后附温比重瓶法、比重计测定法、气相色谱法、高效液相色谱法、电位法、极谱法、分光光度法、红外光谱法、荧光法、化学发光法、氧化还原滴定法、酒精计测量法等氧化还原滴定法是指在酸性条件下用重铬酸钾氧化试样中的乙醇,再用硫酸亚铁铵滴定过量的重铬酸钾,根据重铬酸钾的加入量和硫酸亚铁铵的消耗量计算试样中的乙醇含量。
比色法是指在蒸馏出的馏出液中加入重铬酸钾及硫酸,乙醇被氧化成乙酸而六价铬被还原成三价铬,从而使得溶液颜色由黄色变为绿色,借以用比色法测定。
气相色谱法一般色谱条件色谱柱:HP一5 15m×0.53mm ×1.5u m色谱柱温度:160℃进样口温度:220℃FID检测器温度:250℃柱流量:1ml/min;柱流量+尾吹流量=30ml/min进样方式:分流,分流比为5:1载气:N2;燃烧气H2:40ml/min;助燃气Air:400ml/min顶空瓶加热温度:65℃;定量环温度:130℃;传输管路温度:130℃定量环体积(进样体积):lml比重法比重是指一物质量与同体积同温度纯水质量的比值比重瓶法一般步骤:取洁净、干燥精密称量的比重瓶,装满样品后,置20℃水浴中浸0.5小时,使内容物的温度达到20℃,盖上瓶盖,并用细滤纸条吸去支管标线上的样品,盖好小帽后取出,用滤纸将比重瓶外擦干,置天平室内0.5小时,称量。
再将样品倾出,洗净比重瓶,装满水,以下按上述自“置20℃水浴中浸0.5小时”起依法操作。
比重瓶内不能有气泡,天平室内温度不能超过20℃,否则不能使用此法。
比重计法是采用均匀悬浮体进行沉降分析,被测悬浮液中的颗粒常可视为连续分布。
经过一定沉降时间t后,上层有一层澄清介质,其厚度相当于最小粒径Dmin 的深度hmin,由hmin向下,浓度呈逐渐增加的分布。
在某一定深度h以上的范围内,凡粒径大于与此h相对应的D的颗粒都不复存在。
高效液相色谱法的主要类型及其分离原理

高效液相色谱法的主要类型及其分离原理高效液相色谱法是在经典色谱法的基础上,引用了气相色谱的理论,在技术上,流动相改为高压输送(最高输送压力可达4.9´107Pa);色谱柱是以特殊的方法用小粒径的填料填充而成,从而使柱效大大高于经典液相色谱(每米塔板数可达几万或几十万);同时柱后连有高灵敏度的检测器,可对流出物进行连续检测。
特点1.高压:液相色谱法以液体为流动相(称为载液),液体流经色谱柱,受到阻力较大,为了迅速地通过色谱柱,必须对载液施加高压。
一般可达150~350×105Pa。
2. 高速:流动相在柱内的流速较经典色谱快得多,一般可达1~10ml/min。
高效液相色谱法所需的分析时间较之经典液相色谱法少得多,一般少于1h 。
3. 高效:近来研究出许多新型固定相,使分离效率大大提高。
4.高灵敏度:高效液相色谱已广泛采用高灵敏度的检测器,进一步提高了分析的灵敏度。
如荧光检测器灵敏度可达10-11g。
另外,用样量小,一般几个微升。
5.适应范围宽:气相色谱法与高效液相色谱法的比较:气相色谱法虽具有分离能力好,灵敏度高,分析速度快,操作方便等优点,但是受技术条件的限制,沸点太高的物质或热稳定性差的物质都难于应用气相色谱法进行分析。
而高效液相色谱法,只要求试样能制成溶液,而不需要气化,因此不受试样挥发性的限制。
对于高沸点、热稳定性差、相对分子量大(大于400 以上)的有机物(这些物质几乎占有机物总数的75% ~80% )原则上都可应用高效液相色谱法来进行分离、分析。
据统计,在已知化合物中,能用气相色谱分析的约占20%,而能用液相色谱分析的约占70~80%。
高效液相色谱按其固定相的性质可分为高效凝胶色谱、疏水性高效液相色谱、反相高效液相色谱、高效离子交换液相色谱、高效亲和液相色谱以及高效聚焦液相色谱等类型。
用不同类型的高效液相色谱分离或分析各种化合物的原理基本上与相对应的普通液相层析的原理相似。
高效液相色谱的分离原理

高效液相色谱的分离原理高效液相色谱(High Performance Liquid Chromatography,HPLC)的分离原理主要基于溶质在液相和固相之间的分配行为。
液相色谱将样品溶解在流动相中,然后将其通过填充在色谱柱中的固定相。
溶质与液相和固相之间的相互作用导致在带电痕迹下,样品分子以不同的速度从柱中通过。
分离的原理主要有以下几种方式:1. 亲水性分离:在正常相液相色谱中,固定相一般为疏水膜,溶液中的极性分子会更加倾向于溶解在溶剂中。
相反,非极性分子会更倾向于与固相相互作用。
这样的分离机制适用于众多生物大分子或通过多重氢键与固相相互作用的有机化合物。
2. 反相分离:反相液相色谱(Reverse Phase Liquid Chromatography, RPLC)使用疏水固定相和极性溶剂,溶液中的极性溶质会聚集在固相上,而非极性溶质会倾向于与溶剂混合。
反相分离常用于氢键作用或极性分子之间的相互作用较强的有机化合物。
3. 离子交换分离:它基于离子交换剂与待测物溶解在流动相中,通过与其成键分离。
该方法特别适用于离子性化合物的分离,其中固定相常常是带有交换活性基团(例如磺酸基团或羧酸基团)的阴离子交换树脂或阳离子交换树脂。
4. 大孔态或凝胶态分离:为了分离较大的生物大分子,如蛋白质或多肽,常常使用大孔体积更大的色谱柱和凝胶固相。
这种类型的色谱有助于减小溶质分子的限制,以实现更好的分离效果。
总的来说,高效液相色谱的分离原理是通过溶质与液相和固相之间的分配行为来实现的,不同的分离机制适用于不同类型的化合物和分析目的。
商业HPLC仪器通常配备了多种柱和固定相,以提供灵活的操作,以满足不同类型的分离需求。
HPLC原理和操作详解

高效液相色谱我国药典收载高效液相色谱法项目和数量比较表:鉴于HPLC应用在药品分析中越来越多,因此每一个药品分析人员应该掌握并应用HPLC。
I.概论2一、液相色谱理论发展简况2二、HPLC的特点和优点3三、色谱法分类4四、色谱分离原理4II.基本概念和理论7一、基本概念和术语7二、塔板理论13三、速率理论(又称随机模型理论)15III.HPLC系统18一、输液泵18二、进样器23三、色谱柱24四、检测器29五、数据处理和计算机控制系统35六、恒温装置36IV.固定相和流动相36一、基质(担体)37二、化学键合固定相39三、流动相421.流动相的性质要求422.流动相的选择433.流动相的pH值444.流动相的脱气455.流动相的滤过466.流动相的贮存477.卤代有机溶剂应特别注意的问题478.HPLC用水47V.HPLC应用48一、样品测定48二、方法研究50附件:高效液相色谱法(HPLC)复核细则50一、对起草单位的要求:50二、对复核单位的要求:51I.概论一、液相色谱理论发展简况色谱法的分离原理是:溶于流动相(mobile phase)中的各组分经过固定相时,由于与固定相(stationary phase)发生作用(吸附、分配、离子吸引、排阻、亲和)的大小、强弱不同,在固定相中滞留时间不同,从而先后从固定相中流出。
又称为色层法、层析法。
色谱法最早是由俄国植物学家茨维特(Tswett)在1906年研究用碳酸钙分离植物色素时发现的,色谱法(Chromatography)因之得名。
后来在此基础上发展出纸色谱法、薄层色谱法、气相色谱法、液相色谱法。
液相色谱法开始阶段是用大直径的玻璃管柱在室温和常压下用液位差输送流动相,称为经典液相色谱法,此方法柱效低、时间长(常有几个小时)。
高效液相色谱法(High performance Liquid Chromatography,HPLC)是在经典液相色谱法的基础上,于60年代后期引入了气相色谱理论而迅速发展起来的。
高效液相色谱法的分类及其分离原理[整理版]
![高效液相色谱法的分类及其分离原理[整理版]](https://img.taocdn.com/s3/m/4d564a5cce84b9d528ea81c758f5f61fb7362837.png)
高效液相色谱法的分类及其分离原理高效液相色谱法分为:液-固色谱法、液-液色谱法、离子交换色谱法、凝胶色谱法。
1.液-固色谱法(液-固吸附色谱法)固定相是固体吸附剂,它是根据物质在固定相上的吸附作用不同来进行分配的。
①液-固色谱法的作用机制吸附剂:一些多孔的固体颗粒物质,其表面常存在分散的吸附中心点。
,流动相中的溶质分子X(液相)被流动相S带入色谱柱后,在随载液流动的过程中,发生如下交换反应:,X(液相)+nS(吸附)<==>X(吸附)+nS(液相),其作用机制是溶质分子X(液相)和溶剂分子S(液相)对吸附剂活性表面的竞争吸附。
,吸附反应的平衡常数K为:,K值较小:溶剂分子吸附力很强,被吸附的溶质分子很少,先流出色谱柱。
,K值较大:表示该组分分子的吸附能力较强,后流出色谱柱。
,发生在吸附剂表面上的吸附-解吸平衡,就是液-固色谱分离的基础。
②液-固色谱法的吸附剂和流动相常用的液-固色谱吸附剂:薄膜型硅胶、全多孔型硅胶、薄膜型氧化铝、全多孔型氧化铝、分子筛、聚酰胺等。
一般规律:对于固定相而言,非极性分子与极性吸附剂(如硅胶、氧化铜)之间的作用力很弱,分配比k较小,保留时间较短;但极性分子与极性吸附剂之间的作用力很强,分配比k大,保留时间长。
对流动相的基本要求:,试样要能够溶于流动相中,流动相粘度较小,流动相不能影响试样的检测常用的流动相:甲醇、乙醚、苯、乙腈、乙酸乙酯、吡啶等。
③液-固色谱法的应用常用于分离极性不同的化合物、含有不同类型或不;数量官能团的有机化合物,以及有机化合物的不同的异构体;但液-固色谱法不宜用于分离同系物,因为液-固色谱对不同相对分子质量的同系物选择性不高。
2.液-液色谱法(液-液分配色谱法)将液体固定液涂渍在担体上作为固定相。
①液-液色谱法的作用机制溶质在两相间进行分配时,在固定液中溶解度较小的组分较难进入固定液,在色谱柱中向前迁移速度较快;在固定液中溶解度较大的组分容易进入固定液,在色谱柱中向前迁移速度较慢,从而达到分离的目的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
现代的色谱分析方法在分离效率、分离和分析有 机结合操作过程的自动化方面作了很大的改进。其中 包括气相色谱法和高效液相色谱法两大类,它们已成 为分离分析工作中最重要的方法。
反相色谱法 一般用非极性固定相, 流动相为水或缓冲液,常加入甲醇、 乙腈、异丙醇、丙酮、四氢呋喃等与 水互溶的有机溶剂以调节保留时间。 适用于分离非极性和极性较弱的化合 物。RPC在现代液相色谱中应用最为 广泛,据统计,它占整个HPLC应用 的80%左右。
3.离子交换色谱法 固定相是离子交换树脂,缓 冲液常用作离子交换色谱的流动相。离子交换色 谱法主要用于分析有机酸、氨基酸、多肽及核酸。
色谱法的分离原理是:溶于流动相 (mobile phase)中的各组分经过固定相 时,由于与固定相(stationary phase) 发生作用(吸附、分配、离子吸引、 排阻、亲和)的大小、强弱不同,在 固定相中滞留时间不同,从而先后从 固定相中流出。又称为色层法、层析 法
http://202.112.154.83/zskj/2006/movin
gs/50503.swf
高效液相色谱法按分离机制的不同 分为: ▪液固吸附色谱法 ▪液液分配色谱法(正相与反相) ▪离子交换色谱法 ▪离子对色谱法 ▪分子排阻色谱法
1.液固色谱法 使用固体吸附剂, 被分离组分在色谱柱上分离原理是根 据固定相对组分吸附力大小不同而分 离。分离过程是一个吸附-解吸附的 平衡过程。常用的吸附剂为硅胶或氧 化铝,粒度5~10μm。适用于分离分 子量200~1000的组分,大多数用于非 离子型化合物,离子型化合物易产生 拖尾。常用于分离同分异构体。
4.离子对色谱法 离子对色谱法常用ODS柱(即 C18 ) , 流 动 相 为 甲 醇 - 水 或 乙 腈 - 水 , 水 中 加 入 3~10 mmol/L的离子对试剂,在一定的pH值范围内 进行分离。
5.排阻色谱法 固定相是有一定孔径的多孔性填 料,流动相是可以溶解样品的溶剂。小分子量的 化合物可以进入孔中,滞留时间长;大分子量的 化合物不能进入孔中,直接随流动相流出。幻灯 片3
1.4 操作步骤 提取:将样品粉碎,称取5.0-10.0g于具塞
三角瓶中,加50ml水,电动振荡器振荡30分钟 后,调节pH至中性,定容至100ml;,抽滤,弃 去初滤液10ml,剩余滤液再经微孔膜(0.45μ) 过滤,滤液待用。 测定:分别取标准溶液及样品提取液注入高效 液相色谱,进行色谱分析, 根据保留时间及峰面积定 性、定量。色谱分析
HPLC有以下特点:
高压——压力可达150~300 Kg/cm2。色谱柱每米降压为75 Kg/cm2 以上。
高速——流速为0.1~10.0 ml/min。
高效——可达5000塔板每米。在一根柱中同时分离成份可达100种
高灵敏度——紫外检测器灵敏度可达0.01ng。同时消耗样品少。 HPLC与经典液相色谱相比有以下优点:
HPLC鉴于HPLC应用在药品分析中越来越多,因此每一个药品 分析人员应该掌握并应用HPLC。
一、液相色谱理论发展简况
二、色谱分离原理
三、HPLC的特点和优点
四、实例应用:高效最早是由俄国植 物学家茨维特(Tswett) 在1906年研究用碳酸钙 分离植物色素时发现的, 色谱法(Chromatography) 因之得名。FLASH后来在此基础 上发展出纸色谱法、薄层色谱法、 气相色谱法、液相色谱法。幻灯
速度快——通常分析一个样品在15~30 min,有些样品甚至在5 min 内即可完成分辨率高,选择固定相和流动相以达到最佳分离效果。
灵敏度高——紫外检测器可达0.01ng,荧光和电化学检测器可达 0.1pg
柱子可反复使用——用一根色谱柱可分离不同的化合物。
样品量少,容易回收——样品经过色谱柱后不被破坏,可以收集单 一组分或做制备。幻灯片 3
2.液液色谱法 使用将特定的液态物质涂 于担体表面,或化学键合于担体表面而形成 的固定相,分离原理是根据被分离的组分在 流动相和固定相中溶解度不同而分离。分离 过程是一个分配平衡过程。
正相色谱法 采用极性固定相,流动相 为相对非极性的疏水性溶剂(烷烃类如 正已烷、环已烷),常加入乙醇、异丙 醇、四氢呋喃、三氯甲烷等以调节组分 的保留时间。
高效液相色谱法
液相色谱法开始阶段是用大直径的 玻璃管柱在室温和常压下用液位差输送流动相,称为经典液 相色谱法,此方法柱效低、时间长(常有几个小时)。高效 液相色谱法(High performance Liquid Chromatography, HPLC)是在经典液相色谱法的基础上,于60年代后期引入了 气相色谱理论而迅速发展起来的。它与经典液相色谱法的区 别是填料颗粒小而均匀,小颗粒具有高柱效,但会引起高阻 力,需用高压输送流动相,故又称高压液相色谱法(High Pressure Liquid Chromatography,HPLC)。又因分析速度 快而称为高速液相色谱法(High Speed Liquid Chromatography,HSLP)。也称现代液相色谱。
荧光增白剂是卫生部严令禁止在食品 中添加的制癌性物质。对混在面粉、 面粉改良剂、面粉快速发酵粉等和食 品添加剂中的检验、国家有定性及限 量方法,但操作复杂,耗时长,为此, 我们建立了简便、快捷、灵敏度较好 的高效液相色谱法
1 材料与方法 1.1 仪器:美国WATERS公司高效 液相色谱仪,UV——468紫外检 测器,510泵,2010工作软件,SEP——PAKEL柱 1.2 试剂:1 荧光增白剂标准液33号0.1g,加 水 溶 解 , 定 容 至 100mL , ( 含 荧 光 增 白 剂 1.0mg/ml)2 棕色瓶中保存使用时吸取上述标 准溶液10 mL,置于100 mL容量瓶中,加水稀释 至刻度(相当于0.1 mg/ml荧光增白剂)3 甲醇 1.3 仪器条件:流动相100%甲醇,测定波长 365nm;流速灵敏度1.0AUFS
