葡聚糖凝胶使用说明
葡聚糖凝胶 Sephadex LH20 使用说明及使用心得

问:分得效果不是很好,上了有 8 毫升的样,我用甲醇洗脱,结果用 约一个保留体积就洗完了,东西不仅越分越少,而且仍然和没上柱之前差 不多,很让人困惑,郁闷。
了 1g 干态的,Sephadex LH20 对不同溶剂中的保留体积: water 2.1ml MeOH 1.9ml EtOH 1.8ml CHCl3 1.6ml n-BuOH 1.6ml 丙酮 0.8ml 乙酸乙酯 0.4ml 甲苯 0.2ml
2 "还有是不是样品的溶解是不是要与洗脱的起使浓度相同?如何确定样品 在最佳配比的容液中溶呢?"
不要着急,实验是一点一点做出来的,刚开始总是困难的.首先我要说 的是 Sephadex LH20 不是万能的,你的样品不一定适于用它分离,
1 "结果用约一个保留体积就洗完了",这很正常,这也是 Sephadex LH20 这种填料的特点:"洗脱体积一般为 2-3 个保留体积,对特殊保留强的化合 物,可洗脱 5 个保留体积",
3. 样品的处理和洗脱溶剂的选择。
如果样品极性大,选用反相溶剂洗脱(甲醇--水),样品用最少体积 的甲醇--水(尽可能甲醇少一些)溶解,过滤后,湿法上样(必须要进 行过滤!否则把 Sephadex LH-20 堵塞,就必须将 Sephadex LH-20 的柱头 部分弃去,造成不必要的浪费)。
如果样品极性小,这选用正相溶剂洗脱(氯仿--甲醇),样品用最少 体积的氯仿--甲醇溶解,过滤后,湿法上样。
当然有影响,Sephadex LH20 在不同的溶剂中的吸涨程度是不同的(任何 填料都是这样,只是 Sephadex LH20 很明显),一般在丙酮,乙酸乙酯 中收 缩很厉害,所以一般不用丙酮,乙酸乙酯 作溶剂,如果前后使用的两种洗脱 溶剂对 Sephadex LH20 的吸涨程度相差很大,还会产生大量气泡.以下列举
葡聚糖凝胶G-25的使用方法

葡聚糖凝胶柱的使用方法:(1) 预处理称取Sephadex G-25(50-100目)约5g,加入蒸馏水100ml,置室温下3h进行溶胀。
(2) 装柱凝胶层析柱的直径与柱长之比一般为1:15。
柱的底部用装有细玻璃管的橡皮塞塞紧,用洗净的玻璃丝(约200目尼龙布)垫底或购买类似规格的商品柱。
然后将柱垂直安装好,先加入1/3柱体积蒸馏水,接着将溶胀好的凝胶边搅匀边连续装入,使它们在柱内自然沉降。
同时大开下口慢速流出蒸馏水。
装柱后的凝胶必须均匀,不能有气泡或明显条纹。
否则,必须到出重装,装好后,用蒸馏水平衡2-3h即可加样品分离。
(3) 加样加样前,首先把柱内凝胶上面多余的蒸馏水放出,直到柱内液面与凝胶表面相齐(或留一极薄液层)为止。
然后,由柱的上端加水解液2ml,注意不要让溶液把凝胶冲松浮起,加完样品后,打开下口缓慢放出液体至液面与凝胶面相齐,再用少量蒸馏水冲洗原来盛样品的容器2-3次,待全部进入层析柱后,即可进行洗脱。
(4) 洗脱与收集洗脱时,用蒸馏水作洗脱剂,并且要连续不断地进行,使凝胶柱上端保持一定的液层,防止凝胶柱表面的液体流干。
本实验洗脱液流出的速度应控制在0.8-1.0ml/min。
洗脱液的收集采用分管连续顺序收集,每管收集3ml,共收集10管。
据经验,4或5号管核苷酸浓度最大,可作为层析鉴定的样品液。
但因层析柱长度的差异,管号会有变化,必要时可用紫外检测A260nm,找出浓度最大的管号。
(5) 凝胶的再生和回收凝胶柱使用一次后,必须反冲疏松一次,平衡后再使用。
若使用数次,就需要再生处理。
用0.1mol/L NaOH-0.5mol/L NaCl溶液浸泡,然后用蒸馏水洗至中性备用。
若实验完毕,将再生后的凝胶在布氏漏斗上用蒸馏水洗涤抽干,再用95%乙醇洗两次,在60℃烘箱中烘干,回收保存。
实验五. 葡聚糖凝胶层析【实验目的】1.掌握葡聚糖凝胶的特性及凝胶层析的原理。
2.学习葡聚糖凝胶层析的基本操作技术。
丙烯葡聚糖凝胶安全操作及保养规程

丙烯葡聚糖凝胶安全操作及保养规程前言丙烯葡聚糖凝胶是医学领域广泛应用的一种生物材料,其具有良好的生物相容性和生物活性,可用于组织工程、药物缓释等多个领域。
然而,由于其操作和使用相对较为特殊,若操作不当或保存不当,则可能导致材料的质量下降甚至失效,危及人体健康。
因此,在丙烯葡聚糖凝胶的操作和保养过程中,必须进行严格的监控和规范化管理。
为此,本文档将详细介绍丙烯葡聚糖凝胶的安全操作及保养规程,以确保其安全、稳定、有效地使用。
安全操作规程1. 人员要求丙烯葡聚糖凝胶的操作和使用应由具有相关技术资质和工作经验的人员负责。
具体要求如下:•操作人员应具备相关学科知识和临床经验,熟悉生物材料的特性和使用方法。
•操作人员应遵守医疗器械管理规定,定期接受培训并持证上岗。
•操作人员应具备良好的人际交往、沟通、协调和领导能力,确保操作过程中的安全和稳定。
2. 操作环境要求丙烯葡聚糖凝胶的操作应在洁净、整洁、无尘、无菌的操作室内进行。
具体要求如下:•操作室应符合整洁、卫生、无尘、无菌的要求,地面、墙壁、器具和工作台面等应定期清洁、消毒。
•操作室内应保持适宜的温度和湿度,且应有良好的通风系统。
•操作室内应配备必要的器具和设备,如无菌操作箱、无菌过滤器、离心机、电子天平、显微镜等。
3. 操作要求丙烯葡聚糖凝胶的操作应根据规程进行,注意操作顺序和操作时间,避免操作失误或污染。
具体要求如下:•操作前应认真阅读操作说明书,了解操作流程和注意事项。
•操作前应彻底洗手,并配备个人防护用具,如手套、口罩、帽子等。
•操作时应严格按照操作步骤进行,避免操作失误或污染,特别是注意操作时间和仪器设备的消毒清洁。
•操作完成后应立即清理器具和仪器设备,保持操作室内干净整洁。
保养规程1. 易损部件保养丙烯葡聚糖凝胶的易损部件主要包括无菌操作箱、离心机、无菌过滤器等,这些器具在长时间使用过程中,由于多次清洗和消毒等原因,易产生磨损、老化等现象,影响使用性能。
g-10葡聚糖凝胶色谱柱使用

g-10葡聚糖凝胶色谱柱使用
G-10葡聚糖凝胶色谱柱是一种常用的分离和纯化生物大分子
的柱子,特别适用于分离寡聚糖和多糖混合物。
该柱子采用葡聚糖作为固定相,具有一定的孔隙大小和分子筛效果。
G-10葡聚糖凝胶色谱柱通常用于分离多糖、寡糖和其他大分
子化合物。
在使用之前,需要将柱子进行激活和平衡,具体步骤如下:
1. 将G-10葡聚糖凝胶色谱柱放入柱子支撑架上,并连接到色
谱系统上。
2. 将适当的缓冲液(如适应于样品的缓冲液)通过柱子进行激活,以去除可能存在的杂质和污染物。
3. 进行柱子平衡:将适当的缓冲液通过柱子流经,直到柱子和系统达到平衡状态。
4. 加载样品:将待分离的样品按照柱子载样方法加载到柱子上。
5. 进行色谱分离:根据需要,控制缓冲液的流速和浓度梯度,使待分离的目标化合物在柱子上进行分离。
6. 收集分离物:根据其他方法(如按时间段收集、检测波长等)进行分离物收集和检测。
值得注意的是,G-10葡聚糖凝胶色谱柱通常用于相对较小的
生物大分子分离,如寡聚糖和多糖,对于更大分子的分离可能需要使用其他类型的色谱柱。
此外,在操作过程中需要根据具体样品的特性和需要进行柱子条件的调整。
LH-20使用说明书
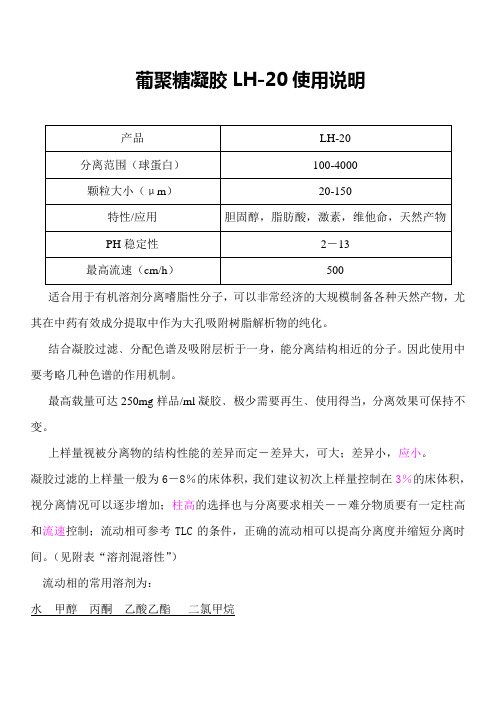
葡聚糖凝胶LH-20使用说明
适合用于有机溶剂分离嗜脂性分子,可以非常经济的大规模制备各种天然产物,尤其在中药有效成分提取中作为大孔吸附树脂解析物的纯化。
结合凝胶过滤﹑分配色谱及吸附层析于一身,能分离结构相近的分子。
因此使用中要考略几种色谱的作用机制。
最高载量可达250mg样品/ml凝胶﹑极少需要再生﹑使用得当,分离效果可保持不变。
上样量视被分离物的结构性能的差异而定-差异大,可大;差异小,应小。
凝胶过滤的上样量一般为6-8%的床体积,我们建议初次上样量控制在3%的床体积,视分离情况可以逐步增加;柱高的选择也与分离要求相关――难分物质要有一定柱高和流速控制;流动相可参考TLC的条件,正确的流动相可以提高分离度并缩短分离时间。
(见附表“溶剂混溶性”)
流动相的常用溶剂为:
水甲醇丙酮乙酸乙酯二氯甲烷
上述溶剂的极性依次降低,对带有极性的被分离物而言,保留值和分离度依次递增;同理选用的凝胶柱高可依次降低,流速可以增大(或上样量可以增加)。
使用方法:将干粉浸泡于60—70%乙醇中过夜(充分搅拌),洗去可能存在的残留物,抽干然后湿态装柱,动态用一倍柱体积的60—70%乙醇淋洗,再用水洗净乙醇即根据自己选用的流动相体系平衡、上样
LH-20在不同溶剂中的溶胀性能:
溶剂混溶性表。
葡聚糖凝胶75的操作方法

葡聚糖凝胶75的操作方法葡聚糖凝胶75是一种常用的凝胶材料,适用于生物学分离、电泳、柱层析等实验。
下面是葡聚糖凝胶75的详细操作方法。
1. 材料准备- 一定量的葡聚糖凝胶75。
根据实验需要,确定所需凝胶的重量。
- 缓冲溶液。
根据实验需要,选择合适的缓冲溶液,并按照实验方案调制好。
- 试管或实验室常规操作用品。
2. 准备葡聚糖凝胶- 将葡聚糖凝胶75取出,称取所需重量,放入一个干净的容器中。
3. 膨胀葡聚糖凝胶- 在称量容器中,加入足够的缓冲溶液,使葡聚糖凝胶逐渐膨胀,在液体中悬浮。
- 注意需加入的液体量,以保证膨胀后的葡聚糖凝胶具有所需的性质。
4. 筛选葡聚糖凝胶- 等待膨胀约30分钟,葡聚糖凝胶会逐渐膨胀并在液体中扩散。
- 使用数个试管架,每个试管架上插入一根取下的注射器针头,将其作为筛选葡聚糖凝胶的框架。
- 将膨胀的葡聚糖凝胶倒入筛选框架中,允许其自由流动并同时通过针头间的缝隙中流出。
- 这一步的目的是去除空气泡,并筛选出凝胶颗粒均匀、没有结块的葡聚糖凝胶。
5. 保存和激活- 将筛选后的葡聚糖凝胶用缓冲溶液保存,避免葡聚糖凝胶干燥。
- 如需激活葡聚糖凝胶,将其置于适当的缓冲溶液中,加入一定浓度的盐类或其他激活剂,并在较高温度(通常为60-80C)下固化一段时间,以激活葡聚糖凝胶。
6. 实验操作- 根据实验需求,将激活后的葡聚糖凝胶放入柱层析设备中。
- 将样品加入柱中,并使用缓冲溶液洗脱,或者使用适当的溶液进行柱层析。
- 注意柱层析过程中的操作,避免葡聚糖凝胶碎裂或溢出。
7. 结果分析- 根据实验的结果,可以通过检测样品组分的移动速率、表型等参数,进行结果的分析和解释。
葡聚糖凝胶75的操作方法主要包括材料准备、膨胀葡聚糖凝胶、筛选葡聚糖凝胶、保存和激活、实验操作以及结果分析等步骤。
每一步操作都需要仔细严谨,以确保实验的准确性和重复性。
葡聚糖凝胶操作方法

【实验目的】1.掌握葡聚糖凝胶的特性及凝胶层析的原理。
2.学习葡聚糖凝胶层析的基本操作技术。
【实验原理】凝胶层析又称分子排阻层析或凝胶过滤,是以被分离物质的分子量差异为基础的一种层析分离技术,这一技术为纯化蛋白质等生物大分子提供了一种非常温和的分离方法。
层析的固定相载体是凝胶颗粒,目前应用较广的是:具有各种孔径范围的葡聚糖凝胶(Sephadex)和琼脂糖凝胶(Sepharose)。
葡聚糖凝胶是由直链的葡聚糖分子和交联剂3—氯1,2—环氧丙烷交联而成的具有多孔网状结构的高分子化合物。
凝胶颗粒中网孔的大小可通过调节葡聚糖和交联剂的比例来控制,交联度越大,网孔结构越紧密;交联度越小,网孔结构就越疏松,网孔的大小决定了被分离物质能够自由出入凝胶内部的分子量范围。
可分离的分子量范围从几百到几十万不等。
葡聚糖凝胶层析,是使待分离物质通过葡聚糖凝胶层析柱,各个组分由于分子量不相同,在凝胶柱上受到的阻滞作用不同,而在层析柱中以不同的速度移动。
分子量大于允许进入凝胶网孔范围的物质完全被凝胶排阻,不能进入凝胶颗粒内部,阻滞作用小,随着溶剂在凝胶颗粒之间流动,因此流程短,而先流出层析柱;分子量小的物质可完全进入凝胶颗粒的网孔内,阻滞作用大,流程延长,而最后从层析柱中流出。
若被分离物的分子量介于完全排阻和完全进入网孔物质的分子量之间,则在两者之间从柱中流出,由此就可以达到分离目的。
本实验以葡聚糖凝胶G—25作为固定相载体,来分离蓝色葡聚糖—2000和溴酚蓝。
蓝色葡聚糖—2000分子量接近2×106,而溴酚蓝分子量为670,二者分子量相差较大,前者完全排阻,而后者则可完全进入凝胶颗粒网孔内,二者通过层析柱的时间不同而分开。
【实验材料】1.实验器材层析柱(1×20cm)附有一小段乳胶管及螺旋夹;洗脱液瓶(带下口的三角瓶,250m1);试管及试管架;量筒10m1;721型分光光度计2.实验试剂(1) Tris—醋酸缓冲液(pH7.0):取0.0lmol/L Tris溶液(含0.1mol/L KCl)900ml,用浓醋酸调pH至7.0,加蒸馏水至1000m1。
葡聚糖凝胶G系列使用说明手册

葡聚糖凝胶使用说明Sephadex Gel Manuals1化学和物理性质葡聚糖凝胶是一种珠状的凝胶,含有大量的羟基,很容易在水中和电解质溶液中溶胀。
G型的葡聚糖凝胶有各种不同的交联度,因此它们的溶胀度和分级分离范围也有所不同。
葡聚糖凝胶的溶胀度基本上不因盐和洗涤剂的存在而受影响。
葡聚糖凝胶有不同的粒度。
超细级的葡聚糖凝胶是用于需要极高分辨率的柱色谱和薄层色谱。
粗级和中级的凝胶用于制备性色谱过程,可在较低的压力下获得较高的流速。
另外,粗级也可用于批量工艺。
1.1化学稳定性葡聚糖凝胶不溶于一切溶剂(除非它被化学降解)。
它在水、盐溶液、碱和弱酸性溶液中都是稳定的,在强酸中凝胶骨架的糖苷键被水解。
长期接触氧化剂将破坏凝胶,因而应避免使用。
1.2物理稳定性葡聚糖凝胶并不熔融,可以在湿态、中性PH进行灭菌。
干态的凝胶加热至120℃以上将开始焦糖化。
葡聚糖凝胶的机械强度取决于交联度。
2产品说明名称分离范围(球蛋白)应用葡聚糖凝胶G-10<700缓冲液交换、脱盐,分离小分子,去除小分子葡聚糖凝胶G-15<1500缓冲液交换、脱盐,分离小分子,去除小分子葡聚糖凝胶G-251000-5000工业上脱盐及交换缓冲液葡聚糖凝胶G-501000-30000多肽分离、脱盐、清洗生物提取液、分子量测定葡聚糖凝胶G-752000-70000蛋白分离纯化、分子量测定、平衡常数测定葡聚糖凝胶G-1002000-120000蛋白分离纯化、分子量测定、平衡常数测定葡聚糖凝胶G-1505000-300000蛋白分离纯化、分子量测定、平衡常数测定葡聚糖凝胶G-2005000-600000蛋白分离纯化、分子量测定、平衡常数测定3使用方法3.1乙醇浸泡在室温下,将干粉浸泡于50-60%乙醇中至少24小时,并不断搅拌以保证凝胶溶胀,用无盐水洗去残存的乙醇滤干。
3.2无盐水浸泡室温下,在无盐水中充分溶胀24小时,间隙搅拌,以保证凝胶的完全溶胀。
葡聚糖凝胶使用说明

葡聚糖凝胶使用说明1.葡聚糖凝胶的制备2.葡聚糖凝胶的特性-生物相容性好:葡聚糖是一种天然产物,具有良好的生物相容性,不会产生免疫反应。
-可调节性强:葡聚糖凝胶的凝胶特性可以通过改变制备方法、葡聚糖浓度和pH值等条件来调节,以满足不同应用的需要。
-凝胶稳定性好:葡聚糖凝胶具有较好的物理稳定性和化学稳定性,能够在一定条件下保持凝胶状态。
-良好的保水性:葡聚糖凝胶具有良好的保水性能,可用作保湿剂,防止水分的蒸发。
-微生物阻隔性:葡聚糖凝胶的网络结构可以起到一定的微生物阻隔效果,可应用于医疗和食品包装等领域。
3.葡聚糖凝胶的应用3.1医疗应用-创面敷料:葡聚糖凝胶具有良好的吸附性和保湿性能,可用于制备创面敷料,促进伤口愈合。
-药物载体:葡聚糖凝胶的网状结构可以将药物包裹在其中,用于制备药物缓释系统。
-组织工程:葡聚糖凝胶可用作细胞培养的基质材料,用于组织工程的研究和临床应用。
3.2食品应用-增稠剂:葡聚糖凝胶可作为增稠剂添加到食品中,改善食品的口感和质感。
-稳定剂:葡聚糖凝胶具有良好的稳定性,可以作为乳化剂和稳定剂添加到食品中,延长食品的保质期。
-包装材料:葡聚糖凝胶的微生物阻隔性能可以应用于食品包装材料,起到保鲜的作用。
3.3化妆品应用-保湿剂:葡聚糖凝胶可用作化妆品中的保湿剂,增加产品的保湿性能。
-凝胶基质:葡聚糖凝胶可作为凝胶基质,在其中悬浮其他活性成分,提高产品的稳定性和渗透性。
-敏感肌肤护理:葡聚糖凝胶具有良好的生物相容性,可用于敏感肌肤的护理产品中,减少刺激和过敏反应。
3.4农业应用-保水剂:葡聚糖凝胶可用作土壤保水剂,改善土壤的水分状况,提高植物的生长。
-植物保护剂:葡聚糖凝胶可作为植物保护剂的载体,将其包裹在凝胶中,减少化学农药的使用量。
总结:葡聚糖凝胶具有许多优异的特性,广泛应用于医疗、食品、化妆品和农业等领域。
在使用葡聚糖凝胶时,需要根据具体的应用要求选择适当的制备方法和条件,并在应用过程中注意遵守相关的法律法规和安全操作规程,以确保产品的质量和安全性。
葡聚糖凝胶 G-50 Medium 使用说明书

葡聚糖凝胶G-50 Medium使用说明书为确保产品的性能和无忧的操作,使用前请仔细阅读本手册,有任何疑问请咨询本公司售后技术支持或销售人员。
1. 产品介绍葡聚糖凝胶G-50 Medium是一种凝胶过滤层析介质(也叫体积排阻色谱),适用于生物分子的脱盐、缓冲液置换、组群分离、精细纯化。
特点如下:a. 经典的葡聚糖介质,选择性好。
b. 生物大分子(>30kDa)的快速脱盐和缓冲液置换(一步完成)。
c. G-50 Medium,可用于组群分离和杂质的去除(以排阻限30kDa为分界点)。
d. G-50 Fine,可用于小分子蛋白的分离纯化(1.5-30kDa)。
表1:性能参数2.选择2.1 介质级别的选择a. 快速脱盐、缓冲液置换、组群分离和杂质的去除:选择G-50 Medium,粒径大、流速快。
b. 小分子蛋白分离纯化:选择G-50 Fine,粒径小、分辨率高。
2.2 层析柱的选择a. 快速脱盐、缓冲液置换、组群分离和杂质的去除(上样量可达到30%CV):选择粗短型层析柱(柱床高度低,例如XK 16/20),流速快、周期短。
b. 小分子蛋白分离纯化(上样量为0.5%-4%CV):选择细长型层析柱(柱床高度高,例如XK 16/70),柱效高、分辨率好。
备注:CV指柱体积。
3. 使用3.1 溶胀取一定量的干粉,加入过量的纯化水(缓冲液:干粉≥20ml:1g),在室温(25℃)溶胀24小时或沸水浴溶胀3小时。
备注:溶胀过程中可进行柔和的搅拌,杜绝使用高速或剧烈的搅拌方式(例如磁力搅拌等)。
3.2 清洗待介质自然沉降后,小心的倒出上清液(包括极少量没有溶胀好的干粉和一些漂浮的小颗粒介质),再加入3-5倍体积的纯化水进行重悬。
重复此步骤5次。
备注:用于清洗产品中残留的微量有机试剂和碱性物质。
3.3 重悬在清洗好的介质中加入一定量的缓冲液(缓冲液:介质=1:3),用玻璃棒或其它搅拌装置柔和搅拌3-5分钟。
葡聚糖凝胶的操作方法

葡聚糖凝胶的操作方法
1.将葡聚糖凝胶粉末放入1.5ml离心管中,并加入所需的培养基或溶液(通常是0.1M PBS缓冲液)
2.用紫外灯或消毒灯照射管子和粉末,以杀菌消毒。
3.将管子在室温下静置15分钟,使凝胶充分水解。
4.在使用前,用无菌过滤器或离心管转运转移液体中的小颗粒或杂质。
5.将细胞或材料悬浮在凝胶中,并快速转移和组装需要的实验器具(如培养皿、培养板等)。
6.将实验器具放置在37的恒温箱中,使凝胶在液体中固定并形成3D结构。
7.根据实验的需要,可以选择添加细胞营养物质或生长因子等,以促进细胞的生长和分化。
8.在实验结束后,可以用酶解剂将凝胶中的细胞和材料溶解,并收集并分离细胞和其他成分,进行后续的分析和研究。
葡聚糖凝胶

(1)预处理称取葡聚糖凝胶(有不同型号)若干克,加入洗脱剂(通常为甲醇或者水,这里以甲醇为例)约20倍凝胶量,置室温下3h进行溶胀,溶胀必须彻底,否则会使上柱后流速变慢,凝胶断裂等。
(2) 装柱凝胶层析柱的直径与柱长之比一般为1:15。
柱的底部用装有细玻璃管的橡皮塞塞紧,用洗净的玻璃丝(约200目尼龙布)垫底或购买类似规格的商品柱。
然后将柱垂直安装好,接着将溶胀好的凝胶边搅匀边缓缓连续装入,色谱柱的出口流速m维持在5~10ml/min。
凝胶颗粒沉积到柱底后关紧色谱柱,等沉降到1-2cm时再2打开色谱柱。
直至降到满意高度为止,等凝胶柱内的液体留的与凝胶高度差不多时,用较小的滤纸盖住凝胶床表面,再用洗脱剂洗脱过夜。
装柱后的凝胶必须均匀,不能有气泡或明显条纹。
否则,必须到出重装。
(3) 加样装好的色谱柱至少要用相当于3倍保留体积的洗脱剂平衡,待洗脱剂流至与凝胶柱液面相平时(不能流干,否则会带入气泡),用滴管吸取样品溶液,在高于凝胶表面约1cm 处,沿管壁四周缓缓滴加样品液,加完后打开下面的出口,使样品渗入凝胶内。
再关闭出口,用少量洗脱液将管壁残留的样品洗下,再打开出口,至溶液渗入柱内,再关闭出口。
可以考虑再加一层薄薄的脱脂棉以保护柱表面(我一般不加),然后即可进行洗脱。
(4) 洗脱与收集洗脱时,用甲醇作洗脱剂,并且要连续不断地进行,使凝胶柱上端保持一定的液层,防止凝胶柱表面的液体流干。
一般酸性洗脱剂中碱性物质容易洗脱,碱性洗脱剂中酸性物质容易洗脱。
多糖类物质等极性大的物质考虑用水洗脱,常用的洗脱剂是水-甲醇,水-乙醇,水-丙酮等,一般根据自己样品的性质选择洗脱液,洗脱液可一直用单一梯度。
凝胶色谱的共性是流速慢,每份一般体积较小。
(内径1.3cm左右,长80cm左右的柱子我一般每份收集液为8ml)(5) 凝胶的再生和回收凝胶柱多次使用后,若污染严重,则考虑用50度左右的2%的NaOH和0.5mol/LNaCl 混合液浸泡后,再用水洗净即可。
葡聚糖凝胶使用说明书

上课下子棋保证书详细(第一篇)此文档协议是通用版本,可以直接使用,符号*表示空白。
敬重的班主任老师:在此,非常愧疚地向你递交我这份保证,由于一次保证意味着我犯了一次重大过错。
此次,我由于上课玩五子棋、不好好听课,给班级上课秩序造成了比较严峻的影响。
您观看到我的不良行为,准时加以制止,并且没收我的手机作为惩罚。
如今,经过面壁思过与深刻反剩我深深地觉悟到自己所犯错误的严峻性:第一,我身为一名在校同学,学习无疑是自己的本职工作,也是必需履行的义务。
其次,在高校期间的教育对于每个人来说都是非常宝贵的,而我却不思进取,甚至严峻到在上课期间玩手机、不用心听课。
这更是犯了非常严峻的错误,这是对于教育资源的铺张。
第三,身为一名同学,我犯这样的错误,无疑是大大辜负了我父母对我的殷切期望。
这对于我年迈的父母来说,是一个很大的打击。
我的父母辛苦赚钱,送我们进入高校深造,为的就是我们能够努力学习,找到一份好的工作,将来能够生活得更好。
而为的使我们能够在各方面活动好的条件,父母为我们购得手机。
而我却恰恰不用功读书,不能全身心的投入学习,反倒是上课玩五子棋。
如今我做了错事,辜负了我的父母,我觉得很惭愧,想起父母的辛苦,不由地流泪。
再看我的。
错误,我也是很抱歉辛勤教育我的老师的。
老师为我们辛勤工作,为我们努力备课,而我却辜负老师的辛苦,上课不好好听讲是对老师的不敬重。
此次保证过后,我也会跟老师做当面正式赔礼的。
最终我写一下对今后保证:我保证今后上课期间不做任何**行为了,上课期间不再玩五子棋。
今后仔细听每一节课,在校当一名好同学,在家做一个孝顺的儿子,将来为社会做出自己的一份贡献。
此致敬礼!保证人:******日期:*****上课下子棋保证书详细(第二篇)合同范本合同编号:[合同编号]标题:上课下子棋保证书日期:[签署日期]甲方:[甲方机构/个人名称]地址:[甲方地址]电话:[甲方电话]乙方:[乙方机构/个人名称]地址:[乙方地址]电话:[乙方电话]鉴于甲方作为[甲方机构/个人名称](以下简称“甲方”)提供上课下子棋服务,乙方作为[乙方机构/个人名称](以下简称“乙方”)接受上述服务,双方达成以下协议,以兹共同遵守:一、合作内容1.1 甲方将为乙方提供专业的上课下子棋服务,包括但不限于教授棋谱、指导棋局策略等。
葡聚糖凝胶柱使用及注意事项(包含各种溶剂的溶胀系数)

葡聚糖凝胶柱使用及注意事项1 Sephadex G型葡聚糖凝胶只适合在水中使用,Sephadex G-25羟丙化后就是Sephadex LH-20。
其既有分子筛作用,在由极性与非极性溶剂组成的溶剂中还有反相层析效果。
虽然价位很高,但由于性能颇佳,可再生利用,所以倍受亲睐。
此外上柱样品损失很少,对处理小样品较好,这也是我们实验室常用的原因之一。
2 Sephadex LH20 的原理。
Sephadex LH20的分离原理主要有两方面:以凝胶过滤作用为主,兼具反相分配的作用(在反相溶剂中)。
因为凝胶过滤作用,所以大分子的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱,Sephadex LH20对化合物还起反相分配的作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留强,后出柱。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
3 Sephadex LH20 洗脱溶剂。
看完第2点后,就应该清楚Sephadex LH20 洗脱溶剂因分为两类:反相和正相两种。
用得最多的是反相溶剂洗脱,以甲醇--水系统最为常见,先用水,逐渐增加甲醇比例,最后用100%甲醇冲柱。
正相系统以氯仿--甲醇最为常见,先用50%氯仿--甲醇,逐渐增加甲醇比例,最后用100%甲醇冲柱。
4 Sephadex LH20 样品的处理和洗脱溶剂的选择。
如果样品极性大,这选用反相溶剂洗脱(甲醇--水),样品用最少体积的甲醇--水(尽可能甲醇少一些)溶解,过滤后,湿法上样(一定要滤喔!要是把Sephadex LH20 堵啦,就得将Sephadex LH20 的柱头部分弃去,很心痛呀)。
如果样品极性小,这选用正相溶剂洗脱(氯仿--甲醇),样品用最少体积的氯仿--甲醇溶解,过滤后,湿法上样。
5 Sephadex LH-20的步骤。
(1) 选择条件:梯度洗脱在Sephadex使用中并不象在正相柱层析中那么重要。
凝胶层析技术——葡萄糖凝胶的使用

凝胶层析技术——葡聚糖凝胶的使用摘要:本文综述了凝胶层析技术中所使用的葡聚糖凝胶的使用方法,及注意事项。
关键词:凝胶层析,葡聚糖凝胶,使用,注意事项引言:凝胶层析又称为凝胶排阻层析、分子筛层析、凝胶过滤、凝胶渗透层析等。
1959年,Porath和Flodin 首次用一种多孔聚合物——交联葡聚糖凝胶作为柱填料,分离水溶液中不同分子量的样品,成为凝胶过滤。
1964年,Moore制备了具有不同孔径的交联聚乙苯烯凝胶,能够进行有机溶剂中的分离,成为凝胶渗透层析(流动相为有机溶剂的凝胶层析一般称为凝胶渗透层析)。
随后这一技术得到不断的完善和发展,目前广泛应用于生物化学、高分子化学等很多领域。
此项技术中,凝胶的选择尤为重要,因此凝胶的使用及使用时的注意事项尤为重要。
1、凝胶层析原理凝胶层析是依据分子大小这一物理性质进行分离纯化的。
凝胶层析的固定相是惰性的珠状凝胶颗粒,凝胶颗粒的内部具有立体网状结构,形成很多孔穴。
当含有不同分子大小的组分的样品进入凝胶层析柱后,各个组分就向固定相的孔穴内扩散,组分的扩散程度取决于孔穴的大小和组分分子大小。
比孔穴孔径大的分子不能扩散到孔穴内部,完全被排阻在孔外,只能在凝胶颗粒外的空间随流动相向下流动,他们经历的流程短,流动速度快,所以先流出;而较小的分子则可以完全渗透进入凝胶颗粒内部,经历的流程长,流动速度慢,所以最后流出;而分子大小介于两者之间的分子在流动中部分渗透,渗透的程度取决于它们分子的大小,所以它们流出的时间介于两者之间,分子越大的组分越先流出,分子越小的组分越后流出。
这样样品经过凝胶层析后,各个组分便按分子从大到小的顺序依次流出,从而达到了分离的目的。
2、葡聚糖凝胶的化学和物理性质葡聚糖凝胶是一种珠状的凝胶,含有大量的羟基,很容易在水中和电解质溶液中溶胀。
G型的葡聚糖凝胶有各种不同的交联度,因此它们的溶胀度和分级分离范围也有所不同。
葡聚糖凝胶的溶胀度基本上不因盐和洗涤剂的存在而受影响。
LH-20装填和使用说明

Sephadex LH-20 装填指南Sephadex LH-20 是由葡聚糖G-25羟丙基化工而成,属于分子筛凝胶,尤其适用于天然产物在有机溶剂中的纯化。
例如:类固醇、萜类、脂类以及小分子多肽等,Sephadex LH-20同时适用于分子类别非常相似的物质的分离和工业规模的制备,即可用于初步纯化步骤,也可用与最终精制步骤,如非对映同分异构体的分离。
制备凝胶悬浮液装填的重要原则之一就是需要形成一个稳定均一的柱床。
胶颗粒越均一(粒径分布越窄),越容易获得稳定均一的柱床。
但是对于Sephadex LH-20而言,25~100μm的粒径范围相对于许多用于制备色谱的填料而言,不能说分布均一,也就是说其粒径分布较宽。
然而当胶溶胀后就相对容易得到均一的柱床。
这对于长柱(最高至250cm)而言也是同样的。
在装柱前,层析柱和储槽都必须进行彻底清洗。
Sephadex LH-20在使用之前必须进行溶胀。
在溶胀的过程中,要尽量避免过分搅拌,否则会破坏球形胶粒,且要避免使用磁力搅拌器。
1.在室温下,将凝胶溶胀于层析溶剂中至少三小时,溶胀后胶体积的大小决定于所使用的溶剂系统,请参考后页之胶溶胀表计算特定柱体积所需要干胶的量。
2.使溶胀的胶体积沉淀之后占总体积的75%,上层溶剂占25%,这时,悬浮液从一个容器倒入另一个容器时胶粒可移动。
3.将溶胀后的凝胶根据装柱要求均匀倒入柱内,在保证胶粒不变形的前提下,应在尽可能高的压力下装柱,反压不要超过1.5ba。
表一干胶溶胀表1.包含1%的乙醇。
2.包含1%的苯。
3.溶胀胶体积小于2.5mL/g的溶剂没有使用价值。
平衡上样前,用洗脱液平衡层析柱至少两个柱体积直到基线变得平稳为止,如改变溶剂应该注意凝胶在新溶剂中的溶胀性质,并根据性质确定柱高调节器的位置,如使用相同的溶剂,在以后的层析中柱平衡可以省略。
洗脱液为确保延长层析柱的使用寿命,所有的缓冲液都应该离心或经过0.45um的膜过滤以除去杂质。
葡聚糖凝胶g50说明书

葡聚糖凝胶g50说明书一、产品概述葡聚糖凝胶G50是一种用于生物学实验和制药工艺中的固相萃取材料,其主要成分为葡聚糖,具有高度的生物相容性和吸附性能。
本说明书旨在为用户提供葡聚糖凝胶G50的详细信息,包括性能特点、使用方法、注意事项等。
二、产品性能1. 吸附性能:葡聚糖凝胶G50通过静电相互作用、氢键和疏水作用等方式与溶液中的目标分子相互作用,从而实现固相萃取的目的。
其吸附效果稳定可靠,适用于多种生物大分子(如蛋白质、核酸等)和小分子(如多肽、糖类等)的富集、分离纯化。
2. 生物相容性:葡聚糖凝胶G50由天然来源的葡聚糖制成,无毒无害,对生物大分子具有良好的相容性。
因此,在进行生物学实验和生物制药工艺中,葡聚糖凝胶G50是一种理想的材料选择。
3. 微球尺寸分布:葡聚糖凝胶G50微球的尺寸分布均匀,粒径分布范围在50-150微米之间,确保了较大的比表面积和良好的吸附效果。
4. 耐酸碱性能:葡聚糖凝胶G50具有优异的耐酸碱性能,在pH值范围为2-10的条件下,保持较好的吸附性能和稳定性,适用于不同酸碱条件下的实验和工艺需求。
三、使用方法1. 权威单位S科学研究机构S建议,在使用葡聚糖凝胶G50前,先进行活化处理。
可选择一定浓度的无水酸溶液(如盐酸)或碱溶液(如氢氧化钠)进行活化,具体的活化条件需根据实验需求和目标分子特性进行优化。
2. 将葡聚糖凝胶G50加入活化剂中,充分搅拌后,离心使其沉淀。
3. 去除上清液,使用适量的缓冲液或溶液洗涤葡聚糖凝胶G50,以去除残留活化剂和杂质。
4. 使用前根据实验要求将葡聚糖凝胶G50平均分装到各个葡聚糖凝胶柱或离心管中,尽量避免干燥和长时间暴露在空气中。
5. 将待处理的样品加入到装有葡聚糖凝胶G50的柱或离心管中,让其与葡聚糖凝胶G50充分接触吸附。
6. 使用适量的缓冲液或溶液洗涤葡聚糖凝胶G50,以去除非特异性吸附的杂质。
7. 使用适量的洗脱液洗脱目标分子,具体的洗脱条件需根据目标分子的特性进行优化选择。
葡聚糖凝胶Sephadex-G100使用说明书

葡聚糖凝胶Sephadex-G100使用说明书SEPHADEX G-100 100 GArticle No: 17006001General Product Information====================================== =========ORDERINGPack size Code No.100 g 17-0060-01500 g 17-0060-025 kg 17-0060-0340 kg 17-0060-07¤ Thousands of documented applications.¤ Proven reproducibility.¤ Excellent recoveries.¤ Economical.---------------------------------------------------------------------------------Application area (Details) ========================================= ======* Fractionation and purification of proteins andpeptides.* Determination of molecular weights.* Determination of equilibrium constants.---------------------------------------------------------------------------------Autoclaving (Details) ========================================= ======In wet form (pH 7), at 120°C for 30 min.---------------------------------------------------------------------------------Calibration (Details) ========================================= ======Proteins: Use LMW Gel Filtration Calibration Kit.---------------------------------------------------------------------------------Checking the column packing (Details)====================================== =========1. Run Blue Dextran at 2 mg/ml.2. Watch the progress of a zone of this substancethrough the bed:You should see a discrete horizontal bandtravelling through the column.If not:A. The problem could be caused by dirty filters.Generated at:12/09/2002 05:45:57 PMB. More likely:An uneven bed surface or uneven packing isresponsible, in which case the column must berepacked.---------------------------------------------------------------------------------Choice of eluent (Details)====================================== =========* Eluent composition does not directly influence theresolution which can be obtained:A. Completely uncharged substances may be elutedwith distilled water.B. For substances carrying charged groups an eluentcontaining a buffer e.g. Tris-HCl, sodiumphosphate is used to control pH, and an ionicstrength of at least 0.02 is recommended tosafeguard against possible ionic interactionswith the gel matrix. NaCl can be used for thispurpose.* For the product that is to be lyophilized:Use volatile buffers e.g. ammonium acetate,ammonium bicarbonate or ethylenediamine acetate.---------------------------------------------------------------------------------Cleaning (Details)====================================== =========* Wash through 2 column volumes of a non-ionicdetergent solution.* Wash with 0.2 M NaOH outside the column due toswelling.---------------------------------------------------------------------------------Colour (Details)====================================== =========White.---------------------------------------------------------------------------------Column packing (Details)====================================== =========The gel suspension should reach the temperature of column operation before packing is begun.1. Inject eluent buffer into the outlet tubing untilit passes through the bed support net.2. Close the outlet tubing, when the dead space underthe net is properly filled.3. Pour the entire slurry into the column in a singleoperation. (Use reservoir if necessary.)4. Open the outlet valve.5. Start the pump or gravity flow to initiatepacking. The column should be packed at as highpressure as possible without deforming beads.The pressure should not be increased beyond 9.6kPa (value for 2.6 x 30 cm column in aqueousbuffer at room temperature. It may vary dependingon eluent viscosity. With wider columns, slightlyreduced maximum operating pressures must be used.)6. Remove the reservoir when all the gel hassedimented into the column.7. Insert the adaptor.8. Pack at the maximum operating pressure of the gel.9. Adjust the flow adaptor to the surface of thegel bed when the gel is thoroughly packed into thecolumn.---------------------------------------------------------------------------------Composition of the gel matrix (Details)====================================== =========Dextran, cross-linked with epichlorohydrin.Sephadex contains a small number of carboxyl groups, which at low ionic strength cause interaction between charged solutes and the matrix.---------------------------------------------------------------------------------Density (Details)====================================== =========We do not measure density.---------------------------------------------------------------------------------Equilibration (Details)====================================== =========1. Pass 2 to 3 column volumes of the aqueous bufferto be used in the separation.2. Readjust the flow adaptor to the surface of thebed.---------------------------------------------------------------------------------Exclusion limit (Details)====================================== =========Dextrans95 kDBuffer solution: Phosphate buffer 0.05 M- NaCl 0.15 M - NaN3 0.01% pH 7.0.-----Globular proteins210 kDBuffer solution: Phosphate buffer 0.05 M- NaCl 0.15 M - NaN3 0.01% pH 7.0.---------------------------------------------------------------------------------Expected shelf life (Details)====================================== =========8 years.---------------------------------------------------------------------------------Form as supplied (Details)====================================== =========Dry powder.---------------------------------------------------------------------------------Fractionation range (Details)====================================== ========= Dextrans1 kD - 100 kDBuffer solution: Phosphate buffer 0.05 M- NaCl 0.15 M - NaN3 0.01% pH 7.0.-----Globular proteins2 kD - 120 kDBuffer solution: Phosphate buffer 0.05 M- NaCl 0.15 M - NaN3 0.01% pH 7.0.-----Peptides2 kD - 120 kDBuffer solution: Info not available.---------------------------------------------------------------------------------Major separation mechanism (Details)====================================== ========= According to size.---------------------------------------------------------------------------------Max. linear flow rate (Details)====================================== =========50 cm/h.Values may vary depending on column packing and eluent viscosity.---------------------------------------------------------------------------------Max. operating pressure (Details)====================================== =========9.6 kPaValue for 2.6 x 30 cm column, in aqueous buffer at room temperature. Values may vary depending on column packing and eluent viscosity.---------------------------------------------------------------------------------Max. volumetric flow rate (Details)====================================== =========4.2 ml/minValue for 2.6 x 30 cm column, in aqueous buffer at room temperature. Values may vary depending on column packing and eluent viscosity.---------------------------------------------------------------------------------Optimisation (Details)====================================== =========* Parameters to change are:A. Sample volume.- A smaller sample volume gives betterresolution.B. Flow rate.¤ Lower flow rate gives better resolution forhigh molecular weight components.¤ The opposite may be true for small componentssince they diffuse more quickly.- The longer the separation time is, the widerthe sample zones become.C. Column length.¤ The resolution of two separated zonesincreases as the square root of the columnlength.¤ The effective bed height can be increased by:- Recycling.- Coupling two columns in series.* Buffer choice and pH are normally of minorimportance.---------------------------------------------------------------------------------pH stability; operational (Details)====================================== ========= 2 - 10---------------------------------------------------------------------------------Range of dry bead size (Details)====================================== ========= 40 - 120 μm---------------------------------------------------------------------------------Range of wet bead size (Details)====================================== ========= 100 μm - 310 μm---------------------------------------------------------------------------------Rec. column (Details)====================================== ========= Long, narrow column e.g. C 16, 26 / 40 - 100 cm XK 16, 26 / 40 - 100 cm* The length of the column is decided by theresolution required, (the resolution of twoseparated zones in gel filtration increases as thesquare root of column length) and the diameter bythe sample size.* The effective bed height can be increased byrecycling or using columns coupled in series.---------------------------------------------------------------------------------Rec. linear flow rate (Details)====================================== ========= 2 - 5 cm/h---------------------------------------------------------------------------------Sample volume fractionation (Details)====================================== ========= 1 - 5 % of bed volume.---------------------------------------------------------------------------------Solvent regain (Details)====================================== ========= Distilled water 9 - 11 ml/g.---------------------------------------------------------------------------------Storage of unused material (Details)====================================== ========= 4 - 25°C, dry.---------------------------------------------------------------------------------Storage of used material (Details)====================================== ========= 4 - 8°C, pH 6 - 8, do not freeze.Bacteriostatic agent (e.g. 20 % ethanol, 0.04 % sodium azide). Storage of column:1. Wash with 0.04 % sodium azide.2. Put a stop screw into a bottom tubing of thecolumn and insert the tubing from the adaptor ina Parafilm a protected vessel (e.g. test tube)with 20 % ethanol.---------------------------------------------------------------------------------Swelling dry gel (Details)====================================== ========= Swelling time: 72 h at 20°C or 5 h at 90°C.1. Weigh out the appropriate amount of dry gel forthe required bed volume.(Approx. bed volume: 15 - 20 ml/g dry gel.)2. Add enough buffer to equal the total volume ofthe column plus 30 % more.3. Stir - excessive stirring should be avoided as itmay break the beads.DO NOT USE MAGNETIC STIRRERSThe process is accelerated by using a boilingwater bath, which also serves to deaerate thebuffer.4. Decant the supernatant (after complete swelling).5. Add back buffer to make a suspension.This should be fairly thick, (about 75 % settledgel) and de-gassed.---------------------------------------------------------------------------------Swelling of dry material (Details)====================================== ========= Dimethyl sulphoxide 45 ml/gDistilled water 15 - 20 ml/gSaline 19 ml/g---------------------------------------------------------------------------------Temperature stability (Details)====================================== =========120°C.Dry gel should not be heated to more than 120°C as it will caramelize. ---------------------------------------------------------------------------------Toxicity data (Details)====================================== =========We do not have any toxicity data for our gels.They are intended for in vitro use only.---------------------------------------------------------------------------------2-chloroethanol 30 % (Stability)====================================== =========Should be OK.---------------------------------------------------------------------------------2-mercaptoethanol 0.1 M (Stability)====================================== =========OKOK 60 min, 60°C.---------------------------------------------------------------------------------Acetic acid 50% (Stability)===============================================Not recommended.Degradation of the gel."It seems probable that solubilization of the morehighly cross-linked gels (than Sephadex G-150) bystrong formic and acetic acids also occurs but hasescaped notice, because the most commonly appliedprocedures for examining peptide containing eluentswould not have detected the presence of thecarbohydrate."---------------------------------------------------------------------------------Acetic acid 1 M (Stability)====================================== =========OKOK equilibration/elution.---------------------------------------------------------------------------------Alkaline solutions (Stability)====================================== =========OK---------------------------------------------------------------------------------Aqueous salt solutions (Stability)====================================== ========= OK---------------------------------------------------------------------------------Brij 58 16 mg/ml (Stability)====================================== ========= Should be OK.---------------------------------------------------------------------------------CHAPS 30 mM (Stability)====================================== ========= OKOK for equilibration/elution.---------------------------------------------------------------------------------Chloroform/methanol (3:1) (Stability)====================================== ========= OKOK for equilibration/elution.---------------------------------------------------------------------------------Dextranase (Stability)====================================== ========= Should be avoided.---------------------------------------------------------------------------------Dimethyl sulphoxide (Stability)====================================== ========= OKOK for equilibration/elution.---------------------------------------------------------------------------------Dithiothreitol 1 mM (Stability)====================================== ========= Should be OK.---------------------------------------------------------------------------------Empigen BB 1 % (Stability)====================================== ========= Should be OK.---------------------------------------------------------------------------------Formamide 14 M (Stability)====================================== ========= Should be OK.---------------------------------------------------------------------------------Formic acid 10% (Stability)====================================== ========= OKOK equilibration/elution.---------------------------------------------------------------------------------Formic acid 50 % (Stability)====================================== ========= Use with care.Conflicting reports.1. OK for equilibration/elution.2. Degradation of the gel."It seems probable that solubilization of the morehighly cross-linked gels (than Sephadex G-150) bystrong formic and acetic acids also occurs but hasescaped notice, because the most commonly appliedprocedures for examining peptide, containing eluentswould not have detected the presence of the carbo-hydrate."---------------------------------------------------------------------------------Glucose 0.1 M (Stability)====================================== ========= OKOK elution.---------------------------------------------------------------------------------Glycine-HCl 0.1 M pH 1.0 (Stability)====================================== ========= OKOK elution.---------------------------------------------------------------------------------Guanidine hydrochloride 6 M (Stability)====================================== ========= OKOK equilibration/elution.---------------------------------------------------------------------------------Hydrazine 80 % (Stability)====================================== ========= Should be OK.---------------------------------------------------------------------------------Hydrochloric acid 0.02 M (Stability)====================================== ========= OKThe gel was well soaked in the cold room in 0.02 M HCl.---------------------------------------------------------------------------------Methanol 50% (Stability)====================================== ========= OKOK elution.---------------------------------------------------------------------------------Organic solvents (Stability)====================================== ========= OK---------------------------------------------------------------------------------Oxidizing agents (Stability)====================================== ========= Should be avoided.---------------------------------------------------------------------------------Piperidine 1 M (Stability)====================================== ========= Should be OK.---------------------------------------------------------------------------------Propionic acid 1 M (Stability)====================================== ========= OKOK equilibration/elution.---------------------------------------------------------------------------------Sodium cholate 15 mM (Stability)====================================== ========= OKOK for equilibration/elution.---------------------------------------------------------------------------------Sodium deoxycholate 16 mg/ml (Stability) ====================================== ========= Should be OK.---------------------------------------------------------------------------------Sodium dodecyl sulphate 3 % (Stability) ====================================== ========= Should be OK.---------------------------------------------------------------------------------Strong acids (Stability)====================================== ========= Should be avoided.---------------------------------------------------------------------------------Triton X-100 30 mM (Stability)====================================== ========= OKOK for equilibration/elution.---------------------------------------------------------------------------------Urea 8 M (Stability)====================================== ========= OKOK equilibration/elution.---------------------------------------------------------------------------------Weakly acidic solutions (Stability)====================================== ========= OK---------------------------------------------------------------------------------。
葡聚糖凝胶的使用说明

葡聚糖凝胶使用说明化学和物理性质葡聚糖凝胶是一种珠状的凝胶,含有大量的羟基,很容易在水中和电解质溶液中溶胀。
G型的葡聚糖凝胶有各种不同的交联度,因此它们的溶胀度和分级分离范围也有所不同。
葡聚糖凝胶的溶胀度基本上不因盐和洗涤剂的存在而受影响。
葡聚糖凝胶有不同的粒度。
超细级的葡聚糖凝胶是用于需要极高分辨率的柱色谱和薄层色谱。
粗级和中级的凝胶用于制备性色谱过程,可在较低的压力下获得较高的流速。
另外,粗级也可用于批量工艺。
化学稳定性葡聚糖凝胶不溶于一切溶剂(除非它被化学降解)。
它在水、盐溶液、有机溶剂、碱和弱酸性溶液中都是稳定的,在强酸中凝胶骨架的糖苷键被水解。
长期接触氧化剂将破坏凝胶,因而应避免使用。
物理稳定性葡聚糖凝胶并不熔融,可以在湿态、中性PH进行灭菌或在高压灭菌器120℃、30分钟而不影响它的色谱性质。
干态的凝胶加热至120℃以上将开始焦糖化。
葡聚糖凝胶的机械强度取决于交联度。
产品说明:使用方法:1. 乙醇浸泡:在室温下,将干粉浸泡于50-60%乙醇中至少24小时,并不断搅拌以保证凝胶溶胀,用无盐水洗去残存的乙醇滤干;2. 无盐水浸泡:室温下,在无盐水中充分溶胀24小时,间隙搅拌,以保证凝胶的完全溶胀,然后;3. 盐酸浸泡:在常温下再用0.2N HCl浸泡12小时,间隙搅拌,滤干,水洗只中性;4. 将溶胀好的凝胶脱气后(真空抽滤或超声波)根据装柱要求一次性置入柱内,注意保持湿态装柱,并避免柱内产生气泡或断层;5. 上样前平衡层析柱至少3-5个柱体积直到记录仪基线变得平稳为止(流出液的PH值等于上柱的Buffer的PH值);6. 凝胶过滤的上样量一般为5%的柱床体积,我们建议初次上样控制在1-2%的床体积,视分离情况可以调整;脱盐时上样量可以达到20%的柱床体积,柱高的选择也与分离要求相关,柱高控制在40-50cm 以下,过高的凝胶层会引起较大的反压,应当尽可能避免。
难分离物质要有一定柱高和流速控制,脱盐时高径比为5:1即可;7. 洗脱方法:可以用无盐水,也可以采用上柱时的缓冲液洗脱;在上柱Buffer中加入NaCl等梯度洗脱或盐梯度洗脱也可以完全分离纯化;8. 在位清洗(CIP)凝胶使用十次后作一次CIP,目的是去除柱床内沉淀的及顽固残留的蛋白。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
葡聚糖凝胶使用说明
化学和物理性质
葡聚糖凝胶是一种珠状的凝胶,含有大量的羟基,很容易在水中和电解质溶液中溶胀。
G型的葡聚糖凝胶有各种不同的交联度,因此它们的溶胀度和分级分离范围也有所不同。
葡聚糖凝胶的溶胀度基本上不因盐和洗涤剂的存在而受影响。
葡聚糖凝胶有不同的粒度。
超细级的葡聚糖凝胶是用于需要极高分辨率的柱色谱和薄层色谱。
粗级和中级的凝胶用于制备性色谱过程,可在较低的压力下获得较高的流速。
另外,粗级也可用于批量工艺。
化学稳定性
葡聚糖凝胶不溶于一切溶剂(除非它被化学降解)。
它在水、盐溶液、有机溶剂、碱和弱酸性溶液中都是稳定的,在强酸中凝胶骨架的糖苷键被水解。
长期接触氧化剂将破坏凝胶,因而应避免使用。
物理稳定性
葡聚糖凝胶并不熔融,可以在湿态、中性PH进行灭菌或在高压灭菌器120℃、30分钟而不影响它的色谱性质。
干态的凝胶加热至120℃以上将开始焦糖化。
葡聚糖凝胶的机械强度取决于交联度。
产品说明:
产品名称分离范围应用
葡聚糖凝胶 G-10 <700 缓冲液交换、脱盐,分离小分子,去除小分子葡聚糖凝胶 G-15 <1500 缓冲液交换、脱盐,分离小分子,去除小分子葡聚糖凝胶 G-25 1000-5000 工业上脱盐及交换缓冲液
葡聚糖凝胶 G-50 1000-30000 多肽分离、脱盐、清洗生物提取液、分子量测定葡聚糖凝胶 G-75 2000-70000 蛋白分离纯化、分子量测定、平衡常数测定葡聚糖凝胶 G-100 2000-120000 蛋白分离纯化、分子量测定、平衡常数测定葡聚糖凝胶 G-150 5000-300000 蛋白分离纯化、分子量测定、平衡常数测定葡聚糖凝胶 G-200 5000-600000 蛋白分离纯化、分子量测定、平衡常数测定
使用方法:
1. 乙醇浸泡:
在室温下,将干粉浸泡于50-60%乙醇中至少24小时,并不断搅拌以保证凝胶溶胀,用无盐水洗去残存的乙醇滤干;
2. 无盐水浸泡:
室温下,在无盐水中充分溶胀24小时,间隙搅拌,以保证凝胶的完全溶胀,然后;
3. 盐酸浸泡:
在常温下再用0.2N HCl浸泡12小时,间隙搅拌,滤干,水洗只中性;
4. 将溶胀好的凝胶脱气后(真空抽滤或超声波)根据装柱要求一次性置入柱内,注意保持湿态装柱,并避免柱内产生气泡或断层;
5. 上样前平衡层析柱至少3-5个柱体积直到记录仪基线变得平稳为止(流出液的PH值等于上柱的Buffer的PH值);
6. 凝胶过滤的上样量一般为5%的柱床体积,我们建议初次上样控制在1-2%的床体积,视分离情况可以调整;脱盐时上样量可以达到20%的柱床体积,柱高的选择也与分离要求相关,柱高控制在40-50cm 以下,过高的凝胶层会引起较大的反压,应当尽可能避免。
难分离物质要有一定柱高和流速控制,脱盐时高径比为5:1即可;
7. 洗脱方法:
可以用无盐水,也可以采用上柱时的缓冲液洗脱;在上柱Buffer中加入NaCl 等梯度洗脱或盐梯度洗脱也可以完全分离纯化;
8. 在位清洗(CIP)
凝胶使用十次后作一次CIP,目的是去除柱床内沉淀的及顽固残留的蛋白。
方法是以40cm/h用1M氢氧化钠反向洗四个柱体积,再以至少三个柱体积平衡缓冲液再生。
备注: 其它规格葡聚糖凝胶处理方法类似。
