第三章 烯烃
合集下载
第三章-烯烃

Alkene
§3.1 定义
含有碳碳双键的不饱和烃叫做烯烃 碳碳双键,是烯烃的官能团。 碳碳双键,是烯烃的官能团。 官能团 分类: 分类: 单烯烃:通式是C 单烯烃:通式是CnH2n 二烯烃: 二烯烃: CnH2n-2 2n多烯烃: 多烯烃: 不饱和度: 不饱和度:Ω=n4+1+(n3-n1)/2
§3.2 结构
亲电加成反应 环状溴鎓 环状溴鎓离子 解释
立体化学特征: 立体化学特征:反式加成 几个例子
CH 3 C H CH3 C H 顺 -2-丁烯 丁 C H CH3 C H CH 3 Br2
Br+ C Br
CH3 CH3 H H C C
Br CH3
H Br 2R,3R - 2,3 - 二 溴 丁 烷 Br CH 3 H CH3 H C C Br CH 3 H
乙烯分子中的σ键 乙烯分子中的σ
乙烯分子中的π键 乙烯分子中的π
五个σ键在同一个平面上; 五个σ键在同一个平面上;π电子云分布在平面的 上下两方。C=C( 键和2p 2pπ键 上下两方。C=C(sp2-sp2 σ键和2p-2p π键) 。C=C
π键的特点: 键的特点: 不如σ键牢固( 轨道是侧面重叠的) 不如σ键牢固(因p轨道是侧面重叠的) 不能自由旋转( 键没有轨道轴的重叠) 不能自由旋转(π键没有轨道轴的重叠) 电子云沿键轴上下分布,易极化,发生反应。 电子云沿键轴上下分布,易极化,发生反应。 不能独立存在 乙烯分子中所有原子在同一平面上,键长和键角为: 乙烯分子中所有原子在同一平面上,键长和键角为:
Br+ C Br
2S,3S - 2,3 - 二 溴 丁 烷
CH3 C H CH3 C H 反-2-丁烯 丁 C CH3 CH3 C H H Br2
§3.1 定义
含有碳碳双键的不饱和烃叫做烯烃 碳碳双键,是烯烃的官能团。 碳碳双键,是烯烃的官能团。 官能团 分类: 分类: 单烯烃:通式是C 单烯烃:通式是CnH2n 二烯烃: 二烯烃: CnH2n-2 2n多烯烃: 多烯烃: 不饱和度: 不饱和度:Ω=n4+1+(n3-n1)/2
§3.2 结构
亲电加成反应 环状溴鎓 环状溴鎓离子 解释
立体化学特征: 立体化学特征:反式加成 几个例子
CH 3 C H CH3 C H 顺 -2-丁烯 丁 C H CH3 C H CH 3 Br2
Br+ C Br
CH3 CH3 H H C C
Br CH3
H Br 2R,3R - 2,3 - 二 溴 丁 烷 Br CH 3 H CH3 H C C Br CH 3 H
乙烯分子中的σ键 乙烯分子中的σ
乙烯分子中的π键 乙烯分子中的π
五个σ键在同一个平面上; 五个σ键在同一个平面上;π电子云分布在平面的 上下两方。C=C( 键和2p 2pπ键 上下两方。C=C(sp2-sp2 σ键和2p-2p π键) 。C=C
π键的特点: 键的特点: 不如σ键牢固( 轨道是侧面重叠的) 不如σ键牢固(因p轨道是侧面重叠的) 不能自由旋转( 键没有轨道轴的重叠) 不能自由旋转(π键没有轨道轴的重叠) 电子云沿键轴上下分布,易极化,发生反应。 电子云沿键轴上下分布,易极化,发生反应。 不能独立存在 乙烯分子中所有原子在同一平面上,键长和键角为: 乙烯分子中所有原子在同一平面上,键长和键角为:
Br+ C Br
2S,3S - 2,3 - 二 溴 丁 烷
CH3 C H CH3 C H 反-2-丁烯 丁 C CH3 CH3 C H H Br2
有机化学 第三章 烯烃全

KOH
Br
C2H5OH
+ HBr
17
3-4 烯烃的物理性质
物质状态 C2~C4 气体,C5~C18液体 ,C19~固体
沸点、熔点和相对密度 均随相对分子量的增加而上升;直链烯烃的沸 点略高于支链烯烃;末端烯烃(α-烯烃)的沸点 略低于双键位于碳链中间的异构体。
溶解性 不溶于水,易溶于有机溶剂。
HCl CF3CH2CH2 Cl
Cl
CF3CH2CH2
(主)
HCl CF3CHCH3
Cl
Cl
CF3CHCH3
35
烯烃的亲电加成反应
HX反应活性 HI > HBr > HCl > HF
H2C CH2
HBr HAc
CH2 Br
CH2 H
HCl H2C CH2 AlCl3
H2C CH3 Cl
36
与硫酸的加成 ——间接水合
H3C C
H
CH3 C
H
H C
H3C
CH3 C
H
顺式
反式
7
3-2 烯烃的异构和命名
系统命名法
选主链:选择含双键的最长碳链作主链, 称 “某烯”, 若碳原子数大于10, 则称为“某碳 烯”;
编号:从靠近双键的一端开始编号,确定双键 (两双键碳原子中编号小的数字)及其它取代 基的位次;
其它同烷烃的命名。
18
顺 反 异 构 体 的 差 异
极性较大, b.p. 较高 极性较小, b.p. 较低
对称性较差,m.p. 较低
对称性较好,m.p. 较高19
3-5 烯烃的化学性质(重点)
• 反应:加成、氧化、卤代
α HCCC
第三章 烯烃

e
小结:1°环己烷有两种极限构象(椅式和船 式),椅式为优势构象。 2°一元取代基主要以e键和环相连。 3°多元取代环己烷最稳定的构象是e键上取 代基最多的构象。 4°环上有不同取代基时,大的取代基在e键 上构象最稳定。
环烷烃的工业来源
环烷烃存在于某些地区的石油中,石油因产 地的不同,环烷烃的含量不同。环烷烃主要 是环戊烷和环己烷以及它们的烷基衍生物。
环烷烃的化学性质
由于形成了弯曲键,使得C-C键变弱,有利 于亲电试剂的进攻。亲电试剂(在反应过程中 接受电子或共用电子的试剂)。
加成反应
环丙烷和环丁烷
取代反应
环己烷和环戊烷
(1)取代反应
+Cl2 光或热 Cl
+Cl2
光或热
Cl
(2)氧化反应
O + OH
空气,环烷酸锰,125~165oC,0.8~1.5MPa
第三章
环烷烃
环烷烃
定义:分子中只含有C-C单键和C-H键的一类 环状化合物。 通式:CnH2n
环烷烃的分类
根据分子中碳环的数目分类: 小环(3~4元环) 单环环烷烃
普通环(5~7元环) 中环(8~11元环) 大环(≥12元环)
二环环烷烃
多环环烷烃
环烷烃的命名
根据分子中成环碳原子数目,称为环某烷。 环上的支链作为取代基时,当环上只有一个 取代基时,把取代基的名称写在环烷烃的前 面。 环上的支链作为取代基,当环上连有两个取 代基时,取代基位次按“最低系列”原则列 出,基团顺序按“次序规则”小的优先列出 。
环烷烃的工业制法
目前工业上获得环己烷基本上都是由苯加氢 生成。如用Raney为催化剂,于200~240oC 和3.92MPa压力下,苯液加氢生成环己烷。 如:
第三章 烯 烃

第三章 烯 烃 (Alkenes )
3.1 烯烃的结构
一、sp2杂化(sp2 Hybridization)
H C H C
H H
乙烯的结构
三个 sp2 杂化轨道 乙烯中的五个σ键 处于同一平面
定义:两个P电子轨道以“肩并肩”的方式 而形成的键叫π键。形成π键的电子称为 π电子。
H C H C H
H
亲电加成(Electrophilic Addtion Reactions) :
C
C
+
H
X
C H
C X
A. 反应机理:
δ + δ -
(1)
C
C
+
H
X
C H
C +
+
X
碳正 离 子 中 间 体
(2)
C H C +
+
X
C H
C X
CH2 CH2 CH2
CH2 CH2 CH2ຫໍສະໝຸດ + + +
HCl HBr HI
(1)、催化氧化 使用催化剂,以氧气或过氧化物为氧化剂 可得到不同产物:
O
+ O2 + O2
PdCl2/CuCl2
Ag
O
(2)、高锰酸钾氧化
• 与冷而稀的高锰酸钾水溶液反应
R R' H
KMnO4
常温
R HO
R'
顺式 邻 二 醇
H
OH
•与热而浓的高锰酸钾水溶液反应,随着烯 烃结构不同产物不同
R R'' H
规则的理论依据:
1)碳正离子稳定性 碳正离子的形成:
3.1 烯烃的结构
一、sp2杂化(sp2 Hybridization)
H C H C
H H
乙烯的结构
三个 sp2 杂化轨道 乙烯中的五个σ键 处于同一平面
定义:两个P电子轨道以“肩并肩”的方式 而形成的键叫π键。形成π键的电子称为 π电子。
H C H C H
H
亲电加成(Electrophilic Addtion Reactions) :
C
C
+
H
X
C H
C X
A. 反应机理:
δ + δ -
(1)
C
C
+
H
X
C H
C +
+
X
碳正 离 子 中 间 体
(2)
C H C +
+
X
C H
C X
CH2 CH2 CH2
CH2 CH2 CH2ຫໍສະໝຸດ + + +
HCl HBr HI
(1)、催化氧化 使用催化剂,以氧气或过氧化物为氧化剂 可得到不同产物:
O
+ O2 + O2
PdCl2/CuCl2
Ag
O
(2)、高锰酸钾氧化
• 与冷而稀的高锰酸钾水溶液反应
R R' H
KMnO4
常温
R HO
R'
顺式 邻 二 醇
H
OH
•与热而浓的高锰酸钾水溶液反应,随着烯 烃结构不同产物不同
R R'' H
规则的理论依据:
1)碳正离子稳定性 碳正离子的形成:
第三章 烯烃

电子云呈圆柱形对称分布
电子云集中于两原子核连线 分子有对称轴
对称轴上电子云密度最大
电子云呈双冬瓜形
电子云分散于分子平面上下 无对称轴,有对称面 对称轴上电子云密度为零 键能较小
键 的 性 质
键能大
成键两原子可绕键轴自由旋转
键的极化度小 较稳定,不易断裂
不能自由旋转
键易极化变形 活性高,易断裂
第二节
X
CH3CH2CH=CH2 + HBr
CH3CH2CCH3 + CH3CH2CH2CH2Br
Br
主
I
CH3CH2C=CH2 + HI
CH3
CH3CH2-C-CH3 100%
CH3
区位选择性反应:当反应的取向有可能产生几个产物 时,主要生成其中一个产物的反应。 马氏规则是世
界上第一个区 区位专一性反应:当反应中化学键的断裂有两种以上 域选择性反应 的取向,但却只有一个产物生成的反应。 烯与其它不对称试剂加成时,正性基团加到含H较多 的双键碳上,负性基团加到含H较少的双键碳上。
HO
δ
与卤水的加成→β -卤代醇
Cl
δ
3、与乙硼烷的加成
CH2=CH2 + BH3 CH2=CH2 (CH3CH2)3B CH3CH2BH2 H2O2 H2O/OHCH2=CH2 CH3CH2BHCH2CH3
3CH3CH2OH + H3BO3
不对称烯烃的加成,氢加到含氢较少的双键碳原子上
共有12个电子,其中8个电子形 成四个B—H键,在一个平面上, 平面上下有两个三中心两电子键
激发态
杂化态
sp2杂化轨道
三个sp2杂化轨道的关系
sp2杂化轨道与p轨道的关系
有机化学 第三章 烯烃

在次卤酸中,氧原子的电负性(3.5) 较氯原子(3.0)和溴 原子(2.8)强,使分子极化成HO X。加成仍符合马氏规律。 在实际生产过程中,通常用氯和水代替次卤酸,结果生成 氯乙醇和,1,2-二氯乙烷。
CH2=CH2
Cl2/H2O
δ- δ+
CH2CH2 + CH 2CH2 Cl OH Cl Cl
– 反应机理
– 顺反异构体的命名
• 顺/反标记法 相同基团在双键同侧为“顺(cis)” ,反之,为“反(trans)”。 • Z/E标记法 依照“次序规则”,比较双键碳上连接的两个基团, 较优基团在双键同侧为“Z” ,反之,为“E”。
CH3 H C C CH3 CH3 H
H
C
C
CH3 CH2CH3
CH3CH2 H
有 机 化 学 ORGANIC CHEMISTRY
第三章 烯烃
CHAPTER 3 ALKENES
第三章 烯 烃 3 ALKENES
分类
开链烯烃 如:(CH3)2C=CH2
按碳的连 接方式分
环烯烃
如:
单烯烃 按双键 数目分 多烯烃
如:H2C=CH2
如:
第一节 烯烃的结构、异构和命名 3.1 Structure,Isomerism and nomenclature
• 加卤化氢 如:
一卤代烷
AlCl3 130~ 250℃
CH2=CH2 + HCl
CH3CH2Cl
分子不对称的烯烃加HX时,可得两种加成产物:
CH3CH=CH2 + HX CH 3CH2CH2X + CH 3CHCH3 X
马氏(Markovnikov)规律:不对称烯烃发生亲电加成时, 酸中带正电荷的质子H+总是加到含氢较多的双键碳原子 上,而负性基团加到含氢较少的双键碳原子上。如:
第三章 烯烃

亲电试剂
H X C H 0oC C H C OSO3H C OH C X C OH C X
卤代烷
(X=Cl, Br, I) H OSO3H
硫酸氢酯
C
C
+
H H OH C H
-
醇
CCl4 C X C X
X X (X=Cl, Br)
-
邻二卤代烷
X
OH
b-卤代醇
次卤酸
1、 烯烃与 H-X 的加成
烯烃的化学性质
1. 双键的结构与性质分析
C C
C
C
键能: s 键 ~347 kJ / mol p 键 ~263 kJ / mol
p 电子结合较松散, 易参与反应。是电子 供体,有亲核性。
p 键活性比 s 键大
与亲电试剂结合
不饱和,可加成至饱和
与氧化剂反应
2. 烯烃加成的三种主要类型
加 成
双取代烯烃异构体用“顺”、“反”标
记
(H3C)2HC H C(CH3)3 H
顺-2, 2, 5-三甲基-3-己烯
cis-2, 2, 5-trimethyl-3-hexene
取代基在双键的同侧
多取代烯烃,用 Z 或 E 型标记 Z 型:两个双键碳上的优先基团(或原子)在同一侧。 E 型:两个双键碳上的优先基团(或原子)不在同一侧。
o
Br H
+
H
Br
立体有择反应,立体选择性:Br2 > Cl2
在有机分析中的应用:鉴别烯烃 例:烯烃 + 5%溴的CCl4溶液 红棕色褪去
烯烃与X2的亲电加成机理(环正离子机理)
X X C C X X C C C X X X C C C C OH2 X H2O H2O C C -H HO C -H X C C OH X C C C C X X X
第3章烯烃

3.4.2.2.1与卤素加成
卤素对烯烃加成的活性次序:F2>Cl2>Br2>I2(不反应) 氟与烯烃的反应太剧烈,往往使碳链断裂;碘与烯烃难于起反 应。故烯烃的加卤素实际上是指加氯或加溴。 应用:烯烃 + 5%溴的CCl4溶液 红棕色褪去,Br2/CCl4 溶液可用来检验烯烃。
3.4.2.2.2与氢卤酸加成
类似反应: H+催化下烯烃与HOR或RCOOH的加成 3.4.2.2.4与次卤酸加成
马式规则:极性试剂与不对称烯烃加成时,试剂中带负电荷 的部分主要加在含氢加少的双键碳原子上。
β-卤代醇的应用——制备环氧乙烷衍生物
烯烃亲电加成反应小结:
3.4.2.2.5硼氢化氧化反应 定义:B-H键对烯烃双键进行加成反应,称为硼氢化反应。
(Z)-3-甲基-4-异丙基庚烷
3.1.3.3顺反异构体的命名
Z、E标记适用于所有的顺反 异构体,它与顺反标记法相比, 更具有广泛性。这两种标记法 之间没有必然的联系,顺式构 型不一定是Z构型,反式构型 如按顺反命名应该为:顺-3-甲基-2-戊烯 也不一定是E构型。 按Z、E命名法应该为:E-3-甲基-2-戊烯
CH
CY
吸电子诱导 比较标准
斥电子诱导
取代基的吸电子(-I效应)强弱次序: 取代基的供电子(+I效应)强弱次序:
•3.5.1诱导效应对马式规则的解释
+ CH3-CH=CH2 HX
甲基斥电子基 CH3 CH CH2
使双键电子云发生偏移
CH3 CH CH2 δ+ δ -
+ CH3 CH CH2
H+
δ+ δ -
a
C b
a
C b
第三章 烯烃

3.1.2 烯烃的命名规则(系统命名):
(1)主链选择:选择含碳碳双键的最长碳链为主 链(母体),根据含碳数目称为某烯. (2)主链编号:从最靠近双键的一端开始给主碳 链编号. (3)双键位置:将双键位置标明在烯烃名称前面 (只标出位次较小双键碳原子位置). (4)其它同烷烃的命名规则.
Naming alkenes
B.碳正离子的结构和稳定性 ----马尔科夫尼科夫(Markovnikov,s rule)规律 CH3
2 C=CH2 CH3 2-甲基丙烯
CH3 CH3 + 2HCl C-CH3 + CH-CH2Cl CH3 Cl CH3
主要产物
马尔科夫尼科夫规律 --卤化氢与不对称烯烃加成时, 可以得到两种不同的产物,以H原子加到含氢较多的双 键C原子上,而卤素原子加到含氢较少或不含氢的双键 碳原子上的那种产物为主. Why?
>C=C< + Y-X -C-C( sp2) Y Z
(sp3)
例1: CH2=CH2 +Cl-Cl CH2Cl-CH2Cl H= -171kJ/mol 例2: CH2=CH2 +Br-Br CH2Br-CH2Br H= -69kJ/mol
• 加成反应往往是放热反应,往往需要较低的活化能. 所以烯烃容易发生加成反应是烯烃的一个特征反应.
在烯烃名称前加顺(cis-)或反(trans-)字表示,例如:
CH3 CH3 CH3 CH3
C=C
H H H
C=C
Cl
顺-2-丁烯
CH3 C=C H
顺-2-氯-2-丁烯
CH3CH2 C=C CH3
H
CH3
H
H
反-2-丁烯
第三章 烯烃

活性MnO2,SeO2,O2+金属催化剂等
氨化氧化反应
磷钼酸铋
工业生产丙烯氰的方法 丙烯氰可生产聚丙烯腈纤维(腈伦)、ABS塑料、AS塑料、丙烯酰胺等。
(6)烯丙位氢的特殊活性
3.5 烯烃的制备
3.5.1 醇的脱水-消去反应
扎伊采夫 规则:
3.5.2 卤代烷烃消去反应
3.5.3 邻二卤代物的脱卤素反应
sp2
sp2
sp2
p sp2
π键
p
C-Hσ键 C-Cσ键
π键的特点:作用较弱、不能旋转(旋转时将被破坏)
烯烃的同分异构
构造异构:丁烯为例(比丁烷复杂-双键位置) 顺反异构:
顺-1,2-二氯乙烯
反-1,2-二氯乙烯
顺式
反式
顺式 顺式 反式
顺式
IUPAC的Z(顺),E(反)规则:
大 a 大 小 大 大 大
(7)硼氢化反应
二烷基硼
三烷基硼
硼烷是典型的Lewis酸,缺电子性质(二聚体的存在),亲电加成。
复杂烯烃的加成产物规律?
硼氢化反应在有机合成中的应用
硼氢化-氧化反应:制备伯醇重要方法。
3.4.2 氧化
(1)臭氧化反应
臭氧化-还义: 烯烃结构推断:
(2)高锰酸钾氧化反应
产物规则及其意义: 反应机理:
复杂烯烃水合反应
重排
仲碳正离子
叔碳正离子
碳正离子的重排: 与碳正离子的稳定性有关。 迁移的可以是H,烷基。
重排产物
H迁移的例子:
迁移什么?取决于什么? 与卤化氢发生反应时是否可以重排?
(3)卤素加成
乙烯气体可使溴的四氯化碳溶液迅速褪色
第3章 烯烃

因此:烯烃为平面分子,从烯烃双键平面
的同侧加氢,为顺式加氢。
氢化热:加氢反应是放热反应, 1 mol不饱和
烃催化加氢所放出的热量称为氢化热。
CH 3 CH 2 CH
CH 3 C H
CH 3 C H C CH 3
CH 2
CH 3
C H
H
有机化学
20
不饱和烃的氢化热越大,说明原不饱和 烃分子的内能越大,该不饱和烃的相对稳定 性较小。 -1
1、系统命名法(某烯)
(和烷烃有很大的相似性,但略有不同) A、选择含双键的、最长的、最多碳链作为主链; B、在编号时从靠近双键的一端开始,使表示双
键位臵的数字尽可能小;
C、双键的位臵要标明,并用两个双键碳中编号 较小的数字标明。 注:数字和汉字之间必须用“-”横线隔开。
有机化学
9
CH 3CH 2C
有机化学
17
3.2.2 烯烃的化学性质
加成反应 氧化反应 聚合反应
C C C H
α- C
α- H 氧化反应 取代反应
一、加成反应
加成反应:烯烃的П键断裂,原来的双键上各 加一个原子或基团。
C C
+
Y
Z
C Y
C Z
Y=Z:H2 , X2
Y≠Z:H-X , HO-X , H-OH , (H-BH2)2 , H2SO4
Markovnikov规律: ① 不对称的烯烃与不对称试剂加成时,氢加到 连氢较多的双键碳上。 CH3
CH 3 C CH 2 + H-OH
CH3 C CH2
CH 3
CH 3 C CH CH 3 + H SO 2 4 H 2O
OH H
CH3 CH3 C CH CH3
第三章 烯烃

带有完全或部分正电荷的分子或基团,叫亲电
试剂,如:
Aδ+— BδA+ (1)常见的亲电试剂
+ B-
H-X (X=Cl、Br、I) H-OH H-OSO3H X-OH (X=Cl、Br) X-X (X=Cl、Br)
(2)亲电加成反应
R-CH=CH2 + A+ 慢 R-C+H-CH2 + R-CH-C+H2 A A B- 快 B- 快 R-CH-CH2 + R-CH-CH2
H
H
反式加成
(5)与HXO加成(X=Cl、Br)
OH R-CH=CH2 + HXO 讨论: 1)机理为: HXO X+ + OHR-CH— CH2 X
反应时X+先加上去,然后OH-从另一侧上去。是反 式加成,不对称双键符合马氏规律。
2)第二步上去的负离子除了OH-以外,还有X-。
CH3 CH3C=CH2 + Br2 + H2O CH3 Br OH CH3 Br Br
第三章 烯烃
分子中具有C=C双键的不饱和烃(unsaturated hydrocarbon),叫烯烃(alkene),通式为 CnH2n, C=C为官能团。 由双键的数目,可分为单烯烃(只含一个C=C),双 烯烃(含两个C=C)和多烯烃(含两个以上C=C)。
3.1、烯烃的异构和命名
3.2、烯烃的结构 3.3、烯烃的来源和制法 3.4、烯烃的物理性质 3.5、烯烃的化学性质
2)溴的CCl4溶液为红色,此反应可用于烯烃的定 性检验。 3)加F2反应太剧烈,难以控制。加I2反应很难进 行。 烯烃与溴加成出现”混杂”产物,表明加成是分步 进行。如:
试剂,如:
Aδ+— BδA+ (1)常见的亲电试剂
+ B-
H-X (X=Cl、Br、I) H-OH H-OSO3H X-OH (X=Cl、Br) X-X (X=Cl、Br)
(2)亲电加成反应
R-CH=CH2 + A+ 慢 R-C+H-CH2 + R-CH-C+H2 A A B- 快 B- 快 R-CH-CH2 + R-CH-CH2
H
H
反式加成
(5)与HXO加成(X=Cl、Br)
OH R-CH=CH2 + HXO 讨论: 1)机理为: HXO X+ + OHR-CH— CH2 X
反应时X+先加上去,然后OH-从另一侧上去。是反 式加成,不对称双键符合马氏规律。
2)第二步上去的负离子除了OH-以外,还有X-。
CH3 CH3C=CH2 + Br2 + H2O CH3 Br OH CH3 Br Br
第三章 烯烃
分子中具有C=C双键的不饱和烃(unsaturated hydrocarbon),叫烯烃(alkene),通式为 CnH2n, C=C为官能团。 由双键的数目,可分为单烯烃(只含一个C=C),双 烯烃(含两个C=C)和多烯烃(含两个以上C=C)。
3.1、烯烃的异构和命名
3.2、烯烃的结构 3.3、烯烃的来源和制法 3.4、烯烃的物理性质 3.5、烯烃的化学性质
2)溴的CCl4溶液为红色,此反应可用于烯烃的定 性检验。 3)加F2反应太剧烈,难以控制。加I2反应很难进 行。 烯烃与溴加成出现”混杂”产物,表明加成是分步 进行。如:
有机化学 第三章 烯烃

C O
O
O
过氧化乙酰
过氧化苯甲酰
链引发 R R O O R HBr or hv 2 R R
. O
+
Br
. O
+
OH
.
链增长
. Br + CH3 CH . Br + CH3 CH .
CH3 CH CH2 Br
.
CH2 CH2 CH3 CH CH2Br CH3 CHBr CH3 CH2 Stable CH2
.
Unstable
+
HBr
CH2Br
+
. Br
四、加硫酸
也符合马氏规则,氢加在含氢多的碳原子上。
H2 C CH2
+
H O SO2 OH
H2O
H CH CH3 OSO2OH H
CH3CH2OH H3 C CH CH2
+HO
SO2 OH H
H2O
H3 C CH CH2 OH
CH CH2 OSO2OH CH3 H
CH2CH2CH3 CH2CH3
Br Cl
Cl H
顺-3-甲基-4-乙基-3-庚烯 (E)-3-甲基-4-乙基-3-庚烯
反-1,2-二氯-1-溴乙烯 (Z) -1,2-二氯-1-溴乙烯
双键的性质分析
C C C C
键能: s 键 ~347 kJ / mol p 键 ~263 kJ / mol
p 电子结合较松散, 易参与反应。是电子 供体,有亲核性。 与亲电试剂结合 与氧化剂反应
H
CH3 C CH CH2 CH3 H
④反马氏规则:
在过氧化物存在下,氢原子加在含氢少的碳原子 上。注意:只有HBr有此反应。
第三章 烯烃

CH2
CH2 + HOSO2OH
CH3CH2
+ OSO2OH
CH3CH2
+ OSO2OH
CH3CH2OSO2OH
CH3
CH
CH2 + HOSO2OH
CH3CHCH3 + OSO2OH
CH3CHCH3 + OSO2OH
(CH3)2CHOSO2OH
烯烃在酸的催化下也可以直接加水生成醇,例如:
CH2=CH2 H2O H3PO4 3000C,70MPa CH3CH2OH
顺-2-丁烯,bp:3.5℃,mp: -139.3℃,r:0.6213
CH3 C H C
H CH3
反-2-丁烯,bp:0.9℃,mp: -105.5℃,r:0.6042
3.命名 (1)系统命名 选择包含C=C双键在内的最长碳链为主链。 从最靠近双键一端开始编号。 双键的位次以双键原子中编号小的数字表明,写在烯烃 的前面。
CH3CH2C CH3
2-甲基-1-丁烯
CH2 CHC CH3 CH3
CH2
CH3CH
C CH3 CH3
CH2
2-甲基-2-丁烯
CH3CH2CH
CHCH3
3-甲基-1-丁烯
2. 顺反异构:由于双键旋转受阻,构造相同的分子中的 原子在空间排列方式的不同所造成的异构现象。
CH3 C H C CH3 H
C O
C
C C
当作
C C C
CH3
<CH3CH2 CH
<CH2 O
CH CH CH2>
CH3
H C CH3 CH3
CH2OH<
CH3 C CH > C CH3 CH2CH3 > CH3
第三章 烯烃

•组成键的电子称为 电子; •组成 键的电子称为 电子;
(4) 碳碳单键和双键电子云分布的比较
C-C 键
电子云不易与外界接近
C-C 键
电子云暴露在外.易接近亲电试剂
•键电子云集中在两核之间,不易与外界试剂接近;
•双键是由四个电子组成 ,相对单键来说 ,电子云密度更大 ; 且构成键的电子云暴露在乙烯分子所在的平面的上方和 下方,易受亲电试剂(+)攻击,所以双键有亲核性 (-).
• 能够用常规方法将顺反异构体分离出来。 • 顺反异构体的物理性质、波谱性质、化学性质及生 理活性等均有明显差异。
二、烯烃的命名
很少采用普通命名。 系统命名:以烷烃的命名原则为基础。烷 乙烯 丙烯 异丁烯
烯
异戊二烯
1、构造异构的命名 (1)主链:选择含双键在内的最长碳链为主链, 称为某烯(中文十个碳以上碳链称为某碳烯) (2)编号:优先给予双键最小编号 (3)双键位置在书写时必须标明(烯键在1-位 可以省略),取两个烯碳中数字最小的。 (4)构型如明确,应当标明。 (5)其它同烷烃的命名规则。
•(1-4)异丁烯与HBr亲电加成反应过程
异丁烯和 HBr 的亲电加 成过程及能量变化
•(1-5) 碳正离子的结构和稳定性-- 马尔科夫尼科夫规律 马尔科夫尼科夫--Markovnikov CH3 CH3 CH3 2 C=CH2 + 2HCl C-CH3 + CH-CH2Cl CH3 CH3 Cl CH3 2-甲基丙烯 为主 马尔科夫尼科夫规律 --卤化氢与不对称烯烃加成 时 , 可以得到两种不同的产物 , 但其中之一为主 . 即加成 时以H原子加到含氢较多的双键C原子上,而卤素原子加 到含氢较少或不含氢的双键碳原子上的那种产物为主.
第三章 烯烃
①键能小,不太稳定 ②电子云受核约束小,易极化 ③成键两原子不能自由旋转 ④两个原子间可以有一个或两个键
有机化学
上页
下页
回主目录
返回
§ 3-2 烯烃的命名和异构现象
一 、烯烃的命名
1 选主链:选择含碳碳双键在内的最长碳链为 主链,按主链碳原子的数目称为某烯 。 2 编号: 从离双键最近的一端开始编号;如果双 键位置相同,则从靠近支链的一端开始编号;并将 双键位置写在“某烯”的前面。 3 命名:再在“某烯”的前面,从小到大写出其他支链 位置、数目和名称。
有机化学
上页
下页
回主目录
返回
一、加成反应
1. 催化加氢
Ni , H 2
高温,高压
催化加氢常用的催化剂:Pt、Pd、Ni等
2. 亲电加成反应
亲电试剂:凡是正离子或缺电子物质都叫亲电试剂。 亲电加成反应:由亲电试剂的作用而引起的加成反应 叫亲电加成反应。
有机化学
上页
下页
回主目录
返回
(1). 加卤素
C C + X2 C X C X
高分子 、高聚物
单体
n CH CH2 CH3
AlR3 TiCl4
1MPa , 50℃
[
CH CH2 CH3
]
n
有机化学
上页
下页
回主目录
返回
四、-H的反应
烯烃中,与双键碳直接相连的碳原子称为-C原子, -C原子上的氢称为-H。 -H可以被取代或氧化。
H H C H CH CH2
-C
-H
有机化学
上页
下页
回主目录
返回
次序规则:
A 比较直接相连原子的原子序数,原子序数大的,即为大基团。 例如:—CH3;—NH2 ; —OH;—Cl;—Br B 若直接相连原子的原子序数相同,则按顺序比较下一个 原子的原子序数,直到比出大小为止。
31第三章烯烃
2px 2py 2pz 2s
isolated C atom
2pz sp2 sp2 sp2
hybridised C atom in C2X4
134pm
120
154pm CC
Planar
sp2
sp2
sp2
sp2
pp
H C
H
H
+
C
H
H C
H
H C
H
H
C H
H C
H
存在
σ
独立存在
(两核之间只能有一个σ)
H
CH3
C
C
H
CH3
顺式
H
CH3
C
C
CH3
H
反式
顺式:沸点高 反式:沸点低
μ = 0.33D bp = 3.7 0C (偶极矩大) mp = -139 0C (对称性低)
μ= 0 bp = 0.9 0C (偶极矩小) mp = -106 0C (对称性高)
3.4 烯烃的化学性质
C
H3C CH = CH2
没有必然的联系
基:
CH2 =
CH2 = CH
CH3 CH = CH
CH2 = CH CH2 43 21 CH3 CH = CH CH2
CH3 CH2 CH = CH
(亚甲基) 乙烯基 丙烯基 烯丙基 2 – 丁烯基 丁烯基 请记住这些基的名称
3.3 烯烃的物理性质
沸点—偶极矩—大,bp大 熔点—对称性—大,mp大
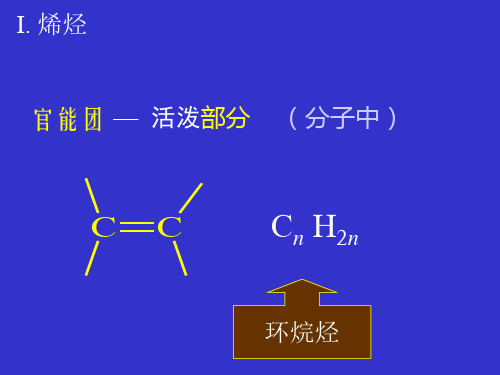
I. 烯烃 官能团 — 活泼部分 (分子中)
CC
Cn H2n
环烷烃
3.1 烯烃的结构 Electronic Structure 乙烯:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解:Cl2与C=C的加成有两种机理,一种经环正离子中间体完成,另一种是经碳正离子中间体完成。这两种反应的机理分别如下:
(1)环正离子中间体机理:
(2)碳正离子中间体机理:
3-5(大连理工大学2005年硕士研究生入学考试试题)试用反应机理说明下列反应现象:
解:本题考查烯烃的α氢原子卤代反应,NBS在光照条件下引发产生溴自由基,烯烃的α氢原子由于受双键的影响比较活泼,容易被夺去而形成新的自由基,与溴自由基发生链终止后得到产物。反应机理为:
解:本题考察烯烃ui次溴酸的加成反应,有方程式:
3-17(中科院2002年硕士研究生入学考试试题)填空题
解析:NBS与丙烯α氢原子发生卤代反应,得到 ,丙烯与HBr加成符合马尔科夫尼科夫规律,得到 。
3-18(浙江工业大学2008年硕士研究生入学考试试题)化合物 的系统命名是:
答案:(Z)-3-甲基-3-己烯。
3-19(华东理工大学2006年硕士研究生入学考试试题)命名或写出下列化合物的结构。
答案:(Z)-3,4-二甲基-3-庚烯
解:该化合物有七个碳原子,双键在第三个碳原子上,故命名为3,4-二甲基-3-庚烯。由于优先基团位于双键的同侧,在空间构型上为顺式,所以该化合物的系统命名为:(Z)-3,4-二甲基-3-庚烯。
各步反应如下:
(1)
(2)
(3)
3-2(南京航空航天大学2007年硕士研究生考试试题)反应机理推断。
解:反应机理为:
3-3(浙江工业大学2007年硕士研究生入学考试试题)对下列反应提出合理的机理解释。
解:烯烃与溴离子的加成机理为溴鎓离子机理,机理如下:
3-4(西安交通大学2005年硕士研究生入学考试试题)写出下列反应的机理:
3-6(华中科技大学2004年硕士研究生入学考试试题)写出下列反应的机理。
解:(1)溴化氢被引发产生溴自由基:
(1)溴自由基夺取一个氢:
3-7(大连理工大学2004年硕士研究生入学考试试题)写出下列反应的机理:。
解:本题考查烯烃α氢原子的氯代反应,反应机理为:
Cl2在500℃下分解产生氯自由基:
3-8(大连理工大学2004年硕士研究生入学考试试题)合成题:有丙烯为原料合成丁酸。
解:A的分子式为C5H10,可知A有一个双键或环烷烃,又根据其与溴作用只得到一种产物,所以A为 。
各步反应为:
3-27(吉林大学2005-2006学年第2学期期末考试试题)反应题(写出主要有机产物,如有立体化学问题请注明)。
3-28(北京化工大学2006-2007学年第1学期期末考试试题)完成下列反应:
解:根据烯烃的反马氏规则加成反应得到卤代烷烃,卤代烷与金属镁在干醚的作用下生成的格利雅试剂与二氧化碳反应水解生成羧酸。合成过程为:
3-9(上海交通大学2005年硕士研究生入学考试试题)完成下列转化(无机试剂任选):
解:根据烯烃加成和烷烃的取代反应,完成转化的各步反应如下:
3-10(南京航空航天大学2008年硕士研究生入学考试试题)完成下列反应式,写出主要产物。
3-30(陕西师范大学2005-2006学年第1学期期末考试试题)完成反应。
解:(1)根据烯烃与臭氧的氧化反应知,水解后的产物为 。
(2)根据烯烃的加成反应,得到反式加成物 。
(3)根据烯烃α氢原子的氯代反应得到a:CH2=CH=CH2-Cl;根据烯烃的硼氢化反应得到b:CH3-CH2-CH2-OH;根据烯烃与水的加成反应得到c: 。
3-20(中科院2006年硕士研究生入学考试试题)比较下列碳正离子的稳定性。
答案:A﹥B﹥D﹥C。
解析:考察碳正离子稳定性的顺序。
3-21(大连理工大学2004年硕士研究生入学考试试题)下列碳正离子中,()最稳定。
答案:A。
解析:A中羟基氧上含孤对电子,可以与带正电荷的碳原子共轭,使电荷分散。
3-22(中国科学院2002年硕士研究生入学考试试题)下列碳正离子最稳定的是:
过氧化物在光照下产生自由基:
溴自由基的产生:
(2)反应机理:
3-26(湖南大学2005-2006学年第2学期期末考试试题)某烃A,分子式为C5H10,它与溴水不发生反应,在紫外光照射下与溴作用只得一种产物B(C5H9Br)。将化合物B与KOH的醇溶液作用得到C(C5H8),化合物C经臭氧化并在Zn粉存在下水解得到戊二醛。写出化合物A的构造式及各步反应。
解:(1)根据烯烃与卤化氢的加成反应,产物为CF3CH2CH2Cl,符合马氏规则。
(2)发生的反应为:
3-32(天津大学2003-2004学年第1学期期末考试试题)用系统命名法命名下列化合物或写出构造式。
解:根据烯烃的命名规则,可以命名为:
(1)(E)-6-氯-4-己烯-2-醇(2)3-(2-甲基丙基-4-己烯-1-炔
3-12(上海交通大学2006年硕士研究生入学考试试题)完成下列反应:
解:根据下述反应:
3-13(北京交通大学2004年硕士研究生入学考试试题)完成下列反应.
解:(1)根据烯烃的硼基化反应,发生的反应为:
(2)发生的反应为:
3-14(浙江大学2004年硕士研究生入学考试试题)完成下列反应,若为立体选择性反应,需写出产物的立体结构。
链终止:
3-24(吉林大学2005-2006学年第2学期期末考试试题)为下面的反应提出合理的、分步的反应机理。
解:反应机理可以分以下几步完成,具体为:
3-25(吉林大学2004-2005学年第2学期期末考试试题)为下面的反应提出合理的、分步的反应机理,用弯箭头表示电子对的转移。
解:(1)反应机理为:
(4)烯烃的硼氢化反应产物水解得到 。
(5)根据烯烃与HBr的加成反应,产物符合马氏加成规律,得到 。
(6)根据烯烃α氢原子较活泼,能发生取代反应,得到 。
(7)根据烯烃与HBr在过氧化物作用下发生自由基加成反应,得到 。
3-31(天津大学2003-2004学年第1学期期末考试试题)完成下列各反应式。
解:根据烯烃的反马氏加成规律,过氧化物引发生成溴自由基,过氧化物与烯烃发生自由基加成,生成CH3CH2CH2Br。
3-11(中科院2006年硕士研究生入学考试试题)完成下列反应,如有立体化学问题,请注明。
解:根据烯烃的硼氢化反应
C3H6CH(CH3)CHOH考虑其在空间中的立体构型,所以答案为: 或 。
(3)
第三章烯烃
3-1(南京航空航天大学2008年硕士研究生入学考试试题)某烯烃经催化剂加氢得到2-甲基丁烷。加HCl得到2-甲基-2-氯丁烷。如经臭氧化并在锌粉存在下水解,可以得到丙酮(CH3COCH3)和乙醛(CH2COH),写出该烯烃的结构式以及各步反应。
解:根据烯烃的加氢加氯化氢化物可知该烯烃有两个甲基,根据臭氧化水解产物可得出该烯烃的分子结构为: 。
答案:D。
解析:根据碳正离子稳定性顺序,与D中存在p-π共轭效应,使电荷分散,其它选项没有。
3-23(北京化工大学2006-2007学年第1学期期末考试试题)写出下列反应的反应机理。
(有机过氧化物可用R-O-O-R表示)。
解:此反应机理为自由基取代机理,具体为:
链引发:
链增长:
重复进行,直到链终止。
解:NBS与烯烃α氢原子发生卤代反应:
与次溴酸发生加成反应:
最后发生消去反应:
3-15(华中科技大学2004硕士研究生入学考试试题)完成下列反应。
解:(1)根据烯烃的硼氢化反应,有:
(2)根据环烯烃的氧化反应,得到产物 和 。
(3)根据烯烃与O3反应的产物生成醛和酮的反应,有:
3-16(兰州大学2003年硕士研究生入学考试试题)写出下列反应的主要产物,如有立体异构体,需标明产物的立体结构。
3-29(湖南大学2005-2006学年第2学期期末考试试题)完成下列反应,写出主要产物。
解:(1)CH3CH2CH=CH2与HBr在过氧化物的作用下发生自由基加成反应,反应符合反马尔科夫尼科夫规律,产物是CH2CH2CH2Br。
(2)此反应分两步进行,第一步
(1)环正离子中间体机理:
(2)碳正离子中间体机理:
3-5(大连理工大学2005年硕士研究生入学考试试题)试用反应机理说明下列反应现象:
解:本题考查烯烃的α氢原子卤代反应,NBS在光照条件下引发产生溴自由基,烯烃的α氢原子由于受双键的影响比较活泼,容易被夺去而形成新的自由基,与溴自由基发生链终止后得到产物。反应机理为:
解:本题考察烯烃ui次溴酸的加成反应,有方程式:
3-17(中科院2002年硕士研究生入学考试试题)填空题
解析:NBS与丙烯α氢原子发生卤代反应,得到 ,丙烯与HBr加成符合马尔科夫尼科夫规律,得到 。
3-18(浙江工业大学2008年硕士研究生入学考试试题)化合物 的系统命名是:
答案:(Z)-3-甲基-3-己烯。
3-19(华东理工大学2006年硕士研究生入学考试试题)命名或写出下列化合物的结构。
答案:(Z)-3,4-二甲基-3-庚烯
解:该化合物有七个碳原子,双键在第三个碳原子上,故命名为3,4-二甲基-3-庚烯。由于优先基团位于双键的同侧,在空间构型上为顺式,所以该化合物的系统命名为:(Z)-3,4-二甲基-3-庚烯。
各步反应如下:
(1)
(2)
(3)
3-2(南京航空航天大学2007年硕士研究生考试试题)反应机理推断。
解:反应机理为:
3-3(浙江工业大学2007年硕士研究生入学考试试题)对下列反应提出合理的机理解释。
解:烯烃与溴离子的加成机理为溴鎓离子机理,机理如下:
3-4(西安交通大学2005年硕士研究生入学考试试题)写出下列反应的机理:
3-6(华中科技大学2004年硕士研究生入学考试试题)写出下列反应的机理。
解:(1)溴化氢被引发产生溴自由基:
(1)溴自由基夺取一个氢:
3-7(大连理工大学2004年硕士研究生入学考试试题)写出下列反应的机理:。
解:本题考查烯烃α氢原子的氯代反应,反应机理为:
Cl2在500℃下分解产生氯自由基:
3-8(大连理工大学2004年硕士研究生入学考试试题)合成题:有丙烯为原料合成丁酸。
解:A的分子式为C5H10,可知A有一个双键或环烷烃,又根据其与溴作用只得到一种产物,所以A为 。
各步反应为:
3-27(吉林大学2005-2006学年第2学期期末考试试题)反应题(写出主要有机产物,如有立体化学问题请注明)。
3-28(北京化工大学2006-2007学年第1学期期末考试试题)完成下列反应:
解:根据烯烃的反马氏规则加成反应得到卤代烷烃,卤代烷与金属镁在干醚的作用下生成的格利雅试剂与二氧化碳反应水解生成羧酸。合成过程为:
3-9(上海交通大学2005年硕士研究生入学考试试题)完成下列转化(无机试剂任选):
解:根据烯烃加成和烷烃的取代反应,完成转化的各步反应如下:
3-10(南京航空航天大学2008年硕士研究生入学考试试题)完成下列反应式,写出主要产物。
3-30(陕西师范大学2005-2006学年第1学期期末考试试题)完成反应。
解:(1)根据烯烃与臭氧的氧化反应知,水解后的产物为 。
(2)根据烯烃的加成反应,得到反式加成物 。
(3)根据烯烃α氢原子的氯代反应得到a:CH2=CH=CH2-Cl;根据烯烃的硼氢化反应得到b:CH3-CH2-CH2-OH;根据烯烃与水的加成反应得到c: 。
3-20(中科院2006年硕士研究生入学考试试题)比较下列碳正离子的稳定性。
答案:A﹥B﹥D﹥C。
解析:考察碳正离子稳定性的顺序。
3-21(大连理工大学2004年硕士研究生入学考试试题)下列碳正离子中,()最稳定。
答案:A。
解析:A中羟基氧上含孤对电子,可以与带正电荷的碳原子共轭,使电荷分散。
3-22(中国科学院2002年硕士研究生入学考试试题)下列碳正离子最稳定的是:
过氧化物在光照下产生自由基:
溴自由基的产生:
(2)反应机理:
3-26(湖南大学2005-2006学年第2学期期末考试试题)某烃A,分子式为C5H10,它与溴水不发生反应,在紫外光照射下与溴作用只得一种产物B(C5H9Br)。将化合物B与KOH的醇溶液作用得到C(C5H8),化合物C经臭氧化并在Zn粉存在下水解得到戊二醛。写出化合物A的构造式及各步反应。
解:(1)根据烯烃与卤化氢的加成反应,产物为CF3CH2CH2Cl,符合马氏规则。
(2)发生的反应为:
3-32(天津大学2003-2004学年第1学期期末考试试题)用系统命名法命名下列化合物或写出构造式。
解:根据烯烃的命名规则,可以命名为:
(1)(E)-6-氯-4-己烯-2-醇(2)3-(2-甲基丙基-4-己烯-1-炔
3-12(上海交通大学2006年硕士研究生入学考试试题)完成下列反应:
解:根据下述反应:
3-13(北京交通大学2004年硕士研究生入学考试试题)完成下列反应.
解:(1)根据烯烃的硼基化反应,发生的反应为:
(2)发生的反应为:
3-14(浙江大学2004年硕士研究生入学考试试题)完成下列反应,若为立体选择性反应,需写出产物的立体结构。
链终止:
3-24(吉林大学2005-2006学年第2学期期末考试试题)为下面的反应提出合理的、分步的反应机理。
解:反应机理可以分以下几步完成,具体为:
3-25(吉林大学2004-2005学年第2学期期末考试试题)为下面的反应提出合理的、分步的反应机理,用弯箭头表示电子对的转移。
解:(1)反应机理为:
(4)烯烃的硼氢化反应产物水解得到 。
(5)根据烯烃与HBr的加成反应,产物符合马氏加成规律,得到 。
(6)根据烯烃α氢原子较活泼,能发生取代反应,得到 。
(7)根据烯烃与HBr在过氧化物作用下发生自由基加成反应,得到 。
3-31(天津大学2003-2004学年第1学期期末考试试题)完成下列各反应式。
解:根据烯烃的反马氏加成规律,过氧化物引发生成溴自由基,过氧化物与烯烃发生自由基加成,生成CH3CH2CH2Br。
3-11(中科院2006年硕士研究生入学考试试题)完成下列反应,如有立体化学问题,请注明。
解:根据烯烃的硼氢化反应
C3H6CH(CH3)CHOH考虑其在空间中的立体构型,所以答案为: 或 。
(3)
第三章烯烃
3-1(南京航空航天大学2008年硕士研究生入学考试试题)某烯烃经催化剂加氢得到2-甲基丁烷。加HCl得到2-甲基-2-氯丁烷。如经臭氧化并在锌粉存在下水解,可以得到丙酮(CH3COCH3)和乙醛(CH2COH),写出该烯烃的结构式以及各步反应。
解:根据烯烃的加氢加氯化氢化物可知该烯烃有两个甲基,根据臭氧化水解产物可得出该烯烃的分子结构为: 。
答案:D。
解析:根据碳正离子稳定性顺序,与D中存在p-π共轭效应,使电荷分散,其它选项没有。
3-23(北京化工大学2006-2007学年第1学期期末考试试题)写出下列反应的反应机理。
(有机过氧化物可用R-O-O-R表示)。
解:此反应机理为自由基取代机理,具体为:
链引发:
链增长:
重复进行,直到链终止。
解:NBS与烯烃α氢原子发生卤代反应:
与次溴酸发生加成反应:
最后发生消去反应:
3-15(华中科技大学2004硕士研究生入学考试试题)完成下列反应。
解:(1)根据烯烃的硼氢化反应,有:
(2)根据环烯烃的氧化反应,得到产物 和 。
(3)根据烯烃与O3反应的产物生成醛和酮的反应,有:
3-16(兰州大学2003年硕士研究生入学考试试题)写出下列反应的主要产物,如有立体异构体,需标明产物的立体结构。
3-29(湖南大学2005-2006学年第2学期期末考试试题)完成下列反应,写出主要产物。
解:(1)CH3CH2CH=CH2与HBr在过氧化物的作用下发生自由基加成反应,反应符合反马尔科夫尼科夫规律,产物是CH2CH2CH2Br。
(2)此反应分两步进行,第一步
