美国新药申请手续
美国FDA新药注册申报NDA流程简介

美国FDA新药注册申报NDA流程简介
美国FDA(Food and Drug Administration)是负责监管药品的安全性和有效性的机构。
NDA(New Drug Application)是制药公司向FDA提交的新药注册申报文件,它是提交给FDA以申请新药上市的必要步骤。
NDA的流程可以大致分为以下几个步骤:
1.前期研究:制药公司在研发新药之前通常会进行多个阶段的临床试验,以评估新药的安全性和有效性。
这些临床试验的结果将用于NDA中。
2.提交申请:在完成所有必要的研究和试验后,制药公司将准备并提交NDA申请给FDA。
这个申请包括新药的所有相关信息,如药物成分、制造过程、稳定性、临床试验结果、药品标签等。
3.文件审查:FDA会对提交的NDA进行审查,确保申请文件的完整性和合规性。
如果发现不完整或有疑问的地方,FDA可能会请求补充信息或进一步解释。
4.审查评估:FDA的药品审评员会对申请进行详细评估,根据临床试验数据、药物的安全性和有效性等因素,来判断是否批准新药上市。
审评员可能会与制药公司进行沟通,提出问题或寻求进一步资料。
5.决策:基于审评员的评估和建议,FDA会做出决策,即批准或拒绝新药的上市申请。
如果批准,FDA会制定药品标签和使用说明等要求。
需要注意的是,整个NDA流程可能需要一段时间,通常需要
几年的时间来完成。
此外,FDA还有一些快速审评程序,如加速审评、优先审评等,可以加快某些重要新药的审批速度。
【医疗药品管理】FDA新药申请指南
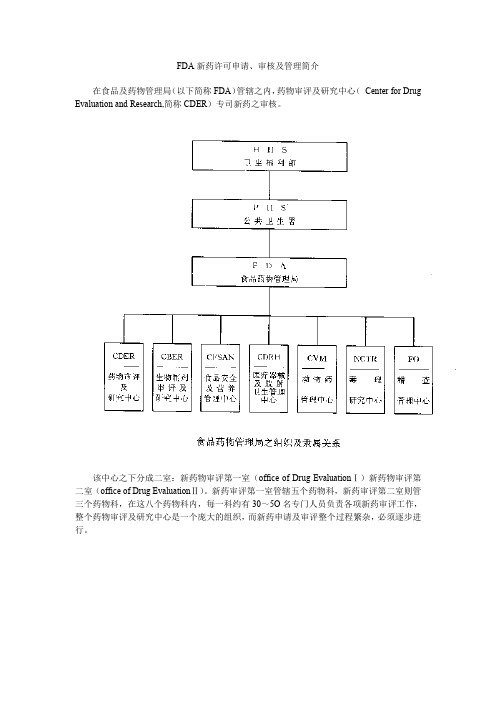
FDA新药许可申请、审核及管理简介在食品及药物管理局(以下简称FDA)管辖之内,药物审评及研究中心(Center for Drug Evaluation and Research,简称CDER)专司新药之审核。
该中心之下分成二室:新药物审评第一室(office of Drug EvaluationⅠ)新药物审评第二室(office of Drug EvaluationⅡ)。
新药审评第一室管辖五个药物科,新药审评第二室则管三个药物科,在这八个药物科内,每一科约有30~5O名专门人员负责各项新药审评工作,整个药物审评及研究中心是一个庞大的组织,而新药申请及审评整个过程繁杂,必须逐步进行。
药物审评及研究中心(Center for Drug Evalution and Research,CDER)之组织说明如下:1.秘书室(Executive Secretariant Staff)2.总务室(Office of Management)(l)药物资记中心(Drug Information Resource)(2)医学图书馆(Medical Library)(3)总务及王计(Management and Budget)(4)资讯系统设计(Information System Design)3.专业进修室(Professional Development)4.顾问团(Advisors and Consultants Staff)5·前导性新药审评(Pilot Drug Evaluation)6.非处方药审评室(office of OTC Drug Evaluation)(1)单篇非处方药审评室(MonograPh Review Staff)(2)非处方药政策性科(OTC Drug Policy Staff)(3)医学审评科(Medical Review Staff)7.非专利处方药室(office of Generic Drugs)(1)化学第一科(ChemistryⅠ)(2)化学第二科(ChemistryⅡ)(3)生体相等性科(Bioequivalence)8.研究发展室(Office of Research Resources)(1)研究及试验科(Research and Testing)(2)药品分析科(Drug Analysis)(3)生体药学科(Biopharmaceutics)(4)临床药理科(Clinical pharmacology)9.新药标准室(Office of Drug Standards)(l)新药市场广告及信息科(Drug Marketing,Advertising and Communications)10.新药合法性室(Office of Compliance)(1)新药信息科(Drug Labeling Compliance)(2)新药品质审核科(Drug Quality Evaluation)(3)新药产品及制造品质科(Mahufacturing and Product Quality)(4)科学性侦查科(Scientific Investigations)(5)新药管理科(Regulatory Affairs)11.新药流行学及统计生物学室(Office of Epidemiology and Biostatistics)(1)流行学及监视科(Epidemiology and Surveillances)(2)生物统计科(Biometrics)12.新药审评第一室(Office of Drug EvaluationⅠ,ODEI)(1)心脏药物科(Division of Cardio-Renal Drug Products)(2)神经药物科(Division of Neuropharmacological Drug Products)(3)肿瘤肺药物科(Division of Oncology and Pulmonary Drug Products)(4)影像、手术及牙药物科(Division of Medical Imaging Surgical and Dental Drug Products)(5)胃肠及凝血药物科(Division of Gastrointestinal and Coagulation Drug Products)13.新药审评第二室(Office of Drug Evaluation Ⅱ, ODE Ⅱ)(1)新陈代谢及内分泌药物科(Division of Metabolism and Endocrine Drug ProductS)(2)抗传染药物科(Division of Anti-Infective Drug Products )(3)抗病毒药物科(Division of Anti—Viral Drug ProductS)二、新药申请(一)药物的定义依据联邦食品药物及化妆品法第二章第201节,药物的定义如下:l.美国药典,同种治疗法药典,或者国家处方集(National Formulary)中所列的物质。
FDA新药审批流程简述

FDA新药审批流程简述FDA(美国食品药品监督管理局)负责监管并审批新药的上市。
下面将对FDA新药审批流程进行简述。
1.阶段Ⅰ临床试验:新药首先在健康志愿者身上进行,评估药物的安全性和耐受性,并确定药物的剂量范围。
2.阶段Ⅱ临床试验:新药在患者身上进行,评估药物的疗效和副作用。
试验时间较长,研究人员需要收集更多的数据,以确定新药的安全性和效力。
3.阶段Ⅲ临床试验:新药在大规模患者群体身上进行,以证明其疗效和安全性是否持久有效,并与现有的治疗方法进行比较。
4.新药申请:药企将试验结果提交给FDA,并申请新药上市批准。
包括药物的数据和试验结果,使用方法等。
FDA会评估申请材料。
5.NDA审批:NDA(新药申请)包括对药物研究的细节、试验结果等的描述。
FDA对NDA进行评估,确定药物是否符合上市标准。
此过程可能需要数月或数年。
6.审查:FDA将药物进行详细审查,并与药企进行沟通,以充分了解药物的性质和潜在的风险。
7.审查会议:FDA可能会召开药物审查会议,邀请专家、学者和公众就药物的疗效和风险发表意见。
8.确认上市:如果FDA认为新药符合上市标准,将发出批准通知,允许药企将新药投入市场销售。
以上是FDA新药审批流程的简要概述。
在流程中,FDA扮演着保障公众健康和安全的角色,确保新上市的药物是安全有效的。
FDA New Drug Approval Process OverviewThe FDA (U.S. Food and Drug Administration) is responsible for regulating and approving new drugs for market. The following is an overview of the FDA's new drug approval process.1. Phase I Clinical Trials: The new drug is first tested on healthy volunteers to assess its safety and tolerability and determine the dosage range.5. NDA Approval: The NDA (New Drug Application) includes a detailed description of the drug's research, trial results, etc. The FDA evaluates the NDA to determine if the drug meets the approval standards. This process can take months or years.7. Review Meetings: The FDA may hold drug review meetings where experts, scholars, and the public are invited to provide opinions on the drug's efficacy and risks.9. Post-Market Surveillance: The FDA continues to monitor the drug's safety and effectiveness, collects feedback from the market, and takes necessary actions, including further research and updating warning labels.The above is a brief overview of the FDA's new drug approval process. Throughout the process, the FDA plays a crucial role insafeguarding public health and safety, ensuring that newly marketed drugs are safe and effective.。
FDA新药审批流程简述

FDA新药审批流程简述FDA(美国食品药品监督管理局)是负责监督和管理美国食品和药品安全的联邦机构。
它负责确保市场上的药品是安全有效的,并且符合严格的审批标准。
新药审批是FDA的主要职责之一,它是一个复杂且漫长的过程,通常包括以下几个步骤:1.提交新药申请(NDA)首先,药物制造商需要通过NDA向FDA提交有关新药的完整资料。
这些资料通常包括药物的化学成分、制造工艺、药理学研究、临床试验数据以及用于治疗的适应症等信息。
此外,还需要提供药物的质量、安全和有效性的证据。
2.评估申请文件一旦FDA收到NDA,会对申请文件进行评估。
这个过程通常包括对文件的完整性和合规性的审查,例如核实所有必需的资料是否齐全。
如果缺少必要的信息,FDA可能会要求制造商提供补充材料。
3.优先审批对于一些药物,FDA可能会给予优先审批待遇。
例如,对于治疗一些严重疾病的新药,FDA可能会加快审批速度,以符合患者的迫切需求。
4.临床试验阶段一旦FDA确认NDA文件完整无误,药物制造商可以开展临床试验。
临床试验是评估药物疗效和安全性的关键步骤,通常分为三个阶段(I、II、III)。
这些试验需要遵守严格的方案和伦理规定,以确保患者的安全和药物的有效性。
5.申请审核委员会的审查在临床试验结束后,药物制造商将向FDA提交试验结果,并要求FDA审核审查委员会对其进行审查。
审查委员会是由FDA专家组成的独立机构,他们会仔细评估试验结果以及相关数据和文献,并发表意见。
这些意见对于FDA的最终决策具有重要影响。
6.申请批准在经过临床试验和审查后,FDA将根据收集到的数据和顾问委员会的意见,决定是否批准新药上市。
如果FDA认为药物的风险和益处之间的平衡是积极的,它将批准新药,并颁发批准证书。
7.监督上市后安全性一旦新药获得批准,FDA对其进行监督,以确保其安全性和真实性。
制造商需要持续向FDA提供有关药物的安全性和有效性的信息。
此外,FDA还通过药物安全盛会进行监测,并与制造商和医疗专业人员合作,收集和分析有关药物的副作用和其他安全问题的信息。
fda申请流程

fda申请流程
美国食品药品监督管理局(FDA)的药品审批流程如下:
1. 新药仿制品开发阶段:研发人员在进行药物开发过程后,把研发成果提交给FDA审核。
2. 预申请(Pre-IND)阶段:申请者向FDA提交一份详细的文件,描述了要研究的药物,提供了初步的安全性和效力证据,以及可支持药物的基本药学特性。
FDA将回复申请者,要求其提供有关clincial trials的资料及其他额外信息。
3. 申请阶段(IND):申请者向FDA提交IND文件,包括临床前及临床试验的原始资料及数据,以证明药品安全性和有效性。
4.研究人员在FDA获得批准后,可以正式开展药物临床试验,在各个阶段进行临床研究,收集临床数据,并分析和评估药物的安全性和有效性。
5. 提交表决材料:在数据收集和临床试验阶段结束后,申请者可以向FDA提交申请文件,提供有关临床研究的报告和数据,并解释其研究结果及证据。
6. FDA审查:FDA将审查申请所提供的所有文件及数据,进行详尽的评估,确保药物质量满足有关标准,药物安全有保障,和效果可满足期望。
7. FDA作出批准或拒绝决定:根据审核结果,FDA将向申请者发出相关文件,批准或者拒绝其新药仿制品的申请。
欧美新药注册介绍和案例

欧美新药注册介绍和案例欧美新药注册是指将新的药物推向市场之前,必须经过一系列严格的审查和验证程序,确保其安全性、有效性和质量。
在欧美,新药注册通常需要进行临床试验、获得批准、监测和报告等步骤。
本文将介绍欧美新药注册的整体流程,并通过案例分析其具体应用情况。
欧美新药注册流程通常分为以下几个主要阶段:1.预临床阶段:在试验室和动物模型中评估药物的毒理学、药代动力学、药物相互作用等特性。
这一阶段的目标是确定药物是否具有潜力用于治疗人类疾病,并确定其安全性。
2.临床试验阶段:将药物用于人体进行试验,以确定其安全性和有效性。
临床试验分为三个阶段:(1)第I期试验:在健康志愿者中进行,主要评估药物的药代动力学、毒理学和耐受性。
(2)第II期试验:在患者中进行,主要评估药物的疗效、剂量反应关系和副作用。
(3)第III期试验:在大量患者中进行,用于确认药物的疗效和安全性,并与现有治疗方案进行比较。
3.注册申请:在完成临床试验后,药企可以向监管机构提交注册申请。
这些申请文件通常包括药物的质量控制、制造过程、药代动力学、毒理学和临床数据等。
4.批准和监管:监管机构将对注册申请进行评估,并根据药物的疗效、安全性和质量决定是否批准上市。
注册通过后,监管机构会继续监督药物的安全性和有效性,药企需要定期提交监测和报告。
下面我们通过一个案例来了解具体的欧美新药注册流程。
以美国食品药品监督管理局(FDA)为例,根据其官方网站提供的信息,我们了解到Imfinzi(durvalumab)是一种用于治疗晚期肺癌的免疫治疗药物。
1.预临床阶段:Imfinzi在机体内的药物动力学和毒性特性通过预临床评估得到初步验证,并显示出潜力用于治疗晚期肺癌。
2.临床试验阶段:Imfinzi进行了一系列的临床试验,其中包括:(1)第I期试验:对健康志愿者进行试验,验证药物的安全性和药代动力学。
(2)第II期试验:对晚期肺癌患者进行试验,评估药物的疗效和副作用。
FDA新药审批流程

从FDA新药审批流程来推算HIP成为新药的最快时间大家一直对cureDM公司的HIP很关注,确实,如果基于此原理的新药对人体有效并安全的话,无疑是大家的福音。
不过自从2010年4月cureDM和Sanofi-aventis 公司达成对于HIP全球独占专利许可协议后,该药的研发一直没有消息,论坛中很多人都很失望。
在此,通过简单分析,来看看这个药如果真的研发成功,需要等多久我们才能用到。
FDA新药审批流程如下:临床前试验:由制药公司进行的实验室和动物研究,以观察化合物针对目标疾病的生物活性,同时对化合物进行安全性评估。
这些试验大概需要3.5年的时间。
研发中新药申请(Investigational New Application,IND):在临床前试验完成后,公司要向FDA提请一份IND,之后才能开始进行药物的人体试验。
如果30天内FDA没有发出不予批准的申明,此IND即为有效。
提出的IND需包括以下内容:先期的试验结果,后续研究的方式、地点以及研究对象;化合物的化学结构;在体内的作用机制;动物研究中发现的任何毒副作用以及化合物的生产工艺。
另外,IND 必须得到制度审核部门(the Institutional Review Board)的审核和批准。
同时,后续的临床研究需至少每年向FDA提交一份进展报告并得到准许。
临床试验,I期:此阶段大概需要1年时间,由20~80例正常健康志愿者参加。
这些试验研究了药物的安全性方面,包括安全剂量范围。
此阶段的研究同时确定了药物在体内的吸收、分布、代谢和排泄、以及药物的作用持续时间等项目。
临床试验,II期:此阶段需要约100到300名志愿患者参与进行一些控制研究,以评价药物的疗效。
这个阶段大约需要2年时间。
临床试验,III期:此阶段持续约3年时间,通常需要诊所和医院的1000~300名患者参与。
医师通过对病患的监测以确定疗效和不良反应。
新药申请(New Drug Application,NDA):通过三个阶段的临床试验,公司将分析所有的试验数据。
一文读懂FDA新药注册流程

一文读懂FDA新药注册流程FDA(美国食品药品监督管理局)是一个负责监管和审批新药上市的机构。
其新药注册流程遵循一系列严格的标准和程序,确保新药的安全性和有效性。
以下是一份详细的描述FDA新药注册流程的1200字以上文章。
FDA新药注册流程是一个复杂而严格的过程,旨在保护公众的健康和安全。
该流程通常分为三个主要阶段:实验室研究、临床试验和申请审批。
首先,在实验室研究阶段,新药的发现和开发开始于基础科学研究。
科学家们进行一系列的实验,以验证一些化合物是否具有潜在的治疗效果。
这个阶段的目标是鉴定和筛选出可能的药物候选。
一旦确定了潜在的候选者,科学家会继续开展研究,并了解药物的药动学、药理学和安全性。
接下来,进入临床试验阶段。
在这个阶段,新药候选者将在人体中进行测试。
临床试验是一系列严格控制的研究,其目的是评估药物的安全性和有效性。
临床试验分为三个阶段,每个阶段都有不同的目标和参与人数。
第一阶段的临床试验是对一小群健康志愿者进行的,目的是评估药物的安全性和耐受性,并确定适当的剂量。
这个阶段通常只涉及数十名志愿者,并在医院或临床研究中心进行。
第二阶段的临床试验是在相对较大的患者群体中进行的,通常包括数百名患者。
这个阶段的主要目标是确定药物的疗效,并进一步评估安全性。
经过第二阶段的临床试验,确定了相对安全和有效的药物剂量和用法。
第三阶段的临床试验是最大规模的研究,通常包括数千名患者。
在这个阶段,药物的疗效和安全性将在各种人群中进行全面评估。
这些试验旨在确认药物是否比现有疗法更安全或更有效。
此阶段可能需要数年时间,并需收集大量的数据和信息。
一旦临床试验完成,并证明了药物的安全性和有效性,便可以进入申请审批阶段。
在这一阶段,该药物的制造商将向FDA提交一份申请,申请批准该药物上市。
申请中需要包括所有先前实验室和临床试验的数据和报告。
申请审批是一个详细和复杂的过程。
FDA的专业人员将仔细研究申请中的数据,确保其准确性和可靠性。
美国FDA新药许可申请、审核及管理简介
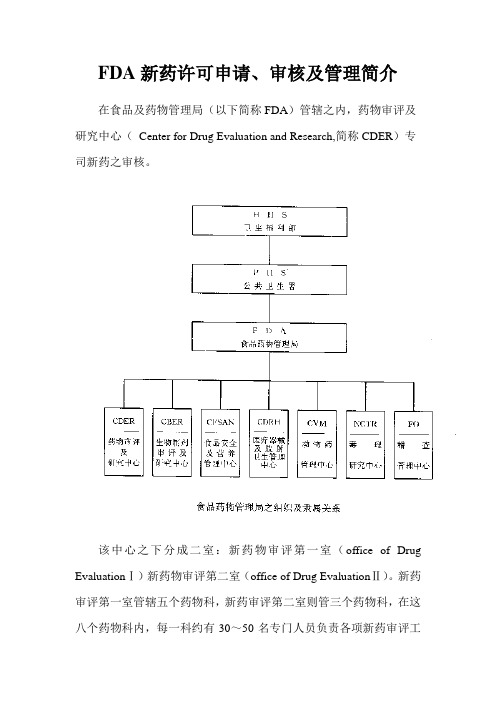
FDA新药许可申请、审核及管理简介在食品及药物管理局(以下简称FDA)管辖之内,药物审评及研究中心(Center for Drug Evaluation and Research,简称CDER)专司新药之审核。
该中心之下分成二室:新药物审评第一室(office of Drug EvaluationⅠ)新药物审评第二室(office of Drug EvaluationⅡ)。
新药审评第一室管辖五个药物科,新药审评第二室则管三个药物科,在这八个药物科内,每一科约有30~50名专门人员负责各项新药审评工作,整个药物审评及研究中心是一个庞大的组织,而新药申请及审评整个过程繁杂,必须逐步进行。
药物审评及研究中心(Center for Drug Evalution and Research,CDER)之组织说明如下:1.秘书室(Executive Secretariant Staff)2.总务室(Office of Management)(l)药物资记中心(Drug Information Resource)(2)医学图书馆(Medical Library)(3)总务及王计(Management and Budget)(4)资讯系统设计(Information System Design)3.专业进修室(Professional Development)4.顾问团(Advisors and Consultants Staff)5·前导性新药审评(Pilot Drug Evaluation)6.非处方药审评室(office of OTC Drug Evaluation)(1)单篇非处方药审评室(MonograPh Review Staff)(2)非处方药政策性科(OTC Drug Policy Staff)(3)医学审评科(Medical Review Staff)7.非专利处方药室(office of Generic Drugs)(1)化学第一科(ChemistryⅠ)(2)化学第二科(ChemistryⅡ)(3)生体相等性科(Bioequivalence)8.研究发展室(Office of Research Resources)(1)研究及试验科(Research and Testing)(2)药品分析科(Drug Analysis)(3)生体药学科(Biopharmaceutics)(4)临床药理科(Clinical pharmacology)9.新药标准室(Office of Drug Standards)(l)新药市场广告及信息科(Drug Marketing,Advertising and Communications)10.新药合法性室(Office of Compliance)(1)新药信息科(Drug Labeling Compliance)(2)新药品质审核科(Drug Quality Evaluation)(3)新药产品及制造品质科(Mahufacturing and Product Quality)(4)科学性侦查科(Scientific Investigations)(5)新药管理科(Regulatory Affairs)11.新药流行学及统计生物学室(Office of Epidemiology and Biostatistics)(1)流行学及监视科(Epidemiology and Surveillances)(2)生物统计科(Biometrics)12.新药审评第一室(Office of Drug EvaluationⅠ,ODEI)(1)心脏药物科(Division of Cardio-Renal Drug Products)(2)神经药物科(Division of Neuropharmacological Drug Products)(3)肿瘤肺药物科(Division of Oncology and Pulmonary Drug Products)(4)影像、手术及牙药物科(Division of Medical Imaging Surgical and Dental Drug Products)(5)胃肠及凝血药物科(Division of Gastrointestinal and Coagulation Drug Products)13.新药审评第二室(Office of Drug Evaluation Ⅱ, ODE Ⅱ)(1)新陈代谢及内分泌药物科(Division of Metabolism and Endocrine Drug ProductS)(2)抗传染药物科(Division of Anti-Infective DrugProducts )(3)抗病毒药物科(Division of Anti—Viral Drug ProductS)二、新药申请(一)药物的定义依据联邦食品药物及化妆品法第二章第201节,药物的定义如下:l.美国药典,同种治疗法药典,或者国家处方集(National Formulary)中所列的物质。
美国新药申请审评程序

美国新药申请审评程序在美国, 一个普通的新化合物从最初的发现到申请上市, 大约需要经过15 年的时间, 其中FDA用于审评的时间大约为6~12 个月。
FDA 将最终决定该新药能否进入市场, 因此除了实施有效的新药开发计划外, 熟悉FDA 的新药审评程序对于申请人来说也是非常重要的一个环节。
美国创新药物的申请包括两个步骤:①新药研究申请(investigational new drug application , IND) , 相当于我国的临床研究申请。
②新药申请( new drugapplication , NDA) , 相当于我国的新药上市申请,在三期临床结束后提出。
本文介绍的是FDA 对新药申请(即NDA) 的审评程序。
1、预备会议(pre - NDA meeting)在三期临床结束后, 申请人就可以进行新药申请, 在申请人提交NDA 之前, FDA 新药审评部门通常会和申请人举行一次会议。
在会议上, 申请人提交临床试验的概述报告, 让FDA 及评阅人员了解所申请新药的NDA 格式和内容。
2、新药申请的审评程序 (New Drug Application review process)2.1 、申请书的受理(filing of NDA)在收到新药申请书以后的60 天内, FDA 首先会对新药申请书的完整性作出评价。
如果FDA 认为申请书的内容完整可以受理作进一步的评价, 则书面通知申请人。
如果FDA 发现申请书中存在下列任何原因, 将拒绝受理此申请书, 并书面告知相关理由:①没有完成FDA 申请表(356h 表) ;②申请书不符合规定的格式;③申请书不完整, 所要求的一项或多项内容缺失;④缺少一份完整的环境评估报告, 或申请人请求FDA 放弃对此部分内容的要求,但没有能够提交充分的信息来说服FDA ;⑤对于非英语的申请书, 没有准确而完整的英文译本;⑥没有指出是否在符合GLP 的条件下开展每个非临床试验;⑦没有指出每个临床试验是否符合伦理委员会规定(institutional review board regulations) 和知情同意书规定(informed consent regulations) ;⑧FDA 已经批准了该新药的申请书或简化申请书;⑨对于应该用简化申请书的形式来递交的新药, 如果申请人想以NDA 的形式来递交, 那么可以在30 天内书面要求和FDA 就此问题举行一次讨论会。
FDA新药申请程序

FDA新药申请程序FDA(美国食品药品监管局)是负责监管美国食品和药品的联邦机构,其主要职责是确保公众使用安全、高效的药品和食品。
当制药公司开发一种新药时,他们必须按照FDA的一系列规定和程序来提交新药申请。
下面将详细介绍FDA新药申请程序。
新药开发的第一阶段是前临床研究,该阶段的目标是确定是否有足够的证据表明药物是安全的,并且有望对特定疾病或疾病群体产生治疗效果。
前临床研究主要包括体外实验和动物实验。
在这个阶段,研究人员必须向FDA提交一份“药物开发准备报告”(Investigational New Drug Application,简称IND),包括药物的化学成分、药理学相关数据以及试验设计。
FDA对IND进行评估,如果认为药物的风险低于潜在获益,那么该公司将被允许进行下一阶段的研究。
下一个阶段是临床试验,主要分为三个阶段:I期、II期和III期。
I期试验通常在健康志愿者身上进行,目的是评估药物的安全性和耐受性,以及确定适当的剂量范围。
II期试验是在患者中进行,旨在确定药物的治疗效果和剂量。
III期试验是在更大的病人群体中进行,以进一步确认药物的效果和安全性,并与标准治疗进行对比。
在三个阶段的试验中,制药公司负责收集试验数据,并根据FDA的规定提交适当的数据报告。
FDA对NDA进行评估的时间通常为10个月,在此期间,FDA的专家组织会就各个方面对申请进行审查,包括药物的质量、安全性和有效性。
如果发现问题或需要补充资料,FDA可能会要求制药公司提供额外的信息。
一旦NDA获得FDA的批准,该药物就可以在美国市场上销售和使用。
此外,FDA还设有一项称为“加速批准”(Fast Track)的计划,该计划旨在加快新药上市的进程,特别是对于那些用于治疗重大或无法治愈疾病的药物。
加速批准要求制药公司在研发和临床试验过程中紧密合作,并提供进行中的试验数据。
加速批准使得制药公司可以更早地让新药上市,以满足患者的需求。
FDA新药申请程序

FDA新药申请程序FDA(美国食品药品监管局)是负责确保美国公众获得安全和有效药物的监管机构。
为了确保药物的安全性和疗效,FDA对新药申请进行了严格的审查和批准程序。
新药开发是一个复杂和昂贵的过程,通常需要多次临床试验和大量数据收集。
下面将详细介绍FDA新药申请的程序。
1.基础研究和药物发现阶段:在此阶段,科学家通过实验室研究、细胞培养和动物实验等方法鉴定出一种具有潜在治疗作用的新药物。
2.预临床研究(药物毒理学和药代动力学研究):在此阶段,新药物的体内代谢、毒理学和药代动力学特性进行评估。
该阶段的研究数据将用于设计后续临床试验。
3.临床试验:临床试验是评估新药疗效和安全性的关键步骤。
该阶段分为三个阶段:I期、II期和III期。
I期试验旨在评估药物在人体内的代谢和安全性。
II期试验考察药物对特定疾病的疗效。
III期试验是最后一个阶段,目的是确定药物的疗效、剂量和安全性。
5.NDA审查:一旦NDA被提交给FDA,它将分配给一个专门的评审团队进行审查。
该团队会仔细审查文档中的所有数据和信息,并进行评估。
他们将对药物的质量、安全性和疗效进行评估,并提出问题和需要进一步证明的地方。
审查的时限通常为10个月,但在一些情况下可能会延长。
6.审查结果:FDA会向药企发出一封通知信,信中解释审查团队的评估和意见。
如果药物符合FDA的安全性和有效性要求,FDA将批准NDA,并核发许可证。
如果存在问题或缺失,FDA可能要求补充信息或重新评估。
7.药物上市:一旦FDA批准了新药的NDA,该药物即可在美国市场上市销售。
药企将开始生产、推广和销售药物,并严格遵守FDA的监管要求。
8.后续监管:药物上市后,FDA将继续监督其安全性和有效性。
FDA在市场上设立了不同的监测系统,包括药理学、药效学和不良事件报告。
如果出现安全问题或重大风险,FDA有权采取必要的措施,包括药品召回、警告公告和流行病学调查等。
总之,FDA的新药申请程序旨在确保药物的安全性和疗效。
欧美新药注册介绍和案例

欧美新药注册介绍和案例欧美新药注册是指在欧洲和美国进行药物注册的流程和要求。
在欧美地区,新药注册是一个严格监管的过程,需要遵循一系列法规和标准,以确保新药的安全性、有效性和质量。
下面我将从流程、要求和案例等方面进行介绍。
首先,让我们来看看欧美新药注册的流程。
在欧美地区,新药注册的流程通常包括以下几个阶段,临床试验前的药物研发阶段、临床试验阶段、注册申请阶段和上市后监管阶段。
在药物研发阶段,研发人员需要进行药物的化学合成、药理学和毒理学研究等工作。
在临床试验阶段,药物需要进行临床试验,分为三个阶段,分别是I期、II期和III期临床试验。
在注册申请阶段,申请人需要向监管机构提交注册申请材料,包括药物的临床试验数据、药物质量控制、生产工艺等信息。
最后,在上市后监管阶段,药物上市后需要进行定期的安全性监测和评估。
其次,让我们来看看欧美新药注册的要求。
在欧美地区,新药注册需要满足一系列的法规和标准,包括药物质量标准、临床试验设计、药物安全性评价、药物有效性评价等方面的要求。
此外,申请人还需要提交完整的注册申请材料,包括药物的化学、药理学和毒理学特性、临床试验数据、药物生产工艺和质量控制等信息。
最后,让我们来看一个欧美新药注册的案例。
以美国FDA为例,曾经批准上市的新药包括抗癌药物Keytruda(pembrolizumab)、抗艾滋病病毒药物Truvada(emtricitabine/tenofovirdisoproxil fumarate)等。
这些新药在注册申请过程中,都需要提供充分的临床试验数据和其他相关信息,以证明药物的安全性和有效性。
总的来说,欧美新药注册是一个严格监管的过程,需要申请人充分了解注册流程和要求,并提交完整的注册申请材料。
只有满足了监管机构的要求,药物才有可能获得注册批准并上市销售。
希望以上介绍能够对你有所帮助。
FDA申请程序范文

FDA申请程序范文美国食品药品监督管理局(FDA)是负责监管食品、药品、医疗器械和化妆品等产品的国家机构。
为了保证产品的安全性和有效性,生产商必须向FDA提交申请并获得批准。
下面将介绍FDA申请程序的一般步骤。
1.确定适用的申请类型:根据产品的特性和用途,生产商需要确定适用的申请类型。
常见的申请类型包括新药申请(NDA)、生物制品许可申请(BLA)、通用药物申请(ANDA)和医疗器械许可申请(PMA)等。
2.收集试验数据:生产商需要进行临床试验或实验室研究,以获得关于产品安全性和有效性的数据。
这些数据将在申请中提交给FDA进行评估。
4.提交申请:生产商需要将申请文件以电子形式提交给FDA。
申请文件的格式和要求将根据不同的申请类型而有所不同,生产商需要仔细阅读和遵守FDA的要求。
5.审查和评估:FDA将对申请文件进行审查和评估,以确定产品是否符合安全和有效的要求。
审查时间根据不同的申请类型和产品的复杂性而不同,通常需要数月或数年时间。
6.提供附加信息:在审查过程中,FDA可能会要求生产商提供额外的信息或进行进一步的试验。
生产商需要及时提供所需的信息,以帮助FDA做出最终决定。
7.获得批准或拒绝:根据审查和评估的结果,FDA将决定是否批准申请。
如果申请获得批准,生产商可以开始生产和销售产品。
如果申请被拒绝,FDA将提供详细的理由,并提供进一步的指导以帮助生产商改进申请。
总结起来,FDA申请程序是一个复杂和耗时的过程。
生产商需要仔细准备申请文件,并按照FDA的要求进行提交和配合。
切记,获得FDA的批准是保证产品安全性和有效性的重要步骤,也是产品上市和销售的法律要求之一。
FDA新药审核流程

FDA新药审核流程FDA(美国食品药品监督管理局)是美国联邦政府的一个机构,负责审批并监督所有食品、药品、医疗器械、化妆品和其他消费品的安全性和有效性。
新药审核是FDA的一个重要职责,涉及多个环节和步骤。
下面将详细介绍FDA新药审核的流程。
1. 前期准备:在提交新药申请(New Drug Application,NDA)之前,药厂需要进行大量的研发工作,包括药物的预临床实验、临床试验、效力和安全性评估等。
这个过程通常持续数年。
2.提交NDA:一旦药厂认为新药具备了提交FDA审批的条件,他们将向FDA提交NDA。
NDA需要包含大量的数据和信息,包括药物的化学成分、制备方法、质量控制等。
3.优先审查:FDA对一些新药进行优先审查,这些药物通常是用于治疗罕见病或临床需求紧迫的药物。
优先审查可以缩短FDA的审批时间。
4.首次评审:FDA将对NDA进行首次评审,评估药物的有效性和安全性。
评审小组通常由FDA的药物评审员和其他专家组成。
5.补充材料:在首次评审之后,FDA可能会要求药厂提供额外的数据和信息,以填补信息不完整或不足的方面。
6.药物评估:FDA的药物评审员将针对NDA中的各个方面进行全面评估,包括活性成分、药物代谢、药动学、药效学、不良反应等。
评审员还会研究临床试验数据,以评估药物的效果和安全性。
8.二次评审:在考虑了所有相关数据和信息之后,FDA可能会对NDA进行二次评审,并向药厂提供评审意见和建议。
此时,FDA可能会提出一些需要满足的条件,才能最终批准该药物上市。
9.批准与上市:如果通过了二次评审,FDA将批准新药上市,并授予该药物一个专利保护期。
这意味着在一定的时间内,其他药厂不能生产和销售相同的药物。
10.监测与后市场研究:一旦药物上市,FDA将继续监测该药物的有效性和安全性。
药厂也需要承担监测和报告药物的不良反应的责任。
此外,FDA可能要求药厂进行后市场研究,以更好地了解药物的效果和安全性。
FDA新药申请程序

FDA新药申请程序美国食品药品监督管理局(FDA)是负责监管和批准新药上市的机构。
在美国,所有新药都必须经过FDA的审查和批准程序,以确保其安全性和有效性。
以下是FDA新药申请程序的详细步骤:第一步:发现和基础研究新药的开发通常从科学家对疾病的基础研究开始。
在这个阶段,科学家会尝试理解疾病的发生机制,并尝试找出治疗该疾病的潜在药物。
第二步:临床前研究在将药物应用于人体之前,需要进行大量的临床前研究。
这些研究包括体外和动物试验,以评估药物的安全性和有效性。
如果临床前研究表明药物有治疗潜力,并且不会对人体造成严重的安全风险,那么可以开始提交FDA新药申请。
第三步:IND(Investigational New Drug)申请IND申请是一份详细的文件,其中包含了新药的临床前研究数据、药物特性、疾病的治疗需求以及计划进行的临床试验的详细计划。
一旦IND申请被FDA接受,开发者可以开始进行临床试验。
第四步:临床试验临床试验是确定新药是否安全、有效以及对疾病产生治疗效果的关键步骤。
它分为三个不同的阶段:I期、II期和III期。
在这些试验中,药物将被应用于患者身上,并且监测其效果和副作用。
临床试验的设计必须符合FDA的规定,并且需要得到患者的知情同意。
第五步:申请审查在临床试验结束后,开发者将提交新药申请(NDA)给FDA。
NDA是一份详细的文件,其中包含了从临床试验中获得的所有数据,包括药物的安全性和有效性数据。
这些数据需要经过严密的分析和解释,以证明药物的治疗效果。
第六步:审查过程一旦NDA被提交,FDA将进行审查。
审查过程包括多个阶段,包括初步审查、详细审查和面板审查。
FDA将评估所有提供的数据,并就药物的安全性、有效性和适应症提出问题。
在这个过程中,开发者和FDA之间可能会进行多次的沟通和交流,以澄清问题和提供进一步的信息。
第七步:批准和上市经过审查过程,如果FDA认为新药是安全有效的,并且对疾病产生治疗效果,那么他们将批准其上市。
FDA新药审批流程简述(中英文)

FDA新药审批流程简述(中英⽂)FDA新药审批流程美国的新药审批可以说是世界上最严格和规范的,作为⼀个公司通常需要花费5亿美元资⾦,⽤ 12到15年的时间才能将⼀个新药从试验室⾛⼊市场。
在5000个临床前化合物中⼤约只有5个化合物可以进⼊临床试验(Clinical Trials),⽽这5个化合物中只有⼀个才能被批准⽤于临床治疗病⼈,成为真正的药物。
从⼀个实验室发现的新化合物发展成为⼀个治疗疾病的药物,需要经过如下开发阶段:⼀、临床前试验将⼀个新发现的化合物经过实验室和动物试验,证明该化合物针对特定⽬标疾病具有⽣物活性,并且要评估该化合物的安全性。
⼆、新药临床研究申请当⼀个化合物通过了临床前试验后,需要向FDA提交新药临床研究申请,以便可以将该化合物应⽤于⼈体试验。
如果在提交申请后30天内FDA没有驳回申请,那么该新药临床研究申请即被视为有效,可以进⾏⼈体试验。
新药临床研究申请需要提供先前试验的材料;以及计划将在什么地⽅,由谁以及如何进⾏临床试验的说明;新化合物的结构;投药⽅式;动物试验中发现的所有毒性情况;该化合物的制造⽣产情况。
所有临床⽅案必须经过机构审评委员会(Institutional Revuew Board,IRB)的审查和通过。
每年必须向FDA 和IRB 汇报⼀次临床试验的进程和结果。
三、⼀期临床试验这⼀阶段的临床试验⼀般需要征集20-100名正常和健康的志愿者进⾏试验研究。
试验的主要⽬的是提供该药物的安全性资料,包括该药物的安全剂量范围。
同时也要通过这⼀阶段的临床试验获得其吸收、分布、代谢和排泄以及药效持续时间的数据和资料。
四、⼆期临床试验这⼀期的临床试验通常需要征集100-500名相关病⼈进⾏试验。
其主要⽬的是获得药物治疗有效性资料。
五、三期临床试验这⼀期的临床试验通常需1000-5000名临床和住院病⼈,多在多个医学中⼼进⾏,在医⽣的严格监控下,进⼀步获得该药物的有效性资料和鉴定副作⽤,以及与其他药物的相互作⽤关系。
FDA新药审批流程简述

FDA新药审批流程简述FDA(美国食品药品监督管理局)是负责监督和监管美国药品市场的机构,负责确保新药的安全性和有效性。
FDA的新药审批流程是一系列的评估和审查过程,由多个部门和专业人士参与。
以下是FDA新药审批流程的简要描述:1.前临床研究阶段:药物研发者在动物模型和离体实验中对新药进行测试,以确定其安全性和毒性潜力。
这个阶段主要是为了确认新药的潜在效果和毒副作用。
2.临床试验阶段:分为三个阶段进行人体临床试验。
第一阶段是在健康志愿者身上测试新药的安全性和药代动力学特性。
第二阶段是在病人身上测试新药的安全性和疗效。
第三阶段是在大量患者身上进行随机、双盲、安慰剂对照的试验,以证明新药的效果和安全性。
3.NDA(新药申请)提交:如果临床试验结果积极,研发者将提交一份完整的NDA给FDA,包括对药物的详细描述,药理学、临床试验和毒性数据,以及质量和制造信息。
4.NDA审评:FDA的药物评估员将对NDA进行评估,包括审查药物的临床试验结果、药代动力学和毒性数据,评估药物的有效性和安全性。
5.审查周期:FDA有一定的审查周期,这在一定程度上取决于药物的治疗领域和创新性。
优先审查的新药可以加速审批过程。
在审查期间,FDA可能会要求额外的信息或进行进一步的讨论。
6.FDA决策:经过审查后,FDA将就新药的批准做出决定。
如果批准,FDA将发布一份新药批准信函,并告知制药公司其药品在市场上的条件和限制。
7.药品上市:获得FDA批准的药物可以在市场上销售和推广。
然而,一些药物可能会接受后续的监管和追踪,以进一步评估其长期安全性和效果。
需要注意的是,这个简述只是新药审批流程的概述,并且过程可能因药物类型、治疗领域和创新性而略有不同。
此外,FDA还有其他途径可以加速新药的审批过程,例如优先审查、快速通道和条件批准等。
一文读懂FDA新药注册流程

一文读懂FDA新药注册流程FDA是美国食品药品监管机构,负责监管并批准新药的注册上市。
新药注册流程从药物的发现到获得FDA批准上市,经历了严格的评审和测试。
以下是一份1200字以上的一文,介绍FDA新药注册流程。
一、发现和开发药物(时间:2-10年)新药注册流程的第一步是发现和开发一种新的药物。
这通常是由科学家和药物研究人员进行的,在实验室中对药物进行初步的研究和试验,以确定其潜在的功效和安全性。
二、临床前研究(时间:1-3年)在药物通过实验室研究后,需要进行临床前研究。
这些研究通常包括对动物进行试验,以评估药物的药代动力学、药效学和毒理学特性。
此外,还需要进行体外试验和体外试验,以验证药物的潜在疗效和安全性。
三、申请IND(初步新药申请)(时间:30天-2年)在完成临床前研究后,药物研发者需要提交一个初步新药申请(Investigational New Drug Application,IND),以获得FDA的许可,进行人体临床试验。
IND申请包括对药物的药理、毒理学和制剂学特性的详细描述,以及与人类试验相关的计划和协议。
四、临床试验(时间:2-10年)IND获得批准后,药物研发者可以开始进行临床试验。
临床试验分为三个阶段:1.第一阶段:对少数健康志愿者进行试验,以评估药物的安全性和耐受性,确定最佳剂量。
2.第二阶段:对几百名患者进行试验,以评估药物的有效性和安全性,确定疗效。
3.第三阶段:对数千名患者进行试验,以进一步评估药物的疗效和安全性。
临床试验期间,药物研发者需要收集大量的数据,并提交给FDA进行评估。
此外,临床试验还需要遵守伦理及法规要求,确保试验安全、道德和可靠。
五、NDA申请(新药申请)(时间:1-2年)FDA将对NDA进行评估,并在一定时间内作出决定。
如果FDA对药物的临床试验结果满意,认为药物的潜在益处大于潜在风险,就会批准药物上市。
六、审评(时间:6个月-2年)FDA的审评过程可以分为两个阶段:1.审查阶段:FDA将评估NDA中提供的所有数据和信息,对药物的安全性和有效性进行分析和评估。
FDA新药注册(NDA)流程

FDA新药注册(NDA)流程ZK作者/ 伯格编辑/ ZK主创们01引⾔据统计,在美国每个被批准上市的新药,平均研发成本⾼达20亿美元,平均研发周期超过10年。
⽽且新药研发的成功率⾮常低,有很多药品从概念到成功上市,成功率只有5%,可谓是「百⾥挑⼀」。
每个成功上市的新药背后,都凝聚着众多专家,投资⼈和企业的⼼⾎。
为了保证市场的健康成长,同时⿎励创新和研发,美国⾷品与药品管理局(Food and Drug Administration, FDA)制定了⼀系列⾮常完善的监管⼿段。
在美国,⼀个普通的新化合物从最初的发现到申请上市,⼤约需要经过15年的时间,其中 FDA ⽤于审评的时间⼤约为6到10个⽉。
美国的联邦⾷品、药品、化妆品法案 FDCA(Federal Food, Drug and Cosmetic Act)规定了新药审评的过程,此法案有关新药审评最重要的条款相当简单明了。
FDCA 规定,任何⽤于诊断、治愈、缓解、预防⼈、其它动物疾病的物品,以及⽤于影响⼈、或其它动物⾝体的结构、或功能的物品(⻝品除外)为药品。
FDCA 还规定,任何新药在上市之前⼀定要表明它是安全、有效并且经过审批的。
02新药申请条件符合以下任何情况均可以向 FDA 提出 NDA 申请:1、新分⼦实体(NME)2、新化学实体(NCE)3、原批准药品相同化学成分的新盐基、新酯基4、原批准药品的新配⽅组成5、原批准药品的新适应症(包括处⽅药转⾮处⽅药使⽤)6、新剂型、新给药途径、新规格(单位含量)7、两种以上原批准药品的新组合03新药注册途径505(b)指的是 FDCA 第5章第505分章,即505法案。
505法案包括NDA的3种申请:1、505b1:申报者进⾏所有药学研究(Completely new)2、505b2:同样也是申报者进⾏所有药学研究,但不同的是部分信息不实由申报者⾃⼰完成(by),或者这些研究不是为了申报者⽽完成的(for);以及申报者没有引⽤的权利(Hybrid new, Some studyyoucan bridge)3、505j:欲申报制剂在 API,剂型,给药途径,标签,质量,检验,适应症上都和已有品种⼀样。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
美国新药申请手续新药申请可分为两个阶段,即新药临床试验申请(Investigational New Drug Application,简称IND)及新药上市许可申请(New Drug Application,简称NDA)。
1.新药临床试验申请(IND)一般新药试验申请的目的是请求FDA核准进行第一次人体临床试验,不管是否已在美国之外其他各国进行人体试验,只要是在美国申请,需Form FDA1571表。
及Form FDA1572表。
新药试验申请所提出的内容应包括新药的物理化学性质、临床前(pre clinical)或非临床(non clinical),以及健康志愿者(healthy volunteer)或病人使用的经验[若是已在美国以外之国家取得人体试验结果,最重要的资料是第一次在美国进行人体试验的计划书(clinical protocol)]。
进一步说明,新药试验申请至少应包括下列资料:(1)药物的化学名称、分子式、构造、投药方式(口服、注射或其他方法),如无商标名称trade name)亦可先用公司暗码名称(code name)代替。
(2)主要成分及所知之非主要成分(没作用的成分)及所测得之杂物(impurities),并列出成分组成。
(3)供应药物公司的地址。
(4)药物来源,工厂设备(facilities)及质量控制(controls)的资料以说明如何制造、包装等,以确保药物的认定(identity)、效力(strength)、质量(quality)及纯度(purity)。
(5)所有临床前之动物药理实验、毒性试验资料、动物毒性试验,须遵照优良实验室规范(GLP)。
若未遵照是项规定,则应加以说明。
(6)一份依据临床前动物实验的结果—确定该新药物第一次用于人体实验相当安全(reasonably safe)的声明。
(7)一份提供所有相关资料—包括其可能发生副作用之临床研究员手册(Clinical Investigator‘s Brochure)。
(8)一份第一次在美国进行人体试验计划书(Protocol)—该计划书应阐明实验目的、实验手续、药物授予法、参加实验者合格条件及不合格条件(inclusion and exclusion criteria)、处理特别反应或过度反应之方式、实验室血液及尿液检查等。
(9)一份说明书(包括提供学历、经历及医学经验等文件)—证明医生及专业人员有足够能力执行人体试验。
(10)经过研究机构审评委员会(Institutional Review Board)的核准,进行人体试验计划之文件。
(11)一份同意于向FDA提出人体试验申请日起30天开始进行人体试验之声明书。
正如Form FDA1571规定,除非经FDA特准,一般而言,FDA收到新药试验申请日起30天内是不能进行人体试验的。
新药试验申请送达相关的药物审评科评审后,如无问题,FDA也不会通知公司,亦即新药试验公司于30天期限未收到FDA通知有任何异议(objection)时此新药试验申请(IND)即开始生效(in effect)。
换言之食品药物管理局并非“核准”(Approve)IND,而是“反对”而已。
如FDA对该新药申请之临床试验持不同意见,则有临床试验暂缓进行(Clinical hold)之判定,此时公司应充分合作,而补足FDA所要求的资料或实验。
新药试验如无法确定向FDA那一科(Division)申请时,可先以电话查询。
如申请之新药试验有两种药物,一般依具主要疗效(Primary mode function)之药物来决定。
如药物与生物制剂(biologics)或医疗器材(medical device)合并使用时,大致亦依主要疗效(Primary mode function),或经过不同的中心(CDER,CBER或CDRH)讨论而决定管辖权,详细情况请参考,Federal Register,Docket No.91N—0257 V ol 56,No. 225 November 21,1991.2.新药试验进行之阶段(IND phase)(1)当新药试验申请(IND)开始生效后,人体试验即由第一阶段逐步进展到第二阶段、第三阶段。
A.第一阶段(phase1):试验对象一般是健康的志愿者,有时是住院的病人,人数可由数名(5名~10名)到50名左右。
主要目的是试验人体能忍受的剂量及发现可能的副作用(安全性),初期的药物动力学(pharmacokinetics)药物在人体之吸收、分布、代谢、排出等试验也一并进行。
B第二阶段(phase 2):以少数患者(至少100名)为对象,主要目的是为了解该药可能之疗效,亦即临床药理研究以确定药的用途、短期毒性,无反应者(nonresponder),及可一能的药物相互作用(drug interaction)(有效性)。
C.第三阶段(Phase 3):对象是多数的病患,人数在数百人或上千人,此阶段的试验多数需在医学中心(multicenter trials)进行。
这一阶段的试验,可找出适当的疗效剂量(optimal dose range),可与安慰剂(placebo)比较或与有效对照剂(active reference drug)比较,大都需以双盲试验(double-blind test)进行,且较长期服药的副作用、不良作用及与其他药物相互作用等,都可在此阶段中发现。
此第三阶段是整个新药试验主要的试验,因此试验的设计应与FDA协商,通常是在第二阶段完成以后,征求FDA的咨询(end of phase3 meeting)。
(2)新药试验申请(IND)生效后,当人体试验一个又一个阶段进行时,非临床试验(nonclniclstudies)也须同时进行。
因为非临床试验是以动物来评估药物在人体的安全性,听包括的项目及试验的长短应在相关人体试验之前进行:譬如药物对生殖能力及系统的作用须先完成后,才可以进行包括女性健康志愿者或病患之人体试验。
非临床试验可包括以下项目:A.急性毒性试验B.亚急性毒性试验C.长期毒性试验D.致癌性试验E.致突发性试验F.生殖试验a.生殖力影响试验b.致略性试验c.围产期及产后毒性试验G.抗原性试验H.药物依赖性试验I .溶血性试验J.血液共容性试验K.动力学及毒性试验L.其他特别设计之毒性试验除上述的毒性试验外,非临床试验包括下列各项:A.药理实验B.药物动力学实验C.药理/药物动力学实验D.药物之吸收、分布、代谢及排出实验3.新药之申请(New Drug Application,NDA)当人体试验第三阶段完成,所需非临床试验已告结束,则可检具一套资料,向FDA申请新药上市许可之核准,同时需填Form FDA356表。
NDA申请时应具备下列条件:(1)申请信函(cover letter)一份,必须说明申请理由、药物的用途、所附资料内容,并指出临床或非临床方面值得注意的结果。
(2)申请内容目录(index)一份,必须清楚易懂,以利审核。
(3)摘要(summary)一份,说明该药物所有的安全性及有效性(safety and effectiveness)。
(4)化学部分(制造及品质),所提供之有关资料应包括下列各项:A.阐明以下资讯a. 药的本质(drug substance)b.药的产品(drug Product)c.安慰剂(Placebo)d.药品标示(labeling)e.环境影响评估(environmental analysis)B.详述以下项目a.药的认定(drug identity)b.药的效力(drug potency)c.药的品质(drug quality)d.药的纯度(drug purity)(5)化学制造及质量管理方法之确定(methods validation package)(6)药品提示(Labeling)(7)非临床药理及毒理学资料—此一部分中的药理学资料因为不受优良实验室作业规范之管辖并与药的毒性无关,故较易撰写;毒理学方面的试验则需依照优良实验作业规范执行且项声明是否依该规范进行。
毒理实验结果解释很可能因人而易,如有较特殊的发现,应请专家协助撰写特别评估报告。
有关非临床毒性试验包括下列项目:A.急性毒性试验(acute toxicity Studies)B.亚急性毒性试验(subchronic toxicity studies)C.长期毒性试验D.致癌性试验(carcinogenicity Studies)E.致突发性试验(mutagenicity studies)F.生殖试验(reproductive toxicity Studies)a.生殖力影响试验(fertility and general reproductive performance studies;segment1 Study)b.催畸性试验(teratogenicity study;segnent 2 study)c.围产期及产后毒性试验(peri-and post-natal toxicity study)G.抗原性试验(antigenicity Studies)H.药物依赖性试验(dependence studies)I.溶血性试验(hemdytic effect studies)J.血液共容性试验(blood compatibility studies)K.毒理动力学试验(toxicokinetic studies)(8)人体动力学(human Pharmacokinetics)及生体可用率(bioavailability)(9)细菌学研究资料(10)临床试验结果(11)最新药物使用之安全报告(Safety Update Report)(12)个案资料(Case Report Forms)之整理(Tabulations)(13)个案资料(14)专利权之资料因人体试验结果及有关资料颇多,最近有电脑辅助的新药上市许可申请(CANDA,Computer-Assisted New Drug Applications),详情请参照CANDA Computer Guidance.另外一般新药上市许可申请者也须准备一份核准基准摘要(Summary basis of approval),供食品药物管理局参考或修改,以节省审评时间。
三、新药之审评(一)新药试验申请(IND)之审评这阶段的审核是针对第一次用于人体,或是第一次在美国作人体试验。
IND审评申请新药主要的依据来自动物药理及毒理实验结果,以及依据第一次人体试验的结果来判定是否有足够的药理实验及毒性试验资料,另外在化学方面则注重该新药是否具有稳定性(stability),是否渗有其他有害的杂物(impurities),或具不合规定的非有效成分(inactive ingredients)等。
