高等有机化学3
高等有机化学——第三章有机反应活性中间体

乃春) 五. 氮烯 (乃春)(Nitrenes)
1. 氮烯的类型 2.氮烯的结构 氮烯的结构 单重态氮烯 三重态氮烯 3. 氮烯的反应 加成反应 插入反应
六. 苯炔 (Benzyne)
1. 苯炔的结构 2. 苯炔的产生 3. 苯炔的反应 亲核加成 亲电加成 环加成
一. 正碳离子 (Carbocations)
• 关于三苯甲基游离基 的二聚体结构不是象 冈伯格所提出的六苯 乙烷结构, 乙烷结构 , 经核磁共 振谱研究表明为醌式 结构: 结构:
Ph3C C H
Ph
Ph
离子游离基
O Na C O Na
当金属钠和二苯甲酮在二甲氧基乙烷中反应时,得到 当金属钠和二苯甲酮在二甲氧基乙烷中反应时, 兰色物质, 兰色物质,为二苯甲酮负离子游离基的钠盐
直接与杂原子相连的正碳离子结构: 直接与杂原子相连的正碳离子结构:
氧上未共有电子对所 占 p 轨道 与中心碳原子上的空的 p轨道 轨道 侧面交盖,未共有电子对离域, 侧面交盖,未共有电子对离域, 正电荷分散。 正电荷分散。
CH3O
CH2
类似地,羰基正离子: 类似地,羰基正离子:
R C O
R C
O
乙烯型正碳离子: 乙烯型正碳离子:
CH3 H3C C OH CH3
HSO3F - SbF5 - SO2 -60℃ ℃
CH3 H3C C + H +O + SO F3 3 CH3 + SbF + SO
5 2
很多正碳离子的结构与稳定性的研究都是在超酸 介质中进行的。 介质中进行的。
非经典正碳离子
1) π键参与的非经典正碳离子 键参与的非经典正碳离子 实验表明: 实验表明: 反-7-原冰片烯基对甲苯磺酸酯 - 在乙酸中的溶剂解的速度 大 1011倍 +
高等有机化学

NaNH2 液氨
(CH3)2CH-C
- (CH3)2CHBr C
(CH3)2CH
C
C CH(CH 3)2
H2 C-Pd-BaSO4
(CH3)2CH C H C
CH(CH3)2 (TM4) H
二、醇及其衍生物
1、简单醇的切断,可以在羟基官能团处 切断。
a R2 b C R1 a R3 b R1 + R2 + R3COOR3 OH R3 + R1 + R2 OH R2 R1 O
例14 试合成
N
TM14
O
分析 方法一
N O
+ N
HO O
CO 2 +
BrMg
FGI
HO
MgBr CH3CH2CHO +
Synthesis 1:
Br Mg,Et 2O MgBr 1)C2H5CHO,Et2O + 2)H3O
1)PBr3 2)Mg,Et2O
HO BrMg
CO2 Et 2O
H3O
+
逆合成法
逆合成法是采用结构分析的方法,在回推过程
中将复杂的分子结构逐步简化,只要每步回推 得当,就可得出合理的合成路线。
逆合成法
目标分子 中间体 原料 目标分子←中间体←原料
1、最推崇的分析方法——切断法 (disconnection) 2、重新连接法以Con表示(Connection) 3、重排法以rearr表示(rearrangement)
分析
O O
FGI
O
-
+ MeI
O CO 2Et
+
Br
合成
O CO 2Et
高等有机化学魏荣宝第三版答案

高等有机化学魏荣宝第三版答案1、属于倍半萜的化合物是()[单选题] *A龙脑B莪术醇C薄荷醇D青蒿素(正确答案)2、以下哪种方法是利用混合中各成分在溶剂中的溶解度不同或在冷热情况下溶解度显著差异的原理而达到分离的()[单选题] *A沉淀法B分馏法C结晶法(正确答案)D升华法3、很少含有挥发油的植物科为()[单选题] *A菊科B唇形科C茜草科(正确答案)D姜科4、可与异羟肟酸铁反应生成紫红色的是()[单选题] * A羟基蒽醌类B查耳酮类C香豆素类(正确答案)D二氢黄酮类5、下列化合物中具有强烈天蓝色荧光的是()[单选题] * A七叶内脂(正确答案)B大黄素C麻黄碱D大豆皂苷6、萜类化合物在化学结构上的明显区别是()[单选题] * A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同7、下面化合物能与异羟肟酸铁反应的是()[单选题] * A花椒内酯(正确答案)B柠檬烯C色原酮D天精8、除了能够沉淀有羧基或邻二酚羟基成分,还能沉淀一般酚羟基成分的是()[单选题] *A碱式醋酸铅(正确答案)B中性醋酸铅C酸碱沉淀法D以上都不对9、下列基团在极性吸附色谱中的被吸附作用最强的是()[单选题] *A羧基(正确答案)B羟基C氨基D醛基10、当一种溶剂无法结晶时,常常使用混合溶剂,下列不是常用的混合溶剂是()[单选题] *A甲醇-水B乙酸-水C乙醚-丙酮D石油醚-水(正确答案)11、具有挥发性的生物碱是()[单选题] *A苦参碱B莨菪碱C麻黄碱(正确答案)D小檗碱12、碱水提取芦丁时,若PH过高会使()[单选题] *A产品质量降低B产品收率降低(正确答案)C苷键水解断裂D内酯环开环13、纸色谱是分配色谱中的一种,它是以滤纸为(),以纸上所含的水分为固定相的分配色谱。
()[单选题] *A固定相B吸附剂C展开剂D支持剂(正确答案)14、牛蒡子属于()[单选题] *A香豆素类B木脂内酯(正确答案)C苯丙酸类D15、极性最大的溶剂是()[单选题] *A酸乙酯(正确答案)B苯C乙醚D氯仿16、南五味子具有的主要化学成分是()[单选题] * A色原酮B胆汁酸C多糖D木脂素(正确答案)17、二氢黄酮类专属性的颜色反应是()[单选题] * A盐酸-镁粉反应B四氢硼钠反应(正确答案)C硼酸显色反应D锆盐-枸橼酸反应18、具有挥发性的香豆素成分是()[单选题] * A游离小分子简单香豆素(正确答案)B香豆素苷C呋喃香豆素D双香豆素19、水蛭的主要化学成分是()[单选题] *A有机酸B蛋白质(正确答案)C多糖D生物碱20、生物碱碱性的表示方法常用()[单选题] * ApKBBKBCpH(正确答案)DpKA21、处方中厚朴主要化学成分厚朴酚,其结构类型是()[单选题] * A黄酮B香豆素C木脂素(正确答案)D三萜皂苷22、在简单萃取法中,一般萃取几次即可()[单选题] *A3~4次(正确答案)B1~2次C4~5次D3~7次23、E何首乌(正确答案)下列不含蒽醌类成分的中药是()*A丹参(正确答案)B决明子C芦荟D紫草(正确答案)24、不属于木脂素类化合物的物理性质的是()[单选题] *A一般没有挥发性B有光学活性C易溶于有机溶剂D有色晶体(正确答案)25、挥发油可析出结晶的温度是()[单选题] *A0~-20℃(正确答案)B0~10℃C0~20℃D0~15℃26、从香豆素类的结构看,香豆素是一种()[单选题] * A内酯(正确答案)B羧酸C酰胺D糖27、挥发油的溶解性难溶于()[单选题] *A水(正确答案)B乙醇C石油醚D乙醚28、具有光化学毒性的中药化学成分类型是()[单选题] * A多糖B无机酸C鞣质D呋喃香豆素(正确答案)29、下列溶剂中亲脂性最强的是()[单选题] *A甲醇B苯(正确答案)C三氯甲烷D丙酮30、检识黄酮类化合物首选()[单选题] *A盐酸-镁粉反应(正确答案)B四氢硼钠反应C硼酸显色反应D锆盐-枸橼酸反应。
高等有机化学-第3章-电子效应

是单一方向的,即在键链中不产生极性的交替现象。
诱导效应的传递有一定的限度。一般来说,从产生诱 导效应的基团开始,其影响沿着键链由近而远依次传递,并 迅速减弱,传递超过五个原子后,影响便消失了。取代基的 诱导效应大致按公比1/2.7的等比级数急剧减弱,即若以α−C 的诱导效应为1,则β−C为1/2.7,γ−C为1/7.29,…等。
σ−p 超共轭
二.共轭效应的涵义和特征
在共轭体系中,电子不是定域在成键原子之间,而是围绕整
个分子轨道作整体的运动。每个成键电子都要受到分子中其它原 子核的作用。不管共轭体系有多大,其作用贯穿在整个共轭体系
中,这种电子通过共轭体系传递并引起体系性质改变的效应,叫
做共轭效应。 ① 起源 子
H C1 H
° 122
5Å 6Å C2 1.4 ° 116
共轭效应起源于共轭体系中电子的高度活动性,是由于
电子在整个分子轨道的离域作用所引起的。例如1,3−丁二烯分
H C3
1. 3 5Å
1.3
H C4 H
H
② 存在 共轭效应只存在于共轭体系中,它不象诱导效应存在于一
切键上。
③ 传导方式 共轭双键最突出的特征之一是在这些分子中存在着一 种传递原子相互影响的特殊方式,这个方式与沿ζ键传递的方式 具有质的区别。诱导效应是由于键的极性沿σ键而传导,共轭效 应则由于电子的转移,沿共轭键而传递,其结果是共轭键的电 子云密度或多或少的发生平均化(常反映为键长的平均化)。
第三章 电子效应和溶剂效应
3.1 诱导效应
3.2
3.3
共轭效应
超共轭效应
高等有机化学3

丬F溴 P卜L· 子痈
函.'囱 凤t,〃1s9),
W俊 '辐
{丨 :∫ |古
灸斋卜敏
'. -J
i0;!j淼 :喔
这样 灾岛子在小踉小±1宀 溴吾麻 勾中l
`荏同钠 啼 杓 ,往 往 万以 直详 晟 叩
即狂非熟于麻扪秒 D肭 so巾 、叫帝觥亭
d‘
瑟、翻嬲暇 '由 `∷
树`o柙
'
中”秭1碌 子连 铂 基 团
1冫
'几φ ∷耦 猁 域
矿也越 窈另锐晶'穗 刻
r晏 缁
考罢ቤተ መጻሕፍቲ ባይዱ
H扌
lΘ 潴剂拗应
饪的 确莎庋刊
剂戚.碜 甸玟扭旬息黾
坚 屮 ¨ 1吵 弘X其 中平 南 子鼎 ⒋ 刊 坤 吃 五 W篓 豇 挤坠 玎樘竺 豳骘 凹插凹 翁刷 而们'
∴罢簧暴掼鼍鞋毛箔琨托茅硭糨等篝署荔铺箐掇秽#;碰芽 甯∷言丨、 票劫曜氛魄 i扯 I絮
`亻 辆 孰
、
;:1薛 `眸 :¨ ξ叮 :。 J∷
F∶ 丿∵
vy¨ ’
L「
r 廴箩 C≯包 子 飧 立廴 '
^
∵ 讯磷 荔 虹
ˉ ,~
‘丛兰山亠 △庄二
0汁 9∶ 摊翩 些村划 △苟氵玄污 片枷午 盯 △ 片 烹驯埔泅冖 冖由卉 ,∷Υ疒 拊 迁 砀 喇丛钭 奸 ″ 叫刀>是 俄 咆 讧
,‘ ;Ι饺'孺哏珏祈基基⒎呵.忄娌玎、!隼 隽.f』虍
:嘤W矿梦叮 碱九V⒈确鬈石口·°≤=獭耳 < I品. ~~ I 箔 ' 拜扌;ˉ勘两空由确F问四'卜枷生饰中应刑.闾`二~廴。邛^ 是是臼 四~ 廴b戾·、碎贝心⒏铀gn,F`,b中~杉`’中·添’′”破ˉ祜劢冖厣碌猸卜导子揽ˉ为为冲s疒厂琢杂茫化涣涣、'锘 巾轫赭之迕丿圭`潭L矢
高等有机化学课件3-第三章 立体化学

NO2 CO2H
NO2 CO2H
有对称面(能同镜影分子重选),非手性。
NO2 CO2H
CO2H NO2
CO2H NO2
NO2 CO2H
手性分子
6
Br Br 6'
Br
Br
2' 2 Cl Cl
Cl
Cl
(R)-2,2’-二氯-6,6’-二溴联苯
(R)-2,2’-dibromo-6,6’-dichlorobiphenyl
构型异构: 顺反异构: H
Cl CH3 Cl H
COOH H OH CH3 HO
CH3 H
COOH H CH3
H
对映异构:
D-(-)-乳酸 mp: 52.8° 非对映异构: H
H COOH OH OH CH3
L-(+)-乳酸
COOH H HO OH H CH3
构象异构:
H H
CH3 H H CH3
V U X
R R
V W Z W Z
S S
V
V W X W X
S R
U X
U Z
R S
U Z
Y (A)
Y ( B)
Y (C)
Y ( D)
A和B(C和D)为对映异构体,A和C或者D(B和 C或者D)为非对映异构体。
• 对映异构体之间有相同的性质(除了对偏 振光和手性环境),然而非对映异构体具 有不同的熔点、沸点、溶解度、反应性等 物理、化学及光谱性质。 • 多手性中心的分子最多具有2n个异构体(n =分子中手性中心数),但有时分子内存 在着对称面,这时异构体数减少。
今有两试管分别置入(-)乳酸和(+)乳酸,我 们如何知道它们的构型?
高等有机化学第三章立体化学

contents
目录
• 立体化学基本概念 • 碳原子立体化学 • 手性分子结构与性质 • 立体化学在有机合成中应用 • 立体化学在药物设计中的应用 • 实验方法与技巧
01
立体化学基本概念
立体异构现象
立体异构体
分子式相同,但空间排列不同的化合 物,具有不同的物理和化学性质。
碳原子手性判断
对称面与对称中心
若一个分子中存在一个对称面或对称中心,则该分子不具有旋光性。对称面是指能将分子分为两个互为镜像的部 分的平面;对称中心是指能将分子中任意一点与另一点重合的点。
潜手性与非对映异构体
潜手性是指分子中某些基团可以围绕单键旋转而产生手性的现象。非对映异构体是指具有相同分子式、不同结构 且不能通过旋转操作相互转化的立体异构体。
感谢观看
。
化学性质差异
手性分子在化学反应中可能表 现出不同的反应速率和选择性
。
生物活性差异
许多生物活性物质都是手性的 ,其生物活性与手性密切相关 ,不同手性分子的生物活性可
能存在显著差异。
手性识别与拆分方法
手性识别
通过对手性分子的结构和性质进行分析,确定其手性特征。常见的方法包括X射线晶体学、圆二色光 谱、核磁共振等。
构型与构象
构型
分子中原子或基团在空间中的相 对位置关系,是固定的空间排列
。
构象
由于单键旋转而产生的不同空间排 列,是动态的空间排列。
构型与构象的关系
构型是构象的基础,构象是构型的 动态表现。不同的构型可能产生不 同的构象,而同一构型也可能产生 多种不同的构象。
02
碳原子立体化学
碳原子杂化类型
sp杂化
03
高等有机化学-3羰基反应共166页

谢谢!
166
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
高等有机化学-3羰基反应
11、用道德的示范来造就一个人,显然比用法律来约束他更有价值。—— 希腊
12、法律是无私的,对谁都一视同仁。在每件事上,她都不徇私情。—— 托马斯
13、公正的法律限制不了好的自由,因为好人不会去做法律不允许的事 情。——弗劳德
14、法律是为了保护无辜而制定的。——爱略特 15、像房子一样,法律和法律都是相互依存的。——伯克
▪
高等有机化学各章习题及答案 3

亲核取代反应预计下列各对反应中哪一个比较快解释之。
1)(CHCHO3O3H和FOSCCCFCFOSCC563563CHCH33ⅠⅡ在100%乙醇中溶剂解反应。
(2)98%的甲酸中溶剂解反应CCH=CHCHC=CHCHHCHOTs(Ⅰ)或HOTs(Ⅱ)在223223)(OOCOPhCHhOP在醋酸中的溶剂解反应。
和CHCH Br Br试对下列反应提出合理的反应机理。
)(1ClOCH3Cl-HCOOCCOCl32)(CH(O)CO23NN+,△OCCHOH3O外消旋化产物旋光性反应物-1;:1640cmIR—溴代—ρ—羟基乙苯生成一种白色固体:40~43℃,用碱性氧化铝处理2UV:282nm(水中),261nm(醚中);NMR在和(TMS内标)处有两个等幅单峰,元素分析(%):C,;H,%,对产物提出合理的机构,并提出此产物生成的机理。
B的物质在弱碱水溶液中反应,得产物A具有结构式SHCS56CH3O/HNaHCO23OH+Br-NON CHC2CHC3HCO56BA-的进攻对AHO这是一个分步骤完成的反应。
其第一步为的可信的反应机理;A生成B(1)试给出一个由键—NCH2)的实验证实,B中的N—(C=O)键的转动速度比A中的(2)核磁共振(NMR 的转动速度低的很多。
其可能原因是什么写出下列反应的机理)(1CH3CH3OHCH2ClCH2lCCP,Ph43CHCH33CHCH33(2)H SOCl2HSCHCHCHCSCHCHCHHCCSCHHCHSCHC565622225526226OHClCH23()O流回(EtO)PCHOEtPCHI+333tOE4.62—乙酰氧基环己醇对甲苯磺酸酯酸解时,发现反式异构体比顺式异构体快670倍。
且顺式异构体得到的是反式二醋酸酯(构型变化),而由于反式异构体得到的却是构型保持的产物。
试解释其原因.O OTsCHOC3COO-CH3OCOOHCH3CHOCCHOC33OO OTsCHOC3COO-CH3O COOHCH3CHOCCHOC33O下面给出他们的相对速曾经有具有ω—苯硫取代基的一系列卤代烷甲醇解反应的速率报道。
高等有机化学PPT课件

CH3CONHNH2 HNO2 CH3CON3
CH3NCO
X
O
C=NOH
CH3NCO
X
O
O
C N O C NHCH3
乃春在芳环邻位是不饱和支链时,极易环化成五元环,这一 性质对杂环的合成具有重要意义:
AX B
H N:
A BX
N
H
第三节:自由基
自由基是共价键发生均裂,每个碎片各保留一个电子,是带 单电子的三价碳的化合物。
2004年1版 6、洪琳编《有机反应活性中间体》高等教育出版社1999.6第一版 7、斯图尔特.沃伦著《有机合成――切断法探讨》丁新腾译,上海科学
技术文献出版社1986年1月第一版 8、黄宪、吴世晖、徐汉生《有机合成》(上、下)
第一章 有机反应活泼中间体及在合成上的应用
在有机反应中,经常出现的活泼中间体是卡宾、乃春、自由基、碳正离子、 碳负离子(包括苯炔、叶立德)
第一章 有机反应活泼中间体 及在合成上的应用
第一节:卡宾(碳烯)(Carbene) 第二节: 乃春 第三节:自由基 第四节:碳正离子 第五节、碳负离子(Carbenion)(活泼亚甲基
化合物)和叶立德
第二章 官能团的选择性互变
第一节 还原反应 第二节 氧化反应
第三章 官能团的保护
第一节: 羟基的保护(醇、酚羟基的保护) 第二节:烯键的保护 第三节:羰基的保护(用醇保护) 第四节:羧基的保护-酯化 第五节:胺基的保护-酰化或成盐
(六)生物有机化学( Bioorganic Chemistry) (七)元素和金属有机化学(Element and Metal Organic Compounds Chemistry) (八)有机化学中的一些重要应用研究
高等有机化学第三部分

Ar N O H H
Ar
N
O
H
metal H
Ar
NH2 + H2O
H
完整版课件ppt
32
CC CCCC OH NH2 OH O O O
O CC
C CO2H OH
C CO2H O
完整版课件ppt
21
机理:
C OH C OH + Pb(OAC)4
C O Pb(OAC)3
C OH
+ HOAC
C OPb(OAC)3 slow C OH
CO C O Pb(OAC)2 + HOAC
CO Pb(OAC)2源自机理:HeROH
HH
HH
e
KOH
H
H
H
HH
完整版课件ppt
8
Gomberg-Bachmamn Pinacol Synthesis
Na Hg
2RCOR
R2C CR2
OH OH
R C R + Na O
RCR O
RR sol
RCCR
OO
RR RCCR
OH OH
完整版课件ppt
9
(二)负氢转移(Hydride Transfer)
OHCH3Br
CH3OH 和 CH3Br LiAlH4 CH4
在机理中都是SN2,但一个是还原,而另一 个却不是。
完整版课件ppt
5
3-7-1 机理
没有哪个机理能够概括很多氧化还原反应,没有普遍 性,有的就是些具体例子,这里只能按Wibeng的方法粗 粗地分一下。
(一)电子直接转移(Direct electron transfer) (二)负氢转移(Hydride Transfer) (三)氢原子转移(Hydrogen-atom transfer) (四)无机酸酯的中间体进行的氧化 (五)取代机理 (六)加成-消除机理
高等有机化学:第三章 立体化学

手性的三配位硫化物和膦化物
3.5.2 带手性轴或手性面
H
H 镜面 H
H
C
C
14 H
H
14' H
H
镜面
H
H
15
15'
螺环分子
螺旋状(螺省)化合物
镜面
(4)
(5)
CH2CO2H
16
17
17'
ac
镜面
ca
bd
db
阻转异构体的联苯
PhO2S CH2CO2H
N NO2
HH (2) (8')
(8)
(2') HH
12c
CH2OH O
OH
HO
OH
OH
CH2OH
H OH
H OH H
HO
OH
H OH
12d
12e
Fischer投影式表示糖的结构
a
y
x
b
c
z
CO2H HO H
CH3
ax
y
b
zc
CO2H HO H
HH
H
z
yx
ba
c H
H
CO2H
H
H
OH
Newman投影式和Fischer投影式的相互转化
3.2 同分异构体的类型
H
镜面
CH3
CH3
H
H
CH3
H3C
43a H
镜面
H
H 43b
CHC3H3 H
H3C H3C
H 44'
OH
OHOH
OHOH
OH OHOH
HO
高等有机化学第三部分3-2.ppt
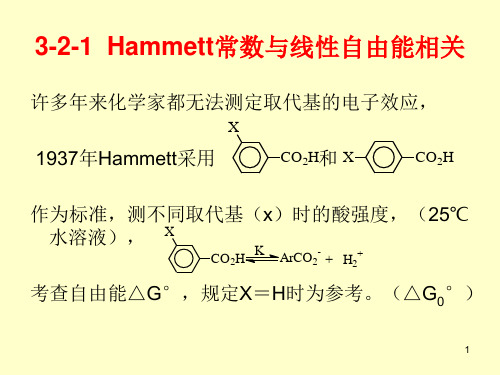
H
H
ρ=- 5.090 ,(EtOH,25℃)
8
Hammett常数还可以应用于IR、NMR等物理常数的预测。
注意: a. σp和σm数值有所不同但趋势一致,而邻位取代基的电
子效应无法在Hammett方程中反应,因为它有时所起的作用 不仅仅是电子效应。
b. 虽然Hammett常数得到广泛地应用,但有很多的例外, 即使在没有邻位效应的情况下,它有时也无法将诱导效应和 共轭效应综合考虑。为解决这问题,已经有许多的方法建立, 如H.C.Brown就定义了σ+(给电子)和σ-(吸电子),但都 只适用于很小的范围,没有一个能像Hammett常数应用得那 么广。
3
基团的σp和σm值举例:
GROUP σp
Br
0.26
N=NPh 0.34
CO2R CF3 CN
0.44 0.53 0.70
NO2 N2+
0.81 1.93
σm 0.37 0.28 0.35 0.46 0.62 0.71 1.65
GROUP
σp
I
0.28
CO2H 0.44 COMe 0.47
NH3+ 0.60 SO2Me 0.73 NMe3+ 0.82
KH = 6.5 KD
12
应用:
H C CH3 Br2 O
Br
C CH3 O
KH KD
= 6.1 ,说明决速步骤中有C-H键断裂。
H C CH3 的 O
OH
CH3 Br2 的
Br
CH3 O
13
(三) 二级同位素效应: 同位素取代不是在断裂的 键上(主要 是α、β位)
同样推导得二级同位素效应
例如取代效应:
高等有机化学——反应机理-3

Aldol reaction的立体化学
练习
(安息香缩合反应)
Retro-aldol 反应
Knoevenagel 缩合反应
(催化剂为三级胺时反应不好)
Knoevenagel 缩合反应
(E1cb消除)
共轭加成反应
Michael 加成反应
Robinson annulation
Robinson annulation
是加成-消除反应机理,不是SN2反应机理。
酯与胺反应生成酰胺
加成-消除反应的催化剂
(I- 也有类似作用)
Claisen 缩合反应
酯在碱的催化下缩合为β-酮酯。
逆Claisen缩合反应
格式试剂、金属负氢试剂对酯基的加成反应
格式试剂对酰胺的加成反应
α,β-不饱和羰基化合物的烯基碳上的取代反应
亲核性
ⅱ. 当亲核性原子的位阻变大时,亲核性大大下降,而碱 性 稍有增加。 亲核性:t-BuO- << EtO碱性:t-BuO- > EtO-;
iii 负电荷的离域使碱性大大下降;相对而言,亲核性则 只是部分下降
亲核性
iv. 非质子极性溶剂可以溶解阴离子,因此化合物的碱性 和亲核性都会增加,但亲核性增加得更多。
第一步( Michael 加成反应)
Robinson annulation
第二步( Aldol 加成反应)
Robinson annulation
第三步( 脱水反应)
思考题
C(sp2)-X上的亲核取代反应
羰基碳上的取代反应
许多羰基化合物(如:酯、酰氯、酰胺、酸酐)里,羰基连有离去基团, 羰基碳上带有一定的正电性,有利于亲核试剂的进攻,发生亲核取代反应。
高等有机化学 立体化学 课件

➢ 2 )构型异构 仅仅通过单键的旋转或环翻转不能使分 子中某个原子在空间中的不同排列得以互相转化的立体 异构。
➢ 构型异构又可分为顺反异构和光学异构两种
3.2 对称元素、手性、前手性和立体源中心
• 分子中的对称元素 • 简单对称轴(Cn) 当一条直线穿过一个分子并使这个分
3.1.2 立体异构---- 构象和构型
立体异构是指分子的构造相同,但因分子中的原子在空间 的位置或排列方式不同而引起的同分异构。可以分为构象 (Comformation )和构型(configuration )两种。
➢ 1 )构象异构 仅仅通过单键的旋转或环翻转后分子中 的原子在空间的不同排列方式就能相互转化的立体异构。
若分子中某一个原子(团)上的任意两个配体交换位置后 即产生一个新的立体异构体时,这个原子(团)即被称为 立体源中心。
3.3 手性分子的种类
手性分子:中心手性、轴手性、螺旋手性和平面手性。 中心手性分子有以下几种:
1 )有一个手性碳原子的化合物
2)三价手性原子的化合物 如果氮原子上的孤对电子当作 “虚”原子对待,则和三个不同基团结合的叔胺就成为一个
• 5 )阻转异构体 如果拥有邻位基团且足够大,以致 两个苯基绕C 一C 单键的旋转受到阻碍而造成的光学 异构体。
拓展(科研):苯在202 nm 处有一个较强的UV 吸收, 联苯UV 的最大吸收入max在248 nm 处,这显示出由于 联苯分子中两个苯环处在一个共轭体系中,使入max向 长波方向移动。在联苯分子的邻位引入取代基则将影响 到两个苯环的共平面性,UV 上表现出入max向短波区移 动。如2-甲基联苯入max 为236 nm , 2 , 2-二甲基联苯的 入max为224nm 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
R' HH
O O H R R > H R'
较不稳定
较稳定
三.环状分子的构象(角张力) 六元环 (一)环烷烃及其衍生物 燃烧热(表3-1,P.68) 小环(环丙烷和环丁烷)的内能,比其它环烷烃高得多,说明 存在很大张力;环己烷张力最小。 (1) 小环 环丙烷:最大角张力,其次扭转张力较高。 (2) 普通环和环己烷衍生物 环戊烷:平面构象几乎没有角张力;但扭转张力较高。 环己烷:最稳定构象——椅型;船型构象不稳定。
C-2空间构型保持不变
C-2空间构型反转
另:SN2反应中的瓦尔登翻转(构型翻转)。
3—4 构象和构象分析 构象:由单键旋转所形成的分子中基团在空间不同排列的立体形象。 一.空间张力(steric strain) 用空间能反映空间能力;Es Es =E() + E() + E(r) + E(d) E():键角张力。表示键角偏离正常键角(109.50)所产生的能量变 化,其大小与键角偏离值△的平方成正比; E():扭转张力。连接于相邻原子上的非键基团所处的空间向位,相 对于对位交叉构象的空间向位所产生的能量变化,重叠式构象 时,扭转张力最大。它是由空间电子效应所引起的。 E(r):拉伸张力。表示键长偏离正常键长的能量变化,其大小与键长 偏离值△r的平方成正比。 E(d):非键张力。表示不成键的基团之间的吸引力和排斥力,它包括 范德华力,偶极(电荷)作用力,氢键作用力等。 在多数情况下,非键张力常常是范德华力(主要是色散力)作用的 结果。
(顺式) (反式)
两个不同的环并联时,有顺反异构体,也有对映异构体。
3—3 动态立体化学 一.立体选择反应(stereoselective reaction) 定义:同一反应物能够生成两种以上的立体异构物时,其一异构体生 成较多的反应。Eg.
I CH3CH2CHCH 3
KOC(CH3)3
H3C H
O CH3 C D 酶 还原
D (R) OH H (S) 外消旋
H3C
H D (S)
[a]D=-0.280
进攻Si面
3—2 顺反异构 一.由双键引起的顺反异构 (一)含C=C的化合物 (C=C含一个 键,一个∏键)
W X C C (A) Y Z w C C X (B) Y Z
A.命名 ① 顺—反命名:当W=Y时,(A)为顺式,(B)为反式。 ② Z-E命名:基团按次序规则排列大小。两个优先(大)基 团处于双键同侧,为Z式;反之为E式。 Cl Cl Me Et Br COOH C C eg. C C C C Br
H slow C6H5 C H3C Br -Br
-
H H C CH 3 C6H5 OH fast (R) H HO C C6H5 CH 3 + C6H5 C OH (S)
H3C
构型转化 构型保持 具有对称面的不饱和键经过加成得到一对对映体,可说明另一种 前手性关系,即 Prochiral face.
乙烷的构象 :
(交叉式)
正丁烷的构象:
H H Me Me HH H H Me H H Me Me H H H Me H H H Me Me H H
全重叠 部分重叠 邻位交叉 对位交叉 Es/KJ.mol-1 ~25 ~14 ~3 0 构象异构体:在各种构象中,那些能量处于极小值的构象。 注意:并不是任何化合物都是对位交叉构象所占比例大于邻位 交叉构象。 H Me Me (Me与Cl间距离相当于 Cl H H 它们的范德华半径之 eg. > 和,二者产生吸引) H H
C6H5 a-C10H7 C C6H5 C C C10H7- a CH3 H C C C CH3 H
b. 联芳基型化合物(具手性轴) (R)-(+) (S)-(-) -2,2’-二氨基-6,6’-二甲基联苯
Ch 3 H3C NH 2 H2N
c. 手性面分子(分子中无手性中心,无手性轴) 取代对苯二酚双环醚衍生物。 (CH )
W C N X (A) X (B) Y W C N Y (C) W N N Y W N N Y (D)
命名:1。对于肟(=C=N-OH)、腙(=C=N-NH2 )和其它化合物,若W=Y,则 (A)为顺式,(B)为反式。 2.Z-E法:氮上的未共用电子对在顺序规则中位于H之后。 3.偶氮化合物(C)总是顺式或Z型;(D)则是反式或E型。
Me H H (A) CH 2 H H H CH 2 H H H3C H (C) CH 2 H H CH 2 H CH 3 (B) H CH 3 (D)
(重叠式构象) (交叉式构象) 稳定性: A,or B > C, or D B > A (氢原子重叠式>甲基与双键重叠) 2.羧基化合物:优势构象为重叠式;不同之处:取代基与羧基重叠 最稳定。
a e
CH3 a e e a
a:直立键 e:平伏键
椅型反转:a
e,e
a
椅型 取代基在平伏键上的 构象比在直立键上的稳定。 CH3
O
CH3
CH3
H
O
(较不稳定)
H O O H
(较稳定)
HO
H
C O 甲基与 重叠; 甲基在e 键可降低非键张力;
OH 较稳定 较不稳定
(3) 环和大环 (4 ) 环 (二)环烯 四.构象分析 通过研究分子的构象来分析分子的物理和化学性质。 在环己烷体系中,取代基在键与在e键的能量差,称为该取代 基在环己烷中的构象能,构象能越大,表示- 取代基的构象越不稳 定, 二易于通过环的反转变成e-取代基的构象。 3—5 空间效应 定义:分子内各基团之间,或两分子相互接近时不同分子的基团 之间,通过空间直接相互作用所引起的取代基效应。 空间效应的大小与相互作用基团的大小和形状密切相关。 一般总是将空间张力分解为角张力,扭转张力和非键张力,用 以定性地解释空间效应对分子性能的影响。 空间效应一般具体化为位阻效应。
H H Cl H
H H H O OH H H OH H H
>
(通过氢键形成 五元环结构)
H
H
OH
二.链状分子的构象 (一)饱和烃及有关衍生物(sp3-sp3键的旋转) 简单烃类化合物空间张力: 全重叠 > 部分重叠 > 邻位交叉 > 对位交叉 稳定性顺序则相反。 (二)含C=C和C=O的化合物(sp2-sp3键的旋转) 1.1-丁稀分子的极限构象:
关于位阻: 1.位阻可使分子产生手性轴或手性面,从而拆分为对映体。 2.位阻可表现在化合物分子间的相互作用方面。这是由原子或 基团相处在他们的范德华力半径所不允许的范围之内时所发 生的一种相互作用。 3.某些情况下,位阻还会改变电子效应的大小。 H C CH eg. ON OH ON OH
3 3 2 2
二.由环引起的顺反异构 环中的键不能自由旋转,产生顺反异构;也可能出现对映异构体。
H COOH H COOH H H COOH H COOH H COOH COOH
对映体 反式异构体
COOH H H COOH COOH COOH H H
内消旋体 顺式异构体
无对映体
顺式 反式 两个相同的环在相邻原子间并联的稠环化合物,有顺反异构,无 对映异构。eg.十氢化萘
Me C C H Me
Br + C Br (单线态二溴卡宾) Br + C Br Me H Br Br
Br Br
eg.
H
H
H Me
H Me H
三. 反应过程中的构型反转
COOH HO 2 H H3 H COOH (-)-苹果酸 COOH AgOH Cl 2 H H 3 H COOH (-)-氯丁二酸 KOH COOH H 2 OH H 3 H COOH (+)-苹果酸
前张力(叔胺的三个烃基造成更大的空间张力所致) 胺的碱性顺序:(CH3)2NH > CH3NH2 > (CH3)3N > NH3 (20) (10) (30) 2)
+
H hp OH H
R
ph
CH 3
CH 3
赤型(较多)
苏型(较少)
5 .空间效应还包括两类张力,即前张力( face strain )和后张力 (back strain). 前张力:双分子接近形成的面对面的空间效应。 eg. R' R 与三烷基硼反应, 1) R N B R' 其碱性顺序:
R R' R3N<R2NH<RNH2<NH3
re 面 O C (顺时针方向, H) O H C 3 H C
si 面 (逆时针方向,O
C
H)
从左侧看,O→C→H的顺序,其转向是顺时针的,称为re面; 从右侧看,称为si面。 Re面与si面,对映异构关系,称为对映异位面;特殊试剂可辨认。 O OH OH NaBH4 Eg. CH3 C D R与S等量, H3C H + H3C D
H Et H Me H (Z) (Z) (E)
B.顺反异构体数目:N=2n (n为双键数) C.性质: 原因 : 稳定性 顺式<反式 顺式中基团空间排斥作用大,内能高 沸点 顺式>反式 反式空间体积大;顺式偶极矩大,分子间引力 密度 顺式>反式 同上 折射率 顺式>反式 同上 熔点 顺式<反式 反式对称性好,排列更紧密有序 溶解度 顺式>反式 同上 加热 顺式→反式 (二)含C=N和N=N的化合物 ∏键不能旋转,产生顺反异构。
3—1 对映异构 旋光性物质(光活性物质):能使偏振光旋转的物质。 光学活性的物质总是成对出现,一个左旋,一个右旋,互为对映体;
一.分子的对称因素和手性 判断分子具有手性的充分必要条件: 分子既没有对称面,没有对称中心,也没有四重交替对称轴。 一般情况下,只要分子中既没有对称面也没有对称中心,即可判 断它是手性分子。 手性分子的几种情况: ⑴分子含有手性中心即不对称碳原子(连接四个不同取代基的碳原 子) ⑵非碳手性中心(Si,N,S,P As以及B等);非碳原子所形成的不 对称四面体(或三角锥体)化合物也有对映异构现象。 ⑶某些分子无手性中心,也有旋光性。 a. 丙二烯衍生物
