苏教版化学选修3专题1课件 .ppt
合集下载
苏教版 高中化学 选修三 专题1《揭示物质结构的奥秘》ppt课件

3.(SJ·P3改编)下列说法不是研究分子空间结构时重点探讨的问题的
是 ( )
A.有些元素能形成同素异形体
B.有机化合物存在同分异构现象
C.分子中各原子的连接顺序、连接方式以及原子在分子中的空间相对
位置的确定 D.同位素问题
【解析】选D。研究分子空间结构时重点探讨的问题有 :有些元素能形 成同素异形体,有机化合物存在同分异构现象,分子中各原子的连接顺 序、连接方式以及原子在分子中的空间相对位置的确定 ,分子结构对 物质的性质有什么影响等问题,同位素问题不是研究分子空间结构时 重点讨论的问题。
4.(SJ·P5改编)研究物质结构,可以帮助人们开发新型材料。下列哪
些不属于新型材料 ( )
A.信息材料
C.纳米材料
B.光导纤维
D.可降解高分子材料
【解析】选B。信息材料、纳米材料、超导材料、可降解高分子材料
的开发、研制和应用,都依赖物质结构的研究,光导纤维不是研究物质 结构要开发的新型材料。
5.(SJ·P5改编)哪些内容的发现不是为有机立体化学的发展奠定基础 的 ( )
A.碳原子的四价 B.有机物的同分异构现象 C.有机物中碳原子成键的立体结构 D.有机分子结构中价键的饱和性
【解析】选B。碳原子的四价、有机物中碳原子成键的立体结构、有
机化合物分子结构中价键的饱和性等相继被发现 ,为有机立体化学的
发展奠定了基础,故B选项符合题意。
一、人类探究物质结构的历史 1.人类探索原子结构的历史: (1)量子力学建立之前的原子结构的演变。
它几乎集中了原子的全部质量,电子带负电荷,在原子核周围空间做高
速运动。
(4)玻尔——原子轨道模型。
电子在原子核外空间内一定的轨道上绕核做高速运动,这些轨道的能 量变化是不连续的。
高中苏教版化学选修3 目录课件PPT

1课时 原子核外电子的运动 第2课时 原子核外电子的排布
第二单元 元素性质的递变规律 第1课时 原子核外电子排布的周期性 第2课时 电离能和电负性
专题复习课
第一单元 金属键 金属晶体 第二单元 离子键 离子晶体 第三单元 共价键 原子晶体
第1课时 共价键 第2课时 共价键的键能与化学反应的反应热、原子晶体 第四单元 分子间作用力 分子晶体 专题复习课
第一单元 分子构型与物质的性质 第1课时 分子的空间构型 第2课时 分子的极性与手性分子
第二单元 配合物的形成和应用 专题复习课
专题5 物质结构的探索无止境 模块综合测评
Thank you for watching !
第二单元 元素性质的递变规律 第1课时 原子核外电子排布的周期性 第2课时 电离能和电负性
专题复习课
第一单元 金属键 金属晶体 第二单元 离子键 离子晶体 第三单元 共价键 原子晶体
第1课时 共价键 第2课时 共价键的键能与化学反应的反应热、原子晶体 第四单元 分子间作用力 分子晶体 专题复习课
第一单元 分子构型与物质的性质 第1课时 分子的空间构型 第2课时 分子的极性与手性分子
第二单元 配合物的形成和应用 专题复习课
专题5 物质结构的探索无止境 模块综合测评
Thank you for watching !
苏教版高三化学选修3物质结构与性质(全套)精品课件

苏教版高三化学选修3物质结构与 性质(全套)精品课件
第二单元 离子键 离子晶体
苏教版高三化学选修3物质结构与 性质(全套)精品课件
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第二单元 元素性质的递变规律
苏教版高三化学选修3物质结构与 性质(全套)精品课件
专题3 微粒间作用力与物质的 性质
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第一单元 金属键 金属晶体
苏教版高三化学选修3物质结构 与性质(全套)精品课件目录
0002页 0066页 0091页 0167页 0Байду номын сангаас01页 0344页
专题1 揭示物质结构的奥秘 第一单元 原子核外电子的运动 专题3 微粒间作用力与物质的性质 第二单元 离子键 离子晶体 第四单元 分子间作用力分子晶体 第二单元 配合物的形成和应用
专题1 揭示物质结构的奥秘
苏教版高三化学选修3物质结构与 性质(全套)精品课件
专题2 原子结构与元素的性质
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第一单元 原子核外电子的运动
第二单元 离子键 离子晶体
苏教版高三化学选修3物质结构与 性质(全套)精品课件
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第二单元 元素性质的递变规律
苏教版高三化学选修3物质结构与 性质(全套)精品课件
专题3 微粒间作用力与物质的 性质
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第一单元 金属键 金属晶体
苏教版高三化学选修3物质结构 与性质(全套)精品课件目录
0002页 0066页 0091页 0167页 0Байду номын сангаас01页 0344页
专题1 揭示物质结构的奥秘 第一单元 原子核外电子的运动 专题3 微粒间作用力与物质的性质 第二单元 离子键 离子晶体 第四单元 分子间作用力分子晶体 第二单元 配合物的形成和应用
专题1 揭示物质结构的奥秘
苏教版高三化学选修3物质结构与 性质(全套)精品课件
专题2 原子结构与元素的性质
苏教版高三化学选修3物质结构与 性质(全套)精品课件
第一单元 原子核外电子的运动
苏教版高中化学选修三课件专题1

那么锗的比热最大,锗与锡间比热的差值应 与锡铅之间差值相当,故得锗的比热约为 218+88=306。锗处于金属与非金属的交界 线,估计有两性。 【答案】 (1)密度(g/cm3): 5.3 比热[J/(kg·K)]:306 (2)锗的金属性比锡弱,非金属性比硅弱; 既能与强酸反应又能与强碱反应
【规律方法】 元素的性质在周期表中呈现出一定的规律, 特别是同周期或同主族元素之间,要依据已 知的规律来推断未知的信息。
题型探究技法归纳
人类对物质结构的认识
例1 某科技报道,美国夏威夷联合天文中 心的科学家发现了一种新型氢微粒,这种微 粒是由3个质子和2个电子构成。对这种微 粒,下列说法正确的是( ) A.是H的一种新的同位素
B.是H2的一种新的同分异构体 C.它的组成可表示为H3 D.它比普通H2分子多一个氢原子核 【思路点拨】 本题考查原子的组成以及同 位素、同分异构体的概念。
(2)在同温同压下,同体积的任何气体含有相 同数目的分子。有了这两条分子假说,道尔 顿原子论和盖·吕萨克的气历史进程图表
原子结构 模型
相关科学家
特点
坚实不可再分的实心球
平均分布着正电荷的粒 子嵌着同样多的电子
原子结 构模型
相关科学家
特点
【解析】 这种微粒的符号为 H+ 3 ,它比 H2 多了一个质子(氢原子核),与 H2 的关系既不是 同位素也不是同分异构体,而是一种离子。
【答案】 D
【规律方法】 原子是由原子核和核外电子 组成的,原子核是由质子和中子组成的。原 子不带电,原子核带正电,电子带负电。质 子带正电,中子不带电。且有关系:核电荷 数=质子数=核外电子数。
1808年,英国人道尔顿又对原子论加以总结. 这样就结束了化学史上愚昧的炼金时代,保 证了化学向前健康地迅速发展。因此,化学 中的新时代应该说是从原子论开始的。 答案:①要考虑构成物质的微粒,有分子、 原子、质子、中子、甚至更小的夸克等。② 要考虑同种元素的原子有质子数相同而中子 数不同的情况,即同位素。只有③正确。
高中化学苏教版选修3课件:专题1揭示物质结构的奥秘 (共29张PPT)

(2) 化学键 理论知识和分子间作用力知识。 (3)分子的 空间结构 知识。 3.探索物质微观结构的方法 探索物质微观结构的方法主要有 实验方法 、 模型化方法 、科学假说 和论证方法、量子力学研究方法、 光谱和衍射实验方法 等。
归纳总结
人类探索物质结构的历史 1.由于道尔顿最早提出了原子论,合理地解释了当时的一些化学现象和规 律,给化学奠定了唯物主义理论基石,所以道尔顿被誉为近代化学之父。 2.从原子结构模型的演变过程可以看出,人类对原子结构的认识过程是逐 步深入的。虽然很多科学家得到了一些错误的结论,但对当时发现真相 作出了一定的贡献。 3.随着现代科学技术的发展,科学家已能利用电子显微镜和扫描隧道显微 镜来拍摄表示原子图像的照片并且能在晶体硅表面上用探针对原子进行 “搬迁”。
D.H++OH-===H2O 解析 抓住中和反应和反物质的特征即可,常见H+带正电荷,其反物
质为H-;OH-带负电荷,其反物质为OH+。
1
2
3
4
5
解析
答案
(3)画出氢离子反物质的原子结构示意图________。
解析 书写H-的原子结构示意图时要注意电子带正电荷。
1
2
3
4
5
解析
答案
本课结束
1
2
3
4
5
解析
答案
4.(1)19 世纪末,人们开始揭示原子内部的秘密,最早发现电子的科学
汤姆生 。 家是________
(2)道尔顿的原子学说曾起了很大的作用。他的学说包含下列三个论点:
①原子是不能再分的粒子
②同种元素的原子的各种性质和质量都相同
③原子是微小的实心球体
①②③ 。 从现代的观点看,你认为三个论点中不确切的是__________
归纳总结
人类探索物质结构的历史 1.由于道尔顿最早提出了原子论,合理地解释了当时的一些化学现象和规 律,给化学奠定了唯物主义理论基石,所以道尔顿被誉为近代化学之父。 2.从原子结构模型的演变过程可以看出,人类对原子结构的认识过程是逐 步深入的。虽然很多科学家得到了一些错误的结论,但对当时发现真相 作出了一定的贡献。 3.随着现代科学技术的发展,科学家已能利用电子显微镜和扫描隧道显微 镜来拍摄表示原子图像的照片并且能在晶体硅表面上用探针对原子进行 “搬迁”。
D.H++OH-===H2O 解析 抓住中和反应和反物质的特征即可,常见H+带正电荷,其反物
质为H-;OH-带负电荷,其反物质为OH+。
1
2
3
4
5
解析
答案
(3)画出氢离子反物质的原子结构示意图________。
解析 书写H-的原子结构示意图时要注意电子带正电荷。
1
2
3
4
5
解析
答案
本课结束
1
2
3
4
5
解析
答案
4.(1)19 世纪末,人们开始揭示原子内部的秘密,最早发现电子的科学
汤姆生 。 家是________
(2)道尔顿的原子学说曾起了很大的作用。他的学说包含下列三个论点:
①原子是不能再分的粒子
②同种元素的原子的各种性质和质量都相同
③原子是微小的实心球体
①②③ 。 从现代的观点看,你认为三个论点中不确切的是__________
苏教版高中化学选修三课件专题1

要点突破讲练互动
探索物质的微观结构
探究导引1 原子学说的基本要点是什么?它能否解释 “1体积的氯气和1体积的氢气生成2体积的 氯化氢”?
氯原子构成氯气,氢原子构成氢气,则1体 积的氯气和1体积的氢气生成2体积的氯化氢 时,不能解释氯化氢的结构与形成。
探究导引2 提出“分子学说”的背景以及“分子学说的内 容”是什么? 提示:1808年,法国化学家盖·吕萨克 (J.L.Gay-Lussac 1778~1850)根据化合反应 实验的发现,提出假说:“在同温同压下, 相同体 积的不 同气体 含有相 同数目的原 子”。
自主体验
1. 下列有关化学史知识错误的是( ) A.原子分子学说的建立是近代化学发展 的里程碑 B.俄国科学家门捷列夫发现了元素周期 律,编制了元素周期表
解析:选D。本题首先要清楚同位素和同素 异形体的区别,前者的对象是原子,而后者 的对象是单质;其次要了解同位素的物理性 质有差别,而化学性质基本相同。14C与12C 质子数相同,中子数不同,故D正确。
想一想 你能说出原子结构模型的演变过程 吗? 提示:原子结构模型大致经历了五个发展阶 段的变化:道尔顿原子模型→汤姆生原子模 型→卢瑟福原子模型→玻尔原子模型→量子 力学原子模型。
5. 物质结构的研究,是生命科学在___分__子___ 水平上探索生命现象的本质。 6. 物质结构研究对于保护____生__态__环__境_____、 实现社会的可持续发展具有重大意义。
新知初探自学导引
自主学习
一、人类探索物质结构的历史 1. 19世纪初,最早提出原子概念的是英国科 学家__道__尔__顿____,他认为物质由____原__子___ 组成,在化学变化中___原__子___不可再分割, 其性质在化学反应中保持___不__变_____。
苏教版高中化学选修三课件第三章第一节晶体常识PPT.pptx

• 四教学目标 • 1.基础目标 • 1)了解晶体与非晶体的本质差异 • 2)掌握晶体的基本性质 • 3)了解得到晶体的三种途径 • 4)通过生活常识、情感经验从宏观特征逐步过渡到微观特
征,认真把握内部有序造就了外部有序
• 5)通过对晶体内部微观结构决定性质,宏观性质反映微观 结构的分析,培养学生的空间想象力和创兴精神,激发学生 的学习兴趣。
• 2·学生已有知识对本节内容学习的影响
• (1)正面影响:前两章已学过的有关物质结构知识已经帮助 学生形成了“结构决定性质”的模式,这为学生理解“内部 有序造就了外部规则”的事实奠定了基础;结合前两章的内 容,再通过本章的学习,学生能够比较全面地认识物质的结 构及结构对物质性质的影响,提高分析问题和解决问题的能 力。
• 思考与交流:图依次为Na、Zn,I2,C晶胞的示意图,数一数,它们平
• 均分别含几个原子?
• 钠_______锌________碘______金刚石________
第二课时计划
4、晶体与非晶体的判定方法 1).检测熔点法: 2).最可靠方法: 二、晶胞 1.晶胞内涵 2.对晶胞的“无隙并置”的理解 3.均摊法的晶胞模型。晶胞堆积动画
谢谢聆听
第三章第一节
晶体常识
• 一·课时安排:本节课分为两个课时来 完成
第1课时内容:P60—P62一晶体的概念、特征及性质、 和晶体的制备,晶体与非晶体的本质差异
第二2课·晶时胞内的容概:念P6,2—晶P胞64与晶晶体体与的非关晶系体,的晶区胞分中、所含 原子数的简单计算
• ·利用具体的实物和图片进行教学;
• ·运用观察、分析、对比、讨论等教学策略引导学生自主学习;
• ·通过实验帮助学生了解得到晶体的一般途径;
2020—2021学年高中化学苏教版选修3专题1揭示物质结构的奥秘专题优化总结课件(共8张PPT)

二、结构决定性质,性质体现结构 在通信网中必不可少的材料是化合物半导体。现在
最为普及的化合物半导体有两种,一种是镓砷半导体 ,它 用 作便携电话和无线电通信发射微波的零件;另一种化 合物 半 导体由比镓(Ga)多18个电子的元素A和与砷(As)同族且电子层 比砷少一层的元素B组成,它是作为通信电缆中 光信号 转 变 为电信号的中继器零件。此化合物的化学式为( D ) A.GaP B.AlP C.GaAs D.InP [解析] 根据元素周期表,比Ga多18个电子的元素,应 该 为 Ga同一主族下一周期的元素In,同族且电子层比砷少一层的 元素应该为P,因2021学年高中化 学苏教版选修3专题1揭 示物质结构的奥秘专题 优化总结课件(共8张
PPT)
2020/9/13
揭 示 物 质 结 构 的 奥 秘
揭 示 物 质 结 构 的 奥 秘
揭 示 物 质 结 构 的 奥 秘
C.金原子的“硬核”带正电,原子内含的正电荷集中在“核上” D.电子带负电绕原子核作高速圆周运动 [解析] ①实验现象“大多数α粒子畅通无阻地通过”,说 明原 子不是“实心球”,而是内部很“空旷”;②α粒子能偏转甚至被 弹回,根据电性作用和动量守恒原理,说明原子的内部 存 在 带正电的刚性体微粒,且质量比α粒子大得多;③偏转或被弹 回的粒子很少,说明这个带正电的“硬核”体积比原子本 身 小 得多。但本实验不能直接得出有关电子的存在、电子的 运 动 情况的结论,特别是“圆周运动”的概念本身就是错误的。 [答案] D
苏教版化学选修3《揭示物质结构的奥秘》ppt课件

D.1H、13C、35Cl
解析:选D。A中18O的质子数为8、中子数为10, 不符合题意;B中12C的质子数和中子数均为6,不 符合题意;C中6C的质子数、中子数均为6,16S的 质子数和中子数均为16;D中1H的质子数为1,13C 的中子数为7,35Cl的质子数为17,符合题意。
3.2011 年 4 月 22 日是第 42 个“世界地球日”, 主题是“珍惜地球资源,转变发展方式”。下列行 为中不.符合这一主题的是( ) A.采用“绿色化学”工艺,使原料尽可能转化为 所需要的物质 B.大量开采地下水,以满足社会对水的需求 C.减少直至不使用对大气臭氧层起破坏作用的氟 氯烃 D.节约能源,提高能源利用率
3.元素__原__子__结__构__的周期性变化是元素性质周期 性变化产生的原因。 4.研究物质结构常用_实__验__方__法___、 模__型__化__方__法__、 科学假设和论证方法, _光__谱__和_衍__射__实__验___方法早 已应用于研究原子、分子和晶体结构。
思考感悟 你能说出原子模型的演变过程吗? 【提示】 原子结构模型大致经历了五个发展阶 段的变化。道尔顿原子模型→汤姆生原子模型→ 卢瑟福原子模型→玻尔原子模型→量子力学原子 模型。
2.揭示物质的结构与性能的关系,可帮助我们预 测物质的性能。
3.研究物质结构,能帮助我们了解材料的结构与 性能之间的关系。_信__息__材__料___、纳米材料、超导材 料、_可__降__解___高分子材料等新型材料的开发、研制 和应用,都依赖于物质结构的研究。
4.物质结构的研究,使生命科学在_分__子__水平上探 索生命现象的本质。
【解析】 N4是由一种元素组成的物质,因而是一 种新型的单质而不是化合物;N4和N2是两种不同的 物质,所以两者的转化是化学变化;N4的摩尔质量 为56 g/mol;N4和N2的关系是同素异形体。
高中化学苏教版选修3课件 专题1 揭示物质结构的奥秘 课件

栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
你能说出原子结构模型的演变过程吗? 提示:原子结构模型大致经历了五个发展阶段的变化:道 尔 顿原子模型→汤姆生原子模型→卢瑟福原子模型→玻尔原 子 模型→量子力学原子模型。
二、研究物质结构的意义 1.从物质的结构,可以认识物质的性能。例如:金刚石、石 墨、C60、碳纳米管等均由碳元素组成,但是它们的性能却有 很大差别,这是由于____碳__原__子__之__间__的__排__列__方__式__不__同______。 2.研究物质的结构,能够为设计与合成新物质提供理论基础. 3.揭示物质的结构与性能的关系,可帮助我们预测物质的 性能。
3.1869年,俄国化学家____门__捷__列__夫_____揭示了自然界的 一 条基本规律——元素周期律。 4.19世纪中叶以后,人们对有机化合物的认识有了重大进 展 . 有机物中碳原子应满足_______四________价。 5.19世纪末至20世纪初,物理学揭开了原子内部结构的奥 秘, 发现了微观粒子波粒二象性。____量__子__力__学_____为化学提供了 分析原子和分子结构的理论基础。
1808年,英国人道尔顿又对原子论加以总结。这样就结 束 了 化学史上愚昧的炼金时代,保证了化学向前健康地迅速发展.因 此,化学中的新时代应该说是从原子论开始的。 答案:①要考虑构成物质的微粒,有分子、原子、质子、 中 子、甚至更小的夸克等。②要考虑同种元素的原子有质子 数 相同而中子数不同的情况,即同位素。只有③正确。
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
栏目 导引
专题1 揭示物质结构的奥秘
你能说出原子结构模型的演变过程吗? 提示:原子结构模型大致经历了五个发展阶段的变化:道 尔 顿原子模型→汤姆生原子模型→卢瑟福原子模型→玻尔原 子 模型→量子力学原子模型。
二、研究物质结构的意义 1.从物质的结构,可以认识物质的性能。例如:金刚石、石 墨、C60、碳纳米管等均由碳元素组成,但是它们的性能却有 很大差别,这是由于____碳__原__子__之__间__的__排__列__方__式__不__同______。 2.研究物质的结构,能够为设计与合成新物质提供理论基础. 3.揭示物质的结构与性能的关系,可帮助我们预测物质的 性能。
3.1869年,俄国化学家____门__捷__列__夫_____揭示了自然界的 一 条基本规律——元素周期律。 4.19世纪中叶以后,人们对有机化合物的认识有了重大进 展 . 有机物中碳原子应满足_______四________价。 5.19世纪末至20世纪初,物理学揭开了原子内部结构的奥 秘, 发现了微观粒子波粒二象性。____量__子__力__学_____为化学提供了 分析原子和分子结构的理论基础。
1808年,英国人道尔顿又对原子论加以总结。这样就结 束 了 化学史上愚昧的炼金时代,保证了化学向前健康地迅速发展.因 此,化学中的新时代应该说是从原子论开始的。 答案:①要考虑构成物质的微粒,有分子、原子、质子、 中 子、甚至更小的夸克等。②要考虑同种元素的原子有质子 数 相同而中子数不同的情况,即同位素。只有③正确。
苏教版化学选修有机化学基础课件:专题3第一单元

(1)加成反应
①概念:构成有机化合物不饱和键的两个原 子与其他原子或原子团直接结合而生成新物 质的反应。 ②反应方程式:(一定条件下与卤素、氢气、 水、卤化氢反应)
栏目 导引
专题3
常见的烃
CH2 ==CH2 +Cl2 ― →
,
CH2 ==CH2 +Br2 ― →
,
栏目 导引
专题3
常见的烃
CH2 ==CH2 +H2 ― →_____________, ― CH3—CH3
如:
这个反应的化学方程式常用下式来表示:
栏目 导引
专题3
常见的烃
(3)氧化反应
黑烟 ①烯烃易燃烧,燃烧时火焰明亮并伴有_____, 燃烧通式为:
3n 点燃 CnH2n+ O2 ― →nCO2+nH2 O ― 2 _________________________________。
②烯烃可被高锰酸钾酸性氧化,故烯烃可使 其_________。 褪色
引发剂
催化剂
。
栏目 导引
专题3
常见的烃
想一想
1.如何除去乙烷气体中混有的乙烯? 提示:(1)一般方法
将混合气体通入盛有溴水的洗气瓶,乙烯与
溴发生加成反应生成液态产物而被除去,乙 烷因不反应而逸出。 (2)若要除去乙烷中的乙烯并得到纯净干燥的 乙烷,方法如下:
栏目 导引
专题3
常见的烃
①使用溴水
栏目 导引
栏目 导引
专题3
常见的烃
4.根据有机化合物组成和结构的特点,认识
加成反应、取代反应和消去反应。 5.能说明加聚反应和缩聚反应的特点。
栏目 导引
专题3
常见的烃
新知初探自学导引
高中化学苏教版选修三专题3第4单元第1课时分子间作用力ppt课件

本 课
键”):
时 栏
(1)NaCl 溶于水时破坏 离子键 ;
目 开
(2)HCl 溶于水时破坏 极性键 ;
关
(3)SO2 溶于水时破坏 极性键 ;
(4)NaOH 和 HCl 反应时形成 离子键 和 极性键 ;
知识·回顾区
第1课时
(5)反应 2H2+O2===2H2O 中,被破坏的是非极性键, 形成的是 极性键 ;
本 课 时 栏 目 开 关
第1课时
学习·探究区
第1课时
3.氢键的概念与形成条件
(1)氢键的概念是一种特殊的 分子间作用力 ,它是由
已经与 电负性很强 的原子形成共价键的氢原子 与
另一分子中 电负性很强 的原子之间的作用力。
本
课
(2)氢键的通式可用 X—H…Y 表示。式中 X 和 Y 代表
时
栏
F、O、N,“—”代表共价键 ,“…”代表氢键 。
3.关于氢键的下列说法中正确的是 A.每个水分子内含有两个氢键
(C )
B.在水蒸气、水和冰中都含有氢键
本
C.分子间形成氢键能使物质的熔点和沸点升高
课 时
D.HF 的稳定性很强,是因为其分子间形成氢键
栏
解析 氢键属于分子间作用力,它主要影响物质的物理
目
开 关
性质,与化学性质(如稳定性等)无关。水分子内只有共价
学习·探究区
第1课时
4.氢键对物质物理性质的影响
(1)对物质熔、沸点的影响:组成和结构相似的物质,
当 分子间存在氢键 时,熔、沸点较高 ,如 HF、
本
H2O、NH3 等;而 分子内存在氢键 时,使熔、沸
课 时
点 降低 。
栏 目
苏教版高中化学选修3原子结构ppt
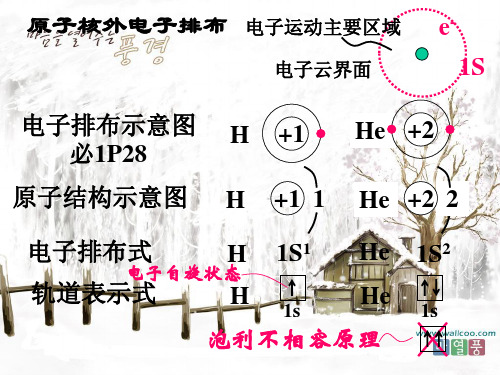
Li
1S 2S
原子轨道能?量
1s ?2s
Li
能量最低原理
1s 2s
请写出Be的原子结构示意图、电子排布式、
轨道表示式
2P
2P
B +5 2 3
2P B 1S2 2S3
2P 1S
Bபைடு நூலகம்
1s 2s
2P
2S
B 1S2 2S22P1
2P
B
原子轨道能量
1s 2s 2p
1S__2S__2Px__2Py__2Pz
B
1s 2s 2p
轨
道
3P排满后电子先进入3d 还是4S轨道?
核外电子排布顺序
4f
4d 5S 4P 3d 4S 3P 3S
2P 2S
1S
5S ?
4S 4P 4d 4f 3S 3P 3d
2S 2P 1S
练习:第四周期各元素原子的电子排布式、
轨道表示式
20Ca 1S22S22P63S23p6 4S2 ? 3d2
21Sc
电子排布式
Na 1S22S22P63S1
1s 2s
Al 1S22S22P63S23p1
原子实[Ne]
1s
外围电子
2s
P 1S22S22P63S23p3 [Ne]3S23P3 1s 2s
轨道表示式电子 式?
2p 3s 2p 3s 3p
2p 3s 3p
Cl 1S22S22P63S23p5 [Ne]3S23P5 1s 2s 2p 3s 3p
Ar 1S22S22P63S23p6
1s 2s 2p 3s 3p
K [Ar]4S1
1s 2s 2p 3s 3p 4s
各电子层原子轨道类型、数目、可容纳电子数
1S 2S
原子轨道能?量
1s ?2s
Li
能量最低原理
1s 2s
请写出Be的原子结构示意图、电子排布式、
轨道表示式
2P
2P
B +5 2 3
2P B 1S2 2S3
2P 1S
Bபைடு நூலகம்
1s 2s
2P
2S
B 1S2 2S22P1
2P
B
原子轨道能量
1s 2s 2p
1S__2S__2Px__2Py__2Pz
B
1s 2s 2p
轨
道
3P排满后电子先进入3d 还是4S轨道?
核外电子排布顺序
4f
4d 5S 4P 3d 4S 3P 3S
2P 2S
1S
5S ?
4S 4P 4d 4f 3S 3P 3d
2S 2P 1S
练习:第四周期各元素原子的电子排布式、
轨道表示式
20Ca 1S22S22P63S23p6 4S2 ? 3d2
21Sc
电子排布式
Na 1S22S22P63S1
1s 2s
Al 1S22S22P63S23p1
原子实[Ne]
1s
外围电子
2s
P 1S22S22P63S23p3 [Ne]3S23P3 1s 2s
轨道表示式电子 式?
2p 3s 2p 3s 3p
2p 3s 3p
Cl 1S22S22P63S23p5 [Ne]3S23P5 1s 2s 2p 3s 3p
Ar 1S22S22P63S23p6
1s 2s 2p 3s 3p
K [Ar]4S1
1s 2s 2p 3s 3p 4s
各电子层原子轨道类型、数目、可容纳电子数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6、1911年英国物理学家卢瑟福(汤姆生的 学生)提出了带核的原子结构模型
7、1913年丹麦物理学家波尔(卢瑟福的学生) 引入量子论观点,提出新的原子壳层结构模 型,他发现了氢原子光谱。
启示
人类对原子结构认识的逐渐深入,都是 建立在实验研究基础上的,实验是揭示 原子结构的重要手段。 汤姆生、卢瑟福、玻尔、海森伯四代师 生都是诺贝尔科学奖获得者,他们勇于 怀疑科学上的“定论”,不迷信权威, 向自己的恩师挑战,为科学的发展作出 了重要贡献。在他们的身上闪烁着科学 探索精神的光辉!
4、1869年,已有63 种元素为科学家所认 识,俄国化学家门捷 列夫将各元素按原子 量的变化联系起来, 揭示了自然界的一条 基本规律---元素周期 律。
1897年,英国科学家汤姆生利用阴极 射线在电场和磁场中的偏转,得出了 阴极射线是带负电的粒子流,并测定 了这种粒子流的荷质比,然后他做了 各种气体的阴极射线,发现现象相同, 于是得出结论:这种粒子必定是所有 物质的共同组成部分,这就是人们后 来所说的电子.
5.1897年,英国科学家汤姆生发现了电子。 1904年提出“葡萄干面包式”的原子结构模 型: 原子是一个平均分布着正电荷的粒子,其 中镶嵌着许多电子,这些电子带负电荷,中和了 正电荷从而形成中性原生的物理学家 卢瑟福把一束变动的α粒子射向一 片极薄的金箔,他惊奇地发现,过去 一直认为原子是实心球,而这种由实 心球紧密排列的金箔,竟让大多数α 粒子畅通无阻地通过,就象金箔不在 那而似的,但也有极少数α粒子发生 偏转,或被笔直弹回。 由此可得出什么结论?
例:1811年,人们发现在同温同压 下,气体反应中各气体的体积互 成简单的整数比.例如1体积氯气 和1体积氢气反应生成2体积氯 化氢,根据道耳顿的原子论,如果 物质是由氯气、氢气原子组成, 讨论氯化氢又是由什么组成,分 析道耳顿的原子论的缺陷并交 流.
3、1811年,意大利科学家阿伏加德罗提 出了分子的概念,他认为气体分子是由 几个原子构成的.1860年,国际化学界 确立了原子分子论.原子分子论的问世 标志化学真正成为一门科学并得到较 快发展.
揭示物质结构的奥秘
І
原子结构模型的演变
1、 公元前5世纪,希腊哲学家 德谟克利特等人认为 :万物 是由大量的不可分割的微粒 构成的,即原子。
2.
19世纪初,英国科学家道尔顿提出近代原 子学说,他认为原子是微小的不可分割的 实心球体,物质由原子组成,原子不能被创造, 也不能被毁灭,在化学变化中原子不可分割, 他们的性质在化学反应中保持不变。
