(完整版)药物临床试验英文缩写2017.1.20
药物临床试验英文缩写

Investigator
研究者
Investigator’s brochure, IB
研究者手册
Last observation carry forward, LOCF
最接近一次观察的结转
LC-MS
上市前许可(申请)
PSI
Statisticians in the Pharmaceutical Industry
制药业统计学家协会
QA
Quality Assurance
质量保证
QC
Quality Control
质量控制
RA
Regulatory Authorities
监督管理部门
SA
Site Assessment
New Drug Entity
新化学实体
NIH
National Institutes of Health
国家卫生研究所(美国)
PI
Principal Investigator
主要研究者
PL
Product License
产品许可证
PMA
Pre-market Approval (Application)
合同研究组织
Contract/ agreement
协议/合同
Control group
对照组
Coordinating committee
协调委员会
Crea
肌酐
CRF(case report form)
病例报告表
Crossover design
交叉设计
Cross-over Study
交叉研究
Css
稳浓度
美国食品与药品管理局
药物临床试验英文缩写

Alb
白蛋白
ALD(Approximate Lethal Dose)
近似致死剂量
ALP
碱性磷酸酶
Alpha spending function
消耗函数
ALT
丙氨酸氨基转换酶
英文全称
中文全称
Analysis sets
统计分析的数据集
Approval
批准
Assistant investigator
独立数据监察委员会
IEC
Independent Ethics Committee
独立伦理委员会
IND
Investigational New Drug
新药临床研究
IRB
Institutional Review Board
机构审查委员会
IVD
In Vitro Diagnostic
体外诊断
IVRS
Interactive Voice Response System
意向性分析(一统计学)
Interactive voice response system IVRS
互动式语音应答系统
Interim analysis
期中分析
International Conference of Harmonization ICH
人用药品注册技术要求国际技术协调会 国际协调
英文全称
中文全称
编制盲底
Blind review
盲态审核
Blind review
盲态检查
Blinding method
盲法
Blinding/masking
盲法/设盲
Block
层
Block size
药物临床试验英文缩写
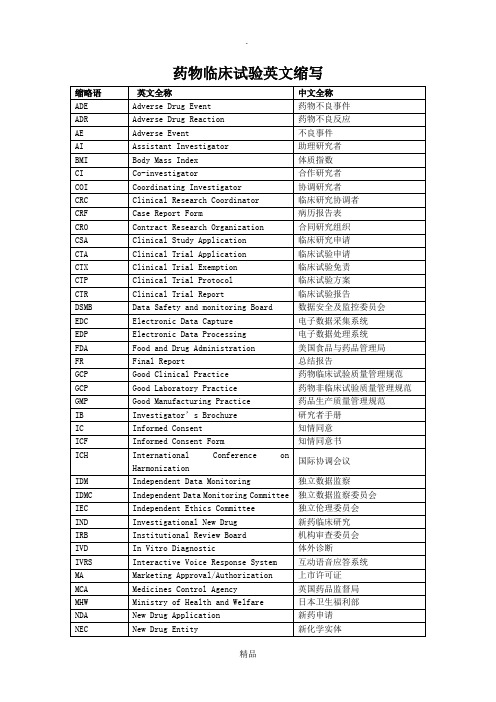
SAE
Serious Adverse Event
严重不良事件
SAP
Statistical Analysis Plan
统计分析计划
SAR
Serious Adverse Reaction
严重不良反应
SD
Source Data/Document
原始数据/文件
SD
Subject Diary
受试者日记
临床试验报告
DSMB
Data Safety and monitoring Board
数据安全及监控委员会
EDC
Electronic Data Capture
电子数据采集系统
EDP
Electronic Data Processing
电子数据处理系统
FDA
Food and Drug Administration
申办研究者
SIC
Subject Identification Code
受试者识别代码
SOP
Standard Operating Procedure
标准操作规程
SPL
Study Personnel List
研究人员名单
SSL
Subject Screening Log
受试者筛选表
T&R
Test and Reference Product
互动语音应答系统
MA
Marketing Approval/Authorization
上市许可证
MCA
Medicines Control Agency
英国药品监督局
MHW
Ministry of Health and Welfare
药物临床试验英文缩写

MA
Marketing Approval/Authorization
上市许可证
MCA
Medicines Control Agency
英国药品监督局
MHW
Ministry of Health and Welfare
日本卫生福利部
NDA
New Drug Application
新药申请
NEC
合同研究组织
Contract/ agreement
协议/合同
Control group
对照组
Coordinating committee
协调委员会
Crea
肌酐
CRF(case report form)
病例报告表
Crossover design
交叉设计
Cross-over Study
交叉研究
Css
稳浓度
Excellent
显效
Exclusion criteria
排除标准
Factorial design
析因设计
Failure
无效失败
Final point
终点
Fixed-dose procedure
固定剂量法
Forced titration
强制滴定
Full analysis set
全分析集
GC-FTIR
信息收集
Informed consent IC
知情同意
Initial meeting
启动会议
Inspection
检察/视察
Institution inspection
机构检查
Institution review board, IRB
药物临床试验英文词汇及缩写
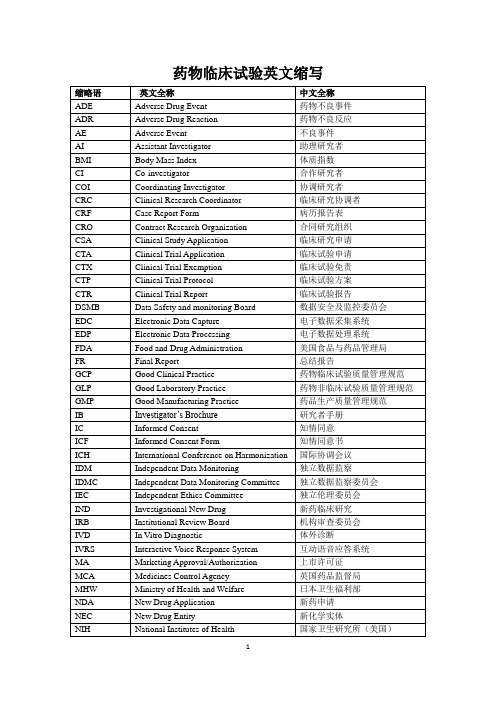
英文全称 Inclusion criteria Independent ethics committee IEC Information consent form ICF Information Gathering Informed consent IC Initial meeting Inspection Institution inspection Institution review board, IBR Intention-to –treat Interim analysis International Conference of Harmonization ICH Investigational Product Investigator Investigator’s brochure, IB Last observation carry forward, LOCF LC-MS LD50 LOCF, Last observation carry forward Logic check LOQ (Limit of Quantization) Lost of follow up Marketing approval/ authorization Matched pair Missing value Mixed effect model Monitor Monitoring Monitoring Plan Monitoring Report MRT MS MS-MS MTD(Maximum Tolerated Dose) Multi-center Trial
3
中文全称 准确度 阳性对照 活性对照 药物不良反应 不良事件 不良医学事件 药物不良反应 白蛋白 近似致死剂量 碱性磷酸酶 消耗函数 丙氨酸氨基转换酶 统计分析的数据集 批准 助理研究者 天门冬酸氨基转换酶 衰减全反射法 稳态血药浓度-时间曲线下面积 稽查 稽查/视察 稽查报告 稽查员 偏性 偏倚 生物等效应 空白对照 编制盲底 盲态审核 盲态检查 盲法 盲法/设盲 层 每段的长度 延滞效应 病历 病例报告表病例记录表 分类变量
药物临床试验英文缩写

Informed consent IC
知情同意
Initial meeting
启动会议
Inspection
检察/视察
Institution inspection
机构检查
Institution review board, IBR
机构审查委员会
Intention-to –treat ITT
意向性分析(- 统计学)
Emergency envelope
应急信件
End point
终点
Endpoint Criteria
终点指标
Endpoint criteria/ measurement
终点指标
Equivalence
等效性
Essential Documentation
必需文件
Ethics committee
伦理委员会
临床试验申请
Clinical trial exemption CTX
临床试验免责
Clinical trial protocol CTP
临床试验方案
Clinical trial/ study report
临床试验报告
Cmax
峰浓度
Co-investigator
合作研究者
Comparison
对照
Compliance
研究者手册
IC
Informed Consent
知情同意
ICF
Informed Consent Form
知情同意书
ICH
International Conference on Harmonization
国际协调会议
IDM
Independent Data Monitoring
药物临床试验英文缩写
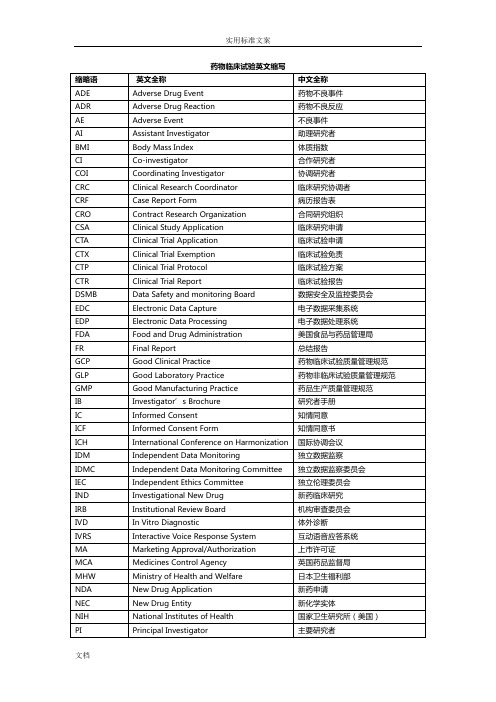
新化学实体
NIH
National Institutes of Health
国家卫生研究所(美国)
PI
Principal Investigator
主要研究者
PL
Product License
产品许可证
PMA
Pre-market Approval (Application)
临床试验申请
Clinical trial exemption CTX
临床试验免责
Clinical trial protocol CTP
临床试验方案
Clinical trial/ study report
临床试验报告
Cmax
峰浓度
Co-investigator
合作研究者
Comparison
对照
Compliance
假设检验
Improvement
好转
Inclusion Criteria
入选表准
Inclusion criteria
入选标准
Independent ethics committee IEC
独立伦理委员会
Information consent form ICF
知情同意书
Information Gathering
药物临床试验英文缩写
缩略语
英文全称
中文全称
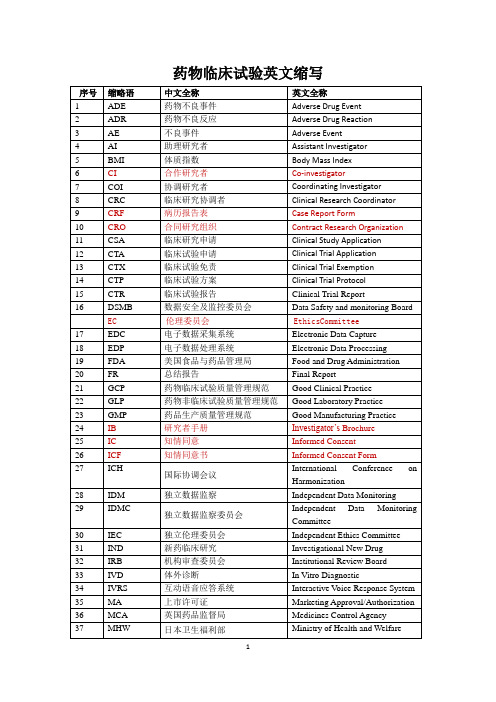
ADE
Adverse Drug Event
药物不良事件
ADR
Adverse Drug Reaction
药物不良反应
AE
Adverse Event
不良事件
AI
Assistant Investigator
(完整版)药物临床试验英文缩写2017.1.20

常见缩略语集1、药物临床试验英文缩写 (2)2、血尿检查英文缩写 (7)3、实验室英文缩写 (10)更新日期:2017年1月20日11、药物临床试验英文缩略语缩略语英文全称中文全称阳性对照AC /Active control活性对照药物不良事件ADE Adverse Drug Event药物不良反应ADR Adverse Drug Reaction不良事件Adverse EventAE助理研究AIAssistant Investigator近似致死剂ALDApproximate Lethal Dose曲线下面Area under the cureAUC体质指Body Mass IndexBMI计算机辅助试验设CATDComputer-assisted trial design合作研究CICo-investigator协调研究Coordinating InvestigatorCOI临床研究协调CRCClinical Research Coordinator病例报告病例记录CRFCase report form/ case record form 合同研究组CROContract Research Organization临床研究申Clinical Study ApplicationCSA临床试验申Clinical Trial ApplicationCTA临床试验免Clinical Trial ExemptionCTX临床试验方CTPClinical Trial Protocol临床试验报Clinical Trial ReportCTR功能残疾量DASDisability assessment schedule数据安全及监控委员Data Safety and monitoring BoardDSMB 心电ECGElectrocardiogram电子数据采集系Electronic Data CaptureEDC电子数据处理系Electronic Data ProcessingEDP肌电图ElectromyographyEMG全分析Full analysis setFAS美国食品与药品管理FDAFood and Drug Administration总结报Final ReportFR总体评估量Global Assessment ScaleGAS药物临床试验质量管理规Good Clinical PracticeGCP药物非临床试验质量管理规Good Laboratory PracticeGLP药品生产质量管理规Good Manufacturing PracticeGMP头痛影响测定问Headache Impact TestHIT-6gator's BrochurIB Invest研究者手册22、血尿检查英文缩略语中文全7、实验室英文缩略语313。
(完整版)临床试验常见英文缩写

临床试验常见英文缩写ADR(Adverse drug reaction) 不良反应AE(Adverse event)不良事件SAE(Serious Adverse Event) 严重不良事件CRF(Case report form/case record form)病例报告表CRO(Contract research organization)合同研究组织EC(Ethics Committee)伦理委员会GCP(Good clinical practice)药品临床试验管理规范EDC(Electronic data capture)电子数据采集IB(Investigator's Brochure) 研究者手册ND (Not Done) 未做NA (Not Applicable)不适用UK (Unknown)未知PI(Principal investigator )主要研究者Sub-I(Sub-investigator)助理研究者QA(Quality assurance)质量保证QC(Quality control)质量控制SDV(Source data verification)原始资料核对SD(Source data)原始数据SD(Source document ) 原始文件SFDA 国家食品药品监督管理局SOP(Standard operating procedure) 标准操作规程IRB 机构审查委员会ICF(Informed Consent Form) 知情同意书TMF(trial master file)研究管理文件夹临床试验常见英文单词A• Active control ,AC 阳性对照,活性对照阳性对照,活性对照• Adverse drug reaction ,ADR 药物不良反应药物不良反应• Adverse event ,AE 不良事件• Approval 批准• Assistant investigator 助理研究者• Audit 稽查• Audit report 稽查报告• Auditor 稽查员B• Bias 偏性,偏倚• Blank control 空白对照• Blinding/masking 盲法,设盲• Block 层C• Case history 病历• Case report form/case record form ,CRF 病例报告表,病例记录表• Clinical study 临床研究• Clinical trial 临床试验• Clinical trial application ,CTA 临床试验申请• Clinical trial exemption ,CTX 临床试验免责• Clinical trial protocol ,CTP 临床试验方案• Clinical trial/study report 临床试验报告• COA(药品检测报告)• Co-investigator 合作研究者• Comparison 对照• Compliance 依从性• Computer-assisted trial design ,CATD 计算机辅助试验设计• Contract research organization ,CRO 合同研究组织• Contract/agreement 协议/合同• Coordinating committee 协调委员会• Coordinating investigator 协调研究者• Cross—over study 交叉研究• Cure 痊愈• CTRB 临床试验文件夹D• Documentation 记录/文件• Dose—reaction relation 剂量-反应关系• Double blinding 双盲• Double dummy technique 双盲双模拟技术E• Electronic data capture ,EDC 电子数据采集系统• Electronic data processing ,EDP 电子数据处理系统• Endpoint criteria/measurement 终点指标• Essential documentation 必需文件• Excellent 显效• Exclusion criteria 排除标准F• Failure 无效,失败• Final report 总结报告• Final point 终点• Forced titration 强制滴定G&H• Global 全球• Generic drug 通用名药• Good clinical practice ,GCP 药物临床试验质量管理规定• Good manufacture practice ,GMP 药品生产质量管理规范• Good non-clinical laboratory practice ,GLP 药物非临床研究质量管理规范• Health economic evaluation ,HEV 健康经济学评价• Hypothesis testing 假设检验I• Improvement 好转• Inclusion criteria 入选标准• Independent ethics committee ,IEE 独立伦理委员会• Information gathering 信息收集• Informed consent form ,ICF 知情同意书• Informed consent ,IC 知情同意• Initial meeting 启动会议• Inspection 视察/检查• Institution inspection 机构检查• Institutional review board ,IBR 机构审查委员会• Intention to treat 意向治疗• Interactive voice response system ,IVRS 互动式语音应答系统• International Conference on Harmonization ,ICH 国际协调会议• Investigational new drug ,IND 新药临床研究• Investigational product 试验药物• Investigator 研究者• Investigator's brochure ,IB 研究者手册L• Local 局部M&N• Marketing approval/authorization 上市许可证• Matched pair 匹配配对• Monitor 监查员• Monitoring 监查• Monitoring report 监查报告• Multi—center trial 多中心试验• New chemical entity ,NCE 新化学实体• New drug application ,NDA 新药申请• Non—clinical study 非临床研究O• Obedience 依从性• Optional titration 随意滴定• Original medical record 原始医疗记录• Outcome 结果• Outcome assessment 结果指标评价• Outcome measurement 结果指标P• Patient file 病人指标• Patient history 病历• Placebo 安慰剂• Placebo control 安慰剂对照• Preclinical study 临床前研究• Principle investigator ,PI 主要研究者• Product license ,PL 产品许可证• Protocol 试验方案• Protocol amendment 方案补正Q&R(完整版)临床试验常见英文缩写• Quality assurance ,QA 质量保证• Quality assurance unit ,QAU 质量保证部门• Quality control ,QC 质量控制• Randomization 随机• Regulatory authorities ,RA 监督管理部门• Replication 可重复• Run in 准备期S• Sample size 样本量,样本大小• Serious adverse event ,SAE 严重不良事件• Serious adverse reaction ,SAR 严重不良反应• Seriousness 严重性• Severity 严重程度• Simple randomization 简单随机• Single blinding 单盲• Site audit 试验机构稽查• Source data ,SD 原始数据• Source data verification ,SDV 原始数据核准• Source document ,SD 原始文件• Sponsor 申办者• Sponsor-investigator 申办研究者• Standard operating procedure ,SOP 标准操作规程• Statistical analysis plan ,SAP 统计分析计划• Study audit 研究稽查• Subgroup 亚组• Sub—investigator 助理研究者• Subject 受试者• Subject diary 受试者日记• Subject enrollment 受试者入选• Subject enrollment log 受试者入选表• Subject identification code ,SIC 受试者识别代码• Subject recruitment 受试者招募• Subject screening log 受试者筛选表• System audit 系统稽查T&U• Trial error 试验误差• Trial master file 试验总档案• Trial objective 试验目的• Trial site 试验场所• Triple blinding 三盲• Unblinding 破盲• Unexpected adverse event ,UAE 预料外不良事件V&W• Variability 变异• Visual analogy scale 直观类比打分法• Vulnerable subject 弱势受试者• Wash—out 清洗期• Well—being 福利,健康EDC 系统常见英文缩写• 1.SCR (screening) 筛选• 2.DOV (date of visit) 访视第一天• 3。
药物临床试验英文缩写精编WORD版

IEC
Independent Ethics Committee
独立伦理委员会
IND
Investigational New Drug
新药临床研究
IRB
Institutional Review Board
机构审查委员会
IVD
In Vitro Diagnostic
体外诊断
IVRS
Interactive Voice Response System
上市前许可(申请)
PSI
Statisticians in the Pharmaceutical Industry
制药业统计学家协会
QA
Quality Assurance
质量保证
QC
Quality Control
质量控制
RA
Regulatory Authorities
监督管理部门
SA
Site Assessment
Excellent
显效
Exclusion criteria
排除标准
Factorial design
析因设计
Failure
无效 失败
Final point
终点
Fixed-dose procedure
固定剂量法
Forced titration
强制滴定
Full analysis set
全分析集
GC-FTIR
假设检验
Improvement
好转
Inclusion Criteria
入选表准
Inclusion criteria
入选标准
Independent ethics committee IEC
药物临床试验英文词汇及缩写

药物临床试验英文缩写.药物临床试验英文缩写.......实验室检查英文缩写..Accuracy 准确度Active control, AC 阳性对照,活性对照Adverse drug reaction, ADR 药物不良反应Adverse event, AE 不良事件Adverse medical events 不良医学事件Adverse reaction 药物不良反应Alb 白蛋白ALD(Approximate Lethal Dose)近似致死剂量ALP 碱性磷酸酶Alpha spending function 消耗函数ALT 丙氨酸氨基转换酶Analysis sets 统计分析的数据集Approval 批准Assistant investigator 助理研究者AST 天门冬酸氨基转换酶ATR 衰减全反射法AUCss 稳态血药浓度-时间曲线下面积Audit 稽查Audit or inspection 稽查/视察Audit report 稽查报告Auditor 稽查员Bias 偏性,偏倚Bioequivalence 生物等效应Blank control 空白对照Blind codes 编制盲底Blind review 盲态审核Blind review 盲态检查Blinding method 盲法Blinding/ masking 盲法,设盲Block 分段Block 层Block size 每段的长度BUN 尿素氮Carryover effect 延滞效应Case history 病历Case report form 病例报告表Case report form/ case record form, CRF 病例报告表,病例记录表Categorical variable 分类变量Cav 平均浓度CD 圆二色谱CL 清除率Clinical equivalence 临床等效应Clinical study 临床研究Clinical study report 临床试验的总结报告Clinical trial 临床试验Clinical trial application, CTA 临床试验申请Clinical trial exemption, CTX 临床试验免责Clinical trial protocol, CTP 临床试验方案Clinical trial/ study report 临床试验报告Cmax 峰浓度Co-investigator 合作研究者Comparison 对照Compliance 依从性Composite variable 复合变量Computer-assisted trial design, CATD 计算机辅助试验设计Confidence interval 可信区间Confidence level 置信水平Consistency test 一致性检验Contract research organization, CRO 合同研究组织Contract/ agreement 协议/合同Control group 对照组Coordinating committee 协调委员会Crea 肌酐CRF(case report form)病例报告表Crossover design 交叉设计Cross-over study 交叉研究Css 稳浓度Cure 痊愈Data management 数据管理Database 建立数据库Descriptive statistical analysis 描述性统计分析DF 波动系统Dichotomies 二分类Diviation 偏差Documentation 记录/文件Dose-reaction relation 剂量-反应关系Double blinding 双盲Double dummy 双模拟Double dummy technique 双盲双模拟技术Double-blinding 双盲Drop out 脱落DSC 差示扫描热量计Effectiveness 疗效Electronic data capture, EDC 电子数据采集系统Electronic data processing, EDP 电子数据处理系统Emergency envelope 应急信件End point 终点Endpoint criteria/ measurement 终点指标Equivalence 等效性Essential documentation 必须文件Ethics committee 伦理委员会Excellent 显效Exclusion criteria 排除标准Factorial design 析因设计Failure 无效,失败Final point 终点Fixed-dose procedure 固定剂量法Forced titration 强制滴定Full analysis set 全分析集GC-FTIR 气相色谱-傅利叶红外联用GC-MS 气相色谱-质谱联用Generic drug 通用名药Global assessment variable 全局评价变量GLU 血糖Good clinical practice, GCP 药物临床试验质量管理规范Good manufacture practice, GMP 药品生产质量管理规范Good non-clinical laboratory practice, GLP 药物非临床研究质量管理规范Group sequential design 成组序贯设计Health economic evaluation, HEV 健康经济学评价Hypothesis test 假设检验Hypothesis testing 假设检验International Conference of Harmonization, ICH 人用药品注册技术要求国际技术协调会,国际协调会议Improvement 好转Inclusion criteria 入选标准Independent ethics committee, IEC 独立伦理委员会Information consent form, ICF 知情同意书Information gathering 信息收集Informed consent, IC 知情同意Initial meeting 启动会议Inspection 视察/检查Institution inspection 机构检查Institution review board, IBR 机构审查委员会Intention to treat 意向治疗(——临床领域)Intention-to –treat, ITT 意向性分析(-统计学)Interactive voice response system, IVRS 互动式语音应答系统Interim analysis 期中分析Investigator 研究者Investigator's brochure, IB 研究者手册IR 红外吸收光谱Ka 吸收速率常Last observation carry forward, LOCF 最接近一次观察的结转LC-MS 液相色谱-质谱联用LD50 板数致死剂量Logic check 逻辑检查LOQ (Limit of Quantitation)定量限LOCF, Last observation carry forward 最近一次观察的结转Lost of follow up 失访Marketing approval/ authorization 上市许可证Matched pair 匹配配对Missing value 缺失值Mixed effect model 混合效应模式Monitor 监查员Monitoring 监查Monitoring report 监查报告MRT 平均滞留时间MS 质谱MS-MS 质谱-质谱联用MTD(Maximum Tolerated Dose)最大耐受剂量Multicenter trial 多中心试验Multi-center trial 多中心试验New chemical entity, NCE 新化学实体New drug application, NDA 新药申请NMR 核磁共振谱Non-clinical study 非临床研究Non-inferiority 非劣效性Non-parametric statistics 非参数统计方法Obedience 依从性ODR 旋光光谱Open-blinding 非盲Open-label 非盲Optional titration 随意滴定Original medical record 原始医疗记录Outcome 结果Outcome assessment 结果指标评价Outcome measurement 结果指标Outlier 离群值Parallel group design 平行组设计Parameter estimation 参数估计Parametric statistics 参数统计方法Patient file 病人档案Patient history 病历Per protocol,PP 符合方案集Placebo 安慰剂Placebo control 安慰剂对照Polytomies 多分类Power 检验效能Precision 精密度Preclinical study 临床前研究Primary endpoint 主要终点Primary variable 主要变量Principal investigator 主要研究者Principle investigator,PI 主要研究者Product license,PL 产品许可证Protocol 试验方案Protocol 试验方案Protocol amendment 方案补正Quality assurance unit,QAU 质量保证部门Quality assurance,QA 质量保证Quality control,QC 质量控制Query list,query form 应用疑问表Randomization 随机化Randomization 随机Range check 范围检查Rating scale 量表Regulatory authorities,RA 监督管理部门Replication 可重复RSD 日内和日间相对标准差Run in 准备期Safety evaluation 安全性评价Safety set 安全性评价的数据集Sample size 样本含量Sample size 样本量,样本大小Scale of ordered categorical ratings 有序分类指标Secondary variable 次要变量Sequence 试验次序Serious adverse event,SAE 严重不良事件Serious adverse reaction,SAR 严重不良反应Seriousness 严重性Severity 严重程度Significant level 检验水准Simple randomization 简单随机Single blinding 单盲Single-blinding 单盲Site audit 试验机构稽查SOP 试验室的标准操作规程Source data verification,SDV 原始数据核准Source data,SD 原始数据Source document,SD 原始文件Specificity 特异性Sponsor 申办者Sponsor-investigator 申办研究者Standard curve 标准曲线Standard operating procedure,SOP 标准操作规程Statistic 统计量Statistical analysis plan 统计分析计划Statistical analysis plan 统计参数计划书Statistical analysis plan,SAP 统计分析计划Statistical model 统计模型Statistical tables 统计分析表Stratified 分层Study audit 研究稽查Subgroup 亚组Sub-investigator 助理研究者Subject 受试者Subject diary 受试者日记Subject enrollment 受试者入选Subject enrollment log 受试者入选表Subject identification code,SIC 受试者识别代码Subject recruitment 受试者招募Subject screening log 受试者筛选表Superiority 检验Survival analysis 生存分析SXRD 单晶X-射线衍射System audit 系统稽查T1/2 消除半衰期Target variable 目标变量T-BIL 总胆红素T-CHO 总胆固醇TG 热重分析TLC、HPLC 制备色谱Tmax 峰时间TP 总蛋白Transformation 变量变换Treatment group 试验组Trial error 试验误差Trial master file 试验总档案Trial objective 试验目的Trial site 试验场所Triple blinding 三盲Two one-side test 双单侧检验Unblinding 揭盲Unblinding 破盲Unexpected adverse event,UAE 预料外不良事件UV-VIS 紫外-可见吸收光谱Variability 变异Variable 变量Visual analogy scale 直观类比打分法Visual check 人工检查Vulnerable subject 弱势受试者Wash-out 清洗期Washout period 洗脱期Well-being 福利,健康1.临床试验(Clinical Trial):指任何在人体(病人或健康志愿者身上)进行药品的系统性研究,以证实或揭示研究药品的作用、不良反应及/或试验用药品的吸收、分布、代谢和排泄,目的是确定研究药品的疗效与安全性。
药物临床试验英文缩写..
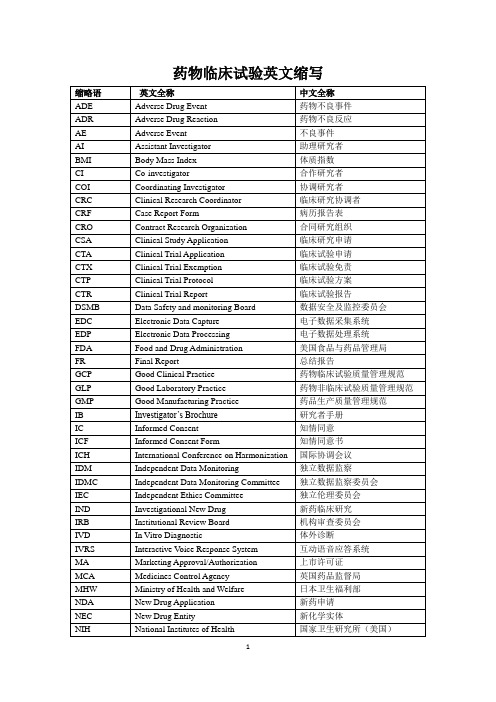
FR
Final Report
总结报告
GCP
Good Clinical Practice
药物临床试验质量管理规范
GLP
Good Laboratory Practice
药物非临床试验质量管理规范
GMP
Good Manufacturing Practice
药品生产质量管理规范
IB
Investigator’s Brochure
CSA
Clinical Study Application
临床研究申请
CTA
Clinical Trial Application
临床试验申请
CTX
Clinical Trial Exemption
临床试验免责
CTP
Clinical Trial Protocol
临床试验方案
CTR
Clinical Trial Report
药物不良反应
Alb
白蛋白
ALD(Approximate Lethal Dose)
近似致死剂量
ALP
碱性磷酸酶
Alpha spending function
消耗函数
ALT
丙氨酸氨基转换酶
Analysis sets
统计分析的数据集
受试和参比试剂
UAE
Unexpected Adverse Event
预料外不良事件
WHO
World Health Organization
世界卫生组织
WHO-ICDRA
WHO International Conference of
Drug Regulatory Authorities
药物临床试验英文缩写

DSMB
Data Safety and monitoring Board
数据安全及监控委员会
EDC
Electronic Data Capture
电子数据采集系统
EDP
Electronic Data Processing
电子数据处理系统
FDA
Food and Drug Administration
Emergency envelope
应急信件
End point
终点
Endpoint Criteria
终点指标
Endpoint criteria/ measurement
终点指标
Equivalence
等效性
Essential Documentation
必需文件
Ethics committee
伦理委员会
药物临床试验英文缩写
英文全称
中文全称
Accuracy
准确度
Active control, AC
阳性对照活性对照
Adverse drug reaction, ADR
药物不良反应
Adverse event, AE
不良事件
Adverse medical events
不良医学事件
Adverse reaction
研究者手册
IC
Informed Consent
知情同意
ICF
Informed Consent Form
知情同意书
ICH
International Conference on Harmonization
国际协调会议
IDM
Independent Data Monitoring
药物临床试验英文缩写汇编
药物临床试验英文缩写药物临床试验英文缩写研究者(Investigator),实施临床试验并对临床试验的质量及受试者安全和权益的负责者。
研究者必须经过资格审查,具有临床试验的专业特长、资格和能力。
协调研究者(CoordinatingInvestigator),在多中心临床试验中负责协调参加各中心研究者工作的一名研究者。
申办者(Sponsor),发起一项临床试验,并对该试验的启动、管理、财务和监查负责的公司、机构或组织。
监查员(Monitor),由申办者任命并对申办者负责的具备相关知识的人员,其任务是监查和报告试验的进行情况和核实数据。
稽查(Audit),指由不直接涉及试验的人员所进行的一种系统性检查,以评价试验的实施、数据的记录和分析是否与试验方案、标准操作规程以及药物临床试验相关法规要求相符。
视察(Inspection),药品监督管理部门对一项临床试验的有关文件、设施、记录和其它方面进行官方审阅,视察可以在试验单位、申办者所在地或合同研究组织所在地进行。
病例报告表(CaseReportForm,CRF),指按试验方案所规定设计的一种文件,用以记录每一名受试者在试验过程中的数据。
试验用药品(InvestigationalProduct),用于临床试验中的试验药物、对照药品或安慰剂。
不良事件(AdverseEvent),病人或临床试验受试者接受一种药品后出现的不良医学事件,但并不一定与治疗有因果关系。
严重不良事件(SeriousAdverseEvent),临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。
标准操作规程(StandardOperatingProcedure,SOP),为有效地实施和完成某一临床试验中每项工作所拟定的标准和详细的书面规程。
设盲(Blinding/Masking),临床试验中使一方或多方不知道受试者治疗分配的程序。
单盲指受试者不知,双盲指受试者、研究者、监查员或数据分析者均不知治疗分配。
药物临床试验英文词汇与缩写

药物临床试验英文缩写药物临床试验英文缩写实验室检查英文缩写Accuracy 准确度Active control, AC 阳性对照,活性对照Adverse drug reaction, ADR 药物不良反应Adverse event, AE 不良事件Adverse medical events 不良医学事件Adverse reaction 药物不良反应Alb 白蛋白ALD(Approximate Lethal Dose)近似致死剂量ALP 碱性磷酸酶Alpha spending function 消耗函数ALT 丙氨酸氨基转换酶Analysis sets 统计分析的数据集Approval 批准Assistant investigator 助理研究者AST 天门冬酸氨基转换酶ATR 衰减全反射法AUCss 稳态血药浓度-时间曲线下面积Audit 稽查Audit or inspection 稽查/视察Audit report 稽查报告Auditor 稽查员Bias 偏性,偏倚Bioequivalence 生物等效应Blank control 空白对照Blind codes 编制盲底Blind review 盲态审核Blind review 盲态检查Blinding method 盲法Blinding/ masking 盲法,设盲Block 分段Block 层Block size 每段的长度BUN 尿素氮Carryover effect 延滞效应Case history 病历Case report form 病例报告表Case report form/ case record form, CRF 病例报告表,病例记录表Categorical variable 分类变量Cav 平均浓度CD 圆二色谱CL 清除率Clinical equivalence 临床等效应Clinical study 临床研究Clinical study report 临床试验的总结报告Clinical trial 临床试验Clinical trial application, CTA 临床试验申请Clinical trial exemption, CTX 临床试验免责Clinical trial protocol, CTP 临床试验方案Clinical trial/ study report 临床试验报告Cmax 峰浓度Co-investigator 合作研究者Comparison 对照Compliance 依从性Composite variable 复合变量Computer-assisted trial design, CATD 计算机辅助试验设计Confidence interval 可信区间Confidence level 置信水平Consistency test 一致性检验Contract research organization, CRO 合同研究组织Contract/ agreement 协议/合同Control group 对照组Coordinating committee 协调委员会Crea 肌酐CRF(case report form)病例报告表Crossover design 交叉设计Cross-over study 交叉研究Css 稳浓度Cure 痊愈Data management 数据管理Database 建立数据库Descriptive statistical analysis 描述性统计分析DF 波动系统Dichotomies 二分类Diviation 偏差Documentation 记录/文件Dose-reaction relation 剂量-反应关系Double blinding 双盲Double dummy 双模拟Double dummy technique 双盲双模拟技术Double-blinding 双盲Drop out 脱落DSC 差示扫描热量计Effectiveness 疗效Electronic data capture, EDC 电子数据采集系统Electronic data processing, EDP 电子数据处理系统Emergency envelope 应急信件End point 终点Endpoint criteria/ measurement 终点指标Equivalence 等效性Essential documentation 必须文件Ethics committee 伦理委员会Excellent 显效Exclusion criteria 排除标准Factorial design 析因设计Failure 无效,失败Final point 终点Fixed-dose procedure 固定剂量法Forced titration 强制滴定Full analysis set 全分析集GC-FTIR 气相色谱-傅利叶红外联用GC-MS 气相色谱-质谱联用Generic drug 通用名药Global assessment variable 全局评价变量GLU 血糖Good clinical practice, GCP 药物临床试验质量管理规范Good manufacture practice, GMP 药品生产质量管理规范Good non-clinical laboratory practice, GLP 药物非临床研究质量管理规范Group sequential design 成组序贯设计Health economic evaluation, HEV 健康经济学评价Hypothesis test 假设检验Hypothesis testing 假设检验International Conference of Harmonization, ICH 人用药品注册技术要求国际技术协调会,国际协调会议Improvement 好转Inclusion criteria 入选标准Independent ethics committee, IEC 独立伦理委员会Information consent form, ICF 知情同意书Information gathering 信息收集Informed consent, IC 知情同意Initial meeting 启动会议Inspection 视察/检查Institution inspection 机构检查Institution review board, IBR 机构审查委员会Intention to treat 意向治疗(——临床领域)Intention-to –treat, ITT 意向性分析(-统计学)Interactive voice response system, IVRS 互动式语音应答系统Interim analysis 期中分析Investigator 研究者Investigator's brochure, IB 研究者手册IR 红外吸收光谱Ka 吸收速率常Last observation carry forward, LOCF 最接近一次观察的结转LC-MS 液相色谱-质谱联用LD50 板数致死剂量Logic check 逻辑检查LOQ (Limit of Quantitation)定量限LOCF, Last observation carry forward 最近一次观察的结转Lost of follow up 失访Marketing approval/ authorization 上市许可证Matched pair 匹配配对Missing value 缺失值Mixed effect model 混合效应模式Monitor 监查员Monitoring 监查Monitoring report 监查报告MRT 平均滞留时间MS 质谱MS-MS 质谱-质谱联用MTD(Maximum Tolerated Dose)最大耐受剂量Multicenter trial 多中心试验Multi-center trial 多中心试验New chemical entity, NCE 新化学实体New drug application, NDA 新药申请NMR 核磁共振谱Non-clinical study 非临床研究Non-inferiority 非劣效性Non-parametric statistics 非参数统计方法Obedience 依从性ODR 旋光光谱Open-blinding 非盲Open-label 非盲Optional titration 随意滴定Original medical record 原始医疗记录Outcome 结果Outcome assessment 结果指标评价Outcome measurement 结果指标Outlier 离群值Parallel group design 平行组设计Parameter estimation 参数估计Parametric statistics 参数统计方法Patient file 病人档案Patient history 病历Per protocol, PP 符合方案集Placebo 安慰剂Placebo control 安慰剂对照Polytomies 多分类Power 检验效能Precision 精密度Preclinical study 临床前研究Primary endpoint 主要终点Primary variable 主要变量Principal investigator 主要研究者Principle investigator, PI 主要研究者Product license, PL 产品许可证Protocol 试验方案Protocol 试验方案Protocol amendment 方案补正Quality assurance unit, QAU 质量保证部门Quality assurance, QA 质量保证Quality control, QC 质量控制Query list, query form 应用疑问表Randomization 随机化Randomization 随机Range check 范围检查Rating scale 量表Regulatory authorities, RA 监督管理部门Replication 可重复RSD 日内和日间相对标准差Run in 准备期Safety evaluation 安全性评价Safety set 安全性评价的数据集Sample size 样本含量Sample size 样本量,样本大小Scale of ordered categorical ratings 有序分类指标Secondary variable 次要变量Sequence 试验次序Serious adverse event, SAE 严重不良事件Serious adverse reaction, SAR 严重不良反应Seriousness 严重性Severity 严重程度Significant level 检验水准Simple randomization 简单随机Single blinding 单盲Single-blinding 单盲Site audit 试验机构稽查SOP 试验室的标准操作规程Source data verification, SDV 原始数据核准Source data, SD 原始数据Source document, SD 原始文件Specificity 特异性Sponsor 申办者Sponsor-investigator 申办研究者Standard curve 标准曲线Standard operating procedure, SOP 标准操作规程Statistic 统计量Statistical analysis plan 统计分析计划Statistical analysis plan 统计参数计划书Statistical analysis plan, SAP 统计分析计划Statistical model 统计模型Statistical tables 统计分析表Stratified 分层Study audit 研究稽查Subgroup 亚组Sub-investigator 助理研究者Subject 受试者Subject diary 受试者日记Subject enrollment 受试者入选Subject enrollment log 受试者入选表Subject identification code, SIC 受试者识别代码Subject recruitment 受试者招募Subject screening log 受试者筛选表Superiority 检验Survival analysis 生存分析SXRD 单晶X-射线衍射System audit 系统稽查T1/2 消除半衰期Target variable 目标变量T-BIL 总胆红素T-CHO 总胆固醇TG 热重分析TLC、HPLC 制备色谱Tmax 峰时间TP 总蛋白Transformation 变量变换Treatment group 试验组Trial error 试验误差Trial master file 试验总档案Trial objective 试验目的Trial site 试验场所Triple blinding 三盲Two one-side test 双单侧检验Unblinding 揭盲Unblinding 破盲Unexpected adverse event, UAE 预料外不良事件UV-VIS 紫外-可见吸收光谱Variability 变异Variable 变量Visual analogy scale 直观类比打分法Visual check 人工检查Vulnerable subject 弱势受试者Wash-out 清洗期Washout period 洗脱期Well-being 福利,健康1.临床试验(Clinical Trial):指任何在人体(病人或健康志愿者身上)进行药品的系统性研究,以证实或揭示研究药品的作用、不良反应及/或试验用药品的吸收、分布、代谢和排泄,目的是确定研究药品的疗效与安全性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Adverse Event
不良事件
AI
Assistant Investigator
助理研究者
ALD
Approximate Lethal Dose
近似致死剂量
AUC
Area under the cure
曲线下面积
BMI
Body Mass Index
体质指数
CATD
Computer-assisted trial design
SFDA
State Food and Drug Administration
国家食品药品监督管理局
缩略语
英文全称
中文全称
SDV
Source Data Verification
原始数据核准
SEL
Subject Enrollment Log
受试者入选表
计算机辅助试验设计
CI
Co-investigator
合作研究者
COI
Coordinating Investigator
协调研究者
CRC
Clinical Research Coordinator
临床研究协调者
CRF
Case report form/ case record form
病例报告表/病例记录表
Headache Impact Test
头痛影响测定问卷
IB
Investigator's Brochure
研究者手册
缩略语
英文全称
中文全称
IBR
Institution review board
机构审查委员会
IC
Informed Consent
知情同意
ICF
Informed Consent Form
知情同意书
ICH
International Conference on Harmonizatio
n国际协调会议
IDM
Independent Data Monitoring
独立数据监察
IDMC
Independent Data Monitoring Committee
独立数据监察委员会
IEC
Independent Ethics Committee
日本卫生福利部
MIDAS
Migraine Disability Assessment
偏头痛残疾程度评估问卷
MSQ
Migraine-Specific Quality of Life questionn
a偏ire头痛特异性生活质量问卷
NDA
New Drug Application
新药申请
NEC
New Drug Entity
独立伦理委员会
IND
Investigational New Drug
新药临床研究
IRB
Institutional Review Board
机构审查委员会
ITT
Intention-to-treat
意向性分析(统计学)
IVD
In Vitro Diagnostic
体外诊断
IVRS
Interactive Voice Response System
常见缩略语集
1、药物临床试验英文缩写2
2、血尿检查英文缩写7
3、实验室英文缩写10
更新日期:2017年1月20日
1
缩略语
英文全称
中文全称
AC
Active control
阳性对照/活性对照
ADE
Adverse Drug Event
药物不良事件
ADR
Adverse Drug Reaction
药物不良反应
CRO
Contract Research Organization
合同研究组织
CSA
Clinical Study Application
临床研究申请
CTA
Clinical Trial Application
临床试验申请
CTX
Clinical Trial Exemption
临床试验免责
CTP
Clinical Trial Protocol
互动语音应答系统
IWRS
interactive web response system
交互式网络响应系统
MA
Marketing Approval/Authorization
上市许可证
MCA
Medicines Control Agency
英国药品监督局
MHW
Ministry of Health and Welfare
GAS
Global Assessment Scale
总体评估量表
GCP
Good Clinical Practice
药物临床试验质量管理规范
GLP
Good Laboratory Practice
药物非临床试验质量管理规范
GMP
Good Manufacturing Practice
药品生产质量管理规范
HIT-6
现场评估
SAE
Serious Adverse Event
严重不良事件
SAP
Statistical Analysis Plan
统计分析计划
SAR
Serious Adverse Reaction
严重不良反应
SD
Source Data/Document
原始数据/文件
SD
Subject Diary
受试者日记
临床试验方案
CTR
Clinical Trial Report
临床试验报告
DAS
Disability assessment schedule
功能残疾量表
DSMB
Data Safety and monitoring Board
数据安全及监控委员会
ECG
Electrocardiogram
心电图
EDC
Electronic Data Capture
电子数据采集系统
EDP
Electronic Data Processing
电子数据处理系统
EMG
Electromyography
肌电图仪
FAS
Full ቤተ መጻሕፍቲ ባይዱnalysis set
全分析集
FDA
Food and Drug Administration
美国食品与药品管理局
FR
Final Report
总结报告
符合方案集
PSI
Statisticians in the Pharmaceutical Industr
y制药业统计学家协会
QA
Quality Assurance
质量保证
QC
Quality Control
质量控制
RA
Regulatory Authorities
监督管理部门
SA
Site Assessment
新化学实体
NIH
National Institutes of Health
国家卫生研究所(美国)
PI
Principal Investigator
主要研究者
PL
Product License
产品许可证
PMA
Pre-market Approval (Application)
上市前许可(申请)
PP
Per Protocol
