一颅锁骨发育不全综合征家族的RUNX2基因分析研究
先天性颅骨锁骨发育不全综合征的研究进展

先天性颅骨锁骨发育不全综合征的研究进展作者:徐山山姚金丹来源:《现代养生·下半月》2015年第08期[摘要]先天性颅骨锁骨发育不全综合征是一种罕见的常染色体显性遗传病,以锁骨发育不全、?门闭合延迟、乳牙滞留、恒牙迟萌、多生牙为典型症状。
本文从CCD的病因、临床表现、牙齿的组织学表现、诊断、分型、治疗方面的研究进行总结。
[关键词]先天性颅骨锁骨发育不全综合征;Cbfal;多生牙先天性颅骨锁骨发育不全综合征(Cleido-craJaial dysplasia,CCD)也称为Maxie-Sainton综合征,是一种罕见的常染色体显性遗传病,发病率约为1:1000000,多数患者有家族史,但无明显性别差异,也有散发病例。
该疾病发生在任何年龄,疾病累及范围较广。
1766年MoraJad首次进行报道,1871年Scheuthauer提及双侧锁骨和颅骨受累,1897年Marie与Sainton将其命名为颅骨锁骨发育不全综合征。
其最显著临床特征(CCD三联征)为囟门闭合迟缓或不闭合锁骨发育不全;数量较多的乳牙滞留和埋伏恒牙、多生牙。
据此3点基本可早期确诊为CCD。
1病因1977年报道家族性CCD患者的核心结合因子a1(core binding factora-1,Cbfal)基因突变,并证实是CCD致病原因,将其定位于染色体6p21区域。
Cbfal是转录因子runt(Runt-re lated transcriptionfactor)家族的成员,由RUNX2编码。
RUNX2全长130kb,由7个编码氨基酸的外显子组成,编码蛋白主要包含三个重要的结构域:N-末端一个谷氨酰胺和丙氨酸重复的Q/A结构域;中间一个保守的runt结构域;C-末端一个富含脯氨酸、丝氨酸和苏氨酸的PST活性结构域。
其中runt结构域介导runt家族的转录因子与Pebp2/Cbfb结合形成异二聚体以获得更强的与DNA结合的能力,并具有与其靶基因启动子区的成骨细胞特异性顺式作用元件相结合的能力,是蛋白质发挥功能非常重要的区域。
颅骨锁骨发育不全综合征一例
颅骨锁骨发育不全综合征一例颅骨锁骨发育不全综合征( cle idocran ia l dysplasia, CCD ),是一种罕见的先天性全身骨骼发育不全性疾病,发病率约百万分之一。
近年来,有报道颅骨锁骨发育不全综合征的致病原因是RunX2/Cbfal基因突变所致。
大约2/ 3 有家族史,其主要特征是全身多发性骨骼发育畸形和牙面的发育异常。
现将重庆医科大学附属口腔医院颌面外科收治的一例颅骨锁骨发育不全综合征病例报道如下。
1.病例简介患者,男性,11岁,以全口乳牙未换来我院就诊。
体格检查情况如下:身材矮小,营养较差,额骨呈方圆形,颅骨膨大,额骨前突明显,囟门已闭,颅面部不成比例,两眼距离较宽,下颌骨扁小。
全口乳牙滞留,恒牙迟萌,乳牙牙体未见明显异常,无松动,第一磨牙发育良好。
右侧锁骨发育不全,形成假关节,右肩下垂,肩关节活动度大并前耸,左侧肩胛骨内角向后伸出如翼状,肩关节盂浅,喙突短小。
胸部呈鸡胸,左侧手臂外翻。
本例患者智力正常,生活学习不受任何影响,学习成绩优秀。
家族遗传史:患者外祖母及母亲均患此病。
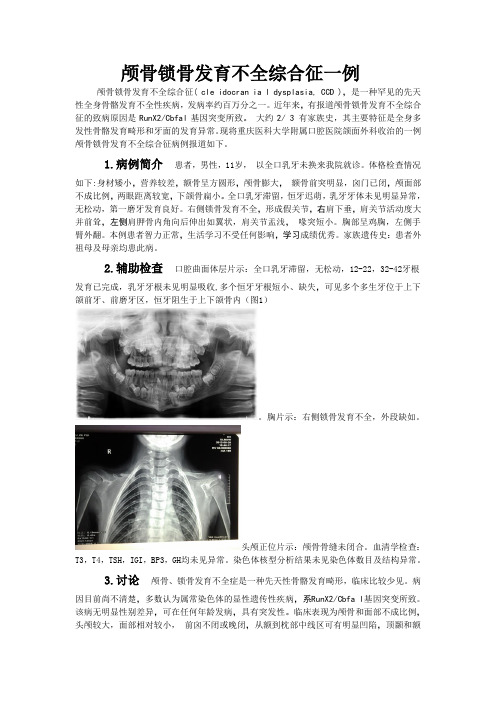
2.辅助检查口腔曲面体层片示:全口乳牙滞留,无松动,12-22,32-42牙根发育已完成,乳牙牙根未见明显吸收,多个恒牙牙根短小、缺失,可见多个多生牙位于上下颌前牙、前磨牙区,恒牙阻生于上下颌骨内(图1)。
胸片示:右侧锁骨发育不全,外段缺如。
头颅正位片示:颅骨骨缝未闭合。
血清学检查:T3,T4,TSH,IGI,BP3,GH均未见异常。
染色体核型分析结果未见染色体数目及结构异常。
3.讨论颅骨、锁骨发育不全症是一种先天性骨骼发育畸形,临床比较少见。
病因目前尚不清楚,多数认为属常染色体的显性遗传性疾病,系RunX2/Cbfa l基因突变所致。
该病无明显性别差异,可在任何年龄发病,具有突发性。
临床表现为颅骨和面部不成比例,头颅较大,面部相对较小,前囟不闭或晚闭,从额到枕部中线区可有明显凹陷,顶颞和额骨常有隆凸,两眼距较宽,鼻梁凹陷,上颌骨发育不足,面中部凹陷,侧貌为凹面形。
Runx2基因与骨相关疾病的研究

Runx2基因与骨相关疾病的研究张云芳(综述);王玉明;段勇(审校)【期刊名称】《医学信息》【年(卷),期】2014(000)021【摘要】Runx2 is the key transcription factor of regulating the bone marrow mesenchymal stem cells into osteoblasts dif erentiation and maturation during bone development. Through many pathways involved in the regulation of bone metabolism, Runx2 Can af ect osteoblasts, osteoclast activity and control bone resorption and formation, and have a great relationship with the formation of many bone-related diseases, Thus providing new ideas and therapeutic targets for the early detection and treatment of these diseases.%Runx2是骨发育过程中调节骨髓间充质干细胞向成骨细胞分化和成熟最关键的转录因子,它通过多条途径参与骨代谢的调控,可影响成骨细胞及破骨细胞活动从而控制骨形成与骨吸收,并与很多骨相关疾病的形成有很大关系,Runx2基因多态性的研究为疾病的早发现及治疗提供新的思路及治疗靶点。
【总页数】2页(P651-652)【作者】张云芳(综述);王玉明;段勇(审校)【作者单位】昆明医科大学第一附属医院检验科,云南昆明 650032;昆明医科大学第一附属医院检验科,云南昆明 650032;昆明医科大学第一附属医院检验科,云南昆明 650032【正文语种】中文【相关文献】1.腺相关病毒介导的klotho基因表达对去势大鼠骨Runx2及MMP-13表达的影响 [J], 王艳娇;马厚勋;李宝善;吴平2.骨保护素基因多态性及其血清浓度与人类相关疾病的研究进展 [J], 杜玉英;周晓辉3.Runx2基因参与Wnt/β-catenin信号通路中骨代谢疾病的研究进展 [J], 樊梅; 唐芳; 马武开; 兰维娅; 李宇; 蒋总; 蔡鑫4.骨保护素(OPG)基因多态性与种植体周围组织疾病的相关性研究 [J], 姚舜;刘倩;邓巍5.Runx2及相关骨科疾病研究进展 [J], 张媛;闫玉仙因版权原因,仅展示原文概要,查看原文内容请购买。
Runx2基因参与骨代谢相关通路的研究进展

Runx2基因参与骨代谢相关通路的研究进展陈伟健;黄永青;晋大祥;谢炜星;温龙飞;李钺;任东成;丁金勇;詹晓欢;许伟鹏【摘要】With the coming of aging era,osteoporosis has become a hot topic.Runx2 gene,as a specific transcription factor of bone differentiation,is involved in a variety of signaling pathways regulating bone differentiation.This paper reviews the involvement of Runx2 gene in transforming growth factor beta(TGF-β)/ bone morphogeneticprotein(BMPs)signaling pathway,Notch signaling pathway,and Wnt signaling pathway.%随着老龄化时代的到来,骨质疏松症成为人们研究的热点,而Runx2基因作为一种成骨分化特异性转录因子,参与多种信号通路调控成骨分化的过程.本文仅就Runx2基因参与转化生长因子-β(transforming growth factor-β,TGF-β)、骨形态发生蛋白(bone morphogenetic proteins,BMPs)通路、Notch 信号通路及Wnt信号通路的研究进展进行综述.【期刊名称】《中国骨质疏松杂志》【年(卷),期】2018(024)004【总页数】4页(P557-560)【关键词】Runx2基因;骨代谢;信号通路【作者】陈伟健;黄永青;晋大祥;谢炜星;温龙飞;李钺;任东成;丁金勇;詹晓欢;许伟鹏【作者单位】广州中医药大学,广东广州510405;广州中医药大学,广东广州510405;广州中医药大学第一附属医院,广东广州510405;广州中医药大学第一附属医院,广东广州510405;广州中医药大学,广东广州510405;广州中医药大学,广东广州510405;广州中医药大学,广东广州510405;广州中医药大学第一附属医院,广东广州510405;广州中医药大学,广东广州510405;广州中医药大学,广东广州510405【正文语种】中文【中图分类】R3361 Runx2的介绍Runx2称为核心结合因子 a1或多瘤病毒增强子结合蛋白及急性骨髓性白血病因子3,属于 runt 结构域基因家族成员之一。
Runx2基因调控致病的研究进展

Runx2基因调控致病的研究进展李悦;宫萍;王燕;郑咏之;贾美君;黄文祺;徐燕;姚成增【摘要】Runx2是一种公认的转录因子,对骨髓间充质干细胞向成骨细胞转化的过程起重要作用.体内外的研究表明,它可通过骨形态发生蛋白/Smads、丝裂原活化蛋白激酶信号通路等多种信号转导途径参与骨代谢,心血管系统的异位钙化,牙齿异常发育,肿瘤和器官纤维化等疾病的发生.另外,相关微RNA、环境因素、细胞因子、激素以及中医药提取物等对Runx2所致疾病也具有重要的调控作用.目前其在疾病的发生、发展以及预后的具体作用机制尚未完全明确,以Runx2为靶点治疗临床疾病或将成为研究热点.%Runx2 is an acknowledged transcription factor essential for osteoblast development from mesenchymal stem cells and maturation into osteocytes.Studies in vitro and in vivo have reported that Runx 2 could participate bone metabo-lism,ectopic calcification of cardiovascular system ,abnormal development of teeth ,tumorigenesis,and organ fibrosis through multiple integrated complex pathways,such as bone morphogenetic protein/Smads,mitogen-activated protein kinases and others.Besides,some factors likemicroRNA,environment,cytokines,hormones and traditional Chinese medicine extract also play a major role in the regulation of the disease induced by Runx 2.However,the function of Runx2 is not completelyunder-stood in the occurrence ,development and prognosis of the diseases ,and the targeting of Runx2 to treat the diseases may become a hotspot in the field.【期刊名称】《医学综述》【年(卷),期】2018(024)011【总页数】6页(P2081-2086)【关键词】Runx2;骨代谢;心血管系统异位钙化;牙齿发育;肿瘤;器官纤维化;调控作用【作者】李悦;宫萍;王燕;郑咏之;贾美君;黄文祺;徐燕;姚成增【作者单位】上海中医药大学附属曙光医院心内科,上海200021;上海中医药大学附属曙光医院心内科,上海200021;上海中医药大学附属曙光医院心内科,上海200021;上海中医药大学附属曙光医院心内科,上海200021;上海中医药大学附属曙光医院心内科,上海200021;上海中医药大学附属曙光医院心内科,上海200021;上海中医药大学附属曙光医院心内科,上海200021;上海中医药大学附属曙光医院心内科,上海200021【正文语种】中文【中图分类】R543.5Runx2属于Runxx蛋白家族一员,由α和β亚单位组成的异二聚体构成,该家族的分子结构中均含有由128个氨基酸构成的相同DNA结合区,该结合区与果蝇属分节基因Runt同源,因此被称为Runt结构域[1]。
RUNX2研究进展

医学分子生物学杂志,2006,3(1):52254 J Med Mol B i ol,2006,3(1):52254作者简介:顾新丰,男,1977年生,硕士研究生通讯作者:蒋垚(电话:02126436918128101,E 2mail:guxinfeng@sjtu 1edu 1cn )Author ’s brief intr oducti on:G U Xinfeng,male,born in 1977,Graduatestudent f or master degree Corres ponding author:J I A NG Yao (Tel:8626436918128101,E 2mail:guxinfeng@sjtu 1edu 1cn )RUNX2研究进展顾新丰,蒋垚上海交通大学附属第六人民医院骨科 上海市,200233【摘要】 RUNX2是转录因子RUNXX 家族成员之一,作为成骨细胞的特异转录因子,对骨组织的形成和重建起着重要作用。
RUNX2决定着多能干细胞向成骨细胞分化,促进软骨细胞的成熟和软骨的血管化。
另外,RUNX2与破骨细胞和细胞外基质的形成也有关。
通过对RUNX2基因表达调控及其诱导成骨细胞分化的分子机制的研究,已为骨代谢性疾病的治疗提供了新的思路。
【关键词】 RUNX2蛋白;骨细胞;基因表达调控【中图分类号】 R341Advances i n the Research of RUNX2G U Xinfeng,J I A NG YaoD epart m ent of O rthopaedics,Shangha i S ixth People ’s Hospital,J iaotong U niversity,Shanghai,200233,China【Abstract 】 RUNX2is a me mber of the runt ho mol ogy domain fa m ily of transcri p ti on fact ors 1A sa s pecific transcri p ti on fact or for osteoblast,RUNX2p lays an i m portant r ole in the f or mati on and re 2constructi on of bone tissue 1It can deter m ine the differentiati on of multi potent ste m cells int o osteo 2blasts,p r omote the maturity of chondr ocytes and vascularizati on of cartilage 1RUNX2is als o ass oci 2ated with the f or mati on of osteoclasts and extracellularmatrix 1Defining the molecular mechanis m s by which RUNX2functi ons as a master regulat ory gene for activating the p r ogra m of osteoblast ogenesis has p r ovided novel insights f or the therapeutic strategies of the metabolic diseases of bone 1【Key words 】 RUNX2p r otein;osteoblast;gene exp ress 骨骼的形成和重建主要是骨祖细胞和软骨祖细胞的分化、增殖和细胞外基质的形成。
RUNX2基因新突变致新生儿颅锁骨发育不全综合征1例

㊃病例报告㊃通信作者:刘洋,E m a i l :e t y y l y@163.c o m R U N X 2基因新突变致新生儿颅锁骨发育不全综合征1例李 娜,张 芳,郝丽红,刘 洋(天津市儿童医院新生儿内科,天津300134) 摘 要:颅锁骨发育不全综合征(c l e i d o c r a n i a l d y s pl a s i a ,C C D )是一种罕见的具有多种骨骼发育异常的常染色体显性遗传性疾病,其致病基因为R U N X 2,位于染色体6p 21㊂C C D 的临床表现多样,其治疗管理需要多学科合作,早期诊断和治疗对纠正畸形和改善患者的生活质量至关重要㊂C C D 在新生儿期临床表现不完全,其锁骨异常极易被误诊为骨折㊂本文总结1例R U N X 2基因新突变所致新生儿C C D 的临床特点,报道其基因突变新位点,以提高临床医师对本病的认识,为探讨C C D 致病的分子遗传学机制提供参考㊂关键词:锁骨颅骨发育不良;R U N X 2基因;婴儿;新生中图分类号:R 681.1 文献标志码:A 文章编号:1004-583X (2021)01-0062-04d o i :10.3969/j.i s s n .1004-583X.2021.01.013C a s e r e p o r t o f an e o n a t ew i t h c l e i d o c r a n i a l d y s p l a s i a c a u s e db y no v e lR U N X 2m u t a t i o n L iN a ,Z h a n g F a n g ,H a oL i h o n g ,L i uY a n g D e p a r t m e n t o f N e o n a t o l o g y ,T i a n j i nC h i l d r e n sH o s p i t a l ,T i a n ji n 300134,C h i n a C o r r e s p o n d i n g a u t h o r :L i uY a n g ,E m a i l :e t y y l y @163.c o m A B S T R A C T :C l e i d o c r a n i a l d y s p l a s i a (C C D )i s a r a r e a u t o s o m a l d o m i n a n t h e r e d i t a r y d i s e a s ew i t hm u l t i pl e s k e l e t a l d y s p l a s i a .I t s p a t h o g e n i c g e n e i sR U N X 2l o c a t e d a t c h r o m o s o m e 6p21.T h e c l i n i c a lm a n i f e s t a t i o n s o f C C Da r e d i v e r s e ,a n d t h em a n a g e m e n t o f i t s t r e a t m e n t r e q u i r e sm u l t i d i s c i p l i n a r y c o o p e r a t i o n .E a r l y d i a gn o s i s a n d t r e a t m e n t a r e e s s e n t i a l t o c o r r e c tm a l f o r m a t i o n s a n d i m p r o v e t h e l i f e q u a l i t y of p a t i e n t s .T h ec l i n i c a lm a n i f e s t a t i o n so fC C Di nt h en e o n a t a l p e r i o da r e i n c o m p l e t e ,a n d t h e a b n o r m a l c l a v i c l e i s e a s i l y m i s d i ag n o s e d a s f r a c t u r e .Thi s p a p e r s u mm a r i z e s t h e c l i n i c a l c h a r a c t e r i s t i c s o f an e w b o r n C C Dc a u s e db y n o v e lR U N X 2m u t a t i o n ,a n dr e po r t st h en e w m u t a t i o ns i t e ss oa st o i m p r o v e c l i n i c i a n s 'u n d e r s t a n d i n g o f t h e d i s e a s e a n d p r o v i d e a r e f e r e n c e f o r e x p l o r i n g t h em o l e c u l a r g e n e t i cm e c h a n i s m o fC C D p a t h o ge n e s i s .K E Y W O R D S :c l e i d o c r a n i a l d y s pl a s i a ;R U N X 2g e n e ;i n f a n t ;n e w b o r n 颅锁骨发育不全综合征(c l e i d o c r a n i a ld y s p l a s i a ,C C D )是一种常染色体显性遗传性骨骼发育不良综合征,主要发病机制为膜内成骨及软骨化骨障碍㊂该病遗传外显率高,临床表型多样,主要表现为颅骨异常㊁锁骨发育不全㊁多生牙齿和身材矮小[1]㊂新生儿发病率约为1ʒ1000000,无种族及性别差异[2]㊂其致病基因为R U N X 2,位于染色体6p21,是一种成骨细胞特异性转录因子编码基因[3]㊂该病在新生儿期临床表现不完全,其头部畸形易与佝偻病混淆,锁骨中断易被误诊为骨折,为早期诊断增加了难度㊂为进一步提高对该病的认识,现将天津市儿童医院收治的1例颅锁骨发育不全综合征的新生儿病例报道如下㊂1 病例资料患儿女,11d ,因 咳嗽3天 于2018年6月4日入院㊂系G 1P 1,顺产娩出,无妊娠期并发症㊂胎龄40周,出生体重3650g ,身长50c m ,头围34c m ,A p g a r 评分8-10-10分㊂家族史未报告具有相似表型或身材矮小等特征的其他家庭成员㊂体格检查:生命体征平稳㊂前囟6c mˑ6c m (图1),后囟4c mˑ4c m(图2),前后囟相连,颅缝2.5c m ,额㊁顶㊁枕骨均小于正常㊂鼻梁增宽㊂右侧锁骨略短,左侧锁骨连续性中断㊁无触痛及骨擦感㊂胸廓正常,双肺听诊呼吸音粗㊁可闻及痰鸣音㊂心脏㊁腹部无异常,新生儿神经反射正常㊂胸部X 线检查提示:右侧锁骨形态短小,左侧锁骨中断骨折?,双肺纹理增粗㊁紊乱(图3)㊂头颅C T 提示少量蛛网膜下腔出血,前后囟增宽(图4)㊂脑干听觉诱发电位检查未见异常㊂甲状腺功能㊁血清维生素D ㊁血清钙㊁血清磷㊁血清碱性磷酸酶和血清甲状旁腺激素水平均在正常范围内㊂入院后积极治疗肺部感染,因不能完全除外左侧锁骨骨折,故给予左上肢绷带固定㊂14天后复查㊃26㊃‘临床荟萃“ 2021年1月20日第36卷第1期 C l i n i c a l F o c u s ,J a n u a r y 20,2021,V o l 36,N o .1Copyright ©博看网. All Rights Reserved.胸片提示肺炎较前吸收好转,仍提示右侧锁骨短小,左侧锁骨中断处无骨痂形成,断端处较钝,端端距离较远(图5)㊂结合该患儿具有颅骨发育不良㊁鼻梁增宽等外观特征,不除外新生儿颅锁骨发育不全综合征㊂在获得患儿家属知情同意及我院伦理委员会批准后,采取患儿及其父母外周血各2m l (枸橼酸钾抗凝),提取基因组D N A ,采用靶向基因捕获二代测序法对骨骼发育异常相关基因进行检测,并对患儿及其父母基因进行一代测序验证㊂结果显示:该患儿R U N X 2基因第4外显子存在错义突变c .539C>A(p.A l a 180G l u ),其父母c .539位点正常(图6)㊂经查询H GM D ㊁C l i n v a r 及d b S N P 数据库,未见相关报道,其突变位点为新突变㊂先证者父亲㊁母亲的测序结果显示该位点未见异常,推测该突变可能为自发性突变㊂本例患儿出院后随访至今,目前15个月龄,前囟及后囟均未闭合,尚无乳牙萌出,精神运动发育适龄,已开始进行骨科及口腔科的随访,定期进行骨骼的影像学评估㊂㊃36㊃‘临床荟萃“ 2021年1月20日第36卷第1期 C l i n i c a l F o c u s ,J a n u a r y 20,2021,V o l 36,N o .1Copyright ©博看网. All Rights Reserved.图6 受检者R U N X 2基因c .539C >A (p .A l a 180G l u )变异S a n ge r 测序家系验证结果,从左到右依次为患儿㊁父亲㊁母亲2 讨 论C CD 是一种常染色体显性遗传性疾病,M u n d l o s 等[4]于1997年确定R U N X 2基因突变为C C D 的分子病因㊂R U N X 2基因位于染色体6p 21,包含一个223k b 的区域,由8个外显子组成,是控制脊椎动物骨骼发育和形态形成的主要调控基因[5]㊂R U N X 2对于膜内和软骨内骨化过程至关重要,是软骨细胞成熟㊁成骨细胞分化和骨形成的重要转录因子㊂与此同时,它作为参与骨骼形成的转录因子,也上调包括胶原蛋白,骨钙素,骨唾液酸蛋白和骨桥蛋白在内的骨基质基因的表达㊂R U N X 2基因的突变与人类的C C D 相关,是目前唯一已知的C C D 致病基因㊂截至目前,已有约200个R U N X 2基因突变位点被报道,包括错义㊁无义㊁缺失㊁插入及剪切突变等多种突变类型㊂经典C C D 患者的R U N X 2突变大多数发生在r u n t 区域,最常见是阻止R U N X 2与D N A 结合的错义突变,或导致截断蛋白的无义突变㊂错义突变只在r u n t 区域内被发现,而无义突变及移码突变可发生在整个基因中[5]㊂通过对本例患儿的基因检测发现,R U N X 2基因第4外显子存在错义突变c .539C >A ,经查询H GM D ㊁C l i n v a r 及d b S N P 数据库均未见相关报道,此为R U N X 2基因的新突变位点,丰富了C C D 疾病的基因突变谱㊂除点突变外,R U N X 2基因内的微缺失亦与C C D 相关,通过对一个家族的基因鉴定发现,该基因内缺失覆盖了外显子2和6之间的区域,所有受检者均表现出身材矮小和小手[6]㊂最近,在C C D 患者中还发现了R U N X 2下游的大量重复,提示R U N X 2的调控序列可能在这种情况下被破坏[7]㊂已有的报道显示,在临床诊断为C C D 的所有患者中,60~70%被检测到R U N X 2基因的突变,其中1/3表现出自发性变异,2/3表现出家族性变异[8-9]㊂对于C C D 表型患者未能通过标准D N A 测序鉴定出突变的情况,应考虑通过定量聚合酶链反应和多种链接依赖性探针扩增方法筛查R U N X 2的基因内缺失和重复[10]㊂C C D 的发病机制可能与截断的R U N X 2蛋白无法与转化生长因子B 的信号转导子相互作用并在成纤维细胞中诱导成骨细胞样表型有关[11]㊂由于膜和软骨内骨的形成都可能受到影响,C C D 不仅表现为锁骨和颅骨的异常,还包括广泛的骨骼发育不良㊂文献报道的C C D 典型症状包括:双侧或单侧的锁骨发育不全或缺失㊁假关节形成㊁肩关节下垂㊁肩关节过度活动;前囟不闭合或闭合延迟㊁颅缝增宽㊁颅扩张㊁颌骨及颧骨发育不全㊁鼻梁塌陷增宽;乳牙滞留㊁恒牙萌出延迟㊁牙根畸形和多余牙齿囊肿等㊂全身表现包括:鸡胸或锥形胸廓㊁肩胛骨变小㊁耻骨联合间隙扩大㊁身材矮小以及许多其他骨骼畸形(如扁平足,膝外翻和脊柱侧凸等)㊂由于面部骨骼发育异常,患儿可因高度弓形腭㊁鼻窦减少㊁乳突细胞减少等因素而罹患反复发作的中耳炎及听力障碍[12-15]㊂本病虽畸形复杂,但大多智力正常,偶有神经系统受累出现癫痫发作的病例报告[16]㊂由于该病临床表现多样化,对于轻症尤其是仅存在牙齿萌出异常而并无典型颅骨㊁锁骨发育异常的患者诊断比较困难㊂临床上本病多因锁骨异常或牙齿畸形就诊,可在任何年龄发病,以出生后2年内为著㊂本例患儿就诊时尚处于新生儿期,临床表现不完全,其锁骨表现与新生儿锁骨骨折难以区分,给最初的诊断造成了困难㊂回顾本例患儿的诊疗过程,该患儿生产过程顺利㊁无产伤史,入院查体双上肢自主活动对称,左侧锁骨走行处无红肿㊁触痛及骨擦感,同时存在前后囟增大㊁颅缝增宽及鼻梁塌平等外观特征㊂经过14天绷带固定治疗,左侧锁骨仍无骨痂形成,且同时伴有右侧锁骨短小,为我们建立C C D 的诊断提供了线索㊂该患儿的R U N X 2基因突变为我们的诊断提供了分子生物学依据㊂在临床工作中,根据患者的外观特征㊁牙齿咬合关系㊁X 线检查结果以及全身情况,可临床诊断C C D ㊂其鉴别诊断主要包括:下颌骨发育不良㊁牙齿畸形㊁先天性锁骨假关节㊁Y u n i s -V a r o n 综合征㊁低磷血症㊁先天性甲状腺功能减退等[17]㊂C C D 在新生儿期临床表现不完全,对于具有前囟增大㊁鼻梁增宽㊁锁骨发育不良等特征的新生儿,应考虑C C D 的可能性,及时进行基因检测有助于早期确诊㊂C CD 的临床管理是多学科的,儿科医师㊁遗传学医师㊁放射科医师㊁骨科医师㊁心理科医师和社会工㊃46㊃‘临床荟萃“ 2021年1月20日第36卷第1期 C l i n i c a l F o c u s ,J a n u a r y 20,2021,V o l 36,N o .1Copyright ©博看网. All Rights Reserved.作者均需参与其中[18]㊂针对面部及牙齿畸形,治疗时机非常重要,手术结合正畸牵引是C C D的有效治疗方法,需要多学科团队合作以达到更好的治疗效果[19]㊂治疗计划在很大程度上取决于患者的需求㊁年龄㊁经济状况㊁永久性牙列的萌发状态㊁牙周和牙髓的健康状况㊂在幼年时除去乳牙和多余牙齿以及覆盖患牙的骨骼可以促进恒牙的自然萌发㊂对于有神经系统受累㊁存在血管神经卡压症状的患儿需给予矫形减压㊂由于患儿在成年期易发生肩关节脱位和骨关节炎,故定期的骨科监测和评估尤为重要㊂由于存在颅骨穹窿骨化不良,患儿需格外注意避免头部创伤㊂应重视对C C D患儿进行耳鼻喉科评估,对于反复耳部感染的患者应给予积极抗感染和通气管插入,具有阻塞性睡眠呼吸暂停的患儿可酌情行腺样体扁桃体切除术以缓解症状㊂有研究表明,对于存在严重的身材矮小的C C D患儿给予生长激素治疗安全且有效[1,20]㊂由于牙齿及颌面发育异常, C C D患儿可发生语言㊁咀嚼㊁吞咽及呼吸功能障碍,过早衰老的外观会对患儿的心理产生重大影响㊂因此,对C C D患儿进行科学的语言培训㊁精神及心理治疗尤为重要,需要心理科医师及社会工作者的共同参与,以进一步提高患儿的生活质量㊂C C D防治的重点在于提早诊断和在疾病早期多学科的共同干预㊂产前超声检查可发现胎儿锁骨短小或缺如㊁短头畸形㊁骨化不成熟㊁前囟突出等特征,可为该病的早期诊断提供重要线索[21]㊂当怀疑有C C D时,临床医师应进行全面的放射学评估,以便及时进行多学科综合治疗管理㊂当无典型临床表现或放射学特征不明显时,应积极寻找家族史㊁及早对R U N X2突变进行遗传学分析㊂由于C C D具有常染色体显性遗传,直系亲属对R U N X2基因突变有50%的遗传几率,建议积极进行相关的遗传预测研究以实现优生优育㊂参考文献:[1]Ça m t o s u n E,A kın cıA,D e m i r a l E,e t a l.A c a s e o fc l e id o c r a n i a ld y s p l a s i a w i t h a n o ve l m u t a t i o n a n d g r o w t hv e l o c i t yg a i n w i t h g r o w t hh o r m o n et r e a t m e n t[J].JC l i n R e sP e d i a t rE n d o c r i n o l,2019,11(3):301-305.[2] R a m o s M e jía R,R o d ríg u e z C e l i n M,F a n o V.C l i n i c a l,r a d i o l o g i c a l,a n da u x o l o g i c a lc h a r a c t e r i s t i c so f p a t i e n t s w i t hc l e id o c r a n i a l d y s p l a s i a f o l l o we d i na p e d i a t r i cr ef e r r a lh o s p i t a li nA r g e n t i n a[J].A r c h A r g e n tP e d i a t r,2018,116(4):e560-e566.[3]J u n g Y J,B a eH S,R y o oHM,e t a l.An o v e l R U N X2m u t a t i o ni ne x o n8,G462X,i n a p a t i e n tw i t h c l e i d o c r a n i a l d y s p l a s i a[J].JC e l l B i o c h e m,2018,119(1):1152-1162.[4] M u n d l o s S,O t t oF,M u n d l o s C,e t a l.M u t a t i o n s I n v o l v i n g t h et r a n s c r i p t i o nf a c t o rC B F A1c a u s ec l e i d o c r a n i a ld y s p l a s i a[J].C e l l,1997,89(5):773-779.[5]J a r u g aA,H o r d y j e w s k aE,K a n d z i e r s k iG,e t a l.C l e i d o c r a n i a ld y s p l a s i aa n d R U N X2-c l i n i c a l p he n o t y p e-g e n o t y p ec o r r e l a t i o n[J].C l i nG e n e t,2016,90(5):393-402.[6] L e eMT,T s a iA C,C h o uC H,e t a l.I n t r a g e n i cm i c r o d e l e t i o no fR U N X2i s a n o v e lm e c h a n i s mf o r c l e i d o c r a n i a l d y s p l a s i a[J].G e n o m i cM e d,2008,2(1-2):45-49.[7] H a n s e nL,R i i sA K,S i l a h t a r o g l u A,e t a l.R U N X2a n a l y s i so fD a n i s h c l e i d o c r a n i a l d y s p l a s i a f a m i l i e s[J].C l i n G e n e t, 2011,79(3):254-263.[8] B a l i o㊅g l u M B,K a r gın D,A l b a y r a k A.T h e t r e a t m e n t o fc l e id o c r a n i a l d y s o s t o s i s(s c he u t h a u e r-m a r i e-s a i n t o ns y n d r o m e),a r a r e f o r mo f s k e l e t a l d y s p l a s i a,a c c o m p a n i e db y s p i n a l d e f o r m i t i e s:A r e v i e w o ft h el i t e r a t u r ea n dt w oc a s e r e p o r t s[J].C a s eR e p O r t h o p,2018,2018:4635761. [9] M o t a e i J,S a l m a n i n e j a dA,J a m a l i E,e t a l.M o l e c u l a r g e n e t i c so f c l e i d o c r a n i a l d y s p l a s i a[J].F e t a l P e d i a t rP a t h o l,2020:1-13.O n l i n e a h e a do f p r i n t.[10] F a r r o wE,N i c o tR,W i s sA,e t a l.C l e i d o c r a n i a l d y s p l a s i a:ar e v i e w o fc l i n i c a l,r a d i o l o g i c a l,g e n e t i ci m p l i c a t i o n s a n d ag u i d e l i n e s p r o p o s a l[J].JC r a n i o f a cS u r g,2018,29(2):382-389.[11] P u v a b a n d i t s i nS,F e b r u a r y M,M a y n eJ,e ta l.C l e i d o c r a n i a ld y s p l a s i aw i t h6p21.1-p12.3m i c r o de l e t i o n:Ac a s e r e p o r t a n dl i t e r a t u r e r e v i e w[J].C l e f tP a l a t eC r a n i o f a cJ,2018,55(6): 891-894.[12] D i nçs o y B i r F,D i nçk a n N,Güv e n Y,e ta l.C l e i d o c r a n i a ld y s p l a s i a:C l i n i c a l,e n d o c r i n o l o g i c a n dm o l e c u l a rf i n d i ng s i n15p a t i e n t s f r o m11f a m i l i e s[J].E u r JM e dG e n e t,2017,60(3): 163-168.[13] M a t t h e w s-B r z o z o w s k aT,H o j a n-J e z i e r s k aD,L o b a W,e t a l.C l e i d o c r a n i a l d y s p l a s i a-d e n t a l d i s o r d e r t r e a t m e n t a n d a u d i o l o g yd i a g n o s i s[J].O pe n M e d(W a r s),2018,13:1-8.[14] C a l l e a M,B e l l a c c h i o E,D i S t a z i o M,e t a l.A c a s e o fc l e id o c r a n i a l d y s p l a s i a w i t h pe c u l i a r d e n t a lf e a t u r e s:p a t h o g e n e t i cr o l e o ft h e R U N X2m u t a t i o n a n d l o n g t e r mf o l l o w-u p[J].O r a lH e a l t hD e n tM a n a g,2014,13(2):548-551.[15] C o o p e r S C,F l a i t zC M,J o h n s t o nD A,e t a l.An a t u r a l h i s t o r yo f c l e i d o c r a n i a l d y s p l a s i a[J].A mJM e dG e n e t,2001,104(1): 1-6.[16] M aY,Z h a oF,Y uD.C l e i d o c r a n i a l d y s p l a s i as y n d r o m ew i t he p i l e p s y:a c a s e r e p o r t[J].B M CP e d i a t r,2019,19(1):97.[17] M e d i n aO,M uño z N,M o n e r i zC.C l e i d o c r a n i a ld y s p l a s i a:ac a s e r e p o r t[J].R e vC h i l P ed i a t r,2017,88(4):517-523.[18]J i r a p i n y o C,D e r a j e V,H u a n g G,e t a l.C l e i d o c r a n i a ld y s p l a s i a:M a n a ge m e n t of t h e m u l t i p l e c r a n i o f a c i a l a n ds k e l e t a l a n o m a l i e s[J].JC r a n i o f a cS u r g,2020,31(4):908-911.[19] Z h u Y,Z o u Y,Y u Q,e ta l.C o m b i n e ds u r g i c a l-o r t h o d o n t i ct r e a t m e n t o f p a t i e n t sw i t hc l e i d o c r a n i a l d y s p l a s i a:c a s e r e p o r ta n d r e v i e wo f t h e l i t e r a t u r e[J].O r p h a n e t JR a r eD i s,2018,13(1):217.[20] T a k a k iN,M o r iJ,M a t s u oS,e ta l.C l e i d o c r a n i a ld y s p l a s i aw i t h g r o w t h h o r m o n e d e f i c i e n c y:a c a s e r e p o r t[J].B M CP e d i a t r,2020,20(1):19.[21] M a h a j a n P S,M a h a j a n A P,M a h a j a n P S.A r a r e c a s e o fc l e id o c r a n i a l d y s p l a s i a p re s e n t i n g w i t hf a i l u r et ot h r i v e[J].JN a t S c i B i o lM e d,2015,6(1):232-235.收稿日期:2020-04-29编辑:张卫国㊃56㊃‘临床荟萃“2021年1月20日第36卷第1期 C l i n i c a l F o c u s,J a n u a r y20,2021,V o l36,N o.1Copyright©博看网. All Rights Reserved.。
Runx2基因与骨相关疾病的研究

Runx2基因与骨相关疾病的研究Runx2是骨发育过程中调节骨髓间充质干细胞向成骨细胞分化和成熟最关键的转录因子,它通过多条途径参与骨代谢的调控,可影响成骨细胞及破骨细胞活动从而控制骨形成与骨吸收,并与很多骨相关疾病的形成有很大关系,Runx2基因多态性的研究为疾病的早发现及治疗提供新的思路及治疗靶点。
标签:Runx2;锁骨颅骨发育不良综合征;骨质疏松症;骨肉瘤;脊柱后纵韧带骨化Runxx相关因子(runt-related gene,Runxx)是一类转录因子蛋白的统称,它们都是由a和β亚单位构成的异二聚体,其特点是在分子结构中均含有一个由128个氨基酸组成的DNA结合区,该结合区与果蝇属的分节基因Runt同源,因此被称为Runt结构域。
Runxx家族主要有Runxl、Runx2和Runx3,Runx2又称为核心结核因子α1(core binding factor α1,Cbfa1),多瘤病毒增强子结合蛋(polymavimsenchancerbinding protein,PEBP)或急性髓系白血病因子(acute myeloidleukemia,AML)。
Runx2基因位于人类常染色体的6p21,长约220kb,包括8个外显子,并具有和其它家族成员相似的Runt结构域,是骨发育过程中调节骨髓间充质干细胞向成骨细胞分化和成熟最关键的转录因子[1],Runx2的表达是成骨细胞开始分化的标志,因此它是骨形成过程中最早和最具特异性的标志基因,此基因的缺失将导致骨发育不良或终止[2]。
Runx2包括N端的多谷氨酰胺/丙氨酸重复序列结构域(Q/A)、中部的runt结构域以及C端的富含脯氨酸、丝氨酸及苏氨酸的PST结构域。
Runx2能特异地识别并结合许多靶基因上PyGPyGGTPy序列,产生不同的生物效应[3]。
Runx2基因的变化与很多疾病相关,特别是骨相关疾病,对其研究有利于疾病的早期发现提供新思路及早期治疗提供新靶点。
Runx2基因与骨相关疾病的研究

Runx2基因与骨相关疾病的研究作者:张云芳王玉明段勇来源:《医学信息》2014年第21期摘要:Runx2是骨发育过程中调节骨髓间充质干细胞向成骨细胞分化和成熟最关键的转录因子,它通过多条途径参与骨代谢的调控,可影响成骨细胞及破骨细胞活动从而控制骨形成与骨吸收,并与很多骨相关疾病的形成有很大关系,Runx2基因多态性的研究为疾病的早发现及治疗提供新的思路及治疗靶点。
关键词:Runx2;锁骨颅骨发育不良综合征;骨质疏松症;骨肉瘤;脊柱后纵韧带骨化Runxx相关因子(runt-related gene,Runxx)是一类转录因子蛋白的统称,它们都是由a 和β亚单位构成的异二聚体,其特点是在分子结构中均含有一个由128个氨基酸组成的DNA 结合区,该结合区与果蝇属的分节基因Runt同源,因此被称为Runt结构域。
Runxx家族主要有Runxl、Runx2和Runx3,Runx2又称为核心结核因子α1(core binding factor α1,Cbfa1),多瘤病毒增强子结合蛋(polymavimsenchancerbinding protein,PEBP)或急性髓系白血病因子(acute myeloidleukemia,AML)。
Runx2基因位于人类常染色体的6p21,长约220kb,包括8个外显子,并具有和其它家族成员相似的Runt结构域,是骨发育过程中调节骨髓间充质干细胞向成骨细胞分化和成熟最关键的转录因子[1],Runx2的表达是成骨细胞开始分化的标志,因此它是骨形成过程中最早和最具特异性的标志基因,此基因的缺失将导致骨发育不良或终止[2]。
Runx2包括N端的多谷氨酰胺/丙氨酸重复序列结构域(Q/A)、中部的runt结构域以及C端的富含脯氨酸、丝氨酸及苏氨酸的PST结构域。
Runx2能特异地识别并结合许多靶基因上PyGPyGGTPy序列,产生不同的生物效应[3]。
Runx2基因的变化与很多疾病相关,特别是骨相关疾病,对其研究有利于疾病的早期发现提供新思路及早期治疗提供新靶点。
先天性颅骨锁骨发育不全综合征的研究进展

先天性颅骨锁骨发育不全综合征的研究进展作者:徐山山姚金丹来源:《现代养生·下半月版》 2015年第8期徐山山姚金丹吉林大学口腔医院吉林省长春市 130012【摘要】先天性颅骨锁骨发育不全综合征是一种罕见的常染色体显性遗传病,以锁骨发育不全、囟门闭合延迟、乳牙滞留、恒牙迟萌、多生牙为典型症状。
本文从CCD 的病因、临床表现、牙齿的组织学表现、诊断、分型、治疗方面的研究进行总结。
【关键词】先天性颅骨锁骨发育不全综合征;Cbfal;多生牙先天性颅骨锁骨发育不全综合征(Cleido-cranial dysplasia,CCD)也称为Marie-Sainton 综合征,是一种罕见的常染色体显性遗传病,发病率约为1:1000000,多数患者有家族史,但无明显性别差异,也有散发病例。
该疾病发生在任何年龄,疾病累及范围较广。
1766 年Morand 首次进行报道,1871 年Scheuthauer 提及双侧锁骨和颅骨受累,1897 年Marie 与Sainton 将其命名为颅骨锁骨发育不全综合征。
其最显著临床特征(CCD三联征)为:囟门闭合迟缓或不闭合;锁骨发育不全;数量较多的乳牙滞留和埋伏恒牙、多生牙。
据此3 点基本可早期确诊为CCD[1]。
1 病因1977 年报道家族性CCD 患者的核心结合因子a1(core binding factora-1,Cbfal)基因突变,并证实是CCD 致病原因,将其定位于染色体6p21 区域。
Cbfa1是转录因子runt(Runt-re lated transcriptionfactor)家族的成员,由RUNX2 编码。
RUNX2 全长130kb,由7 个编码氨基酸的外显子组成,编码蛋白主要包含三个重要的结构域:N- 末端一个谷氨酰胺和丙氨酸重复的Q/A 结构域;中间一个保守的runt结构域;C- 末端一个富含脯氨酸、丝氨酸和苏氨酸的PST 活性结构域。
其中runt结构域介导runt 家族的转录因子与Pebp2/Cbfb 结合形成异二聚体以获得更强的与DNA 结合的能力,并具有与其靶基因启动子区的成骨细胞特异性顺式作用元件相结合的能力,是蛋白质发挥功能非常重要的区域[2]。
颅骨锁骨发育不全:附1例病例报告及文献复习

颅骨锁骨发育不全:附1例病例报告及文献复习臧运华1 陈杰2(1安丘市妇幼保健院口腔科 262100; 2青岛大学医学院附属医院口腔正畸科266011)【中图分类号】R681【文献标识码】A【文章编号】1672-5085(2012)12-0271-03先天性锁颅骨发育不全(CCD)是极罕见的以骨化不良为特征的畸形,又称遗传性颅骨锁骨发育不全,骨盆、颅锁骨发育不全,Hulkerantt 骨形成不全,颅锁指骨发育不全,全身性骨发育障碍及骨—牙形成障碍。
除发生在锁骨和颅骨以外,还伴有其它骨发育不全。
颅骨锁骨发育不全属染色体显性遗传性疾病。
Morand于1766年首次报道,1897年Marie与Santon报道4例始命名为锁颅骨发育不全症。
之后,随着对此病的进一步认识, 1952年Jackson [1] 将其命名为骨—牙结构不良,1969年欧洲小儿放射学会又把本病命名为颅—锁骨形成障碍。
1991年国内曹来宾[2]等报道本病51例,并根据分析出的特征性X线表现, 认为本病称为骨—牙形成障碍似更确切。
笔者报道1例此病患者,结合文献资料,对该病的病因、临床表现、影像学特点以及该病的诊断及治疗加以复习。
资料和方法钟X,女,13岁,因“地包天”要求治疗。
查体:身高140cm,智力正常,额部凸出,鼻梁塌陷,眼距较宽,面中部发育不足。
合像及面像如图1。
实验室检查:血、尿、粪常规正常,粘多糖定性试验( - ) ,血钙、血磷、碱性磷酸酶正常,血红蛋白分析未见异常。
病史:乳牙即为反合,卤门闭合较晚。
其母为反合畸形。
X线检查:胸部平片显示锁骨外1/3钙化不良,脊柱侧曲(图2),曲面断层片及螺旋CT显示下颌双尖牙区有多数牙阻生(图3,4)染色体检查:未见明显异常。
诊断:症状不典型的颅骨锁骨发育不全矫治过程与初步矫治计划:1前方前引器矫治上颌发育不足,解除前牙反合。
经过3-6个月牵引,反合已解除(图5)。
2 拔除滞留乳牙,正颌外科手术去除阻生恒牙表面骨阻力,牵引发育正常的牙齿至正确的位置。
构建靶向Runx2基因成骨样细胞MC3T3-E1慢病毒载体

构建靶向Runx2基因成骨样细胞MC3T3-E1慢病毒载体秦晗;龚永庆;徐宏志【摘要】背景:研究表明成骨细胞特异性转录因子(Runx2)的杂合突变、基因插入、缺失等是造成颅骨锁骨发育不全的重要原因.目前关于Runx2基因沉默后成骨细胞功能会发生怎样的变化,及如何沉默成骨细胞Runx2基因表达的相关研究未见报道.目的:构建靶向Runx2基因的小鼠成骨样细胞MC3T3-E1慢病毒载体,为颅骨锁骨发育不全的研究提供实验依据.方法:根据预实验结果在含5 mg/L Polybrene的ENi.S培养液中,病毒按MOI=40进行感染,按病毒序号分为4组:NC组:pFU-GW-016PSC53349-1;KD1组:LVpFU-GW-016PSC60107-1;KD2组:LVpFU-GW-016PSC60108-1;KD3组:LVpFU-GW-016PSC60109-1.转染后16 h换液,72 h 后,Celigo全视野细胞扫描分析仪观察检测基因的表达情况;两步法进行Real-Time PCR检测Runx2基因的沉默效果.结果与结论:①病毒转染后72 h,NC组未见荧光表达;KD1组可见少量荧光表达;KD2组荧光表达增强;KD3组可见强绿色荧光;②Real-Time PCR结果提示KD3组获得较好Runx2基因沉默效果;③实验成功构建靶向Runx2基因的MC3T3-E1细胞慢病毒载体,筛选出特异性抑制成骨细胞Runx2基因的病毒,并初步确定其作用的时间、相应的计量.【期刊名称】《中国组织工程研究》【年(卷),期】2018(022)028【总页数】5页(P4429-4433)【关键词】组织构建;Runx2基因;MC3T3-E1细胞;慢病毒;转染【作者】秦晗;龚永庆;徐宏志【作者单位】徐州医科大学附属连云港医院口腔科,江苏省连云港市 222002;徐州医科大学附属连云港医院口腔科,江苏省连云港市 222002;徐州医科大学附属连云港医院口腔科,江苏省连云港市 222002【正文语种】中文【中图分类】R318文章快速阅读:文题释义:颅骨锁骨发育不全(cleidocranial dysplasia,CCD):是一种广泛累及包括锁骨、颅骨在内的整个骨骼系统的常染色体显性遗传性疾病(MM119600),出生发病率约为1∶100 000;研究表明RUNX2基因杂合突变、基因插入、缺失等是造成颅骨锁骨发育不全的重要原因。
新生儿颅骨锁骨发育不全一例的RUNX2基因突变检测并文献复习

博硕论坛·论著新生儿颅骨锁骨发育不全一例的RUNX2基因突变检测并文献复习李蕊,康文清,金娟,郭静作者单位:450018河南,郑州大学附属儿童医院、河南省儿童医院、郑州儿童医院NICU作者简介:李蕊(1987-),女,医学硕士,住院医师,研究方向:新生儿重症诊疗。
E-mail:517252695@qq.com通讯作者:康文清(1967-),女,医学硕士,主任医师,硕士研究生导师,研究方向:新生儿重症诊疗。
E-mail:kwq_0608@163.com[摘要]目的报告颅骨锁骨发育不全(CCD)患儿1例的RUNX2基因突变检测情况。
方法患儿临床查体后进行临床及影像学检查,明确诊断为CCD。
提取患者全血基因组DNA送第三方检测机构(金域医学检验中心),通过高通量基因测序检测患儿RUNX2基因型。
结果患者RUNX2基因型为c.201dupG p.(Gln68fs)。
结论成功发现了RUNX2基因的致病突变,补充了国内外CCD致病基因的突变位点数据库。
[关键词]颅骨锁骨发育不全;RUNX2;突变[中图分类号]R726[文献标识码]A[文章编号]1674-3806(2019)03-0302-03doi:10.3969/j.issn.1674-3806.2019.03.16Neonatal cleidocranial dysplasia and mutation ofRUNX2gene in1case and literature review LIRui,KANGWen-qing,JIN Juan,et al.Neonatal Intensive Care Unit,Children's Hospital Affiliated to Zhengzhou University,Henan Children's Hospital,Zhengzhou Children's Hospital,Henan450018,China[Abstract]Objective To study the mutation ofRUNX2gene in a neonate with cleidocranial dysplasia (CCD).Methods The clinical and imaging examinations of the neonate with CCD were performed after physical ex-amination,and the diagnosis was confirmed as clavicular dysplasia of the skull.The genomic DNA of the whole bloodwas extracted and sent to the third party(KingMed Diagnostics)for detection,and the genotype ofRUNX2was detec-ted by high-throughput genome sequencing.Results The mutant type ofRUNX2gene in the patient was c.201dupGP.(Gln68fs).Conclusion A pathogenic mutation ofRUNX2is found successfully,which supplements the gene mu-tation database of CCD.[Key words]Cleidocranial dysplasia(CCD);Runt-related transcription factor2(RUNX2);Mutation颅骨锁骨发育不全(cleidocranial dysplasia,CCD)为罕见的先天性常染色体遗传性骨骼发育畸形病,出生发病率约为1ʒ1000000[1]。
【G007】颅锁发育不良综合征(CCD)

【G007】颅锁发育不良综合征(CCD)概述是一种累及骨骼和牙齿的常染色体显性遗传性疾病,具有明显的家族聚集性,男女发病率无明显差别,临床发病率约为1∶1 000 000。
临床CCD常见的临床症状有:囟门闭合延迟,颅骨缝增宽,锁骨钙化不良、缺失,锥形胸,耻骨联合增宽而致骨盆发育不良,身材矮小等;口腔表现常见上颌骨发育不足,有多生牙,乳牙滞留,恒牙萌出延迟等。
病因病理CCD致病基因是成骨细胞特异性转录因子Runx2基因,该基因定位于染色体6p21,该基因的错意表达、基因插入、缺失或者移码突变等都是造成CCD综合征的重要原因。
CCD呈常染色体显性遗传,有很高的外显率和不同的表现型,轻症仅有牙齿异常,严重者表现为全身骨质受累。
影像表现X线表现1颅骨:额窦未发育,副鼻窦气化不良。
主要表现为膜内化骨发育不全、发育迟缓和软骨化骨(颅底) 的骨发育停滞,额骨圆凸呈方头,头颅不成比例增大。
颅骨骨板变薄,颅骨横径增大,底部相对狭窄,囟门大而不闭,颅缝增宽分离,可见缝间骨。
乳突气化发育不良或不发育,垂体凹可发育浅小;(图片来源网络)2锁骨:锁骨发育不全是该病的主要X 线表现,双侧锁骨中外1/ 3多缺如。
胸廓狭窄呈钟状胸,锁骨中段形成假关节,因锁骨发育短小或缺如。
3肩胛骨及胸廓:肩胛骨较小且上移或下移、胸廓呈上窄下宽的锥形及肋骨倾斜下垂见于大多数病例。
4骨盆:耻骨联合增宽或缺如,坐骨发育不良,髂骨翼狭窄细长,髋臼变浅、股骨头颈发育不良,可见髋内翻及髋关节脱位。
5四肢:四肢长骨骨干可变细,干骺端稍变窄,双下肢可不等长,指、趾骨可有锥形骨骺并增长或变短。
此外,有时尚见脊柱侧弯、椎体棘突裂等脊柱受累征象,本病系全身性骨发育障碍,膜内化骨和软骨化骨的骨骼均可受累及。
颅骨锁骨发育不良综合征患者的RUNX2基因突变检测分析

颅骨锁骨发育不良综合征患者的RUNX2基因突变检测分析轩东英;庄最新;谢宝仪;章锦才【期刊名称】《实用口腔医学杂志》【年(卷),期】2009(25)4【摘要】Objective: To analyze mutations of RUNX2 gene in a Chinese family with CCD. Methods: The proband and her parents were investigated in the present study. Radiological examination regarding osseous malformations was carried out over the entire body. Genomic DNA was extracted from whole blood, and the RUNX2 gene was amplified by PCR from genomic DNA. 100 healthy people were also included. DNA sequences were analyzed by using BLASTN (BLAST nucleotide) program. Results: Both the proband and her mother have typical CCD clinical characteristics, different from her healthy father. After BLASTN analysis, one novel mutation was identified in the proband and her mother, a heterozygous A to G transition mutation at nucleotide 478 in exon 2, which converted asparagines to aspartic acid at codon 160 (478 A>G,N160D). Conclusion: The N160D mutation is identified as a novel heterozygous mutation, which supplements the data of RUNX2 gene mutation research.%目的:检测鉴定我国一个颅骨锁骨发育不良综合征(CCD)家系RUNX2基因突变情况.方法:采用先证者查证法,对家系各成员进行全身健康状况及口腔专科检查,进行CCD诊断;抽取先证者及其父母外周静脉血,提取基因组DNA, PCR扩增RUNX2基因并测序,BLAST同源分析,同时检测100名健康人的相同位点,排除多态位点的可能.结果:先证者具有典型的CCD临床特征,其母亲亦为CCD患者,父亲则无相应临床表现;将先证者的RUNX2基因测序结果进行Blastn比较分析,在Exon 2上发现了一个A→G突变;实际测序图谱显示双峰结构(G、A),对其CCD母亲的基因检测表明,此突变来自母系染色体该基因478位点的基因突变;密码子AAC→GAC可能部分引起第160位氨基酸的改变,天冬酰胺(Asn,N)变成天冬氨酸(Asp,D);该突变型为478 A>G,N160D.家系健康成员同一位点显示G的单峰,即与野生型序列相同.结论:检测到的478 A>G,N160D为新的基因突变位点,拓展了国内CCD基因层次的研究领域,为国内外CCD致病基因的突变位点数据库增添了新的资料.【总页数】4页(P544-547)【作者】轩东英;庄最新;谢宝仪;章锦才【作者单位】广东省口腔医院·南方医科大学附属口腔医院,510280;广东省口腔医院·南方医科大学附属口腔医院,510280;广东省口腔医院·南方医科大学附属口腔医院,510280;广东省口腔医院·南方医科大学附属口腔医院,510280【正文语种】中文【中图分类】Q786【相关文献】1.锁骨颅骨发育不全1个家系2例患者RUNX2基因突变检测报告及文献复习 [J], 刘康香;张增;钟燕;黄秋双;章振林2.颅骨锁骨发育不良综合征患者RUNX2基因突变检测 [J], 梁国健;谢宝仪;轩东英3.颅骨锁骨发育不良综合征患者的临床检查及诊断 [J], 轩东英;章锦才;陈昭文;万贤凤;邝喆;张治勇;徐平平;胡飞4.锁骨颅骨发育不良综合征患者颅面部特征回顾性分析 [J], 陈红;秦猛;季海宁;郑元华;丁寅5.新生儿颅骨锁骨发育不全一例的RUNX2基因突变检测并文献复习 [J], 李蕊;康文清;金娟;郭静因版权原因,仅展示原文概要,查看原文内容请购买。
先天性颅锁骨发育疾病研究报告

先天性颅锁骨发育疾病研究报告疾病别名:骨-牙发育不全,MARIE - SAINTON 综合征所属部位:头部就诊科室:骨科病症体征:发育性骨盆异常,颅骨连续性中断,短头畸形疾病介绍:先天性颅锁骨发育不全是怎么回事?先天性颅锁骨发育不全是一种先天性全身性膜性骨骨化不全,以颅顶骨与锁骨发育障碍为主要特征,可多骨或单骨受累症状体征:先天性颅锁骨发育不全有什么症状呢?专家指出,该病的病变累及面较广,除主要累及锁骨、颅骨以外,尚可存在骨盆骨化不完全,脊柱畸形变扁、附件缺如或隐性脊柱裂等,牙齿以及腕骨、骨钙化缓慢等情况。
症状表现主要为头大面小,肩下沉、狭胸,前客、头顶及下颌相对较大,锁骨可部分或完全缺如,通常为对称性。
有时合并有肌肉异常,如三角肌的前部和斜方肌的锁骨部缺如。
化验检查:先天性颅锁骨发育不全的检查是怎样进行的呢?专家指出,本病主要是进行X线检查,有学者按有无遗传学关系及症状的轻重不同分为三类:(1)第一类为标准型::有家族遗传关系,颅骨、锁骨、骨盆等均受累。
其X线表现典型。
如单侧或双侧锁骨部分或全部缺如,颅骨骨化不全,前囟门大,颅骨缝未闭,有时胸骨柄缺如,广泛脊柱裂等。
(2)第二类为家族遗传型:有家族遗传关系,但颅骨不受累。
(3)第三类为散发型:无家族遗传关系。
鉴别诊断:先天性颅锁骨发育不全的诊断方法有哪些呢?专家指出,X线检查方法为确诊本病的主要手段,由于该病X线征象具有以上特殊性,所以诊断并不困难,关键在于能想到本病。
必要时仍需与以下疾病相鉴别:(1) 佝偻病:佝偻病所显示的方颅,囟门闭合延迟锥体及骨盆变形有时与该病相似,但前者无锁骨发育障碍,且经抗佝偻病治疗迅速好转。
(2) 软骨发育不全:为全身对称性软骨发育障碍骨骼纵向生长缓慢,而横向生长正常,故管状骨粗短,病人身材矮小且四肢短小,但膜化骨不受累。
(3) 克汀病:虽也显示为颅骨发育滞迟,颅缝增宽,并见缝间骨,但无锁骨、坐骨、耻骨的缺损及骨化中心延迟等。
两个锁骨颅骨发育不全综合征家系的遗传学分析的开题报告

两个锁骨颅骨发育不全综合征家系的遗传学分析的
开题报告
摘要:
两个锁骨颅骨发育不全综合征家系存在明显的家族遗传情况。
该综合征是一种罕见的遗传性疾病,主要表现为锁骨和颅骨的发育不良,严重影响患者的生活质量。
本文将对这两个家系进行遗传学分析,寻找致病基因,为疾病的治疗提供科学依据。
关键词:锁骨颅骨发育不全综合征;家族遗传;致病基因;遗传学分析
一、研究背景
锁骨颅骨发育不全综合征是一种罕见的遗传性疾病,由于缺乏足够的锁骨和颅骨,患者的头部和上肢运动明显受限制。
本病发病率极低,目前仅有少数家族遗传报告,因此对该病的研究仍处于初步阶段。
二、研究目的
通过对两个锁骨颅骨发育不全综合征家系的遗传学分析,探讨致病基因,为未来疾病的治疗提供理论基础和科学依据。
三、研究方法
采用基因测序技术,对患者和家系成员进行基因检测;将检测结果进行分析,筛选出与疾病有关的基因;通过实验验证,确定致病基因。
四、预期结果
本研究预计能够找到与锁骨颅骨发育不全综合征相关的基因,从而为疾病的治疗提供理论支持。
五、研究价值
锁骨颅骨发育不全综合征是一种罕见的疾病,对于其病因和治疗还存在诸多未知。
本研究通过遗传学分析,寻找致病基因,为进一步研究疾病的发生机制和治疗提供参考,具有重要的理论和实践价值。
六、研究进展
目前,我们已收集到两个锁骨颅骨发育不全综合征家系的样本,正在进行基因测序和分析工作,预计在未来几个月内取得初步研究成果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一颅锁骨发育不全综合征家族的RUNX2基因分析研究目的检测一个颅锁骨发育不全综合征(CCD)家系RUNX2基因突变情况。
方法采用先证者查证法,对CCD家系各成员进行全身健康状况及口腔专科检查,拍摄X线片;抽取先证者及其父母、姐姐外周静脉血,提取基因组DNA,聚合酶链反应(PCR)扩增RUNX2基因并测序,将先证者及其父母、姐姐RUNX2基因测序结果进行Blastn比较分析。
结果在先证者RUNX2基因的外显子2上发现了一个C→T突变,此突变来自母系染色体该基因568位点的基因突变;密码子CGG→TG G引起RUNX2编码的转录因子第190位保守的精氨酸变成色氨酸,突变型为c.568C>T。
结论 c.568C>T突变是导致该家系发病的分子基础。
标签:颅锁骨发育不全综合征;RUNX2;基因突变颅锁骨发育不全综合征(cleidocranial dyspla-sia,CCD)是一种累及骨骼和牙齿的常染色体显性遗传性疾病[1],具有明显的家族聚集性,男女发病率无明显差别,临床发病率约为1:1 000 000。
CCD常见的临床症状有囟门闭合延迟或不闭合,颅骨缝增宽,锁骨钙化不良、缺失或部分缺失,锥形胸,耻骨联合增宽而致骨盆发育不良,身材矮小等;口腔表现常见上颌骨发育不足,有多生牙,乳牙滞留,恒牙萌出延迟或埋伏牙等症状[2-5]。
目前CCD的发病机制尚不清楚,本研究采用分子生物学的方法对1个颅锁骨发育不全家系的患者进行RUNX2基因测序分析研究。
1 材料和方法1.1 研究对象CCD家系1个,来自山东省济南市,家系图见图1。
先证者,女,29岁,2010年6月因“牙齿不齐,咀嚼困难”到济南市口腔医院修复科就诊,要求修复上下牙列缺损。
采用先证者查证法,对家系各成员进行全身健康状况及口腔专科检查。
查体:先证者反,混合牙列,恒牙仅16、17、26、27、36、37、46萌出,全部乳牙均滞留,11~15、21~25、31~35、41~45未萌,65、71、72、73、75、81、82、83、85松动Ⅱ度;颅骨和面部比例失调,头大面小,前额及顶部突出呈方形,前囟门未闭合,从额部到枕部中线区有明显凹陷;面中部发育不足,凹面型,眶距增宽;上颌骨及颧骨发育不足,下颌骨发育相对正常;肩部窄小,胸部呈圆锥形,锁骨短小,仅在近胸骨处可扪及,双肩下垂并可在胸前并拢。
X线(图2)检查:上下颌骨内有埋伏牙,滞留乳牙牙根未见明显吸收,前囟门未闭合,颅缝增宽,并见多块缝间骨,双侧肩胛骨较小,呈翼状,位置下垂,双侧锁骨肩峰端部分缺如,耻骨联合间隙增宽,骶髂关节轻度增宽。
先证者及其母亲的临床表现和X线特征均符合CCD 特征。
该家系中3代共15位成员,其中CCD患者2例:先证者及其母亲,其母亲自述先证者姥姥、姥爷和其兄弟姐妹无类似症状。
箭头所指为先证者,Ⅰ~Ⅳ代表代数。
图 1 患者家族谱系图Fig 1 The pedigree of the involved family1.2 基因组DNA提取及测序ⅡⅢ1.2.1 DNA提取抽取先证者及其父母、姐姐外周静脉血各2 mL,放入干冰冻存,使用Universal Ge-nomic DNA Extraction Kit试剂盒进行DNA 提取,取 1 μL进行琼脂糖凝胶电泳,获得基因组DNA。
1.2.2 聚合酶链反应(polymerase chain reaction,PCR)扩增参照文献[6]的方法设计7对寡核苷酸引物(表1),然后对RUNX2 基因分别使用TaKaRa LA Taq?、TaKaRa MightyAmp DNA Polymerase?进行套式PCR 扩增,反应体系及方法按照说明书进行。
1.2.3 基因测序及突变位点分析使用TaKaRa Aga-rose Gel DNA Purification Kit切胶回收目的片段进行测序,测序由宝生物工程(大连)有限公司完成,并对测序结果进行Blastn比较分析。
2 结果将先证者的RUNX2基因测序结果进行Blastn比较分析,在Exon 2上发现了一个C→T突变,实际测序图谱显示双峰结构(C、T);对于其CCD母亲的基因检测结果表明,此突变来自母系染色体该基因568位点的基因突变;密码子CGG→TGG可能引起RUNX2编码的转录因子第190位(R190W)保守的精氨酸变成色氨酸。
该突变型为c.568C>T,CGG>TGG。
先证者的父亲、姐姐的测序结果显示,在同一位点显示C的单峰,即与Blastn中健康人的序列相同(图3)。
3 讨论目前的研究表明,颅锁骨发育不全的致病基因是RUNX2,该基因定位于染色体6p21[7-8],基因的错意表达、基因插入、缺失或者移码突变等都是造成颅锁骨发育不全综合征的重要原因[9]。
锁骨颅骨发育不全呈常染色体显性遗传,有很高的外显率和不同的表现型,轻症仅有牙齿异常,严重者表现为全身骨质受累[2]。
本研究家系中母女两人受累,家系其他成员表型正常,考虑基因突变为突发性,突发后呈常染色体显性遗传。
锁骨颅骨发育不全的致病基因RUNX2是哺乳动物编码转录因子PEBP2/CBF异二聚体d亚单位的3个基因之一,此α亚单位包含了有结合DNA能力的128个氨基酸残基,并且这一结构在进化中为保守区域,与果蝇的runt区域具有较高的同源性,因而得名[6]。
研究发现RUNX2基因敲除小鼠模型没有骨组织和成骨细胞,这表明该转录因子为成骨细胞分化所必需,其在维持正常的骨骼生长发育中起着重要的作用[10-11]。
RUNX2基因突变存在热点区域,该基因外显子1、2、3、5、7编码蛋白质的3个重要功能域:谷氨酸-丙氨酸富集区(QA功能域)、runt功能域和脯氨酸-丝氨酸-苏氨酸富集区(PST功能域)[12-14]。
本研究检测到的R190W突变发生在RUNX2中,位于runt功能域内,这个碱基改变将导致位于runt 结构域中第190 位保守的精氨酸编码为色氨酸(R190W)。
在runt区域中的精氨酸拉伸物对DNA的结合有重要作用,因此,这个区域的破坏可以导致DNA结合能力的丧失[13],精氨酸侧链是DNA结合的主要区域,当被不同的疏水性的色氨酸代替后,干扰了runt区域的结构,降低了DNA的结合能力。
2001年Berg-witz 等[15]首次报道了这个突变位点,本研究结果则进一步证实了RUNX2中的R190W错义突变为CCD的致病突变,推测R190W(c.568C>T)为一个突变热点。
典型CCD一般根据患者的典型面容、咬合关系、X线片检查以及全身情况即可诊断,X线检查方法为确诊本病的主要手段。
由于CCD的X线征象具有特殊性,所以诊断并不困难,关键在于是否能想到本病。
但对于轻症特别是仅有牙齿萌出异常患者的临床诊断较困难,通过检测RUNX2是否存在突变位点可以辅助诊断CCD。
由于本病目前尚无确切有效的治疗手段且外显率高,即使检测基因发现有突变位点也并无好的治疗方法,因此CCD患者愿意进行抽血基因检测的比例很少。
尽管目前已有80~90个RUNX2不同的突变位点被报道,约500个独立的CCD患者家族经过突变检测的筛选,但是此疾病致病基因的筛选和验证分析工作仍远远不够,新基因位点的鉴定将保证进一步的系统突变分析工作的开展,这可以为探讨CCD致病机制的分子遗传学机制打下坚实的基础。
对于已经发现的CCD患者应进行遗传咨询,通过产前诊断及时发现携带有致病基因的胎儿[16]。
目前对CCD并无确切有效的治疗方法。
对于处于生长发育期的患者可以采用正畸的方法进行治疗,必要时拔除滞留乳牙,减小恒牙萌出的阻力,或者采用牵引的办法帮助恒牙萌出;对于骨缺损导致的鼻梁塌陷等,可采用整形外科手术的方法进行骨移植,恢复患者的容貌;对于缺失牙齿,可采用种植或活动义齿等修复方法来进行修复。
总之,对于CCD患者需要多学科联合修复治疗,长期的临床效果尚需要进一步观察。
[参考文献][1] Mundlos S,Otto F,Mundlos C,et al. Mutations involving the transcription factor CBFA1 cause cleidocranial dyspla-sia[J]. Cell,1997,89(5):773-779.[2] Mundlos S. Cleidocranial dysplasia:clinical and molecu-lar genetics[J]. J Med Genet,1999,36(3):177-182.[3] Fernandez BA,Siegel-Bartelt J,Herbrick JA,et al. Holo-prosencephaly and cleidocranial dysplasia in a patient due to two position-effect mutations:case report and review of the literature[J]. Clin Genet,2005,68(4):349-359.[4] 邓润智,唐恩溢,杨旭东,等. 颅骨锁骨发育不全综合征的特征分析[J]. 口腔医学研究,2008,24(1):70-71.Deng Runzhi,Tang Enyi,Yang Xudong,et al. Clinical cha-racteristics of cleidocranial dysplasia[J]. J Oral Sci Res,2008,24(1):70-71.[5] 蒋兰,李勇,赖文莉. 锁骨颅骨发育不全综合征1例[J]. 华西口腔医学杂志,2009,27(4):459-460.Jiang Lan,Li Yong,Lai Wenli. Cleidocranial dysplasia:acase report[J]. West China J Stomatol,2009,27(4):459-460.[6] Quack I,V onderstrass B,Stock M,et al. Mutation analysis of core binding factor A1 in patients with cleidocranial dys-plasia[J]. Am J Hum Genet,1999,65(5):1268-1278.[7] Lin WD,Lin SP,Wang CH,et al. RUNX2 mutations in Tai-wanese patients with cleidocranial dysplasia[J]. Genet Mol Biol,2011,34(2):201-204.[8] Kamamoto M,Machida J,Miyachi H,et al. A novel muta-tion in the C-terminal region of RUNX2/CBFA1 distal to the DNA-binding runt domain in a Japanese patient with cleidocranial dysplasia[J]. Int J Oral Maxillofac Surg,2011,40(4):434-437.[9] Zhang C,Zheng S,Wang Y,et al. Mutational analysis of RUNX2 gene in Chinese patients with cleidocranial dyspla-sia[J]. Mutagenesis,2010,25(6):589-594.[10] Komori T,Yagi H,Nomura S,et al. Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts[J]. Cell,1997,89(5):755-764.[11] Chung CR,Tsuji K,Nifuji A,et al. Micro-CT evaluation of tooth,calvaria and mechanical stress-induced tooth mo-vement in adult Runx2/Cbfa1 heterozygous knock-out mice[J]. J Med Dent Sci,2004,51(1):105-113.[12] 轩东英,庄最新,谢宝仪,等. 颅骨锁骨发育不良综合征患者的RUNX2基因突变检测分析[J]. 实用口腔医学杂志,2009,25(4):544-547.Xuan Dongying,Zhuang Zuixin,Xie Baoyi,et al. Mutations in RUNX2 gene in a Chinese family with cleidocranial dy-splasia(CCD)[J]. J Pract Stomatol,2009,25(4):544-547.[13] Yoshida T,Kanegane H,Osato M,et al. Functional ana-lysis of RUNX2 mutations in Japanese patients with cleido-cranial dysplasia demonstrates novel genotype-phenotype correlations[J]. Am J Hum Genet,2002,71(4):724-738.[14] Zhou G,Chen Y,Zhou L,et al. CBFA1 mutation analysis and functional correlation with phenotypic variability in cleidocranial dysplasia[J]. Hum Mol Genet,1999,8(12):2311-2316.[15] Bergwitz C,Prochnau A,Mayr B,et al. Identification of novel CBFA1/RUNX2 mutations causing cleidocranial dysplasia[J]. J Inherit Metab Dis,2001,24(6):648-656.[16] Hermann NV,Hove HD,J?rgensen C,et al. Prenatal 3D ultrasound diagnostics in cleidocranial dysplasia[J]. Fetal Diagn Ther,2009,25(1):36-39.(本文编辑李彩)。
