2018年第一类医疗器械生产企业产品信息表
安徽宝葫芦信息科技集团股份有限公司介绍企业发展分析报告

Enterprise Development专业品质权威Analysis Report企业发展分析报告安徽宝葫芦信息科技集团股份有限公司免责声明:本报告通过对该企业公开数据进行分析生成,并不完全代表我方对该企业的意见,如有错误请及时联系;本报告出于对企业发展研究目的产生,仅供参考,在任何情况下,使用本报告所引起的一切后果,我方不承担任何责任:本报告不得用于一切商业用途,如需引用或合作,请与我方联系:安徽宝葫芦信息科技集团股份有限公司1企业发展分析结果1.1 企业发展指数得分企业发展指数得分安徽宝葫芦信息科技集团股份有限公司综合得分说明:企业发展指数根据企业规模、企业创新、企业风险、企业活力四个维度对企业发展情况进行评价。
该企业的综合评价得分需要您得到该公司授权后,我们将协助您分析给出。
1.2 企业画像类别内容行业软件和信息技术服务业-软件开发资质一般纳税人产品服务空1.3 发展历程2工商2.1工商信息2.2工商变更2.3股东结构2.4主要人员2.5分支机构2.6对外投资2.7企业年报2.8股权出质2.9动产抵押2.10司法协助2.11清算2.12注销3投融资3.1融资历史3.2投资事件3.3核心团队3.4企业业务4企业信用4.1企业信用4.2行政许可-工商局4.3行政处罚-信用中国4.4行政处罚-工商局4.5税务评级4.6税务处罚4.7经营异常4.8经营异常-工商局4.9采购不良行为4.10产品抽查4.11产品抽查-工商局4.12欠税公告4.13环保处罚4.14被执行人5司法文书5.1法律诉讼(当事人)5.2法律诉讼(相关人)5.3开庭公告5.4被执行人5.5法院公告5.6破产暂无破产数据6企业资质6.1资质许可6.2人员资质6.3产品许可6.4特殊许可7知识产权7.1商标信息最多显示100条记录,如需更多信息请到企业大数据平台查询7.2专利7.3软件著作权7.4作品著作权7.5网站备案7.6应用APP7.7微信公众号8招标中标8.1政府招标8.2政府中标8.3央企招标8.4央企中标9标准9.1国家标准9.2行业标准9.3团体标准9.4地方标准10成果奖励10.1国家奖励10.2省部奖励10.3社会奖励10.4科技成果11土地11.1大块土地出让11.2出让公告11.3土地抵押11.4地块公示11.5大企业购地11.6土地出租11.7土地结果11.8土地转让12基金12.1国家自然基金12.2国家自然基金成果12.3国家社科基金13招聘13.1招聘信息感谢阅读:感谢您耐心地阅读这份企业调查分析报告。
亳州御坊堂生物科技有限公司介绍企业发展分析报告

Enterprise Development专业品质权威Analysis Report企业发展分析报告亳州御坊堂生物科技有限公司免责声明:本报告通过对该企业公开数据进行分析生成,并不完全代表我方对该企业的意见,如有错误请及时联系;本报告出于对企业发展研究目的产生,仅供参考,在任何情况下,使用本报告所引起的一切后果,我方不承担任何责任:本报告不得用于一切商业用途,如需引用或合作,请与我方联系:亳州御坊堂生物科技有限公司1企业发展分析结果1.1 企业发展指数得分企业发展指数得分亳州御坊堂生物科技有限公司综合得分说明:企业发展指数根据企业规模、企业创新、企业风险、企业活力四个维度对企业发展情况进行评价。
该企业的综合评价得分需要您得到该公司授权后,我们将协助您分析给出。
1.2 企业画像类别内容行业医药制造业-中成药生产资质空产品服务空1.3 发展历程2工商2.1工商信息2.2工商变更2.3股东结构2.4主要人员2.5分支机构2.6对外投资2.7企业年报2.8股权出质2.9动产抵押2.10司法协助2.11清算2.12注销3投融资3.1融资历史3.2投资事件3.3核心团队3.4企业业务4企业信用4.1企业信用4.2行政许可-工商局4.3行政处罚-信用中国4.4行政处罚-工商局4.5税务评级4.6税务处罚4.7经营异常4.8经营异常-工商局4.9采购不良行为4.10产品抽查4.11产品抽查-工商局4.12欠税公告4.13环保处罚4.14被执行人5司法文书5.1法律诉讼(当事人)5.2法律诉讼(相关人)5.3开庭公告5.4被执行人5.5法院公告5.6破产暂无破产数据6企业资质6.1资质许可6.2人员资质6.3产品许可6.4特殊许可7知识产权7.1商标信息最多显示100条记录,如需更多信息请到企业大数据平台查询7.2专利7.3软件著作权7.4作品著作权7.5网站备案7.6应用APP7.7微信公众号8招标中标8.1政府招标8.2政府中标8.3央企招标8.4央企中标9标准9.1国家标准9.2行业标准9.3团体标准9.4地方标准10成果奖励10.1国家奖励10.2省部奖励10.3社会奖励10.4科技成果11 土地11.1大块土地出让11.2出让公告11.3土地抵押11.4地块公示11.5大企业购地11.6土地出租11.7土地结果11.8土地转让12基金12.1国家自然基金12.2国家自然基金成果12.3国家社科基金13招聘13.1招聘信息感谢阅读:感谢您耐心地阅读这份企业调查分析报告。
2018年8月1日医疗器械新版目录及法规细则

2018年8月1日医疗器械新版目录及法规细则医疗器械目录,是医疗生产企业和销售器械的一个行业标准。
新的版本发布,都有哪些改动的?快来瞅瞅吧~2017年9月4日,CFDA举行新闻发布会,正式发布新修订的《医疗器械分类目录》(以下简称新《分类目录》,分为22个子目录,自2018年8月1日起实施。
与2002版相比,新版主要变化如下:1、将43个子目录整合精简为22个。
2、将260个产品类别细化扩充为206个一级产品类别和1157个二级产品类别。
3、增加了产品预期用途和产品描述。
4、在原1008个产品名称举例的基础上,扩充到6609个典型产品名称举例。
5、调整了部分产品的管理类别。
管理类别降低的产品序号产品原类别新类别1射频消融设备用灌注泵三类二类2发光二极管(LED)手术照明灯二类一类3接触椎间隙的非无菌提供的骨科重复使用手术器械二类一类4可能接触中枢神经系统的非无菌提供的骨科用凿、锉、铲、脊柱外科定位/导向/测量器械、脊柱外科开孔扩孔器械、脊柱外科神经根探子、脊柱外科植骨块嵌入器等二类一类5开口用锥(如手锥)二类一类6胃肠道造影显像剂三类二类7胃肠超声显像粉三类二类8放射性核素扫描装置三类二类9内窥镜气囊控制器三类二类10带有LED光源的医用光学放大器具二类11碘液保护帽三类二类12一次性使用活检针三类二类13足部隔离用品、隔离护罩二类一类14接触胸腔、腹腔、脑室、腰椎、体内创面或体表真皮深层及其以下组织创面的引流导管三类二类15造口袋(含造口底盘)、造口护理用品、造口底盘、造口栓、防漏膏、造口护肤粉、造口皮肤保护剂等造口护理产品一类16髂骨穿刺针三类二类17用于非慢性创面、接触真皮深层及其以下组织且所含成分不可被人体吸收的的医用敷料三类二类18脱敏剂类产品三类二类19银汞合金三类二类20与有源器械(如牙科手机)连接使用的牙科锉、口腔车针、牙科钻(头)等产品一类21正畸弹簧二类一类22种植体密封材料三类二类23牙周塞治剂三类二类24洁牙粉三类二类25根管扩大液、根管清洗剂三类二类26临时冠桥树脂三类二类27牙托梗二类一类28X射线影像处理系统、核医学成像、医用磁共振成像系统三类二类29全自动酶联免疫分析仪、全自动化学发光免疫分析仪、全自动荧光免疫分析仪三类二类30微生物鉴定药敏分析仪器、微生物药敏培养监测仪器三类二类31洗板机二类一类管理类别升高的产品序号产品原类别新类别1脑压板一类二类2主动呼吸控制系统二类三类6、新《分类目录》的划分,势必会影响到医疗器械的注册审批。
惠州一类产品备案业务登记表

产品备案号
生产范围
Ⅰ类6864医用卫生材料及敷料** Ⅰ6821医用电子仪器设备** Ⅰ类6864医用卫生材料及敷料**
Ⅰ类6801基础外科手术器械,Ⅰ类6820普通诊察器械,Ⅰ类68 Ⅰ类6808腹部外科手术器械** Ⅰ类6864医用卫生材料及敷料** Ⅰ类6854手术室、急救室、诊疗室设 备及器具,Ⅰ类6866医用高分子材料 及制品,Ⅰ类6840体外诊断试剂(特 Ⅰ类6864医用卫生材料及敷料** Ⅰ类6820普通诊察器械** Ⅰ类6858医用冷疗、低温、冷藏设备及器具** Ⅰ类6822 医用光学器具、仪器及内 窥镜设备,Ⅰ类6854手术室、急救室 、诊疗室设备及器具,Ⅰ类6866医用 Ⅰ类6864医用卫生材料及敷料**
广东省惠州市惠阳区秋长维布新村展滔工业 园B2栋2楼 张佑生 广东省惠州市东江高新科技产业园上霞北路 1号华阳工业园B区13#厂房 方启春 惠阳区新圩镇长布村新秋公路旁 左文进
惠州市江北云山路16号双子星国际商务大厦 惠州市惠城区永联路126号卓立工业园A栋六楼A区 B座1010室 黄小托 广东省惠州市博罗县园洲镇沙头工业区 广东省惠州市博罗县园洲镇沙头工业区 唐荣
惠州市下角东路8号院内的一栋六层厂房第六层 惠州市下角东路8号院内的一栋六层厂房第六层 蔡景驹 惠州市惠城区水口街道办事处龙津北街2号(厂房1) 惠州市惠城区水口街道办事处龙津北街2号(厂房1) 盛文娟 博罗县杨村镇新田村下山小组黄岗 惠东县白花镇工业区 博罗县园洲镇梁屋白耀前村福兴工业区 博罗县杨村镇新田村下山小组黄岗 惠东县白花镇工业区 王超 林松柏
广东省惠州市惠城区马安镇马安村塘布地段 广东省惠州市惠城区马安镇马安村塘布地段 柯照文 博罗县福田镇福兴工业区 博罗县福田镇福兴工业区 熊芳
第一类医疗器械备案信息表

第一类医疗器械备案信息表备案号:鲁菏械备20140034号第一类医疗器械备案信息表备案号:鲁菏械备20150052号第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表备案号:鲁菏械备20160049号第一类医疗器械备案信息表备案号:鲁菏械备20160048号第一类医疗器械备案信息表备案号:鲁菏械备20160032号第一类医疗器械备案信息表备案号:鲁菏械备20160028号第一类医疗器械备案信息表备案号:鲁菏械备20160085号第一类医疗器械备案信息表备案号:鲁菏械备20160092号第一类医疗器械备案信息表备案号:鲁菏械备20160096号第一类医疗器械备案信息表备案号:鲁菏械备20160099号第一类医疗器械备案信息表备案号:鲁菏械备20160056号第一类医疗器械备案信息表备案号:鲁菏械备20140006号第一类医疗器械备案信息表备案号:鲁菏械备20140036号第一类医疗器械备案信息表备案号:鲁菏械备20140037号第一类医疗器械备案信息表备案号:鲁菏械备20140038号第一类医疗器械备案信息表备案号:鲁菏械备20140039号第一类医疗器械备案信息表备案号:鲁菏械备20150010号第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表备案号:鲁菏械备20170052号第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表备案号:鲁菏械备20180104号。
医疗器械经营企业检查要点

范文下载:www. 1ppt.co m/fan wen/
试卷下载:www.1ppt.c om/shiti /
教案下载:www. 1ppt.co m/jiao an/
PPT论坛:www.1ppt .cn
医疗器械经营企业检查要点
目录/Contents
01
医疗器械经营法规及要点
02
经营质量管理规范要点
01 相关法规
检查要点:1、组织机构图;2、人员花名册;3、任命书;4、人员学历、工作 简历、专业资质证书等资料;5、岗前培训记录、年度培训计划、培训记录、厂 家培训证明或者证书等。
LOGO
质量管理体系——文件
1、企业所有活动应当有制度支持,建立的制度、职责、程 序符合国家有关规定,同时也要企业实际相符合。
(质量管理机构或者管理人员的职责;质量管理规定;采购、收货、验收的规 定;供货者资格审核的规定;库房贮存、出入库、运输管理的规定;销售和 售后服务的规定;不合格医疗器械管理的规定;医疗器械退、换货的规定; 医疗器械不良事件监测和报告规定;医疗器械召回规定;设施设备维护及验 证和校准的规定;卫生和人员健康状况的规定;质量管理培训及考核的规定; 医疗器械质量投诉、事故调查和处理报告的规定)
质量管理体系——人员
2、对从事诊断试剂、植介入医疗器械、角膜接触镜、助听器等经营企业,《规 范》对其相关人员资格提出相应特殊要求。 ①从事体外诊断试剂的质量管理人员中,应当有1人为主管检验师,或具有检验 学相关专业大学以上学历并从事检验相关工作3年以上工作经历。从事体外诊断 试剂验收和售后服务工作的人员,应当具有检验学相关专业中专以上学历或者具 有检验师初级以上专业技术职称。 ②从事植入和介入类医疗器械经营人员中,应当配备医学相关专业大专以上学历, 并经过生产企业或者供应商培训的人员。 ③从事角膜接触镜、助听器等其他有特殊要求的医疗器械经营人员中,应当配备 具有相关专业或者职业资格的人员。 3、售后服务人员应当经过生产企业或者其他第三方的技术培训并取得企业售后 服务上岗证。也可以约定由生产企业或者第三方提供售后服务支持。
医疗器械测试题含参考答案

医疗器械测试题含参考答案一、单选题(共49题,每题1分,共49分)1、按照《医疗器械分类规则》第六条的规定,以无菌形式提供的医疗器械,其分类应不低于()医疗器械管理。
A、第二类或第三类B、第二类C、第三类D、第一类正确答案:B2、医疗器械生产企业因违法生产被食品药品监督管理部门立案调查但尚未结案的,或者收到行政处罚决定但尚未履行的,食品药品监督管理部门应当()。
A、不予许可B、不予受理C、中止许可,直至案件处理完毕D、终止许可正确答案:C3、医疗器械生产企业作出医疗器械召回决定的,二级召回应当在()日内通知到有关医疗器械经营企业、使用单位或者告知使用者。
A、1B、7C、5D、3正确答案:D4、受理注册申请的食品药品监督管理部门应当自受理之日起()工作日内将注册申请资料转交技术审评机构。
A、10个B、5个C、3个D、15正确答案:C5、医疗器械经营企业、使用单位履行了本条例规定的进货查验等义务,有充分证据证明其不知道所经营、使用的医疗器械为《医疗器械监督管理条例》第八十一条第一款第一项、第八十四条第一项、第八十六条第一项和第三项规定情形的医疗器械,并能如实说明其进货来源的,()。
A、可以免予处罚B、收缴其经营、使用的不符合法定要求的医疗器械,可以免除行政处罚C、不予处罚D、依法没收其经营、使用的不符合法定要求的医疗器械正确答案:B6、医疗器械生产企业跨省、自治区、直辖市设立生产场地的,应当()医疗器械生产许可。
A、共同申请一个B、合并使用一个C、单独申请D、变更正确答案:C7、医疗器械注册证遗失的,注册人应当立即在原发证机关指定的媒体上登载遗失声明。
自登载遗失声明之日起满()个月后,向原发证机关申请补发。
A、3B、4C、1D、2正确答案:C8、《医疗器械经营许可证》编号的编排方式为:XX食药监械经营许XXXXXXXX号。
其中:()X代表许可部门所在地省、自治区、直辖市的简称。
A、第四位B、第三位C、第二位D、第一位正确答案:D9、对第三类医疗器械需要()。
第一类医疗器械备案信息表

第一类医疗器械备案信息表
备案号:苏通械备
备案人名称
南通美康医疗器械有限公司
备案人统一社会
91320611668955966W
信用代码
备案人注册地址
南通市港闸区天生路598号1幢
生产地址
南通市港闸区天生路598号1幢
代理人
(进口医疗器械适用)
代理人注册地址
(进口医疗器械适用)
产品名称
医用护理垫
按产品功能及形状分为:A、B、C、D、E、F、G、H、I、J、K型;
型号/规格
按产品面料材质分为:涤棉、全棉、皮革。
产品描述
一次性使用病床或检查床上用的卫生护/
备案单位
南通市行政审批局
和日期
备案日期:2018年7月10日
变更情况
2018年7月10日,备案人注册地址、生产地址由“南通市港闸路17号”变更
第18020号公告附件
为“南通市港闸区天生路598号1幢”。
备案号:苏通械备
备案人名称
南通美康医疗器械有限公司
备案人统一社会
信用代码
91320611668955966w
备案人注册地址
南通市港闸区天生路598号1幢
生产地址
南通市港闸区天生路598号1幢
代理人
(进口医疗器械适用)
第18020号公告附件
中华人民共和国医疗器械注册证

《中华人民共和国医疗器械注册证》(第一类医疗器械)审批表企业名称(签章):企业法人代表(签字):云南省昆明市药品监督管理局制填表及提交材料说明一、本表请用钢笔填写或打印,字迹不清、填写项目不符合者不予受理;二、本表由申请办《中华人民共和国医疗器械注册证》(一类器械)的企业填写,一式二份,报所在地药品监督管理部门;三、提交审批表应同时提交如下材料:1、境内医疗器械注册申请表;2、医疗器械生产企业资格证明:营业执照副本;3、适用的产品标准及说明:采用国家标准、行业标准作为产品的适用标准的,应提交所采纳的国家标准、行业标准的文本;注册产品标准应当由生产企业签章。
生产企业应当提供所申请产品符合国家标准、行业标准的声明,生产企业承担产品上市后的质量责任的声明以及有关产品的型号、规格划分的说明。
这里的“签章”是指:企业盖章,或者其法定代表人,负责人签名加企业盖章(以下涉及境内医疗器械的,含义相同);4、产品全性能自测报告;5、企业生产产品的现有资源条件及质量管理能力(含检测手段)的说明;6、医疗器械说明书;7、所提交材料真实性的自我保证声明。
应当包括所提交材料的清单、生产企业承担法律责任的承诺。
(注:所有材料随申请表一起交到昆明市人民政府便民服务中心:昆明市药品监督管理局窗口)医疗器械注册登记表注册号:×(×)1(食)药监械(准)字××××3第×4××5××××6号第一类医疗器械注册证审批表(注:此页除“申报单位联系人”及“申报单位联系人电话”由填表人填写外,其余均由药监部门填写。
)。
简述医疗器械注册证编号的编排方式

简述医疗器械注册证编号的编排方式医疗器械注册证编号是一种用于标识医疗器械注册证的编码方式。
在中国,医疗器械注册证编号的编排方式遵循特定规则,具体如下:1. 首先,医疗器械注册证编号由一串数字组成,通常包括8位或9位数字。
这些数字代表了不同的含义,可以反映出医疗器械的一些基本信息。
2. 编号的第一位通常表示医疗器械的注册类别。
不同的医疗器械注册类别有不同的编号规则,如1表示一类医疗器械,2表示二类医疗器械,3表示三类医疗器械等。
3. 第二至四位表示医疗器械的注册地区。
不同的地区有不同的编号规则,通常是根据地区的行政区划代码来确定。
4. 第五位至六位表示医疗器械的注册年份。
通常使用两位数字来表示年份,如18表示2018年。
5. 第七位至八位表示医疗器械的注册序号。
这两位数字用于标识同一地区同一类别医疗器械的不同注册证。
6. 在一些特殊情况下,医疗器械注册证编号可能会包含额外的信息,如生产厂家信息等。
通过医疗器械注册证编号的编排方式,我们可以快速了解医疗器械的基本信息。
医疗器械注册证编号的编排方式统一规范,有助于监管部门进行管理和监督,方便企业和消费者查询和了解相关信息。
同时,医疗器械注册证编号的编排方式也为医疗器械的追溯和溯源提供了基础,有助于保障医疗器械的质量和安全。
需要注意的是,医疗器械注册证编号仅仅是医疗器械的一种标识方式,并不能完全代表医疗器械的质量和性能。
消费者在购买医疗器械时,除了关注注册证编号外,还应该结合其他因素,如生产企业的信誉、产品的品牌和质量认证等,全面评估医疗器械的安全性和有效性。
医疗器械注册证编号的编排方式是一种标识医疗器械的编码方式。
通过了解医疗器械注册证编号的编排规则,我们可以获取到医疗器械的一些基本信息。
医疗器械注册证编号的编排方式规范统一,有助于管理部门监管医疗器械,也为企业和消费者提供了便利。
但需要注意的是,医疗器械注册证编号仅仅是医疗器械的一种标识方式,选择医疗器械时还需要综合考虑其他因素。
国晟(河南)医疗生物科技有限公司介绍企业发展分析报告模板

Enterprise Development专业品质权威Analysis Report企业发展分析报告国晟(河南)医疗生物科技有限公司免责声明:本报告通过对该企业公开数据进行分析生成,并不完全代表我方对该企业的意见,如有错误请及时联系;本报告出于对企业发展研究目的产生,仅供参考,在任何情况下,使用本报告所引起的一切后果,我方不承担任何责任:本报告不得用于一切商业用途,如需引用或合作,请与我方联系:国晟(河南)医疗生物科技有限公司1企业发展分析结果1.1 企业发展指数得分企业发展指数得分国晟(河南)医疗生物科技有限公司综合得分说明:企业发展指数根据企业规模、企业创新、企业风险、企业活力四个维度对企业发展情况进行评价。
该企业的综合评价得分需要您得到该公司授权后,我们将协助您分析给出。
1.2 企业画像类别内容行业空资质增值税一般纳税人产品服务:第一类医疗器械生产;第一类医疗器械销售;1.3 发展历程2工商2.1工商信息2.2工商变更2.3股东结构2.4主要人员2.5分支机构2.6对外投资2.7企业年报2.8股权出质2.9动产抵押2.10司法协助2.11清算2.12注销3投融资3.1融资历史3.2投资事件3.3核心团队3.4企业业务4企业信用4.1企业信用4.2行政许可-工商局4.3行政处罚-信用中国4.4行政处罚-工商局4.5税务评级4.6税务处罚4.7经营异常4.8经营异常-工商局4.9采购不良行为4.10产品抽查4.11产品抽查-工商局4.12欠税公告4.13环保处罚4.14被执行人5司法文书5.1法律诉讼(当事人)5.2法律诉讼(相关人)5.3开庭公告5.4被执行人5.5法院公告5.6破产暂无破产数据6企业资质6.1资质许可6.2人员资质6.3产品许可6.4特殊许可7知识产权7.1商标7.2专利7.3软件著作权7.4作品著作权7.5网站备案7.6应用APP7.7微信公众号8招标中标8.1政府招标8.2政府中标8.3央企招标8.4央企中标9标准9.1国家标准9.2行业标准9.3团体标准9.4地方标准10成果奖励10.1国家奖励10.2省部奖励10.3社会奖励10.4科技成果11土地11.1大块土地出让11.2出让公告11.3土地抵押11.4地块公示11.5大企业购地11.6土地出租11.7土地结果11.8土地转让12基金12.1国家自然基金12.2国家自然基金成果12.3国家社科基金13招聘13.1招聘信息感谢阅读:感谢您耐心地阅读这份企业调查分析报告。
生产和生产后信息风险评价及措施表
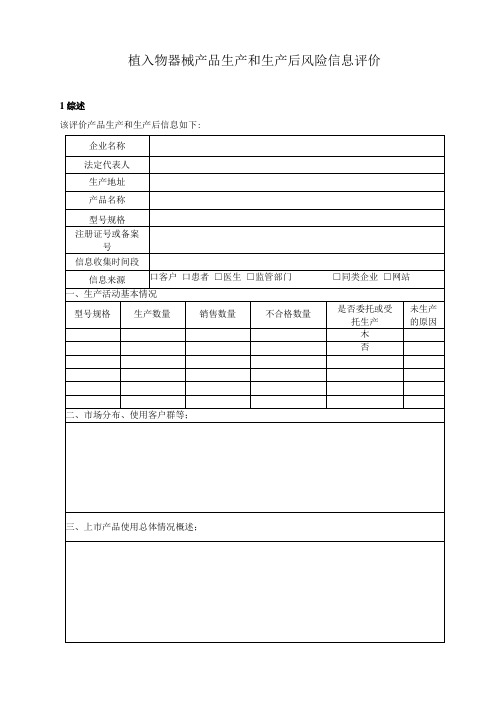
植入物器械产品生产和生产后风险信息评价1综述该评价产品生产和生产后信息如下:四、制造依据、执行法规、质量体系情况;本公司已具备注册产品生产条件,已建立质量管理体系并能有效运行。
(一)国务院行政法规《医疗器械监督管理条例》(国务院令第680号)(二)国家食品药品监督管理总局相关规定1、《医疗器械生产监督管理办法》(国家食品药品监督管理总局局令第7号)2、关于实施《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》有关事项的通知(食药监械监〔2014) 143号)3、关于医疗器械生产质量管理规范执行有关事宜的通告(2014年第15号通告)4、关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械监〔2014) 144号)5、国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告(2014年第64号)6、国家食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015) 218号)7、总局关于发布医疗器械生产质量管理规范附录定制式义齿的公告(2016年第195号)8、国家食品药品监管总局关于印发医疗器械生产质量管理规范定制式义齿现场检查指导原则的通知(食药监械监〔2016) 165号)9、国家食品药品监督管理总局关于发布医疗器械生产企业供应商审核指南的通告(2015年第1号)10、国家食品药品监督管理总局关于发布医疗器械生产企业质量控制与成品放行指南的通告(2016年第173号)五、强制性国家标准和行业标准贯彻落实情况本公司己贯彻落实如下标准:六、2018年已作废的强制性国家标准和行业标准经检索国家食品药品监督管理总局网站发布信息:七、医疗器械注册技术审查指导原则执行情况八、市场抽检情况描述2018年度未发生国家局、省局或其他机构抽检情况。
2生产和生产后信息的收集来源信息收集通常可以从质量管理体系中得到。
有关信息的获取方法和职能部门见下表:3生产和生产后信息的评价1)如果有可能涉及安全性的信息,则列表说明(见附表);2)对涉及安全性的信息进行评价(见附表):•是否有先前没有认识的危害出现,如有,分项描述;•是否由危害处境产生的一个或多个估计风险不再是可接受的,如有,分项说明。
北京市食品药品监督管理局关于医疗器械分类工作有关事项的通知

北京市食品药品监督管理局关于医疗器械分类工作有关事项的通知文章属性•【制定机关】北京市食品药品监督管理局•【公布日期】2018.07.05•【字号】京食药监械监〔2018〕25号•【施行日期】2018.07.05•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】医政医管正文北京市食品药品监督管理局关于医疗器械分类工作有关事项的通知京食药监械监〔2018〕25号各有关单位:为贯彻实施《医疗器械分类目录》(国家食品药品监督管理总局2017年第104号公告)(以下简称新《分类目录》),加强北京市医疗器械分类管理,进一步明确医疗器械产品分类有关工作的程序和要求,根据《医疗器械监督管理条例》(国务院令第650号)、《食品药品监管总局办公厅关于规范医疗器械产品分类有关工作的通知》(食药监办械管〔2017〕127号)和《国家食品药品监督管理总局关于实施〈医疗器械分类目录〉有关事项的通告》(2017年第143号通告)等相关规定,现将有关事项通知如下:一、自2018年8月1日起,申请人应当按照新《分类目录》备案或提出注册申请,办理生产经营许可或备案申请。
二、新《分类目录》不包括体外诊断试剂,注册申请人应当按照《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《体外诊断试剂注册管理办法修正案》(国家食品药品监督管理总局令第30号)、《6840 体外诊断试剂分类子目录(2013版)》及后续发布的分类界定文件中有关体外诊断试剂的分类界定产品分类,提出体外诊断试剂备案或注册申请。
三、《关于发布第一类医疗器械产品目录的通告》(国家食品药品监督管理总局通告2014年第8号)、《食品药品监管总局办公厅关于实施第一类医疗器械备案有关事项的通知》(食药监办械管〔2014〕174号)和2014年5月30日以后发布的医疗器械分类界定文件中有关第一类医疗器械产品的分类界定意见继续有效。
自2018年8月1日起,上述文件规定的产品管理类别与新《分类目录》不一致的,以新《分类目录》的产品管理类别为准。
第一类医疗器械生产备案凭证

备案号:粤顺食药监械生产备20180008号
企业名称
佛山市祺蕴医疗器械有限公司
住所
佛山市顺德区北滘镇碧江坤洲红门楼之三(即佛山市顺德区福安达医疗器械制造有限公司左侧)(住所申报)
生产场所
佛山市顺德区北滘镇碧江坤洲红门楼之三(即佛山市顺德区福安达医疗器械制造有限公司左侧)(住所申报)
法定代表人
冯锐坚
企业负责人
梁国潮
生产范围
2002年分类目录:6856
2017年分类目录:15-03
生产产品
列表
产品名称
产品手动病床
粤顺械备20180015号
否
2018年9月21日
备案部门(公章)
备案日期:2018年10月16日
安徽方达药械股份有限公司介绍企业发展分析报告

Enterprise Development专业品质权威Analysis Report企业发展分析报告安徽方达药械股份有限公司免责声明:本报告通过对该企业公开数据进行分析生成,并不完全代表我方对该企业的意见,如有错误请及时联系;本报告出于对企业发展研究目的产生,仅供参考,在任何情况下,使用本报告所引起的一切后果,我方不承担任何责任:本报告不得用于一切商业用途,如需引用或合作,请与我方联系:安徽方达药械股份有限公司1企业发展分析结果1.1 企业发展指数得分企业发展指数得分安徽方达药械股份有限公司综合得分说明:企业发展指数根据企业规模、企业创新、企业风险、企业活力四个维度对企业发展情况进行评价。
该企业的综合评价得分需要您得到该公司授权后,我们将协助您分析给出。
1.2 企业画像类别内容行业医药制造业-化学药品制剂制造资质一般纳税人产品服务空1.3 发展历程2工商2.1工商信息2.2工商变更2.3股东结构2.4主要人员2.5分支机构2.6对外投资2.7企业年报2.8股权出质2.9动产抵押2.10司法协助2.11清算2.12注销3投融资3.1融资历史3.2投资事件3.3核心团队3.4企业业务4企业信用4.1企业信用4.2行政许可-工商局4.3行政处罚-信用中国4.4行政处罚-工商局4.5税务评级4.6税务处罚4.7经营异常4.8经营异常-工商局4.9采购不良行为4.10产品抽查4.11产品抽查-工商局4.12欠税公告4.13环保处罚4.14被执行人5司法文书5.1法律诉讼(当事人)5.2法律诉讼(相关人)5.3开庭公告5.4被执行人5.5法院公告5.6破产暂无破产数据6企业资质6.1资质许可6.2人员资质6.3产品许可6.4特殊许可7知识产权7.1商标信息最多显示100条记录,如需更多信息请到企业大数据平台查询7.2专利7.3软件著作权7.4作品著作权7.5网站备案7.6应用APP7.7微信公众号8招标中标8.1政府招标8.2政府中标8.3央企招标8.4央企中标9标准9.1国家标准9.2行业标准9.3团体标准9.4地方标准10成果奖励10.1国家奖励10.2省部奖励10.3社会奖励10.4科技成果11 土地11.1大块土地出让11.2出让公告11.3土地抵押11.4地块公示11.5大企业购地11.6土地出租11.7土地结果11.8土地转让12基金12.1国家自然基金12.2国家自然基金成果12.3国家社科基金13招聘13.1招聘信息感谢阅读:感谢您耐心地阅读这份企业调查分析报告。
常州飞诺医疗技术有限公司介绍企业发展分析报告模板

Enterprise Development专业品质权威Analysis Report企业发展分析报告常州飞诺医疗技术有限公司免责声明:本报告通过对该企业公开数据进行分析生成,并不完全代表我方对该企业的意见,如有错误请及时联系;本报告出于对企业发展研究目的产生,仅供参考,在任何情况下,使用本报告所引起的一切后果,我方不承担任何责任:本报告不得用于一切商业用途,如需引用或合作,请与我方联系:常州飞诺医疗技术有限公司1企业发展分析结果1.1 企业发展指数得分企业发展指数得分常州飞诺医疗技术有限公司综合得分说明:企业发展指数根据企业规模、企业创新、企业风险、企业活力四个维度对企业发展情况进行评价。
该企业的综合评价得分需要您得到该公司授权后,我们将协助您分析给出。
1.2 企业画像类别内容行业空资质增值税一般纳税人产品服务领域内的技术开发、技术转让、技术服务、技术1.3 发展历程2工商2.1工商信息2.2工商变更2.3股东结构2.4主要人员2.5分支机构2.6对外投资2.7企业年报2.8股权出质2.9动产抵押2.10司法协助2.11清算2.12注销3投融资3.1融资历史3.2投资事件3.3核心团队3.4企业业务4企业信用4.1企业信用4.2行政许可-工商局4.3行政处罚-信用中国4.5税务评级4.6税务处罚4.7经营异常4.8经营异常-工商局4.9采购不良行为4.10产品抽查4.12欠税公告4.13环保处罚4.14被执行人5司法文书5.1法律诉讼(当事人)5.2法律诉讼(相关人)5.3开庭公告5.4被执行人5.5法院公告5.6破产暂无破产数据6企业资质6.1资质许可6.2人员资质6.3产品许可6.4特殊许可7知识产权7.1商标7.2专利7.3软件著作权7.4作品著作权7.5网站备案7.6应用APP7.7微信公众号8招标中标8.1政府招标8.2政府中标8.3央企招标8.4央企中标9标准9.1国家标准9.2行业标准9.3团体标准9.4地方标准10成果奖励10.1国家奖励10.2省部奖励10.3社会奖励10.4科技成果11 土地11.1大块土地出让11.2出让公告11.3土地抵押11.4地块公示11.5大企业购地11.6土地出租11.7土地结果11.8土地转让12基金12.1国家自然基金12.2国家自然基金成果12.3国家社科基金13招聘13.1招聘信息感谢阅读:感谢您耐心地阅读这份企业调查分析报告。
