第一类医疗器械生产备案表
第一类医疗器械备案凭证

91440606MA52PKM175
备案人注册地址
广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)
生产地址
广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)
代理人
/
代理人注册地址
/
预期用途
用于对创面敷料或肢体提供束缚力,以起到包扎、固定作用。
备注
备案单位
和日期
佛山市顺德区市场监督管ห้องสมุดไป่ตู้局
备案日期: 2019年11月06日
变更情况
产品名称
三角巾
型号/规格
型号:FSR-IV、愈合型、修护型、保养型、清洁型规格:5cm×5cm×7cm、10cm×10cm×14cm、20cm×20cm×28cm、30cm×30cm×42cm
产品描述
通常为纺织加工而成的卷状、管状、三角形的材料。其形状可以通过绑扎的形式对创面敷料进行固定或限制肢体活动,以对创面愈合起到间接的辅助作用。部分具有弹力或自粘等特性。非无菌提供,一次性使用。不与创面直接接触。粘贴部位为完好皮肤。
第一类医疗器械备案凭证
叁零医(广东)医疗生物科技有限公司:
根据相关法规要求,对你单位第一类医疗器械:三角巾予以备案,备案号:粤顺械备20190044号。
佛山市顺德区市场监督管理局
日期:2019年11月06日
第一类医疗器械备案信息表
备案号:粤顺械备20190044号
备案人名称
叁零医(广东)医疗生物科技有限公司
第一类医疗器械生产备案表

第一类医疗器械生产备案表一、引言随着医疗技术的快速发展和公众对健康需求的不断提高,医疗器械的生产和使用已成为社会的重要议题。
第一类医疗器械作为医疗器械的重要组成部分,其生产和使用的管理显得尤为重要。
本文将详细解读第一类医疗器械生产备案表的相关内容。
二、第一类医疗器械生产备案表概述第一类医疗器械是指通过常规控制能够确保安全性和有效性的医疗器械,如普通诊察器械、物理治疗器械等。
根据《医疗器械监督管理条例》规定,从事第一类医疗器械生产的单位必须向食品药品监督管理部门提交第一类医疗器械生产备案表,方可从事生产活动。
三、第一类医疗器械生产备案表主要内容第一类医疗器械生产备案表主要包括以下内容:1、生产单位基本信息:包括单位名称、统一社会信用代码、住所、法定代表人、生产等。
2、生产产品信息:包括产品名称、注册证编号、规格型号、生产批量、生产工艺流程等。
3、原材料采购信息:包括主要原材料的种类、供应商、进货渠道等。
4、质量控制信息:包括质量控制标准、检验设备及人员资质、产品检验报告等。
5、销售及售后服务信息:包括销售渠道、售后服务承诺等。
四、第一类医疗器械生产备案表的填报注意事项在填报第一类医疗器械生产备案表时,需要注意以下几点:1、确保填写的信息真实、准确、完整,不得虚报、瞒报。
2、对于生产过程中的关键环节和质量控制点,应详细描述并附上相关证明材料。
3、对于涉及到的技术参数和性能指标,应严格按照相关标准填写。
4、提交的资料应当清晰明了,易于查阅和理解。
五、总结第一类医疗器械生产备案表是保证第一类医疗器械安全性和有效性的重要文件,也是监管部门对生产单位实施监督管理的依据。
各生产单位应认真填写备案表,遵守相关法规,确保医疗器械的质量和安全,为公众的健康提供有力保障。
监管部门也应加强对第一类医疗器械生产的监管力度,确保备案制度的落实和执行。
第一类医疗器械备案信息表一、概述第一类医疗器械备案信息表是用于记录和展示第一类医疗器械备案信息的表格。
一类医疗器械注册备案表

5cm×5cm×8层 10 cm×7 cm×27 cm
19
195 cm×72 cm×150 辽源市富港大众机械有 吉辽食药管械(准)字 cm 限责任公司 2008第1260002号 45*2.5 吉林省亿人健康科技有 限责任公司 吉林省亿人健康科技有 限责任公司 吉林省亿人健康科技有 限责任公司 吉林省亿人健康科技有 限责任公司 吉林省亿人健康科技有 限责任公司 吉四药管械(准)字2004 第1540001号 吉四药管械(准)字2005 第1570001号 吉四药管械(准)字2005 第1570002号 吉四药管械(准)字2005 第1570003号 吉四药管械(准)字2005 第1010004号
吉通药管械(准)字2003 第1560002号 吉通药管械(准)字2003 第1560003号 吉通药管械(准)字2003 第1560004号 吉通药管械(准)字2004 第1660001号 吉通药管械(准)字2004 第1640002号 吉通药管械(准)字2004 第1660003号 吉通药管械(准)字2004 第1660004号 吉通药管械(准)字2005 第1660001号 吉通药管械(准)字2004 第1640002号(更) 吉通药管械(准)字2004 第1660001号(更) 吉通食药监械(准)字 2005第1660002号 吉通食药监械(准)字 2005第1660003号 吉通食药监械(准)字 2004第1660001号(更2) 吉通食药监械(准)字 2004第1660002号(更2) 吉通食药监械(准)字 2006第1560003号 吉通食药监械(准)字 2006第1560004号 吉通食药监械(准)字 2006第1560005号 吉通食药监械(准)字 梅河口市药业包装公司 2006第1660006号 吉通食药监械(准)字 通化市晨宇卫生用品厂 2007第1640001号
第一类医疗器械生产备案凭证

第一类医疗器械生产备案凭证
备案号:粤顺食药监械生产备20140003号企业名称佛山市景优医疗器械有限公司
住所佛山市顺德区乐从镇良村工业北区14号之一
生产场所佛山市顺德区乐从镇良村工业北区14号之一
法定代表人龚燕企业负责人龚燕
生产范围I类6856病房护理设备及器具**
生产产品列表
产品名称产品备案号
是否
受托生产
备案日期手动病床
粤顺械备
20140014号
否
2016年4月
28日
医用腋拐
粤顺械备
20180001号
否
2018年1月
19日
医用助行器
粤顺械备
20180002号
否
2018年1月
19日
备案部门(公章)
备案日期:2018年 1月24日。
第一类医疗器械备案凭证

第一类医疗器械备案凭证
瑞海博医疗科技南通有限公司:
根据相关法规要求,对你单位第一类医疗器械:上肢综合训练器予以备案,备案号:苏通械备20190025号。
南通市行政审批局
(盖章)
日期:2019年9月29日
第一类医疗器械备案信息表
备案号:苏通械备20190025号
第一类医疗器械备案凭证
南通罗伯特医疗科技有限公司:
根据相关法规要求,对你单位第一类医疗器械:下颌骨牵引装置予以备案,备案号:苏通械备20190014号。
南通市行政审批局
(盖章)
日期:2019年9月27日
第一类医疗器械备案信息表
备案号:苏通械备20190014号
第一类医疗器械备案凭证
如皋市恒康医疗器材有限公司:
根据相关法规要求,对你单位第一类医疗器械:引流袋予以备案,备案号:苏通械备20170047号。
南通市行政审批局
(盖章)
日期:2019年10月8日
第一类医疗器械备案信息表
备案号:苏通械备20170047号。
第一类医疗器械备案凭证

第一类医疗器械备案信息表备案号:粤顺械备20190007号备案人名称叁零医(广东)医疗生物科技有限公司备案人统一社会信用代码91440606MA52PKM175备案人注册地址广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)生产地址广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)代理人/代理人注册地址/产品名称液体敷料型号/规格型号:紧致型、保养型、嫩红型、修护型、头部护理型、SPF30、创伤型、愈合型、无痕型规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g产品描述通常为溶液或软膏(不包括凝胶)。
所含成分不具有药理学作用。
所含成分不可被人体吸收。
非无菌提供。
预期用途通过在创面表面形成保护层,起物理屏障作用。
用于小创口、擦伤、切割伤等浅表性创面及周围皮肤的护理。
备注备案单位和日期佛山市顺德区食品药品监督管理局备案日期: 2019年03月20日变更情况型号或规格由“见附件”变更为“型号:紧致型、保养型、嫩红型、修护型、头皮护理型、SPF30 规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”变更时间2019年01月16日;型号或规格由“型号:紧致型、保养型、嫩红型、修护型、头皮护理型、SPF30 规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”变更为“型号:紧致型、保养型、嫩红型、修护型、头部护理型、SPF30、创伤型、愈合型、无痕型规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”。
第一类医疗器械备案信息表【模板】

手动病床主要采用碳钢、不锈钢、塑钢材料等设计、制造,主要由床头(尾)板、床架、床面、操作系统、侧护栏、档板和脚轮组成。
预期用途
手动病床主要用于在医疗监护下的成年患者的诊断、治疗或监护时使用,用以支撑患者身体,形成临床所需体位。
备注
备案单位
和日期
XX市XX区市场监督管理局
备案日期:2020年04月16日
第一类医疗器械备案凭证
XX市XXX医疗器械有限公司:
根据相关法规要求,对你单位第一类医疗器械:手动病床予以备案,备案号:粤顺械备********号。
XX市XX区市场监督管理局
日期:2020年04月16日
第一类医疗器械备案信息表
备案号:粤顺械备********号
备案人名称
XX市XXX医疗器械有限公司
备案人统一社会信用代码
变更情况
********MA54BMCH53
备案人注册地址
XX市XX区勒流街道黄连坝咀二路2号之五(住所申报)
生产地址
XX市XX区勒流街道黄连坝咀二路2号之五(住所申报)
代理人
/
代理人注册地址
/
产品名称
手动病床
型号/规格
KS101、KS102、KS103、KS201、KS202、KS301、KS302、KS303、KS401、KS402、KS403、KM101、KM102、KM103、KM201、KM202、KM203、KM301、KM302、KM303、KM401、KM402、KM403、KF001、KF002、KF003、KC101、KC102、KC103、KC201、KC202、KC203、KB001、KB002、KB003、KB004、KSK001、KSK002、KSK003、KSK004
第一类医疗器械备案表(隔离衣)

第一类医疗器械备案表产品名称(产品分类名称): 隔离衣备案人: 沈阳XX有限责任公司沈阳市市场监督管理局制填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(E×cel形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明。
第一类医疗器械备案信息表

(进口医疗器械适用)
代理人注册地址
(进口医疗器分身式(160、165、170、175、180、185);
连身式(160、165、170、175、180、185)。
产品描述
通常采用非织造布为主要原料,经裁剪、缝纫制成。非无菌提供,一次性使用。
预期用途
隔离衣用于医疗机构门诊、病房、检验室等作普通隔离。
/
第一类医疗器械备案信息表
备案号:苏通械备20200030号
备案人名称
南通海盟实业股份有限公司
备案人统一社会信用代码
91320600732493525L
备案人注册地址
南通市港闸区越江路20号
生产地址
南通市崇川区观音山镇太平支路88号1幢
代理人
(进口医疗器械适用)
代理人注册地址
(进口医疗器械适用)
产品名称
产品名称
隔离衣
型号/规格
型号:连身式、分身式。
规格:160、165、170、175、180、185。
产品描述
通常采用非织造布为主要原料,经裁剪、缝纫制成。非无菌提供,一次性使用。
预期用途
用于医疗机构门诊、病房、检验室等作普通隔离。
备注
/
备案单位
和日期
南通市行政审批局
备案日期:2020年3月2日
变更情况
备案人名称
江苏财通纺织科技有限公司
备案人统一社会信用代码
91320612138381811W
备案人注册地址
南通市通州区青年东路189号
生产地址
南通市通州区青年东路189号
代理人
(进口医疗器械适用)
代理人注册地址
(进口医疗器械适用)
产品名称
第一类医疗器械生产备案凭证

第一类医疗器械生产备案凭证
备案号:粤顺食药监械生产备20150002号企业名称
住所佛山市顺德区陈村镇石洲村委会岗北工业区白陈路石洲段2号B1座三层之三生产场所佛山市顺德区陈村镇石洲村委会岗北工业区白陈路石洲段2号B1座三层之三法定代表人邱万桥企业负责人邱万桥
生产范围I类:6864医用卫生材料及敷料
生产产品列表产品名称产品备案号
是否
受托生产
备注检查手套
粤顺食药监械(准)
字2012第1660010
否
检查手套
粤顺食药监械(准)
字2012第1660011
否
备案部门(公章)
备案日期:2015年3月30日。
第一类医疗器械生产备案表
附件1第一类医疗器械生产备案表填表说明:一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局公布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
第一类医疗器械生产备案材料要求1.第一类医疗器械生产备案表;2.所生产产品的医疗器械备案凭证复印件;3.经备案的产品技术要求复印件;4.营业执照和组织机构代码证复印件;5.法定代表人、企业负责人身份证明复印件;6.生产、质量和技术负责人的身份、学历职称证明复印件;7.生产管理、质量检验岗位从业人员、学历职称一览表;8.生产场地的证明文件〔有特殊生产环境要求的,还应提交设施、环境的证明文件〕复印件;9.主要生产设备和检验设备目录;10.质量手册和程序文件;11.工艺流程图;12.经办人授权证明;13.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第一类医疗器械生产备案凭证备案号:XX食药监械生产备XXXXXXXX号备案部门〔公章〕备案日期:年月日第二类医疗器械经营备案表填表说明一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局公布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
第二类医疗器械经营备案材料要求1.第二类医疗器械经营备案表;2.企业营业执照复印件;3.企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件;4.企业组织机构与部门设置说明;5.企业经营地址、库房地址的地理位置图、平面图〔注明实际使用面积〕、房屋产权证明文件或者租赁协议〔附房屋产权证明文件〕复印件;6.企业经营设施和设备目录;7.企业经营质量管理制度、工作程序等文件目录;8.经办人授权证明;9.其他证明材料。
第一类医疗器械生产备案表

第一类医疗器械生产备案表第一类医疗器械生产备案表企业名称:营业执照注册号:成立日期:组织机构代码:注册资本(万元):营业期限:企业类型:邮编:住所:联系生产地址:联系人员情况:法定代表人:企业负责人:联系人:人员总数(人):生产管理人员(人):质量管理人员(人):技术人员数:专业技术人员(人):一类检验机构状况:备案事项:生产范围:生产产品列表:序号产品名称产品备案号备注本企业承诺所提交的全部备案资料真实有效,并承担一切法律责任。
同时,保证按照法律法规的要求从事医疗器械生产活动。
法定代表人(签字)(企业盖章)填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表生产范围应当按照国家食品药品监督管理部门发布的第一类医疗器械产品目录和相应体外诊断试剂分类子目录中规定的管理类别、分类编码和名称填写。
第一类医疗器械生产备案变更表备案编号:组织机构代码:联系人:变更内容:企业名称:住所:法定代表人:企业负责人:生产地址非文字性变更:生产地址文字性变更:原备案事项:联系变更后事项:备案日期:生产范围:生产产品:本企业承诺所提交的全部资料真实有效,并承担一切法律责任。
同时,保证按照法律法规的要求从事医疗器械生产活动。
法定代表人(签字)(企业盖章)填表说明:1.本表按照实际内容填写,不涉及的可缺项。
2.本表生产范围应当按照国家食品药品监督管理部门发布的第一类医疗器械产品目录和相应体外诊断试剂分类子目录中规定的管理类别、分类编码和名称填写。
第一类医疗器械生产备案凭证补发表备案编号:企业名称:住所:生产地址:法定代表人:联系人:企业负责人:联系备案日期:组织机构代码:生产范围:生产产品列表:序号:补发:遗失、损毁原因:说明:本企业承诺所提交的全部资料真实有效,并承担一切法律责任。
同时,保证按照法律法规的要求从事医疗器械生产活动。
第一类医疗器械生产备案凭证
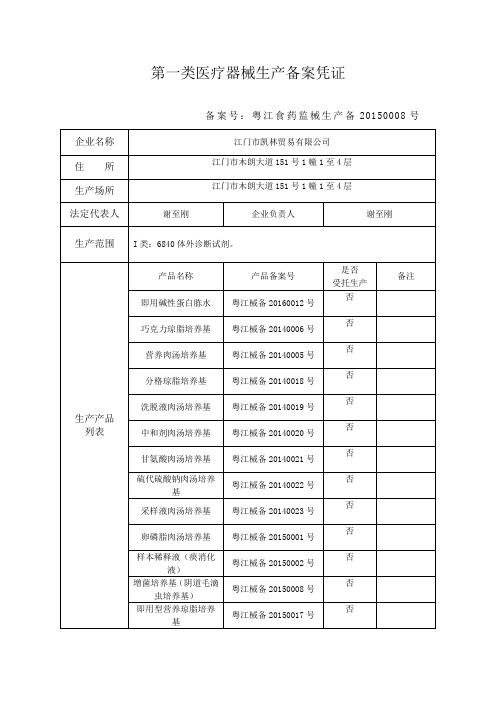
备案号:粤江食药监械生产备20150008号
企业名称
江门市凯林贸易有限公司
住所
江门市木朗大道151号1幢1至4层
生产场所
江门市木朗大道151号1幢1至4层
法定代表人
谢至刚
企业负责人
谢至刚
生产范围
I类:6840体外诊断试剂。
生产产品
列表
产品名称
产品备案号
是否
受托生产
备注
即用碱性蛋白胨水
粤江械备20140022号
否
采样液肉汤培养基
粤江械备20140023号
否
卵磷脂肉汤培养基
粤江械备20150001号
否
样本稀释液(痰消化液)
粤江械备20150002号
否
增菌培养基(阴道毛滴虫培养基)
粤江械备20150008号
否
即用型营养琼脂培养基
粤江械备20150017号
否
运送保存培养基
粤江械备20150016号
粤江械备20160012号
否
巧克力琼脂培养基
粤江械备20140006号
否
营养肉汤培养基
粤江械备20140005号
否
分格琼脂培养基
粤江械备20140018号
否
洗脱液肉汤培养基
粤江械备20140019号
否
中和剂肉汤培养基
粤江械备20140020号
否
甘氨酸肉汤培养基
粤江械备20140021号
否
硫代硫酸钠肉汤培养基
否
革兰染色液
粤江械备20190009号
否
备案部门(公章)
备案日期:2019年3月7日
否
第一类医疗器械备案信息表

有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□第一类医疗器械备案信息表
有源□无源体外诊断试剂□第一类医疗器械备案信息表
备案号:鲁菏械备20190028号
有源□无源体外诊断试剂□。
第一类医疗器械生产备案凭证
企业名称
河南正源医疗装备有限公司上海仙代生物科技(商丘)有限公司
住 所
民权县高新技术产业开发区富民六路66号
生产场所
民权县高新技术产业开发区富民六路66号
法定代表人
刘继青
企业负责人
刘继青
生产范围
原分类目录:Ⅰ类:6854手术室、急救室、诊疗室设备及器具 ;现分类目录:Ⅰ类:15患者承载器械。
生产产品
列表
产品名称
产品备案号
是否
受托生产
备注
医用冷敷贴
豫商械备20170007号
否
2018年12月27日
医用退热贴
豫商械备20170008号
否
2018年12月27日
透气胶带
豫商械备20170009号
否
2018年12月27日
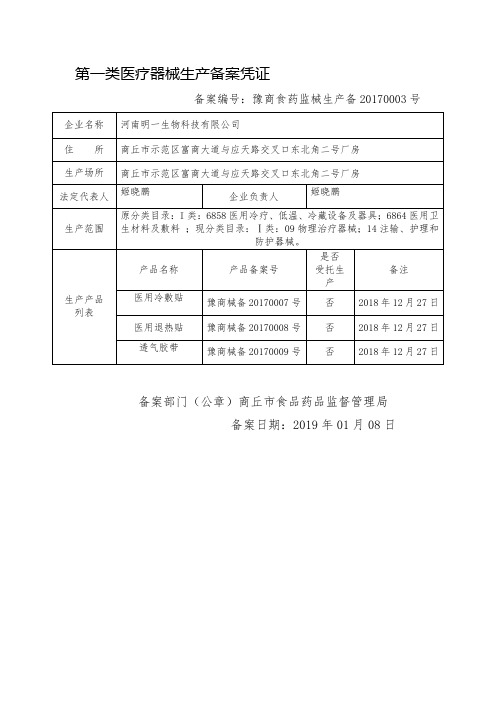
备案部门(公章)商丘市食品药品监督管理局
备案日期:2019年01月08日
第一类医疗器械生产备案凭证
生产产品
列表
产品名称
产品备案号
是否
受托生产
备注
马镫形多功能腿架
豫商械备20170002号
否
2017年6月29日
备案部门(公章)商丘市食品药品监督管理局
备案日期:2019年01月16日
第一类医疗器械生产备案凭证
备案编号:豫商食药监械生产备20170003号
企业名称
河南明一生物科技有限公司上海仙代生物科技(商丘)有限公司
住 所
商丘市示范区富商大道与应天路交叉口东北角二号厂房
生产场所
商丘市示范区富商大道与应天路交叉口东北角二号厂房
法定代表人
姬晓鹏
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
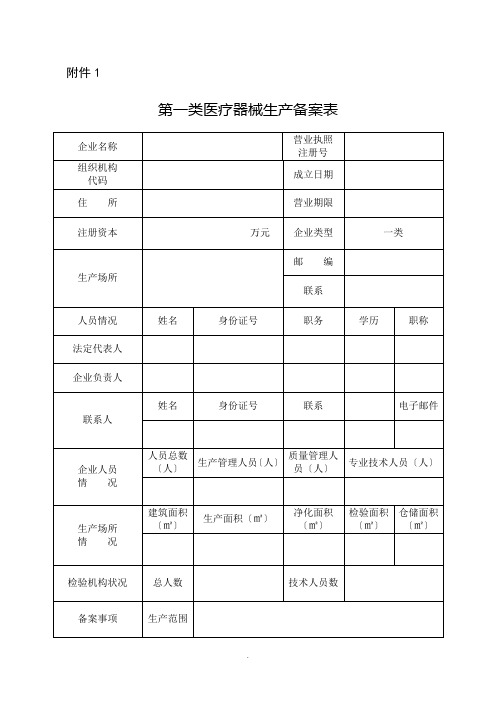
附件1
第一类医疗器械生产备案表
填表说明:
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等
按照营业执照内容填写。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
附件2
第一类医疗器械生产备案材料要求
1.第一类医疗器械生产备案表;
2.所生产产品的医疗器械备案凭证复印件;
3.经备案的产品技术要求复印件;
4.营业执照和组织机构代码证复印件;
5.法定代表人、企业负责人身份证明复印件;
6.生产、质量和技术负责人的身份、学历职称证明复印件;
7.生产管理、质量检验岗位从业人员、学历职称一览表;
8.生产场地的证明文件(有特殊生产环境要求的,还应提交设施、环境的证明文件)复印件;
9.主要生产设备和检验设备目录;
10.质量手册和程序文件;
11.工艺流程图;
12.经办人授权证明;
13.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
附件3
第一类医疗器械生产备案凭证
备案号:XX食药监械生产备XXXXXXXX号
备案部门(公章)
备案日期:年月日
附件4
第二类医疗器械经营备案表
填表说明
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
附件5
第二类医疗器械经营备案材料要求
1.第二类医疗器械经营备案表;
2.企业营业执照复印件;
3.企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件;
4.企业组织机构与部门设置说明;
5.企业经营地址、库房地址的地理位置图、平面图(注明实际使用面积)、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;
6.企业经营设施和设备目录;
7.企业经营质量管理制度、工作程序等文件目录;
8.经办人授权证明;
9.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
附件6
第二类医疗器械经营备案凭证
备案号:XX食药监械经营备XXXXXXXX号
备案部门(公章)
备案日期:年月日。
