02-1环境化学第二章__大气环境化学
第二章 大气环境化学3 自由基反应

H-ONO间的键能为324.0kJ/mol 。HNO2对 200~400nm的光有吸收,吸光后发生光离解,初 级过程为: HNO2+hv→HO+NO HNO2+hv→H+NO2
次级过程: HO+NO→ HNO2
HO+HN02 → H2O+NO2
HO+NO2→ HNO3 HNO2的光解可能是大气中HO的重要来源之一
在对流层中,由于O2存在,可发生如下反应:
H + O2→ HO2 HCO + O2 → HO2 + CO
甲醛的光离解
可见空气中甲醛光解可产生HO2自由基。其他醛 类的光解也可以同样方式生成HO2,如乙醛光解:
CH3CHO+ hv → H + CH3CO
H+O2→ HO2
所以醛类的光解是大气中HO2的重要来源之一
(4)NO2的光离解
键能为300.5kJ/mol
NO2在290~410nm内有连 续吸收光谱。
吸收小于420nm波长的光 可发生离解: NO2十hv → NO +O O+O2+M→ O3+M 据称这是大气中唯一已知 O3的人为来源。
(5)亚硝酸的光解
亚硝酸HO-NO间的键能为201.1kJ/mol,
(9)卤代烃的光离解
卤代甲烷光解初级过程:
① 紫外光照射,CH3X+ hv →CH3+X
② 键强顺序为CH3-F> CH3-Cl > CH3-Br > CH3-I
③ 高能量的短波长紫外光照射,可能发生两个键断裂,
应断裂两个最弱键,例CF2Cl2离解为 CF2+2Cl
④ 即使最短波长的光,三键断裂也少见。
环境化学第二章

气在上升时温度降低值与上升高度的比。
Γd=0.98℃/100m≈1 ℃/100m
空气移动,高压区→低压,膨胀降温,压缩升温。 当气团在水平方向运动,非绝热过程。 当气团作垂直升降运动时,近似为绝热过程
第一节 大气中污染物的迁移
四、大气稳定度:指大气中某一高度上的气块在垂直方
第一节 大气中污染物的迁移
平流层(stratosphere) (12-48km) ①气温随高度增加而升高,Γ<0 ,层顶接近0℃, 20km-25km臭氧浓度最高; ②气体状态稳定,垂直对流很小,污染物成一薄层 ③空气稀薄,大气透明度高
民航:最高飞行10km左右 人造卫星:30-50km以上
第一节 大气中污染物的迁移 中间层(mesosphere )(48-78km) ①气温随高度增加而降低,气温可达-92℃; ②垂直运动剧烈; ③发生光化学反应。 热层(thermosphere)/电离层(80-800km) ①气温随高度增加而迅速升高,顶部可达1200℃ ②空气密度很小,气体电离。
第一节 大气中污染物的迁移
地理地势的影响
➢ 海风:白天陆地上空的气温增加得比海面上空快,在 海陆之间形成指向大陆的气压梯度,较冷的空气从海 洋流向大陆而形成海风。
➢ 陆风:夜间海水温度降低得较慢,海面的温度较陆地 高,在海陆之间形成指向海洋的气压梯度,于是陆地 上空的空气流向海洋,形成陆风。
冷
气
光物理过程
辐射跃迁: A* A h
通过辐射磷光或荧光失活
碰撞失活:A* M A M
为无辐射跃迁,即碰撞失活
光化学过程
光离解: A* B1 B2 生成新物质
与其它分子反应生成新物种:
环境化学第二章大气环境化学

NO、NO2,通式NOx
4)燃料燃烧过程中NOx形成机理
含氮化合物+O2
NOx
N2在高温下(>2000℃)
O2 O·+ O· N2 + O· NO + N·
O2 + N· NO + O· 结·O论H:+燃N烧·过程中NO排+放的H氮·氧化物主要为NO
以上快 (占N9O0%+以1上/)2,O其2 次才N为ON2O2(仅占10%左慢右)
第一节 大气结构、组成和性质
一、大气垂直分层 二、大气的组成 三、大气中的主要污染物
一、大气垂直分层
通常把静态大气的温度和密度在垂直方向上的分布 ,称为大气温度层结和大气密度层结。
大气
依据
大气的 温度层结 密度层结 运动规律
划分为
对流层 平流层 中间层
热层 散逸层
(一)对流层
平均厚度12km,赤道19km,两 极8-9km,云雨主要发生层, 夏季厚,冬季薄。
CO2(0.0314%) >99.9% 2)稀有气体(H2、CH4、SO2、NH3、CO、O3等)
<0.1% 3)水(正常范围 1-3%)
(二)大气组分的停留时间
1、停留时间
某种组分在大气中存在的平均时间,用τ表示
假定大气中某种组分的总量为M,那么其速率变化可表示为: dM/dt=P+I-R-O
P为该物质的总质量生成速率; I 为该物质的总质量流入速率; 总的输入速率 R为该物质的总质量去除速率; O为该物质的总质量流出速率; 总的输出速率
CO (73-185)、 H2O (10)、 SO2 (2) 、NOx (10)
(三)大气组分浓度表示法
1、体积浓度表示法:一百万体积的空气中所 含污染物的体积数-ppm, ppb ,ppt 表示为10-6,10-9,10-12
环境化学复习

第二章大气环境化学1、大气层的结构 Layers of the Atmosphere(英文)A、对流层troposphere对流层是大气的最底层,其厚度在赤道附近为16—18km;在中纬度地区为10—12km,两极附近为8—9km。
最显著特点是气温随海拔高度的增加而降低,大约每上升100m,温度降低0.6度。
另一个特点是密度大,大气总质量的3/4以上集中在对流层。
B、平流层stratosphere从对流层顶到海拔高度约为50km的大气层。
特点:①空气没有对流运动,平流运动占显著优势。
②空气比对流层稀薄得多,水汽、尘埃的含量甚微,很少出现天气现象③在高15—60km内,有约20km的一层臭氧层The Ozone Layer。
O2→O•+O•、O•+O2→O3、O3→O•+O2、O3+O•→2O2是臭氧光解的过程。
平流层温度随海拔高度的增加而增加。
C、中间层mesosphere从平流层顶到80km高度的大气层。
空气较稀薄,由于臭氧层消失,温度随海拔高度的增加而迅速降低。
D、热层(电离层)thermosphere从80km到约500km的大气层。
大气温度随海拔高度的增加而迅速增加。
2.大气中的主要污染物含硫化合物;含氮化合物;含碳化合物;含卤素化合物2、辐射逆温层Radiation inversion对流层大气的重要热源是来自地面的长波辐射,故离地面越近气温越高;离地面越远气温越低。
随高度升高气温的降低率称为大气垂直递减率:Γ=-dT/dz T—热力学温度K, z—高度当Γ=0 时,称为等温气层;当Γ<0 时,称为逆温气层。
这时气层稳定性强,对大气的垂直运动的发展起着阻碍作用。
根据逆温形成的过程不同,可分为两种:近地面层的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温;自由大气的逆温:乱流逆温、下沉逆温、锋面逆温气块在大气中的稳定度与大气垂直递减率(Γ)和干绝热垂直递减率(Γd)两者有关。
若Γ<Γd,表明大气是稳定的;若Γ>Γd,大气是不稳定;若Γ=Γd,大气处于平衡状态。
环境化学 第二章 大气环境化学

大气中重要吸光物质的光离解
4 3
(1) O2和N2的光离解
2
1 O2键能493.8KJ/mol。相 应波长为243nm。在紫外区 lgε 0 120-240nm有吸收。
O2 + hν
λ < 240 nm
-1 -2
O· + O·
N2键能:939.4KJ/mol。 对应的波长为127nm。
-3
-4
HNO
3
h ν HO NO
2
2
HO CO CO
H
2
H O 2 M HO 2HO
2
M
(有CO存在时)
H 2O 2 O 2
产生过氧自由基和过氧化氢
(5) SO2对光的吸收
SO2的键能为545.1kJ/mol, 吸收光谱 中呈现三条吸收带,键能大,240 - 400 nm 的光不能使其离解,只能生成激发态:
思考题:
太阳的发射光谱 和地面测得的太阳光 谱是否相同?为什么?
3.3大气中重要自由基来源
自由基 由于在其电子壳层的外层有
一个不成对的电子,因而有很高的活 性,具有强氧化作用。如:
CH 3 C(O)H hv H 3 C HCO
由于高层大气十分稀薄,自由基的半 衰期可以是几分钟或更长时间。自由基参 加反应,每次反应的产物之一是自由基, 最后通过另一个自由基反应使链终止,如:
SO 2 h SO 2
*
240 400 nm
SO2*在污染大气中可参与许多光化学反应。
( P73,图2-32)
(6) 甲醛的光离解
HCHO中H-CHO的键能为 356.5 kJ/mol, 它对 240 – 360 nm 范围内的光有吸收, 吸光后的光解反应为:
环境化学期末复习资料
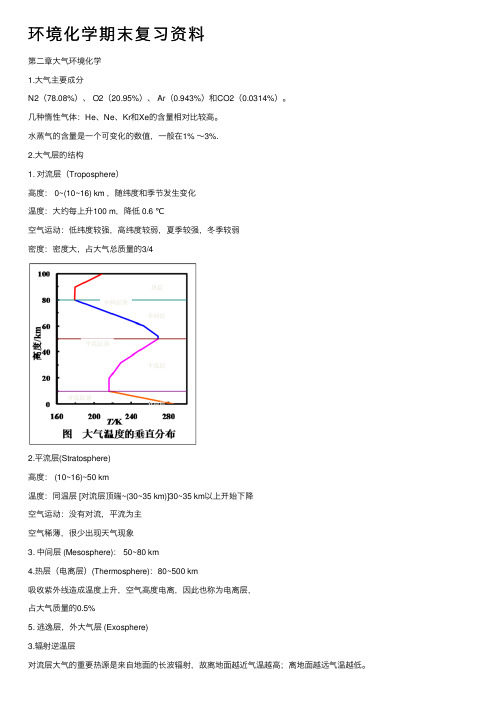
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。
环境化学 第二章 大气环境化学

0 160 200 240 280 K
8
大气温度的垂直分布
高度(km)3000
散逸层
(+ )
500
400 热成层 300
(+ )
200
100 越往上氧、氦等气体的原子态越多
90 中间层顶
80
电离层
紫外线的强烈照
射,N2和O2产生 不同程度的离解
度 高 k( m)
70 中间层
60
对流层
16
2.平流层(Stratosphere)
范围:高度12~50km 特征: ① 温度随高度增加而上升, 温度大约为220~260K, 在
12~20km处温度基本不变。 ②由于高能电磁辐射比对流层强烈,所以光化学反应很
重要。 ③O3层即存在于此层下部,高度为15~35km处,其中
25km处浓度最高。
擦层边界层低层大气(1-2km)污染物 80
集中;自由层:自然现象对流层顶层:
水变冰,阻止氢的损失
60
X(km)
B、平流stratosphere
O2→O· + O · O · +O2→O3
O3→O · + O2 O3+ O · →2O2
40
吸收紫外线
C、中间层mesosphere
20
D、热层(电离层)thermosphere
1、要在江南地区顺利育苗,可采取哪些有效的措施?
夜间在秧田里灌水;人造烟雾的办法
2、温室内气温高于室外的原因是什么? 温室内二氧化碳的浓度较高,水分充足,能更多的吸收红外线长波辐射, 保温效应好
3、农民在冬季采用塑料大棚发展农业,是对哪些自然条件进行改造? 热量条件和水分条件
《大气环境化学 》课件

PART 05
大气污染控制与治理
REPORTING
政策法规与标准制定
政策法规
制定和实施大气污染防治相关政策法规,包括污染物排放标准、环境质量标准等,以规范企业和个人的行为,减 少大气污染物的排放。
标准制定
根据不同地区和行业的实际情况,制定大气污染物排放标准,以及环境空气质量标准,为污染控制提供科学依据 。
交通运
总结词
交通运输过程中会产生大量的尾气和颗粒物,如一氧化碳、氮氧化物、碳氢化合 物等。
详细描述
交通运输是大气污染物的重要来源之一,主要来自汽车、摩托车和运输车辆等。 这些车辆在行驶过程中会排放大量的尾气,其中含有多种有害物质,如一氧化碳 、氮氧化物、碳氢化合物等。
农业活动
总结词
农业活动如施肥、喷洒农药等会产生一定的大气污染物,如 氨气、氮氧化物等。
《大气环境化学》 PPT课件
REPORTING
• 大气环境化学概述 • 大气污染物的来源与形成 • 大气污染物的传输与转化 • 大气污染物对人类和环境的影响 • 大气污染控制与治理 • 大气环境化学的未来展望
目录
PART 01
大气环境化学概述
REPORTING
大气环境化学的定义与重要性
定义
大气环境化学是一门研究大气环境中 化学物质的形成、转化、传输和影响 等过程的学科。
要点一
与地球科学
要点二
与生物学
研究大气化学与地球大气的相互作用,如火山喷发对大气 化学的影响。
研究大气污物对生物体的影响,以及生物体对大气污染 物的适应和进化。
THANKS
感谢观看
REPORTING
其影响因素。
大气中化学物质的环境效应与健康影响
第二章 大气环境化学 环境化学(袁加程)第二版

第一节 大气组成及大气层结构
大气温度层结的温度一般是随高度增加而降低,但有时常 发生温度随高度而增加的现象,这种现象叫逆温,出现逆温
的气层,叫逆温层。
※研究逆温的目的:由于逆温层的存在,大气扩散较难,阻
碍了污染物随着空气垂直运动的扩展,在特殊的天气能造
成严重的污染事件,如雾霾。所以研究逆温层的形成、高
60
平流层顶
中间层
40 20
对流层顶 平流层
0
对流层
160
200
T/K
240
280
图 大气温度的垂直分布
第一节 大气组成及大气层结构
4. 热层(电离层)
高度: 80~500 km
100
热层
80 60
中间层顶
该层空气稀薄,大气质量仅 占总质量的0.5﹪。太阳所发 出的紫外线绝大部分都被这 一层的物质所吸收,大气温 度随高度的增加而迅速增加。 在太阳紫外线和宇宙射 线作用下,该层空气处于高 度电离状态,因此也称为电 离层。
1. 对流层
低层大气(1~2 km):摩擦层 或边界层,污染物集中; 自由层大气(2 km以上):自 然现象;
高度 /km
60
平流层顶 中间层
100 80
中间层顶
热层
40
平流层
对流层顶层:水变冰,阻止水
分子进入平流层,阻止了氢的
20
0
对流层顶 对流层
损失。
H2O → H + HO
160
200
T/K
第一节 大气组成及大气层结构
大气的升温过程
太 阳 辐 射
射向宇宙空 间
地
面 吸 收
大气吸收
大 气 辐 射 地面
环境化学习题

环境化学习题第二章大气环境化学1. 何谓大气温度层结2. 逆温现象对大气中污染物的迁移有什么影响3. 何谓大气垂直递减率和干绝热垂直递减率如何用其判断大气稳定度4. 影响大气中污染物迁移的主要因素是什么5. 大气中有那些重要的吸光物质其吸光特征是什么6. 太阳的发射光谱和地面测得的太阳光谱有何不同为什么7. 大气中有哪些重要自由基其来源如何8. 大气中有哪些重要含氮化合物说明它们的天然和人为来源及对环境的污染。
9. 叙述大气中的NO转化为NO2的各种途径。
10. 大气中有哪些重要的碳氢化合物它们可发生哪些重要的光化学反应11. 碳氢化合物参与的光化学反应对各种自由基的形成有什么贡献12.说明光化学烟雾现象,解释污染物与产物的日变化曲线,并说明光化学烟雾产物的性质与特征。
13. 说明烃类在光化学烟雾形成过程中的重要作用。
14. 何谓有机物的反应活性如何将有机物按反应活性分类15. 简述大气中SO2氧化的几种途径。
16. 论述SO2液相氧化的重要性,并对各种催化氧化过程进行比较。
17. 说明酸雨形成的原因。
18. 确定酸雨pH界限的依据是什么19. 论述影响酸雨形成的因素。
20. 什么是大气颗粒物的三模态如何识别各种粒子模21. 说明大气颗粒物的化学组成以及污染物对大气颗粒物组成的影响。
22. 大气颗粒物中多环芳烃的种类,存在状态以及危害性如何23. 何谓温室效应和温室气体24. 说明臭氧层破坏的原因和机理。
第三章水环境化学1. 请推导出封闭和开放体系碳酸平衡中[H2CO3*]、[HCO3-]、[CO32-]的表达式,并讨论这两个体系之间的区别。
2. 请导出总酸度、CO2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总炭酸量和分布系数(α)的函数。
3. 向某一含有碳酸的水体加入重碳酸盐,问:①总酸度、②总碱度、③无机酸度、④酚酞碱度、⑤CO2酸度,是增加还、减少还是不变。
4. 在一个pH为,碱度为mmol/L的水体重,若加入碳酸钠是其碱化,问需要加多少mmol/L 的碳酸钠才能使水体pH值上升至。
02-1环境化学第二章__大气环境化学(1)

(三)中间层
从平流层顶到约85km的高度
特点:
1、空气更稀薄 2、无水分 3、温度随高度增加而降低,中间层顶,气温最低
(-100℃) 4、对流运动强烈。 5、中间层中上部,气体分子(O2、N2)开始电离。
(四)热层
从80km到约500km的高度
特点: 1、温度随高度增加迅速增高; 2、大气更为稀薄; 3、大部分空气分子被电离成为离子和自由
第一节 大气结构、组成和性质
一、大气垂直分层 二、大气的组成 三、大气中的主要污染物
一、大气垂直分层
通常把静态大气的温度和密度在垂直方向上的分布, 称为大气温度层结和大气密度层结。
大气
依据
大气的 温度层结 密度层结 运动规律
划分为
对流层 平流层 中间层
热层 散逸层
(一)对流层
平均厚度12km,赤道19km,两 极8-9km,云雨主要发生层, 夏季厚,冬季薄。
以上快 (占N9O0%+以1上/)2,O其2 次才N为ON2O2(仅占10%左慢右)
(三)含碳化合物的来源和演变
CO、CO2、CHx、含氧烃等
1、CO
1)危害
阻碍体内氧气输送 参与光化学烟雾形成
·OH + CO CO2 + H· O2 + H· HO 2·+ M
NO + HO2· NO2+ ·OH
N2O +
N2+O·N2O +
hv N2O +
O2N·O
N2+O2
O·
(二)含氮化合物的来源和演变
2、NOx
1)危害
NO、NO2,通式NOx
与血红蛋白结合,肺炎
损伤叶组织、造成斑点 光化学烟雾
(二)含氮化合物的来源和演变
NO、NO2,通式NOx
大气环境化学2.1

氨在对流层中主要是转化为气溶胶銨盐,而后 经湿沉降和干沉降去除。汇强估计湿沉降为 (38~85)×106t/a(1976年数据),干沉降约 为10×106t/a。近年来,NH3为OH自由基氧 化形成 NOx也被认为是NH3的一个重要的汇。
四、向平流层输送
向平流层输送也是某些气体和气溶胶粒子的汇。
2.2.3含硫化合物
大气中含硫化合物主要有:氧硫化碳(COS)、 二硫化碳(CS2)、二甲基硫((CH3) 2S)、硫化 氢 (H2S)、二氧化硫(SO2)、三氧化硫(SO3)、 硫酸(H2SO4)、亚硫酸盐(SO32-)和硫酸盐 (SO42-)等。
二、天然源 (1) 自然尘(风沙、黄砂、土壤粒子等); (2) 森林、草原火灾(排放出CO、CO2、SOx、 NOx、HC); (3) 火山活动(排放出SO2、H2O、硫酸盐尘等 颗粒物); (4) 森林排放(主要为萜烯类碳氢化合物) (5) 海浪飞沫(颗粒物主要为硫酸盐与亚硫酸盐)。
当制定某一空气污染地区的控制对策, 进行 模式计算时,必须考虑全部源的相对排放强 度,做出污染源清单(Source Inventory),这里不仅要考虑人为源,而 且要考虑天然源。在有些情况下天然源甚至 比人为源更重要。有人曾对全球的硫氧化物 和氮氧化物的排放作了估计,认为全球氮排 放中93%、硫氧化物排放中60% 来自天然 源。
植物对粒子的去除效率与粒子大小、植物表 面大小、形状以及湿度都有关系。对于气态 污染物,干沉降也是很重要的一种去除途径。 地表吸收的机制尚不十分清楚,看来与许多 因素,如气象条件、地表的物理、化学性质 以及气体本身的性质等有关。
二、湿沉降(湿去除)
第二章大气环境化学

南极冰山解体
第二章 大气环境化学
本章内容
第一节 大气的组成及其主要污染物
第二节
第三节
大气中污染物的迁移
大气中污染物的转化
(光化学烟雾,硫酸型烟雾,酸雨,温室效应、臭氧层破 坏等。)
第一节
大气的组成及其旋转的空气层。
大气也称为大气圈或大气层。大气是地球上一切生命
第二节 大气中污染物的迁移
近地面层逆温:辐射逆温、平流逆温、融雪逆温、 地形逆温 自由大气逆温:乱流逆温、下沉逆温、锋面逆温
逆温
C 什么时候容 易产生辐射 逆温?
lnP B
E
D
F
T
A
图2-3 辐射逆温(陈世训,1991)
第二节 大气中污染物的迁移 二、气团及其干绝热减温率
气团: 污染气体由污染源排到大气中时,一般不会立即和周 围大气混合均匀,这样污染性气体的理化性质有别于周围大 气,可视作一个气团。 干过程:是指固定质量的气块所经历的不发生水相变化的过 程。 干绝热过程:固定质量的气块在干过程中其内部的总质量不 变,也是一个绝热过程。
第二节
大气中污染物的迁移 气温垂直 递减率和逆 温对污染物 迁移的影响?
一、气温垂直递减率和逆温 气温垂直递减率(Г ) :
dT Γ dz
T——绝对温度(K);z——高度。
对流层中,气温一般是随高度增加而降低。但在 一定条件下会出现反常现象。可由垂直递减率 (Г ) 的变化情况来判断。当 Г = 0 时,称为等温气层; 当Г <0时,称为逆温气层。
大气中污染物的迁移 三、 大气的稳定度
大气的稳定度是指气层的稳定程度,其层结大气使气块趋 于回到原来的位置,则层结是稳定的。
环境化学PPT课件

2021/6/16
2
第一节、污染物在大气中的迁移
污染物在大气中的迁移是指由污染源排放出来的污染物由于空气的运 动使其传输和分散的过程。迁移过程可使污染物浓度降低。大气圈 中空气的运动主要是由于温度差异而引起的。
由于地球旋转作用以及距地面不同高度的各层大气对太阳辐射吸收程 度上的差异,使得大气的温度、密度在垂直方向上呈不均匀的分布。 人们常把静大气 的温度和密度在垂直方向上的分布称为大气温度层 结和大气密度层结。
根据大气的温度层结、密度层结的运动规律,可将大气划分为对流层、 平流层、中层和热层等若干层。此外,还有所谓散逸层,有时也划 作一个层区。
2021/6/16
3
一、大气的组成和停留时间
二、大气垂直分层
三、气块的绝热过程和干绝热递减率
四、大气稳定度
五、逆温
六、局地环流对污染物扩散的影响
2021/6/16
特点:(1)气温随高度升高而降低,空气垂直对流强烈。
(2)空气密度大。
(3)天气复杂多变。
(4)对流层下部湍流。
(5)污染物的迁移转化主要发生在这一层。
2021/6/16
8
2021/6/16
9
2、平流层: 对流层顶到约50km的地方
特点:
(1) 空气基本无对流,平流运动占显著优势。
(2) 空气比下层稀薄,水汽、尘埃含量很少,很少 有天气现象,透明度极高。
ON3O(小2(大小于气于1天中1月)停、)留等SO时,2间(它小小们于于在0.1大0年1气年的中)气、的体N浓H,度3如(~变H1化天2O比)(、1较0N.明1O天显和)。、
2021/6/16
7
二、大气垂直分层:
1962,WMO, 对流层、平流层、中间层、热成层、逸散 层。
环境化学(第二版)课后习题参考答案

习题第一章绪论2、根据环境化学的任务、内容和特点以及发展动向,你认为怎样才能学好环境化学这门课?环境化学是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
环境化学以化学物质在环境中出现而引起环境问题为研究对象,以解决环境问题为目标的一门新型科学。
其内容主要涉及:有害物质在环境介质中存在的浓度水平和形态,潜在有害物质的来源,他们在个别环境介质中和不同介质间的环境化学行为;有害物质对环境和生态系统以及人体健康产生效用的机制和风险性;有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
环境化学的特点是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
当前我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染、以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废物和城市垃圾对水题和土壤的污染。
3、环境污染物有哪些类别?主要的化学污染物有哪些?按环境要素可分为:大气污染物、水体污染物和工业污染物。
按污染物的形态可分为:气态污染物、液态污染物和固体污染物;按污染物的性质可分为:化学污染物、物理污染物和生物污染物。
主要化学污染物有:1.元素:如铅、镉、准金属等。
2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等3•有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、等;4. 金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等;5. 含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等;6. 含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等;7. 有机卤化物:四氯化碳、多氯联苯、氯代二噁瑛;8. 有机硫化物:硫醇、二甲砜、硫酸二甲酯等;9. 有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。
第二章-大气环境化学-大气中污染物质的转化-2016

2. HNO3的离解 HNO3 + hν 若有CO存在: HO· +CO H· +O2 +M 2 H O2 ·
HO-NO2键能为 199.4 kJ/mol
HO·+NO2
CO2 + H · H O2· +M H2 O2 +O2
二氧化硫对光的吸收 SO2 + h ν
SO2*
键能为545.1 kJ/mol
光量子能量与化学键之间的对应关 系:
通常波长大于700nm(红外线)的光不能 引起光化学离解。
3.大气中重要的吸光物质的光离解 氧分子和氮分子的光离解
键能为 939.4 kJ/mol
键能为 493.8 kJ/mol
N2+hν O2+hν
N· +N· O· +O·
(波长<243nm) (波长<127nm)
R·
O2
RO2
+ ·
NO
氧化
NO2 + RO ·
甲烷的氧化反应
CH4+HO · CH3 · +H2O
CH4+ O ·
CH3 · +O2
CH3 · +HO ·
CH3O2 ·
大气中的O · 主要来自O3的光解,通过上述反应, CH4不断消耗O ·,可导致臭氧层的损耗,同时可发 生如下反应:
NO+ CH3O2 ·
若NO浓度高时,会伴随如下反应: NO+O3 NO2+O2 NO+NO3 2NO2 NO3与烷烃的反应速度很慢: RH+NO3 R ·+HNO3 这是城市夜间HNO3的主要来源。
这是城市夜 间HNO3 的主要来 源。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(五)逸散层
特点:
1、500km以上高空
2、空气稀薄,密度几乎与太空相同
3、空气分子受地球引力极小,所以气体
及其微粒可以不断从该层逃逸出去
二、大气的组成
——气体组分和大气颗粒物
(一)气体组分及分布 1、气体组分
CO2(0.0314%) >99.9%
2)稀有气体(H2、CH4、SO2、NH3、CO、O3等)
3)清除
干湿沉降
1、SO2
4)浓度特征
1、SO2
4)浓度特征
夏季低,一天变化 不大;冬季浓度高 且变化大 随高度增加而增加 随风向变化
2、H2 S
1)来源
主要天然来源,含硫有机物的分解,以及 硫酸盐在厌氧环境被反硫化细菌还原
2CH2O+SO42-
2)清除 HO· +H2S H2S
2HCO3-+H2S
1)氮(78.08%)、氧(20.95%)、氩(0.934%)、
<0.1%
3)水(正常范围 1-3%)
(二)大气组分的停留时间
1、停留时间
某种组分在大气中存在的平均时间,用τ表示
假定大气中某种组分的总量为M,那么其速率变化可表示为: dM/dt=P+I-R-O
P为该物质的总质量生成速率; I 为该物质的总质量流入速率; 总的输入速率
(三)含碳化合物的来源和演变
CO、CO2、CHx、含氧烃等
2、CO2
3)清除
植物光合作用、海水吸收后以碳酸盐形式存在
3、CHX
气态存在于大气中的是碳原子数在1-10, 包括可挥发性的所有烃类,烯烃、芳香烃。
是形成光化学烟雾的主要参与者。
相比较而言,开放程度大的链烯烃活性高于 较为封闭的环烯烃,含有氧原子的碳氢化物活性 高于链烷烃。
温室效应比CO2大20倍
甲烷
1)危害: 温室气体,导致温室效应
2)来源:
燃料燃烧过程、原油以及天然气的泄漏
厌氧细菌发酵为主
2CH2O CO2+CH4
CH4+HO· 3)清除: CH4+Cl·
CH3· +H2O 主要 CH3· +HCl
4)浓度特征:
夏低冬高,北半球高
(四)卤代烃的来源和演变 1、来源
四、影响大气污染物迁移的因素
一、辐射逆温层
对流层大气的重要热源是来自地面的长波辐射,故离地面越
近气温越高;离地面越远气温越低。 随高度升高气温的降低率称为大气垂直递减率:
Γ =-dT/dz
对流层中,dT/dz<0, Γ =0.65K/100m 一定条件下出现反常现象 当Γ =0 时,称为等温层;
当Γ <0 时,称为逆温层。这时气层稳定性强,对大气的
按化学组成
一次污染物:直接从污染源排放的污染物; 二次污染物:由一次污染物经化学反应形成的污染物
(一)含硫化合物的来源和演变
1、SO2
1)危害
人呼吸道 损伤叶组织、造成缺绿病或黄萎 硫酸烟雾和酸性降水
1、SO2
2)来源
天然来源:火山喷发、土壤厌氧微生物与植 物释放、陆地上降雨、风吹起的海盐
人为来源:矿物燃料燃烧、硫化矿冶炼
下图白天的层结曲线为ABC
夜晚近地面空气冷却较快,层结曲线变为FEC,其中FE为逆温层。 以后随着地面温度降低,逆温层加厚,在清晨达到最厚,如DB段。 日出后地面温度上升,逆温层
近地面处首先破坏,自下而上
逐渐变薄,最后消失。
C
B
lnP
100-150 m;
平静而晴朗的夜晚
E
T 图2-23. 辐射逆温(陈世训,1981)
D
F
A
辐射逆温的生消过程
大气某些性质与大气污染的关系 气温垂直递 减率
大气稳定度
对扩散稀释
大气污染程度
Γ>0 不稳定 Γ=0 较稳定 Γ<0(逆温) 非常稳定
有利 不利 非常不利
轻微 重 非常严重
四、影响大气污染物迁移的因素
1、风和大气湍流的影响
1)影响污染物在大气中扩散的三个因素:
风:气块规则运动时水平方向速度分量, 使污染物向下风向扩散; 竖直方向的为铅直运动:大尺度——系统性铅直运动; 小尺度 ——对流
夏季厚,冬季薄。
特点:
1、气温随高度升高而降低;
2、空气密度大;
3、有三小层、天气复杂多变;
4、对流运动强烈。
(二)平流层
对流层顶到约50km
特点:
1、空气基本无对流,平流运动占显著优势; 2、空气比下层稀薄,水汽、尘埃含量很少, 很少有天气现象,透明度极高; 3、在15-35km的范围内,厚度约20km的臭氧层。
(三)中间层
从平流层顶到约85km的高度
特点: 1、空气更稀薄 2、无水分 3、温度随高度增加而降低,中间层顶,气温最低
(-100℃)
4、对流运动强烈。 5、中间层中上部,气体分子(O2、N2)开始电离。
(四)热层
从80km到约500km的高度
特点:
1、温度随高度增加迅速增高;
2、大气更为稀薄; 3、大部分空气分子被电离成为离子和自由 电子,又称电离层,可以反射无线电波
R为该物质的总质量去除速率;
O为该物质的总质量流出速率;
总的输出速率
2、主要组分分布
特点:
1、N2一直延伸到100km,最大浓度出现在50Km, N主要50-100km 2、O2主要在低于60km,O高于60km 3、CO2主要在低于50km,集中2km 4、水蒸汽主要在低于10km,集中6km
(二)大气组分的停留时间
ppm和mg/m3之间的换算(原因是有些大气污染 物的浓度是用ppm表示的,有些是用mg/m3表示
的)。
22.4 ppm mg / m3 M
例1:求在标准状态下,30mg/m3的氟化氢的ppm浓 度。 解:氟化氢的分子量为20,则:
c=30×22.4/20=33.6ppm
M mg / m ppm 22.4
第二章 大气环境化学
当前三大全球环境问题:气候变化、酸沉降、臭氧层损耗都发生在大气圈内
第一节 大气的结构、组成和性质 第二节 污染物在大气中的迁移 第三节 大气中污染物的转化 第四节 大气颗粒物
重点内容:
1、污染物在大气中的转化 1)光化学反应基础 2)自由基反应和来源 3) 氮氧化物和碳氢化合物、硫氧化合物的转化 2、几种代表性的大气环境污染问题 1)酸雨,光化学烟雾,硫酸烟雾型污染 2)温室效应 3)臭氧层破坏 3、大气颗粒物 1)粒径分布 2)三模态 3)化学组成
人为污染:有机化学溶剂挥发 天然污染:海洋
(四)卤代烃的来源和演变 2、氟氯烃类
1)危害
通式CnH2n-x-yFxCly 通式x+y≤2n+2,CFC
破坏臭氧层 CCl3F+hv Cl· +O3 ClO· +O 温室气体
· CCl2F+Cl· ClO· +O2 Cl· +O2
(四)卤代烃的来源和演变 2、氟氯烃类
当大气处于稳定态条件下时 P+I=R+M P+I
=
M R+O
(二)大气组分的停留时间
例如
含硫化合物在对流层的平均浓度为1µg/kg,而对 流层空气总质量为4×1021g。而硫的天然和人为源
总贡献为200×106t/a,求硫停留时间
S总质量M=4×1021 × 1µg/kg=4×106t
(三)含碳化合物的来源和演变
CO、CO2、CHx、含氧烃等
1、CO
1)危害
阻碍体内氧气输送 参与光化学烟雾形成
· OH + CO O2 + H· NO + HO2· CO2 + H· HO 2· +M
NO2+ · OH
温室气体,导致温室效应
(三)含碳化合物的来源和演变
CO、CO2、CHx、含氧烃等
3
例2、已知大气中二氧化硫的浓度为5ppm,求以
mg/m3表示的浓度值。 解:二氧化硫的分子量为64。 c =5×64/22.4mg/m3=14.3mg/m3
3、个数/cm3(超微量组分,HO· 、分子、原子)
一些自由基浓度为ppt级,经常用每立方厘米中的分子 个数来表示,这时可以有换算关系: 标态下(T=0℃,P=101.325Pa),n=1mol,V=22.4L
1、CO
4)浓度特征
城市多于非城市,一天中峰值出现在早晚交通 量大时 随高度、纬度变化(北高南低)
(三)含碳化合物的来源和演变
CO、CO2、CHx、含氧烃等
2、CO2
1)危害
温室气体,导致温室效应
2)来源
人为污染:矿物质燃料燃烧、森林破坏 天然污染:海洋脱气、甲烷转化、动植物呼吸、 腐败、森林火灾
CO (73-185)、 H2O (10)、 SO2 (2) 、NOx (10)
(三)大气组分浓度表示法
1、体积浓度表示法:一百万体积的空气中所
含污染物的体积数-ppm, ppb ,ppt
表示为10-6,10-9,10-12 2、质量浓度表示法:每立方米空气中所含污
染物的质量数-mg/m3,µg/m3
湍流:使污染物向各个方向扩散;
浓度梯度:使污染物发生质量扩散。 三种作用中风和湍流起主导作用。
2)摩擦层
H2O + · HS SO3
(二)含氮化合物的来源和演变
NO、NO2、N2O、NH3
1、 N2O
天然来源,土壤硝酸盐经细菌脱氮
NO3-+2H2+H+
1/2N2O + 5/2H2O
难溶于水,寿命长、稳定在低层大气中,但可 在平流层发生光解
N2O+hv
N2+O·N2O+ O· 2NO N2 O+ O·
n/V=2.46×1019个分子/cm3
