【环境化学】第2.2章 大气环境化学——第三节 大气中污染物的转化
《环境化学》课件第二章-2

稳定性: C2H5 > (CH3) 3CCH2 > CH2=CH > C6H5 和 CH3 > CF3 D/kJ· mol-1:410 415 431 435 435 443
2-7
《环境化学》 第二章 大气环境化学
(2)自由基的结构和活性 (Structure and Reactivity of Free Radicals) 卤原子夺氢的活性是:F•>Cl•>Br•
增长
终止
2-11
《环境化学》 第二章 大气环境化学
第三节
大气中污染物的转化
(2.3 Transformation of Atmospheric Pollutants)
一、自由基化学基础 (Chemical Foundation for Free Radicals) 二、光化学反应基础 (Foundation for Photochemical Reactions) 三、大气中重要自由基来源 (Source for Important Free Radicals in the
Atmosphere)
四、氮氧化物的转化 (Transformation of NOx) 五、碳氢化合物的转化 (Transformation of Hydrocarbons) 六、光化学烟雾 (Photochemical Smog) 七、硫氧化物的转化及硫酸烟雾型污染 (Transformation of
光化学过程 A* → B1 + B2 +… A* + C → D1 + D2 +… 光解,即激发 态物种解离成 为两个或两个 以上新物种。
2-14
A*与其他分子反应生成新的物种。
《环境化学》 第二章 大气环境化学
02-2环境化学第二章--大气环境化学

问题:理论计算表明,波长420nm光能够使水分子发生水解,这属于可见光 范畴,但实际上为什么大气对流层中的水分子并没有全部发生光解呢?
水不吸收420nm的光,其吸收峰在
红外波段5000-8000nm和大于20000nm
第7页,共28页。
2、光化学第二定律
H • +O2+M→HO2 • +M 2HO2• →H2O2+O2
第21页,共28页。
2. HNO3的离解
HO-NO2键能为199.4 kJ/mol,
HNO3的光解是大 气中OH自由基的
重要来源之一
能够使其断裂的光子波长为≤599nm
对120-335nm 的辐射有不同程度的吸收
HNO3 + h ν → HO·+NO2
➢ 根据光化学第一定律,若发生光分解反应,则需要:
ENA
hN A
即 h:c N
A
E0
hcN A
E0
第9页,共28页。
hcN A
E0
➢ 计算实例:若E0=300kJ/mol,
若E0=170kJ/mol,
若E0=160kJ/mol,
若E0=150kJ/mol,
则需要λ≤399nm;
则需要λ≤704nm; 则需要λ≤748nm; 则需要λ≤798nm。
第4页,共28页。
3)举例:
大气辉光(即大气在夜间的发光现象)
为什么植物能在常温下将光能转化为化学能贮存?
虽然太阳中的紫外线可以断裂很多高分子,为什么
是由一部分激发的OH•(自由基)引起的辐射跃迁
暴露于大气中的高分子材料并不在短时间内发生明
环境化学:第二章大气环境化学 3
-4
λ < 120 nm
N2 + hν
N+N
120 160 200 240
λ (nm)
图2-29 O2吸收光谱(R. A. Bailey, 1978)
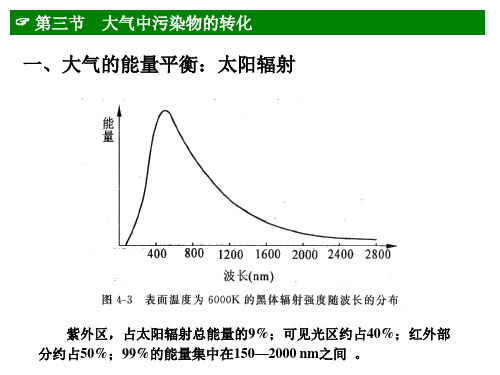
第三节 大气中污染物的转化
(2)臭氧的光离解
O + O2 + M 低碰于撞1反00应0 km的大气中,O3 + M
臭氧吸收1180 nm以下的光就可以离解,但主要 吸收290 nm以下的光,较长波长的光可以进入对流 层和地面。
A :B 能量 A+ + BA :B 能量 A·+B·
不对称裂解 对称裂解
自由基——由对称裂解生成的带单电子的原子或原子 团称为自由基。
第三节 大气中污染物的转化
2、自由基反应(free radical reaction)
凡是有自由基生成或由自由基诱发的反应都 叫做自由基反应。
CCl3F + hγ(175~220nm)
c. H2O2 + hν 2·OH
第三节 大气中污染物的转化
1、 HO 自由基的来源
HO最高含量出现在热带,因为那里温度高,太阳辐射强。
第三节 大气中污染物的转化
2、 HO2自由基的来源
a. 甲醛光解(主要来源):
HCHO + hν
H + HCO
H+O2 + M HCO+O2
HO2 + M HO2+CO
第三节 大气中污染物的转化
3、大气中重要吸光物质的光离解 4
(1) O2和N2的光离解
3
2
O2键能493.8KJ/mol。相
1
应波长为243nm。在紫外区 lgε
环境化学第2章大气环境化学-4-转化

③它是唯一能由天然源排放而造成大浓度的气体。大气中甲烷的主 要来源是由有机物的厌氧发酵过程产生的,原油及天然气的泄漏也会 向大气排放甲烷。
④甲烷温室效应要比CO2大20倍。近100年来大气中甲烷浓度上升了 一倍多。目前全球范围内甲烷浓度已达到1.65mL/m3。
多环芳烃通常以PAH表示。典型的芳香化合物如: 芳香烃广泛地应用于工业生产过程中,用来做溶剂、
原料。苯乙烯常用来做塑料的单体和合成橡胶的原料。 许多芳香烃在香烟的烟雾中存在,因此它们在室内含量
要高于室外。
★ 3.4.2碳氢化合物在大气中的反应
(1)烷烃的反应:烷烃可与大气中的HO·和O·发生H 摘除反应:
环己烷
1.2×104
117
如甲烷的氧化反应:
O·主要来自O3的光
解,CH4不断消耗
CH4 + HO·→ CH3·+ H2O O ·,可导致臭氧层
CH4 + O·→ CH3·+ HO·
的损耗
CH3·+ O2 → CH3O2·
·CH3O2是一种强氧化性的自由基,它可将NO氧化为NO2:
NO + CH3O2·→ NO2 + CH3O·
大气污染化学中的
②一氧化氮和二氧化氮(用NOX表示)
氮氧化物
天然来源:
主要是生物有机体腐败过程中微生物将有机氮转化成 为NO,NO继续被氧化成N2O。另外,有机体中的氨基 酸分解产生的氨也可被HO·氧化成为NOX。
NOx人为来源: 主要是矿物燃料的燃烧。
O2 ↔ ·O + ·O ·O + N2 → NO + ·N ·N + O2 → NO + ·O 2NO + O2 → 2NO2 反应慢,因此NO2含量很少。 城市大气中的NOX主要来自汽车尾气和一些固定排放源。矿物 燃料燃烧过程中所产生的NOX,以NO为主,通常占90%以上, 其余为NO2。
环境化学第2章大气环境化学-5-转化..

大气中SO2的转化首先是SO2氧化成SO3,随后被水
吸收生成硫酸,从而形成酸雨或硫酸烟雾。硫酸与大
气中的NH4+等阳离子结合生成硫酸盐气溶胶。
1)SO2的直接光氧化
SO2 + hv(290~340nm)→1SO2(单重态) SO2 + hv(340~400nm)→3SO2(三重态) 能量较高的单重态分子可按以下过程跃迁到三重态或基态 :
第三节 大气中污染物的转化
3.5 光化学烟雾
3.6 硫氧化物的转化及硫酸烟雾型污染 3.7 大气颗粒物
思考题:
1. 说明光化学烟雾现象,解释污染物与产物的日变 化曲线,并说明光化学烟雾产物的性质与特征。 2. 说明烃类在光化学烟雾形成过程中的重要作用和
有机物在光化学反应中活性顺序。
3. 简述SO2氧化的几种途径。
修正的亨利系数 : K S1 K S1 K S 2 K K H [1 ] 2 [H ] [H ]
* H
* [S(Ⅳ) ]= K H pSO2
三种形态S(Ⅳ)的摩尔分数与pH之间的关系为: 低pH
α0 K K s1 K s2 -1 SO2 H 2O [1 s1 ] C总 [H ] [H ]2
措施: ①在洛杉矶市出售的汽车必须是“清洁的”,要求94年后
出售的汽车全部安装“行驶诊断系统”,即时监测机动车
的工作状态,让超标车辆即时脱离排污状态和接受维修。 ② 鼓励人们乘公共汽车上班,以减少汽车尾气。 ③是世界上利用风能和太阳能发电最多的地方,在替代清 洁燃料的研究方面也处于领先地位。政府通过低息贷款和 补贴的方式鼓励人们尝试使用清洁燃料汽车。
HO·+ SO2→ HOSO2 · (控速)
大气环境化学大气中污染物的转化

大气环境是人类生存的基础,提供氧 气、调节气候等重要功能。
生态系统平衡的维护
大气环境是生态系统中不可或缺的一 部分,对维持生态平衡起着重要作用 。
大气污染物的来源和影响
工业排放
工业生产过程中产生的废气、烟尘 等是大气污染物的主要来源之一, 对环境和人体健康造成严重影响。
交通运输
汽车、飞机等交通工具排放的尾气 是大气污染物的重要来源,包括一 氧化碳、氮氧化物等有害物质。
限制机动车尾气排放
加强机动车尾气排放标准,推广新能源汽车,鼓励公共交通出行, 减少私家车使用。
控制生活污染源
提倡绿色生活方式,减少一次性塑料制品的使用,加强垃圾分类和 资源回收利用。
改善能源结构
增加清洁能源比重
大力发展太阳能、风能、水能等 可再生能源,逐步减少对化石能
源的依赖。
提高能源利用效率
推广节能技术和设备,加强能源管 理和监测,减少能源浪费。
包括水溶性离子、痕量元 素、碳元素等,这些组分 决定了颗粒物的物理和化 学性质。
PART 03
大气中污染物的转化过程
REPORTING
WENKU DESIGN
光化学转化
光化学转化是指大气中的污染物在阳 光的作用下,通过吸收光能发生化学 反应,从而改变其化学性质的过程。
光化学转化在大气污染物的转化中起着 重要的作用,特别是对于一些持久性有 机污染物,如多环芳烃和二噁英等。
PART 06
结论
REPORTING
WENKU DESIGN
大气环境化学的重要性和挑战
重要性
大气环境化学研究污染物在大气中的迁移、转化、归宿和影响,对于环境保护和 人类健康具有重要意义。
挑战
大气环境化学第四节讲

HO2•为氧化剂:HO2• +NO→NO2+HO• RO2 •过氧烷基为氧化剂:RO2• +NO→NO2+RO• RC(O)O2 •过氧酰基为氧化剂:RC(O)O2• +NO→NO2+RC(O)O• HO• +NO→HNO2(很容易被光解)
RO• +NO→RONO(很容易被光解)
《环境化学》第二章 大气环境化学
1 根据
NO2 +hv → NO + O•
k1
说明大气中不
O• +O2 +M → O3 + M
O3 +NO → NO2 +O2 可能同时得到高浓度的O3和NO?
k3
k2
2、某次光化学烟雾事件中,上午11:30达到稳态,此时测得 [NO2]=0.03mg/m3, [NO]=0.01mg/m3,若k1=9×10-3秒-1, k3=3.2×10-17cm3/(个· 秒)。求此时体系中[O3](提示: 注意单位换算,仅考虑光线照射NO2 、NO与空气的混合 体系上)。
一、自由基化学基础 二、光化学反应基础 三、大气中重要自由基来源 四、氮氧化物的转化 五、碳氢化合物的转化 六、光化学烟雾 七、硫氧化物的转化及硫酸烟雾型污染 八、酸性降水 九、温室气体和温室效应 十、臭氧层的形成与损耗
Company name
《环境化学》第二章 大气环境化学
思考题
大气中。
相比较而言,开放程度大的链烯烃活性高于较为封闭 的环烯烃,含有氧原子的碳氢化物活性高于链烷烃。
《环境化学》第二章 大气环境化学
1 烷烃的反应
A: 与HO∙反应
RH+HO• →R• +H2O (例如:CH4+HO• →CH3• +H2O,反应速度快 RH+O• →R• +HO• (例如:CH4+O• →CH3• +HO•,反应速度慢 R• + O2 → ROO• (例如: CH3• + O2 → CH3OO•) ROO• +NO → NO2 + RO• (例如: CH3OO•+NO →NO2 +CH3O•) RO•+ NO2 →RONO2(例如: CH3O•+ NO2→CH3ONO2) RO•+O2 →HO2 • +醛(或酮)(烷氧基被氧气摘氢生成醛和过氧羟基 例如:CH3O•+O2→ HO2• +H2CO)
第二章大气环境化学(3)

第⼆章⼤⽓环境化学(3)第⼆章⼤⽓环境化学(3)第三节⼤⽓中污染物的转化⼆、光化学反应基础1、光化学反应⼀个原⼦、分⼦、⾃由基或离⼦吸收⼀个光⼦所引发的反应,称为光化学反应。
光化学反应的起始反应(初级过程)是:A + hν→A* (2-1)式中A*为A的激发态,激发态物种A*进⼀步发⽣下列各种过程。
光解(离)过程:A* → B1 + B2+…(2-2)直接反应:A* + B → C1+C2+… (2-3)辐射跃迁:A* → A + hν(荧光、磷光) (2-4)⽆辐射跃迁(碰撞失活):A* + M → A+M (2-5)其中(2-2)、(2-3)为光化学过程,(2-4)、(2-5)为光物理过程。
对于⼤⽓环境化学来说,光化学过程最重要的是受激分⼦会在激发态通过反应⽽产⽣新的物种。
初级光化学过程包括光解离过程、分⼦内重排等。
分⼦吸收光后可解离产⽣原⼦、⾃由基等,它们可通过次级过程进⾏热反应;光解产⽣的⾃由基及原⼦往往是⼤⽓中·OH、HO2·和RO·等的重要来源;对流层和平流层⼤⽓中的主要化学反应都与这些⾃由基或原⼦的反应有关。
次级过程是指初级过程中反应物、⽣成物之间进⼀步发⽣的反应。
例如,H2和Cl2混合物光解,发⽣链式反应:Cl2 + hν→2Cl·Cl· + H2→HCl + H·H· + Cl2→HCl + Cl·2Cl·→Cl22、光化学定律1)格鲁塞斯(Grotthus)与德雷伯(Drapper)提出了光化学第⼀定律:只有被分⼦吸收的光,才能有效地引起分⼦的化学变化。
2)爱因斯坦(Einstein)光化学第⼆定律:在光化学反应的初级过程中,被活化的分⼦数(或原⼦数)等于吸收光的量⼦数,或者说分⼦对光的吸收是单光⼦过程,即光化学反应的初级过程是由分⼦吸收光⼦开始的。
E=hν=hC/λE = hνN0 = N0hC/λ式中:λ为光量⼦的波长;h为普朗克常数,6.626×10-34J·s/光量⼦;C为光速,2.9979×1010 cm/s;N0为阿伏加德罗常数,6.022×1023/mol;代⼊上式得:E= 119.62 ×106/λ若λ=300 nm, E=398.7 kJ/mol ;λ=700 nm, E=170.9 kJ/mol 。
环境化学-2.2 大气中污染物的转化

NO2的键能为300.5 kJ/mol,在 大气中活泼,易参加许多光化学反应, 是城市大气中重要的吸光物质,在低 层大气中可以吸收全部来自太阳的紫 外光和部分可见光,在 290-400nm 范围内有连续光谱,在对流层大气中 具有实际意义。
(图2-31)
NO2 h NO O 420 nm
控制臭氧的浓度 NOX、RH(碳氢化合物,氮 氧化合物)的初始浓度大小,影 响O3的生成量和生成速度。
NOX可以溶于大气的水相中,构成液相 平衡体系。 NOX的液相平衡
NO ( g ) NO ( aq) NO2 ( g ) NO2 (aq)
2NO2 (aq) 2H NO2 NO3
NO(aq) NO2 (aq) 2H 2NO2
烷烃与自由基的反应:
见后面光化学烟NO2活泼,是大气主要污染物之 一,也是大气中O3的人为来源。
NO2在阳光下与OH•、 O3等反应
OH NO2 M HNO3
K 1.6 10
11
这是污染大气中气态HNO3的 主要来源,同时也对酸雨和酸雾 的形成起重要作用。气态HNO3 在大气中难以光解,湿沉降是其 在大气中去除的主要过程。
初级过程
H HOC H 2 CO 2H M H 2 M 2 HCO 2CO H 2
次级过程
对流层中由于有O2的存在,可进一步反 应: H O HO H O HO
2 2
2
2
醛类光解是过氧自由基的主要来源
卤代甲烷的光解最有代表性,对大
气 污染的化学作用最大,CH3X光解的初 级 过程如下: CH 3 X h CH 3 X 卤代甲烷在近紫外光的照射下离解:
第二章.环境化学-第3节(2)

1、大气中的含氮化合物
主要含氮污染物:N2O、NO、NO2、NH3、HNO2、HNO3、 亚硝酸酯、硝酸酯、亚硝酸盐、硝酸盐、铵盐等。
N2O: 简介:无色气体,清洁空气组分,低层大气中含量最高的 含氮化合物。 天然源:环境中的含氮化合物在微生物作用下分解而产生 的,是其主要来源。 人为源:土壤中含氮化肥经微生物分解可产生。
4.NOx 的液相转化 (1)NOx 的液相平衡。NO和NO2在气液两相间 的关系为: NO(g) NO(aq) NO2(g) NO2(aq) 溶于水中的NO(aq)和NO2(aq)可通过如 下方式进行反应: 2 NO2( aq ) 2H+ +NO2- +NO3NO(aq)+ NO2( aq ) 2H+ +2NO2-
3、氮氧化物的气相转化
C、过氧乙酰硝酸酯 PAN( peroxyacyl nitrates) PAN 是由乙酰基与空气中的氧气结合形成过氧乙酰基,然后再 与NO2 化合生成化合物。 O CH3CO· + O2 → CH3COO· O O CH3COO· + NO2 → CH3COONO2
乙酰基来源:
另外,稳态时:d [ NO2 ]
dt
k1 [ NO ] k 3 [O3 ][NO ]
=0,
所以
[O3 ]
k1 [ NO2 ] k 3 [ NO ]
(所以[O3]也随[NO2]呈正比例变化) (2) (3)
因为体系中总氮是守恒的,因此有
[ NO] [ NO2 ] [ NO]0 [ NO2 ]0
甲烷的氧化反应 CH4+HO· CH3·+H2O CH4+O· CH3·+HO· CH3·+O2 CH3O2· 大气中的O· 主要来自O3的光解,通过上述 反应,CH4不断消耗O·,可导致臭氧层的损耗, 同时,CH3O2· 是一种强氧化性自由基,可发 生如下反应: NO+ CH3O2· NO2 + CH3O· CH3O·+ NO2 CH3O NO2 CH3O·+ O2 HO2·+H2CO
【环境化学】第2.2章 大气环境化学——第三节 大气中污染物的转化

2019/9/15
3
3.1 自由基化学基础(自学)
自由基:由于共价键均裂而生成的带有未成对电子的碎片,活性 很高。
自由基活性的体现:氧化性
自然界排入大气的大多数微量气体都是还原态的,如CO、H2S、 NH3、CH4等,但从大气中经过干沉降或降水过程而带回地表 的物质却常常是氧化态的,如CO2、H2SO4、HNO3、HCHO等。
光离解成两种或两种以上新物种 与C反应生成新物种
2019/9/15
14
第二章 大气环境化学 /第三节 大气污染物的转化 / 3.2光化学反应基础
3.2.2 光化学反应过程
初级过程(续) 环境化学中,光化学过程对于描述大气污染物在光作
用下的转化规律更有意义。 关注内容:
(1)激发态物种解离条件 (2)激发态物种与什么物种反应可产生新物种。
名称 马斯河谷烟雾事件 洛杉矶光化学烟雾事件
多诺拉烟雾事件 伦敦烟雾事件 水俣病事件 骨痛病事件 四日哮喘事件 米糠油事件
时间及地点
中毒事件
原因
1932年 比利时马斯河谷
咳嗽、流泪、喉痛、恶心、呕吐, SO2转化为SO3,
数千人发病、60死亡
进入肺部
1943年 美国洛杉矶
刺激眼、喉和鼻,大多数居民患病, NOx和VOCs转化
3.2.3 光化学反应定律
光化学第一定律(Grotthus-Draper,1817,格罗杜斯和德拉波定律) 定律:只有分子吸收的光,才能引起分子的化学反应
解释:
光子的能量 > 化学键能时,才能引起光化学反应; 不是大于该分子化学键能的光子都能引起该分子发生光化学反应。
分子基态与激发态能量是不连续的,受激分子从基态激发到激发 态所需的能量要与光子的能量相匹配。分子对某特定波长的光要 有特征吸收光谱,才能发生光化学反应。
第二章-大气环境化学-大气中污染物质的转化-2016

一、自由基化学基础
2、自由基的结构和性质的关系 自由基稳定性: 烷基自由基稳定性:叔>仲>伯 共轭体系使自由基稳定性增加。
3、自由基反应
自由基反应分类: 单分子自由基反应(裂解、重排): RC(O)O2·+ NO RC(O)O·+ NO2 RC(O)O· R·+ CO2
自由基-分子相互作用(加成、取代): HO·+ CH2=CH2 HOCH2 - CH2·
O
CH3CO ·+O2 CH3COO ·
O
CH3COO ·+NO2
O
CH3COO NO2
乙醛的来源:
C2H6 +HO ·
C 2H 5 · +O2
C 2H 5 · + H 2O
C2H5 O2 ·
C2H5 O2 · +NO
C2H5 O ·+ O2
C2H5 O ·+ NO2
CH3CHO + HO2
五、碳氢化合物的转化
臭氧的光离解 臭氧分子的离解:
键能为 101.2 kJ/mol
O3+ h ν
O· + O2 (波长<1180nm)
臭氧分子的合成: O· + O2+ M
O3+ M
NO2 的光离解 NO2 + h ν 键能为 300.5 O· + O2+ M
kJ/mol
NO+O· O3 + M
亚硝酸和硝酸的光离解 1. HNO2 的离解 HO-NO键能为201.1 kJ/mol H-ONO键能为324.0 kJ/mol 初级过程: HNO2 +h ν HO· +NO 或 HNO2 +h ν H· +NO2 次级过程: HO ·+NO HNO2 HO ·+ HNO2 H2O + NO2 HO· + NO2 HNO3
《环境化学》课件第二章-3

NO → NO2 不 需要 O3 参与也 能发生,导致 O3 积累
O3 积累过程导致 许多羟基自由基 的产生
NO和烃类化合物 耗尽
2-7
《环境化学》 第二章 大气环境化学
hν
[O]
[O]
[O] [O]
Generalized scheme for the formation of photochemical smog
图 EKMA方法中的O3等体积分数曲线 (唐孝炎,1990) 0 RH
K
0 NO x
2-10
《环境化学》 第二章 大气环境化学
B.O3 的控制
当[RH]0/[NOx]0 高时,[NOx]0少, O3的生成受[NOx]0的影响明显; [RH]0/[NOx]0 低时,[NOx]0高, O3的生成受[NOx]0的影响不明显;
Oxysulfides and Sulfuric Acid Smog)
八、酸性降水 (Acid Precipitation) 九、温室效应 (Greenhouse Effect) 十、臭氧层的形成与耗损(Formation and Depletion of Ozone Layer)
2-13
《环境化学》 第二章 大气环境化学
Oxysulfides and Sulfuric Acid Smog)
八、酸性降水 (Acid Precipitation) 九、温室效应 (Greenhouse Effect) 十、臭氧层的形成与耗损(Formation and Depletion of Ozone Layer)
2-1
《环境化学》 第二章 大气环境化学
2-4
《环境化学》 第二章 大气环境化学
B. 日变化曲线
第二章 大气环境化学(&3)

HNO2 + hv → HO • + NO
另一个初级反应为:
HNO2 + hv → H • + NO2
次级反应为:
HO • + NO → HNO2 HO • + HNO2 → H 2O + NO2 HO • + NO2 → HNO3
(2-15)为初级过程,(2-16)和(2-17)为 次级过程
光化学第一定律(Grotthus 和Drapper)
只有激发态分子的能量足够使分子内的化学键 断裂时,即光子的能量大于化学键的能量,才 能引起光解反应; 特定波长的光必须被做作用的分子吸收才能是 分子产生有效的光化学反应。
光化学第二定律(Einstein)
NO2 + NO3 ⇔ N 2O5
(3)过氧乙酰基硝酸酯(PAN)
CH 3CHO + hv → CH 3CO + H •
CH 3CO + O2 → CH 3C (O )OO • CH 3C (O )OO + NO2 → CH 3C (O )OONO2 ( PAN )
3、NOx的液相转化
(1)NOx的液相平衡
2、大气中HO·和HO2 ·的来源
清洁空气中 O3 的光离解是大气中HO的主要来 源:
O3 + hν → O • +O2
O • + H 2O → 2 HO •
污染大气中 HNO2 和 H2O2 的光离解:
HNO2 + hv → HO • + NO H 2O2 + hv → 2 HO •
环境化学第2章大气环境化学-3-转化.

在光化学反应的初级过程中,被活化的分子数(或原子数) 等于吸收光的量子数,或者说分子对光的吸收是单光子过程, 即光化学反应的初级过程是由分子吸收光子开始的。
(3)光量子能量与化学键之间的关系
Einstein公式:
E hv
hc
λ:光量子波长nm=10-9m ; h:普朗克常数, 6.626×10-34J.s c:光速,3×108m/s
400KJ/mol 的键能,理论上可以断裂许多化合键,或
引发老化-氧化过程,例如一些高聚物的光敏波长,聚
氯乙烯(塑料, 320nm ),聚丙烯( 300nm ),聚苯 乙烯(318nm)。
例题:
计算λ=300nm的光子能量,相当于物质分子在 什么温度下的平均动能? (提示:温度与能量的关系方程:波尔茨曼方 程E=3KT/2,K波尔茨曼常数=1.38×10-23J/K, T开氏温度)。
H2CO + hv→H· + HCO·
H2CO + hv→CO+H2 次级过程有:
H·+ HCO·→H2 + CO
2H·+ M→H2 + M
2HCO·→2CO+H2
在对流层中,由于O2存在,可发生如下反应: H·+ O2→ HO2 · HCO ·+ O2→ HO2 ·+ CO 因此空气中甲醛光解可产生HO2 · 自由基。其他醛类的光解也 可以同样方式生成HO2 · ,如乙醛光解: CH3CHO + hv →H· + CH3CO ·
分子的化学键能越大,需要光子的波长越短。
上次课主要知识点
大气中的主要污染物 污染物的迁移 (逆温、大气稳定度、影响迁移的因素) 光化学反应
本次课主要内容: 大气中主要吸光物质的光解、主要自由基 氮氧、碳氢化合物的转化
第二章-大气环境化学-大气中污染物质的转化-2016

2. HNO3的离解 HNO3 + hν 若有CO存在: HO· +CO H· +O2 +M 2 H O2 ·
HO-NO2键能为 199.4 kJ/mol
HO·+NO2
CO2 + H · H O2· +M H2 O2 +O2
二氧化硫对光的吸收 SO2 + h ν
SO2*
键能为545.1 kJ/mol
光量子能量与化学键之间的对应关 系:
通常波长大于700nm(红外线)的光不能 引起光化学离解。
3.大气中重要的吸光物质的光离解 氧分子和氮分子的光离解
键能为 939.4 kJ/mol
键能为 493.8 kJ/mol
N2+hν O2+hν
N· +N· O· +O·
(波长<243nm) (波长<127nm)
R·
O2
RO2
+ ·
NO
氧化
NO2 + RO ·
甲烷的氧化反应
CH4+HO · CH3 · +H2O
CH4+ O ·
CH3 · +O2
CH3 · +HO ·
CH3O2 ·
大气中的O · 主要来自O3的光解,通过上述反应, CH4不断消耗O ·,可导致臭氧层的损耗,同时可发 生如下反应:
NO+ CH3O2 ·
若NO浓度高时,会伴随如下反应: NO+O3 NO2+O2 NO+NO3 2NO2 NO3与烷烃的反应速度很慢: RH+NO3 R ·+HNO3 这是城市夜间HNO3的主要来源。
这是城市夜 间HNO3 的主要来 源。
大气环境化学大气中污染物的转化

烃类自由基的稳定性取决于连接在具有未成对电子碳原子 上的烷基数目,按叔>仲 伯 上的烷基数目,按叔 仲>伯 共轭效应增稳定
2)自由基结构和活性的关系 )
自由自夺去一价原子, 自由自夺去一价原子,实际就是夺氢或卤素 烷烃的氯代反应中, 进攻的活性按叔>仲 伯 烷烃的氯代反应中,被CL·进攻的活性按叔 仲>伯 进攻的活性按叔 卤原子夺氢的活性按F·> CL·> Br· 卤原子夺氢的活性按 氯或溴与烯烃通常加成反应 分子中官能团增加其形成的自由基活性 H-CH2CN D=360KJ/mol H-CH2OH D=385KJ/mol H-CH2CH3 D=410KJ/mol
•
•
H•
H•
•
•
•
•
3)自由基活性大,反应性强,不论液相、气相均能反应,且产物 )自由基活性大,反应性强,不论液相、气相均能反应, 常为另一个自由基,因此又能引发后续反应, 常为另一个自由基,因此又能引发后续反应,所以也称 自由基反应为自由基链锁反应 4)通过另一个自由基反应使链终止,如: )通过另一个自由基反应使链终止,
dt
2、体系中O2是大量存在的,M是不变的,因此 、体系中 是大量存在的, 是不变的 是不变的, [O2]、[M]可以看作常数。此时还有变量 可以看作常数。 、 可以看作常数 此时还有变量[NO]、[ 、 NO2]、[O]、[O3]。同样 、 、 。 有: d[O]
dt = k1[NO ] − k2[O][O2 ][M] 2
三、大气中重要自由基的来源(重点) 大气中重要自由基的来源(重点) 共价键断裂时,有两种可能形式:共价异裂和共价均裂; 共价键断裂时,有两种可能形式:共价异裂和共价均裂;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初级过程(续)
激发态物种后续过程:
• 光物理过程:
A* → A+hv 辐射跃迁荧光(fluorescence)或磷光(phosphorescence)
咳嗽、喉痛、胸闷、呕吐和腹泻,5 天内4000人死亡
口齿不清、面部痴呆、全身麻木、 精神失常,死亡50人
粉尘中Fe2O3使 SO2转化为硫酸盐 食用含甲基汞的鱼
关节痛、骨骼软化萎缩,自然骨折, 食用含镉废水灌溉
患者280人,死亡34人
的“镉米”和水
支气管炎、肺气肿,500多人患病, 死亡36人
眼皮肿、出汗、全身疙瘩、恶心、 呕吐,患者5000人、死亡16人
2019/9/15
8
第二章 大气环境化学 /1 光化学反应基本知识
光子的能量和引发化学反应的波长
ε= hv = hc/λ (爱因斯坦方程) h -普朗克常数,6.626×10-34J·s/光子
ν- 光的频率;
c -光速,2.998×1017nm/s
2019/9/15
3
3.1 自由基化学基础(自学)
自由基:由于共价键均裂而生成的带有未成对电子的碎片,活性 很高。
自由基活性的体现:氧化性
自然界排入大气的大多数微量气体都是还原态的,如CO、H2S、 NH3、CH4等,但从大气中经过干沉降或降水过程而带回地表 的物质却常常是氧化态的,如CO2、H2SO4、HNO3、HCHO等。
第三节 大气污染物的转化
3.1 自由基化学基础(自学)
3.2 光化学反应基础
3.2.1光化学反应基本知识
3.2.2 光化学反应过程
3.2.3 光化学反应定律 3.2.4 大气中重要吸光物质
3.3 大气中重要自由基的来源
2019/9/15
12
第二章 大气环境化学 /第三节 大气污染物的转化 / 3.2光化学反应基础
第二章 大气环境化学
第三节 大气中污染物的转化
污染物的迁移:物理过程,空间分布发生变化,化学 组成不变。
污染物的转化:化学反应(如:光解、氧化还原、酸 碱中和、聚合等反应),转化成为无毒物质,从而去 除了污染;或者转化成为毒性更大的污染物,加重了 污染。
2019/9/15
1
20世纪30~60年代世界重大污染事件
名称 马斯河谷烟雾事件 洛杉矶光化学烟雾事件
多诺拉烟雾事件 伦敦烟雾事件 水俣病事件 骨痛病事件 四日哮喘事件 米糠油事件
时间及地点
中毒事件
原因
1932年 比利时马斯河谷
咳嗽、流泪、喉痛、恶心、呕吐, SO2转化为SO3,
数千人发病、60死亡
进入肺部
1943年 美国洛杉矶
刺激眼、喉和鼻,大多数居民患病, NOx和VOCs转化
第三节 大气污染物的转化
3.1 自由基化学基础(自学)
3.2 光化学反应基础
3.2.1光化学反应基本知识
3.2.2 光化学反应过程 3.2.3 光化学反应定律 3.2.4 大气中重要吸光物质
3.3 大气中重要自由基的来源
2019/9/15
7
第二章 大气环境化学 /第三节 大气污染物的转化 / 3.2光化学反应基础
在常温常压下,氧并不能将这些还原态气体氧化。20世纪初, 人们曾认为它是被O3、H2O2所氧化,近20年多来的研究表明, 主要起氧化作用的是自由基。
2019/9/15
4
3.1 自由基化学基础(自学)
大气中重要自由基
HO·(羟基自由基) HO2·(氢过氧自由基) R·(烷基自由基) RO·(烷氧自由基) RO2·(过氧烷基自由基)
有毒重金属微粒及 SO2
食用多氯联苯的米 糠所致
2019/9/15
2
第二章 大气环境化学
第三节 大气污染物的转化
3.1 自由基化学基础(自学)
3.2 光化学反应基础
3.2.1 光化学反应基本知识 3.2.2 光化学反应过程 3.2.3 光化学反应定律 3.2.4 大气中重要吸光物质
3.3 大气中重要自由基的来源
3.2.1 光化学反应基本知识
光化学反应定义
定义:分子、原子、自由基或离子吸收光子而发生的化学反应, 称为光化学反应。
解释
物种吸收光能,激发到高能态,然后激发态物种进行化学反应过程; 光是一种电磁辐射,具有波动和微粒的二重性,光化学反应既与电磁
辐射有关,又与物质的相互作用有关,所以光化学处于物理和化学的 交叉。
65岁老人400余人死亡
为O3等氧化性物质
1943年 美国多诺拉
1952年 英国伦敦
1953年 日本九州熊本水俣镇
1955-1972年 日本富山县
1955年以来 日本四日市
1968年 日本就州等23个府县
咳嗽、喉痛、胸闷、呕吐和腹泻,4 SO2和烟尘、硫酸
天内约6000人患病,17人死亡
盐,吸入肺部
2019/9/15
5
3.1 自由基化学基础(自学)
自由基反应特点
与热化学反应区别大 气相和液相中相似 酸碱和极性的改变不产生影响
自由基反应主要类型
单分子自由基反应 自由基-分子相互作用:加成和取代 自由基-自由基相互作用 自由基链反应
2019/9/15
6
第二章 大气环境化学
λ-波长,nm
2019/9/15
9
第二章 大气环境化学 /第三节 大气污染物的转化 / 3.2光化学反应基础
3.2.1 光化学反应基本知识
3.2
光化学反 应
基础
• 光子的能量和引发化学反应的波长(续)
波长 < 100nm 的光子能量很高,可引起分子、原子的放射蜕 变或衰变,属于放射化学范畴,而不属于一般的光化学范畴;
3.2.2 光化学反应过程
初级过程
定义:化学物质吸收光量子形成激发态物种以及激发 态物种随后发生的过程。
激发过程:
A+hv → A* hv-光量子 A*-物种A的激发态/活化分子 (excited state)
2019/9/15
13
第二章 大气环境化学 /第三节 大气污染物的转化 / 3.2光化学反应基础
波长 > 800nm 的光子能量太低(近红外光:800~ 30000nm ),不能引发光化学反应,而只能使分子转动或增 加振动能,最终又以热的形式损失掉。
发生光化学反应所对应光的范围一般包括100~800nm(可见光 400~800nm,紫外光150~400nm)。
2019/9/15
10
第二章 大气环境化学
