高三化学选修三离子晶体知识点(人教版)
人教版化学选修三第三章第四节 离子晶体课件16ppt
CsCl的晶体结构及晶胞构示意图
---Cs+ ---Cl-
Cs+周围距离最近的Cl-有 8 个, Cl-周围最近的Cs+有 8 个 这几个Cs+ 在空间构成的几何构型 立方体。
Cs+周围距离最近的Cs+有 6 个, Cl-周围最近的Cl- 有 6 个
(4)ZnS型晶胞
①阳离子的配位数:4 ②阴离子的配位数:4 ③一个ZnS晶胞中含: 4个Zn2+和4个S2-
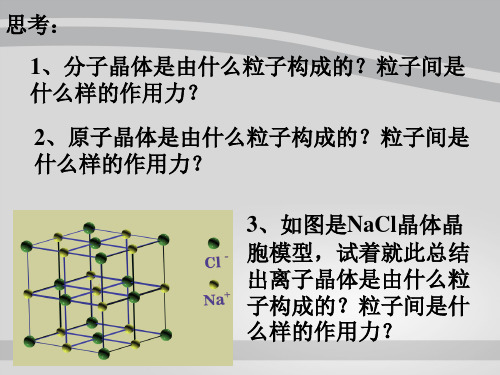
思考:
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
6
6
CsCl
8
8
NaCl、 CsCl两种离子晶体中阳离子和阴离子 的配位数不相等,所以晶体结构是不同的
• 你认为是什么因素决定了离子晶体中离子 的配位数?
2、构成粒子:阴、阳离子 3、相互作用力:离子键(静电作用)
4、离子晶体的结构特征:
(1)、离子键没有饱和性和方向性,在晶体 中阴阳离子尽可能采取最密堆积
(2)、离子晶体中不存在单独的分子,化学 式代表阴阳离子最简个数比
5、常见的离子晶体:
强碱 NaOH Ba(OH)2等 大多数的盐 BeCl2 AlCl3除外 活泼金属氧化物 Na2O CaO MgO等
思考:
1、分子晶体是由什么粒子构成的?粒子间是 什么样的作用力?
2、原子晶体是由什么粒子构成的?粒子间是 什么样的作用力?
3、如图是NaCl晶体晶 胞模型,试着就此总结 出离子晶体是由什么粒 子构成的?粒子间是什 么样的作用力?
第四节、离子晶体
一、离子晶体
1、定义:由阳离子和阴离子通过离 子键结合而成的晶体。
③一个CaF2晶胞中平 均含:
高中化学选修3人教版离子晶体课件
一般易溶于水,而难溶于非极性溶剂。 (4) 导电性
固态不导电,水溶液或者熔融状态下能导电。
高中化学选修3人教版离子晶体课件
高中化学选修3人教版离子晶体课件
问题1、常见的离子晶体结构有
哪些类型呢?
NaCl
高中化学选修3人教版离子晶体课件
CsCl CaF2
高中化学选修3人教版离子晶体课件
球形对称的,它们在空间各个方向上的静电作用 相同,都可以和带不同电荷的离子发生作用 • 没有饱和性:
在静电作用能达到的范围内,只要空间条 件允许,一个离子可以多个离子发生作用
学习目标
• 1、掌握离子晶体的概念,能识别常见 的晶胞。
• 2、掌握离子晶体结构是由什么因素决 定
• 3、掌握离子晶体熔沸点与晶格能大小 的关系
晶格能是离子晶体中离子键强度大 小的一个量度。
晶格能的大小与离子带电量成正比, 与离子半径成反比.
课堂小结
• 常见三种离子晶体的结构及阴阳离子配位 数
• 离子晶体结构的影响因素:几何因素、电 荷因素
• 晶格能的大小判断及对物理性质的影响
高中化学选修3人教版离子晶体课件
(2)电荷因素: 晶体中正负离子的电荷比 像CaF2这样正负离子不同的离子晶体, 正负离子的配位数肯定不同。
问题9、离子晶体具有哪些物理性质
呢? 1、一般易溶于水,而难溶于非极性剂。
2、固态不导电,水溶液或者熔融状态
下能导电。
3、熔点较高,硬度较大,难挥发难缩
NaCl CsCl
什么是配位数?
一个离子周围最邻近的异电性离子的数目。 离子晶体的化学式能不能代表分子组成?
×
高中化学选修3人教版离子晶体课件
人教版高中化学选修三 3.4 离子晶体 课堂课件

一、离子晶体
1、定义 离子间通过离子键结合而成的晶体 微粒:离子 作用力:离子键
2、常见的离子晶体 强碱、部分金属氧化物、大部分盐类
3、离子晶体中的离子配位数 (C.N.) 离子周围最邻近的异电性离子的数目
2Na + Cl2 == 2NaCl
Na
+11
+17
Cl
Na+
+11
、几种典型离子晶体的结构
分析思考: 1、Na+配位数? Cl-配位数?
66
NaCl晶体中阴、阳离子配位数
分析思考: 2、NaCl晶体中每个Cl-周围最近且 等距离的Cl-有几个?每个Na+周围
最近且等距离的Na+有几个 12
4、几种典型离子晶体的结构
分析思考:
1、Cs+配位数?8
Cl-配位数? 8
C.液溴的汽化和钠的熔化
D.HCl和NaCl溶于水
3、下面图像是从NaCl或CsCl晶体结构
图中分割出来的部分结构图,试判断
属于NaCl晶体结构的是( C
)
(1)
(2)
(3)
A.①和③ C.①和④
(4)
B.②和③ D.只有①
二、晶格能
1、定义: 气态离子形成1mol离子晶体时释放的能量 常取正值,单位:kJ/mol
AB型离子晶体的晶格能
NaF NaCl NaBr
离子
电荷 1 1
1
晶格能
kJ/mol 923 786 747
NaI MgO CaO SrO BaO
1 222 2 704 3791 3401 3223 3054
2、影响晶格能大小的因素 ⑴ 离子的电荷数 相同类型的离子晶体,离子电荷越大, 晶格能越大 ⑵ 离子的核间距 离子电荷数相同的同类型的离子晶体, 离子核间距越小,晶格能越大
【人教版】高中化学选修3知识点总结

第一章原子结构与性质一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。
说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。
也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。
(2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。
比如,p3的轨道式为或,而不是。
洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
4. 基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s22s22p63s23p64s1。
人教高中化学选修3第三章晶体结构与性质知识点填空

人教高中化学选修3第三章晶体结构与性质知识点填空晶体是指具有一定空间有序性的固体物质,是由经过长程有序排列的原子、离子或分子组成的。
晶体结构与性质是化学选修3第三章的内容,下面将对该章的主要知识点进行填空。
1.晶体的结构主要包括(1)晶格、(2)晶胞、(3)晶体结构。
(1)晶格是指由无限多几何平面上的点构成的集合,三维空间中的晶格是无穷多平行平面上点的无限点阵。
晶格可以分为能量、距离和方向三种类型。
(2)晶胞是晶格的最小单元,具有对称性。
晶胞由晶体中的原子、离子或分子排列成一定的几何形状,一般为立方体、四方体或其他形状。
(3)晶体结构是指晶体中原子、离子或分子组成的排列方式。
晶体结构可以分为离子晶体结构、原子晶体结构和分子晶体结构三类。
2.离子晶体结构是指晶体由离子形成的结构。
离子晶体的特点是离子之间的相互作用力强,有规则的排列方式。
离子晶体可以根据离子的大小和电荷进行分类,常见的有(1)正离子负离子型离子晶体、(2)阳离子阴离子型离子晶体、(3)阳离子周期表电子构型型离子晶体、(4)绝对化合物型离子晶体和(5)复式离子型离子晶体。
3.原子晶体结构是指晶体由原子形成的结构。
原子晶体的特点是原子之间的相互作用力弱,有规则的排列方式。
原子晶体可以根据原子的配位数和密堆度进行分类,常见的有(1)体心立方晶格、(2)面心立方晶格、(3)密堆充分立方晶格和(4)六方密堆晶格。
4.分子晶体结构是指晶体由分子形成的结构。
分子晶体的特点是分子之间通过分子间力进行相互作用,有较弱的相互作用力。
分子晶体可以根据分子的形状和相互作用类型进行分类,常见的有(1)极性分子晶体、(2)非极性分子晶体、(3)氢键分子晶体和(4)范德华力分子晶体。
5.晶体的性质与其结构密切相关。
根据晶体的导电性可将晶体分为导体、绝缘体和半导体三类。
导体的晶体具有较好的导电性,绝缘体的晶体导电性极差,而半导体的导电性介于导体和绝缘体之间。
晶体的导电性主要与其组成离子、原子或分子的性质以及晶体的结构有关。
人教版高中化学选修3---第四节-----离子晶体讲解及习题

1.了解离子晶体的结构特点。
2.能根据离子晶体的结构特点解释其物理性质。
3.了解晶格能的定义及应用。
细读教材记主干1.什么是离子键?其成键微粒有哪些?提示:带相反电荷离子之间的相互作用叫作离子键,其成键微粒是阴、阳离子。
2.由离子键构成的化合物叫离子化合物;离子化合物一定含离子键,可能含共价键,含离子键的化合物一定是离子化合物。
3.离子晶体是由阴、阳离子通过离子键结合而成的晶体。
决定离子晶体结构的重要因素有:几何因素(正负离子的半径比),电荷因素(正负离子的电荷比),键性因素(离子键的纯粹程度)。
4.离子晶体硬度较大,难以压缩,具有较高的熔点和沸点,固体不导电,溶于水或在熔融状态下可以导电。
[新知探究]1.概念由阳离子和阴离子通过离子键结合而成的晶体。
(1)构成粒子:阳离子和阴离子。
(2)作用力:离子键。
2.决定晶体结构的因素3.熔、沸点熔、沸点较高,难挥发硬度硬度较大,难以压缩溶解性一般在水中易溶,在非极性溶剂中难溶1.离子晶体中的“不一定”(1)离子晶体中不一定都含有金属元素,如NH4NO3晶体。
(2)离子晶体的熔点不一定低于原子晶体,如MgO的熔点(2 800 ℃)高于SiO2的熔点(1 600 ℃)。
(3)离子晶体中除含离子键外不一定不含其他化学键,如CH3COONH4中除含离子键外,还含有共价键、配位键。
(4)由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是分子晶体。
(5)含有阳离子的晶体不一定是离子晶体,也可能是金属晶体。
(6)离子晶体中不一定不含分子,如CuSO4·5H2O晶体。
[对点演练]1.(2016·邢台高二检测)CaC 2晶体的晶胞结构与NaCl 晶体的相似(如图所示),但CaC 2晶体中由于哑铃形C 2-2的存在,使晶胞沿一个方向拉长。
下列关于CaC 2晶体的说法中正确的是( )A .1个Ca 2+周围距离最近且等距离的C 2-2数目为6 B .该晶体中的阴离子与F 2是等电子体C .6.4 g CaC 2晶体中含阴离子0.1 molD .与每个Ca 2+距离相等且最近的Ca 2+共有12个解析:选C 依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca 2+周围距离最近的C 2-2有4个,而不是6个,故A 错误;C 2-2含电子数为2×6+2=14,F 2的电子数为18,二者电子数不同,不是等电子体,故B 错误;6.4 g CaC 2为0.1mol ,CaC 2晶体中含阴离子为C 2-2,则含阴离子0.1 mol ,故C 正确;晶胞的一个平面的长与宽不相等,与每个Ca 2+距离相等且最近的Ca 2+应为4个,故D 错误。
【人教版】高中化学选修3知识点总结:第三章晶体结构与性质

【人教版】高中化学选修3知识点总结:第三章晶体结构与性质第一篇:【人教版】高中化学选修3知识点总结:第三章晶体结构与性质第三章晶体结构与性质课标要求1.了解化学键和分子间作用力的区别。
2.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
3.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
4.理解金属键的含义,能用金属键理论解释金属的一些物理性质。
5.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
要点精讲一.晶体常识 1.晶体与非晶体比较2.获得晶体的三条途径①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
3.晶胞晶胞是描述晶体结构的基本单元。
晶胞在晶体中的排列呈“无隙并置”。
4.晶胞中微粒数的计算方法——均摊法如某个粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。
中学中常见的晶胞为立方晶胞立方晶胞中微粒数的计算方法如下:注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状二.四种晶体的比较2.晶体熔、沸点高低的比较方法(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)原子晶体由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高.如熔点:金刚石>碳化硅>硅(3)离子晶体一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。
(4)分子晶体①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。
④同分异构体,支链越多,熔、沸点越低。
(5)金属晶体金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。
人教版化学选修三《离子晶体》精品课件

---Cs+
①铯离子和氯离子的配位数: 每个Cs+周围同时吸引8个Cl-,每个Cl-周 围同时吸引8个 Cs + 化学式:CsCl
②每个晶胞含 1 个铯离子、 1 个氯离子。 化学式:CsCl ③与铯离子等距离且最近的铯离子有 6 ④与氯离子等距离且最近的氯离子有 6 个。 个。
3.CaF2晶体的结构模型
第四节 离子晶体
离子晶体定义、成键粒子、相互作用力
定义: 由阳离子和阴离子通过离子键结合而 成的晶体。
成键粒子: 阴、阳离子
相互作用力:离子键
常见晶体离子:强碱、活泼金属氧化物、大 部分的盐类。
离子晶体的结构特征
①离子键没有饱和性和方向性,在晶体中 阴阳离子尽可能采取最密堆积; ②离子晶体中不存在单独的分子,化学式 代表阴阳离子最简个数比;
晶格能定义、符号和单位 1.定义:气态离子形成1摩尔离子晶体时释放 的能量。 2.符号:U 3.单位:kJ/mol
晶格能的大小的影响因素
离子电荷越大,阴、阳离子半径越小,即 阴、阳离子间的距离越小,则晶格能越大。简 言之,晶格能的大小与离子带电量成正比,与离
子半径成反比。
晶格能的作用和意义
晶格能越大 ,则 ①形成的离子晶体越稳定;(离子键越强) ②熔点越高;
①Ca2+的配位数: 8 F-的配位数:4 化学式:CaF2 ②一个CaF2晶胞中含: 4个Ca2+和8个F化学式:CaF2
---Ca2+ ---F-
4.ZnS晶体的结构模型
①Zn2+离子的配位数: 4 S2-的配位数: 4 化学式:ZnS ②一个ZnS晶胞中含:4个阳离子和4 个阴离子 化学式:ZnS
决定离子晶体结构的因素
【K12教育学习资料】化学新导学笔记人教选修三讲义:第三章 第四节 离子晶体
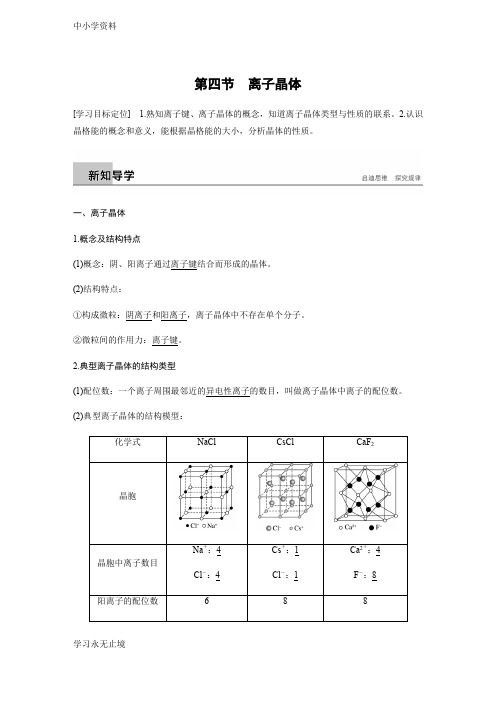
第四节离子晶体[学习目标定位] 1.熟知离子键、离子晶体的概念,知道离子晶体类型与性质的联系。
2.认识晶格能的概念和意义,能根据晶格能的大小,分析晶体的性质。
一、离子晶体1.概念及结构特点(1)概念:阴、阳离子通过离子键结合而形成的晶体。
(2)结构特点:①构成微粒:阴离子和阳离子,离子晶体中不存在单个分子。
②微粒间的作用力:离子键。
2.典型离子晶体的结构类型(1)配位数:一个离子周围最邻近的异电性离子的数目,叫做离子晶体中离子的配位数。
(2)典型离子晶体的结构模型:(3)在NaCl 晶体中,每个Na +周围最近且等距离的Na +有12个,每个Cl -周围最近且等距离的Cl -也有12个。
在CsCl 晶体中,每个Cs +周围最近且等距离的Cs +有6个,每个Cl -周围最近且等距离的Cl -也有6个。
3.决定晶体结构的因素 (1)思考讨论:①在NaCl 和CsCl 两种晶体中,阴、阳离子的个数比都是1∶1,都属于AB 型离子晶体,为什么二者的配位数不同、晶体结构不同?答案 在NaCl 晶体中,正负离子的半径比r +r -=0.525,在CsCl 晶体中,r +r -=0.934,由于r+r -值的不同,结果使晶体中离子的配位数不同,其晶体结构不同。
NaCl 晶体中阴、阳离子的配位数都是6,CsCl 晶体中阴、阳离子的配位数都是8。
r+r -数值越大,离子的配位数越高。
②为什么在NaCl(或CsCl)晶体中,阳、阴离子的配位数相同;而在CaF 2晶体中,阳、阴离子的配位数不相同?答案 在NaCl 、CsCl 晶体中,阳、阴离子的配位数相同,是由于阳、阴离子电荷(绝对值)相同,因而阳、阴离子的个数相同,结果导致阳、阴离子的配位数相同;若阳、阴离子的电荷不相同,阳、阴离子的个数必定不相同,结果阳、阴离子的配位数就不会相同。
如CaF 2晶体中,Ca 2+的配位数为8,F -的配位数为4,离子所带电荷越多,配位数越多。
新人教化学选修3第3章第4节离子晶体
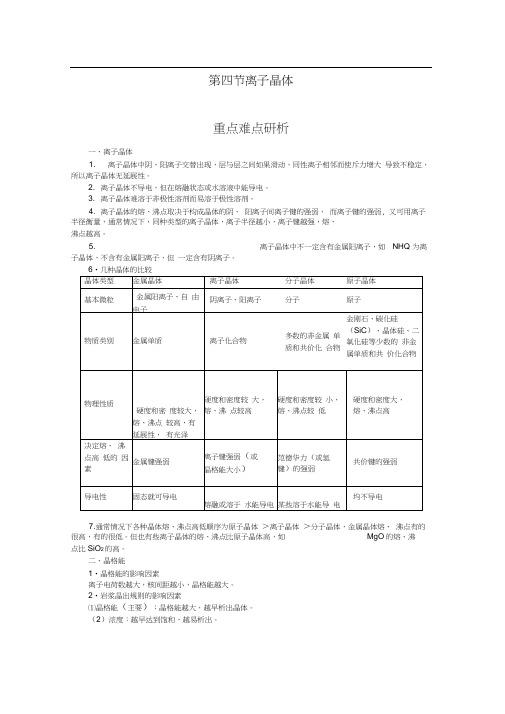
第四节离子晶体重点难点研析一、离子晶体1. 离子晶体中阴、阳离子交替出现,层与层之间如果滑动,同性离子相邻而使斥力增大导致不稳定,所以离子晶体无延展性。
2. 离子晶体不导电,但在熔融状态或水溶液中能导电。
3. 离子晶体难溶于非极性溶剂而易溶于极性溶剂。
4. 离子晶体的熔、沸点取决于构成晶体的阴、阳离子间离子键的强弱,而离子键的强弱, 又可用离子半径衡量,通常情况下,同种类型的离子晶体,离子半径越小,离子键越强,熔、沸点越高。
5. 离子晶体中不一定含有金属阳离子,如NHQ 为离子晶体,不含有金属阳离子,但一定含有阴离子。
6•几种晶体的比较7.通常情况下各种晶体熔、沸点高低顺序为原子晶体>离子晶体>分子晶体,金属晶体熔、沸点有的很高,有的很低。
但也有些离子晶体的熔、沸点比原子晶体高,如MgO的熔、沸点比SiO2的高。
二、晶格能1•晶格能的影响因素离子电荷数越大,核间距越小,晶格能越大。
2•岩浆晶出规则的影响因素⑴晶格能(主要):晶格能越大,越早析出晶体。
(2)浓度:越早达到饱和,越易析出。
典型实例剖析10例1在医院施行外科手术时,常用HgCl 2的稀溶液作为手术刀的消毒剂。
已知HgCl 2有如下性质:①HgCl 2晶体熔点较低;②HgCl 2在熔融状态下不能导电;③ HgCl 2在水溶液中 可发生微弱的电离。
下列关于HgCl 2的叙述正确的是( )A . HgCl 2属于共价化合物B . HgCl 2属于离子化合物C . HgCl 2属于非电解质D . HgCl 2属于强电解质解析 分子晶体一般熔、沸点较低,熔化后不能导电,符合共价化合物的特点,溶于水 后可微弱电离则说明是弱电解质。
答弓 A此类习题主要考查不同类型晶体的物理性质的特点。
正确解答这类习题,要全面比较并 记忆四种类型晶体的物理性质各个方面的异同点。
晅例2 离子晶体熔点的高低决定于阴、阴离子之间的距离、晶格能的大小, 识判断KCl 、NaCl 、CaO 、BaO 四种晶体熔点的高低顺序是 ()A . KCI>NaCI>BaO>CaOB . NaCI>KCI>CaO>BaOC . CaO>BaO>KCl>NaClD . CaO>BaO>NaCl>KCl解析 对于离子晶体来说,离子所带电荷数越多,阴、阳离子核间距离越小,晶格能越 大,离子键越强,熔点越高。
高中化学34离子晶体-课件新人教版选修3

熔点越高;硬度越大。
总结一
❖ 离子晶体有什么特点?
无单个分子存在;NaCl不表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。 且随着离子电荷的增加,核间距离的缩短, 晶格能增大,熔点升高。
一般易溶于水,而难溶于非极性溶剂。
固态不导电,水溶液或者熔融状态下能导 电。
二、晶格能
❖ 定义:气态离子形成1摩离子晶体时释放的
能量。 仔细阅读表3—8,分析 ❖ 晶格能的晶大格小能与阴的、大阳小离与子离所子带晶电荷的乘积
成正比,体与的阴熔、阳点离有子什间么的关距系离?成反比。 简言之,晶格离能的子大晶小体与离的子晶带格电能量成与正哪比,与离子半
径成反比. 晶格些能因越素大有:晶 关?格能 q1q2
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NaCC+ll--
Na+
ClNa+ Cl-
Cl-
Na+
Cl- Na+ Na+
Cl- NaC-+ l
Na+ ClNa+
NaC+ l-
Cl-
Na+
Cl-
Na+ Cl-
Na+
Cl-
Cl- Na+ Na+
NaC-+ l
ClNa+
ClNa+
可见:在NaCl晶 体中,钠离子、 氯离子按一定的 规律在空间排列 成立方体。
氯离子:顶点;或者反之。 (2)每个晶胞含铯离子、氯 离子的个数 铯离子:1个 ;氯离子:1个 (3)与铯离子等距离且最近 的铯离子、氯离子各有几个?
高中化学选修3课件-3.4 离子晶体1-人教版

2、常见晶胞类型
(1)NaCl型晶胞
离子晶体中离子的配位数(缩写为C.N.):是指一个离子 周围最邻近的异电性离子的数目。
【小组活动1】观察NaCl晶胞,按以下要求填空。
1.钠离子和氯离子的位置: Na+:___体___心__和__棱___中__点____
Cl- :____面__心__和___顶__点__;____ 或反之。 2.每个晶胞含钠离子、氯离子的个数:
【课堂小结】
【复习】离子键 一、离子晶体 1、定义:由阳离子和阴离子通过离子键结合
而成的晶体。
2、常见晶胞类型
(1)NaCl型晶胞 (2)氯化铯型晶胞 (3)CaF2型晶胞
课堂练习
1.下列物质中,属于离子晶体,并且含有共
价键的是( D )
A.CaCl2
B.MgO
C.N2
D.NH4Cl
2.下列离子晶体的叙述中,正确的是( D )
_面__心____, 8个F-在大立方体内F-
构成一个 小__立__方__体__。
Ca2+
2.每个晶胞含Ca2+ 、 F-的个数:
Ca2+:_4_个_____F- :___8_个____ 3. CaF2晶体中阴、阳离子配位数: Ca2+配位数:__8___F- 配位数:__4___
4.每个F-周围与距离最近的Ca2+在空间构成的 几何构型为__正__四__面__体____。
6.每个Na+周围距离最近的Cl-在空间构成的 几何构型为___正__八__面__体_______。
(2)氯化铯型晶胞
【小组活动2】观察CsCl晶胞,按以下要求填空。
1.铯离子和氯离子的位置: Cs+:_____顶__点____________
人教版化学选修3离子晶体PPT(45页)

1.CsCl的沸点是1290°C,NaCl的沸点达到 1413°C,为什么? 2.外力敲击金属时,金属通常不容易断裂, 敲击食盐晶体时,容易破碎,原因是什么? 3.NaOH晶体是否可以导电? 4.阅读82页科学视野
4.离子晶体结构对物理性质的影响
(1)熔沸点较高,阳离子电荷数越多, 半径越小,熔沸点越高 (2)离子晶体较硬脆 (3)晶体时不导电
A
B
C
D
晶体
硫化钾
干冰
金刚石
碘
组成晶体的微粒
阴阳离子
晶体微粒间存在的作用力 离子键
分子 共价键
原子 共价键
பைடு நூலகம்
分子 范德华力
• 2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是( C )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2 C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO • 3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序。
c. 含氧酸盐(包括铵盐) d.大多数碱
人教版化学选修3离子晶体PPT(45页)
晶体 氯化钠 干冰 金刚石
熔点 (℃)
801
▪ 思考:
-56.2 3550
➢为什么氯化钠的性质与干冰、金 刚石的不同?
人教版化学选修3离子晶体PPT(45页)
人教版化学选修3离子晶体PPT(45页)
各种离子晶体
人教版化学选修3离子晶体PPT(45页)
是 A.Li<Na<K<Ru
( A)
B.F2<Cl2<Br2<I2 C.金刚石>晶体硅>碳化硅
D.NaCl>KCl>CsCl
人教版化学选修三第三章第四节《离子晶体》16pptppt

铯离子:6个 ;氯离子:8个
(3)CaF2型晶胞
1、一个CaF2晶胞中含: 4个Ca2+和8个F-
①Ca2+的配位数:8 ②F-的配位数:4
(4)ZnS型晶胞
1、一个ZnS晶胞中含: 4个阳离子和4个阴离子 ①阳离子的配位数:4 ②阴离子的配位数:4
科学探究:
• 你认为是什么因素决定了离子晶体中离子
19、心脏太软,容易被柿子夹住。头脑太好了,很容易被缺乏内心看到。最初的善意帮助将成为最后的恶意后果。 18、我不在乎是风,雨还是晴天。我只知道,如果是您,无论何时何地,即使我押注自己一生的运气,我也会如期到达。 3、如果不是你的,不要保留它;如果让您感到不舒服,请不要停止。如果人在寒冷中行走,他的心脏会保持温暖;如果不可避免地聚集在一 起,他将独自享受世界的欣喜。不要回顾过去,不要回顾未来。这就是你应该拥有的生活。
24、永远不要打破生活中的四件事:信任,关系,诺言和内心,因为一旦破裂,就不会发出声音,但这是非常痛苦的。 4、您必须感谢自己不断前进的道路,也许您的梦想没有实现,也许生活不如您所愿,但请不要放弃,您必须记住,您渴望的美好事物会迟到 ,但这不会不存在。
3、如果不是你的,不要保留它;如果让您感到不舒服,请不要停止。如果人在寒冷中行走,他的心脏会保持温暖;如果不可避免地聚集在一 起,他将独自享受世界的欣喜。不要回顾过去,不要回顾未来。这就是你应该拥有的生活。
高三化学选修三离子晶体知识点(人教版)

高三化学选修三离子晶体知识点(人教版)
1.什么是分子晶体、原子晶体和金属晶体?
2.下列物质的固体中哪些是分子晶体?哪些是原子晶体?哪些是金属晶体?
干冰金刚石冰铜水晶碳化硅 NaCl CsCl
讲述:显然,氯化钠、氯化铯固体的构成微粒不是前面所讲的分子、原子,离子之间的作用力也不一样,这就是我们今天要学习的一种新的晶体类型。
一、离子晶体
1.离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体
活动1:展示氯化钠、氯化铯晶体结构,思考这两种晶体的构成微粒、离子之间的作用力是什么?
归纳小结:
(1)离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体
(2)离子晶体的构成微粒是离子,离子间的作用力为离子键。
2.离子晶体的类别
活动2:思考我们学过的物质中哪些类型的物质是离
子晶体?
归纳:强碱、活泼金属氧化物、绝大多数盐
精品小编为大家提供的高三化学选修三离子晶体知识点,大家仔细阅读了吗?最后祝同学们学习进步。
高三化学选修三分子晶体和原子晶体知识点梳理
高三化学选修三晶体的常识知识点整理。
人教版高中化学选修3 3.4离子晶体 课件精选课件

第四节 离子晶体
问题展示
1.离子晶体的概念、构成离子晶体的微 粒、微粒间的作用力和配位数是什么 ?
2.氯化钠、氯化铯、氟化钙配位数空间 构型?
3.离子晶体物理性质 4.晶格能的概念的理解? 5.如何比较离子晶体的熔沸点高低?
一、离子晶体
1、离子晶体
概念:由阳离子和阴离子通过离子键 结合而成的晶体叫做离子晶体
NaCl CsCl
立方面 心堆积
立方体 心堆积
6:6(0.414-0.732) 8:8 (0.732-1.0)
布置任务
做完一遍过83-86页习题
向你的美好的希冀和追求撒开网吧,九百九十九次落空了,还有一千次呢人若软弱就是自己最大的敌人游手好闲会使人心智生锈。故天将降大任于斯人也,必先苦其心 乏其身,行拂乱其所为,所以动心忍性,增益其所不能。让生活的句号圈住的人,是无法前时半步的。少一点预设的期待,那份对人的关怀会更自在。榕树因为扎根于 越长越茂盛。稗子享受着禾苗一样的待遇,结出的却不是谷穗。进取乾用汗水谱烈军属着奋斗和希望之歌。患难可以试验一个人的品格,非常的境遇方可以显出非常的 角度来看它。机会只对进取有为的人开放,庸人永远无法光顾。困苦能孕育灵魂和精神的力量骄傲,是断了引线的风筝,稍纵即逝;自卑,是剪了双翼的飞鸟,难上青 圆规的两只脚都动,永远也画不出一个圆。有困难是坏事也是好事,困难会逼着人想办法,困难环境能锻炼出人才来。只存在於蠢人的字典里。青,取之于蓝而青于蓝 ,然后知松柏之后凋也。积极的人在每一次忧患中都看到一个机会,而消极的人则在每个机会都看到某种忧患。一个能从别人的观念来看事情,能了解别人心灵活动的 。志当存高远。绳锯木断,水滴石穿让我们将事前的忧虑,换为事前的思考和计划吧!锲而舍之,朽木不折;锲而不舍,金石可镂。没有天生的信心,只有不断培养的 上下而求索天行健,君子以自强不息。会当凌绝顶,一览众山小。丈夫志四海,万里犹比邻。也,而不可夺赤。信言不美,美言不信。善者不辩,辩者不善。知者不博 ,和其光,同其尘,是谓“玄同”。故不可得而亲,不可得而疏;不可得而利,不可得而害;不可得而贵,不可得而贱。故为天下贵。天下之至柔,驰骋天下之至坚。 有益。知者不言,言者不知。更多老子名言敬请关注习古堂国学网的相关文章。柔弱胜刚强。鱼不可脱於渊,国之利器不可以示人。善为士者,不武;善战者,不怒; 为之下。是谓不争之德,是谓用人之力,是谓配天古之极是以圣人后其身而身先,外其身而身存无为而无不为。取天下常以无事,及其有事,不足以取天下。合抱之木 累土;千里之行,始於足下。多言数穷,不如守中。天下莫柔弱於水,而攻坚强者莫之能胜,以其无以易之。天长地久。天地所以能长且久者,以其不自生,故能长生 其身而身存。非以其无故能成其私。譬道之在天下,犹川谷之於江海。江海之所以能为百谷王者,以其善下之,故能为百谷王。是以圣人欲上民,必以言下之;欲先民 而民不重,处前而民不害。是以天下乐推而不厌。以其不争,故天下莫能与之争。是以圣人抱一为天下式。不自见,故明;不自是,故彰;不自伐,故有功;不自矜, 与之争。故道大,天大,地大,人亦大。域中有四大,而人居其一焉修之於身,其德乃真;修之於家,其德乃余;修之於乡,其德乃长;修之於邦,其德乃丰;修之於 ,以家观家,以乡观乡,以邦观邦,以天下观天下。吾何以知天下然哉?以此。慈故能勇;俭故能广;不敢为天下先,故能成器长。今舍慈且勇;舍俭且广;舍後且先 天将救之,以慈卫之。道生一,一生二,二生三,三生万物。知人者智,自知者明。胜人者有力,自胜者强。知足者富。强行者有志。一个实现梦想的人,就是一个成 己完全投入于权力和仇恨中,你怎么能期望他还有梦梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远得不到宁静,直到这些梦想成为事实。落叶——树叶撒 弯腰拾起;与其肩负苦涩的回忆,不如走向明天,淋浴春雨梦想绝不是梦,两者之间的差别通常都有一段非常值得人们深思的距离。一个人要实现自己的梦想,最重要 气和行动。一个人如果已经把自己完全投入于权力和仇恨中,你怎么能期望他还有梦?如果一个人不知道他要驶向哪个码头,那么任何风都不会是顺风。最初的梦想紧 由让一切都曾失去过。谁不曾迷茫?谁有不曾坠落呢?安逸的日子谁不想有呢?如果骄傲没被现实大海冷冷拍下,如果梦想不曾坠落悬崖千钧一发,又怎会懂得要多努 执著的人拥有隐形翅膀?现在的一切都是为将来的梦想编织翅膀,让梦想在现实中展翅高飞。很多时候,我们富了口袋,但穷了脑袋;我们有梦想,但缺少了思想。、 低微,但是不可以没有梦想。只要梦想一天,只要梦想存在一天,就可以改变自己的处境乐理知识和乐器为我的音乐梦想插上了一双希望的翅膀。长大以后,我要站在 的风采,为大家带来欢乐。没有一颗心会因为追求梦想而受伤,当你真心想要某样东西时,整个宇宙都会联合起来帮你完成。青年时准备好材料,想造一座通向月亮的 庙宇。活到中年,终于决定搭一个棚。一个人有钱没钱不一定,但如果这个人没有了梦想,这个人穷定了。梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远 为事实。如果失去梦想,人类将会怎样?不要怀有渺小的梦想,它们无法打动人心。最初所拥有的只是梦想,以及毫无根据的自信而已。但是,所有的一切就从这里出 幸福,有时梦想破灭也是一种幸福。人生最苦痛的是梦醒了无路可走。做梦的人是幸福的;倘没有看出可以走的路,最要紧的是不要去惊醒他。在每一个想你的日子里 却更难。想你,已成为我的习惯。努力向上吧,星星就躲藏在你的灵魂深处;做一个悠远的梦吧,每个梦想都会超越你的目标。要想成就伟业,除了梦想,必须行动。 排,实际上人们每天在安排着自己的一切活动家都是梦想家。悲观的人,先被自己打败,然后才被生活打败;乐观的人,先战胜自己,然后才战胜生活。梦想一旦被付 是人生最快乐的时光,但这种快乐往往完全是因为它充满着希望,而不是因为得到了什么或逃避了什么。你的生活深度取决于你对年幼者的呵护,对年长者的同情,对 强者的包容。因为生命中总有一天你会发现其中每一个角色你都扮演过。事实上是,哪个男孩女孩没有做过上天入地、移山倒海的梦啊,只不过在生活面前,很多人慢 以他们沦落为失去梦想的人;而有些人,无论生活多么艰难,从来没有放弃��
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三化学选修三离子晶体知识点(人教版)化学是在原子层次上研究物质的组成、结构、性质、及变化规律的自然科学,这也是化学变化的核心基础。
查字典化学网为大家推荐了高三化学选修三离子晶体知识点,请大家仔细阅读,希望你喜欢。
1.什么是分子晶体、原子晶体和金属晶体?
2.下列物质的固体中哪些是分子晶体?哪些是原子晶体?哪些是金属晶体?
干冰金刚石冰铜水晶碳化硅NaCl CsCl
讲述:显然,氯化钠、氯化铯固体的构成微粒不是前面所讲的分子、原子,离子之间的作用力也不一样,这就是我们今天要学习的一种新的晶体类型。
一、离子晶体
1.离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体
活动1:展示氯化钠、氯化铯晶体结构,思考这两种晶体的构成微粒、离子之间的作用力是什么?
归纳小结:
(1)离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体
(2)离子晶体的构成微粒是离子,离子间的作用力为离子键。
2.离子晶体的类别
活动2:思考我们学过的物质中哪些类型的物质是离子晶体?
归纳:强碱、活泼金属氧化物、绝大多数盐
小编为大家提供的高三化学选修三离子晶体知识点,大家仔细阅读了吗?最后祝同学们学习进步。
