第四章 重排反应
第四章 重排反应

C C O
Br(CH2)9 C CHN2 O
NH3.H2O/AgNO3 Br(CH2)9CH2CONH2
49%
O N2
hν CH3OH
H
75%
H3COOC
RCOOH
RCOCl
CH2N2
RCOCHN2
RCH C O COCl
H2O
RCH2COOH
1. CH2N2 2. PhCOOAg/EtOH/TEA CH2COOC2H5
84~92%
Arndt-Eistert同系列羧酸的合成反应 同系列羧酸的合成反应
Arndt-Eistert合成是将一个酸变成它的高一级同系 合成是将一个酸变成它的高一级同系 物或转变成同系列酸的衍生物, 如酯或酰胺 如酯或酰胺)的反 物或转变成同系列酸的衍生物,(如酯或酰胺 的反 该反应可应用于脂肪族酸和芳香族酸的制备。 应。该反应可应用于脂肪族酸和芳香族酸的制备。 反应包括下列三个步骤: 反应包括下列三个步骤: 1.酰氯的形成 酰氯的形成; 1.酰氯的形成; 2.酰氯和重氮甲烷作用生成重氮酮 酰氯和重氮甲烷作用生成重氮酮; 2.酰氯和重氮甲烷作用生成重氮酮; 3.重氮酮经Wolff重排变为烯酮 重氮酮经Wolff重排变为烯酮, 3.重氮酮经Wolff重排变为烯酮,再转变 为羧酸或衍生物。 为羧酸或衍生物。
R1 C C R2 OH OH
羟基离去后碳正离子的稳定性:叔碳 仲碳 仲碳>伯碳 羟基离去后碳正离子的稳定性:叔碳>仲碳 伯碳
P CH3OC6H5 Ph P CH3OC6H5 C C Ph OH OH P CH3OC6H5 P CH3OC6H5 C Ph + P CH3OC6H5 C O C Ph O Ph C Ph C6H5OCH3 P H2SO4
有机重排反应详尽总结

有机重排反应详尽总结重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程,现将有机重排反应进行一个详尽的总结。
(1)Amadori重排反应酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。
此反应的底物和产物都称为“Amadori化合物”。
各种Lewis酸都已应用于此反应:CuCl2 , MgCl2 , HgBr2 , CdCl2 , AlCl3 , SnCl4 , etc。
此反应中只需催化量的酸就可以催化胺和醛糖反应,进而重排。
伯胺,仲胺,脂肪胺或芳香胺都可以发生此反应。
糖胺类化合物会发生复杂的美拉德反应(食物在烹饪或储藏过程中糖,胺,氨基酸和蛋白质等进行重排和降解)。
此反应中生成的黑色产物是由于发生了此类非酶褐变反应。
(2)Baker-Venkataraman重排贝克-文卡塔拉曼重排反应(Baker-Venkataraman重排)是2-乙酰氧基苯乙酮衍生物在碱作为催化剂之下生成1,3-二酮的反应。
这个反应常用于制造色酮和黄酮类化合物。
(3)Bamberger RearrangementN-芳基羟胺在强酸水溶液作用下重排为氨基苯酚的反应。
(4)Beckmann Rearrangement贝克曼重排反应(Beckman rearrangement)指醛肟或酮肟在酸催化下生成N-取代酰胺的亲核重排反应,反应中起催化作用的酸常用五氯化磷。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名。
(5)Brook RearrangementC-Si→O-Si的离子性重排反应,从羟基硅烷到硅醚的转化。
Brook 重排反应的推动力是产物中键能较高的 Si-O 键的生成。
第四章 重排反应

二、Pinacol重排反应 重排反应
若反应中形成正离子,除了上面的相应双键进行亲电加成外, 若反应中形成正离子 , 除了上面的相应双键进行亲电加成外 ,还 可以由迁移H原子、烃基、芳基或其它带有一对电子的基团而变得稳定。 可以由迁移 原子、烃基、芳基或其它带有一对电子的基团而变得稳定。 原子 当这些迁移进行十分顺利时,在合成上就有应用价值。 当这些迁移进行十分顺利时,在合成上就有应用价值。特别是与形成正 离子的相邻碳原子上带有羟基时, 离子的相邻碳原子上带有羟基时,由羟基转变为羰基化合物是一个有利 的重排方式。由酸催化邻二醇形成酮的反应,称为“ 重排。 的重排方式。由酸催化邻二醇形成酮的反应,称为“Pinacol”重排。 重排
O TFA, C6H6
O
∆
H 2400C
100% H
H
H 83%
2、Claisen 重排 、
其与Cope重排完全相似, 只不过将其中的一个 重排完全相似,只不过将其中的一个CH2 变为氧 。 在有 变为氧。 其与 重排完全相似 机合成中常用于构建一些难以合成的官能团,具有非常重要的应用价值。 机合成中常用于构建一些难以合成的官能团,具有非常重要的应用价值。
烯烃 异丁烯 苯乙烯
.CCl3 1.00 >19
:CBr2 1.00 0.4 3.2
Br2 1.00 0.6 1.9
环氧化反应 1.00 0.1 13.5
3-甲基 丁烯 0.17 甲基1-丁烯 甲基
一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三烯卡宾, 一些与环状共轭体系相连的卡宾如环丙烯卡宾和环庚三烯卡宾,在 这些分子中,空的P轨道参与共轭体系 不显示明显的缺电子特征, 轨道参与共轭体系, 这些分子中,空的 轨道参与共轭体系,不显示明显的缺电子特征,实 际上是环丙烯正离子和卓鎓离子的共轭碱。 际上是环丙烯正离子和卓鎓离子的共轭碱。
《分子重排反应》课件

III. 分子重排反应的机理
• 分子重排反应的机理涉及分子内、分子间的结构变化以及化学键的重组。 • 这类反应通常包括断裂原始键、形成新的共价键、转移原子或基团等
步骤。 • 具体反应机理的理解对于控制反应路径和提高反应效率至关重要。
IV. 分子重排反应的影响因素
1 1. 温度
温度对分子重排反应速率和选择性起着重要 作用,通常较高的温度会促进分子重排反应 的进行。
II. 分子重排反应的分类
1. 根据反应类型
分子重排反应可以根据不同 的反应类型进行分类,如醇 酯互变异构、氧杂环化、羰 基互变异构等。
2. 根据反应条件
分子重排反应也可以根据不 同的反应条件进行分类,如 酸催化、碱催化、高温条件 下发生的分子重排反应等。
3. 根据反应底物
分子重排反应还可以根据不 同的反应底物进行分类,如 环状化合物的分子重排反应、 链状化合物的分子重排反应 等。
VII. 分子重排反应与有机合成的关系
分子重排反应是有机合成中的重要环节,可以用于构建复杂分子结构和控制化学反应的选择性。
2
2. 药物合成
分子重排反应在药物合成中发挥着重要作用,可用于合成药物前体和改进药物性 能。
3
3. 新型材料制备
分子重排反应可用于制备新型材料,例如高分子材料、金属配合物等。
VI. 分子重排反应的实验方法
为了研究和实施分子重排反应,可以使用各种实验方法,如核磁共振(NMR)、质谱(MS)和红外光谱(IR) 等。
2 2. 反应物浓度
反应物浓度越高,分子重排反应的速率通常 会增加。
3 3. 催化剂
催化剂可以显著提高分子重排反应的速率, 并且可以排反应的进行和产物 选择性有重要影响。
重排反应总结

重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)32(CH 3)33H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。
重排反应

重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程。
以下例子中取代基R由碳原子1移动至碳原子2:分子间重排反应也有可能发生。
按反应机理,重排反应可分为:基团迁移重排反应和周环反应。
基团迁移重排反应反应物分子中的一个基团在分子范围内从某位臵迁移到另一位臵的反应。
常见的迁移基团是烃基。
迁移基团的原来位臵称为迁移起点,迁移后的位臵称为迁移终点,这类反应又可按价键断裂方式分为异裂和均裂,前者重要得多,其中尤以缺电子重排最为重要。
缺电子重排反应是反应物分子先在迁移终点形成一个缺电子活性中心,从而促使迁移基团带着键裂的电子对发生迁移,并通过进一步变化生成稳定产物。
以频哪酮重排反应为例,反应物分子中的一个羟基与酸作用形成锌盐后失水变为缺电子活性中心正碳离子,促使邻位带羟基碳原子上的一个甲基带着电子对发生1,2-迁移,同时羟基氧原子上未共用电子对转移至碳?氧之间构成双键,最后失去质子而得产物(见上反应式)。
在迁移终点形成一个富电子活性中心后,促使迁移基团不带键裂电子对而转移,叫富电子重排反应,例如法沃斯基重排:a - 卤代酮在强碱作用下重排,生成碳架不同的羟酸酯,反应通过富电子活性中心负碳离子进行:环反应反应物因分子内共价键协同变化而发生重排Favorsky重排反应的反应,有电环化反应和δ迁移反应。
例如环丁烯经加热发生逆向电环化而得1,3-丁二烯,1,3-己二烯经加热发生氢原子1,5-迁移而得2,4-己二烯。
这类重排在合成中应用最多的是属于3,3-迁移的科普重排和克莱森重排。
科普重排是1,5-二烯受热重排为另一个1,5-二烯的反应。
例如内消旋-3,4-二甲基-1,5-己二烯经加热几乎定量地转变为(Z ,E)-2,6-辛二烯:克莱森重排反应是参与反应的体系中有一个氧原子代替了碳原子。
第四章 重排反应

H O 2 H C 3 C C H 3 C H +2
C H 3
C H 3
C H 3
CH3
CH3
+ H3C C CH2
Br
H3C C CH2Br
极不稳定
较稳定
CH3
重排
CH3
CH3
Br
H3C
C +
CH2CH3
H3C
CH3 C CH2CH3 Br
主要产物
1. 形成C+ 形式
(1) 卤代烃 Ag+、AgCl或Lewis酸催化
H
R2 C C R4
OH OH
R1 R2 C C R4
R3 O
1. 反应机理:
II
H3C CH3 CH3 C C CH3
HO OH
H3C CH3 H+ CH3 C C CH3
CH3
HO +OH2
H3C CH3
-H 2O CH3 C C CH3 +
OH CH3
重排 CH3 C C CH3 -H+ CH3 C C CH3
H H 3C C C Ph
C H 3C H 3
OH NHTs Ph3P/DEAD
OPPh3
NHTs -Ph3P=O
NHTs
NHTs
NHTs
二、Pinacol重排
在酸催化作用下,取代的邻二醇失去一分子水,重排生成醛 或酮的反应称Pinacol重排。取代的邻二醇称为频呐醇,重排 生成的酮称为频呐酮
R1 R3
• 重排生成的脂环烯酮在氧气的存在下经光照,释放出CO2, 生成环酮。
• 抗HⅣ病毒药物Oxetanocin可通过该重排而制得中间体, 经还原、脱保护而制得产品。
重排反应

R O C C R'
H2O R'OH O C CH R NH3 R'NH2
RCH2COOH RCH2COOR' RCH2CONH2 RCH2CONHR'
阿恩特-埃斯特尔特(Arndt-Eistert)合成
R'COOH R'COX CH2N2 R'COCH=N2 H2O R'CH2COOH
制备多一个碳的羧酸
第六章
重排反应
Rearrangement Reaction
定义:受试剂或介质的影响,同一有机分子内的一个基团
或原子从一个原子迁移到另一个原子上,使分子构架发生 改变而形成一个新的分子的反应称为重排反应。
W A B A W B
A:重排起点原子,B:重排终点原子,W:重排基团
分类: 离子型机理(亲核重排,亲电重排) 自由基重排 周环机理重排(σ-键迁移重排)
4
AlCl3
Et2O
PhCH2NHPh
2、Hofmann重排
酰胺用溴(或氯)和碱处理转变为少一个碳原子的伯胺的 反应。又叫Hofmann降解反应。
O R C NH2
NaOX
机理:
O R C NH2
or X2/NaOH O Br2 R C NH Br -HBr
RNH2
OH O R C N Br
-Br
O EtO EtONa
Cl
CH2COOEt C 所连接的取代基越少越稳定
CH3 Br H3C C EtONa C CH3 Br H3C C C O CH2 EtO Br H3C O C C OEt H3C EtOOC C CH2 CH2 Br C CH2
COOEt
第二部分 第四章 重排反应

H2O
CH3CH2CHCH2
CH3CH2CH+CH3
CH3CH=CHCH3
亲电重排: 亲电重排:
Ph CH2 O CH3 PhLi C6H6
Ph CH O CH3
Li+
CH3 - + H2O Ph CH O Li
自由基重排
Cl Cl C CH=CH2 Cl Br
CH3 Ph CH OH
Cl Cl C CH CH2Br Cl
本课程按照活泼中间体或机理进行分类讲解, 本课程按照活泼中间体或机理进行分类讲解, 着重介绍以下几类型反应: 着重介绍以下几类型反应: 1、经过正离子重排 、 2、经过负离子重排 、 3、经过卡宾Carbene 、氮宾 、经过卡宾 氮宾Nitrene重排 重排 4、σ-迁移反应(属于周环重排) 、 迁移反应 属于周环重排) 迁移反应(
H2O
R C N R' OH2
-H+
R C N R' OH
互变 异构
R C NH R' O
脱羟、重排、夺羟、 脱羟、重排、夺羟、互变
举例
Et 例 1 n-Bu C C Me H N OH
H2SO4 乙醚
Et O n-Bu C N C CH3 H H
例2 C N OH
NO2
PCl5
NO2 N C OH HN C O
NH2 HNO2 OH
CHO
试分析
CH2NH2 OH
HNO2
O
• 通常经过三元环碳正离子历程,迁移基团从离去基 通常经过三元环碳正离子历程, 三元环碳正离子历程 团背后迁移。 团背后迁移。
CH3 H ph NH2 OH HO Me NH2 H OCH3
《有机化学重排反应》课件

THANKS
感谢观看
详细描述
重排反应通常涉及分子内部的重排,包括电子、质子和原子的重新排列,这种 重排可以发生在分子内或分子间,并伴随着键的断裂和形成。重排反应通常伴 随着键能的变化,需要一定的活化能来启动反应。
重排反应的重要性
总结词
重排反应在有机化学中具有重要的意义,它涉及到许多有机化合物的合成、转化和降解过程。
详细描述
重排反应的动力学与热力学
动力学研究
分析重排反应的动力学特征,如反应 速率常数、活化能等,以及如何影响 反应进程。
热力学研究
探讨重排反应的热力学性质,如反应 熵变、焓变等,以及与反应条件的关 系。
重排反应的历程与过渡态
历程研究
揭示重排反应的具体步骤和中间体,以及各 步骤之间的相互转化。
过渡态研究
分析重排反应过程中的过渡态结构,以及如 何影响反应活化能和产物形成。
贝克重排反应是一种有机化学反应,涉及环丙烷环系的重排过程。在反应中,环丙烷环系通过加热或 其他能量源的激发,发生重排,生成新的化合物。
沃尔夫-凯惜纳重排反应
总结词
涉及芳香族化合物的重排反应
详细描述
沃尔夫-凯惜纳重排反应是一种有机化学反应,涉及芳香族化 合物的重排过程。在反应中,芳香族化合物通过加热或其他 能量源的激发,发生重排,生成新的化合物。
计算化学的应用
利用计算化学方法预测和优化 重排反应的途径和产物,提高
反应效率。
06
参考文献
参考文献
《有机化学重排反应》第二版,作者
01
XXX,出版社:XXX。
《有机化学重排反应》第三版,作者
02
XXX,出版社:XXX。
"有机化学重排反应研究进展",作者
重排反应

重排反应重排反应范围较广,引起重排反应的因素也很多。
一般情况下都是分子受试剂作用后,暂时产生一个不稳定中心,这个不稳定中心经分子内某些基团的迁移和调正,趋向较稳定的形式,这样便发生了重排反应。
从形成不稳定中心的性质看大体克将重排反应分为四类:缺电子体系重排,即某些基团向缺电子中心迁移;失电子体系重排,即某些基团向失电子中心迁移;丙烯型重排;向芳核的迁移性重排 其中以缺电子体系的重排最为重要一.缺电子体系重排反应 缺电子体系重排都包含着一个基团从碳原子上转移到仅有六个价电子的邻近原子上的重排如,由于这类重排反应,是分子中一个原子灰基团向相邻原子上的转移,故又称1,2-转移重排反应 二.频呐醇重排一个偶尔用于酮的合成的反应,它作为产物确实能生成羰基化合物,频哪醇用无机酸处理时,转变成甲基叔丁基酮。
先失去水生成正碳离子,正碳离子重排产生质子化的酮。
(芳基比烷基有较大的迁移能力)2,3-二甲基-2,3-丁二醇用30%的热硫酸处理,就可以重排成3,3-二甲基-2-丁酮。
CH3CH3CH3OH OHCH3C C CH3CH3OCH3C C CH3H2O30%H2SO4反应机理是:首先在质子的进攻下,形成正碳离子的不稳定中心,从而引起分子中烷基的转移,然后失去一个质子完成重排。
上述重排中,正碳离子的形成是关键的一步,反应过程中,如能生成类似正碳离子者,都能发生此类重排,例如用硝酸银处理3-溴-2,3-二甲基-2-丁醇。
某些不对称的邻二醇在酸的处理下,也能发生呐侉重排如果邻二醇的取代基R 不同时,一般多是失电子的基团发生转移,因失电子基具有更大的亲核能力。
不对称的醇也能发生重排,只是正碳离子有它的几个中最稳定的一个形式。
C CRR R HOHCC R RR H OH III 注意:因为二式比一式稳定,故不生成一式。
二.瓦格涅尔、麦尔外英重排CH3CH3CH3CH3C C CH3CH3OCH3C C CH330%H2SO4OH Br有些醇类,尤其是b-碳原子上连有2~3个烃基的醇类,遇酸不仅生成正常的取代或消除产物,还往往伴有碳架的重排。
有机化学重排反应讲解
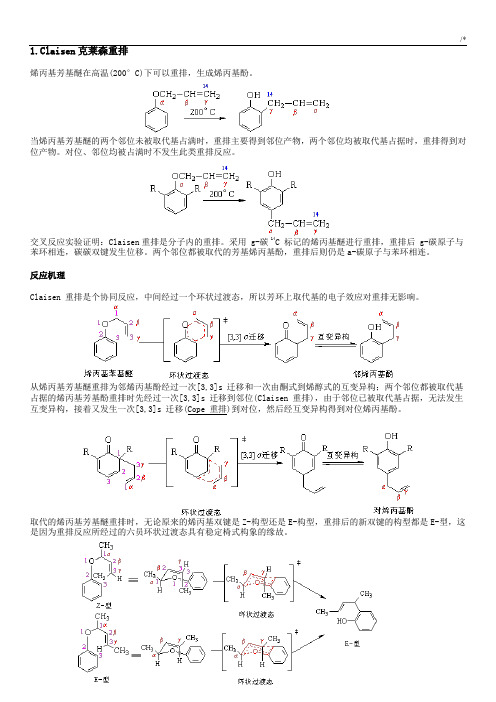
1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
重排反应医学知识讲座培训课件

1. 反应通式
重排反应医学知识讲座
100
2. 反应机理
重排反应医学知识讲座
101
3. 影响因素
(1) 过氧酸
过氧乙酸 三氟过氧乙酸 过氧苯甲酸
间氯过氧苯甲酸
后发现廉价、方便 的H2O2/HOAc
重排反应医学知识讲座
102
(2) 酮的结构
重排反应医学知识讲 座
在同一分子内,一个基团从一个原子 迁移至另一个原子而形成一个新分子 的反应称为重排反应
W AB
W AB
A:重排起点原子,B:重排终点原子,W:重排基团
重排反应医学知识讲座
2
按反应历程分类
➢离子型机理
亲核重排 亲电重排
➢自由基重排
➢σ-键迁移重排
周环机理重排
重排反应医学知识讲座
110
季铵盐的四个取代基,哪一个迁移呢? 基团形成的碳正离子越稳定,迁移能力越强
重排反应医学知识讲座
111
三、Wittig醚重排
醚类化合物和烷基锂或氨基钠作用重排生 成醇的反应,称为Wittig醚重排反应
1. 反应通式
重排反应医学知识讲座
113
2. 反应机理
重排反应医学知识讲座
114
第五节 -键迁移重排
重排反应医学知识讲座
19
(3) 烯烃化合物Wagner-Meerwein重排
重排反应医学知识讲座
20
(4) 胺化合物Wagner-Meerwein重排
重排反应医学知识讲座
21
重排反应医学知识讲座
22
二、Pinacol重排
连二醇类化合物用酸处理时重排生成醛或 酮的反应,称为Pinacol重排反应。 1. 反应通式
最新第四章--重排反应

C6H5
C C C6H5 KOH/C2H5OH
OO C6H5 OH C6H5 C COO
C6H5 C C C6H5 + OH OO
O C6H5 C C OH
O C6H5
OO C6H5 C C OH
C6H5
OHO C6H5 C C O
RCCR Y RCCR
OH Y
OH
R R C C R Y为
OR
NH2 X
OSO2R
Tiffeneau环扩大反应
1-氨基甲基环烷醇用亚硝酸处理,经重排形成 多一个碳的环烷酮的反应,称为Tiffeneau环 扩大反应。
(CH2)n
OH C
HNO2 (CH2)n
CH2NH2
O C CH2
三、 二苯乙醇酸重排
异冰片 -H
CH2 CH2
莰烯
Ph
C H3 OTs C CH CH3
P hH
CH3 *
H 3 C C C* P h CH3 CH3
C H3 P h C C*H C H 2
H
C H3
P h C C* C H 3 CH3 CH3 +
H 3 C C C* P h CH3 CH3
CH2 CH3
CH3
CH3
反应包括下列三个步骤: 1.酰氯的形成; 2.酰氯和重氮甲烷作用生成重氮酮; 3.重氮酮经Wolff重排变为烯酮,再转变 为羧酸或衍生物。
H3CO H3CO
P C H3OC 6H5 C C Ph
OH OH
P C H3OC 6H5
P C H3OC 6H5 C Ph
+ห้องสมุดไป่ตู้
有机化学基础知识点整理官能团的重排反应和转位反应

有机化学基础知识点整理官能团的重排反应和转位反应有机化学基础知识点整理:官能团的重排反应和转位反应导言:有机化学是研究含有碳元素的化合物的科学,是化学的一个重要分支。
在有机化学中,官能团的重排反应和转位反应是常见的重要反应类型之一。
本文将围绕这一主题展开讨论,介绍官能团的重排反应和转位反应的基本概念、机理以及相关实例。
一、官能团的重排反应1.1 概念官能团的重排反应是指有机化合物中某个官能团经过原子或原团的重新排列,从而形成新的有机化合物的反应过程。
这一过程通常伴随着键的断裂和形成。
1.2 机理官能团的重排反应的机理多样,总体可分为以下几种类型:1) 亲核取代反应:亲核试剂通过攻击一个键,使之断裂并形成新键,从而导致重排反应的发生。
2) 质子化/去质子化反应:质子的加入或脱离导致官能团成键重组,从而改变分子结构。
3) π电子迁移:电子云的重分布引发重排反应。
1.3 实例1) 醇的重排反应:醇可以发生缩醛和醚的转化反应。
例如,2-甲氧基乙醇在酸性条件下可以发生重排反应生成乙醚和甲醛。
2) 烯烃的重排反应:均相或异相环加成反应中,烯烃经过质子化后发生重排反应,生成稳定的胺、酮或醇等产物。
二、官能团的转位反应2.1 概念官能团的转位反应是指有机化合物中一个官能团与另一个官能团的位置互换,形成新的有机化合物的反应过程。
转位反应常涉及原子或原团的重新排列。
2.2 机理官能团的转位反应机理多种多样,常见的机理包括:1) 质子转移:质子从一个官能团转移到另一个官能团上,形成新的分子结构。
2) 共轭体系的重建:通过改变共轭体系的结构,使得官能团发生位置变化。
2.3 实例1) 羧酸的转位反应:在质子辅助下,羧酸可以发生转位反应,生成相应的酰胺。
例如,苯甲酸经过转位反应可以生成苯乙酰胺。
2) 稀土元素催化下的转位反应:稀土金属催化剂的存在可以促进官能团的转位反应,例如酮的转位反应。
结论:官能团的重排反应和转位反应是有机化学中常见的重要反应类型。
重排反应医学知识讲座培训课件

四. 应用特点
重排反应医学知识讲座
91
(一) 制备伯胺
重排反应医学知识讲座
92
(二) 制备氨基甲酸酯
重排反应医学知识讲座
93
重排反应医学知识讲座
94
四、Schmidt反应
(一) 反应通式
重排反应医学知识讲座
95
二. 反应机 理 (一) 羧酸与叠氮酸de反应机理
重排反应医学知识讲座
96
四. 应用特点
在光、热或金属化合物催化下,α-重氮酮 重排生成烯酮de反应称为Wolff重排.
一. 反应通式
Wolff重排
重排反应医学知识讲座
61
Arndt-Eistert合成
重排反应医学知识讲座
62
二. 反应机理
重排反应医学知识讲座
63
三. 影响因素
重排反应医学知识讲座
64
四. 应用特点
(一) 由羧酸制备多一个碳原子de酸或其衍生物
重排反应机理复杂多样,规律性不强, 在此就不罗列讲解了,后续课程会结合具 体de重排反应进行讲解,此部分内容仅供 参考
重排反应医学知识讲座
6
第二节 从碳原子到碳原子de重排
一、Wagner-Meerwein重排
重排反应医学知识讲座
7
一. 反应通式
(如果R四 = H)
(如果R二 含一个α-氢)
R =烷基、 芳基或氢
79
三. 影响因素
(一) 反应条件de影响
如果R为脂肪取代基,碳原子数小于八
重排反应医学知识讲座
80
所用de碱用醇钠代替氢氧化钠,重排后de 异氰酸酯与醇作用得到氨基甲酸酯
重排反应医学知识讲座
81
重排反应

7 重排反应重排反应指同一分子内,某一原子或基团从一个原子迁移到另一个原子形成新的分子的反应。
利用重排常常可以合成用其它方法难以合成的物质。
其反应机理不外乎亲核、亲电和自由基几种。
按其迁移的方式大致可分为从碳原子到碳原子的重排、从碳原子到杂原子的重排以及从杂原子到碳原子的重排等几种。
7.1从碳原子到碳原子的重排从碳原子到碳原子的重排使碳骨架发生变化。
其中典型的重排包括亲核1,2-重排和亲电1,2-重排。
前者包括Wagner-Meerwein重排和Pinacol重排;后者包括Wolf和Arndt-Eistert重排等。
7.1.1Wagner-Meerwein重排在质子酸或Lewis酸催化下形成的碳正离子中,烷基、芳基或氢从正离子相邻的碳原子上迁移到正离子上的反应,称为Wagner-Meerwein重排。
生成更稳定的碳正离子或产物成为重排的动力。
反应示例:双环二烯酮重排为四氢萘酚。
用质子酸处理某些环外烯烃可致重排。
7.1.2 Pinacol重排酸催化下,邻二醇脱水重排为醛或酮的反应称为Pinacol重排。
(1)四取代邻二醇的重排如果四个取代基相同,得单一产物。
如果是对称的邻二醇,产物分配主要取决于迁移基团的迁移能力。
迁移能力可能与亲核能力正相关。
一般而言,芳基>烷基>氢。
对位供电子基取代的芳基>未取代的芳基>邻位取代的芳基(空间障碍)。
如果是不对称的邻二醇,产物分配主要取决于形成的碳正离子的稳定性,与迁移基团的迁移能力关系不大。
不对称Pinacol重排的选择性不是太好,常常得到混合物,在药物合成上的意义不太大。
(2)三取代邻二醇的重排对于三取代的邻二醇,其中的叔碳上形成的碳正离子较稳定,所以一般是仲碳上的基团(或氢原子)迁移。
如果需要叔碳上的基团迁移,可采用衍生物法在碱性条件下重排。
(3)脂环上的邻二醇重排羟基位于脂环上的邻二醇的重排常导致脂环结构的变化。
螺环的形成:羟基共环的情形:如上,对于羟基共环的情形,总是处在离去的羟基反式的基团迁移,这在一定程度上说明Pinacol重排可按分子内SN2机理进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、Beckmann重排 酮肟类化合物在酸性催化剂的作用下,重排成取 代酰胺的反应称为Beckmann重排。
R R'
C N
OH
H
O R C NHR'
机理
Beckmann重排的应用
• • • •
R R' C N OH OH
将酮转变为酰胺 确定酮的结构 扩环成内酰胺化合物 制备仲胺
O H R C NHR'
1.对称的连二乙醇
R2 R1 C
R2 C R1
芳基>烃基 供电子取代芳基>吸电子取代芳基
OH OH
CH3 CH3 Ph C C Ph OH OH CH3 C Ph + Ph C Ph O CH3 C CH3 Ph H
H3C C O
主产物
次产物
Ph Ph P CH3OC6H5 C C C6H5OCH3 P OHOH
RCOO ჴ℃
NH O
95%
二、Hofmann反应
酰胺用溴(或氯)和碱处理转变为少一个碳原子的伯胺 的反应称为Hofmann反应或Hofmann降解反应。
RCONH2 + Br2 + 4 OH + CO2 + 2 Br + 2 H2O RNH2 3
机理
R C NH2 O OH Br2 R C NHBr O
Stevens重排的应用
由季铵盐制得烃基叔胺 制备缩环或螺环化合物
CH3ONa CH3OH N(CH3)2 CH2Ph (CH3)2N CH2Ph
1-氨基甲基环烷醇用亚硝酸处理,经重排形成 多一个碳的环烷酮的反应,称为Tiffeneau环扩 大反应。
(CH2)n
C
OH CH2NH2
HNO2
(CH2)n
C
O
CH2
三、 二苯乙醇酸重排
二苯基乙二酮类化合物用碱处理,生成二苯 乙醇酸的反应称为二苯乙醇酸重排反应。
KOH/C2H5OH
C6H5 C C C6H5 O O C6H5 OH C COO C6H5
R2 A CH2 N R2 R1
A为: 常用的碱为 NaOH,RONa,NaNH2, CH3SO-CH2Na等
NaNH2
A CH N R2 R1
R3
机理
R2
R1 :B N CH2 A R3 R1 CH A
R2
R1 N CH A R3
R2 N R3
•为分子内重排 •迁移基构型保持
1、1,2-迁移 2、构型保留 3、五元环要求
C C O
Br(CH2)9 C CHN2 O
NH3.H2O/AgNO3 Br(CH2)9CH2CONH2
49%
O N2
h CH3OH
H
75%
H3COOC
RCOOH
RCOCl
CH2N2
RCOCHN2
RCH C O COCl
H2O
RCH2COOH
1. CH2N2 2. PhCOOAg/EtOH/TEA CH2COOC2H5
H
C6H5OCH3 P Ph C C O Ph C6H5OCH3 P + Ph P CH3OC 6H5 C C Ph O C6H5OCH3 p
94%
6%
2.不对称的连二乙醇
R1 R1 C
R2 C R2
重排的方向决定碳正离子的稳定性
OH OH
羟基离去后碳正离子的稳定性:叔碳>仲碳>伯碳
P CH3OC 6H5 Ph H2SO4 P CH3OC 6H5 C C Ph OH OH P CH3OC 6H5 P CH3OC6H5 C Ph + P CH3OC 6H5 C O C Ph O Ph C Ph C 6H5OCH3 P
84~92%
Arndt-Eistert同系列羧酸的合成反应
Arndt-Eistert合成是将一个酸变成它的高一级同系
物或转变成同系列酸的衍生物,(如酯或酰胺)的反 应。该反应可应用于脂肪族酸和芳香族酸的制备。 反应包括下列三个步骤: 1.酰氯的形成; 2.酰氯和重氮甲烷作用生成重氮酮; 3.重氮酮经Wolff重排变为烯酮,再转变 为羧酸或衍生物。
O
H2O2/HOAc 50℃ 2h ,
O
O
85~90%
第三节从杂原子到碳原子的重排
•Steven重排 •Sommelet-Hauser重排 •Wittig重排
关注1,2重排 烯丙基结构 构型保留
R
机理
碱 B R Y C Y C BH H Y C R
一、Stevens重排
季铵盐分子中连于氮原子的碳原子上具有吸电子 的基团取代时,在强碱性条件下,可重排生成叔 胺的反应称为Stevens重排反应。
RCON3 N2 R N C O H
RNH2
RNH2
Schimidt重排
RCOOH + HN3
H
RNH2
操作简便 收率较高
五、Baeyer-Villiger反应
酮类用过氧酸(如过氧乙酸、过氧三氟醋酸等)氧化,在烃基与 羰基之间插入氧原子而成酯的反应称为Baeyer-Villiger反应。
R C R' O C6H5COOOH R C OR' O
COOCH3 CH2COOH 1. SOCl2 2. CH2N2 COOCH3 (CH2)2COOCH3
H H3CO
H H3CO
84%
第二节 从碳原子到杂原子的重排
• • • • Beckmann重排 Hofmann重排Curtius重排 Schmidt反应 Baeyer-Villiger重排
关注1,2重排 构型保留
81%
Cl
CH3CO3H Cl COCH3 Cl Cl OCOCH3
80%
C O
CH3CO3H NO2 HAc NO2 95%
O C O
供电子环有利
CF3CO3H/CHCl3 56% O O 近双键有利
O
后发现廉价、方便的H2O2/HOAc
O H2O2/HOAc 50℃ 4h ,
O
O
90~95%
91% 83%
CH3O
COOH
五、Wolff重排
重氮酮在银、银盐或铜存在条件下,或用光照射 或热分解消除氮分子而重排为烯酮,生成的烯酮 进一步与羟基或胺类化合物作用得到酯类、酰胺 或羧酸的反应称为Wolff重排反应。
R C C R O N N R R R'OH R C C R O R R O CH C OR'
O OH O ref. COOH OH
O
O KOH
HO HOOC
79%
C8H17 KOH/C3H7OH.H2O C8H17 O HO HOOC O HN O H N
O
92~100% 甾体缩环
H N HN OH COOH O
O 1)CH3O /CH3OH O O 2) H2O
97%
四、Favorski卤代酮重排
C6H5 C C C6H5 + OH O O O O C C OH C6H5
C6H5
O C C OH O C6H5
C6H5
C6H5
OHO C C O C6H5
Ar' Ar C C Ar' O O Ar C C OH OHO + Ar HO C C Ar' O OH
迁移能力:吸电子基芳环> 供电子基芳环
OH H
异冰片
-H CH2 CH2
莰烯
CH3 OTs Ph C CH3 CH CH3 *
PhH
H3C C
* C Ph
CH3 CH3 H Ph C * C CH3
CH3 * Ph C CH CH2 CH3
? CH3 CH3 + * H3C C C Ph
CH3 CH3
CH2 CH3 TsOH CH3 CH3 C6H5 H3C
0~5, 105min N N C O N NH2
F3 C N F3 C N N
OH N H
72%
三、Curtius重排
酰基叠氮化合物在惰性溶液中加热分解为 异氰酸酯的反应称为Curtius重排反应。
R C N3 O
机理
N2
R N C O
1、烃基迁移与脱氮同时发生 2、迁移基构型保留
Curtis重排的应用
OH2
O
99%
H3C H3C
H3C H3C
OH Trans-二醇 H3C H3C OH H
OH CH3 CH3C O
(三) Semipinacol重排
R R R C C R OH Y Y R R R C C R OH
NH2 X OSO2R
R R C C R O R
Y为
Tiffeneau环扩大反应
引入氨基 -COOH-NH2
Ph 1.ClCOOC2H5 COOH 2. NaN3 1. 2. H2O/H Ph CON3
Ph 76~81% .HCl NH2
酰基叠氮的制备方法
四、Schmidt反应
包括三类反应: 1、羧酸和叠氮酸在硫酸或Lewis酸的催化下, 得到比原来羧酸少一个碳原子伯胺。
第一节 从碳原子到碳原子的重排
1. Wagner-Meerwein重排 2. Pinacol重排 3. 苯偶酰-二苯乙醇酸型重排 4. Favorski重排
5. Wolff重排
关注1,2重排 构型保留
一、Wagner-Meerwein重排
终点碳原子上羟基、卤原子或重氮基等,在质子酸或Lewis酸 催化下离去形成碳正离子,其邻近的基团作1,2-迁移至该碳原 子,同时形成更稳定的起点碳正离子,后经亲核取代或质子消 除而生成新化合物的反应称为Wagner-Meerwein重排。
